USAGE DES MÉDICAMENTS RECOMMANDÉS À LA
SUITE D’UN PREMIER INFARCTUS AIGU DU
MYOCARDE AU QUÉBEC CHEZ LES PERSONNES
AGÉES : EFFET DE LA DÉFAVORISATION ET DU
SEXE
Mémoire
Adjo Enyonam Akator
Maîtrise en sciences pharmaceutiques - pharmaco-épidémiologie
Maître ès sciences (M.Sc.)
Québec, Canada
USAGE DES MÉDICAMENTS RECOMMANDÉS À LA
SUITE D’UN PREMIER INFARCTUS AIGU DU
MYOCARDE AU QUÉBEC CHEZ LES PERSONNES
AGÉES : EFFET DE LA DÉFAVORISATION ET DU
SEXE
Mémoire
Adjo Enyonam Akator
Sous la direction de :
Line Guénette, directrice de recherche
Claudia Blais, codirectrice de recherche
iii
Résumé du mémoire
L’objectif de notre étude était d’évaluer, chez les personnes âgées assurées au régime public d’assurance médicaments (RPAM) du Québec, l’association entre l’usage des médicaments recommandés à la suite d’un premier infarctus aigu du myocarde (IAM), l’indice de défavorisation et le sexe. En utilisant les données du Système intégré de surveillance des maladies chroniques du Québec (SISMACQ) mises en place par l’Institut national de santé publique du Québec (INSPQ), nous avons réalisé une étude de cohorte populationnelle chez les Québécois de ≥ 66 ans, hospitalisés pour un premier IAM entre le 1er janvier 2006 et le 31 décembre 2011 et admissibles
au RPAM 6 mois avant et au moins 30 jours après l’hospitalisation. La présence de réclamations pour les 3 classes des médicaments recommandés (antiagrégant plaquettaire, bétabloquant, hypolipémiant) dans la même fenêtre temporelle, c’est-à-dire à 30 jours et à 365 jours après la sortie de l’hôpital était considéré comme un usage approprié. Respectivement, au 30ème et au 365ème jour après la sortie de
l’hôpital, parmi les 19 017 et les 16 547 individus considérés, 13 234 (69,6 %) et 10 772 (65,1 %) étaient exposés à un usage approprié. Comparativement aux personnes ayant un indice de défavorisation faible, c’est-à-dire les moins défavorisés, les personnes ayant un indice de défavorisation élevé (les plus défavorisés) n’étaient pas plus à risque d’usage inapproprié des médicaments recommandés à la suite d’un premier IAM. Les femmes étaient 5 % plus à risque d’usage inapproprié des médicaments recommandés uniquement à 30 jours. Nos résultats suggèrent que les personnes âgées ayant subi un premier IAM et couvertes par le RPAM du Québec ont un accès équitable aux médicaments, ce qui répond bien à un des objectifs de la mise en place du régime public d’assurance médicaments (RPAM) du Québec.
iv
Abstract
The objective of this study was to evaluate the association between the use of the guideline-recommended drugs (GRD) following a first acute myocardial infarction (AMI), the deprivation index and the sex, in elderly people covered by public drug plan (PDP), in the province of Quebec. We conducted a population-based cohort study of Quebecers aged ≥ 66 years living in Quebec using the Quebec Integrated Chronic Disease Surveillance System (QICDSS) introduced by the Institut national
de santé publique du Québec (INSPQ). Individuals having a first hospitalized AMI
between January 1, 2006 and December 31, 2011 and being covered by the PDP 6 months before and at least 30 days following this hospitalization were considered. People were deemed using the GRD if they received simultaneously drugs three classes (antiplatelet, beta-blocker and lipid-lowering) on the 30th and the 365th day
after hospital discharge. On day 30 and 365 after hospital discharge, respectively 19,017 and 16,547 individuals were considered among which 13,234 (69.6%) and 10,772 (65.1%) were using GRD. No significant association was observed for individuals most materially and socially deprived compared to those least deprived. Women were 5% more likely inappropriate use of GRD only at 30 days. Our results suggest an equitable access to drugs for the elderly in the PDP that experienced a first AMI, which responds well to one of the objectives of setting up the Quebec PDP.
v
Table des matières
Résumé du mémoire ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
1 Chapitre 1 : État des connaissances ... 5
1.1 L’infarctus aigu du myocarde ... 5
1.1.1 Définition ... 5
1.1.2 Épidémiologie de l’infarctus aigu du myocarde ... 5
1.1.3 Facteurs de risque ... 5
1.1.4 Traitements à la sortie de l’hôpital ... 6
1.1.4.1 Les antiagrégants plaquettaires ... 9
1.1.4.2 Les bétabloquants ... 11
1.1.4.3 Les hypolipémiants ... 11
1.1.4.4 Les IECA ou les ARA ... 12
1.2 Usage optimal des médicaments après un infarctus aigu du myocarde ... 12
1.3 Usage des médicaments chez les personnes âgées ... 14
1.4 Indice de défavorisation et usage optimal des médicaments après un infarctus aigu du myocarde ... 15
1.5 Usage des médicaments après un infarctus aigu du myocarde en fonction du sexe ... 17
1.6 Usage des données médico-administratives pour la recherche et la surveillance ... 18 2 Chapitre 2 : Objectifs ... 20 2.1 Objectif général ... 20 2.2 Objectifs spécifiques ... 20 3 Chapitre 3 : Méthode ... 21 3.1 Devis de l’étude ... 21 3.2 Sources de données ... 21
3.3 Population à l’étude, échantillon et taille d’échantillon ... 22
3.4 Définition des variables ... 25
3.4.1 Objectif 1 : Usage des médicaments recommandés ... 25
3.4.2 Objectif 2 : Les médicaments recommandés, la défavorisation et le sexe 28 3.4.2.1 Variables indépendantes ... 28
3.4.2.2 Variable dépendante ... 28
3.4.2.3 Variables potentiellement confondantes... 28
3.5 Analyse ... 32
3.5.1 Objectif 1 : Usage des médicaments recommandés ... 32
3.5.2 Objectif 2: Les médicaments recommandés et la défavorisation ... 32
3.5.3 Objectif 3 : Les médicaments recommandés et le sexe ... 32
vi
4.1 Description de l’usage des médicaments à 30 et 365 jours après la sortie de
l’hôpital ... 33
4.1.1 À 30 jours après la sortie de l’hôpital ... 33
4.1.2 À 365 jours après la sortie de l’hôpital ... 36
4.2 Effet de la défavorisation sur l’usage des médicaments recommandés à la suite d’un premier infarctus aigu du myocarde ... 39
4.2.1 Résumé de l’étude ... 39 4.2.2 Abstract ... 39 4.2.3 Introduction ... 40 4.2.4 Methods ... 41 4.2.5 Results ... 48 4.2.6 Discussion ... 55 4.2.7 Conclusion ... 57
4.3 Effet du sexe sur l’usage des médicaments suite à un infarctus aigu du myocarde ... 58
4.3.1 À 30 jours après la sortie de l’hôpital ... 58
4.3.2 À 365 jours après la sortie de l’hôpital ... 59
5 Chapitre 5 : Discussion ... 61
5.1 Résumé des principaux résultats ... 61
5.2 Interprétation des résultats ... 61
5.2.1 Mesure de l’usage des médicaments à 30 et à 365 jours après la sortie de l’hôpital ... 61
5.2.2 Évaluation de l’association entre l’usage des médicaments recommandés et l’indice de défavorisation ... 63
5.2.3 Évaluation de l’association entre l’usage des médicaments recommandés et le sexe ... 65
5.3 Forces et limites ... 66
Conclusion ... 69
vii
Liste des tableaux
Tableau 1: Liste des médicaments recommandés à la sortie de l'hôpital après un infarctus aigu du myocarde ... 8 Tableau 2: Définition des variables potentiellement confondantes ... 30 Tableau 3: Définition des comorbidités ... 31 Tableau 4: Codes d'interventions en santé utilisés pour l'identification de
l'intervention coronarienne reçue lors de l'hospitalisation ... 31 Tableau 5: Comparaison des caractéristiques de la cohorte à 30 jours en fonction de l'usage approprié et inapproprié des médicaments ... 34 Tableau 6: Comparaison des caractéristiques de la cohorte à 365 jours en fonction de l'usage approprié et inapproprié des médicaments ... 37 Table 7: Characteristics of 30-day cohort according to the least deprived and most deprived quintiles of material and social deprivation in percentage ... 49 Table 8: Unadjusted and adjusted prevalence ratio for non-exposure to guideline-recommended drugs 30 days after hospital discharge for a first acute myocardial infarction ... 53 Table 9: Unadjusted and adjusted prevalence ratio for non-exposure to guideline-recommended drugs 365 days after hospital discharge for a first acute myocardial infarction ... 54 Tableau 10: Rapport de prévalence brut et ajusté de l'usage inapproprié des
médicaments recommandés après un premier infarctus aigu du myocarde 30 jours après la sortie de l'hôpital ... 59 Tableau 11: Rapport de prévalence brut et ajusté de l'usage inapproprié des
médicaments recommandés après un premier infarctus aigu du myocarde 365 jours après la sortie de l’hôpital ... 60
viii
Liste des figures
Figure 1: Extraction de la cohorte des patients âgés de 66 ans ou plus ayant subi un premier infarctus entre le 1er janvier 2006 et le 31 décembre 2011 ... 24 Figure 2: Sélection de la population à l'étude ... 25 Figure 3: Schématisation de la mesure de l'exposition au traitement ... 27 Figure 4: Extraction of cohort of patients aged 66 years or more, who were
hospitalized for a first AMI between January 1, 2006 and December 31, 2011 ... 43 Figure 5: Selection of the population-based study cohort ... 44 Figure 6: Measurement of exposure to guideline-recommended drugs after hospital discharge ... 46
ix
Liste des abréviations
AAS : Acide acétylsalicylique
ACC : American college of cardiology ACE : Angiotensin-converting enzyme ADP : Adénosine diphosphate
AHA : American heart association AMI : Acute myocardial infarction APR : Adjusted prevalence ratio
ARA : Antagoniste des récepteurs de l’angiotensine II ARB : Angiotensin-receptor blocker
BIESP : Bureau d’information et d’études en santé des populations CABG : Coronary artery bypass graft
CI : Confidence interval
CIM : Classification internationale des maladies FIPA : Fichier d’inscription des personnes assurées GRD : Guideline-recommended drugs
HMG-CoA réductase : Hydroxyméthylglutaryl-CoA réductase IAM : Infarctus aigu du myocarde
IC : Intervalle de confiance
ICD : International classification of diseases ICP : Intervention coronarienne percutanée
IECA : Inhibiteur de l’enzyme de conversion de l’angiotensine INSPQ : Institut national de santé publique du Québec
MED-ÉCHO : Maintenance et exploitation des données pour l’étude de la clientèle hospitalière
NAM : Numéro d’assurance maladie
NSTEMI : Infarctus du myocarde sans élévation du segment ST OMS : Organisation mondiale de la santé
PAC : Pontage aorto-coronarien
PCI : Percutaneous coronary intervention PDP : Public drug plan
QICDSS : Quebec integrated chronic disease surveillance system RAMQ : Régie de l’assurance maladie du Québec
RC : Rapport de cote
RMR : Région métropolitaine de recensement RPA : Rapport de prévalence ajusté
RPAM : Régime public d’assurance médicament RR : Relative risk
SD : Standard deviation SES : Socioeconomic status SSÉ : Statut socioéconomique
SISMACQ : Système intégré de surveillance des maladies chroniques au Québec SP-POS : Santé des populations et pratiques optimales en santé
x
Remerciements
À ma directrice de recherche, la professeure Line Guénette, merci d’avoir accepté de m’encadrer tout au long de cette maitrise.
À ma codirectrice de recherche, la professeure Claudia Blais, merci de m’avoir accueillie au sein de ton équipe et de m’avoir encadrée.
Aux membres de ma famille, particulièrement à mon grand frère : Kokou Akator pour les encouragements, le soutien matériel et les précieux conseils.
Aux chercheurs de la Chaire sur l’adhésion aux traitements de l’Université Laval : la professeure Jocelyne Moisan, le professeur Jean-Pierre Grégoire et la professeure Sophie Lauzier, merci pour l’encadrement, les apports et les conseils.
Aux membres de la Chaire sur l’adhésion aux traitements de l’Université Laval et aux membres de l’axe Santé des populations et pratiques optimales en santé, merci pour vos divers apports et aides.
Aux étudiants de la Chaire sur l’adhésion aux traitements de l’Université Laval : Catherine, Mariam, Richi, Thanh, Arsène, Carlotta, Hervé, merci pour vos différents apports à la réalisation de ce travail.
Aux membres et aux étudiants du bureau d’information et d’études en santé des populations de l’Institut national de santé publique du Québec, merci pour vos apports à ce travail.
xi
Avant-propos
Le présent mémoire comporte un article qui sera soumis à une revue scientifique (Canadian journal of Cardiology) avec révision des pairs.
Exposure to guideline-recommended drugs after a first acute myocardial infarction in the elderly: effect of deprivation
Adjo Enyonam Akator, BSc, Claudia Blais, PhD, Philippe Gamache, BSc, Carlotta Lunghi, PhD, Line Guénette, PhD.
La contribution de chaque coauteur à la rédaction de l’article se présente comme suit : Adjo Enyonam Akator : Auteure principale, j’ai révisé la littérature sur le sujet. J’ai participé à la conception de l’étude. J’ai réalisé les analyses statistiques et j’ai écrit la première version de l’article. J’ai participé à la rédaction des versions subséquentes. Claudia Blais : Professeure associée à la Faculté de pharmacie de l’Université Laval et chercheure à l’Institut national de santé publique du Québec. Codirectrice de recherche, co-auteure, elle a contribué à la conception de l’étude et des analyses statistiques, à l’interprétation et à la contextualisation des résultats et à la révision de la première version et des versions subséquentes de l’article.
Philippe Gamache : Statisticien à l’Institut national de santé publique du Québec. Co-auteur, il a participé à la conception des analyses statistiques, il a construit la cohorte, et fait une partie des analyses statistiques. Il a participé à l’interprétation des résultats et à la révision de la première version et des versions subséquentes de l’article.
Carlotta Lunghi: Étudiante au doctorat en pharmacoépidémiologie à l’Université Laval. Co-auteure, elle a participé à la conception de l’étude, à l’interprétation des résultats et à la révision de la première version et des versions subséquentes de l’article.
Line Guénette : Professeure adjointe à la Faculté de pharmacie de l’Université Laval. Directrice du mémoire, co-auteure, elle a contribué à la conception de l’étude et des analyses statistiques, à l’interprétation et à la contextualisation des résultats et à la révision de la première version et des versions subséquentes de l’article.
Les résultats du présent mémoire ont fait l’objet de présentations orales ou par affiche :
- À la journée de la recherche de la faculté de pharmacie de l’Université Laval, Québec, le 23 avril 2015 : Usage des médicaments recommandés à la suite d’un premier infarctus aigu du myocarde chez les personnes âgées au Québec : effet de la défavorisation. (présentation orale)
- À la journée de la recherche des étudiants de l’axe Santé des Populations et Pratiques Optimales en Santé (SP-POS), Québec, le 4 mai 2015 : Usage des
xii
médicaments recommandés à la suite d’un premier infarctus aigu du myocarde au Québec chez les personnes âgées : effet de la défavorisation. (présentation orale)
- Au 31st International Conference on Pharmacoepidemiology & Therapeutic
Risk Management, Boston, du 23 au 26 août 2015 : Use of the guideline-recommended drugs after a first acute myocardial infarction in the province of Quebec in the elderly: effect of deprivation and sex. (présentation par affiche) - À la journée des étudiants du Bureau d’information et d’études en santé des
populations (BIESP) de l’Institut national de santé publique du Québec, Québec, le 17 novembre 2015 : Usage des médicaments recommandés à la suite d’un premier infarctus aigu du myocarde chez les personnes âgées au Québec : effet de la défavorisation et du sexe. (présentation orale)
- Au Congrès de la Société québécoise d’hypertension artérielle, Québec, le 21 janvier 2016 : Usage des médicaments recommandés à la suite d’un premier infarctus aigu du myocarde chez les personnes âgées au Québec : effet de la défavorisation et du sexe. (présentation par affiche)
1
Introduction
Les maladies cardiovasculaires sont des maladies chroniques et se définissent comme l’ensemble des affections qui touchent le cœur et les vaisseaux sanguins (1). Elles regroupent: les cardiopathies ischémiques dont l’infarctus aigu du myocarde, les maladies vasculaires cérébrales, l’hypertension, les artériopathies périphériques, les cardiopathies rhumatismales, les malformations cardiaques congénitales et l’insuffisance cardiaque (1).
Dans le monde, les maladies cardiovasculaires sont la première cause de mortalité. En 2008, l’Organisation mondiale de la Santé (OMS) estimait à 17,3 millions le nombre de décès imputables aux maladies cardiovasculaires, soit 30 % des décès de toutes causes (2).
L'infarctus aigu du myocarde (IAM) ou la crise cardiaque résulte de la nécrose d’une partie du muscle cardiaque qui se produit quand une ou plusieurs artères coronaires s’obstruent (3, 4). L’IAM est l’une des maladies cardiovasculaires ayant une morbidité et une mortalité élevées (3). Chaque année, on recense au Canada environ 70 000 IAM, et en 2005-2006, il y a eu 60 996 hospitalisations liées à l’IAM au Canada (3, 5). En 2003 au Québec, le taux d’hospitalisation pour un IAM était de 177/100 000 habitants et 9,3 % des décès de toutes causes étaient attribuables à l’IAM, soit 32,1 % des décès par maladies cardiovasculaires (4).
Les maladies cardiovasculaires et l’IAM en particulier ont des répercussions graves sur la vie des personnes, leurs familles et la société (3). De nombreuses personnes atteintes de maladies cardiovasculaires ont déclaré être limitées et avoir besoin d’aide pour accomplir leurs activités quotidiennes (3). En 2000 au Canada, les maladies cardiovasculaires ont engendré environ 22 milliards de dollars de coûts. Les coûts directs (soins hospitaliers, médicaments et soins médicaux) s’élevaient à 7,6 milliards de dollars et la valeur de la production économique perdue en raison de la perte de productivité, des incapacités et des décès se chiffrait à 14,6 milliards de dollars (3).
2
Il existe deux types d’IAM en fonction du changement observé à l’électrocardiogramme: l’IAM avec ou sans sus-décalage du segment ST. Le traitement de l’IAM se subdivise en deux phases (5). La première phase du traitement se déroule au cours de l’hospitalisation et diffère en fonction du type d’IAM (5, 6). En cas d’IAM avec sus-décalage du segment ST (STEMI) (obstruction totale de l’artère), il existe deux moyens pour débloquer l’artère : l’administration de trombolytiques par la fibrinolyse ou l’angioplastie primaire (intervention coronarienne percutanée) (6, 7). En cas d’IAM sans sus-décalage du segment ST (NSTEMI), on administre des anticoagulants (héparine en intraveineuse) au patient afin d’éviter l’obstruction complète de l’artère rétrécie. Une fois que le patient est stabilisé, on procède à des examens (angiographie par exemple) qui permettent d’évaluer les risques de complications subséquentes. En cas d’obstruction marquée dans des parties importantes du réseau d’artères coronaires, un des deux traitements mécaniques est utilisé : l’implantation d’une endoprothèse (angioplastie : un ballonnet permet d’étirer les portions d’artères rétrécies du cœur puis ces artères sont maintenues ouvertes grâce à un petit tube grillagé appelé endoprothèse ou tuteur coronarien) ou un pontage aorto-coronarien (création d’un pont qui contourne les artères endommagées à l’aide d’artères provenant de la poitrine ou du bras, ou à l’aide de veines saphènes de la jambe) (6, 7). La deuxième phase du traitement débute à l’hôpital (une fois la première phase complétée) et se poursuit à la sortie de l’hôpital (7, 8). Au cours de cette phase, selon les lignes directrices américaines et canadiennes, quatre ou cinq médicaments dépendant du type d’IAM, doivent être administrés par voie orale au patient (7, 9, 10). On retrouve généralement dans le traitement recommandé (traitement optimal) un ou deux médicaments de la classe des antiagrégants plaquettaires (dont l'acide acétylsalicylique), un bêtabloquant, un inhibiteur de l'enzyme de conversion de l'angiotensine (IECA) ou un antagoniste des récepteurs de l'angiotensine II (ARA) et une statine ou un hypolipémiant (7, 9, 10). Le traitement de l’IAM à la sortie de l’hôpital est un traitement à long terme et fait intervenir la notion d’usage optimal des médicaments.
L’usage optimal des médicaments peut être subdivisé en deux composantes : l’usage optimal des médicaments par les professionnels de la santé (la qualité de la
3
prescription en fonction des recommandations nationales ou internationales de traitement (lignes directrices de traitements des maladies) et l’usage optimal des médicaments par le patient, c’est-à-dire le degré avec lequel le comportement du patient coïncide avec les recommandations du professionnel de santé (11-13). Des études réalisées au Canada et dans le monde ont montré que les patients qui reçoivent le traitement optimal (traitement composé des quatre classes de médicaments citées précédemment) ont un taux de mortalité à un an inférieur comparativement aux patients qui reçoivent une seule classe de médicaments ou aucun médicament (14, 15). Il existe des facteurs qui sont associés à la non-adhésion au traitement, ce sont : les facteurs liés au patient (les connaissances, les croyances, les attitudes, la perception et les attentes), les facteurs liés au traitement médicamenteux (la forme, le nombre de prise par jour, les effets secondaires), les facteurs liés à l’état de santé du patient (symptômes graves et incommodants), les facteurs liés au système de santé et aux professionnels de santé (l’accès à une assurance médicaments, le fait d’être soigné par un médecin spécialiste ou non) et les facteurs liés au statut socio-économique (SSÉ) du patient (le revenu, le niveau d’éducation, le soutien familial) (12, 16). Des études ont montré que l’usage des médicaments recommandés après un IAM varie en fonction du SSÉ (17, 18).
Grâce à une prise en charge rapide des cas d’IAM, une diminution des décès attribuables à l’IAM a été observée au fil du temps au Canada et au Québec même si le taux de mortalité demeure encore assez élevé dans l’année suivant un premier IAM (19, 20). Cependant, il y a des évidences que le taux de mortalité après le premier IAM varie selon le SSÉ (19, 21, 22). Une étude réalisée au Québec a montré que les personnes ayant un SSÉ faible, avaient une mortalité plus élevée dans l’année suivant le premier IAM comparativement aux personnes ayant un SSÉ élevé, en dépit du système de soins de santé universel qui prévaut actuellement (19). Selon Blais et al., l’accessibilité aux interventions cardiaques ne serait pas l’origine de cette inégalité (19).
Les hommes sont plus à risque de faire un IAM que les femmes (23). Cependant, les femmes sont plus à risque d’IAM à un âge plus avancé comparativement aux hommes
4
(23). Au Québec, les hommes ont un taux de mortalité plus élevé que les femmes dans l’année suivant un premier IAM (19). Par ailleurs, des auteurs ont montré qu’il existe une différence dans l’usage des médicaments à la suite d’un IAM en fonction du sexe (23, 24).
Au Québec, l’usage des médicaments à la suite d’un IAM en fonction du SSÉ et en fonction du sexe est très peu documenté. C’est pourquoi nous nous proposons d’évaluer s’il existe une association entre l’usage des médicaments à la suite d’un premier IAM et le SSÉ d’une part, et d’autre part, entre l’usage des médicaments à la suite d’un premier IAM et le sexe. Nous avons donc réalisé une étude de cohorte populationnelle rétrospective chez les personnes âgées de 66 ans ou plus ayant subi un premier IAM au Québec en utilisant les données du Système intégré de surveillance des maladies chroniques du Québec (SISMACQ), de l’Institut national de santé publique du Québec (INSPQ).
Les résultats de la présente étude permettent d’accroitre les connaissances sur l’usage des médicaments après un IAM en évaluant l’usage des médicaments recommandés en fonction du SSÉ et du sexe à la suite d’un premier IAM chez les personnes âgées au Québec. Ces connaissances permettront éventuellement aux décideurs et aux professionnels de la santé de mieux cibler les interventions qui visent à améliorer l’usage des médicaments recommandés à la suite d’IAM dans la population.
Le présent travail s’articule autour de cinq chapitres. Le premier chapitre décrit l’état des connaissances sur l’IAM, son traitement à la sortie de l’hôpital et l’usage des médicaments à la suite d’un IAM en fonction du SSÉ et du sexe. Les objectifs de notre étude sont présentés au chapitre deux. Le chapitre trois fait la description de la méthode que nous avons utilisée pour réaliser notre étude. Le chapitre 4 présente les résultats de notre étude avec une insertion d’un article intitulé : Usage des médicaments à la suite d’un premier IAM chez les personnes âgées au Québec : effet de la défavorisation. Une discussion des résultats est présentée au chapitre cinq suivie d’une conclusion.
5
1 Chapitre 1 : État des connaissances 1.1 L’infarctus aigu du myocarde
1.1.1 Définition
L’IAM est défini comme une diminution de l’apport en oxygène aux cellules du muscle du cœur, ce qui est responsable de la mort (nécrose) de ces cellules et donc de la destruction d’une partie du muscle cardiaque (3, 4). La diminution de l’apport en oxygène est attribuable à la formation d’un thrombus (caillot) dans une des artères coronaires qui irrigue le cœur (3, 4, 25). En fonction du changement observé au niveau de l’électrocardiogramme, on distingue deux types d’IAM : l’IAM avec et sans sus-décalage du segment ST (25, 26).
1.1.2 Épidémiologie de l’infarctus aigu du myocarde
Au Canada en 2008-2009, 66 707 personnes ont été hospitalisées à la suite d’un IAM et 2 266 d’entre elles, soit 3,4 % ont eu plus d’un IAM dans une même année (27). Environ une personne sur quatre ayant subi un IAM meurt avant d’obtenir les soins médicaux et 8,3 % des patients hospitalisés pour un IAM sont décédés à l’hôpital dans les 30 jours suivant leur hospitalisation (27). De plus, de 2006-2007 à 2008-2009, 4,7 % des patients ayant fait un IAM ont été réhospitalisés dans les 28 jours suivant leur sortie (27). En 2006, le taux d’hospitalisation lié à un IAM au Canada variait de 7,0 pour 100 000 habitants dans la tranche d’âge des 25-34 ans à 1 629,8 pour 100 000 habitants dans la tranche d’âge des 85 ans et plus (3). Les hospitalisations étaient plus fréquentes chez les hommes que chez les femmes, avec un taux d’hospitalisation en 2004 de 275 personnes sur 100 000 chez les hommes contre 125 personnes sur 100 000 chez les femmes (3). Toujours au Canada, le nombre de décès attribuables à l’IAM est passé de 31 457 décès en 1969 à 18 125 décès en 2004 (3).
1.1.3 Facteurs de risque
Les facteurs de risque de l’IAM sont identiques aux facteurs de risque des maladies cardiovasculaires (4, 28). Les facteurs de risque se subdivisent en deux grandes catégories : les facteurs de risque non modifiables et les facteurs de risque modifiables (4, 28). Les facteurs de risque non modifiables regroupent : l’âge, le sexe
6
et l’histoire familiale positive de maladie cardiovasculaire (4, 28). L’incidence d’IAM augmente avec l’âge et les hommes sont plus à risque d’IAM que les femmes (3, 4, 29). Par contre, le déficit estrogénique engendré par la ménopause serait à l’origine de l’augmentation du risque d’IAM (de maladies cardiovasculaires) chez les femmes plus âgées (30, 31). Les personnes dont un parent (mère, père, sœur ou frère) a développé une maladie coronarienne ont un risque élevé de développer les maladies cardiovasculaires (28). Les facteurs de risque modifiables sont : le tabagisme, la sédentarité, les mauvaises habitudes alimentaires et la consommation excessive d’alcool, l’hypertension artérielle, le diabète et la dyslipidémie, le surplus de poids, l’obésité et le statut socioéconomique (29, 32). Le tabagisme multiplie le risque d’IAM par cinq chez les personnes âgées de 30 à 40 ans (29). Le risque de décès pour IAM ne varie pas pour une pression artérielle moyenne inférieure à 115/75 mm Hg quel que soit l’âge. Par contre après 40 ans, ce risque est multiplié par deux pour chaque augmentation de 10 mm Hg de la pression diastolique et de 20 mm Hg de la pression systolique (29, 33). L’IAM est l’une des complications du diabète. Le risque d’être hospitalisé pour un IAM est trois fois plus élevé chez les diabétiques comparativement aux non diabétiques (34). Le risque de maladie coronarienne augmente progressivement du quartile inférieur au quartile supérieur de la cholestérolémie totale, indépendamment des autres facteurs de risque (29). Il existe un lien entre les maladies en général et les conditions socio-économiques (3, 4). La mortalité par maladies cardiovasculaires est étroitement liées aux conditions socio-économiques (la profession, le revenu et l’éducation) de la population (3, 4). De plus, il existe aussi un lien entre les facteurs de risque des maladies cardiovasculaires et les conditions socio-économiques de la population (3, 4).
1.1.4 Traitements à la sortie de l’hôpital
Les lignes directrices de la Société canadienne de cardiologie et de l’American College of Cardiology (ACC) conjointement avec l’American Heart Association (AHA) présentent les différents traitements de l’IAM (7, 9, 10). Le traitement se déroule en deux phases : la phase aiguë et la phase chronique (7, 9, 10). La phase aiguë du traitement de l’IAM commence au moment de la prise en charge du patient (pendant le transfert vers l’hôpital jusqu’à la fin de l’hospitalisation) (7, 9, 10). La
7
phase chronique du traitement débute à l’hôpital (une fois la première phase complétée) et se poursuit à la sortie de l’hôpital (7-10). Selon les lignes directrices canadiennes et américaines, le traitement chronique (traitement optimal) est composé de quatre classes de médicaments : les antiagrégants plaquettaires, les bétabloquants, les hypolipémiants et les IECA ou les ARA (7, 9, 10). Le traitement chronique permet la prévention de récidives d’IAM et améliore la survie (35). Une liste complète des différents médicaments de ces classes est présentée au tableau 1.
8
Tableau 1: Liste des médicaments recommandés à la sortie de l'hôpital après un infarctus aigu du myocarde
Classe pharmaceutique Dénomination commune du médicament Code de dénomination commune
Antiagrégants plaquettaires Acide acétylsalicylique 46077, 46353, 47365, 47595, 143 Clopidogrel 46486, 47307 Ticlopidine 45617 Prasugrel 47834 Ticagrélor 47866 Bétabloquants Acébutolol 45463 Aténolol 46325, 43670, 46315 Bisoprolol 47355 Carvédilol 47199, 46319 Labétalol 45243 Métoprolol 38275, 46763, 46780 Nadolol 40563, 46157 Pindolol 39016, 45408 Propranolol 8229 Hypolipémiants Statines Atorvastatine 46355, 47232 Fluvastatine 47083, 46240 Lovastatine 47604, 45500 Rosuvastatine 46860 Pravastatine 45570, 47169, 47595 Simvastatine 45564, 46584 Fibrates Bézafibrate 47092 Fénofibrate 45574, 46575, 47366, 47373, 47754, 47596 Gemfibrozil 44879 Séquestrant de l’acide biliaire Résine de cholestyramine 01989 Chlorhydrate de colestipol 44905
Autres hypolipémiants Niacine 47560, 46803, 47604
Ézétimibe 47456 Inhibiteurs de l’enzyme de conversion de l’angiotensine Bénazépril 47049 Captopril 42071 Cilazapril 47056, 47320 Énalapril 45476, 45572 Fosinopril 47002 Lisinopril 45576, 47040 Périndopril 47117, 46258, 47449 Quinapril 45629, 47301
9
Classe pharmaceutique Dénomination commune du médicament Code de dénomination commune
Ramipril 47079, 46216, 47655 Trandolapril 47250, 47440 Antagonistes des récepteurs de l’angiotensine II Candésartan 47309, 46529, 47412, 46760 Éprosartan 47389, 47534,47532 Irbésartan 47282, 46459, 47354 Losartan 47135, 46284, 46441, 47207 Olmésartan 47763, 47764 Telmisartan 47333, 46587, 47413 Valsartan 47259, 46418, 47369
1.1.4.1 Les antiagrégants plaquettaires 1.1.4.1.1 L’acide acétylsalicylique
L’acide acétylsalicylique (AAS) inhibe la cyclo-oxygénase 1, ce qui a pour conséquence le blocage de la formation du thromboxane A2, entrainant à son tour le blocage de l’agrégation plaquettaire induite par cette voie (36). Il est recommandé de façon systématique chez tous les patients ayant eu un IAM et ne présentant pas de contre-indications (ulcère gastroduodénal, hémorragie intracrânienne) ou d’allergies (9). Il est utilisé à une dose initiale de 162 à 325 mg par jour et une dose d’entretien de 75 à 162 mg par jour. C’est un traitement qui doit être utilisé pour une longue durée (9).
L’AAS est souvent utilisé en association avec d’autres antiagrégants plaquettaires et la durée du second antiagrégant plaquettaire varie idéalement entre 1 mois et une année et fonction du type d’IAM, du type de traitement aigue reçu à l’hôpital (traitement médical ou chirurgical) et du type d’endoprothèse (37). Lorsque le patient est porteur d’endoprothèse, la durée de l’usage des antiagrégants plaquettaires peut être de 3 à 6 mois (37).
10
1.1.4.1.2 Le clopidogrel ou la ticlopidine
Le clopidogrel et la ticlopidine sont deux thiénopyridines dont le mécanisme d’action est le blocage de l’activation des plaquettes par l’adénosine diphosphate (ADP), en inhibant de façon sélective et irréversible la liaison de cet agoniste à son récepteur plaquettaire (5). Cette réaction affecte ainsi l’activation ADP-dépendante du complexe de la glycoprotéine membranaire plaquettaire IIb-IIIa (GPIIb-IIIa), principal récepteur du fibrinogène sur la surface de la plaquette sanguine (36). Le clopidogrel ou la ticlopidine sont recommandés en combinaison avec l’AAS après un IAM, chez les patients ayant subi une intervention coronarienne percutanée (ICP) (5). La durée du traitement varie en fonction du type d’IAM, de la stratégie de prise en charge de l’IAM à l’hôpital et du type d’endoprothèse (5). Le traitement avec le clopidogrel doit être maintenu pendant au moins une année à une dose de 75 mg par jour (9). La ticlopidine n’est presque plus utilisée car elle est associée à plus d’effets indésirables hématologiques. Sa dose est de 250 mg deux fois par jour avec une durée minimale d’un mois et idéalement jusqu’à une année chez les patients ayant subit un traitement médical. Lorsque le patient est porteur d’une endoprothèse nue (sans pharmacoactif), la durée minimale est d’un mois et en cas d’endoprothèse avec pharmacoactif la durée minimale est 3 à 6 mois (38).
1.1.4.1.3 Autres antiagrégants plaquettaires
Le prasugrel est un inhibiteur irréversible des récepteurs plaquettaires P2Y12
(récepteursdes médicaments antiagrégants plaquettaires), tandis que le ticagrélor est un inhibiteur direct et réversible des récepteurs plaquettaires P2Y12 (5). Le prasugrel
agit plus rapidement et a un pouvoir d’inhibition plaquettaire plus grand que le clopidogrel (38). Il réduit les évènements cardiovasculaires majeurs chez les patients ayant subi une intervention coronarienne percutanée (ICP) après un IAM comparativement au clopidogrel (38). Le ticagrélor quant à lui est plus efficace que le clopidogrel dans le syndrome coronarien aigu. Le prasugrel ou le ticagrelor sont recommandés en association avec l’AAS comme agents de première intention après une NSTEMI ou une STEMI (38). Le prasugrel est prescrit en association avec l’AAS chez les patients ayant subi une ICP (5). Le ticagrélor, par contre, est prescrit en association avec l’AAS chez les patients qui ont soit eu un traitement médical, une
11
ICP, une endoprothèse ou un pontage aorto-coronarien (PAC) (5). La durée de traitement du second antiagrégant plaquettaire est d’un mois minimum en cas d’endoprothèse standard et d’une année minimum en cas d’endoprothèse recouverte de médicaments (endoprothèse active ou pharmaco-active) (5). Les endoprothèses actives sont enduites d’agents inhibiteurs de la prolifération endothéliale de type immunosuppresseur (sirolimus) ou cytostatique (paclitaxel) (9).
1.1.4.2 Les bétabloquants
Les bétabloquants sont des antagonistes compétitifs; en se liant aux récepteurs β-adrénergiques, ils s’opposent à la fixation des catécholamines (36). Ils bloquent les récepteurs béta du système sympathique au niveau du cœur, des vaisseaux et des bronches. Leurs actions sur les récepteurs béta-1 (cardiaque) entrainent une diminution de la fréquence et de la conduction cardiaque et une diminution de la contractilité cardiaque. Ces effets ont pour conséquence la diminution du travail du cœur et de sa consommation en oxygène (39). Les bétabloquants sont recommandés chez tous les patients ayant subi un IAM et qui ne présentent pas de contre-indications (exemple : asthme, hypotension, choc cardiogénique) (5). Le traitement avec les bétabloquants est de longue durée (35).
1.1.4.3 Les hypolipémiants
Selon les lignes directrices canadiennes de dyslipidémies, les statines sont les hypolipémiants de première intention (40). Les statines inhibent de façon compétitive, au niveau hépatique, l’enzyme responsable de la transformation de l’HMG-CoA réductase (hydroxyméthylglutaryl-CoA réductase) en mévalonate, précurseur du cholestérol. Il en découle une série d’effets indirects qui entrainent la baisse du LDL-cholestérol (Low Density Lipoprotein), qui est liée à l’inhibition plus ou moins complète de l’HMG-CoA réductase (39, 41). Les autres hypolipémiants sont une alternative en cas de contre-indication ou d’intolérance aux statines (40, 42). L’hypolipémiant de deuxième intention est l’ezétimibe (40, 42). L’ezétimibe inhibe de façon sélective l’absorption du cholestérol au niveau de l’intestin, réduisant ainsi l’apport de cholestérol intestinal vers le foie (38). La niacine, les fibrates et les séquestrants de l’acide biliaire (la cholestyramine) viennent après les statines et
12
l’ezétimibe (40). Les hypolipémiants sont recommandés chez les patients ayant subi un IAM et ne présentant pas de contre-indications (insuffisance hépatique, insuffisance rénale sévère) (9).
1.1.4.4 Les IECA ou les ARA
L’enzyme de conversion de l’angiotensine (ECA) catalyse le catabolisme la conversion de l’angiotensine I en angiotensine II. L’angiotensine II exerce plusieurs effets physiologiques dont la stimulation de la sécrétion de l’aldostérone, une vasoconstriction générale et coronarienne directe. L’inhibition de l’ECA entraine une diminution de la résistance artériolaire générale et des pressions diastoliques et systoliques moyennes (38). Les ARA bloquent de façon sélective la liaison de l’angiotensine II au récepteur de l’angiotensine de type 1 (AT1) ce qui entraine une inhibition du système rénine-angiotensine-aldostérone (SRAA). Le SRAA régule la pression sanguine et l’équilibre hydro-électrolytique. Les ARA provoquent une vasodilatation, une inhibition de la sécrétion de l’aldostérone, une réduction du tonus sympathique et une diminution de l’hypertrophie cellulaire (38). Les IECA ou les ARA sont recommandés aux patients ayant subi un IAM et qui présentent un dysfonctionnement ventriculaire systolique gauche (fraction d’éjection du ventricule gauche : FEVG ≤ 30 %) (5, 9). Les IECA peuvent aussi être utilisés pour contrôler l’hypertension artérielle qui est un facteur de risque de l’IAM (5, 9). Les ARA sont une option de traitement en cas d’intolérance aux médicaments de la classe des IECA (toux) (9).
1.2 Usage optimal des médicaments après un infarctus aigu du myocarde
L’usage optimal des médicaments est celui qui maximise les bienfaits et minimise les risques pour la santé de la population en tenant compte des diverses options possibles, des coûts et des ressources disponibles, des valeurs des patients et des valeurs sociales (11). Plusieurs facteurs peuvent influencer l’usage optimal des médicaments. Parmi ces facteurs nous pouvons citer : l’accessibilité au médicament, la qualité de la prescription et la qualité de l’usage des médicaments par le patient (11, 20). L’accessibilité peut se définir en termes de disponibilité et de coût du médicament (11, 20). La qualité de la prescription est définie ici comme la capacité des
13
prescripteurs à se conformer aux recommandations nationales et internationales de prescription des médicaments (11). Enfin, la qualité de l’usage par le patient réfère ici à l’adhésion au traitement (11). L’adhésion au traitement médicamenteux peut être scindée en trois composantes: l’acceptation (initiation), la persistance et l’observance. Lorsque la personne qui a reçu une ordonnance se rend à la pharmacie pour la faire exécuter une première fois, on peut dire qu’elle accepte son traitement. Si elle poursuit son traitement pendant toute la durée prévue, on peut dire qu’elle persiste à prendre son traitement. Enfin, l’observance c’est quand la personne prend exactement son traitement selon la posologie (dose et moment de prise) recommandée par le prescripteur (12, 13). L’adhésion du patient aux traitements recommandés peut être mesurée par plusieurs méthodes : les méthodes directes et les méthodes indirectes (43). Les méthodes directes consistent soit à faire un dosage des médicaments dans les fluides biologiques du patient, soit à faire une observation directe du patient lors de la prise de ses médicaments. Dans les méthodes indirectes, on procède soit à une mesure de l’usage à partir de bases de données médico-administratives (ou de dossiers de pharmacie), soit à un décompte des médicaments rapportés par le patient, soit à une mesure auto-rapportée de l’usage des médicaments par le patient (questionnaires) (43). La mesure indirecte de l’usage de médicaments dans les bases de données médico-administratives est une méthode beaucoup utilisée en pharmacoépidémiologie parce qu’elle présente beaucoup d’avantages : des coûts peu élevés, une bonne accessibilité, et la possibilité d’étudier une grande population sur une longue période (43). Pour évaluer l’adhésion des patients aux médicaments dans les bases de données médico-administratives différents outils sont utilisés selon la composante de l’adhésion. Les composantes les plus fréquemment mesurées dans les différentes études sont l’observance et la persistance (44, 45). La proportion de jours couverts (PDC en anglais : proportion of days covered) dichotomisée est souvent utilisée pour évaluer l’observance. Cette technique consiste à diviser la somme des durées de traitements dispensés pour le médicament étudié au cours d’une période par le nombre de jours correspondant à la période totale d’observation. Le résultat obtenu est multiplié par cent. Lorsque la PDC est supérieure à un certain pourcentage, souvent fixé à 80 %, le patient est considéré comme étant observant (44, 45). Le
14
modèle anniversaire dichotomisé est fréquemment utilisé pour évaluer la persistance aux traitements. Le patient est considéré comme persistant s’il remplit une ordonnance dans la période qui entoure une période déterminée, souvent le premier anniversaire de son début de traitement (45).
Deux études réalisées au Canada ont rapporté une augmentation au fil du temps de l’usage des médicaments recommandés à la suite d’un IAM (14, 46). La première étude a observé une augmentation dans l’adhésion du patient au traitement recommandé à la suite d’un IAM tandis que la seconde a observé une amélioration dans la prescription du traitement recommandé à la suite d’un IAM (14, 46). En effet, Jackevicius et al. ont observé entre 1999 et 2001, dans l’ensemble du Canada, une augmentation respectivement de 5 %, 15 %, 13 % et 12 % pour l’usage de l’aspirine, de bétabloquants, des IECA et des statines (46). Yan et al., de leur côté, ont observé une amélioration de 23,9 % dans la prescription des médicaments recommandés à la suite d’un IAM entre 1999 et 2003 (14). Choudhry et al. ont attribué l’amélioration de l’adhésion au traitement recommandé à la suite d’un IAM (augmentation de 17,5 % de l’usage de la statine entre 1995 et 2003) qu’ils ont observée à une augmentation (34,9 %) de la prescription de ces médicaments par les professionnels de la santé (47). Une autre étude réalisée en Ontario a montré qu’il existe une association entre le niveau d’adhésion au traitement et la mortalité à la suite d’un IAM : les personnes ayant une faible adhésion aux statines et aux bétabloquants (mesurée à l’aide d’une proportion de jours couverts par l’un ou l’autre de ces médicaments < 40 %) avaient un risque de décès plus élevé comparativement aux personnes ayant une forte adhésion (proportion de jours couverts par l’un ou l’autre de ces médicaments ≥80 %) (20).
1.3 Usage des médicaments chez les personnes âgées
La population mondiale en général et celle du Canada en particulier est vieillissante. Cela s’explique par l’augmentation de l’espérance de vie et la baisse du taux de fécondité. Au Canada, la proportion de personnes âgées de 65 ans ou plus est passée de 10 % (2,7 millions) en 1986 à 14 % ( 4,8 millions) en 2010 (48). L’augmentation en âge entraine chez de nombreuses personnes des problèmes de santé surtout liés à
15
l’émergence des maladies chroniques (48). Plus le nombre de maladies chroniques est grand, plus le nombre de médicaments prescrit est élevé (48). Au Canada en 2009, 63 % des personnes âgées assurées au régime d’assurance médicaments de 6 provinces ont présenté une demande de remboursement pour au moins 5 classes de médicaments et 23 % ont présenté une demande de remboursement pour 10 classes de médicaments dans 6 provinces (48). Les personnes âgées consomment donc beaucoup de médicaments. L’usage de plusieurs médicaments augmente le risque d’interaction médicamenteuse et d’effets secondaires surtout chez les personnes âgées tout en sachant que le vieillissement s’accompagne aussi de la diminution de la fonction rénale et hépatique (48). Il a été démontré que plus le nombre de médicaments à prendre par une personne est grand, plus le risque d’usage inapproprié de ces médicaments est élevé (49). Au regard de ce qui précède, les personnes âgées seraient donc plus à risque d’usage inapproprié des médicaments. Mais, une étude réalisée au Québec par Sirois et al. a montré qu’il existe une amélioration substantielle au fil du temps de l’usage des médicaments cardioprotecteurs chez les personnes âgées atteintes de diabète (50).
1.4 Indice de défavorisation et usage optimal des médicaments après un infarctus aigu du myocarde
L’indice de défavorisation s’inspire des travaux de Townsend sur le concept de défavorisation développé au milieu des années 1980 (51). Selon cet auteur, la défavorisation («deprivation» en anglais) est définie comme «un état observable et démontrable de désavantage relatif face à la communauté locale ou à l’ensemble de la société à laquelle appartient l’individu, la famille et le groupe» (51). Ce désavantage peut toucher plusieurs aspects de la vie tel que : l’alimentation, le domicile, l’éducation, les relations sociales et le travail (51).
Au Québec, la création de l’indice de défavorisation a été motivée par l’absence de données socioéconomiques dans les bases de données médico-administratives (52). Il a donc été mis en place pour suivre l’évolution des inégalités sociales relatives à certains phénomènes de santé comme la mortalité et les hospitalisations (52). L’indice de défavorisation permet de qualifier le niveau de défavorisation d’une aire
16
de diffusion sur deux dimensions : matérielle et sociale (19, 51, 52). Une aire de diffusion est un petit territoire composé d’un ou plusieurs pâtés de maisons contigus regroupant de 400 à 700 personnes (19, 51, 52). Il s’agit donc d’un indice écologique et non d’un indice propre à l’individu (19). L’indice de défavorisation a été conçu à partir de l’intégration de six indicateurs par une analyse en composante principale (52, 53). Cette analyse comprend essentiellement deux composantes qui reflètent les deux dimensions de la défavorisation : la composante matérielle et la composante sociale. La composante matérielle a été définie à partir de la proportion de personnes sans diplôme d’études secondaires, du rapport emploi/population et du revenu personnel moyen (52, 53). La composante sociale, quant à elle, a été définie à partir de la proportion de personnes vivant seules dans leur ménage, la proportion de personnes séparées, divorcées ou veuves et la proportion de familles monoparentales (52, 53). Les valeurs de défavorisation matérielle et sociale sont classées respectivement en cinq quintiles : quintile 1 (personnes moins défavorisées) au quintile 5 (personnes très défavorisées) (52, 53).
L’indice de défavorisation ou les autres indicateurs du SSÉ sont largement utilisés dans le domaine de la santé publique au Canada et dans d’autres pays (54). Dans une étude réalisée au Québec, Blais et al. ont évalué l’effet du SSÉ (mesuré à l’aide de l’indice de défavorisation) et de la zone géographique de résidence sur la mortalité après un premier IAM. Au total 50 242 patients ayant eu un premier IAM au Québec entre 1997 et 2001 ont été inclus dans l’étude. Le SSÉ a été mesuré à l’aide de l’indice de défavorisation. Dans leur étude les auteurs ont utilisé la définition de Pampalon et al. citée précédemment, c'est-à-dire que l’indice de défavorisation a été subdivisé en deux sous composantes (sociale et matérielle) et chaque sous composante a été divisée en cinq quintiles : quintile 1 (personnes moins défavorisées) au quintile 5 (personnes très défavorisées). Les auteurs ont observé une augmentation significative du risque de décès dans les 365 jours suivant l’IAM chez les patients les plus défavorisés. Les patients les plus défavorisés matériellement et socialement avaient respectivement 16 % et 13 % d’augmentation du risque de décès dans les 365 jours suivant l’IAM comparativement aux patients les moins défavorisés (19). Dans une autre étude réalisée en Italie par Kirchmayer et al., chez 3 920 patients ayant eu
17
un premier IAM entre le 1er janvier 2006 et le 30 juin 2007, il ressort qu’il existe une
différence d’adhésion au traitement après un IAM en fonction de l’âge et du sexe. Cependant, aucune différence n’est observée en fonction du SSÉ (55). Il est à noter que la définition du SSÉ utilisé par Kirchmayer et al. dans leur étude est légèrement différente de celle de Pampalon et al. Les auteurs ont utilisé un SSÉ défini à partir des indicateurs suivants : éducation, emploi, nombre de personnes composant un ménage, la nationalité et le logement (propriétaire ou locataire) (55). Par ailleurs, les auteurs ont mesuré l’usage des médicaments recommandés après un IAM à partir du nombre de réclamations dans l’année suivant la sortie de l’hôpital. Un patient a été considéré comme faisant un usage approprié des médicaments s’il a fait au moins 6 réclamations pour chaque classe de médicaments (4 classes de médicaments ont été considérées : antiagrégant plaquettaire, bétabloquant, IECA/ARA, et statine) (55).
1.5 Usage des médicaments après un infarctus aigu du myocarde en fonction du sexe
Les hommes sont plus à risque que les femmes de faire un IAM. Cependant, les femmes sont plus à risque d’IAM à un âge avancé comparativement aux hommes (3, 4). Les hommes ont un taux de mortalité plus élevé que les femmes dans l’année suivant un premier IAM au Québec (19). Les résultats des études antérieures sont divergents par rapport à l’existence d’une différence ou non dans l’usage des médicaments à la suite d’un IAM en fonction du sexe (23, 56-58). Selon l’étude de Davis et al. réalisée aux États–Unis en 2014, les femmes âgées de moins de 55 ans ont moins de chance de recevoir le traitement optimal (aspirine, bétabloquant, IECA, statine et clopidogrel) à la sortie de l’hôpital après un IAM comparativement aux hommes du même âge (44 % vs. 59 % respectivement, p<0,001) (56). Ce qui suggère que les prescripteurs ont tendance à traiter moins agressivement les femmes comparativement aux hommes. À l’opposé, Hamood et al., dans leur étude réalisée en Israël chez les patients hospitalisés pour premier IAM entre le 1er janvier 2005 et le
31 décembre 2010, n’ont pas trouvé de différence significative entre l’usage des médicaments recommandés à la suite d’un IAM et le sexe. En effet, pour la combinaison d’aspirine, bétabloquant, IECA/ARA et statine : rapport de cote
18
(RC)=1,10 et IC à 95 % : 0,79-1,59 (58). Nous ne pouvons donc pas conclure au vue de ces deux études qu’il existe une différence dans l’usage des médicaments après un premier IAM en fonction du sexe.
1.6 Usage des données médico-administratives pour la recherche et la surveillance
Le SISMACQ, composé de cinq bases de données médico-administratives jumelées, a été créé par l’INSPQ pour faire la surveillance des maladies chroniques (59). Les cinq fichiers médico-administratifs sont : 1) le fichier d’inscription des personnes assurées (FIPA), 2) le fichier des hospitalisations (MED-ÉCHO : Maintenance et exploitation des données pour l’étude de la clientèle hospitalière), 3) le fichier des décès du registre des événements démographiques, 4) le fichier des services médicaux rémunérés à l’acte et 5) le fichier des services pharmaceutiques pour les personnes âgées de 65 ans et plus (59). Uniquement les variables nécessaires à la surveillance des maladies chroniques de ces cinq fichiers sont intégrées au SISMACQ. La description détaillée des fichiers composant le SISMACQ est faite à la section 3.2. Le numéro d’assurance maladie (NAM) est utilisé comme clé de jumelage des cinq fichiers et le SISMACQ est mis à jour chaque année (59). L’extraction et le jumelage des données médico-administratives sont faits par la Régie de l’assurance maladie du Québec (RAMQ) puis les données sont transférées à l’INSPQ avec un identifiant unique anonyme (59, 60). À l’automne 2013, les données du SISMACQ s’étendaient du 1er janvier 1996 au 31 mars 2012 (excepté le fichier
des décès qui s’étendait du 1er janvier 1996 au 31 décembre 2009) (59, 60).
Les données médico-administratives sont de plus en plus utilisées pour la recherche en épidémiologie et en pharmacoépidémiologie, malgré qu’elles n’aient pas été créées à l’origine pour la recherche (43, 59). Leur usage pour la recherche présente beaucoup d’avantages comme des coûts peu élevés, une bonne accessibilité et la possibilité d’étudier une grande population sur une longue période (43). La validité et la fiabilité de certains fichiers composant le SISMACQ ont été démontrées (61-63). Tamblyn et al. ont montré que les informations sur les médicaments provenant du fichier des services pharmaceutiques de la RAMQ sont précises (61). Wilchesky et al.
19
ont quant à eux montré que les informations sur les diagnostics et les conditions contenues dans le fichier des services médicaux rémunérés à l’acte de la RAMQ ont une grande spécificité (90 %) mais la sensibilité de ces données varie beaucoup en fonction des types de maladies (62). Finalement, Lambert et al. ont montré que les données sur les comorbidités des soins cardiaques contenues dans les fichiers des hospitalisations sont valides et fiables (63).
20
2 Chapitre 2 : Objectifs 2.1 Objectif général
Notre étude a été réalisée en collaboration avec l’INSPQ, dans le cadre de leur mandat de surveillance des maladies cardiovasculaires. Elle a évalué l’association entre l’usage des médicaments recommandés à la suite d’un premier IAM chez les personnes âgées de 66 ans ou plus au Québec, l’indice de défavorisation et le sexe.
2.2 Objectifs spécifiques
Notre étude avait trois principaux objectifs spécifiques:
1- Décrire l'usage des médicaments recommandés à la suite d’un premier IAM dans la population québécoise âgée de 66 ans ou plus et le comparer à des critères d’usage approprié;
2- Évaluer l’association entre l'usage des médicaments recommandés à la suite d’un premier IAM et l'indice de défavorisation à 30 et à 365 jours après la sortie de l’hôpital;
3- Évaluer l’association entre l'usage des médicaments recommandés à la suite d’un premier IAM et le sexe à 30 et à 365 jours après la sortie de l’hôpital.
21
3 Chapitre 3 : Méthode 3.1 Devis de l’étude
Nous avons constitué une cohorte populationnelle rétrospective de patients âgés de 66 ans ou plus, hospitalisés pour un premier IAM entre le 1er janvier 2006 et le 31
décembre 2011 et admissibles au régime public d’assurance médicaments (RPAM) 180 jours avant et au moins 30 jours après la sortie de l’hôpital.
3.2 Sources de données
L’article de Blais et al. (44) fait une description détaillée des données du SISMACQ que nous avons utilisées pour réaliser notre étude. Voici le résumé de la description des cinq fichiers composant le SISMACQ:
Le FIPA contient l’information sur les personnes ayant un NAM valide et en vigueur : renseignements démographiques et géographiques, éligibilité et admissibilité au régime public d’assurance maladie et médicaments. Il est administré par la RAMQ (59).
Le fichier MED-ÉCHO contient les informations relatives aux séjours (séjours de courte durée et chirurgies d’un jour) en centres hospitaliers québécois dispensant des soins généraux ou spécialisés. Ce fichier comprend essentiellement les dates d’admission et de sortie, les diagnostics principaux et secondaires. Les diagnostics étaient codés selon la 9e révision de la
Classification internationale des maladies CIM-9 jusqu’au 31 mars 2006 et c’est la 10e révision, CIM-10, depuis le 1er avril 2006. La CIM est une norme
internationale qui a été mise en place par l’OMS pour présenter les diagnostics cliniques (27). Les diagnostics secondaires dans MED-ÉCHO étaient au nombre de 15 avec la CIM-9 tandis qu’ils sont maintenant 25 avec la CIM-10 (59).
Le fichier des décès du registre des événements démographiques répertorie tous les décès (date de décès, et causes de décès) des Québécois y compris ceux qui surviennent à l’extérieur de la province (59).
22
Le fichier des services médicaux rémunérés à l’acte comprend l’ensemble des données liées à la facturation des actes médicaux des professionnels de la santé (soumis à l’application d’une entente avec la RAMQ). Ces données sont aussi administrées par la RAMQ (59).
Le fichier des services pharmaceutiques, administré par la RAMQ, regroupe les informations de réclamations de médicaments remboursés dans le cadre du régime public d’assurance médicaments. Ce fichier comporte les informations sur les médicaments prescrits (code de dénomination commune du médicament, dates de renouvellement, quantité servie, teneur, durée du traitement, etc.) ainsi que les informations sur les professionnels de la santé (classe du prescripteur). Il couvre la presque totalité des personnes âgées de 65 ans ou plus (59).
L’indice de défavorisation matérielle et sociale a été intégré au SISMACQ. Il a été créé à partir d’indicateurs de recensements canadiens à l’échelle de l’aire de diffusion et est assigné aux individus grâce à un fichier de correspondance entre l’aire de diffusion et les codes postaux à six positions du FIPA (59).
3.3 Population à l’étude, échantillon et taille d’échantillon
La population à l’étude est composée de toutes les personnes résidant au Québec âgées de 66 ans ou plus et ayant eu une première hospitalisation pour un diagnostic principal d’IAM entre le 1er janvier 2006 et le 31 décembre 2011. Nous avons retenu
uniquement les personnes avec un diagnostic principal d’IAM parce que les personnes ayant un diagnostic secondaire ont tendance à avoir une prise en charge plus complexe (9). Notre population à l’étude est limitée uniquement aux personnes âgées de 66 ans ou plus en raison de l’admissibilité fortement majoritaire au régime public d’assurance médicaments des personnes âgées de 65 ans ou plus au Québec (99 % des personnes âgées de 65 ans ou plus sont intégrées dans le SISMACQ) et du fait que nous devons retourner dans les données antérieures pour connaître la consommation pré-hospitalière de médicaments (59). Étant donné que notre population à l’étude prend en compte toute la population cible, c’est-à-dire les personnes résidant au Québec âgées de 66 ans ou plus et ayant eu un premier
23
diagnostic principal d’IAM entre le 1er janvier 2006 et le 31 décembre 2011, nous
n’avons pas procédé à un calcul de taille d’échantillon.
À partir du fichier des hospitalisations (MED-ÉCHO), les données des hospitalisations avec diagnostic principal d’IAM (codes 410 ou I21 respectivement de la CIM-9 et CIM-10) entre le 1er janvier 2006 et le 31 décembre 2011 ont été
extraites. Pour maximiser la probabilité qu’il s’agisse bien du premier événement d’IAM et être en conformité avec les recommandations de traitement de l’IAM en vigueur à la sortie de l’hôpital, des critères d’exclusion ont été appliqués. Nous avons donc exclu de notre première extraction les hospitalisations avec anciens IAM en diagnostic principal ou secondaire entre le 1er janvier 1996 et le 31 décembre 2005,
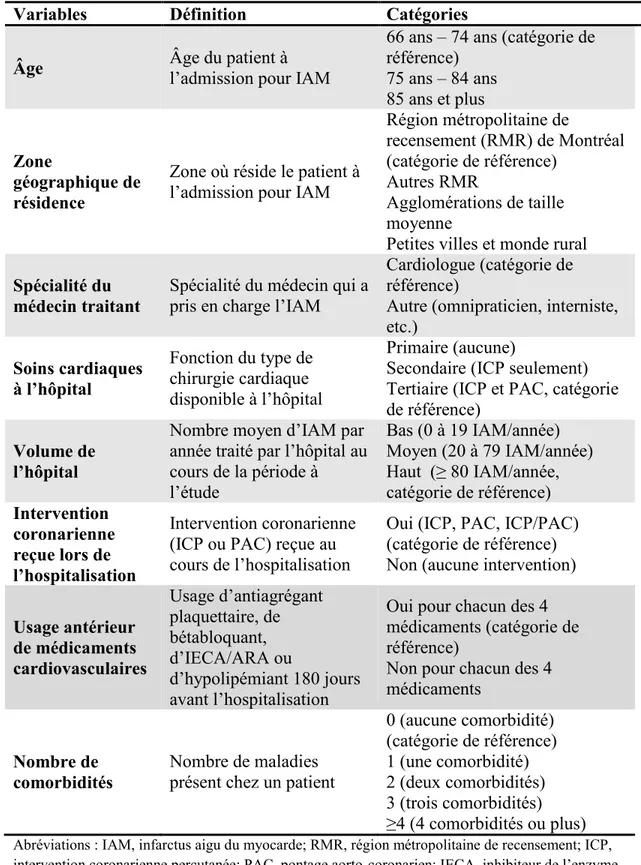
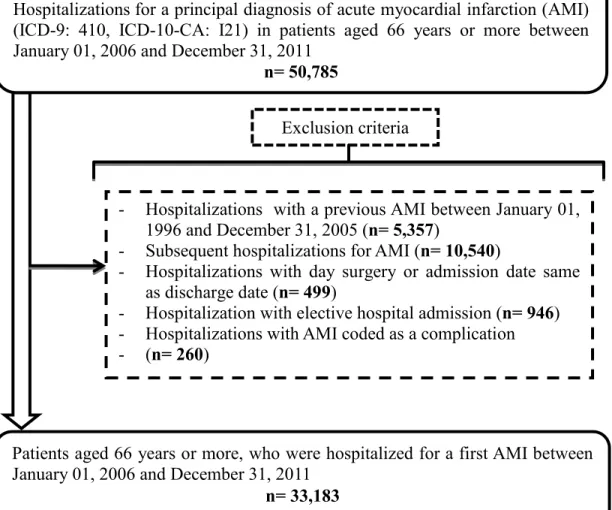
les hospitalisations subséquentes pour IAM (nous avons pris en compte uniquement la première hospitalisation pour un patient, nous avons donc exclu les autres hospitalisations pour un même patient), les hospitalisations pour une chirurgie d’un jour et les hospitalisations où la date d’admission était égale à la date de sortie, les hospitalisations pour admission non urgente et enfin les hospitalisations pour un IAM codé comme complication de l’hospitalisation (figure 1). Au terme de notre sélection, nous avions 33 183 patients âgés de 66 ans ou plus ayant été hospitalisé pour un premier IAM entre le 1er janvier 2006 et le 31 décembre 2011. Afin de s’assurer
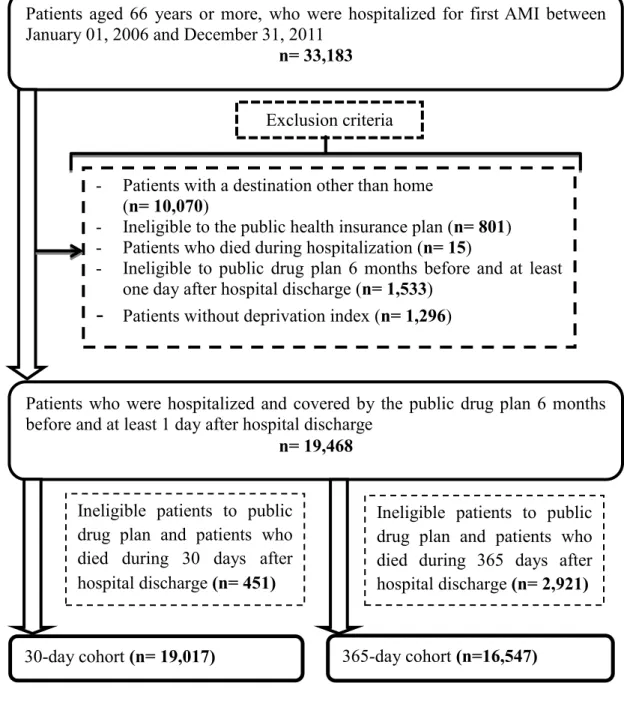
d’avoir les informations sur l’usage des médicaments à la sortie de l’hôpital, nous avons appliqué une série de critères d’exclusion. Nous avons exclu les patients ayant une destination autre que le domicile à la sortie de l’hôpital (par ailleurs, nous avons conservé les patients qui ont été transférés d’un hôpital de niveau inférieur à un hôpital de niveau supérieur parce que nécessitant des soins plus spécialisés), les patients non admissibles au régime d’assurance maladie, les patients décédés au cours de l’hospitalisation, les patients non admissibles au RPAM 180 jours avant et au moins 1 jour après la date de sortie de l’hôpital et les patients qui n’ont pas d’indice de défavorisation. De la cohorte ainsi obtenue, nous avons exclu les patients inéligibles au RPAM ou décédés au cours des 30 jours suivant la sortie de l’hôpital afin d’obtenir notre cohorte à 30 jours. Nous avons ensuite exclu, toujours à partir de notre cohorte initiale, les patients inéligibles au RPAM ou décédés au cours des 365 jours suivant la sortie de l’hôpital afin d’obtenir notre cohorte à 365 jours. Nous
24
avons ainsi obtenu deux cohortes, une cohorte à 30 jours composée de 19 017 patients et une cohorte à 365 jours composée de 16 547 patients (figure 2).
Figure 1: Extraction de la cohorte des patients âgés de 66 ans ou plus ayant subi un premier infarctus entre le 1er janvier 2006 et le 31 décembre 2011
Abréviations : CIM, classification internationale des maladies; IAM, infarctus aigu du myocarde
Hospitalisations des patients âgés de 66 ans ou plus pour un diagnostic principal d’IAM (CIM-9 : 410 et CIM-10 : I21) entre le 1er janvier 2006 et le
31 décembre 2011
(n=50 785)
Critères d’exclusion
Hospitalisations pour anciens IAM en diagnostic principal ou secondaires (CIM-9 : 410 et 412 et CIM-10 : I21, I22, I23, I25.2) entre le 1er janvier 1996 et la 31 décembre 2005
(n=5 357)
Hospitalisations subséquentes pour IAM (n=10 540) Hospitalisations pour chirurgie d’un jour et date
d’admission égale à date de sortie (n=499)
Hospitalisation pour admission non urgente (n=946) Hospitalisation pour IAM codé comme complication de
l’hospitalisation (n=260)
Patients âgés de 66 ans ou plus, hospitalisés pour un premier IAM entre le 1er janvier 2006 et le 31 décembre 2011