La lutte biologique contre le puceron cendré
du chou en production de semences
biologiques
Par : Gaëtan SCUILLER
Soutenu à Angers le 07 Septembre 2018
Devant le jury composé de : Président : Nicolas CHEN
Maître de stage : Jean-Luc TANGUY Enseignant référent : Bruno JALOUX
Autres membres du jury :
Benjamin COUSSY, ingénieur d’études FNAMS
Les analyses et les conclusions de ce travail d'étudiant n'engagent que la responsabilité de son auteur et non celle d’AGROCAMPUS OUEST
Ce document est soumis aux conditions d’utilisation
«Paternité-Pas d'Utilisation Commerciale-Pas de Modification 4.0 France» disponible en ligne http://creativecommons.org/licenses/by-nc-nd/4.0/deed.fr AGROCAMPUS OUEST CFR Angers CFR Rennes Année universitaire : 2017-2018 Spécialité : Horticulture
Spécialisation (et option éventuelle) : PPE-H
Mémoire de fin d’études
d’Ingénieur de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
de Master de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
d'un autre établissement (étudiant arrivé en M2)
Remerciements
Ces 3 ans d’apprentissage au sein de l’OBS m’ont permis de gagner en assurance, en maturité et de voir mes connaissances scolaires s’étoffer par une expérience professionnelle
acquise tout au long de mes périodes en entreprise. Ce fût aussi pour moi l’occasion de travailler en Recherche et Développement, sur des thématiques à la fois complexes mais très intéressantes. Enfin, mon choix de poursuivre dans le domaine de l’expérimentation et
de la santé des plantes s’est confirmé au fil du temps sans jamais m’en lasser.
Je souhaite en premier lieu remercier Mme Véronique TREMELLAT, directrice de l’OBS, de m’avoir permis d’accomplir mon apprentissage au sein de la structure. Je remercie vivement M. Jean-Luc TANGUY, responsable R&D et maître d’apprentissage qui m’a formé au métier de la recherche en appui à différents services. Il a su m’accompagner avec justesse dans
mon cursus en me faisant progresser d’années en années.
Je remercie chaleureusement l’équipe labo et serre, en particulier Lucie LE BIAN (responsable), Daniel LE BORGNE, Christine LAGADEC sans oublier Betty et les différents
saisonniers. J’ai été très heureux de travailler la plupart du temps avec vous. Je n’oublierai pas nos discussions passionnées sur le jardin !
Un grand merci à Guy SALAUN, responsable des cultures sous abri pour m’avoir transmis son goût pour la production des cultures et surtout son ouverture d’esprit sur les innovations
que j’ai pu proposer dans le cadre de la P.B.I.
Je remercie Christophe HENOCQUE, responsable Production, qui m’a particulièrement encadré sur ce sujet de mémoire de fin d’études et qui m’a appris tout ce qu’il faut savoir sur
la production des semences et la filière. Je suis aussi très reconnaissant vis-à-vis des sélectionneurs qui m’ont partagé leur savoir-faire ainsi que toutes celles et ceux avec qui j’ai
eu l’occasion de travailler ou qui m’ont aidé dans les essais. Chacun à sa manière a su me transmettre sa passion, sa joie de travailler au contact du végétal.
Enfin, je remercie M. Philippe GRAPPIN, tuteur d’apprentissage, qui m’a suivi durant ces 3 années ; M. Bruno JALOUX pour le suivi du stage de fin d’études ainsi que pour ses conseils et recommandations ; sans oublier Mme Anne LE RALEC, Emilie PROVOST et les différents partenaires du projet AphidInnov, pour leurs conseils et leur soutien, en particulier dans la
Table des matières
Liste des figures
Liste des tableaux
Liste des annexes
Glossaire
Introduction ... 1
I- Données bibliographiques ... 3
1. La production de chou-fleur porte-graines ... 3
2. Le puceron cendré du chou ... 3
3. La lutte biologique contre le puceron cendré ... 5
a. Nécessité d’une lutte biologique efficace ... 5
b. L’utilisation de Diaeretiella rapae ... 7
c. L’optimisation de la lutte par le nectar extra-floral ... 9
II- Matériel et méthodes ... 11
1. Matériel végétal ...11
2. Matériel animal ...11
3. Protocole expérimental ...13
a. Infestation manuelle de B. brassicae ...13
b. Lâchers de D. rapae et installation des féveroles ...13
c. Echantillonnage et notations ...15
d. Traitements du témoin ...15
e. Analyse statistique des données ...17
III- Résultats ... 19
1. Etat sanitaire des plants ...19
2. Dynamique de population du puceron cendré ...19
3. Dynamique de population du parasitoïde ...21
IV- Discussion ... 23
1. Une infestation manuelle pour simuler une infestation naturelle ...23
2. Facteurs abiotiques et absence de contrôle du puceron cendré ...25
3. Facteurs biotiques et préconisations pour un contrôle de B. brassicae ...25
a. Manipulation des pucerons ...25
b. Lâchers des parasitoïdes ...27
c. Ajustement du mode opératoire ...29
4. Perspectives envisageables ...29
a. Projet AphidInnov ...29
b. Eléments de réflexion sur les méthodes de lutte biologique ...29
Conclusion ... 33
Bibliographie
Sitographie
Liste des figures :
Figure 1 : adulte aptère de Brevicoryne brassicae entouré de sa progéniture (CHAUBET, 2010) ... 4 Figure 2 : adulte ailé de Brevicoryne brassicae (CHAUBET, 2010) ... 4
Figure 3 : hampe florale au stade formation des siliques recouverte de Brevicoryne
brassicae (OBS, 2018) ... 4 Figure 4 : colonie de Brevicoryne brassicae parasitée par le parasitoïde Diaeretiella rapae reconnaissable par les momies dorées (CHAUBET, 2010)... 6 Figure 5 : oviposition d'une femelle Diaeretiella rapae (CHAUBET, 2010) ... 6
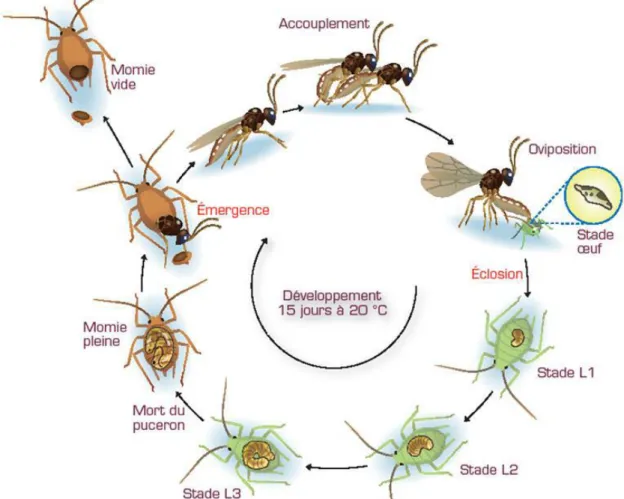
Figure 6 : cycle biologique des parasitoïdes Aphidiinae (CHAUBET, 2011) ... 8
Figure 7 : vue d'un jeune plant de féverole (V. faba) au stade 10 cm. Les nectaires sont entourés en rouge (OBS, 2018) ... 8 Figure 8 : schéma du dispositif expérimental mis en place. Les petits points verts
représentent les porte-graines de chou-fleur ; les points vert foncé représente les plants de féveroles (OBS, 2018) ...10 Figure 9 : vue du tunnel R04 le jour de l'installation des pucerons (OBS, 16/04/2018) ...10
Figure 10 : photo d'un chou-fleur le jour du dépôt des pucerons. Le cercle rouge met en évidence la feuille de dépôt repérée au marquage et le puceron est agrandi à droite (OBS, 2018) ...12 Figure 11 : photo des momies de Diaeretiella rapae déposées dans une boîte de Pétri lors du premier lâcher (OBS, 2018) ...14 Figure 12 : histogramme représentant le pourcentage de plants morts dus aux pourritures engendrées par le mildiou et le botrytis en fonction des blocs. Ces données sont recueillies le 14 juin, date de la fin de pollinisation. Les barres d’erreurs représentent les erreurs
standards. ...18 Figure 13 : graphique représentant le nombre de pucerons par plants en fonction des répétitions des modalités 2 (en bleu) et 3 (en vert). Les courbes pleines sont les répétitions conduites dans un tunnel peu infesté par le mildiou. A l’inverse, les courbes en pointillées sont les répétitions conduites dans des tunnels très infestés par le mildiou. Les barres
d’erreurs représentent les erreurs standards. ...18 Figure 14 : graphique représentant le nombre de pucerons sains par plants en fonction de la modalité 1 (en bleu), de la répétition de la modalité 2 (en rouge) et de la répétition de la modalité 3 (en vert) dans un contexte d'abris très infestés en mildiou. Les barres d’erreurs représentent les erreurs standards. ...20
Figure 15 : graphique représentant les températures moyennes journalières dans l'abri R05. En gris est représentée la température seuil de développement de B. brassicae. En vert est représentée la température seuil de développement de D. rapae. ...22 Figure 16 : graphique représentant les teneurs en pourcentage d’hygrométrie relative moyenne journalière dans l'abri R05...24
Liste des tableaux :
Tableau 1 : données recueillies lors des observations des momies déposées le 16 avril lors du 1er lâcher. Le taux d'émergence à 14 jours est très faible...20 Tableau 2 : données recueillies lors du deuxième apport de D. rapae au 16 mai. Les
observations faites au laboratoire montre un taux d'émergence toujours faible à T+14
jours...20 Tableau 3 : données recueillies après triage des graines récoltées en juillet. Il n’y a pas de différence significative entre les modalités (et ce qu’importe l’état de contamination des tunnels)...22 Tableau 4 : synthèse des ratios utilisés dans des programmes de biocontrôle…………...28
Liste des annexes :
Annexe I : clé de détermination des différents parasitoïdes dont D. rapae (CHAUBET, unknown)
Annexe II : tableau récapitulatif des données de températures et d’hygrométrie relatives relevées dans l’abri R05
Glossaire
Les mots notifiés dans le mémoire par un astérisque (*) sont définis ici.
Anholocyclique : se dit d’un puceron dont le cycle de reproduction est exclusivement asexué (donc incomplet)
Entomopathogène : se dit d’un organisme (en général d’une bactérie ou d’un champignon) qui lutte contre les insectes
Koinobionte : se dit d’une larve de parasitoïde qui se développe dans l’hôte encore en vie afin de disposer d’une ressource nutritive suffisante. Elle le tue à la fin de son développement
Monoécique : se dit des pucerons qui font leur cycle de reproduction sur une même plante hôte
Parasitoïde : se dit d’un organisme qui se développe sur ou dans un autre organisme hôte et qui le tue avant ou après s’être développé
Parthénogénèse : mode de reproduction permettant le développement d’un individu à partir d’un ovule non fécondé (multiplication clonale)
1
Introduction
A la fin de la Seconde Guerre Mondiale, l’agriculture s’est fixée pour objectifs de produire et d’assurer de hauts rendements. Sur le terrain, cela s’est traduit par l’utilisation d’intrants chimiques tels que les produits phytosanitaires. Aujourd'hui, dans la lignée du développement durable, les consommateurs comme les producteurs ou les politiques, se sont rendu compte de l’impact de ces produits sur l’environnement et la santé. Le consommateur devient un « consom’acteur ».
Sa demande se résume ainsi : avoir des produits sains et de qualité. Pour ce faire, les politiques tentent via la réglementation ou les plans nationaux de faire évoluer les stratégies de protection des plantes. La Protection Biologique Intégrée (PBI) est de plus en plus utilisée dans les exploitations agricoles. Cette méthode semble être un juste équlibre entre un mode de production conventionnel et l’agriculture biologique (AB) qui est en plein essor. C’est dans ce contexte, que l’Organisation Bretonne de Sélection (OBS), située à Plougoulm (Finistère, 29), a proposé dans le cadre d’un cursus ingénieur par la voie de l’apprentissage d’une durée de trois ans, des thématiques de recherche et de développement autour de la lutte (biologique ou conventionnelle) contre les thrips, les pucerons et la détection d’un champignon tellurique du sol.
En effet, face à ces changements, les semenciers s’orientent désormais vers la production de graines certifiées « AB » (DE MAY, 2014). Bien que des solutions efficaces de lutte biologique soient existantes, de nombreux verrous perdurent, notamment en culture de porte-graines de chou-fleur sous abri. La période de pollinisation a généralement lieu au printemps. Les abris froids sont à ce moment-là propices pour le développement des ravageurs tels que le puceron cendré du chou (Brevicoryne brassicae). Les conditions de températures et d’hygrométrie se situent dans l’optimum du ravageur et aucun traitement ne peut être effectué au risque de tuer les pollinisateurs (REY et al., 2013). De nombreuses études scientifiques ou produites par la FNAMS (Fédération Nationale des Agriculteurs Multiplicateurs de Semences) semblent orienter le choix d’une lutte via l’utilisation d’hyménoptères parasitoïdes tels que Diaeretiella rapae (M’Intosh).
C’est dans ce contexte que l’OBS avec Savéol Nature, Terres d’Essais et If Tech ont décidé de se rassembler autour de l’UMR IGEPP en participant à un projet ANR d’une durée de trois ans, intitulé : AphidInnov. Dans le cadre de ce projet, un essai est mené à l’OBS durant le printemps 2018. Dans trois mini-tunnels, une production de graines de chou-fleur est lancée. Les pucerons cendrés sont apportés de manière artificielle afin de simuler une infestation naturelle. L’objectif est d’identifier en conditions de production l’intérêt des parasitoïdes dans le contrôle des populations en ravageurs. Le protocole expérimental est construit à l’aide d’une recherche bibliographique et d’échanges menés avec le fournisseur d’auxiliaires. Avant de conclure cette étude, une discussion sur les matériels et méthodes utilisés dans le cadre de cet essai ainsi que les résultats obtenus, vont permettre d’identifier des perspectives à court et moyen terme.
3
I- Données bibliographiques
1. La production de chou-fleur porte-graines
Originaire du Proche-Orient, le chou-fleur (Brassica oleracea var. botrytis) est un légume de la famille botanique des Brassicacées (PORTENEUVE et al., 2015). Très apprécié pour sa pomme compacte et de couleur blanche, la production en France de chou-fleur représente en 2017, 16 782 Ha pour un poids approchant les 297 000 tonnes. (Agreste, 2017). La Bretagne est la 1ère région légumière à l’échelle nationale et la 1ère région
productrice de chou-fleur en Europe. Ainsi, en 2017, plus des 4/5èmes de la production
nationale provenaient de la Bretagne (France Agroalimentaire, 2015). Dans un contexte politique faisant la promotion de l’Agriculture Biologique (AB) en lançant notamment un plan national intitulé « Plan Ambition Bio 2017 », le Ministère de l’Agriculture pose pour objectif de doubler les surfaces bio d’ici à la fin de l’année 2017 (Ministère de l’Agriculture, 2014). Bien que les résultats n’aient pas encore été publiés, la part de bio en 2013 représente alors 7% du volume d’achat (ALLAIN et al., 2014). Cette volonté de produire davantage de produits issus de l’AB peut se traduire par le récent dépassement du seuil des 5% de la Surface Agricole Utile (SAU) française par les exploitations bio. De plus, entre 2015 et 2016, le nombre de producteurs en AB a augmenté de 12% (Agence Bio, 2016).
Parallèlement à ce phénomène, en matière de production de semences, sujet de ce mémoire de fin d’études, la France est au sein de l’Union Européenne, le 1er pays producteur
de semences potagères (GNIS, 2017). Ainsi, un des enjeux les plus importants pour cette filière est de développer la production de semences biologiques pour permettre aux agriculteurs de pouvoir s’approvisionner en graines certifiées « AB » (DE MAY, 2014). Parmi les différents types de semences utilisées, les semences dites conventionnelles non traitées après récolte sont autorisées après dérogation. Ces dernières sont très utilisées faute d’un nombre et d’une qualité de graines certifiées « AB » suffisants. L’enjeu est donc de réduire cette proportion en proposant des graines de chou-fleur certifiées. Cette faible offre s’explique par les verrous rencontrés lors de la production, notamment dans le cadre de la protection des porte-graines vis-à-vis des pucerons, en particulier, le puceron cendré du chou (Brevicoryne brassicae) (REY et al., 2013). Dans le cadre d’une production de semences, le pic d’infestation survient en même temps que les fleurs, c’est-à-dire durant la pollinisation, au printemps. Pour ne pas gêner son bon déroulement et ainsi obtenir des graines, aucune intervention chimique ne peut être effectuée. Or, les infestations de pucerons, si elles ne sont pas bien maîtrisées, peuvent causer de nombreux dégâts (comme l’avortement des fleurs ou des graines) et provoquer des pertes économiques non-négligeables (TACHTELL, 1989). Ainsi, au Pakistan, les infestations de B. brassicae et de Liphaphis erysimi (Kaltenbach) provoquent sur colza des pertes de rendement allant de 75 à 80% (RAZAQ et al., 2011). C’est pourquoi, l’entreprise a fait le choix de participer à un projet ANR afin de lever certains freins empêchant l’obtention de graines.
2. Le puceron cendré du chou
Le puceron cendré du chou, Brevicoryne brassicae (L. 1758), appartient à l’ordre des Hémiptères, au sous-ordre des Sternoryncha et à la famille des Aphididae. Comme son nom semble l’indiquer, ce puceron est strictement inféodé à la famille botanique des
Figure 3 : hampe florale au stade formation des siliques
recouverte de Brevicoryne brassicae (OBS, 2018)
Figure 1 : adulte aptère de Brevicoryne brassicae entouré de sa
progéniture (CHAUBET, 2010)
5 Brassicacées. L’aptère (Fig. 1), de 2-3 mm, est facilement identifiable par sa forme globuleuse, sa couleur gris verdâtre, la présence d’une pruinosité cendrée très caractéristique, de pattes noires et de cornicules noires en forme de tonnelet. L’individu ailé (Fig. 2) est quant à lui reconnaissable par ses pattes noires, des cornicules noires en forme de tonnelet et par la présence de nombreuses sensoria secondaires sur les articles II et III des antennes (LECLANT, 1999 ; TURPEAU et al., 2010).
Dans des régions au climat doux comme en Bretagne, le cycle de reproduction est dit anholocyclique* monoécique*, c’est-à-dire qu’il est incomplet. En effet, le puceron connaît dans l’année une succession de générations asexuées. Les femelles vivipares se reproduisent par parthénogénèse* sur une même plante ou famille de plantes hôtes. Elles donnent ainsi naissance directement à de jeunes larves qui sont génétiquement proches (multiplication clonale). Dans le cas d’une reproduction sexuée, pour un cycle reproductif holocyclique, un premier vol de puceron cendré a lieu début mai à début août selon les régions. Puis, un second d’amplitude plus ou moins importante selon les températures enregistrées en août/septembre, est enregistré en automne, du mois de septembre à la fin du mois d’octobre. Plus les températures estivales sont élevées, plus l’amplitude est importante. Ces femelles sexuées vont alors pondre à la surface inférieure des feuilles où les œufs vont passer l’hiver. Au printemps, à la remontée des températures, les premières colonies apparaissent sur les feuilles puis les individus progressent vers le cœur du chou. Au moment de la floraison, d’importantes colonies de cendrés sont alors visibles sous forme de manchons autour des hampes florales (Fig. 3), compromettant ainsi l’obtention de graines (HULLE et al., 1999). Pour des pucerons cendrés échantillonnés en Turquie et vivant sur du chou pomme (Brassica oleracea var. capitata), il faut 22 jours à 15°C pour obtenir une génération. Les taux de développement les plus élevés sont atteints pour une température comprise entre 20 et 27,5°C. La température minimale de développement est de 4°C et la température maximale est de 30°C (SATAR et al., 2005 ; NEMATOLLAHI et al., 2014). Toutefois, ces valeurs sont approximatives et varient selon les latitudes, les cultivars et le stade phénologique qui influent différemment sur le développement du puceron cendré (JAHAN et al., 2014).
3. La lutte biologique contre le puceron cendré
a. Nécessité d’une lutte biologique efficace
Le puceron cendré du chou est un insecte piqueur-suceur qui peut transmettre des virus tels que le Brevicoryne brassicae Iflavirus (BrBv-IL) ou le virus de la mosaïque du chou-fleur (CaMV) (FERERES & MORANO, 2009 ; LURIA et al., 2016). De plus, ses piqûres de nutrition affaiblissent le plant qui devient plus vulnérable face à d’autres agents pathogènes comme le mildiou ou le botrytis. Les déformations et les chloroses foliaires sont les symptômes les plus caractéristiques de ce puceron et facilitent son observation. Ces dommages sont dus à la salive injectée dans les feuilles qui induit un stress oxydatif (KHATTAB, 2007 ; KUSNIERCZYK et al., 2008). Ainsi, la présence du cendré sur les hampes florales au moment de la floraison peut causer l’avortement des fleurs tout comme celui des graines à la fin de la période de pollinisation.
Afin de réduire au maximum l’effet néfaste du puceron sur les porte-graines, il y a la possibilité d’utiliser les méthodes conventionnelles et de faire une lutte chimique. Cette dernière consiste à traiter les plants lors de l’observation de foyers de pucerons. Cette stratégie est seulement efficace sur une courte période et risque au moment de la floraison
Figure 5 : oviposition d'une femelle Diaeretiella rapae (CHAUBET, 2010) Figure 4 : colonie de Brevicoryne brassicae parasitée par le parasitoïde
Diaeretiella rapae reconnaissable par les momies dorées (CHAUBET, 2010)
7 de gêner les pollinisateurs voire de les tuer. De plus, des systèmes de résistance ont été mis en évidence chez les pucerons (DEVONSHIRE, 1998). Avec le retrait du Pirimor G (Pyrimicarbe) en décembre 2016 (E-phy, 2016), il reste actuellement le Movento (Spirotétramate) et l’Okapi (Lambda cyalothrine + Pyrimicarbe) comme produits phytosanitaires efficaces à disposition (E-phy, 2018a, 2018b). L’Acétamipride (bientôt retirée) et les autres matières actives appartenant à la famille des Néonicotinoïdes telles que le Flonicamide et la Deltaméthrine sont moyennement voire peu efficaces sur le puceron cendré du chou (AHMAD and AKHTAR, 2013 ; SCUILLER, 2016).
Pour réduire les infestations de pucerons, il existe une liste non-exhaustive et disponible de micro/macroorganismes ou de produits homologués en Agriculture Biologique. Parmi les insectes auxiliaires possibles, il y a dans un premier temps les prédateurs généralistes tels que les carabes ou les forficules. Naturellement présents dans l’environnement, ils consomment aussi bien des pucerons que des végétaux, des graines, voire des lombrics. Leur efficacité est difficilement prouvée tant leur mode d’alimentation dépend du milieu (CARROLL & HOYT, 1984 ; PYWELL et al., 2005 ; NICHOLAS et al., 2005 ; KING et al., 2010). Dans un second temps, il y a la possibilité d’utiliser les prédateurs spécialistes tels que les coccinelles, les cécidomyies prédatrices, les chrysopes, les syrphes ou encore les hyménoptères parasitoïdes*. Des élevages existent et permettent en condition de production sous abri de réaliser des lâchers inondatifs. Néanmoins, ces auxiliaires ont une capacité de dispersion plus ou moins importante et leur maintien dans la culture dépend d’une source de nourriture constituée de nectar ou de pollen, située à proximité (HINDAYANA et al., 2001 ; AMOROS-JIMENEZ et al., 2012 ; YANG et al., 2013 ; BRENNAN, 2016 ; HEIMOANA et al., 2017). Or, en condition de production de semences, une contrainte est à prendre en compte. Pour limiter le risque de diminuer le nombre de croisements, nous évitons d’utiliser des macroorganismes qui se nourrissent de pollen tels que les chrysopes, les coccinelles ou les syrphes. Des essais menés en 2006-2007 par la Fédération Nationale des Agriculteurs Multiplicateurs de Semences (FNAMS) ont montré un fort intérêt quant à une utilisation précoce de Diaeretiella rapae, un hyménoptère parasitoïde. En effet, 90% des pucerons sont parasités pour un lâcher réalisé 5 heures après l’infestation de jeunes choux fourragers (Brassica oleracea acephala). Toutefois, ce protocole une fois transféré à une culture porte-graines ne donne pas de résultats satisfaisants. Quel que soit l’auxiliaire utilisé, les populations de pucerons ne sont pas contrôlées et la culture donne peu ou pas de graines (PERENNEC, 2006 ; FNAMS 2009, 2011).
b. L’utilisation de Diaeretiella rapae
Parmi la liste d’auxiliaires présentée précédemment, les syrphes (Epysirphus balteatus) et les parasitoïdes sont ceux qui semblent présenter en plein champ un réel intérêt dans le contrôle des colonies de pucerons (GEORGE, 1957). En plein champ, le parasitisme (Fig. 4) peut atteindre 40% sous condition d’une faible abondance en ravageur (LOPEZ et al., 1990 ; DUCHOVSKIENE & RAUDONIS, 2008). Le puceron cendré du chou étant très spécifique du genre Brassica, seules deux espèces de parasitoïdes sont capables de la parasiter : Diaeretiella rapae (M’Intosh, 1855) et Praon volucre (Haliday, 1833) (WILSON & LAMBDIN, 1987 ; ELLIOTT et al., 1994 ; PIKE et al., 1999). Le premier, rencontré le plus fréquemment dans la nature, est un insecte appartenant à l’ordre des Hyménoptères, au sous-ordre des Apocrites, à la famille des Braconidae et à la sous-famille des Aphidiinae. Sa nervation alaire très caractéristique lui permet de se distinguer des autres genres de la même sous-famille (Annexe I). Les individus adultes sont ailés et mesurent environ 3 mm de long. La femelle (Fig. 5) se distingue du mâle par son abdomen qui est plus
Figure 6 : cycle biologique des parasitoïdes Aphidiinae (CHAUBET, 2011)
Figure 7 : vue d'un jeune plant de féverole (V. faba) au stade 10 cm. Les nectaires sont entourés en
9 long et plus effilé. Ce dimorphisme sexuel est dû à la présence d’un ovipositeur chez la femelle. Cet organe particulier permet aux femelles de pondre leurs œufs dans les pucerons hôtes. Ce parasitoïde est qualifié de cosmopolite, c’est-à-dire qu’il peut parasiter une large gamme d’hôtes. Récemment, il a été mis en évidence que D. rapae pouvait parasiter une centaine d’espèces de pucerons (SINGH & SINGH, 2015) ainsi que tous les stades larvaires ZHANG & HASSAN, 2003). Toutefois, la principale espèce hôte est B. brassicae (PIKE et al., 1999). Bien que sa température seuil de développement soit en moyenne de 6,38°C (SOUZA et al., 2017), les besoins en température sont à quelques degrés près les mêmes pour le parasitoïde que ceux de son hôte (SAMPAIO et al., 2017). Concernant son cycle biologique (Fig. 6), nous pouvons observer que les Aphidiinae sont des endoparasites solitaires, ce qui signifie qu’ils pondent un seul œuf dans l’hôte. De plus, ces parasitoïdes sont dits koinobiontes*, c’est-à-dire que la larve va effectuer son développement dans le puceron sans le tuer. Les femelles s’accouplent une à deux fois dans leur vie et vont stocker dans un organe particulier, la spermathèque, les spermatozoïdes. Au moment de la ponte des œufs, elles adapteront selon la qualité des hôtes rencontrés le sex-ratio (proportion de femelles) de leur progéniture. Ce dernier diminue lorsque la densité de l’hôte augmente. Ce qui signifie donc qu’il y a plus de femelles lorsque les colonies de pucerons sont petites (KANT & MINOR, 2017). L’âge des femelles parents joue également sur le sexe de la génération suivante. Ainsi, plus une femelle est âgée et plus elle donnera naissance à des mâles (BERNAL & GONZALEZ, 1997). Il est également très fréquent d’observer un délai entre l’arrivée des pucerons et celle des parasitoïdes. Ainsi, dans le cadre d’une application dans une stratégie de biocontrôle, il a été mis en évidence qu’une introduction précoce (dans les 4 premiers jours suivant l’infestation) de D. rapae permet de contrôler jusqu’à 90% des populations de puceron cendré (NEUVILLE et al., 2015). De plus, l’activité parasitaire est la plus élevée dans les deux à trois premiers jours après l’émergence des adultes (KANT et al., 2013). L’entreprise If Tech cherche actuellement à développer la maîtrise de l’élevage de ce parasitoïde dans l’objectif d’une commercialisation. C’est dans ce contexte que cette entreprise a rejoint le projet AphidInnov et que nous utiliserons dans notre essai leurs insectes.
c. L’optimisation de la lutte par le nectar extra-floral
La lutte biologique inondative se définit par l’utilisation d’organismes vivants lâchés dans un abri ou en plein champ et permet de limiter les dommages dus au ravageur cible (EILENBERG & LOMER, 2001). Les facteurs de réussite étant nombreux, les résultats sont variables et demandent donc à être optimisés. Il a été observé dans une parcelle située à proximité d’une prairie fleurie, que les femelles D. rapae pondent davantage en bordure de champs (ROOT, 1973, TYLIANAKIS et al., 2004). L’hypothèse d’une augmentation de l’efficacité des parasitoïdes a ainsi pu être posée et vérifiée en 2005. Ainsi, en présence de nectar, les femelles parasitoïdes sont plus fécondes augmentant alors le taux de parasitisme (HEIMPEL & JERVIS). Ces résultats confirment de précédents essais où il a été mis en évidence qu’il y a deux fois plus de parasitoïdes dans les cultures jouxtant des haies ou bandes fleuries (MORINO & LANDIS, 1996). De même sous abri, il a été testé des plants de féveroles (Vicia faba L., 1753), de la famille botanique des Fabacées, comme source de nectar. Installées à proximité des foyers de ravageurs, les femelles D. rapae vivent en moyenne 14 jours (contre 7 en l’absence de nourriture) et le taux de parasitisme est deux fois plus important (96 momies par femelles contre 45). Ce nectar qualifié d’extra-floral puisque produit par des glandes spécifiques appelées nectaires (Fig. 7), est composé de sucrose, de fructose et de glucose) (BAYHAN et al., 2007 ; BODLAH et al., 2012 ; JAMONT et al., 2013, 2014). Cette source d’énergie bien que de même composition que le nectar produit au niveau des fleurs, est dans ce cas produit au niveau des stipules et ce dès un
Figure 8 : schéma du dispositif expérimental mis en place. Les petits points verts représentent les
porte-graines de chou-fleur ; les points vert foncé représente les plants de féveroles (OBS, 2018)
11 stade jeune plant (10 cm). Cette plante non hôte du puceron cendré du chou apporte une source d’alimentation aux auxiliaires et contribue donc à augmenter son efficacité. Cela s’explique par le fait que les femelles parasitoïdes ont besoin d’énergie pour pouvoir pondre leurs œufs. Le nectar, floral ou extra-floral, est une source de nourriture qui leur est bénéfique. Dans un contexte de production de semences, l’optimisation des lâchers de parasitoïdes par les plants de féveroles semble être judicieux et fait donc parti de l’essai détaillé ci-après.
II- Matériel et méthodes
1. Matériel végétal
L’essai est mis en place dans trois minis-tunnels (R04, R05 et R10) de 60 m² à l’OBS (site de Kernonen, 29500 Plougoulm). Ce sont des abris froids qui ne bénéficient pas d’une protection antigel. Chaque abri est divisé en deux par un voile insect-proof. Ainsi, nous avons environ 25 plants de choux par blocs soit une cinquantaine de plants par modalité. La culture a été mise en place fin septembre 2017 et a été conduite en conventionnel pour éviter toutes infestations de ravageurs avant le début de l’essai (entendre l’infestation manuelle du puceron cendré). Chaque abri comporte 3 rangées de chou-fleur (Fig. 8). La densité sur le rang est de 0,60 cm et les rangs sont espacés de 0,80 cm. La lignée plantée est le mâle de l’hybride Daoulas (variété phare de l’OBS). La figure 9 donne un aperçu de la culture sous abri au moment du début de l’essai. Le dernier traitement insecticide et fongicide a été effectué au 16/03/2018. Seule la partie haute du R10 a nécessité un second insecticide dit de rattrapage contre le puceron vert (Myzus persicae Sulzer, 1776 ; le 06/04).
2. Matériel animal
L’élevage du puceron cendré se fait à l’OBS (site de Kernonen), dans un tunnel dédié à l’expérimentation. Ce dernier est ainsi soumis à un climat variable. La population utilisée est locale. Elle provient de plants de choux-fleurs infestés. Tous les ans, de nouveaux individus sont ajoutés à l’élevage afin d’assurer un brassage génétique. Les pucerons sont élevés sur de jeunes plants de choux-fleurs (5-8 feuilles) et ce depuis le mois de juin 2017. L’élevage de B. brassicae est enfermé dans une cage constituée de filets insect-proof.
L’élevage du parasitoïde D. rapae est effectué par la société If Tech (partenaire du projet) basée aux Ponts De Cé (49130).
Figure 10 : photo d'un chou-fleur le jour du dépôt des pucerons. Le cercle rouge met en évidence la
13
3. Protocole expérimental
Avant de lancer l’essai qui se caractérise par le dépôt des pucerons sur les plants de chou-fleur, les tunnels ont été scindés en 2 par un filet insect-proof. Ce dispositif permet de conserver à la fois les conditions de production et de climat, mais aussi de mettre en place 3 modalités (dont une témoin) répétées 2 fois. Ainsi, nous pouvons pour des doses de parasitoïdes équivalentes tester leur efficacité selon la présence ou non des féveroles.
a. Infestation manuelle de B. brassicae
Travaillant dans des abris clos, il est peu probable que le puceron cendré se soit naturellement introduit. Nous avons donc choisi de l’introduire artificiellement, à raison d’un individu par plant. Cette faible infestation s’explique par le souhait d’étudier l’efficacité d’une stratégie de lutte biologique en mimant l’apparition des premières colonies.
Le dépôt des pucerons s’est déroulé selon des étapes bien définies. Le jour du lancement de l’essai, le 09/04, le bout du limbe de la feuille choisie pour le dépôt est marqué à la bombe aérosol (Fig. 10). Cette feuille se situe dans le tiers supérieur du plant, proche de la pomme. Cela permet de suivre dans le temps l’évolution des pucerons sans risquer de voir entrer en sénescence la feuille. Ensuite, des larves de stade L3 ou L4 sont choisies puis déposées une à une sur les porte-graines à l’aide d’un pinceau fin (taille 0). Ce choix se justifie par leur immaturité à pondre et par une facilité de manipulation. De plus, ces stades sont les plus parasités, assurant ainsi l’obtention de momies dès le premier lâcher (KANT et al., 2012). La méthode du pinceau peut provoquer des blessures du stylet mais est la plus simple à utiliser. Trois jours après le dépôt, l’absence de pucerons a été observée déclenchant une seconde infestation. Le 20/04, soit 12 jours après le début de l’essai, aucune colonie de cendré n’est observée. Une troisième infestation est effectuée. La dose est de 5 larves apportées sur 90% des plants. Ce choix repose sur la dynamique théorique exponentielle) des pucerons et les 10% de non-installations choisis de manière empirique (ROBERT et al., 1988).
Avant l’infestation, aucun traitement insecticide n’a été effectué. Exception faite pour le tunnel R10 où trois jours avant le dépôt un traitement contre le puceron vert a été appliqué. Néanmoins, au moment de l’infestation, d’autres individus ont été observés et identifiés comme étant Myzus persicae (Sulzer).
b. Lâchers de D. rapae et installation des féveroles
Le premier lâcher de D. rapae est effectué 3 jours après la première infestation (le 12/04). Cela correspond à la nécessité d’intervenir précocement, avant que les pucerons ne s’installent dans la culture. C’est aussi une recommandation de Neuville et al. (2015). Le calcul de la dose à apporter se fait selon le ratio estimé dans les travaux de Zhang et Hassan (2003). Il faut 1 femelle D. rapae pour 5 femelles B. brassicae. Il a été convenu avec l’entreprise If Tech de prendre en compte un sex-ratio de 50%, la dose optimale à apporter par blocs est d’une vingtaine de momies. Les plants de féveroles, semés le 07 mars, sont plantés dans les quatre coins des blocs concernés.
Figure 11 : photo des momies de Diaeretiella rapae déposées dans une boîte de Pétri lors du premier
15 Le second lâcher a lieu un mois après la première infestation, soit au moment de la floraison (le 16/05). La pollinisation dure un mois durant lequel il n’est pas envisageable d’employer des traitements. Comme durant le premier mois, peu de pucerons ont été observés (puisque présents dans les pommes), ce second lâcher a pour objectif de sécuriser la production grainière ou tout du moins, d’obtenir des résultats visibles quant à la maîtrise du ravageur. Pour le calcul de la dose, comme nous n’observons que très peu de pucerons, une estimation globale est effectuée. En considérant de manière empirique que 90% des plants comportent un puceron, en un mois, il s’est multiplié par 5. De même que précédemment, la dose optimale par blocs est de 70 momies.
A chaque lâcher, les momies sont réparties préalablement dans des boîtes de Pétri (Fig. 11) puis déposées en 4 points répartis de manière homogène afin de couvrir l’ensemble des plants. Pendant quinze jours, deux notations hebdomadaires à la loupe binoculaire permettent de suivre le taux d’émergence des adultes des momies. Une estimation est ensuite réalisée afin d’avoir le nombre minimal et maximal de femelles D. rapae dans l’abri.
c. Echantillonnage et notations
Chaque bloc contient une cinquantaine de choux. Afin d’avoir un échantillon statistiquement significatif, les notations se font sur la moitié des plants. Dans le cas d’une production de porte-graines, deux milieux et deux temps sont à distinguer lors de la notation. Le premier mois avant la floraison, les observations se concentrent sur la feuille où le puceron a été déposé. La notation consiste à renseigner le nombre de pucerons, de colonies, d’ailés et de momies présents sur cette même feuille. Pour définir une colonie, nous prenons la définition de LOPEZ et al. (1990) : « au moins cinq pucerons accolés (contact physique) ». Le second temps, au moment de la floraison est marqué par le passage du puceron de la feuille aux hampes. Ainsi, la première hampe colonisée est marquée par un lien. A ce stade, la notation renseigne la taille (en cm) de la colonie, le nombre de foyer, le nombre d’ailés et de momies. Un mois après l’arrêt de la pollinisation, les plants sont battus individuellement afin d’obtenir le poids de semences/plants, le PMG par lots et le nombre de graines/plants.
La semaine suivant la première infestation, les notations sont quotidiennes. Ce qui a permis de refaire très rapidement deux autres apports sans compromettre l’essai. Par la suite, les notations sont réalisées en début et fin de semaine. Puis, à partir de la floraison, les comptages deviennent hebdomadaires. A la fin de la pollinisation, les observations s’arrêtent puisque l’irrigation est coupée pour permettre aux graines de mûrir et aux plants d’entrer en sénescence.
d. Traitements du témoin
Les deux blocs témoins sont traités au savon noir (dose homologuée Ecocert, 10 cl/L) tous les 15 jours. Dès la floraison, les traitements sont suspendus. A la fin de la pollinisation, deux traitements en début et fin de semaine sont appliqués sur la culture afin de réduire l’infestation de pucerons. Ce témoin est qualifié de référence bio puisqu’il s’agit de la stratégie de protection des plants utilisée par l’OBS.
17 e. Analyse statistique des données
Initialement nous avions prévu d’étudier l’impact du parasitisme sur les populations de pucerons cendrés en comparant les modalités entre elles afin d’observer un éventuel effet des féveroles. Néanmoins, des infestations précoces de mildiou sur les pommes des choux-fleurs ont provoqué de très nombreux dépérissements. L’essai se déroulant dans un cadre d’« Agriculture Biologique », nous n’avons fait aucun traitement préventif (tout traitement curatif étant inutile une fois les pommes contaminées). Ainsi, un dénombrement en fin de culture du nombre de plants morts nous a permis de mettre en évidence une nette différence dans l’un des trois tunnels. Un facteur supplémentaire, « pourriture des plants par le mildiou » est donc à prendre en compte dans l’analyse des données, en distinguant a fortiori les dynamiques de population de pucerons cendrés du chou, de parasitoïdes et les rendements grainiers tout en distinguant les répétitions entre abri infesté ou non.
Pour comprendre si la présence du mildiou a impacté significativement (au seuil α de 0,05) la dynamique de population du puceron cendré du chou, nous prenons comme variable le nombre total de pucerons sains (nombre de pucerons sur feuilles + nombre de pucerons estimé sur les hampes calculé à partir de la longueur en cm des manchons (NEUVILLE, 2005)). Cette variable ne suivant pas une loi normale, nous utilisons le Modèle Linéaire Généralisé Mixte. En effet, le nombre de pucerons est apparié, c’est-à-dire que les individus comptés au temps t sont liés à ceux au temps t-1. Pour savoir si le modèle statistique comporte peu d’erreurs-types (présente peu de variance au niveau des données), nous vérifions la surdispersion. Celle-ci doit avoir un ratio proche de 1, auquel cas nous ajustons le modèle par une loi négative binomiale. Nous faisons donc cette comparaison entre la répétition de la modalité 2 issue d’un tunnel « avec » mildiou avec celle « sans » mildiou. De même pour la modalité 3. La modalité 1 ayant ses deux répétitions dans des tunnels fortement infestés, une moyenne du nombre de pucerons sur feuilles et sur hampes est effectuée. Elle est ensuite comparée aux répétitions des deux autres modalités issues des abris « avec » mildiou. Une analyse des modalités et des répétitions entre elles est néanmoins réalisée par la suite pour observer la tendance générale du développement des pucerons.
Cette méthode reste identique dans le cas de l’analyse du parasitisme (en prenant la somme du nombre de momies sur feuilles et sur hampes). Enfin, dans le cas où la récolte des graines a lieu, nous pouvons, toujours en considérant le facteur mildiou, comparer les modalités entre elles.
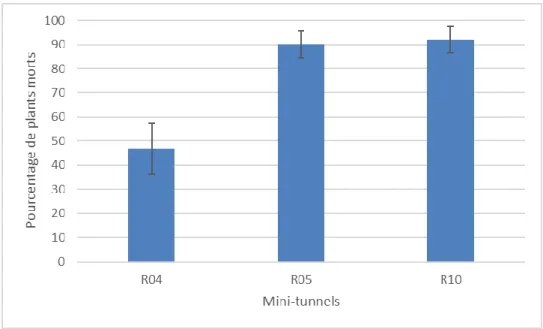
Figure 12 : histogramme représentant le pourcentage de plants morts dus aux pourritures
engendrées par le mildiou et le botrytis en fonction des blocs. Ces données sont recueillies le 14 juin, date de la fin de pollinisation. Les barres d’erreurs représentent les erreurs standards.
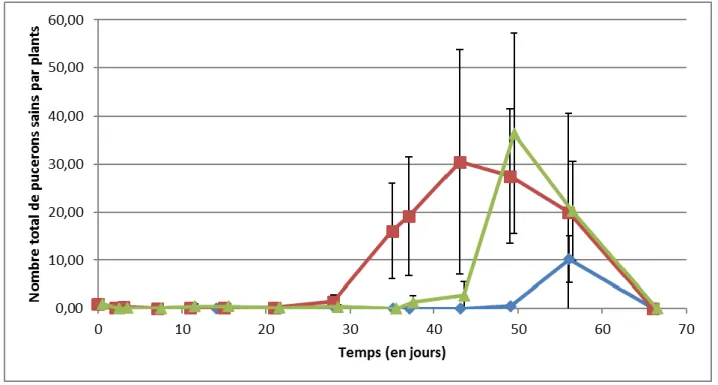
Figure 13 : graphique représentant le nombre de pucerons par plants en fonction des répétitions des
modalités 2 (en bleu) et 3 (en vert). Les courbes pleines sont les répétitions conduites dans un tunnel peu infesté par le mildiou. A l’inverse, les courbes en pointillées sont les répétitions conduites dans des tunnels très infestés par le mildiou. Les barres d’erreurs représentent les erreurs standards.
19
III- Résultats
1. Etat sanitaire des plants
A la fin de la floraison, le nombre de plants morts ou desséchés est très important, et ce en fonction non pas de la modalité, mais de l’abri (Fig. 12). Des infestations de mildiou sont observées dès les premières semaines du mois d’avril. Souhaitant conduire la culture en conditions « d’Agriculture Biologique », aucun traitement anti-fongique n’a été effectué. Les plants sont alors affaiblis et sont ensuite infestés par d’autres champignons pathogènes opportunistes tels que le botrytis ou le Sclerotinia. Seul un tunnel se comporte d’un point de vue sanitaire mieux que les autres. Le R04 présente un taux de plants morts de 46,84 ± 10,5% contre 90,09 ± 5,5% pour le R05 et 91,99 ± 5,6% pour le R10. La lignée cultivée s’est montrée très sensible à ce bioagresseur ce qui est inattendu. Cet état sanitaire de la culture en fin de pollinisation a sans doute perturbé l’installation du puceron cendré et ne permet pas d’assurer un rendement grainier satisfaisant.
2. Dynamique de population du puceron cendré
L’essai a débuté le 09 avril par l’infestation manuelle des plants en déposant une larve de puceron sur chaque chou. Très rapidement, le puceron semble avoir « disparu » des feuilles de dépôt et n’est pas non plus retrouvé sur les feuilles avoisinantes. Ainsi, il a été décidé de refaire un apport au 12 avril afin d’assurer la présence du ravageur dans les abris. Une semaine plus tard, très peu de pucerons sont observés. Un troisième apport est effectué le 20 avril. Dans certains cas ils sont retrouvés morts et tombent lorsque l’observateur touche la feuille. Deux hypothèses sont possibles pour expliquer l’absence de colonies sur feuilles. Premièrement, une prédation « naturellement » présente dans l’abri a pu consommer les larves déposées. Deuxièmement, B. brassicae est un puceron a caractère agrégatif qui a pu s’installer dans les pommes, au niveau de fleurettes. Ainsi, un mois plus tard, le 14 mai, nous observons les premières colonies de cendrés sur les hampes florales. L’apparition du puceron cendré au moment de la floraison est caractéristique d’une entrée précoce du ravageur dans les plants, avec la formation de foyers au niveau des fleurettes, situées dans les pommes. Cela semble confirmer la seconde hypothèse formulée précédemment. De plus, cette situation est en générale redoutée par les semenciers puisque les populations ne sont dès lors plus contrôlées et aboutissent à l’avortement des fleurs voire des graines.
Compte tenu de l’état sanitaire des plants qui se dégradent au fil des semaines, nous pouvons poser comme hypothèse que les dépérissements dus entre autres au mildiou ont un effet sur les populations de pucerons. En comparant les deux répétitions des modalités 2 et 3 provenant d’un abri très infesté et d’un abri moins infesté, nous observons une nette différence (Fig. 13). En effet, au bout de 50 jours d’essai, les plants de la première répétition de la modalité 2 comportent en moyenne 72 pucerons (contre 27,50 pour la deuxième répétition) et les plants se trouvant dans la première répétition de la modalité 3 ont en moyenne 62 pucerons (contre 36 dans la seconde répétition). Nous avons ainsi pu mettre en évidence qu’il y a significativement plus de pucerons dans les répétitions des modalités 2 et
Tableau 1 : données recueillies lors des observations des momies déposées le 16 avril lors du 1er
lâcher. Le taux d'émergence à 14 jours est très faible.
Lâcher du 16/04 % émergence % retrouvées Nombre de momies initial Estimation du nombre minimal et maximal de femelles A T+7 jours 32,25% 86,00% 72 10 11 A T+14 jours 52,78% 50,00% 72 9 19
Tableau 2 : données recueillies lors du deuxième apport de D. rapae au 16 mai. Les observations
faites au laboratoire montre un taux d'émergence toujours faible à T+14 jours. Lâcher du 16/05 % émergence % retrouvées Nombre de momies initial Estimation du nombre minimal et maximal de femelles A T+7 jours 15,00% 86,70% 280 18 21 A T+14 jours 70,50% 43,00% 280 18 74
Figure 14 : graphique représentant le nombre de pucerons sains par plants en fonction de la modalité 1
(en bleu), de la répétition de la modalité 2 (en rouge) et de la répétition de la modalité 3 (en vert) dans un contexte d'abris très infestés en mildiou. Les barres d’erreurs représentent les erreurs standards.
21 3 du tunnel R04 que celles du tunnel R05 et R10 (glm, respectivement <2.10-16 et 0,0145).
Ce résultat indique donc un effet des pourritures dues au mildiou sur la dynamique de population du puceron et suppose donc de s’intéresser aux modalités selon le contexte : « avec » ou « sans » mildiou.
Dans le cas des modalités 2 et 3 dans le R04, tunnel « sans » mildiou, il n’y a pas de différence significative du nombre de pucerons par plants. Ce résultat est également le même entre les abris « avec » mildiou (Fig.14). Néanmoins, nous pouvons graphiquement observer une très faible présence des pucerons dans la modalité 1 (témoin). Il y a significativement plus de pucerons dans les modalités 2 et 3 que dans la modalité témoin (glm, respectivement, 7,2.10-8 et 0,0035). Il semble donc y avoir un effet du savon noir sur la
dynamique de population du ravageur.
En s’affranchissant de l’effet bioagresseur et en comparant chacune des modalités, nous observons bien qu’il y a davantage de pucerons d’une manière générale dans les modalités 2 et 3 que dans le témoin (glm, respectivement 3,77.10-12 et 0,0017). Cela renforce
le possible effet du savon noir sur le développement des pucerons.
3. Dynamique de population du parasitoïde
Le premier lâcher de D. rapae est effectué le 12 avril, soit 3 jours après le premier apport de pucerons et le même jour que le second. Aucune momie n’a ensuite été observée en dépit du deuxième lâcher réalisé le 15 mai. Un mois et demi après la floraison, les premières momies sont aperçues au niveau des manchons de pucerons formés sur les siliques. Cette présence trop tardive ne permet pas de conclure quant à l’efficacité de l’auxiliaire contre B. brassicae et encore moins de démontrer l’intérêt des plants de féveroles.
Au moment des apports des parasitoïdes, des notations pendant quinze jours sont effectuées au laboratoire sous une loupe binoculaire (Tab.1 et 2). Les résultats sont donnés pour l’ensemble des trois abris. Les comptages ont permis de faire une estimation du nombre (minimal et maximal) de femelles D. rapae à avoir émergé dans les abris. Les taux d’émergence des momies sont dans les deux cas très faibles (52,78% et 70,50% respectivement lors du 1er et du 2nd lâcher). De plus, plus des ¾ des momies sont retrouvées
lors de la première lecture contre à peine la moitié à la deuxième lecture. Les estimations obtenues demeurent très faibles par rapport à la quantité de pucerons comptabilisée en mai.
4. Rendement grainier et PMG
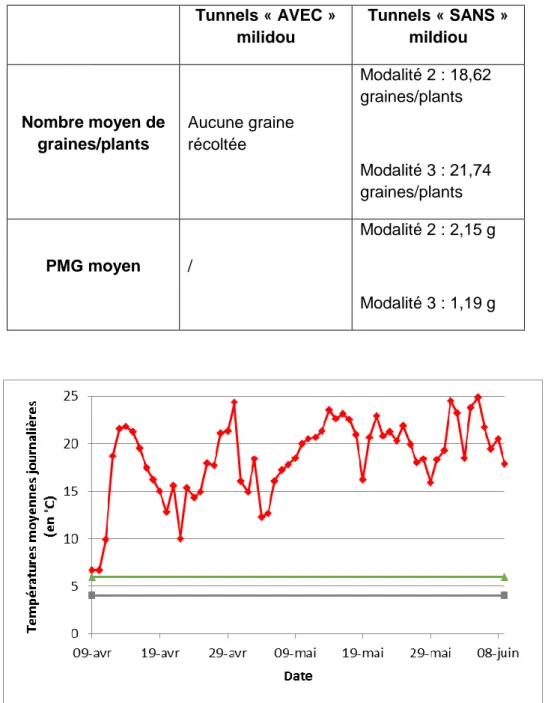
Seuls les choux du tunnel R04 sont récoltés compte tenu de l’état sanitaire des autres tunnels sur lesquels il n’y avait pas une seule silique (Tab.3). Par rapport au témoin de référence, issu d’une production en condition conventionnelle, le nombre de graines/plants est très faible, en moyenne 20,18 graines sont récoltées par plants de choux contre plus de 3000 habituellement. Le PMG moyen est également plus faible (1,67 g contre
Tableau 3 : données recueillies après triage des graines récoltées en juillet. Il n’y a pas de différence significative entre les modalités (et ce qu’importe l’état de contamination des tunnels).
Tunnels « AVEC » milidou Tunnels « SANS » mildiou Nombre moyen de graines/plants Aucune graine récoltée Modalité 2 : 18,62 graines/plants Modalité 3 : 21,74 graines/plants PMG moyen / Modalité 2 : 2,15 g Modalité 3 : 1,19 g
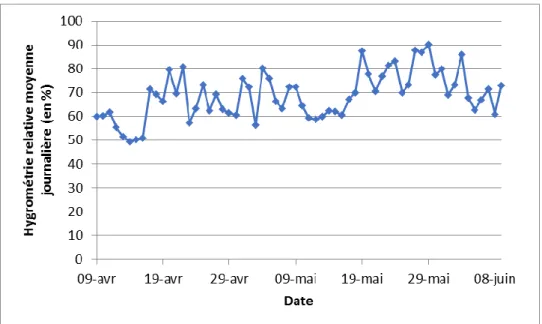
Figure 15 : graphique représentant les températures moyennes journalières dans l'abri R05. En gris
est représentée la température seuil de développement de B. brassicae. En vert est représentée la température seuil de développement de D. rapae.
23 3,26 g). Le faible poids moyen exprime un très faible taux de remplissage de la graine. Ainsi, il est très probable que les graines battues et triées dans le cadre de cet essai ne soient pas viables (taux de germination inférieur à 90%).
La variable nombre moyen de graines par plants ne suivant pas une loi normale, un modèle linéaire généralisé est appliqué aux données. Il en ressort que seul le poids moyen des graines est significativement corrélé au nombre de graines (glm, <2.10-16). En d’autres
termes, cela signifie que plus j’ai de graines, plus le poids est important. En revanche, il n’y a pas de différence significative entre les modalités que ce soit en condition de forte contamination par le mildiou ou non.
IV- Discussion
1. Une infestation manuelle pour simuler une infestation naturelle
En condition de production de porte-graines de chou-fleur, seuls quelques plants sont initialement infestés. Ainsi, nous avons choisi dans cet essai de reproduire cette infestation naturelle où la pression initiale en puceron cendré est faible. Les relevés effectués lors de la première partie de l’essai n’ont pas permis de vérifier la bonne installation du puceron sur les plants de chou. Cela étant, deux autres infestations manuelles ont dû être opérées au risque d’engendrer un biais à la dynamique de population. L’objectif est de s’assurer de la bonne installation du puceron et de pouvoir poursuivre l’essai. Ce n’est qu’à la floraison, c’est-à-dire après l’apparition des hampes que les observations ont pu montrer le caractère agrégatif de B. brassicae (ROBERT et al., 1988). La dynamique observée reproduit exactement le même schéma obtenu en condition réelle de production de semences. Ainsi, l’hypothèse d’une agrégation des individus à l’intérieur des pommes semble le plus probable.
Parallèlement à la dynamique du puceron cendré du chou, des infestations de puceron vert sont observées très précocement dans deux abris sur trois. C’est également dans ces mêmes tunnels que la pression en cendré s’est avérée la moins importante. Cela suppose donc une interaction, ici négative, entre le puceron vert du pêcher et le puceron cendré du chou. Premièrement, il a été mis en évidence que Myzus persicae a un taux relatif de croissance très supérieur à celui de B. brassicae (respectivement 0,16 et 0,09) tout comme le taux de reproduction qui est également plus important. Ainsi nous obtenons une progéniture continue de 65 par adultes de puceron vert contre 41 par adultes de puceron cendré (EMDEN, 1966 ; EMDEN et al., 1971). Nous pouvons donc émettre comme hypothèse que le puceron vert s’est développé plus rapidement que B. brassicae ce qui a freiné le développement de ce dernier.
Figure 16 : graphique représentant les teneurs en pourcentage d’hygrométrie relative moyenne
25
2. Facteurs abiotiques et absence de contrôle du puceron cendré
Le développement du puceron tout comme celui du parasitoïde associé est lié à la température. Les sondes de relevés de température et d’hygrométrie n’ont pas correctement fonctionné, les enregistrements d’un tunnel suffisent déjà à donner une tendance générale et généralisable aux deux autres abris situés dans un environnement géographique très proche. Du 09 avril au 09 juin 2018, la température moyenne est de 18,52 ± 0,52°C et l’humidité relative moyenne est de 68,70 ± 1,26% (Fig. 15 et 16). Pour rappel, la gamme de températures optimales pour le développement du puceron cendré du chou se situe entre 20 et 27,5°C (SATAR et al., 2005 ; NEMATOLLAHI et al., 2014). Pour le parasitoïde D.rapae, cet optimum est compris entre 19 et 21°C (SOUZA et al., 2017). Ainsi, les conditions climatiques dans les tunnels sont proches des optimums de développement du ravageur et de l’auxiliaire. Néanmoins, les températures en matinée se sont révélées être faibles avec une hygrométrie élevée. Or, plus les températures sont basses et l’hygrométrie relative élevée, moins D. rapae est actif. A l’inverse, plus il fait chaud (soit plus il fait ensoleillé), plus la population du parasitoïde est dynamique (KAVAD & KORAT, 2013). L’annexe II donne entre autres les températures minimales journalières et l’hygrométrie relative journalière relevées par la sonde. Les chiffres exposés ci-après sont surlignés en fluo. Trois jours après l’infestation artificielle des plants par les pucerons, nous avons enregistré au minimum 6,6°C pour une hygrométrie relative moyenne de 60,68%. Cette température est à la limite du seuil de développement du parasitoïde qui est, pour rappel, de 6,38°C (SOUZA et al., 2017). D’autres jours, comme le 22/04, le 07/05 ou encore le 13/05, les températures minimales étaient de 2,8°C et l’hygrométrie relative maximale était en moyenne de 98,93%. Dans ces conditions, nous sommes bien en-dessous du seuil de développement de D.rapae et du puceron cendré du chou qui est de 4°C (SATAR et al., 2005 ; NEMATOLLAHI et al., 2014). Ces facteurs abiotiques, puisque liés au climat, n’ont pas dû favoriser convenablement le développement de D. rapae et de B. brassicae, ce qui peut expliquer la « lente » installation de ce dernier ainsi que l’apparition des maladies telles que le mildiou. Ces facteurs climatiques peuvent être responsables d’une absence d’installation du puceron comme ce fut le cas lors de la campagne 2007-2008 menée par la FNAMS (2009). Toutefois, d’autres facteurs directement liés à l’action de l’homme peuvent expliquer une partie des résultats obtenus dans le cadre de cette étude.
3. Facteurs biotiques et préconisations pour un contrôle de B. brassicae
a. Manipulation des pucerons
Deux méthodes d’infestation sont possibles. Dans son expérimentation, S. PERENNEC a infesté au pinceau une feuille de chou qu’elle a ensuite fixé avec une aiguille sur la feuille du chou. Cette méthode est longue et l’aiguille risque d’induire un mécanisme de défense chez la plante ce qui peut freiner le développement du puceron (2006). L’autre méthode, moins chronophage, consiste à appliquer directement au pinceau les larves sur les
27 plants. Dans les deux cas, la manipulation de ces insectes piqueurs-suceurs présente le risque de blesser le stylet du puceron et de causer in fine sa mort. Le second inconvénient lié à ce mode opératoire est de voir le puceron se retourner sur le dos ce qui cause à terme sa mort (il ne se retourne pas de lui-même) voire qu’il ne se fixe pas rapidement au limbe et chute au sol. Enfin, dans le protocole mis en place dans cette expérimentation, nous ne devions observer que la feuille de dépôt, or, le puceron a pu se déplacer et coloniser les feuilles voisines ce qui contraint l’opérateur à augmenter le nombre de feuilles à observer.
b. Lâchers des parasitoïdes
Les résultats présentés précédemment montrent un faible taux d’émergence des parasitoïdes. Cela peut être dû à la manipulation des momies à la réception puisqu’il a fallu les placer dans des boîtes de Pétri pour pouvoir effectuer un lâcher homogène dans les blocs. De plus, le nombre de momies retrouvées pour les observations hebdomadaires sous loupe binoculaire diminue dans le temps. Ce manque traduit une perte d’informations. La « disparition » de ces momies peut être liée à de la prédation au sein même de l’abri par des carabes (SNYDER & IVES, 2001) voire des fourmis (MILLS et al., unknown) ou le vent qui peut les disperser compte tenu de leur petite taille. Afin d’éviter cela, nous pouvons demander au fournisseur If Tech de faire des doses adaptées au lâcher.
Au moment de l’envoi des momies, pour éviter que les adultes n’émergent, des pains de glace sont placés dans les cartons contenant les flacons de D. rapae. A 5°C (température constante) les momies d’A. colemani ou d’A. matricariae sur Myzus persicae présentent un taux d’émergence proche de 0% (ZAMANI et al., 2007). Ainsi, ce procédé de stockage à court terme peut affecter le métabolisme des larves en développement et retarder leur sortie voire leur reproduction à l’émergence.
Le mot d’ordre en lutte biologique est d’introduire le plus tôt possible les auxiliaires (VINCENT & CODERRE, 1992 ; RYCKEWAERT & RHINO, 2016). Ainsi, l’idéal est d’effectuer un lâcher 5 h après la pose des pucerons afin d’obtenir un taux de parasitisme proche de 90% (NEUVILLE, 2008). Le choix des 3 jours repose sur l’essai mené par NEUVILLE et al. (2015). Toutefois, pour une même dose (1 femelle pour 5 pucerons), le résultat obtenu est de très loin différent de ceux obtenus dans la littérature scientifique. Cela peut s’expliquer par un défaut de qualité des momies mais aussi la difficulté de transférer des résultats issus d’essais menés sur des plants de choux au stade 4-5 feuilles en conditions contrôlées à une culture sous abri de porte-graines de choux-fleurs. En effet, bien que D. rapae soit très efficace à chercher et trouver son hôte, la différence de volume entre ces deux stades phénologiques est très nette. Un chou porte-graines représente en moyenne un volume de 0,55m3. Un plant de chou de 4-5 feuilles représente un volume de
0,040m3. Cette différence de volume peut amener à faire des essais sur l’ajustement de la
dose à apporter et la fréquence qui semble, dans les conditions de l’essai, être très nettement insuffisante.
Tableau 4 : synthèse des ratios utilisés dans des programmes de biocontrôle
Contexte Ratio Référence
bibliographique
Conseillé 1,2 :1 ZHANG &
HASSAN,2003 Dans cet essai 0,2 :1
Aphidius colemani (conseillé)
29 c. Ajustement du mode opératoire
Compte tenu des résultats obtenus vis-à-vis des faibles taux d’émergence, il nous faudra à l’avenir augmenter sensiblement la dose d’apport des parasitoïdes de manière à observer des momies dans la durée de l’essai et atteindre un bon contrôle des pucerons cendrés du chou. La dose choisie dans cet essai, recommandée par If Tech, est initialement trop faible (Tab. 4). En effet, idéalement il nous est recommandé par ZHANG & HASSAN d’utiliser un ratio de 1,2 :1 contre le ratio pratiqué dans le cadre de cet essai (0,2 :1) (2003). Même vis-à-vis d’une recommandation d’utilisation d’Aphidius colemani à un ratio de 0,78 :1, nous sommes en dessous de ce dernier (GOH et al., 2001). De plus, dans tous les essais menés et sur lesquels nous nous sommes basés, les femelles parasitoïdes utilisées sont des adultes récemment émergées alors que nous avons utilisés des momies (JAMONT et al., 2013, 2014 ; NEUVILLE et al., 2015).
A l’analyse statistique des colonies de pucerons cendrés présentes sur les hampes, nous nous sommes appuyés sur une publication issue de la FNAMS en 2005. Bien que destinés à l’expérimentation, les résultats demandent à être recalibrés afin de refaire une échelle de notations plus fiable (NEUVILLE, 2005).
4. Perspectives envisageables
a. Projet AphidInnov
Les résultats de cette étude ont été présentés aux partenaires du projet le 25 juin 2018 à l’occasion d’une visite sur site. Suite aux échanges menés qui ont nourri cette discussion, un protocole, qui demandera à être précisé en septembre, a été élaboré. Comme cette année, l’OBS va relancer une production de 300 choux de la même lignée dans 3 minis-tunnels. Les modalités sont en cours de finalisation. Toutefois, il devrait y avoir une modalité témoin non-traité et une modalité avec D.rapae + féveroles. Les pucerons cendrés seront apportés en mars-avril par la plantation d’un certain nombre de plants préalablement infestés dans l’élevage situé sur le site de l’entreprise. Pour le reste de l’essai, le protocole est le même que celui mis en place dans cette étude.
b. Eléments de réflexion sur les méthodes de lutte biologique
Dans le cadre de cette étude, nous avons travaillé sur le couple B. brassicae/D. rapae. Néanmoins, il existe un grand nombre de possibilités potentiellement efficaces à