HAL Id: dumas-01914676
https://dumas.ccsd.cnrs.fr/dumas-01914676
Submitted on 7 Nov 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Évaluation par les médecins généralistes de l’outil
STOPP-START dans la détection des prescriptions
médicamenteuses potentiellement inappropriées chez la
personne âgée
Pierre-Yves Fayolle
To cite this version:
Pierre-Yves Fayolle. Évaluation par les médecins généralistes de l’outil STOPP-START dans la détec-tion des prescripdétec-tions médicamenteuses potentiellement inappropriées chez la personne âgée. Sciences du Vivant [q-bio]. 2017. �dumas-01914676�
Evaluation par les médecins généralistes de l'outil STOPP-START
dans la détection des prescriptions médicamenteuses potentiellement
inappropriées chez la personne âgée
T H È S E
Présentée et publiquement soutenue devant
LA FACULTÉ DE MÉDECINE DE MARSEILLE
Le 11 Décembre 2017
Par Monsieur Pierre-Yves FAYOLLE
Né le 26 avril 1986 à Saint-Etienne (42)
Pour obtenir le grade de Docteur en Médecine
D.E.S. de MÉDECINE GÉNÉRALE
Membres du Jury de la Thèse :
Monsieur le Professeur FRANCES Yves
Président
Monsieur le Professeur ROSSI Pascal
Assesseur
Monsieur le Professeur Associé ADNOT Sébastien
Assesseur
Madame le Docteur CARRIER Hélène
Directeur
Evaluation par les médecins généralistes de l'outil STOPP-START
dans la détection des prescriptions médicamenteuses potentiellement
inappropriées chez la personne âgée
T H È S E
Présentée et publiquement soutenue devant LA FACULTÉ DE MÉDECINE DE MARSEILLE
Le 11 Décembre 2017
Par Monsieur Pierre-Yves FAYOLLE Né le 26 avril 1986 à Saint-Etienne (42)
Pour obtenir le grade de Docteur en Médecine D.E.S. de MÉDECINE GÉNÉRALE
Membres du Jury de la Thèse :
Monsieur le Professeur FRANCES Yves Président Monsieur le Professeur ROSSI Pascal Assesseur Monsieur le Professeur Associé ADNOT Sébastien Assesseur Madame le Docteur CARRIER Hélène Directeur
Mis à jour 16/11/2016
AIX-MARSEILLE UNIVERSITE
Président : Yvon BERLAND
FACULTE DE MEDECINE
Doyen : Georges LEONETTI
Vice-Doyen aux Affaires Générales : Patrick DESSI Vice-Doyen aux Professions Paramédicales : Philippe BERBIS
Assesseurs : * aux Etudes : Jean-Michel VITON * à la Recherche : Jean-Louis MEGE
* aux Prospectives Hospitalo-Universitaires : Frédéric COLLART * aux Enseignements Hospitaliers : Patrick VILLANI
* à l’Unité Mixte de Formation Continue en Santé : Fabrice BARLESI
* pour le Secteur Nord : Stéphane BERDAH
* aux centres hospitaliers non universitaire : Jean-Noël ARGENSON
Chargés de mission : * 1er cycle : Jean-Marc DURAND et Marc BARTHET
* 2ème cycle : Marie-Aleth RICHARD
* 3eme cycle DES/DESC : Pierre-Edouard FOURNIER
* Licences-Masters-Doctorat : Pascal ADALIAN * DU-DIU : Véronique VITTON
* Stages Hospitaliers : Franck THUNY
* Sciences Humaines et Sociales : Pierre LE COZ
* Préparation à l’ECN : Aurélie DAUMAS
* Démographie Médicale et Filiarisation : Roland SAMBUC * Relations Internationales : Philippe PAROLA
* Etudiants : Arthur ESQUER
Responsable administratif :
* Déborah ROCCHICCIOLI
Chefs de service : * Communication : Laetitia DELOUIS * Examens : Marie-Thérèse ZAMMIT * Intérieur : Joëlle FAVREGA
* Maintenance : Philippe KOCK * Scolarité : Christine GAUTHIER
DOYENS HONORAIRES
M. Yvon BERLAND M. André ALI CHERIF
Remerciements
Aux membres du jury,
A mon Président de thèse, Monsieur le Professeur Yves FRANCES
,
Je vous remercie de me faire l'honneur de présider ma thèse.Soyez assuré de ma profonde reconnaissance et de mon profond respect à votre égard. Merci de votre disponibilité pour ce travail de thèse.
A mon juge, Monsieur le Professeur Pascal Maurice ROSSI, Je vous remercie d'avoir accepté de juger mon travail.
Soyez assuré de ma profonde reconnaissance et de mon profond respect à votre égard.
A mon juge, Monsieur le Docteur Sébastien ADNOT, Je vous remercie d'avoir accepté de juger mon travail.
Soyez assuré de ma profonde reconnaissance et de mon profond respect à votre égard.
A mon directeur de thèse, Madame le Docteur Hélène CARRIER, Je te remercie d’avoir accepté de diriger mon travail de thèse.
A mes Maîtres de stage,
Je remercie tous ceux qui ont contribué à ma formation et qui m’ont transmis leur savoir :
- Le service de Pédiatrie du Docteur COMBES de l’hôpital de Hyères les Palmiers, - Le service de Gynécologie du Docteur MOUNAL de l’hôpital de Hyères les Palmiers,
- Le service des Urgences/SAMU du Docteur BOURGEOIS du Centre Hospitalier d’Avignon,
- Le service de Cardiologie du Professeur PAGANELLI à l’hôpital Nord de Marseille, - Le Docteur AMBROSI à Bastia,
- Le Docteur SAMAT pour son humanisme et sa bienveillance,
- Le Docteur SAPIENZA pour le partage de son sens clinique et sa pédagogie.
A ma famille,
Je remercie toute ma famille pour le soutien, qu’elle m’a apporté, au cours de ses longues études de médecine.
Merci, en particulier, à mon père et à ma mère pour leur dévouement.
A mes amis,
Je remercie tous mes amis pour les bons moments passés à leurs côtés. Merci à Lusi et Alain pour leur fidèle amitié.
Merci à Thomas, compagnon de chaque instant.
A ma compagne,
Je te remercie pour l’amour, que tu m’apportes chaque jour.
1
SOMMAIRE
INTRODUCTION
La personne âgée en France
3
Concept de fragilité
4
Polypathologie et polymédication
4
Iatrogénie médicamenteuse
5
Prescriptions Médicamenteuses Inappropriées
6
Problématique
7
METHODES
Type d’étude et population
8
Elaboration du questionnaire
8
Recueil des données
8
Analyse des données
9
RESULTATS
Connaissance de l’outil STOPP-START
11
Application fictive de l’outil à deux ordonnances
11
Opinion sur l’outil et son utilisation
12
DISCUSSION
Principaux résultats
18
Forces de l’étude
18
Limites de l’étude
19
Comparaison à la littérature
19
CONCLUSION
22
BIBLIOGRAPHIE
23
ANNEXES
27
2
" Vieillir c'est organiser - sa jeunesse au cours des ans. "
Eugène Emile Paul GRINDEL alias Paul ELUARD
(14 Décembre 1895-18 Novembre 1952)
3
Introduction
Aujourd’hui, le médecin généraliste se trouve confronté au vieillissement des patients, qu’il soigne. Il est important de pouvoir bien prescrire afin de privilégier le bien vieillir. La baisse de la mortalité, particulièrement concentrée aux âges élevés au cours des dernières décennies, a induit un allongement de la durée de vie et un formidable accroissement des effectifs de population aux grands âges et très grands âges [1]. De meilleures habitudes de vie ainsi que les progrès médicaux ont contribué à repousser l’apparition des maladies chroniques et du handicap. En 2017 en France, l’espérance de vie à la naissance est de 79,3 ans pour un homme et 85,4 ans pour une femme [2].
Le défi de demain sera de réaliser une bonne prise en charge de ces patients. Pour cela, le praticien se doit de bien connaître la personne âgée et de savoir adapter ses prescriptions à cette population.
La personne âgée en France
Différents seuils sont retenus pour définir la personne âgée. La Haute Autorité de Santé (HAS) et l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) considèrent le sujet âgé comme toute personne de 75 ans ou plus, ou de plus de 65 ans présentant une polypathologie.La polypathologie peut être définie comme la coexistence d’au moins deux maladies chroniques. Pour l’Organisation Mondiale de la Santé (OMS), la vieillesse correspond à la période du passage à la retraite. Mais la tendance actuelle est de faire une distinction entre les personnes âgées par groupe d’âges. Deux groupes d’âges sont définis : le troisième âge qui regroupe les sujets de 75 ans à 85 ans (conservation de l’autonomie malgré la dégradation de l’état de santé) et le grand âge, avec les sujets de plus de 85 ans (chez lesquels on observe une majoration de la perte d’autonomie) [3]. Cette population forme un groupe hétérogène à cause des manifestations différentes du vieillissement d’un individu à un autre. Ainsi, c’est l’âge physiologique plutôt que l’âge « chronologique » qu’il est important de considérer, car celui-ci prend en compte l’état de santé du patient.
En 2017, sur 66,9 millions d’habitants en France, 10,1% ont entre 65 et 75 ans, et 9,1% ont plus de 75 ans [2]. La proportion des 75 ans et plus devrait passer à 16% de la population
4 française en 2060 selon les projections de l’Institut National de la Statistique et des Etudes Economiques (INSEE). Ce phénomène de vieillissement de la population ne sera pas sans induire des enjeux économiques et éthiques avec, par ailleurs, une augmentation prévisible du nombre de personnes dépendantes. Au 1er janvier 2012, en France métropolitaine, 1,17 million de personnes âgées étaient dépendantes au sens de l’allocation personnalisée de l’autonomie (APA), soit 7,8% des 60 ans ou plus. A l’horizon 2060, selon le scénario des prévisions de dépendance de l’INSEE, le nombre de personnes âgées dépendantes atteindrait 2,3 millions. Il paraît donc primordial de prévenir autant que possible les causes d’incapacité et de handicap.
Le concept de « fragilité »
Il est défini par une réduction des réserves fonctionnelles limitant les capacités de l’organisme à répondre à un stress même mineur exposant le sujet âgé, à un risque de perte d’autonomie, d’institutionnalisation ou de décès. Il existerait un lien entre « fragilité » et polymédication. Des études suggèrent que la polymédication ou le mésusage des médicaments pourrait induire de la fragilité chez les personnes âgées [4].
Polypathologie et polymédication
L’augmentation de l’espérance de vie s’accompagne d’une augmentation des années de vie avec une ou plusieurs maladies chroniques. La polypathologie entraîne la prescription de plusieurs traitements médicamenteux [5].
La polymédication est définie par l’OMS comme « une administration de nombreux médicaments de façon simultanée ou par l’administration d’un nombre excessif de médicaments ».
Cette définition ne précise par le nombre de molécules, à partir duquel on parle de polymédication. Dans la littérature, ce nombre varie en fonction des études. Les seuils les plus utilisés sont ceux de 5 médicaments ou plus. Plus récemment, devant l’augmentation de la charge thérapeutique, un seuil à 10 médicaments ou plus a été proposé [6]. En outre, il n’y a pas de consensus sur le seuil à adopter pour définir la polymédication [7].
5 Le seuil de 5 médicaments en France, regroupe environ 80% des 75 ans et plus en ambulatoire, alors que le seuil de 10 médicaments regroupe environ entre 30% et 40% de cette population [6].
Le vieillissement de la population et les risques iatrogéniques font de la polymédication un enjeu majeur de qualité des soins et d’efficience de la prescription. Les enjeux économiques sont de trois ordres : une surconsommation de médicaments qui sont inutiles, une augmentation des hospitalisations engendrées par un accident iatrogénique et l’escalade thérapeutique générée par les effets indésirables, une diminution de l’efficience des soins [8].
Iatrogénie médicamenteuse
La iatrogénie médicamenteuse est, selon l’OMS : « un effet indésirable et/ou interaction médicamenteuse ayant potentiellement des conséquences sur la santé d’un individu, imputable au médicament lui-même, mais également à tous les professionnels de santé (médecins, pharmaciens, infirmiers…) et au patient (automédication) ».
L’exposition des sujets âgés au risque iatrogénique est inégale. Plusieurs facteurs augmentent le risque iatrogénique chez ces derniers. Ils sont de deux types. Le premier regroupe ceux liés au sujet : la polypathologie, l’insuffisance rénale, la démence, la dénutrition, les troubles locomoteurs ou encore les déficits sensoriels. Le second comprend ceux liés au traitement : la polymédication, les médicaments à marge thérapeutique étroite, les psychotropes, les médicaments cardiovasculaires, les médicaments récemment mis sur le marché, l’association de plusieurs médicaments ayant une même propriété pharmacologique. La polymédication reste le principal facteur de risque iatrogène.
La plupart des événements iatrogènes médicamenteux (EIM) sont observés, le plus souvent, avec la prise courante de médicaments. Les conséquences de ces EIM sont plus graves chez le sujet âgé. La détection des EIM chez le sujet âgé soulève des difficultés liées notamment à un retard diagnostique du fait d’une présentation atypique.
L’âge, en lui-même, ne semble pas être un facteur de risque d’accident iatrogénique mais il en est, par contre, un facteur de gravité [9]. De plus, il ne faut pas oublier que le risque iatrogénique varie au cours du temps. La survenue d’affections aigues intercurrentes peuvent bouleverser l’équilibre fragile d’une polymédication.
La iatrogénie médicamenteuse a un coût humain et économique très élevé chez le sujet âgé. Elle serait responsable de plus de 10% des hospitalisations chez le sujet âgé, et de près de
6 20% chez les octogénaires. Une partie non négligeable de cette iatrogénie grave serait évitable [10].
Les prescriptions médicamenteuses inappropriées (PMI)
La prescription médicamenteuse inappropriée (PMI) ou potentiellement inappropriée est définie par la prescription d’un médicament : en l’absence d’indication démontrée, ayant un risque élevé d’effets indésirables, ayant un rapport coût-efficacité et/ou bénéfice-risque défavorable.
Ce concept a été introduit par Beers en 1991 : « un médicament est considéré comme inapproprié si son rapport bénéfice-risque est défavorable ou qui a une efficacité douteuse par rapport à d’autres solutions thérapeutiques plus sûres » [11]. Une PMI correspond donc globalement à une prise en compte insuffisante des caractéristiques des médicaments et/ou des patients aboutissant à la prescription d’un médicament, dont le rapport entre le bénéfice escompté et le risque encouru n’est pas optimum.
Mais cette première définition ne permet pas de prendre en compte toutes les modalités de prescriptions qui peuvent être défavorables pour le patient. Ce concept a donc été élargi en introduisant trois modalités de prescriptions sub-optimales : le mésusage, l’excès de traitement et l’insuffisance de traitement.
L’excès de traitement ou « oversuse » correspond à l’utilisation de médicaments prescrits en l’absence d’indication (l’indication n’a jamais existé ou n’existe plus), ou qui n’ont pas prouvé leur efficacité (Service Médicale Rendu ou SMR insuffisant).
Le mésusage est l’utilisation de médicaments, dont les risques dépassent les bénéfices attendus. Il comprend l’utilisation de médicaments indiqués, mais qui ne sont pas correctement prescrits (mauvaise fréquence, durée, mauvais suivi…) ou qui ont une balance bénéfice/risque défavorable.
L’insuffisance de traitement ou « underuse » est défini comme l’absence d’instauration d’un traitement efficace chez le sujet ayant une pathologie, pour laquelle une ou plusieurs classes médicamenteuses ont démontré leur efficacité. Sa prévalence reste élevée dans de nombreuses pathologies, comme la fibrillation auriculaire ou encore l’insuffisance cardiaque, alors que le bénéfice du médicament est souvent supérieur chez le sujet âgé [10][12][13].
7
Problématique
La prise en charge des personnes âgées par le médecin traitant se révèle de plus en plus complexe compte tenu, notamment, de l’évolution démographique et des caractéristiques de ces patients. La polypathologie, plus fréquente avec le vieillissement, entraîne la polymédication et, par ricochet, des effets indésirables médicamenteux ou des interactions médicamenteuses présentant un coût humain et économique élevé. Dans ce contexte, le risque de prescriptions médicamenteuses inappropriées ou potentiellement inappropriées augmente. Le médecin traitant est souvent seul face à cette problématique.
De nombreux outils existent pour aider les praticiens à dépister ces PMI. La revue systématique des prescriptions médicamenteuses a démontré, dans le cadre d’une démarche de prévention, que cette méthode est la meilleure solution pour limiter les PMI, la polymédication et les effets indésirables directement associés [14]. L’outil STOPP-START répond au maximum de critères, permettant une meilleure détection des PMI et leur correction. Au regard des résultats très favorables des études réalisées sur l’outil STOPP START, ce dernier apparaît comme le plus approprié et l’un des plus complets [15]. Est-ce que cet outil dans sa deuxième version peut aider les médecins généralistes à améliorer la prise en charge de leurs patients âgés ?
L’objet de cette thèse était d’étudier si les médecins généralistes considèrent l’outil STOPP-START v.2 comme utile et adapté à leur pratique médicale, susceptible de leur permettre une meilleure identification des PMI chez les personnes âgées.
L’objectif principal de l’étude était de savoir si les médecins généralistes utiliseraient cet outil lors de la prise en charge de leurs patients âgés après l’avoir testé sur deux ordonnances de leurs patients.
Les objectifs secondaires étaient d’essayer de déterminer si les médecins généralistes avaient confiance en l’outil, s’ils le trouvaient facile d’utilisation, quels avantages et limites, ils pouvaient constater.
8
Méthode
Type d’étude et population
Il s’agit d’une étude observationnelle transversale, réalisée entre Septembre 2016 et Février 2017, dans les départements du Rhône et des Bouches-du-Rhône. Des médecins généralistes exerçant en ambulatoire ont été tirés au sort, dans les pages jaunes, de Marseille et ses environs et de Lyon et ses environs. Tous les médecins ayant accepté de participer à l’étude ont été inclus. L’impossibilité de joindre le médecin ou son refus de participation ont été des critères d’exclusion.
Elaboration du questionnaire
Le questionnaire comprenait quatre parties interrogeant les médecins sur (questionnaire disponible en annexe 3) :
- Leurs caractéristiques sociodémographiques et d’exercice définies par le praticien : âge, sexe, mode d’exercice, proportion estimée de patients de plus de 65 ans.
- Leur connaissance et leur utilisation passée de l’outil STOPP-START v.2 (3 items).
- Leurs opinions sur l’outil et son utilisation, recueillies par des échelles de Lickert à 4 modalités et des échelles numériques (8 items).
Le questionnaire a été testé sur une dizaine d’internes en médecine pour en vérifier la clarté. Les éventuelles remarques émises ont été prises en compte pour modifier le questionnaire et ont conduit à sa forme finale.
Chaque médecin a été assuré de l’anonymat de ses réponses.
Recueil des données
Les médecins ont été contactés par téléphone ou rencontrés en personne afin d’obtenir leur accord pour la participation à l’étude. Puis, un courrier électronique leur a été adressé, accompagné d’une lettre informative et de la deuxième version de l’outil STOPP-START (Annexes 1 et 2).
9 Dans un premier temps, il leur a été demandé d’appliquer l’outil de façon fictive à deux ordonnances, de leur choix, contenant plus de 5 médicaments, de patients de plus de 65 ans dont ils souhaitaient réévaluer les prescriptions. L’âge et le sexe du patient concerné par l’ordonnance, le nombre de médicaments prescrits et le temps mesuré pour appliquer l’outil ont été recueillis, ainsi que le nombre de PMI retrouvées distinctement avec la partie STOPP et la partie START. A aucun moment, il ne leur a été demandé de modifier les traitements des patients concernés.
Dans un second temps, après un délai de 15 jours à 3 semaines, les médecins ont été recontactés par téléphone ou rencontrés en personne afin de répondre au questionnaire d’évaluation de l’outil.
Analyse des données
Les données recueillies ont d’abord été saisies dans un tableur Excel®. Les analyses statistiques ont été élaborées à partir du logiciel « R » [16] et le site BiostaTGV [17]. Le test t de Student a été utilisé pour la comparaison des moyennes. Les données qualitatives ont été traitées via le test du Chi-deux ou le test exact de Fischer si les effectifs théoriques étaient inférieurs à 5. Le seuil de significativité statistique a été considéré atteint quand le risque d’erreur était inférieur à 5% (p < 0,05).
10
Résultats
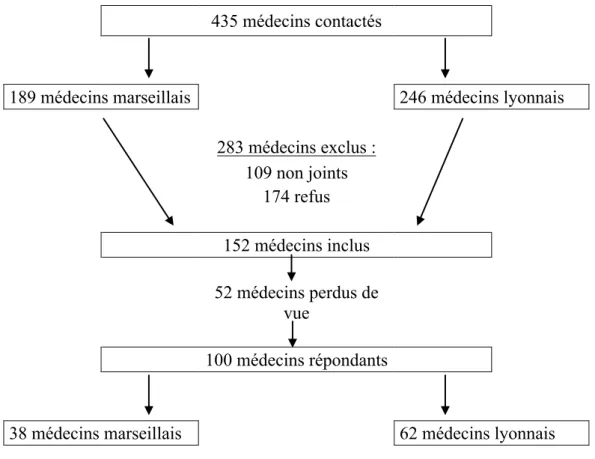
Du 15 septembre 2016 au 10 février 2017, 435 médecins généralistes installés ont été contactés, 35% ont accepté de participer à l’étude et ont été inclus. Ils ont reçu une lettre explicative ainsi que l’outil STOPP-START v.2. 34% des médecins inclus ont été perdus de vue (impossibilité de les recontacter ou non réponse au questionnaire), 66% ont testé l’outil et complété le questionnaire.
435 médecins contactés
189 médecins marseillais 246 médecins lyonnais 283 médecins exclus : 109 non joints 174 refus 152 médecins inclus 52 médecins perdus de vue 100 médecins répondants
38 médecins marseillais 62 médecins lyonnais Figure 1 : diagramme de flux de l’étude
Les caractéristiques des médecins ayant répondu au questionnaire sont disponibles dans le tableau 1.
11 Tableau 1 : caractéristiques des médecins ayant participé à l’étude
Connaissance de l’outil STOPP-START
Parmi les médecins recrutés, seuls 36 % connaissaient déjà l’outil STOPP-START. Parmi eux, 50 % l’avaient déjà appliqué à un de leurs patients, 53 % l’avaient connu au travers d’une revue médicale, 13,9 % au cours d’une Formation Médicale Initiale (FMC) et 33,3 % au cours d’un échange avec un confrère.
Application fictive de l’outil à deux ordonnances
Les données relatives à l’application fictive de l’outil à deux ordonnances de patients par les médecins répondants sont disponibles dans le tableau 2.
CARACTERISTIQUES Nombre SEXE Masculin 52 Féminin 48 29-38 33 39-48 35 AGE 49-65 32 Moyenne 44,2 ans Médiane 42,5 ans RURAL 13 EXERCICE SEMI-RURAL 40 URBAIN 47 moins un quart 40
PATIENTELE un quart et la moitié 58 plus de la moitié 2
12
Données Nombre
Homme 45
Femme 55
Ordonnance 1 Age moyen 78,1 ans
Nombre moyen de médicaments 8,8
Temps moyen d'application de
l'outil 16 min
Homme 56
Femme 46
Ordonnance 2 Age moyen 79,5 ans
Nombre moyen de médicaments 8,6
Temps moyen d'application de
l'outil 13 min 0 4 Nombre de 1 à 2 33 critère(s) STOPP 3 à 5 52 retrouvé(s) plus de 5 11 0 70 Nombre de 1 à 2 25 critère(s) START 3 à 5 4 retrouvé(s) plus de 5 1
Tableau 2 : Données relatives à l’application fictive de l’outil STOPP-START à deux ordonnances
La durée moyenne d’application de l’outil était de 16 minutes pour l’ordonnance 1 et de 13 minutes pour l’ordonnance 2. Le temps moyen d’application de l’outil pour l’ordonnance 2 était significativement inférieur à celui pour l’ordonnance 1 (p < 0,001).
Opinion sur l’outil et son utilisation
Le tableau 3 récapitule les résultats concernant l’opinion des médecins sur l’utilisation de l’outil.
13
En accord En désaccord
(d'accord, plutôt d'accord)
(plutôt pas d’accord, pas d'accord)
En utilisant régulièrement cet outil, je mettrais
moins de temps à l’appliquer 92 8 Les explications détaillées de ses critères
permettent d’améliorer ma pratique médicale 92 8 Sa partie START est un atout pour ne pas oublier un
médicament utile à mon patient. 51 49 Grâce à la division de sa partie STOPP en section,
j’applique seulement les critères correspondants aux
pathologies et aux traitements de mon patient 40 60 Cet outil est une aide pour la réévaluation des
traitements de mes patients de 65 ans et plus 84 16 Cet outil permet d’être vigilant sur de nombreuses
situations à risque pour mon patient. 87 13 Cet outil est adapté à ma pratique 44 56
Le temps d’application de cet outil est trop long 99 1
Un format numérique de cet outil me conviendrait
mieux. 72 28
Tableau 3 : Répartition des réponses des médecins sondés en fonction des affirmations proposées
Plus les médecins généralistes étaient jeunes, plus ils trouvaient l’outil adapté à leur pratique. (p = 0,014).
En accord En désaccord p
29-38 20 13
Age 39-48 16 19 0,014
49-65 8 24
Plus les médecins généralistes étaient jeunes, plus ils trouvaient qu’un format numérique serait plus adapté (p = 0,003).
14 En accord En désaccord p 29-38 30 3 Age 39-48 27 8 0,003 49-65 15 17
Le score moyen retrouvé a été de 5,08. Les résultats se résument par le tableau 4.
Répartition Score moyen p
Générale 5,08 Age 29-38 6,15 39-48 5,03 < 0,001 49-65 4,09 Connaissance Oui 5,97 < 0,001 de l’outil Non 4,57
Tableau 4 : Scores moyens attribués par les médecins en fonction de leur âge et de leur connaissance de l’outil
Plus les médecins étaient âgés, moins ils trouvaient l’outil facile d’utilisation (p < 0,001).
Les médecins, qui connaissaient antérieurement l’outil, jugeaient son utilisation plus facile par rapport à ceux qui ne le connaissaient pas (p < 0,001).
15
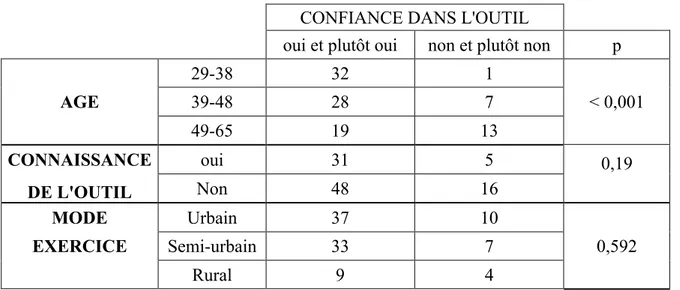
CONFIANCE DANS L'OUTIL
oui et plutôt oui non et plutôt non p
29-38 32 1 AGE 39-48 28 7 < 0,001 49-65 19 13 CONNAISSANCE oui 31 5 0,19 DE L'OUTIL Non 48 16 MODE Urbain 37 10 EXERCICE Semi-urbain 33 7 0,592 Rural 9 4
Tableau 5 : Réponses de la confiance en l’outil des praticiens en fonction des caractéristiques des médecins.
Plus les médecins sondés étaient jeunes et plus ils avaient confiance dans l’outil (p < 0,001).
Confiance dans l’outil
oui, plutôt oui non, plutôt non p
En utilisant régulièrement cet outil, je
mettrai moins de temps à l’appliquer
En accord 79 13 < 0,001
En désaccord 0 8
Les explications détaillées de ses critères permettent d’améliorer ma pratique
médicale
En accord 79 13 < 0,001
En désaccord 0 8
Sa partie START est un atout pour ne pas
oublier un médicament utile à mon patient
En accord 51 0 0,014
En désaccord 28 21
Cet outil est une aide pour la réévaluation des traitements de mes patients de 65 ans et
plus
En accord 76 8 0,012
En désaccord 3 13
Tableau 6 : Réponses de la confiance en l’outil des praticiens en fonction de leur évaluation de l’outil.
16 La confiance dans l’outil des praticiens pouvait être expliquée par la diminution de temps pour l’appliquer en l’utilisant régulièrement (p < 0,001), l’apport des explications détaillées de ses critères (p < 0,001), l’atout de sa partie START (p = 0,014), l’aide de l’outil dans la réévaluation des traitements des patients (p = 0,012).
61 praticiens ne pensaient pas utiliser cet outil dans leur pratique à l’avenir.
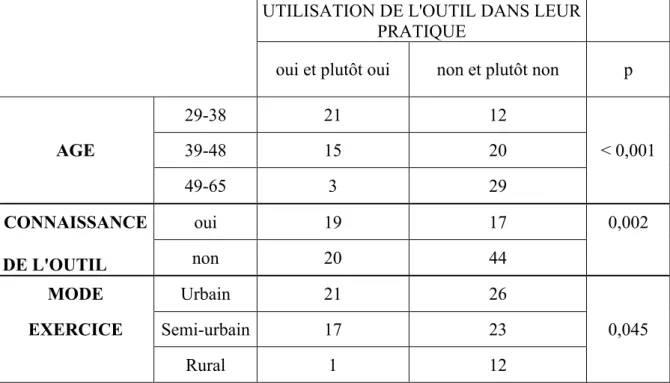
UTILISATION DE L'OUTIL DANS LEUR
PRATIQUE
oui et plutôt oui non et plutôt non p
29-38 21 12 AGE 39-48 15 20 < 0,001 49-65 3 29 CONNAISSANCE oui 19 17 0,002 DE L'OUTIL non 20 44 MODE Urbain 21 26 EXERCICE Semi-urbain 17 23 0,045 Rural 1 12
Tableau 7 : Réponses concernant l’utilisation de l’outil dans la pratique des médecins en fonction de leurs caractéristiques.
Il a été retrouvé trois liens entre les réponses sur l’utilisation de l’outil dans la pratique des médecins et leurs caractéristiques. Plus les praticiens étaient âgés ou exerçaient loin des villes et moins ils étaient enclins à l’utiliser (p < 0,001 et p = 0,045 respectivement). L’absence d’une connaissance antérieure de l’outil favorisait le fait de ne pas être enclin à l’utiliser dans leur pratique (p = 0,002).
17 Oui et plutôt
oui
Non et plutôt
non p
Le temps d’application de cet outil est trop long
En accord 38 61 0,99
En désaccord 1 0
Un format numérique me conviendrait mieux
En accord 36 36 0,007
En désaccord 3 25
Tableau 8 : Réponses concernant l’utilisation de l’outil dans la pratique des médecins en fonction de leur évaluation de l’outil.
Les médecins sondés étaient moins enclins à utiliser l’outil dans leur pratique, lui préférant un format numérique (p= 0,007).
UTILISATION DE L'OUTIL DANS LEUR PRATIQUE
18
Discussion
Principaux résultats
Ce travail a mis en évidence que la majorité des médecins généralistes interrogés n’étaient pas enclins à utiliser l’outil STOPP-START v.2 dans leur pratique. Ce résultat peut être expliqué par le fait qu’ils ne trouvaient pas l’outil adapté à leur pratique dans son format papier puisqu’un format numérique leur semblait plus adapté. Les médecins pensaient moins souvent utiliser l’outil dans leur pratique future en l’absence de connaissance antérieure de l’outil, à un âge supérieur à 40 ans et lorsqu’ils exerçaient en dehors des grandes villes. Ce constat résultait aussi du fait que les médecins n’ont pas jugé son utilisation facile. Les médecins les plus âgés et ceux qui ne connaissaient pas l’outil auparavant trouvaient son utilisation plus difficile. Seulement 36% des praticiens interrogés connaissaient l’outil et seule la moitié de ces derniers l’avait déjà utilisé.
Cependant, les praticiens avaient majoritairement confiance dans l’outil grâce aux explications détaillées de ses critères et à sa partie START. Leur confiance était aussi en rapport avec l’intérêt qu’ils lui trouvaient dans la réévaluation des traitements de leurs patients et avec son temps d’application, qu’ils pensaient pouvoir réduire au fur et à mesure de son utilisation. En effet, en testant l’outil sur deux ordonnances, le temps d’application était moindre lors de la deuxième utilisation.
Forces de l’étude
Le caractère multicentrique de l’étude a permis d’avoir un recueil de l’évaluation plus global de l’outil.
L’originalité de cette étude résidait dans l’évaluation de l’outil par les médecins généralistes après l’appropriation de l’outil par un test fictif sur deux ordonnances. La majorité des études réalisées se sont concentrées sur la démonstration de l’efficacité de l’outil au travers de son application et du recueil du nombre de PMI retrouvées. Bien qu’il ait fait l’objet de nombreuses études [13], il a principalement été étudié en milieu hospitalier. Son évaluation en médecine générale est apparue opportune car ces médecins sont les premiers prescripteurs des personnes âgées.
19
Limites de l’étude
Mode de recrutement des médecins
La première limite est un taux de réponses bas. En effet, seulement 23% des médecins contactés ont participé à l’étude. Il y a donc sans doute un biais de sélection par la participation des médecins les plus motivés ou qui disposaient de plus de temps. De plus, le recrutement via l’annuaire a pu écarter les médecins nouvellement installés ou qui ont procédé à des changements d’adresse ou de coordonnées téléphoniques.
Représentativité des médecins
L’âge moyen des médecins généralistes, en activité régulière en France, est de 51,6 ans avec une répartition de 53% d’hommes ayant une moyenne d’âge de 53 ans et 47% de femmes ayant une moyenne d’âge de 49 ans [18]. L’âge moyen des médecins recrutés (44,2 ans) était statistiquement inférieur à la moyenne nationale (p = 0,038).
La répartition homme/femme des médecins interrogés (47%) était statistiquement comparable à la répartition nationale (p = 0,843).
Comparaison avec la littérature
Bien qu’apparaissant comme l’outil le plus complet dans la détection des PMI [15], cette étude a montré que les médecins généralistes interrogés n’étaient pas enclins à utiliser l’outil STOPP-START dans son format actuel. Pourtant, depuis sa validation en 2008, de nombreux articles originaux ont évalué l’utilisation de ses critères dans différentes situations médicales et dans plus de 24 pays [19]. Ces critères ont démontré, pour différentes populations (patients à domicile, en milieu hospitalier, en institutions pour personnes âgées), qu’ils permettaient de diminuer le risque de survenue d’effets indésirables [20] et d’hospitalisations non-programmées [21]. L’utilisation systématique de l’outil améliore significativement la qualité des prescriptions [22]. Utilisés en milieu hospitalier dans les 72 heures qui suivent une admission, les critères STOPP/START permettent de réduire le risque d’effets indésirables et la durée d’hospitalisation[23,24]. L’outil STOPP/START est considéré comme mieux structuré, plus sensible et d’utilisation plus facile que d’autres outils ayant le même objectif [25]. Une étude australienne a comparé les problèmes détectés par STOPP/START et d’autres outils, dont les
20 critères de Beers 2012, aux problèmes reliés à la pharmacothérapie relevés par des pharmaciens. Cette étude montre que les prescriptions inappropriées détectées par STOPP/START sont proches de celles relevées par des pharmaciens [26].
Plusieurs travaux ont montré, qu’étant donné sa densité, un certain temps d’adaptation était nécessaire pour s’approprier l’outil et pour l’intégrer à sa démarche de révision régulière des traitements [27,28,29]. C’est l’un des freins à l’utilisation de l’outil qui a été retrouvé dans la présente étude. Les travaux cités plus hauts proposaient aussi une simplification des critères pour mieux correspondre aux besoins de la pratique en soins primaires. Il y a une différence de temps d’application de l’outil entre notre étude (entre 13 et 16 min) et la littérature (entre 2 min et 8,3 min) [30]. Ces résultats sont majoritairement obtenus sur l’application de l’outil par un médecin à des dizaines d’ordonnances voire plus. Cela semble confirmer l’efficacité de l’expérience d’utilisation de l’outil sur son temps d’application.
Cependant, les performances de cette deuxième version de l’outil en matière d’utilisation au quotidien, de prévention des effets indésirables et d’amélioration de la qualité des prescriptions devront être confirmées au travers d’études cliniques spécifiques.
Ce travail a aussi montré que l’outil STOPP-START était peu connu et très peu utilisé par les médecins généralistes interrogés. Un précédent travail de thèse sur la faisabilité de l’utilisation d’une version numérique de l’outil auprès des médecins généralistes a retrouvé un taux de connaissance de l’outil de l’ordre de 20% [31]. Il serait intéressant d’améliorer la diffusion de l’outil. Pour la favoriser, une application informatique apparaît comme la solution la plus prometteuse à l’heure de la prescription électronique, comme le montrait ce travail. En effet, la version actuelle de l’outil n’apparaissait pas adaptée aux médecins généralistes qui lui préféraient un format numérique.
Ce point-là a été soulevé par les auteurs de l’outil STOPP-START. Anticipant une probable augmentation du nombre de critères pour les futures mises à jour de l’outil, ils travaillent actuellement sur son développement numérique sous la forme d’une application pour smartphones et tablettes. Elle pourrait permettre de mieux cibler les critères liés aux pathologies du patient ou ses traitements. [15]. Parallèlement aux travaux des auteurs, des recherches ont été développées par le Dr GEOFFRET qui a rendu accessible une première version informatique sur son site internet (www.stoppstart.free.fr). Elle poursuit son travail par la réalisation d’une étude, de plus grande ampleur, dont l’objectif est d’évaluer l’efficacité sur la morbi-mortalité à 1 an d’une intervention consistant à réviser systématiquement les
21 ordonnances de patients polymédiqués, âgés de 75 ans et plus, à l’aide de sa version numérique de l’outil. [31].
Des projets multicentriques européens d’optimisation thérapeutique chez le sujet âgé, SENATOR et OPERAM, devraient aboutir à la conception de logiciels d’identification de prescriptions sous-optimales en incluant notamment STOPP- START v.2 [32][33].
. .
22
Conclusion
Cette étude avait pour but d’évaluer l’intérêt pour les médecins généralistes de l’outil STOPP-START dans la détection des prescriptions médicamenteuses potentiellement inappropriées chez le sujet âgé. Les médecins généralistes ne l’ont pas jugé adapté pour les aider dans leur pratique, mais ont estimé qu’une utilisation régulière pourrait les aider à le maîtriser et auraient préféré un format numérique.
Un travail de simplification de l’outil STOPP-START pour une adaptation à la pratique quotidienne des médecins généralistes et une étude développant et évaluant une version numérique de cet outil pourraient permettre son utilisation régulière en consultation de médecine générale ambulatoire.
23
Bibliographie
[1]. C.Trivalle, Vieillissement de la population et années de vie sans incapacité, Abrégés Gérontologie préventive, Elsevier Masson, 2016, p.29-49.
[2]. J.-B. Champion, C. Collin, C. Lesdos- Cauhapé et Al., Bilan démographique 2016, INSEE première, Janvier 2017, N°1630.
[3]. Haute Autorité de Santé. Prendre en charge une personne âgée polypathologique en soins
primaires. Note méthodologique et de synthèse documentaire. Paris: HAS – Mars 2015
.
[4]. Herr M., Robine JM., Pinot J., Arvieu JJ., Ankri J. (2015). "Polypharmacy and Frailty: Prevalence, Relationship, and Impact on Mortality in a Sample of 2,350 Old People in France".Pharmacoepidemiology and Drug Safety, 24(6): 637-46.
[5]. Clerc P., Le Breton J., Mousquès J., Hebbrecht G. et de Pouvourville G. (2010). "Les enjeux du traitement médicamenteux des patients atteints de polypathologies. Résultats de l'étude expérimentale Polychrome." Irdes, Questions d'Economie de la Santé n° 156, juillet-août. [6]. Marlène Monégat, Catherine Sermet, Marc Perronnin Emeline Rococo, (2014) « La polymédication : définitions, mesures et enjeux Revue de la littérature et tests de mesure », Question d’économie de la Santé n° 204.
[7]. Beuscart J.B, Dupont C, Defebvre M.M et Puisieux (2014). « Potentially inappropriate medications (PMIs) and anticholinergic levels in the elderly : A population based study in a French region » Arch Gerontol Geriatr.
[8]. Hovstadius B. et PetersonG. (2013). « The impact of increasing polypharmacy on prescribed drug expenditure-a register-based study in Sweden 2005-2009 » Heath Pollicy 109 (2) : 166-74.
[9]. Gurwitz JH, Avorn J. The ambiguous relation between aging and adverse drug reactions. Ann Intern Med 1991;114(11):956-66.
[10]. Legrain S. « Consommation Médicamenteuse chez le Sujet Agé : Consommation, Prescription, Iatrogénie et Observance » PMSA-synthèse bibliographique, HAS, 2006.
24 [11]. Beers MH. Explicit criteria for determining potentially inappropriate medication use by the elderly. An update. Arch Intern Med 1997.
[12]. Simon SR, Gurwitz JH. Drug therapy in the elderly: improving quality and access. Clin Pharmacol Ther 2003;73(5):387-93.
[13]. Gurwitz JH, Rochon P. Improving the quality of medication use in elderly patients : a not-so-simple prescription. Arch Intern Med 2002; 162(15) : 1670.
[14]. O’Connor MN, Gallagher P, O’Mahonny D. Inappropriate prescribing criteria, detection and prevention. Drugs Aging 2012;29:437—52.
[15]. P.O Lang,M.dramé, B. Guigard et Al., Les critères STOPP/START. V2 : adaptation en langue française, Elvier-Masson 2015, 1627-4830.
[16]. Institute for Statistics and Mathematics. The R Project for Statistical Computing. [consulté le 16 juin 2017]. Disponibile : http://www.r-project.org.
[17]. Institut Pierre Louis d'épidémiologie et de santé public – INSERM – UPMC. BiostaTGV. [consulté le 16 juin 2017]. Disponible : http://marne.u707.jussieu.fr/biostatgv/#main.
[18]. Bouet, Mourgues, Atlas de la démographie médicale en France, conseil nationale de l’ordre des médecins, 2017.
[19]. O’Mahony D, Callagher P, ryan C et al. STOPP/START criteria for potentially inappropriateprescribing in older people : version 2. Age Ageing 2015;44:213-8.
[20]. Hamilton H, Gallagher P, Ryan C, Byrne S, O’Mahony D. Potentially inappropriate medications defined by STOPP criteria and the risk of adverse drug events in older hospitalized patients. Arch Intern Med 2011;171:1013–9.
[21]. Dalleur O, Spinewine A, Henrard S, Losseau C, Speybroeck N, Boland B. Inappropriate prescribing and related hospital admissions in frail older persons according to the STOPP and START criteria. Drugs Aging 2012;29:829–37.
[22]. Gallagher PF, O’Connor MN, O’Mahony D. Prevention of potentially inappropriate prescribing for elderly patients: a randomized controlled trial using STOPP/START criteria. Clin Pharmacol Ther 2011;89:845–54.
25 [23]. O’Mahony D, Gallagher P, Ryan C, Byrne S, Hamilton H, Barry P et coll. STOPP & START criteria: a new approach to detecting potentially inappropriate prescribing in old age. Eur Geriatr Medicine 2010;1:45–51.
[24]. Dalleur O, Boland B, Losseau V, Henrard S, Wouters D, Speybroeck N et coll. Reduction of potentially inappropriate medications using the STOPP criteria in frail older inpatients: a randomised controlled study. Drugs Aging 2014;31:291–8.
[25]. Lam MP, Cheung BM. The use of STOPP/START criteria as a screening tool for assessing the appropriateness of medications in the elderly population. Expert Rev Clin Pharmacol 2012;5:187–97.
[26]. Curtain CM, Bindoff IK, Westbury JL, Peterson GM. A comparison of prescribing criteria when applied to older community-based patients. Drugs Aging 2013;30:935–43.
[27]. Castillo-Paramo A, Pardo-Lopo R, Gomez- Serranillos I, et al., Criteria STOPP/START
to identify inappropriate prescribing of drugs in elderly patients in primary care: « primum
non nocere »exercer 2013;106(suppl 2):54S-5S.
[28]. Dalleur O., Spinewine A., Degryse J.M, Boland B, STOPP&START : Dépister nos prescriptions inappropriées chez les patients âgés, 2013, la revue de Médecine Générale, N°305. [29]. Gaëtan Couffinhal, Prévalence des ordonnances inappropriées en médecine générale chez la personne âgée à l’aide de l’outil STOPP-START et évaluation de l’outil, thèse soutenue en 2017.
[30]. Cam-Anh K, Haghighi S., Le STOPP START est-il adapté à la pratique quotidienne du médecin généraliste ? Exercer 2015 ; 121(suppl2) : S44-S45.
[31]. Frey-Geoffret Anne, Critères STOPP/START version 2 : étude de faisabilité de l’utilisation d’une version informatisée en médecine générale, thèse soutenue en avril 2016. [32]. Lavan AH, Gallagher PF, O’Mahony D., Methods to reduce prescribing errors in elderly patients with multimorbidity. Clin Interv Aging [Internet]. 23 juin 2016 ; 11:857-66. Disponible sur: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4922820/.
26 gériatriques [Internet]. [cité le 15 sept 2016] Disponible sur: http://cordis.europa.eu/result/rcn/159659_fr.html.
27
ANNEXE 1
STOPP/START.v2
Screening Tool of Older Person's Prescriptions, version 2 (STOPP.v2)
Chez une personne âgée de 65 ans ou plus, la prise de ces médicaments est
potentiellement inappropriée dans les circonstances décrites ci-dessous.
Section A : Indication de prescription
A1. Tout médicament prescrit sans indication clinique (aspirine et statine en prévention cardiovasculaire primaire ; inhibiteur de la pompe à protons sans atteinte œsogastrique récente…) – [sur-prescription]
A2. Tout médicament prescrit au-delà de la durée recommandée, si elle est définie – [sur-prescription]
A3. Toute duplication de prescription d’une classe médicamenteuse (deux benzodiazépines, anti-inflammatoires non stéroïdiens, inhibiteurs spécifiques de la recapture de la sérotonine, diurétiques de l’anse, inhibiteurs de l’enzyme de conversion, β-bloquants, anticoagulants, …) – [monothérapie à optimaliser avant de considérer la duplication]
Section B : Système cardiovasculaire
B1. La digoxine pour une décompensation d’insuffisance cardiaque avec fraction d’éjection ventriculaire gauche (FEVG) conservée – [pas de preuve de bénéfice]
B2. Le vérapamil ou le diltiazem en présence d’une décompensation cardiaque de classe III ou IV – [risque d’aggravation de l’insuffisance cardiaque]
B3. Un β-bloquant en combinaison avec le vérapamil ou le diltiazem – [risque de bloc de conduction cardiaque]
28
B4. Un β-bloquant en présence d’une bradycardie (< 50 bpm), d’un bloc atrio-ventriculaire du second degré ou troisième degré – [risque de bloc complet ou d’asystolie]
B5. L’amiodarone en première intention pour une tachycardie supra-ventriculaire – [risque d’effets secondaires plus important que celui par β-bloquant, digoxine, vérapamil ou diltiazem]
B6. Un diurétique de l’anse en première intention pour une hypertension artérielle – [des alternatives plus sûres et plus efficaces sont disponibles]
B7. Un diurétique de l’anse pour œdèmes des membres inférieurs d’origine périphérique (c.à.d. en l’absence d’argument pour une insuffisance cardiaque, insuffisance hépatique, insuffisance rénale ou syndrome néphrotique) – [la surélévation des jambes et le port de bas de contention sont plus appropriés]
B8. Un diurétique thiazidique ou apparenté (indapamide) en présence d’une hypokaliémie (K+ < 3,0 mmol/L), hyponatrémie (Na+ < 130 mmol/L), hypercalcémie (calcémie
corrigée > 2,65 mmol/L ou > 10,6 mg/dL), ou d’une histoire d’arthrite microcristalline (goutte ou chondrocalcinose) – [risque accru de précipiter ces troubles métaboliques]
B9. Un diurétique de l’anse pour hypertension artérielle en présence d’une incontinence urinaire – [exacerbation probable de l’incontinence]
B10. Un antihypertenseur à action centrale (méthyldopa, clonidine, moxonidine, rilménidine, guanfacine) en l’absence d’une intolérance ou d’une inefficacité des autres classes
d’antihypertenseurs – [les antihypertenseurs à action centrale sont moins bien tolérés] B11. Un inhibiteur de l’enzyme de conversion (IEC) ou un antagoniste des récepteurs de l’angiotensine II (ARA II) en présence d’un antécédent d’hyperkaliémie – [risque de récidive] B12. Un antagoniste de l’aldostérone (spironolactone, éplérénone) en l’absence d’une
surveillance de la kaliémie (au moins semestrielle), lorsque cet antagoniste est associé à un médicament d’épargne potassique (IEC, ARA II, amiloride, triamtérène) – [risque
d’hyperkaliémie sévère (> 6,0 mmol/L)]
B13. Un inhibiteur de la 5-phosphodiestérase (sildénafil, tadalafil, vardénafil) en présence d’une décompensation cardiaque sévère avec hypotension (pression systolique < 90 mmHg) ou d’un angor traité par nitrés – [risque de choc cardiovasculaire]
Section C : Antiagrégants et anticoagulants
C1. De l’aspirine au long cours à dose > 160 mg/j – [risque accru de saignement, sans preuve d’efficacité majorée]
29
C2. De l’aspirine en présence d’un antécédent d’ulcère gastroduodénal sans prescription d’un inhibiteur de la pompe à protons (IPP) – [risque de récidive d’ulcère]
C3. Un antiagrégant plaquettaire (aspirine, clopidogrel, dipyridamole) ou un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) en présence d’un risque hémorragique significatif (hypertension artérielle sévère non contrôlée, diathèse hémorragique, ou récent épisode de saignement spontané important) – [risque élevé d’hémorragie]
C4. De l’aspirine associée au clopidogrel en prévention secondaire des accidents vasculaires cérébraux (sauf si syndrome coronarien aigu concomitant, stent coronarien depuis moins de 12 mois, ou sténose carotidienne serrée symptomatique) – [pas de preuve de bénéfice, hors de ces trois exceptions, par rapport à une monothérapie par clopidogrel]
C5. De l’aspirine associée à un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) pour une fibrillation atriale – [pas de bénéfice additionnel de l’aspirine, qui majore le risque de saignement]
C6. Un antiagrégant plaquettaire (aspirine, clopidogrel, dipyridamole) en association à un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) pour une artériopathie stable (coronarienne, cérébro-vasculaire ou périphérique) – [pas de bénéfice additionnel de l’ajout de l’antiagrégant, qui majore le risque de saignement]
C7. La ticlopidine dans tous les cas – [le clopidogrel et le prasugrel ont des effets secondaires moindres et une efficacité similaire]
C8. Un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) durant plus de 6 mois pour un premier épisode de thrombose veineuse profonde (TVP) sans facteur de risque de thrombophilie identifié – [pas de bénéfice additionnel après 6 mois] C9. Un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) durant plus de 12 mois pour un premier épisode d’embolie pulmonaire (EP) sans facteur de risque de thrombophilie identifié – [pas de bénéfice additionnel après 12 mois]
C10. Un anti-inflammatoire non stéroïdien (AINS) associé à un anticoagulant oral (anti-vitamine K, inhibiteur direct de la thrombine ou du facteur Xa) – [risque accru d’hémorragie gastro-intestinale]
C11. Un anti-inflammatoire non stéroïdien (AINS) en présence d’un antiagrégant
plaquettaire, sans traitement préventif par un inhibiteur de la pompe à protons (IPP) – [risque accru d’ulcère gastroduodénal]
30
Section D : Système nerveux central et psychotropes
D1. Un antidépresseur tricyclique en présence d’une démence, d’un glaucome à angle aigu, d’un trouble de conduction cardiaque, d’un prostatisme/antécédent de globe vésical – [risque d’aggravation par effet anticholinergique]
D2. Un antidépresseur tricyclique en traitement de première intention pour une dépression – [risque accru d’effets secondaires par rapport aux inhibiteurs sélectifs de recapture sélectifs (ISRS)]
D3. Un neuroleptique à effet anticholinergique modéré à marqué (chlorpromazine, clozapine, flupenthixol, fluphenzine, pipothiazine, promazine, zuclopenthixol) en présence d’un
prostatisme ou d’un antécédent de globe vésical – [risque de globe vésical] D4. Un inhibiteur sélectif de recapture de la sérotonine (ISRS) en présence d’une
hyponatrémie (Na+ < 130 mmol/L) concomitante ou récente – [risque d’exacerbation ou de récidive de l’hyponatrémie]
D5. Une benzodiazépine depuis plus de 4 semaines – [un traitement prolongé par
benzodiazépine n’est pas indiqué (critère A1) ; risques de sédation, de confusion, de troubles de l’équilibre, de chute et/ou d’accident de la route. Après 2 semaines, toute prise de
benzodiazépine devrait être diminuée progressivement puisqu’il existe une tolérance de l’effet thérapeutique et un risque de syndrome de sevrage]
D6. Un neuroleptique (autre que la quétiapine ou la clozapine) en présence d’un syndrome parkinsonien ou d’une démence à corps de Lewy – [risque d’aggravation sévère des symptômes extrapyramidaux]
D7. Un médicament à effet anticholinergique en traitement des effets extrapyramidaux induits par un neuroleptique – [risque d’effets anticholinergiques]
D8. Un médicament à effet anticholinergique en présence d’une démence ou/et d’un syndrome confusionnel – [risque d’exacerbation des troubles cognitifs]
D9. Un neuroleptique chez un patient présentant des symptômes psycho-comportementaux associés à une démence, à moins que ces symptômes soient sévères et que l’approche non pharmacologique ait échoué – [risque accru de thrombose cérébrale et de décès]
D10. Un neuroleptique pour insomnies (à moins qu’elles ne soient dues à une psychose ou une démence) – [risques de confusion, d’hypotension, d’effets secondaires extrapyramidaux, de chute]
31
D11. Un inhibiteur de l’acétylcholinestérase en présence d’un antécédent de bradycardie persistante (< 60 bpm), de bloc de conduction cardiaque, de syncopes récidivantes
inexpliquées, de médicament bradycardisant (β-bloquant, digoxine, diltiazem, vérapamil) ou d’asthme – [risque de troubles sévères de la conduction cardiaque, de syncope, d’accident, de bronchospasme]
D12. Une phénothiazine comme neuroleptique de première ligne (à l’exception de la
prochlorpérazine pour nausées, vomissements et vertiges ; de la chlorpromazine pour hoquet persistant ; de la lévomépromazine comme antiémétique en soins palliatifs) – [effets sédatifs et anticholinergiques sévères ; des alternatives plus sûres existent]
D13. La L-dopa ou un agoniste dopaminergique pour des tremblements essentiels bénins ou pour un syndrome parkinsonien – [pas de preuve d’efficacité]
D14. Un antihistaminique de première génération dans tous les cas – [d’autres antihistaminiques plus sûrs sont disponibles]
Section E : Fonction rénale et prescriptions.
Les six prescriptions suivantes sont potentiellement inappropriées chez une personne âgée présentant une altération aiguë ou chronique de sa fonction rénale et notamment lorsque est atteint un certain seuil de débit de filtration glomérulaire (DFG) tel qu’estimé par la
clairance de la créatinine (selon la formule de Cockcroft-Gault et exprimée en mL/min). Se référer aux notices des médicaments et aux recommandations locales.
E1. La digoxine au long cours à une dose > 125 µg/j lorsque le DFG est < 30 mL/min – [risque d’intoxication]
E2. Un inhibiteur direct de la thrombine (dabigatran) lorsque le DFG est < 30 mL/min – [risque accru de saignement]
E3. Un inhibiteur direct du facteur Xa (rivaroxaban, apixaban) lorsque le DFG est < 15 mL/min – [risque accru de saignement]
E4. Un anti-inflammatoire non stéroïdien (AINS) lorsque le DFG est < 50 mL/min – [risque d’aggravation de la fonction rénale]
E5. La colchicine lorsque le DFG est < 10 mL/min – [risque d’intoxication] E6. La metformine lorsque le DFG est < 30 mL/min – [risque d’acidose lactique]
32
Section F : Système digestif
F1. La prochlorpérazine ou le métoclopramide en présence de symptômes extrapyramidaux – [risque d’aggravation]
F2. Un inhibiteur de la pompe à protons (IPP) à dose maximale pendant plus de 8 semaines pour œsophagite peptique ou ulcère gastroduodénal non compliqués – [indication d’une réduction de la dose de l’IPP, voire de son arrêt avant 8 semaines]
F3. Un médicament à effet constipant (anticholinergiques, fer par voie orale, opiacés, vérapamil, antiacide à base de sel d’aluminium) en présence d’une constipation chronique lorsque des alternatives existent – [risque de majoration de la constipation]
F4. Du fer élémentaire à dose > 200 mg/j par voie orale (fumarate de fer > 600 mg/j, sulfate de fer > 600 mg/j, gluconate de fer > 1800 mg/j) – [absorption du fer inchangée au-delà de cette dose, et risque de troubles digestifs]
Section G : Système respiratoire
G1. La théophylline en monothérapie d’une BPCO – [alternatives plus sûres et plus efficaces ; risque d’effets secondaires liés à l’indice thérapeutique étroit]
G2. Des corticostéroïdes par voie systémique plutôt qu’inhalée pour le traitement de fond d’une BPCO modérée à sévère – [exposition inutile à des effets secondaires alors que le traitement inhalé est efficace]
G3. Un bronchodilatateur anticholinergique (ipratropium, tiotropium) en présence d’un glaucome à angle aigu – [risque d’exacerbation du glaucome], ou d’un obstacle à la vidange de la vessie – [risque de rétention urinaire]
G4. Un β-bloquant non cardiosélectif (sotalol, carvédilol, pindolol, propranolol, …), par voie orale ou voie locale (glaucome), en présence d’un antécédent d’asthme nécessitant un
traitement bronchodilatateur – [risque de bronchospasme]
G5. Une benzodiazépine en présence d’une insuffisance respiratoire aiguë ou chronique (pO2 < 60 mmHg ou SaO2 < 89 % ou < 8,0 kPa ou/et pCO2 > 6,5 kPa
33
Section H : Système musculo-squelettique
H1. Un anti-inflammatoire non stéroïdien (AINS) en présence d’un antécédent d’ulcère gastroduodénal ou de saignement digestif, sans traitement gastro-protecteur par IPP ou anti-H2 – [risque de récidive de l’ulcère peptique]
H2. Un AINS en présence d’une hypertension artérielle sévère – [risque de majoration de l’hypertension] ou d’une insuffisance cardiaque sévère – [risque de décompensation cardiaque]
H3. Un AINS au long cours (> 3 mois) en première ligne pour une douleur arthrosique – [un analgésique comme le paracétamol est préférable et habituellement efficace pour contrôler les douleurs arthrosiques modérées]
H4. Une corticothérapie au long cours (> 3 mois) pour une polyarthrite rhumatoïde en monothérapie – [risque d’effets secondaires de la corticothérapie]
H5. Une corticothérapie pour douleur d’arthrose, par voie orale ou locale (injections intra-articulaires admises) – [risque d’effets secondaires systémiques de la corticothérapie] H6. Un AINS ou la colchicine au long cours (> 3 mois) pour le traitement de fond d’une goutte, en l’absence d’un inhibiteur de la xanthine-oxydase (allopurinol ou fébuxostat) sauf si ce dernier est contre-indiqué – [un inhibiteur de la xanthine-oxydase est le premier choix pour la prévention des crises de goutte]
H7. Un AINS ou un inhibiteur sélectif de la COX-2, en présence d’une maladie
cardiovasculaire non contrôlée (angine de poitrine, HTA sévère) – [risque accru d’infarctus du myocarde ou de thrombose cérébrale]
H8. Un AINS en présence d’une corticothérapie sans traitement préventif par inhibiteur de la pompe à protons – [risque accru d’ulcère gastroduodénal]
H9. Un biphosphonate par voie orale en présence d’une atteinte actuelle ou récente du tractus digestif supérieur (dysphagie, œsophagite, gastrite, duodénite, ulcère peptique, ou saignement digestif haut) – [risque de récidive ou de majoration de l’atteinte digestive haute]
Section I : Système urinaire
I1. Un médicament à effets anticholinergiques en présence d’une démence, d’un déclin cognitif chronique – [risque d’une majoration de la confusion, d’agitation], d’un glaucome à angle fermé – [risque d’exacerbation du glaucome] ou d’un prostatisme persistant – [risque de
34
globe vésical]
I2. Un α1-bloquant (tamsulosine, térazocine) en présence d’une hypotension orthostatique
symptomatique ou de syncope post-mictionnelle – [risque de syncopes récurrentes] Section J : Système endocrinien
J1. Une sulphonylurée à longue durée d’action (glibenclamide, chlorpropamide, glimépiride, gliclazide à libération prolongée) pour un diabète de type 2 – [risque d’hypoglycémies prolongées]
J2. Une thiazolidinédione (rosiglitazone, pioglitazone) en présence d’une décompensation cardiaque – [risque de majoration de la décompensation cardiaque]
J3. Un β-bloquant en présence d’un diabète avec fréquents épisodes
hypoglycémiques – [risque de masquer les symptômes d’hypoglycémie. Envisager une diminution du traitement hypoglycémiant pour ramener l’HbA1c entre 7,5 et 8,5 % (59 et 69 mmol/mL) chez les patients âgés fragiles]
J4. Des œstrogènes en présence d’un antécédent de cancer du sein ou d’épisode thromboembolique veineux – [risque accru de récidive]
J5. Des œstrogènes par voie orale ou transdermique sans progestatifs associés chez une patiente non hystérectomisée – [risque de cancer endométrial]
J6. Des androgènes en l’absence d’un hypogonadisme confirmé – [risque de toxicité aux androgènes ; absence de bénéfice prouvé en dehors de l’hypogonadisme]
Section K : Médicaments majorant le risque de chute
K1. Une benzodiazépine dans tous les cas – [effet sédatif, trouble de proprioception et d’équilibre]
K2. Un neuroleptique dans tous les cas – [effet sédatif, dyspraxie de la marche, symptômes extrapyramidaux]
K3. Un vasodilatateur (α1-bloquant, inhibiteur calcique, dérivé nitré de longue durée d’action,
inhibiteur de l’enzyme de conversion, antagoniste des récepteurs de l’angiotensine II) en présence d’une hypotension orthostatique persistante (diminution récurrente de la pression artérielle systolique ≥ 20 mmHg ou diastolique ≥ 10 mmHg lors de la
35
K4. Un hypnotique Z (zopiclone, zolpidem, zaleplon) – [risque de sédation, d’ataxie] Section L : Antalgiques
L1. Un opiacé fort en première ligne d’une douleur légère (par voie orale ou transdermique ; morphine, oxycodone, fentanyl, buprénorphine, diamorphine, méthadone, tramadol,
pethidine, pentazocine) – [non-respect de l’échelle OMS de la douleur]
L2. Un opiacé en traitement de fond (c.à.d. non à la demande) sans la prescription concomitante d’un traitement laxatif – [risque de constipation sévère]
L3. Un opiacé de longue durée d’action en cas de pics douloureux, en l’absence d’un opiacé à action immédiate – [risque de persistance des pics douloureux]
Section N : Charge anticholinergique
N1. Une utilisation concomitante de plusieurs (≥ 2) médicaments à effets anticholinergiques (antispasmodique vésical ou intestinal, antidépresseur tricycliques, antihistaminique de première génération, …) – [risque de toxicité anticholinergique]
Liste non exhaustive de médicaments à activité anticholinergique élevée : - amitriptyline, clomipramine, doxépine, imipramine ;
- hydroxyzine, méclizine, prométhazine ; - clozapine, lévomépromazine ;
- bipéridène, procyclidine, trihexyphénidyle ;
- fésotérodine, flavoxate, oxybutynine, proprivérine ; - solifénacine, toltérodine ;
- ipratropium ;
- butylhyoscine, tizanidine, scopolamine
Principaux effets anticholinergiques centraux : sédation, altération cognitive, delirium (confusion aiguë), désorientation, hallucinations visuelles, agitation, irritabilité, agressivité Principaux effets anticholinergiques périphériques : trouble de l’accommodation visuelle, mydriase, sécheresse buccale, sécheresse oculaire, tachycardie, nausées, constipation, dysurie, rétention vésicale