ETUDES « OMIQUES » DU PHÉNOMÈNE INFLAMMATOIRE ASSOCIÉ À L’OBÉSITÉ Thèse Bénédicte Allam-Ndoul Doctorat en nutrition Philosophiae doctor (Ph. D.) Québec, Canada
©
Bénédicte Allam-Ndoul, 2017ETUDES « OMIQUES » DU PHÉNOMÈNE INFLAMMATOIRE ASSOCIÉ À L’OBÉSITÉ
Thèse
Bénédicte Allam-Ndoul
RÉSUMÉ
Le syndrome métabolique (SMet) est un ensemble de perturbations métaboliques pouvant entrainer le développement de maladies inflammatoires telles que les maladies cardiovasculaires (MCV) ou le diabète de type 2 (DT2). L’un des critères de définition du SMet est la présence d’une obésité abdominale. Etant donné que l’obésité abdominale est très fréquemment associée au SMet, il est important d’approfondir les connaissances sur les mécanismes reliant ces deux conditions. L’obésité et le SMet sont accompagnés d’une inflammation chronique. L’alimentation est un moyen efficace de moduler l’état inflammatoire d’un individu. L’objectif général de ce projet de doctorat est d’étudier le phénomène inflammatoire lié à l’obésité grâce à l’utilisation de diverses méthodes « OMIQUES ».
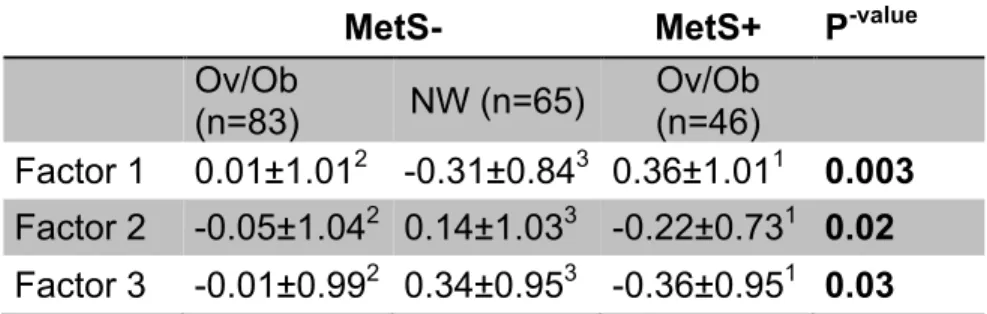
Dans le cadre de cette thèse, un échantillon d’individus comprenant 65 personnes non-obèse et sans SMet, 83 personnes obèses sans SMet ainsi que de 46 personnes obèses avec le SMet a été sélectionné. Une analyse des métabolites plasmatiques a été réalisée. Les personnes obèses, indépendamment de la présence du SMet avaient un profil en métabolites différent des individus non-obèses. La présence du SMet semblait cependant empirer le profil métabolomique des patients obèses.
Par la suite, nous avons entrepris de tester les effets des acides gras n-3 sur l’inflammation. L’action anti-inflammatoire des acides gras n-3 d’origine marine, l’acide éiocsapentaénoique (AEP) et l’acide docosahexaénoique (ADH), est reconnue. La consommation de ces derniers est associée à des effets bénéfiques sur les maladies inflammatoires chroniques. Cependant, les mécanismes moléculaires sous-jacents aux effets anti-inflammatoires de ces acides gras n-3 sont encore peu connus. Nous avons donc testé l’effet de différentes doses d’EPA et de DHA, sur l’expression de gènes inflammatoires, dans des macrophages de type THP-1. Globalement les résultats suggèrent que l’EPA et le DHA modulent l’expression des gènes de l’inflammation de manière spécifique et dose dépendante.
ABSTRACT
The metabolic syndrome (MetS) is a cluster of metabolic disorders, which are associated with an increased risk of type 2 diabetes and cardiovascular diseases. One of the MetS criterions is the presence of abdominal obesity. Since abdominal obesity is associated with MetS, it is important to understand the mechanisms that link these two conditions. A chronic inflammatory state is common among people suffering from obesity and MetS. Modulating the diet is an effective way of reducing this chronic inflammation. The overall global purpose of this PhD project was to study the inflammatory process using OMICs.
The sample of participants was composed of 65 subjects of normal weight (NW) without MetS, 83 overweight/obese (Ov/Ob) subjects without MetS and 46 subjects of Ov/Ob with MetS. An analysis of plasma metabolites was done for each participant. Ov/Ob participants, independently of their MetS status had a different metabolite profile from NW participants. The MetS seems to worsen metabolite profiles.
Then, we tested the effects of n-3 fatty acids (FAs) on inflammation. The anti-inflammatory action of n-3 FAs eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) are well known. However, their mechanism of action is not fully understood. We tested the effect of different doses of EPA and DHA on the expression of genes involved in inflammation in THP-1 macrophages. The results suggest that EPA and DHA regulate the expression of genes involved in inflammation in a dose and FAs n-3 dependant manner.
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VI LISTE DES TABLEAUX ... IX LISTE DES FIGURES ... X LISTE DES ABRÉVIATIONS ... XI REMERCIEMENTS ... XVI AVANT-PROPOS ... XIX
INTRODUCTION GÉNÉRALE ... 1
CHAPITRE 1 : Revue de la littérature ... 5
1. L’Obésité ... 5
1.1 Définition ... 5
1.2 Épidémiologie ... 6
2. Le syndrome métabolique ... 6
2.1 Historique et définition ... 6
2.2 Risques associés au syndrome métabolique ... 7
2.2.1 Risques cardiovasculaires ... 7
2.2.2 Résistance à l’insuline et diabète de type 2 ... 8
2.2.3 Stéatose hépatique non alcoolique ... 8
2.3 Pathophysiologie du syndrome métabolique et de l’obésité ... 9
2.4 L’inflammation ... 10
2.4.1 Définition ... 10
2.4.1.1 Réaction vasculo-excudative ... 10
2.4.1.2 Phase cellulaire ... 11
2.4.1.2.1 Composante cellulaire ... 11
2.4.1.2.2 Les médiateurs solubles de l’inflammation ... 13
2.4.1.3 Résolution de l’inflammation ... 14 2.4.3 Le rôle de l’inflammation dans la survenue des maladies inflammatoires ... 15
2.4.3.1 Maladies cardiovasculaires ... 15
2.4.3.2 Résistance à l’insuline et diabète de type 2 ... 16
3. Approche nutritionnelle dans le cadre de l’inflammation ... 17
3.1 Les acide gras oméga-3 ... 17
3.1.1 Acide gras omega-3 et oméga-6 ... 17
3.1.2 Les différentes sources d’omega-3 ... 19
3.1.3 Les recommandations en n-3 ... 20
4. Les oméga-3 et l’inflammation ... 21
4.1 Les médiateurs de l’inflammation issus des n-3 ... 21
4.2 Rôle des oméga-3 dans le développement des maladies inflammatoires chroniques ... 22
4.2.2 Résistance à l’insuline et diabète de type 2 ... 23
4.3 Rôle différentiel d’EPA et DHA au niveau cellulaire ... 25
5. OMIQUES... 27
5.1 Définition ... 27
5.2 Implications dans la recherche sur les maladies métaboliques ... 27
5.2.1 La métabolomique ... 27
5.2.2 La transcriptomique ... 28
5.2.2.1 PCR en temps réél ... 29
5.2.2.2 Micropuces d’expression………. 30
5.3 Application des technologies OMIQUEs dans la recherche……… ……. 30
CHAPITRE 2 : Problématique ... 33
1. Objectifs et hypothèse ... 34,35 CHAPITRE 3 : Association entre les profiles métaboliques, le syndrome métabolique et l’obésité... 36 Abstract ... 38 Résumé ... 40 Introduction ... 42 Methods ... 44 Results ... 47 Discussion ... 49 Conclusion ... 52
CHAPITRE 4 : Association entre les niveaux d’acides aminés à chaines ramifiées, l’obésité et les complications cardiométaboliques. ... 67
Abstract ... 69 Résumé ... 70 Introduction ... 71 Methods ... 72 Results ... 74 Discussion ... 76 Conclusion ... 79
CHAPITRE 5 : Les effets des acides gras n-3 sur l’expression des gènes inflammatoires dans des macrophages de type THP-1 ... 85
Abstract ... 87
Résumé ... 89
Introduction ... 90
Results ... 94
Discussion ... 95
Conclusion ... 99
CHAPITRE 6 : Les effets de différentes concentrations d’acides gras n-3 sur des macrophages stimulés de type THP-1. ... 107
Abstract ... 109 Résumé ... 110 Introduction ... 111 Methods ... 112 Results ... 115 Discussion ... 117 Conclusion ... 121
CHAPITRE 7 : Étude sur l’effet différentiel de EPA et DHA sur les profils d’expression génique de macrophage stimulés de type THP-1 ... 130
Abstract ... 132 Résumé ... 133 Introduction ... 134 Methods ... 135 Results ... 137 Discussion ... 154 Conclusion ... 157 CHAPITRE 8 : Conclusion ... 159 BIBLIOGRAPHIE :………...168
LISTE DES TABLEAUX
Chapitre 1:
Tableau 1. Catégories de poids selon l’IMC
………5
Tableau 2. Définition du syndrome métabolique selon le NCEP-ATP III……….7
Chapitre 3: Tableau 1. Baseline characteristics ... 55
Tableau 2. Metabolite factor scores (obesity classification of subjects according to BMI criteria)……….56
Tableau 3. Correlations between cardiometabolic risk factor and factor 1 ... 57
Tableau 4. Correlations between cardiometabolic risk factor and factor 2 ... 58
Tableau 5. Correlations between cardiometabolic risk factor and factor 3 ... 59
Tableau 6. Supplementary data 1 ... …… 60
Tableau 7. Supplementary data 2 ... 61
Tableau 8. Supplementary data 3 ... 62
Chapitre 4: Tableau 1. Baseline characteristics of study participants ... 81
Tableau 2. BCAA levels according to metabolic syndrome and obesity status ... 82
Tableau 3. Partial correlations between cardiometabolic variables and BCAAs ... 83
Chapitre 5: Tableau 1. Genes and primers sets for real time PCR ... 101
Chapitre 6: Tableau 1. Probe sets for real-time PCR ... 123
Chapitre 7: Tableau 1. Differentially expressed genes in lipopolysaccharide (LPS)-stimulated macrophages (LPS+) incubated with eicosapentaenoic or docosahexaenoic acid (EPA/DHA). ... 138
LISTE DES FIGURES
Chapitre 1:
Figure 1. Voie de biosynthèse des éicosanoides ... 14
Figure 2. Progression de la dysfonction endothéliale ... 16
Figure 3. Synthèse des acides gras polyinsaturés ... 18
Figure 4. Structure d’un triglycéride ... 20
Figure 5. Médiateurs de la résolution de l’inflammation issus des acides gras n-3 ... 22
Chapitre 3: Figure 1. Metabolites patterns of the INFOGENE study ... 64
Chapitre 5: Figure 1. Effects of n-3 FAs on cytokine gene expression ... 102
Figure 2. Effect of n-3 FAs on the expression of genes involved in FA metabolism. ... 103
Figure 3. Effect of n-3 FAs on the expression of genes involved in NF-KB pathway ... 104
Figure 4. Effect of n-3 FAs on the expression of genes involved in oxidative stress ... 105
Chapitre 6: Figure 1. Influence of n-3 FAs on genes expression ... 124-126 Figure 2. Influence of n-3 FAs on cytokines secretion ... 127-128 Chapitre 7: Figure 1. Proportion of activated pathways in LPS-stimulated macrophages incubated with EPA or DHA ... 139
Figure 2. Effect of EPA and DHA dose reduction (75 µM versus 50 µM, 50 µM versus 10 µM and 75 µM versus 10 µM) on the proportion of modulated pathways belonging to different families ... 140-141 Figure 3. Impact of EPA and DHA on canonical pathways in LPS-stimulated macrophages ... ... 142-144 Figure 4. Impact of EPA and DHA dose reduction on canonical pathways in LPS-stimulated macrophages ... ….….147-149 Figure 5. gene expression differences in LPS-stimulated macrophages (LPS+) versus LPS+ macrophages plus 10, 50 and 75 µM EPA or DHA ... 151
Figure 6. Changes in expression of TNFA and IL6 with different concentration of n-3 FAs ... 153
LISTE DES ABREVIATIONS
AA: amino acids
AACLM : acide aminé à chaine latérale ramifiée AcA: acide arachidonique
AAL: acide alpha-linolénique ACs: acylcarnitines
AEP : acide eiosapentaénoique ADH: acide docosahexaénoique AL: acide linoléique
AGs: acides gras
AGPI: acides gras polyinsaturés AGL: acides gras libres
ARNm : acide ribonucléique messager BCAAs: branched chained amino acids
CMSP: Cellules mononuclées sanguine périphérique COX: cyclooxygenase
CVD: cardiovascular diseases DBP: diastolic blood pressure DHA: docosahexaenoic acid DMSO: dimethyl sulfoxide DT2: diabète de type 2
ECMS: Enquête Canadienne sur les mesures de la santé EPA: eiosapentaenoic acid
FA: fatty acid
FBS: fetal bovine serum GPs: glycerophospholipids
HDL-C: high-density lipoprotein (lipoprotéine de haute densité) cholesterol HOMA-IR: homeostasis model assessment of insulin resistance
HO-1: heme oxygenase IFN- ɣ: interferons gamma IL: interleukine
IMC : indice de masse corporel IR: insulin resistance
LDL-C: LDL-cholesterol LOX : lipoxygenases LPS : lipopolysaccharide LTs : leucotriènes LB : lymphocyte B LT : lymphocyte T LysoPC : lysophosphatidylcholines
MCI : maladies inflammatoires chroniques de l’intestin MCP-1 : monocyte chemoattractant protein-1
MCV : maladies cardiovasculaires MetS: metabolic syndrome
MGST1: microsomal glutathione S-transferase 1 N-3: omega-3
N-6: omega-6
HO-1: heme-oxygenase
MGL1: macrophage galactose type lectine 1 MS: membrane synoviale
MTT: 4, 5-dimethyl-2-thiazol
NCEP-ATP III: national cholesterol education program-adult treatment panel 3 NFKB: nuclear factor-kappa B
NO: nitric oxide
NOS: nitric oxide synthase NW: normal weight
Ov: overweight Ob: obese
PBMC: peripheral blood mononuclear cells PBS: phosphate-buffered
PCA: principal component analysis PCaa: phosphatidylcholines diacyl
PCae: phosphatidylcholines acyl-alkyl PCs: principal component
PCR: réaction en chaine par polymérase PGs: prostaglandines
PLA2: phospholipase 2 PL: phospholipides PN: polynucléaires
PMA: phorbol 12-myristate 13-acetate PR : polyarthrite rhumatoïde
PUFAs: polyunsaturated fatty acids RI: résistance à l’insuline
ROS: reactive oxygen species
RPMI: roswell park memorial institute medium 1640 SBP: systolic blood pressure
SGs: sphingolipids
SHNA: stéatose hépatique non alcoolique SM: shingomyelins
SMet : syndrome métabolique TA : tissu adipeux
TNFA: tumor necrosis factor alpha TG: triglyceride
Total-C: total-cholesterol TX: thromboxane
T2D : type 2 diabetes
V-cam : vascular cell adhesion protein 1 WC : waist circumference
Je dédie cette thèse à ma famille, qui est une source d’inspiration pour moi, et qui m’encourage constamment à donner le meilleur de moi-même.
REMERCIEMENTS
J’ai eu la chance d’intégrer une équipe de recherche exceptionnelle. Tout au long de mes travaux ce fut vraiment un plaisir de me rendre à l’Institut sur la nutrition et les aliments fonctionnels (INAF). Une multitude d’équipes de recherche composent cet institut, ce fut également un plaisir de les côtoyer.
Je tiens à remercier premièrement ma directrice de thèse le Dr Marie-Claude Vohl, qui bien que ne me connaissant pas, a accepté de m’intégrer à son équipe de recherche. Grace à sa disponibilité, sa rigueur et son esprit scientifique affuté, elle fut une excellente directrice de thèse. Elle m’a laissé une grande autonomie, tout en étant accessible, fait qui démontrait la confiance qu’elle avait en moi. Le Dr Vohl m’a fait assister à des congrès nationaux et internationaux qui m’ont permis d’une part de présenter et de discuter de mes résultats et d’autres part de développer mon esprit scientifique et mon sens critique. Merci Marie-Claude pour ton encadrement de qualité, mais aussi pour ton soutien, tu savais quand me dire « Tiens bon Bénédicte ne lâche pas » ! Au-delà de cela merci pour ton écoute et tes précieux conseils concernant mon avenir professionnel. Si tu en doute, laisse-moi te dire que tu es la meilleure !
Je tiens également à remercier le Dr Olivier Barbier, mon co-directeur de thèse. Ce dernier a toujours été disponible, et a été un atout indéniable, particulièrement en ce qui concerne la culture cellulaire. Ses commentaires ont toujours été les bienvenus, ces derniers m’incitant à pousser ma réflexion plus loin et à donner le meilleur de moi-même.
Mes prochains remerciements vont au Dr Frédéric Guénard. Ce dernier, qui fait partie de mon équipe de recherche, a été présent à chaque étape de mes travaux. Son aide et son soutien furent une grande bouffée d’oxygène pour moi.
Enfin un grand merci au Dr Louis Pérusse pour son support dans l’analyse des données de la cohorte INFOGENE qui sont présentées dans les articles des chapitres 3 et 4. Ses commentaires et suggestions ont rendu mes articles meilleurs.
Je remercier les DR Marie-Claude Vohl, Olivier Barbier, Iwona Rudkowska, Alain Veilleux et David Mutch d’avoir accepté d’évaluer ma thèse et ma soutenance.
Merci à ceux qui ont fait et qui font partie de l’équipe du Dr Vohl, à savoir Frédéric Guénard, Iwona Rudkowska, Catherine Ouellette, Hubert Cormier, Elisabeth Thifaut, Véronique Garneau, Bénédicte L Tremblay, Stéphanie Bégin, Bastien Vallée Marcotte, Juan de Toro Martín ainsi que les deux professionnels de recherche Alain Houde et Catherine Raymond. Ils ont rendu mon séjour à l’INAF exceptionnel. Merci à Alain Houde qui a été mon compagnon de culture cellulaire pendant ces 4 années, ce fut un plaisir de travailler avec lui, toujours dans la joie et la bonne humeur. Merci à Frédéric Guénard pour m’avoir encadré dans la réalisation des analyses statistiques et dans le peaufinage de mes articles. Au fil de ces années, il est devenu plus qu’un collègue. J’ai l’honneur de pouvoir le compter parmi mes amis. Merci à Véronique Garneau qui a été d’une précieuse aide dans la réalisation des analyses statistiques des données de la cohorte INFOGENE. Merci à Hubert Cormier qui a contribué à une partie de l’article présenté dans le chapitre 3. Je tiens aussi à remercier Bénédicte L Tremblay, nos petites discussions passionnantes étaient toujours relaxantes. J’aimerais remercier également le CRSNG (numéro : 48031-2012) pour le soutien financier au projet. Finalement, merci à ma famille (père, mère, frère et sœurs) qui sont une source d’inspiration et de motivation sans fin pour moi. Merci également à mes amis de Québec qui ont été présents dans les bons tout comme dans les mauvais moments.
AVANT-PROPOS
La réalisation de cette thèse fut possible grâce à la collaboration de plusieurs personnes. Tout d’abord ma directrice de thèse, Dr Marie-Claude Vohl, professeur à l’École de nutrition de l’université Laval, qui a contribué à toutes les étapes nécessaires à la réalisation des différents projets ainsi qu’à tous les articles présentés dans cette thèse. Cette dernière a participé à la planification du projet, à la révision des documents de demande de financement pour ce projet de doctorat ainsi qu’à l’approbation et à la révision de tous les articles présentés dans cette thèse. Le Dr Olivier Barbier, co-directeur de thèse, est co-auteur de tous les articles rédigés pendant cette thèse. Ce dernier a contribué à la planification du projet présenté dans les chapitres 5, 6 et 7. Il a une expertise en culture cellulaire et dans le métabolisme des AGs n-3. Le Dr Frédéric Guénard a également contribué à tous les articles présentés dans cette thèse. Ce dernier a participé à la réalisation des analyses statistiques. Le Dr Louis Pérusse a contribué à la planification du projet dans lequel s’inscrivent les articles des chapitres 3 et 4. L’expertise du Dr Pérusse dans le domaine de l’obésité et des complications en découlant a contribué à la qualité de ces travaux.
Pour ma part, j’ai conçu la planification du projet sur les AGs n-3 (chapitres 5, 6 ,7) avec le Dr Vohl. J’ai été également responsable des manipulations en laboratoire (chapitres 5, 6, 7), des analyses statistiques (tous les chapitres), de l’analyse des résultats (tous les chapitres) et la rédaction des articles. J’ai par la suite été responsable de l’intégration des commentaires des co-auteurs pour chaque article, de leurs soumissions dans des revues scientifiques ainsi que de leurs révisions. Toutes ces raisons font de moi le premier auteur des articles présentés dans la présente thèse.
La présente thèse contient l’essentiel des travaux que j’ai effectués pendant mon doctorat. Elle est structurée comme suit : 1)- Introduction générale ; 2)- revue de la littérature ; 3)- présentation de la problématique, des objectifs, et des hypothèses de ce projet de doctorat ainsi que de la méthodologie. Les chapitres 3 à 7 sont
constitués des articles scientifiques. Finalement, le chapitre 8 se veut une conclusion générale résumant les résultats de cette thèse et leurs implications.
Les articles scientifiques sont présentés sous forme de manuscrits dans cette thèse.
Chapitre 3 : Allam-Ndoul B, Guénard F, Garneau V, Cormier H, Barbier O, Perusse L, Vohl MC. Association between Metabolite Profiles, Metabolic Syndrome and Obesity Status. Nutrients. 2016 ;8.
Chapitre 4 : Allam-Ndoul B, Guénard F, Garneau V, Barbier O, Perusse L, Vohl MC. Associations between branched chain amino acids levels, obesity and cardiométabolic complications. Integrative Obesity and Diabetes. 2015;10.15761 Chapitre 5: Allam-Ndoul B, Guénard F, Barbier O, Vohl MC. Effect of n-3 fatty acids on the expression of inflammatory genes in THP-1 macrophages. Lipids
Health Dis. 2016; 15:69.
Chapitre 6: Allam-Ndoul B, Guénard F, Barbier O, Vohl MC. Effect of different concentrations of omega-3 fatty acids on stimulated THP-1 macrophages. Genes
and Nutrition.2017;12:7.
Chapitre 7: Allam-Ndoul B, Guénard F, Barbier O, Vohl MC. A study of the differential effects of EPA and DHA on gene expression profiles of stimulated THP-1 macrophages. Nutrients. 20THP-17 Apr 25;9(5).
INTRODUCTION GÉNÉRALE
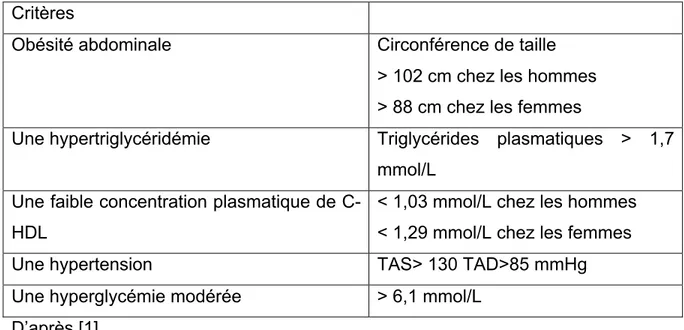
Une personne est atteinte de syndrome métabolique (SMet) lorsqu’elle présente au moins trois des critères suivants: un taux élevé de triglycérides, de l’hypertension, de l’obésité abdominale, une glycémie élevée et un faible taux de cholestérol HDL [1]. Le SMet correspond donc à un ensemble de perturbations métaboliques, prédisposant au développement de maladies chroniques telles que les maladies cardiovasculaires (MCV) ou le diabète de type 2 (DT2) [2]. L’enquête Canadienne sur les mesures de la santé menée de 2012 à 2013 révèle qu’environ 21% des adultes âgés de 18 à 79 ans sont atteints de Smet [3]. Cela est inquiétant car les individus atteints de SMet voient leur risque de survenue de maladies inflammatoires chroniques, telles que les MCV et le DT2 augmenté de façon importante [4].
Le SMet peut être défini par plusieurs facteurs étiologiques dont l’obésité, particulièrement l’obésité viscérale [1]. Il s’agit d’une augmentation excessive de tissu adipeux entourant les viscères à l’intérieur de la cavité abdominale. En 2014, 1,9 milliards d’individus à travers le monde étaient en surpoids (indice de masse corporel (IMC) compris entre 25 et 29.9 kg/m2), parmi ces derniers, 600 millions étaient obèses [5]. À l’échelle Canadienne en 2011, 1 adulte sur 4 était obèse. Cela correspondait à 6,3 millions d’obèses sur tout le territoire. Il est reconnu que l’excès de poids augmente le risque de comorbidités à long terme notamment l’hypertension, les dyslipidémies ou certaines formes de cancers [6]. Il faut cependant souligner le fait que tous les individus atteints de SMet ne sont pas forcément obèses [7]. La prévalence des individus obèses sans SMet est relativement importante, en effet d’après Primeau, 30% de la population obèse serait considérée comme métaboliquement en santé [7]. Ces derniers ont une bonne sensibilité à l’insuline, des profils lipidiques, hormonaux, inflammatoires et immunitaires normaux et ne souffrent pas d’hypertension [7]. Il est donc important d’étudier de façon plus approfondie l’hétérogénéité du phénotype d’obésité.
Le SMet et l’obésité sont 2 conditions affectant le métabolisme de l’organisme. De ce fait, l’étude du changement au niveau des métabolites d’individus obèses/non
obèses et atteints de SMet en comparaison à des individus de poids normal et sans SMet permettrait de mieux comprendre l’impact de l’obésité et du SMet sur les facteurs de risque de MCV. La métabolomique permet l’étude simultanée de plusieurs métabolites (sucres, protéines, acides gras, etc.) produits par le corps humain, c’est donc une méthode de choix pour ce type d’étude.
Le SMet et l’obésité sont accompagnés d’une inflammation systémique et chronique. Cette dernière est l’une des composantes principales participant au développement des MCV, du DT2, mais également au développement d’autres maladies inflammatoires chroniques telles que l’asthme ou les maladies de l’intestin [2]. Le contrôle de l’inflammation est donc un enjeu primordial dans la lutte contre la survenue et le développement de ces maladies.
Une façon très efficace de moduler le profil inflammatoire d’un individu est d’agir au niveau de l’alimentation de ce dernier [8]. En effet, au cours de ces dernières années, de nombreuses études ont démontré que chez des individus atteints de SMet, des modifications au niveau de l’alimentation telles que l’adoption d’une diète pauvre en glucides et en gras ou d’une diète riche en fibre, améliorait le profil métabolique [9;10]. Une étape déterminante fut la découverte de l’effet anti-inflammatoire des acides gras (AGs) n-3. Le rôle bénéfique de ces derniers dans la survenue et le développement de maladies inflammatoires chroniques telles que les MCV [11;12], les maladies inflammatoires chroniques de l’intestin [13] ou encore certains types de cancer [14] est reconnu. Cependant, les mécanismes moléculaires par lesquels ces AGs exercent leurs actions sont loin d’être pleinement élucidés. Des études menées par notre équipe de recherche ont démontré que chez des individus ayant reçu 3g/jour d’AG d’acide éiocsapentaénoique (AEP) et d’acide docosahexaénoique (ADH) (1,9g AEP+1,1gADH), on voyait une modulation des gènes impliqués dans l’inflammation, le stress oxydatif ou encore la voie de signalisation de PPAR-α dans des cellules mononuclées sanguines périphériques (CMSP. Nous avons donc entrepris d’étudier les effets des 2 AGs principaux, AEP et ADH, sur l’inflammation et cela dans des cellules inflammatoires, à savoir des macrophages de type THP-1.
La transcriptomique est l’étude de l’ensemble des ARNm et repose sur la quantification de ces derniers. Elle permet d’avoir une information sur les niveaux d’expression de différents gènes dans différentes conditions. En utilisant 2 méthodes (PCR en temps réel et puce d’ADN complémentaire), nous nous sommes intéressés à l’effet de ces AGs sur l’expression des gènes de l’inflammation.
Cette thèse est divisée en 8 chapitres. Le premier chapitre présente une revue de littérature décrivant le SMet, l’obésité ainsi que l’inflammation. Il introduit également les techniques OMIQUEs utilisées dans cette thèse. La dernière partie de ce chapitre présente une approche nutritionnelle (consommation d’AGs n-3) visant à réduire l’inflammation. Le chapitre 2 présente les objectifs et les hypothèses de cette thèse ainsi que la méthodologie utilisée. Le chapitre 3 présente un article original intitulé « Association between metabolite profiles,
metabolic syndrome and obesity status », publié dans la revue « Nutrients » en
2016. Le chapitre 4 correspond à la présentation d’un article original dont le titre est « Associations between branched chain amino acid levels, obesity and
cardiometabolic complications », et qui a été publié dans la revue « Integrative Obesity and Diabetes » en 2015. Le chapitre 5 présente l’article original intitulé
« Effect of n-3 fatty acids on the expression of inflammatory genes in THP-1
macrophages » publié dans le journal « Lipids in Health and Disease » en 2016. Le
chapitre 6 correspond à un article dont le titre est « Effect of different
concentrations of n-3 fatty acids on stimulated thp-1 macrophages » et publié dans
la revue «Genes and Nutrition ». Enfin le chapitre 7 présente un article intitulé « A
study of the differential effects of EPA and DHA on gene expression profiles of stimulated THP-1 macrophages », sous presse dans la revue « Nutrients ».
CHAPITRE 1 : REVUE DE LA LITTERATURE
1. L’OBÉSITÉ 1.1 Définition
L’obésité correspond à un excès de masse adipeuse pouvant nuire à la santé [16]. Il s’agit d’une pathologie multifactorielle résultant de l’interaction de facteurs environnementaux, métaboliques et génétiques [17]. En pratique clinique, l’obésité est définie par l’IMC. Ce dernier est calculé comme suit : poids (kg)/taille (m)2. L’IMC permet de définir plusieurs catégories de poids.
Tableau 1. Catégories de poids selon l’IMC.
Classification IMC kg/m2
Maigreur <18,5
Poids « normal » 18,5-24,9
Surpoids 25-29,9
Obésité (classe 1) 30-34,9
Obésité sévère (classe 2) 35-39,9 Obésité morbide (classe 3) >40 Adapté de [18].
Il existe deux types d’obésité, qui sont définies selon la distribution du tissu adipeux (TA) :
- L’obésité gynoïde, caractérisée par l’accumulation du TA au niveau du bassin et des cuisses.
- L’obésité androïde, caractérisée par l’accumulation du tissu adipeux au niveau abdominal. Chez les individus ayant une obésité abdominale, on observe une augmentation du risque de survenue de MCV et métaboliques [19].
1.2 Épidémiologie
De nos jours, on observe une augmentation de la sédentarité accompagnée d’une augmentation de la disponibilité des denrées alimentaires, reflet de la croissance économique mondiale. Ce fait est accompagné d’une augmentation de la prévalence de l’obésité. En effet, depuis plusieurs dizaines d’années, la prévalence de l’obésité et du surpoids augmente de façon préoccupante, cela aussi bien dans les pays développés que dans les pays du tiers monde [20]. En 2012-2013, au Canada, 27% des hommes et 26% des femmes étaient obèses (IMC≥30 kg/m2). À l’inverse, en ce qui concerne le surpoids, plus d’hommes que de femmes (43% des hommes contre 28% des femmes) étaient en embonpoint (IMC entre 25 et 30 kg/m2) [6]. Cette condition étant associée à une augmentation de la mortalité ainsi qu’à l’apparition de complications métaboliques, ce constat est très inquiétant [21].
2. LE SYNDROME MÉTABOLIQUE
2.1 Historique et définition
Le concept de SMet fut évoqué pour la première fois en 1923 par Kylin, un médecin Suédois. Ce dernier proposa un mécanisme commun et responsable du développement de 3 conditions : le diabète, l’hyperuricémie ainsi que de l’hypertension [22]. Par la suite, Vague fut le premier à introduire la notion d’obésité tronculaire (obésité viscérale) la mettant en relation avec le développement de l’hypertension, de la goutte, de l’athérosclérose et du diabète [23]. En 1988, Reaven désigna ce groupe de dysfonctions métaboliques sous l’appellation de syndrome X. Le SMet exposerait aux complications cardiovasculaires et au diabète de type 2 [24].
Plusieurs organismes dont l’International Diabetes Federation, l’Organisation Mondiale de la Santé (OMS) et The National Cholesterol Education Program-Adult
légèrement les unes des autres. Dans le cadre de cette thèse, nous avons choisi d’utiliser la définition du NCEP-ATP III [1]. Cette définition est basée sur la présence d’au moins 3 critères de la liste suivante :
Tableau 2. Définition du syndrome métabolique selon le NCEP-ATPIII.
Critères
Obésité abdominale Circonférence de taille
> 102 cm chez les hommes > 88 cm chez les femmes
Une hypertriglycéridémie Triglycérides plasmatiques > 1,7 mmol/L
Une faible concentration plasmatique de C-HDL
< 1,03 mmol/L chez les hommes < 1,29 mmol/L chez les femmes
Une hypertension TAS> 130 TAD>85 mmHg
Une hyperglycémie modérée > 6,1 mmol/L D’après [1].
2.2 Risques associés au syndrome métabolique
Chez les individus atteints de SMet, il est commun d’observer l’apparition de comorbidités telles que la survenue de MCV, de la résistance à l’insuline (RI) pouvant conduire à un diabète de DT2 ou encore de la stéatose hépatique non-alcoolique (SHNA).
2.2.1 Risques cardiovasculaires
Les sujets atteints de SMet ont un risque accru de MCV [25-27]. Les complications associées à cette condition, c’est-à-dire la survenue de maladies coronariennes ou encore d’infarctus du myocarde font partie des causes principales de décès dans les pays industrialisés [28]. Chez des sujets Suédois et Finlandais, la survenue du
SMet était associée à une augmentation significative de la mortalité cardiaque (12% et 2%) [29]. Lakka et collaborateurs ont également prouvé que les hommes atteints le SMet avaient un risque relatif de survenue de décès cardiovasculaires supérieur à la population générale [30]. Dans une méta-analyse comptant 170 000 sujets, Ford et Gami ont montré que le fait d’avoir le SMet augmentait le risque d’accidents cardiovasculaires [31]. Par ailleurs, chez la plupart des individus atteints de SMet, on observe une dyslipidémie athérogène. La composante majeure de cette condition est l’augmentation des lipoprotéines riches en apolipoprotéine B (apo B), à savoir les lipoprotéines de faible densité (LDL) et les lipoprotéines de très faible densité (VLDL) [1]. L’augmentation de ces dernières est considérée comme une cause importante des MCV. Les lipoprotéines athérogéniques (LDL et VLDL) initient l’athérosclérose et jouent un rôle important dans chaque étapes du développement de ces pathologies [32].
2.2.2 Résistance à l’insuline et diabète de type 2
L’insuline produite en temps normal par les cellules β du pancréas a la capacité de stimuler l’utilisation du glucose dans le TA, le muscle ainsi que dans le foie [33;34]. Le DT2 est caractérisé par une RI et une diminution de la production d’insuline. La majorité des individus atteints de SMet sont considérés comme résistants à l’insuline. Le SMet est associé à un fort risque de survenu d’un DT2, en effet la majorité des individus ayant un DT2 sont atteints du SMet [35]. Ford et collaborateurs ont démontré que les individus obèses atteints de SMet avaient un risque relatif de 3,5 à 5,2 fois de développer un DT2 par rapport à des individus sans SMet [36].
2.2.3 Stéatose hépatique non alcoolique
La SHNA est l’une des maladies hépatiques les plus répandue. Elle consiste en une accumulation de graisses au niveau du foie. Cette maladie est associée à une RI hépatique [37]. En découle alors une hyperglycémie et une stimulation de la
production d’insuline, le tout conduisant à une hyperinsulinémie. Le gras hépatique est associé aux composantes du SMet indépendamment de l’IMC. Les épidémies de SMet et d’obésité sont accompagnées d’une augmentation de la prévalence de la SHNA. Krotronen et collaborateurs ont rapporté que l’accumulation de graisse hépatique était 4 fois supérieure chez des sujets atteints de SMet (20-65 ans) que chez des sujets sans SMet [38]. L’association entre le SMet et la SHNA suggère que ces deux conditions partagent des antécédents physiologiques [39].
2.3 Pathophysiologie du syndrome métabolique
Les mécanismes à l’origine du développement du SMet ne sont pas complètement connus. Le rôle du mode de vie sédentaire dans la survenue du SMet est cependant bien documenté [40]. Les composantes génétiques, environnementales et l’interaction entre les deux sont des facteurs étiologiques du SMet qui en font un syndrome d’origine multifactorielle. Par ailleurs, l’obésité abdominale et le DT2 sont fortement associés au SMet [41;42]. Il devient alors impossible de parler de la physiopathologie du SMet sans parler de celle de l’obésité et du DT2.
Parallèlement à l’augmentation de la prévalence de l’obésité dans la population, on observe une augmentation de celle du DT2. Il est estimé qu’environ 90% des DT2 sont attribuables à un excès de poids [43]. Les physiopathologies reliant ces deux conditions sont attribuables entre autres à deux facteurs : 1)- un apport important en AGs via l’alimentation ; et 2)- une lipolyse accrue du TA.
Dans certaines conditions physiologiques, le stockage des AGs dans les adipocytes empêche le relargage de ces derniers dans la circulation sanguine. En effet, les AGs peuvent devenir toxiques quand ils sont libérés dans le réseau vasculaire. Chez les personnes obèses se produit une lipolyse accrue qui favorise le relargage des AGs dans la circulation sanguine. De plus, le TA viscéral est plus actif et libère plus d’AGs libres (AGL) dans le plasma [44]. On assiste donc à une augmentation globale de la concentration en AGL. Chez des volontaires obèses parmi lesquels on observait une augmentation de la concentration en AGs libres, une RI globale a été observée [45]. L’insuline est une hormone qui, en temps
normal, inhibe la lipolyse dans le TA et la production de glucose dans le foie [46]. La RI quant à elle correspond à une désensibilisation des récepteurs membranaires à l’insuline dans le foie, le muscle squelettique et le tissu adipeux. Chez les individus obèses, on assiste à une augmentation de la captation cellulaire en AGL, induisant la β-oxydation mitochondriale, une inhibition du métabolisme du glucose ainsi qu’une dysfonction endothéliale [47]. Les lipides sont utilisés préférentiellement au glucose, ce qui entraine une diminution de la captation de glucose ainsi qu’une diminution de la synthèse de glycogène dans le muscle [48;49]. L’état d’hyperglycémie chronique diminue grandement la sensibilité à l’insuline. Une production accrue d’insuline ayant pour but de palier à l’hyperglycémie est alors lancée. Cette progression continue mène à un défaut de fonctionnement des cellules β pancréatiques et à leur éventuelle apoptose. Tous ces processus accélèrent la progression vers le DT2.
Un excès de TA viscéral est également associé à une augmentation du risque de survenue de MCV et métaboliques et cela indépendamment de l’IMC [50]. L’apparition de ces dysfonctions serait en partie due à l’infiltration accrue de macrophages dans le TA viscéral, secondaire à une hypertrophie importante des cellules adipeuses au niveau abdominal. On observe alors une augmentation de la production de plusieurs cytokines pro-inflammatoires (Tumor Necrosis Factor A (TNFA), Interleukine 6 (IL6), Interleukine 1B (IL1B)) et une diminution de cytokines anti-inflammatoires (IL10). Ce déséquilibre de production de cytokines inflammatoires favorise l’état inflammatoire associé au SMet et à l’obésité mais induit également l’état de RI en altérant la voie de signalisation de l’insuline.
2.4 L’inflammation 2.4.1 Définition
L’inflammation ou réaction inflammatoire est une réponse physiologique de l’organisme à une agression physique, chimique ou biologique. Il s’agit d’un processus bénéfique qui mobilise le système immunitaire dans le but ultime d’éliminer l’agent pathogène.
Pendant sa phase précoce, l’inflammation aigue met en jeu l’immunité innée. Cette phase est nécessaire au déclenchement de la réponse adaptative qui se manifeste de façon tardive. La réaction inflammatoire est divisée en 3 phases majeures [51].
2.4.1.1 Réaction vasculo-excudative
Cette phase est déclenchée par l’activation des cellules endothéliales des vaisseaux sanguins, suivie d’une vasodilatation des vaisseaux, entrainant une augmentation de l’apport sanguin. Survient ensuite un œdème inflammatoire permettant l’apport des moyens de défenses jusqu’à la lésion et l’initiation du foyer inflammatoire. La phase de la réaction vasculo-excudative se clôture par la diapédèse des leucocytes de la circulation sanguine jusqu’au foyer de l’inflammation [52].
La deuxième phase de l’inflammation est la phase cellulaire, qui correspond à la formation du granulome inflammatoire et à la phagocytose de l’agent pathogène. Cette phase est effectuée par les composantes cellulaires et solubles de l’inflammation qui seront décrits dans le paragraphe suivant.
2.4.1.2 Phase cellulaire
2.4.1.2.1 Composantes cellulaires
Mise à part les cellules endothéliales, la totalité des cellules participant à la réponse inflammatoire sont issues de la moelle épinière hématopoïétique. Ces cellules se différencient au niveau médullaire après avoir été stimulées par des facteurs de croissance et des cytokines [52]. Dans cette section, les différentes cellules participant à la réponse inflammatoire seront passées en revue.
-Les leucocytes:
Les leucocytes sont des cellules produites dans la moelle osseuse hématopoïétique et présentes dans le sang, la lymphe, les organes lymphoïdes et
dans de nombreux tissus conjonctifs de l’organisme. Ce groupe est composé des granulocytes, lymphocytes et monocytes
- Les granulocytes :
Les granulocytes sont les cellules les plus représentées du sang. Elles regroupent les polynucléaires neutrophiles (PNN) (50-80% des leucocytes), éosinophiles (PNE) (1-4% des leucocytes) et basophiles (PNB) (0-1% des leucocytes).
Les PNN participent à la phagocytose des éléments étrangers ainsi qu’à la dégranulation. Ils sont également capables de synthétiser une quantité importante de médiateurs inflammatoires lipidiques (leucotriènes (LTs), prostaglandines (PGs) et cytokines). Ce sont les cellules pivot de l’inflammation aiguë.
Les PNE résident au niveau tissulaire. Ils libèrent différents médiateurs inflammatoires, une grande quantité de cytokines pro-inflammatoires ainsi que des chémokines.
Les PNB résident également au niveau tissulaire et sécrètent notamment l’histamine et l’héparine qui servent à empêcher la coagulation sanguine et à augmenter la perméabilité des capillaires sanguins, facilitant ainsi la diapédèse [53].
-Les monocytes et les macrophages :
Les monocytes représentent 2 à 10 % des leucocytes. Ils possèdent d’importantes propriétés phagocytaires, chimiotactiques, sécrétoires et migratoires qui sont indispensables à leurs fonctions. Les monocytes et les macrophages sont des cellules phagocytaires. Elles produisent des protéases, des enzymes hydrolytiques et des espèces réactives de l’oxygène. Toutes ces molécules participent à la destruction d’éléments étrangers. Ces cellules permettent l’amplification de l’inflammation via une libération de cytokines inflammatoires, PGs, LTs et facteurs chimiotactiques, ceci dans le but final de recruter et d’activer d’autres cellules
immunitaires. Les monocytes sont considérés comme les cellules jouant un rôle clé dans le processus inflammatoire chronique [53].
-Les lymphocytes (20-40% des leucocytes) :
Il existe deux populations de LT et LB. Les LB participent à l’immunité spécifique et à la production d’anticorps. Les LT quant à eux ont des fonctions cytotoxiques leurs permettant de supprimer les cellules infectées par les agents pathogènes ainsi que des propriétés régulatrices dans la réponse inflammatoire.
-Les mastocytes et les PNB :
Ces deux types cellulaires participent à l’initiation du phénomène inflammatoire et au recrutement d’autres cellules immunitaires. Par la suite, elles secrètent une multitude de cytokines.
2.4.1.2.2 Les médiateurs solubles de l’inflammation
-Les médiateurs lipidiques de l’inflammation :
Les éicosanoides sont des dérivés d’AGs à 20 carbones, ils incluent les PGs, les LTs, les thromboxanes (TXs) ainsi que les lipoxines (LXs) [54]. Le substrat initial de la synthèse de ces molécules est l’acide arachidonique (AcA) contenus dans les PL membranaires. Suite à un stimulus inflammatoire, l’AcA est clivé par la phospholipase A2. A ce stade, deux voies enzymatiques divergent pour conduire à la formation de médiateurs lipidiques de l’inflammation. Il s’agit des voies des lipoxygénases (LOX) et des cyclooxygénases (COX). L’activité COX permet la
production de PGs et de TXs [55] (Figure 1). Ces médiateurs peuvent être libérés par les macrophages, les mastocytes, les plaquettes ou les cellules endothéliales. Les LTs quant à eux sont obtenus par des réactions catalysées par des LOX. La 5-LOX est une enzyme dont la distribution est limitée à certaines cellules d’origine médullaire, aux monocytes ou macrophages, aux LB, PNN, PNE et PNB. Les médiateurs lipidiques les plus puissants sont la PGE2, la PGI2 et le LTB4 qui participent au recrutement des cellules immunitaires sur le site de l’inflammation [55].
Figure 1 : Voie de biosynthèse des éicosanoides [56]
-Les cytokines :
Elles représentent une famille de médiateurs pro-inflammatoires produits en majeure partie par les cellules effectrices de la réponse immunitaire. Les
interleukines 1B, 6, 8 (IL-1B, IL-6, IL-8) et TNFA sont les cytokines le plus impliquées dans les maladies inflammatoires chroniques.
L’inflammation se termine par un retour à l’homéostasie initiée par la phase de résolution de l’inflammation.
2.4.1.3. Résolution de l’inflammation
Cette phase met fin au processus inflammatoire. Elle permet l’arrêt de l’agression grâce à la déplétion de chémokines pro-inflammatoires ainsi que la destruction des PNN. On observe également un changement du phénotype des macrophages résidents. En effet, les macrophages pro-inflammatoires dits « classiques » ou M1 se transforment en des macrophages anti-inflammatoires dits « alternatifs » ou M2. Les macrophages de types M2 produisent des molécules anti-inflammatoires telles qu’IL-4, IL-10 ainsi que des dérivés lipidiques tels que les résolvines, protectines et lipoxines [57]
2.4.3 Le rôle de l’inflammation dans la survenue des maladies inflammatoires chroniques
Le retour à l’homéostasie survient suite à l’élimination de l’agent pathogène par les effecteurs de la phagocytose (monocytes/macrophages et PNN). Les macrophages et les lymphocytes produisent des cytokines anti-inflammatoires qui suppriment les processus amorcés au cours de l’étape d’amplification. Une perte de contrôle de ce processus peut contribuer à une inflammation chronique et non-contrôlée. Cela peut occasionner d’importants dommages tissulaires et participer à l’apparition de maladies inflammatoires chroniques.
Les MCV comprennent un ensemble de maladies touchant le cœur et les vaisseaux sanguins (infarctus du myocarde, anévrisme, hypertension artérielle etc.). L’une des causes majeures des MCV est l’athérosclérose. Il s’agit d’une condition complexe et multifactorielle touchant les artères de gros et moyen calibre. Ces artères sont constituées de 3 compartiments : l’intima, la média et l’adventice. L’intima est formée d’une simple couche de cellules endothéliales. Ces dernières ont une multitude de fonctions métaboliques et régulatrices. En effet, elles sont impliquées dans le transport métabolique des substances, dans la régulation du tonus vasculaire ou encore dans la défense contre l’inflammation [58]. Le monoxyde d’azote (MA) est l’une des substances clé produite par les cellules endothéliales. Une diminution de sa biodisponibilité peut conduire à une dysfonction endothéliale [59]. L’activation de ces cellules entraine une réponse immunitaire impliquant la production de chémokines (monocyte chemoattractant protein-1 (MCP-1), IL-8 etc.), de facteurs d’adhésion, de sélectines et/ou d’intégrines produites par les cellules circulantes et les cellules endothéliales. La production de toutes ces molécules entraîne le recrutement accru de monocytes au niveau de la surface endothéliale, ces derniers migrent ensuite dans l’intima de l’artère [60;61]. L’influx de monocytes est accompagné par celui d’autres cellules de l’inflammation telles que les LT ou les cellules dendritiques. Une fois rendu dans l’intima, les monocytes se transforment alors en macrophages sous la stimulation de cytokines (TNFA, IL-1β, IFN-ɣ). Les macrophages sont alors convertis en cellules chargées en cholestérol nommées les cellules spumeuses et situées au niveau de la paroi artérielle pour former une strie lipidique. La progression de la plaque athéromateuse est un processus complexe qui peut être réversible dans les étapes précoces de la maladie [62;63]. La transformation de la strie lipidique en plaque fibreuse nécessite le recrutement de cellules musculaires lisses [64] (Figure 2). Ce phénomène est conduit par l’interaction synergique de plusieurs facteurs de croissance.
Figure 2 : Progression de la dysfonction endothéliale Adapté de [65]
2.4.3.2 La résistance à l’insuline et le diabète de type 2
L’insuline stimule le stockage de glucose dans le muscle, inhibe la production hépatique de glucose et la lipolyse du tissu adipeux. Dans des conditions de RI on observe une insensibilisation des récepteurs à l’insuline. Les fonctions citées précédemment sont alors altérées. Cela conduit à une hyperglycémie, à une augmentation de la concentration en AGs libres, à une hyperinsulinémie et à une dysfonction des cellules pancréatiques [46]. Le pancréas continue alors à sécréter de l’insuline mais cette dernière n’a plus d’effets sur ses récepteurs. Ainsi, les cellules pancréatiques s’épuisent au fur et à mesure, conduisant à un DT2 [66;67]. Hotamisligil [68] et Karasik [69] furent les premiers à montrer que la cytokine pro-inflammatoire TNFA était capable d’induire la RI. L’idée qu’une substance surproduite par le TA pouvait avoir un effet systémique et local sur le métabolisme était révolutionnaire. Des études ont par la suite démontré que le TA adipeux produisait le TNFA, mais également la leptine, l’IL-6, la résistine, le MCP-1, l’angiotensine et bien d’autres adipokines [70-72]. Les chémokines telles que MCP-1 et les cytokines pro-inflammatoires étaient responsables de l’activation des voies de signalisation intracellulaire qui participaient au développement de la RI et au DT2. Des études sur l’obésité et la RI chez l’humain ont montré une association
claire entre l’activation chronique des voies de signalisation pro-inflammatoire et la diminution de la sensibilité à l’insuline. Par exemple, des taux élevés de TNFA, IL-6 et IL-8 ont été notés chez des patients insulino-résistants ou diabétiques [73-77]. De plus, la protéine C-réactive, un marqueur inflammatoire non spécifique, avait une concentration élevée chez les individus avec une RI [78].
3. Approche nutritionnelle dans le cadre de l’inflammation
3.1 Les acides gras oméga-3
3.1.1 Oméga-3 et oméga-6
Les AGs n-3 et n-6 sont dits polyinsaturés car leur chaine carbonée contient plusieurs doubles liaisons. Lorsqu’on considère le carbone du groupement méthyl comme le carbone numéro 1, ils sont spécifiquement caractérisés par une dernière double liaison entre les carbones 3 et 4 de la chaine carbonée pour les n-3 et entre les carbones 6-7 pour les n-6.
Les acides alpha linolénique (AAL) et linoléique (AL) sont les deux AGs essentiels [79;80]. Ils sont respectivement les précurseurs des AGs n-3 et n-6. Ils sont dits essentiels car, ne possédant pas les enzymes désaturases delta 12 et 15, le corps humain ne peut les synthétiser. Ils doivent donc être fournis par l’alimentation [81]. Pour être convertis en acide gras polyinsaturés (AGPI) à plus longues chaines, l’AAL et l’AL utilisent les mêmes enzymes. Ainsi, suite à l’action de ces enzymes, l’AAL donne naissance à une multitude d’AGs n-3 dont AEP, ADH et DPA tandis que l’AL donne naissance entre autres à l’AcA (Figure 3). Techniquement, AEP et ADH ne sont pas des AGs essentiels car le corps humain peut convertir AEP et ADH à partir de ALA. Cette conversion reste cependant faible. En effet, 0,2 à 8% d’ALA est convertie en AEP et 0% à 4% pour le ADH [81]. Les quantités d’AEP et ADH obtenues après conversion n’étant pas suffisantes pour avoir un impact
positif sur la santé, ces deux AGs doivent également nous être fournis par l’alimentation [5].
Figure 3 : Voies métaboliques de synthèse des AGPI à très longues chaines à partir des AGs essentiels [82]
3.1.2 Les différentes sources d’acides gras omega-3
L’AAL est principalement retrouvé dans des aliments d’origine végétale tels que les graines de noix, les noix de Grenoble ainsi que les graines de chia. AEP et ADH sont quant à eux retrouvés dans la chair des poissons gras tels que le saumon, le hareng, la sardine ou encore le maquereau ainsi que dans le foie de poissons maigres tel que la morue [83]. Une portion de poisson maigre peu fournir entre 0,2 et 0,3g d’AGs n-3 alors qu’une portion de saumon peut en contenir 1,5 à 3 g [56]. Les AGs n-3 d’origine marine peuvent également être fournis sous forme de
suppléments d’huile de poisson. Les proportions en AEP et en ADH dépendent de la source d’huile poisson. La plupart des huiles de poisson présentent dans le commerce ont une proportion de 18% d’AEP contre 12% de ADH [84]. Ainsi, une capsule d’AGs n-3 de 1 gramme peut fournir environ 0,3g d’AEP et ADH. Il est cependant important de préciser que de nos jours, la proportion de chacun de ces AGs n-3 peut être modifiée grâce à la trans-estérification. Il s’agit d’une réaction chimique qui permet l’hydrolyse de la liaison TG-n-3, ce qui donne naissance à un AGs libre et du glycérol. La ré-estérification subséquente permet la modification du contenu en AGs du TG. Il est donc possible de fabriquer des huiles enrichies en AEP ou ADH.
Les sources d’AGs n-3 diffèrent en termes de quantité absolue et de type de liaisons chimiques. Dans les poissons et dans les huiles non-raffinées obtenues à partir de ces derniers, les AGs n-3 sont présents principalement dans les TG, mais aussi en quantité moins importante sous formes d’AGL. Dans l’huile de krill, en plus des TG et AGL, une partie importante des AGs n-3 est présente sous forme de phospholipides [84]. On retrouve également les AGs n-3 dans l’huile de poisson raffinée, sous forme d’éther éthylique [84] .
Figure 4 : Structure d’un triglycéride
Dans les suppléments d’huile de poisson, l’ADH est présent de façon prédominante en position sn-2 tandis que l’AEP est estérifié de façon aléatoire à toutes les positions du squelette carboné du TG [85]. Cela est différent par
exemple dans l’huile de phoque où l’AEP et l’ADH sont préférablement localisés aux positions sn-1 et sn-3 [86]. Les acides gras peuvent ainsi être facilement libérés de ces positions par la lipase pancréatique et être absorbés directement. La position des AGs dans le squelette carboné du TG ne semblent pas avoir d’effet sur la digestibilité de ces AGs n-3 [87].
3.1.3 Recommandation en acide gras omega-3
Dans la population Canadienne, en 2002, les apports moyens d’AGs n-3 ont été jugés insuffisants [88]. L’apport nutritionnel recommandé pour l’AAL est de 1,6 g/jour pour les hommes et de 1,1 g/jour pour les femmes [89]. Bien qu’au Canada il n’existe pas de recommandations formelles concernant les apports en AEP et ADH, Santé Canada suggère de consommer deux portions de poisson gras par semaine, une portion correspondant à 0,6g à 1,6g d’AEP+ADH [90]. Il est cependant important de souligner que les recommandations changent selon les zones géographiques, ainsi en en Europe par exemple, il est recommandé de consommer au moins 250 mg/jour [91] d’AGs à très longue chaine, ce qui correspond à peu près à deux portions de poissons gras par semaine.
4. Les oméga-3 et l’inflammation
4.1 Les médiateurs de l’inflammation issus des AGs n-3
Dans des conditions normales, les phospholipides (PL) membranaires contiennent une proportion plus élevée d’AcA que d’AEP ou d’ADH. L’analyse de PL membranaires d’humains suivant une diète occidentale a montré que 15-20% des AGs étaient de l’AcA contre 0,5-1% d’AEP et 2-3% d’ADH [92-95]. Ces proportions peuvent cependant changer avec l’alimentation. En effet, chez les individus dont la diète est riche en AGs n-3, on observe une augmentation de la proportion d’AEP et d’ADH par rapport à l’AcA [96;97]. Comme expliqué à la section 2.4.2.2, les PGs,
TXs et LTs sont d’importants médiateurs de l’inflammation. Une consommation importante d’AGs n-3 entraîne une augmentation de la proportion d’AEP dans les PL membranaires. L’enzyme PLA2 a une meilleure affinité pour l’AEP que pour l’AcA. Il y a donc une augmentation de la production d’éicosanoides dérivés d’AEP, à savoir les PGs de série 3, les TXs ainsi que les LTs de série 5 [98;99]. Ces derniers ont une action inflammatoire moindre que les éicosanoides issu de l’AcA. À partir d’AEP, d’ADH et via l’action de la COX et de la LOX, on observe également la production de médiateurs de la résolution de l’inflammation [54]. Les résolvines, sont produites à partir d’AEP (de série E) ou de ADH (de série D) et les protectines et marésines sont issues de l’ADH (Figure 5). Ces molécules ont un rôle important car elles permettent de mettre fin à l’inflammation et favorisent le retour à l’homéostasie [100;101]. Mas et collaborateurs [102] ont montré que chez des individus consommant 1,4g AEP+1g ADH/jour pendant 3 semaines, la concentration en résolvines augmentait dans le sang.
Figure 5 : Médiateurs de la résolution de l’inflammation issus des AGs n-3 [103]
4.2 Rôle des AGs n-3 dans le développement des maladies inflammatoires chroniques
Nous avons précédemment abordé le rôle de l’inflammation dans les maladies inflammatoires chroniques. L’impact des AGs n-3 sur l’inflammation ayant maintenant été établi, les prochaines sections aborderont l’action des AGs n-3 sur quelques maladies chroniques inflammatoires.
4.2.1 Les maladies cardiovasculaires
Le rôle bénéfique des AGs n-3 est reconnu depuis les années 60. Bang et Dyerberg avaient remarqué une faible incidence d’infarctus du myocarde ainsi que des profils lipidiques favorables pour la santé cardiovasculaire chez les Inuits du Groenland [104]. Ces effets étaient attribués à la diète traditionnelle inuit, riche en produits marins dont la chaire est riche en AGs n-3 [104]. Durant ces dernières années, un nombre important d’études s’intéressant aux effets bénéfiques des AGs n-3 suite à leur consommation ont été réalisées. La majorité de ces études ont démontré qu’une augmentation de la consommation de ces AGs était bénéfique, et contribuait à la prévention des MCV [105;106].
Les AGs n-3 sont à présent considérés comme un moyen efficace de diminuer le risque de MCV. L’étude randomisée et contrôlée DART a été la première à démontrer qu’une supplémentation en AGs n-3 (500-900 mg n-3/jour) ou que la consommation de poisson (300 mg de poissons gras/semaine) pendant 2 ans réduisait le risque de mortalité générale chez des patients en rétablissement d’un infarctus du myocarde [107]. Quelques années plus tard, l’étude Italienne GISSI-Prevenzione menée chez 11 324 patients en convalescence suite à un infarctus du myocarde a renforcé ces résultats. Chez ces patients recevant 885 mg d’AEP+ADH pendant 3.5 années, une diminution de 15% des risques de mortalité générale avait été observée. Dans une étude japonaise plus récente (JELIS-study), des sujets hypercholestérolémiques recevant une dose quotidienne de
1800 mg d’AEP+ 5mg de simvastatin pendant 4,6 ans avaient été suivis. Une réduction significative avait été observée en ce qui concernait le risque d’accident coronarien en comparaison à des sujets ne recevant que des statines [108;109].
4.2.2 Résistance à l’insuline et diabète de type 2
Les résultats des études investiguant l’effet bénéfique des AGs n-3 sur la RI et le diabète sont assez hétérogènes. Concernant les études chez les animaux, les effets protecteurs des AGs n-3 dans la survenue de la RI sont clairs. En effet, les études menées chez les animaux ont montré que les AGs n-3 avaient un effet bénéfique sur la glycémie, l’insulinémie et la sensibilité à l’insuline [28;110;111]. Chez des rats ayant reçu une diète riche en sucre [112], une augmentation du poids, de la glycémie, des TG hépatiques ainsi qu’une hyperinsulinémie et une intolérance au glucose ont été notées. Après l’ajout d’AEP et d’ADH (2%, 5% et 7% des lipides totaux) dans la diète initiale pendant 30 jours, un inversement des symptômes fut noté. En fait, 5 et 7% d’AEP et d’ADH améliorait l’index HOMA-IR et diminuait l’expression des gènes impliqués dans lipogenèse de novo hépatique. Dans une étude récente [113], trois diètes ont été données à des souris pendant 10 semaines. Une diète contrôle (10% de lipides), une diète riche en gras (60% de lipides) et une diète riche en gras et en AEP/ADH. Le groupe ayant reçu la diète riche en gras+AEP/ADH avait maintenu un taux de glucose similaire au groupe contrôle. Dans ce groupe, au sein du le muscle squelettique, une amélioration de la sensibilité à l’insuline avait été démontrée par une augmentation de l’expression du transporteur de glucose Glut-4, de l’insuline receptor substrate 1 (IRS1) et du glycogène synthase. La RI est associée à une inflammation chronique médiée entre autres par les macrophages. Une étude réalisée chez les souris par Oh et al. [114] a montré que la protéine G couplée au récepteur 120 (GPR120) et exprimée dans les adipocytes matures, les macrophages et les cellules hépatiques fonctionne comme un récepteur aux AGs n-3. Passant par GPR120, les AGs n-3 inhibent les voies de signalisation de TLR et TNFA, diminuent l’expression des gènes pro-inflammatoires (IL-6, TNFA, MCP-1, IL-1β, iNOS) et augmentent
l’expression des gènes anti-inflammatoires du TA (interleukine-10, MGL1). En ce qui concerne les études sur les humains, les résultats sont assez contradictoires. La majorité des études observationnelles montrent un effet favorable des AGs n-3 sur la RI. La plupart des études notent un effet inverse entre la teneur en AGs n-3 et l’HOMA-IR [115;116]. Cette tendance est également observée chez les populations consommant beaucoup d’AGs n-3 (les esquimaux d’Alaska) [117;118]. Cela montre que les AGs n-3 ont un rôle dans la prévention et dans le traitement de la RI chez l’humain. En revanche, 2 méta-analyses [119;120] ont montré que dans la majorité des essais randomisés et contrôlés, on ne notait pas d’amélioration de la sensibilité à l’insuline après la prise de différentes doses d’AGs n-3. Ce constat demeurait similaire lorsque les effets des AGs n-3 étaient étudiés sur le long terme [121-123]. Il faut toutefois souligner qu’en fonction de la provenance géographique des participants (Europe, États-Unis, Asie-Australie), l’effet de la consommation d’AGs n-3 ou de poisson sur le risque de DT2 varie [124]. La variabilité des résultats chez l’humain peut être attribuable à plusieurs facteurs tels que les différences entre les doses d’AGs n-3 fournies au participants, la durée des traitements, l’état métabolique préexistant des participants ou encore à certains facteurs génétiques [125].
4.3 Rôle différentiel d’AEP et ADH au niveau cellulaire
Dans la plupart des études investiguant les effets des AGs n-3, des mélanges d’AEP et d’ADH sont utilisés. Cependant, nous ne savons pas réellement si les effets étudiés sont attribuables à l’AEP, à l’ADH ou au mélange des deux. Jusqu’au début des années 1990, l’ADH purifié n’était pas disponible. La plupart des études étaient réalisées avec de l’huile de poisson contenant plus d’AEP que de ADH. Il est pourtant reconnu que l’AEP et l’ADH n’ont pas le même effet
[94;126]. Il est donc primordial d’étudier leurs effets séparément afin de comprendre leurs rôles respectifs.
Tel que mentionné précédemment, la dysfonction de l’endothélium vasculaire est un des évènements déclencheurs de l’athérogénèse. Dans des cultures de cellules endothéliales humaines pré-incubées pendant 24h avec des AGs n-3 (20 µmol/L), seul l’ADH inhibait l’expression de l’ARNm de la vascular cell adhesion protein 1 (VCAM-1), une molécule facilitant l’adhésion des leucocytes à l’endothélium vasculaire.
Le MA est un neurotransmetteur produit dans des conditions biologiques par les cellules endothéliales. La réduction de sa production participe entre autre à la genèse de l’athérosclérose [127]. Après l’incubation de cellules endothéliales de rats dans 5 µM d’AEP et d’ADH pendant 72 h, Hashimoto et collaborateurs ont démontré que l’incorporation de l’AEP et de l’ADH dans les phospholipides membranaires entraînait une augmentation de la fluidité membranaire, conduisant à une augmentation de la synthèse de MA. Une réduction significative du cholestérol membranaire avait été également notée. Cet effet était plus important avec l’ADH qu’avec l’AEP.
Les effets respectifs de l’AEP et de l’ADH sur la fonction des leucocytes ont également été étudiés. Kew et al., ont démontré une différence dans l’effet de l’AEP et du ADH. Une supplémentation en ADH (4g/j) diminuait l’activation des LT tandis qu’aucun effet n’était noté pour AEP. Les huiles enrichies en AEP et ADH n’avaient aucun effet sur la production de cytokines, sur l’expression de molécules d’adhésion par les CMSP ainsi que sur la phagocytose effectuée par les monocytes ou les PNN [93]. La supplémentation en ADH supprimait l’activation des LT.
L’AEP et l’ADH modulent également la production de cytokines inflammatoires. Weldon et al., [128] ont étudié l’effet différentiel de l’AEP et de l’ADH sur l’expression des cytokines ainsi que sur l’activation du nuclear factor kappa B (NFKB) dans les macrophages de type THP-1. Le prétraitement des macrophages avec 100 µM d’AEP et d’ADH diminuait la production de TNF-α, IL-1B et IL-6 dans des cellules stimulées par du LPS. Les deux AGs diminuaient l’expression d’ARNm

![Figure 1 : Voie de biosynthèse des éicosanoides [56]](https://thumb-eu.123doks.com/thumbv2/123doknet/5578625.133851/35.918.155.820.397.820/figure-voie-biosynthèse-éicosanoides.webp)
![Figure 2 : Progression de la dysfonction endothéliale Adapté de [65]](https://thumb-eu.123doks.com/thumbv2/123doknet/5578625.133851/38.918.129.857.112.361/figure-progression-la-dysfonction-endothéliale-adapté.webp)
![Figure 3 : Voies métaboliques de synthèse des AGPI à très longues chaines à partir des AGs essentiels [82]](https://thumb-eu.123doks.com/thumbv2/123doknet/5578625.133851/40.918.132.688.221.633/figure-voies-métaboliques-synthèse-longues-chaines-partir-essentiels.webp)

![Figure 5 : Médiateurs de la résolution de l’inflammation issus des AGs n-3 [103]](https://thumb-eu.123doks.com/thumbv2/123doknet/5578625.133851/43.918.206.830.618.901/figure-médiateurs-résolution-l-inflammation-issus-ags.webp)