Rôles et implications de la protéine HRI dans la réponse cellulaire face
au stress
Mémoire
David Martel
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
RÉSUMÉ
OBJECTIFS : Le Bortezomib (Velcade©) est un inhibiteur de protéasome présentement utilisée en chimiothérapie pour soigner les cas de myélomes multiples et de lymphomes. Les tumeurs solides sont souvent résistantes à ce type de traitement. Mon laboratoire d’accueil à récemment déterminé que le traitement de cellules cancéreuses issues de tumeurs solides avec le Bortezomib induit une réponse de stress caractérisée par la phosphorylation du facteur d’initiation à la traduction eIF2α. Cette phosphorylation est médiée par une protéine kinase, nommée Heme Regulated Inhibitor (HRI). La phosphorylation du facteur eIF2α par HRI occasionne la formation de granules de stress (GS); corps cytoplasmiques renfermant les protéines ribosomales, les ARNms, et des molécules de signalisation. La formation des GS est associée à une résistance à la mort cellulaire induite par différents types de stress, tels qu’un choc oxydatif, l’hypoxie ou les radiations. Nous avons ainsi impliqué la formation des GS dans la résistance des cellules cancéreuses au Bortezomib. En effet, nous avons démontré que la suppression des GS en interférant avec l’expression d’HRI sensibilisait les cellules cancéreuses au traitement de Bortezomib. Ce résultat dénote aussi un nouveau rôle potentiel de HRI dans la chimiorésistance. Mon projet consistait donc à tester cette hypothése in vivo en utilisant des cellules cancéreuses déplétées de manière stable en HRI.
MÉTHODES : D’abord, en surexprimant de manière transitoire la protéine HRI grâce à un plasmide GFP-HRI, nous avons pu évaluer l’effet de sa surexpression sur la viabilité cellulaire. D’autre part, en créant des lignées stables exprimant des Small hairpin RNA (shRNA) dirigés contre l’ARNm HRI, nous avons pu étudier l’effet de l’absence de cette kinase sur la physiologie cellulaire et ce, en condition normale et en condition de traitement au Bortezomib.
RÉSULTATS : La surexpression de la protéine HRI cause l’induction de granules de stress dépendant de la phosphorylation du facteur eIF2α. Ce résultat valide nos résultats
de déplétion démontrant un rôle majeur de HRI dans la formation des GS en condition de Bortezomib via la phosphorylation de son substrat eIF2. De façon surprenante, nous avons également constaté une morphologie cellulaire ainsi qu’un taux de croissance différents en condition non traitée, comparativement aux contrôles shRNA non effecteurs. Ceci suggère un rôle nouveau de HRI dans la croissance cellulaire, indépendamment de la phosphorylation d’eIF2a. L’injection sur la membrane chorioallantoique d’un fœtus de poulet (in ovo) de cellules cancéreuses déplétées en HRI occasionne une diminution de développement tumoral. Inversement, on observe la formation d’une masse apparente pour les contrôles non effecteurs et ce, toujours en condition non traitée. Ceci suggère donc un rôle de HRI dans la croissance tumorale. CONCLUSION : La kinase HRI est impliquée dans la résistance des cellules cancéreuses à la mort cellulaire engendrée par le Bortezomib, mais semble également jouer un rôle physiologique dans la croissance tumorale.
Table des matières
RÉSUMÉ ... III LISTE DES TABLEAUX... VII LISTE DES FIGURES ... IX Remerciements ... XV
CHAPITRE 1 : INTRODUCTION ... 17
1.1 Mise en contexte ... 18
1.2 Initiation de la traduction ... 19
1.2.1 Régulation de l’initiation de la traduction en condition de stress ... 21
1.3 La répression de la traduction et les granules de stress ... 23
1.3.1 L’agent chemothérapeutique Bortezomib induit la formation des granules de stress ... 25
1.4 Fonctions et états d’activation de la protéine Heme Regulated Kinase ... 26
1.5 États d’activation de la protéine Heme Regulated Kinase ... 27
1.5 Objectifs de recherche ... 28
CHAPITRE 2 : MATÉRIEL ET MÉTHODES ... 30
2.1 Lignées cellulaires et culture ... 31
2.2 Drogues et traitements ... 31
2.3 Microscopie à fluorescence ... 32
2.5.1 Imagerie en temps réel ... 33
2.4 Analyses des protéines sur gel de polyacrylamide ... 34
2.4.1 Séparation en gel 1 dimension ... 34
2.4.2 Coloration des protéines au bleu de Coomassie ... 34
2.4.3 Immunobuvardage ... 35
2.5 Surexpression protéique ... 36
2.6 Réalisation de lignées stables exprimant des shRNA ... 37
2.7 Cytométrie en flux ... 37
2.8 Immunoprécipitations ... 38
2.9 Interférence à l’ARN transitoire ... 39
2.10Injection in ovo (Chick Chorioallantoic Membrane Assay) ... 39
CHAPITRE 3 : RÉSULTATS ... 41
3.1.1 HRI est sensible aux Dérivés Réactifs de l’Oxygène (DRO) ... 42 3.1.2 L’abondance endogène de HRI modifie la réponse face aux stress ... 46 3.2 Les lignées stables déplétées en HRI présentent un phénotype analogue à celui
de l’interférence à l’ARN transitoire ... 48 3.2.1 Les shHRI stables inhibent l’induction des granules de stress et diminuent
la croissance cellulaire ... 48 3.2.2 Les shRNA-HRI stables semblent être moins résistantes au traitement de
Bortezomib ... 51 3.3 La surexpression d’HRI exogène est viable pour la cellule, mais induit des GS
par la voie eiF2α ... 53 3.3.1 GFP-HRI se localise dans le cytoplasme, forme des agrégats et n’est pas
affecté pas un stress oxydatif ... 55 3.3.2 GFP-HRI ne présente pas plusieurs états de phosphorylation ... 57 3.3.3 Les cellules transfectées ont le même phénotype lors de traitements que
les cellules exprimant la protéine HRI endogène seulement ... 58 3.4 Injections in ovo des lignées déplétées de manière stable en HRI (shRNA-HRI) .. ... 59 3.5 Les partenaires de HRI ... 62 3.5.1 Immunoprécipitations sur des lysats cellulaires ... 62 3.5.2 Immunoprécipitations sur des lysats de cellules surexprimant GFP-HRI 62 CHAPITRE 4 : DISCUSSION ... 65 CHAPITRE 5 : CONCLUSION ... 70 RÉFÉRENCES ... 73
LISTE DES TABLEAUX
Tableau 1 - Caractéristiques des anticorps utilisés en immunofluorescence indirecte
LISTE DES FIGURES
Figure 1 – Les étapes de l’initiation de la traduction
Figure 2 - Les 4 kinases phosphorylant le facteur eIF2α et leurs stress respectifs Figure 3 - Les différentes étapes d’activation de HRI
Figure 4 - Les différents sites d’autophosphorylation de la protéine kinase HRI Figure 5 - Test d’inhibition des DRO
Figure 6 – Effet des inhibiteurs des DRO sur la formation des GS
Figure 7 - L’abondance physiologique d’HRI semble moduler la phosphorylation du
facteur eIF2 α et la mort cellulaire en condition de traitement au Bortezomib
Figure 8 - Une lignée déplétée en protéine HRI de manière stable présente une
phosphorylation d’eIF2 α significativement plus faible et une absence d’induction des GS en condition de traitement au Bortezomib
Figure 9 - La déplétion de protéine HRI sensibilise les cellules cancéreuses à la mort cellulaire suite à un traitement de Bortezomib
Figure 10 - Une surexpression de la protéine GFP-HRI induit GS, phénomène qui passe
par la voie de phosphorylation du facteur eIF2α
Figure 11 - La protéine GFP-HRI se localise dans de petits granules et cette localisation ne semble pas être affectée par un stress oxydatif à l’Arsenite
Figure 12 - La surexpression de protéine GFP-HRI ne semble pas affecter la phosphorylation du facteur eIF2 α en condition de stress
Figure 13 - L’injection in ovo de la lignée cellulaire déplétée de manière stable en HRI, shRNA-HRI, provoque une diminution de croissance tumorale significative et ce, sans traitement de Bortezomib
Figure 14 - Immunoprécipitations sur des lysats cellulaires de cellules HeLa surexprimant la protéine GFP-HRI
Figure 15 - Résumé de la voie fonctionnelle d’HRI mise en lumière durant mon projet de
LISTE DES ABRÉVIATIONS
APS Persulfate d’ammonium
ARNm Acide ribonucléique messager
Ars Arsenite
BSA Albumine sérique de bovin (bovine serum
albumin)
Bz Bortezomib
CsCl Chlorure de césium
DAPI Dihydrochlorure de 4’,6-diamidino-2-phenylindole
DMEM Dulbecco's Modified Eagle Medium
DRO Dérivé réactif de l’oxygène
EDTA Acide éthylène diamine triacétique
eIF Facteur d’initiation eucaryote (eukaryotic initiation
factor)
EIF2AK1 Eukaryotic Initiation Factor 2 α Kinase 1 (HRI)
FBS Sérum de fétus bovin (foetal bovine serum)
FCCP Carbonyl cyanide
p-trifluoromethoxyphenylhydrazone
FMRP Protéine responsable du syndrome du X fragile
(Fragile X mental retardation protéine)
FXRP Groupe de protéine apparenté à FMRP comprenant
FMRP
FXR1P et FXR2P (Fragile X related proteins)
G3BP Protéine marqueur de GS (Ras GTPase-activating
protein-binding protein 1)
GS Granules de stress
hnRNP RNP nucléaire hétérogène (heterogeneous nuclear RNP)
hsp Protéine de stress thermique (heat shock protein)
HRI Heme Regulated Kinase (EIF2AK1)
IEF Focalisation isoélectrique (isoelectric focussing)
kDa Kilo Dalton (103 Dalton)
M Molaire (mol/litre)
mA Milli ampère (10-3 ampère)
Met-tRNAiMet Aminoacyle méthionyl-ARNt initiateur
MgCl2 Chlorure de magnésium
Min Minute
mM Milli molaire (10-3 mol/litre)
mRNP Particule ribonucléoprotéique messagère
Na2HPO4 Phosphate de sodium dibasique
NAC N’acétylcystéine
NaCl Chlorure de sodium
NaH2PO4 Phosphate de sodium monobasique
NaOH Hydroxyde de sodium
NP-40 Nonidet P40
p/v Poid/volume
PBS Solution saline tamponnée au phosphate
(phosphate buffered saline)
PM Poids moléculaire
RNP Ribonucléoprotéine
RPM Rotation par minute
SDS Dodécyle sulfate de sodium
shRNA small hairpin RNA
siRNA small interfering RNA
TCA Acide tri-chloro acétique
V Volts
Remerciements
Je voudrais d’abord et bien sûr remercier de l’accueil et du support reçu tout au long de ma maîtrise mon directeur de recherche, le Dr. Rachid Mazroui. Il a su me transmettre sa passion pour la recherche tout au long des *presque* 4 années passées au sein de son laboratoire. Je suis également très reconnaissant de son accessibilité presque continue pour répondre à mes questions et planifier mes expériences, chose qui se fait rare dans le domaine de la recherche! Je remercie également le Dr. Yves Labelle dont la porte était toujours ouverte pour répondre à mes questions et alimenter de bonnes discussions à propos de tout et de rien. Finalement, je remercie nos deux professionnelles de recherche, Marie-Josée Fournier et Christine Filion, les deux personnes ressources du laboratoire qui avaient toujours réponse à tout concernant les problèmes de manip. Je ne doute aucunement que leurs expériences cumulées dépassent de loin le contenu d’un cours à l’Université!
Je remercie également mes collègues étudiants, Sophie Mokas, Cristina Gareau, Laétitia Coudert, Samia Mellaoui, Charles Gaulin et Andréanne Savard qui ont toujours été présents lors des moments les plus heureux, mais également les plus difficiles. Malgré la petitesse du Centre de Recherche de St-François d’Assise, vous avez su égayer et mettre de la vie dans mes journées tout au long de mes deux années de maîtrise. Un merci particulier aussi à Cristina et Laétitia pour m’avoir accompagné lors de nos happy hour films interminables et de folies les vendredi soirs!
Bref, je garderai d’excellents souvenirs de mes années passées au sein du laboratoire Mazroui.
1.1 Mise en contexte
Lors de cancer, l'exposition des patients aux traitements chimiques ou radiations peut induire les cellules cancéreuses à mobiliser un mécanisme de défense. Ceci permet donc à ces cellules de résister au traitement et de continuer à croître. La résistance des cellules cancéreuses est l'un des principaux obstacles dans le traitement des patients atteints de cancer. Pour cette raison, une importante partie de la recherche actuelle se consacre à mettre en lumière ces mécanismes de résistance et à trouver des moyens de les contrer. Dans cette perspective, mon laboratoire d’accueil a ainsi déjà révélé l'activation de l’Heme-Regulated Inhibitor Kinase (HRI; aussi connue sous l’appellation EIF2AK1) comme un mécanisme potentiellement impliqué dans la chimiorésistance (Gareau C. et al, 2010).
HRI est une kinase de stress connue pour inhiber l'initiation de traduction en induisant la phosphorylation du facteur de l’initiation de la traduction eIF2α (Wek, R. et al., 2006). La phosphorylation du facteur eIF2α se produit en réponse à diverses conditions de stress incluant l'hypoxie, le rayonnement, l'infection virale, et les traitements médicamenteux anti-cancer. Dépendamment du type de stress, la phosphorylation d’eIF2a peut soit favoriser ou au contraire entraver les voies cellulaires apoptotiques engendrées par le stress (Holcik, M. et al, 2005). Le rôle pro-apoptotique de la version phosphorylée du facteur eIF2α est attribué à l'induction de la voie ATF4-CHOP (Wek, R. et al., 2006) ainsi qu’à une inhibition de la traduction de protéines de survie, telle que Bcl-XL (Mounir, Z. et al, 2009). De l’autre côté, les propriétés de survie de phospho-eIF2α sont d’une part médiées par l'activation de la voie PI3K-PKB-mTOR, activation qui corrèle avec le taux de phosphorylation d’eIF2α et induit la phosphorylation de S6 et de 4E-BP1 (Kazemi, S. et al, 2007). Cette survie est également liée à l’induction du facteur de transcription NF-kB, causée par la diminution de traduction générale engendrée suite à la phosphorylation d’eIF2α (Wek, R. et al., 2006). Finalement, la dégradation par le protéasome de protéines suppresseur de tumeur, par
exemple, p53 qui est exportée du noyau suite à l’induction de GSK-3 par phospho-eIF2α (Baltzis, D. et al, 2007), inhibe également l’apoptose. De façon intéressante, la phosphorylation du facteur eIF2α favorise également la survie des cellules cancéreuses en déclenchant la formation de granules de stress; corps cytoplasmiques de repression de la traduction d'ARN et dont la formation est connue pour antagoniser l'apoptose (Arimoto, K. et al, 2008, Gareau, C. et al, 2009, Kim, W. J. et al, 2005, Moeller, B. J. et al, 2004). Dans cette idéologie, il semble donc intéressant d’étudier plus en détail les fonctions de la protéine HRI (kinase phosphorylant le facteur eIF2α) associées au phénomène de résistance cellulaire observée lors de traitement chimiothérapeutique.
1.2 Initiation de la traduction
Chez les eucaryotes, l’ARNm mature est traduit au cours de trois étapes successives et distinctes : l’initiation, l’élongation et la terminaison. L’initiation de la traduction est l’étape limitante de la traduction et elle est donc hautement régulée (Marintchev et Wagner, 2004). Une régulation de la synthèse protéique est essentielle au maintien de l’homéostasie cellulaire ou pour simplement permettre à la cellule de survivre à des conditions difficiles. Cette régulation se déroule principalement pendant l’initiation de la traduction, où le sort des ARNm est déterminé.
L’initiation de la traduction est subdivisée en différentes étapes catalysées par les eIFs (Pain VM, 1996). La première étape consiste en la formation du complexe ternaire (CT) (Figure 1). L’assemblage du CT implique le recrutement d’une molécule de GTP et d’un aminoacyle méthionyl-ARNt initiateur (Met-tRNAiMet) par le facteur eIF2 (Pain VM, 1996). Sous sa forme inactive, ce facteur est porteur d'un GDP, coenzyme hydrolysée au cours de la phase d’initiation ultérieure. Le facteur échangeur du nucléotide guanidine (eIF2B) substitue un GTP à ce GDP. Le facteur eIF2 activé peut alors lier l’ARNt chargé d'une méthionine dont l'anticodon est complémentaire au codon d'initiation (AUG) de l’ARNm. Le CT résultant, eIF2-GTP- Met-tRNAiMet, est ensuite recruté lors de la deuxième étape de l’initiation de la traduction au niveau de la sous-unité
ribosomale 40S à l’aide des facteurs eIF3, eIF5 (Das et al., 1997; Asano, 1999) et eIF1A pour former le complexe de pré-initiation 43S. L’étape suivante est le recrutement du complexe de pré-initiation 43S à l’ARNm, impliquant les facteurs eIF4F and eIF3, résultant en la formation du complexe d’initiation 48S. Les sous-unités 60S sont ensuite recrutées pour former le ribosome 80S compétent pour la traduction.
Figure 1 – L’initiation de la traduction chez les eucaryotes. Les 3 étapes de l’initiation de la traduction; (1) la formation du complexe ternaire (CT) et du complexe de pré-initiation 43S; (2) la formation du complexe de pré-initiation 48S; et (3) la formation du ribosome fonctionnel 80S. (Figure adaptée de Pain, VM, 1996)
1.2.1 Régulation de l’initiation de la traduction en condition de
stress
Lorsqu'elles sont exposées à un stress environnemental ou pathologique (par exemple un choc thermique, stress oxydatif, les radiations UV, les infections virales, etc), les cellules activent rapidement des voies générant une réponse coordonnée impliquant une modulation de la traduction de l'ARNm, qui confère une protection contre les dommages induits par le stress et favorise leur survie. Un des mécanismes les plus caractérisés survenant lors de stress est l’inhibition de l’initiation de la traduction cellulaire (Wek RC. et al, 2006). Cette inhibition de l’initiation de la traduction est largement due à la phosphorylation d’eIF2α (Holcik M. et al, 2005). Chez les métazoaires, eIF2α est connu pour être spécifiquement phosphorylée au niveau de la serine 51 par au moins quatre kinases qui s’activent en réponse aux stress (Wek RC. et al, 2006). La PKR est principalement activée par une infection virale; la protéine kinase Receptor-like Endoplasmic Reticulum Kinase (PERK) est activée surtout lors d'un stress du réticulum endoplasmique; la kinase GCN2 est une protéine sensible aux niveaux d’acides aminés intracellulaires et qui répond également à la privation en acides aminés et à l'inhibition du protéasome; et enfin HRI est activée par le stress osmotique, le choc thermique et le stress oxydatif produit par l'Arsenite (Figure 2). Comme énoncé plus haut, dans des conditions normales de croissance, la forme non-phosphorylée eIF2 s’associe à l’initiateur Met-tRNAiMet (aminoacyle méthionyl-ARNt initiateur) et au GTP, et participe à la sélection ribosomale du codon d'initiation. En prélude à la réunion des petites et grandes sous-unités ribosomales, le GTP complexé avec le facteur eIF2 est hydrolysé en GDP, et eIF2-GDP est libéré de la machinerie traductionnelle. Le facteur eIF2 lié au GDP est recyclé à la forme active eIF2-GTP grâce à une réaction catalysée par le Guanine Nucleotide-Exchange Factor, eIF2B. La phosphorylation induite par le stress du facteur eIF2 sur la sérine 51 change ce facteur de traduction de substrat à inhibiteur d’eIF2B. Comme les niveaux intracellulaires d’eIF2B sont d'environ 10-20 % de ceux d’eIF2 dans le cytoplasme, la phosphorylation d'aussi peu que 10 % des eIF2α peut être suffisante pour séquestrer la quasi-totalité d’eIF2B disponible, ce qui bloque l'activité
d'échange nucléotidique d’eIF2B. Ce phénomène induit la formation de complexes d’initiation de la traduction incomplets et donc, inactifs. L'accumulation de ces complexes inactifs est supposée comme élément favorisant la formation de granules de stress (Anderson P. et al, 2002, Anderson P. et al, 2008, Buchan JR. et al, 2009).
PKR
Infection virales
PERK/ PEK GCN2 HRI
Stress réticulum endoplasmique Stress réticulum endoplasmique, inhibition protéasome (MG132) Stress oxydatif, inhibition du protéasome eIF2α-P eIF2B eIF2-GDP eIF2-GTP +Pi Met-tRNAi eIF2-GTP-Met-tRNAiMet
40S
43S
TRADUCTIONFigure 2 – Les 4 kinases phosphorylant le facteur eIF2α et leurs stress respectifs. Les kinases PKR, PERK/PEK, GCN2 et HRI sont activées lors de différents stress physiologiques et phosphorylent eIF2α. Cette forme phosphorylée séquestre le facteur eIF2B et cause une inhibition de la traduction. (Figure adaptée de Wek et al., 2006)
1.3 La répression de la traduction et les granules de stress
Les granules de stress sont des granules cytoplasmiques denses contenant des ribonucléoprotéines associées à des molécules d’ARN (RNP), sans membrane et insolubles aux détergents non-ioniques (Mazroui et al., 2002). Dû au fait que leur isolation n’a pas encore été réussie, leur caractérisation résulte essentiellement d’observations par microscopie à fluorescence associées à une colocalisation de marqueurs connus des GS. Deux de ces marqueurs ont été utilisés dans le cadre de mes travaux, à savoir la protéine de liaison à l’ARN impliquée dans la régulation de la traduction, fragile X mental retardation protein (FMRP) (Mazroui et al., 2002) et RasGAP-associated endoribonuclease (G3BP), impliquée pour sa part dans la stabilité et la régulation de la traduction des ARN (Tourrière et al., 2003). La formation de GS est associée à la survie cellulaire ainsi qu’à la résistance des tumeurs à la radiothérapie (Moeller et al., 2004; McEwen et al., 2005; Anderson et Kedersha, 2006; Kwon et al., 2007). Leur induction semble être un mécanisme de réponse au stress conservé à travers les espèces. Initialement identifiées dans des cellules de plantes soumises à un choc thermique (Nover et al., 1983; Nover et al., 1989), les GS sont également formées dans des cellules de mammifères (Arrigo et al., 1988). Il est aussi possible d’observer des GS chez les levures Saccharomyces cerevisiae (Buchan et al., 2008; Grousl et al., 2009) et Saccharomyces pombe (Dunand-Sauthier I et al., 2002), le protozoaire Trypanosoma brucei (Kramer et al., 2008), le métazoaire Caenorhabditis elegans (Jud MC et al., 2008) et Drosophila melanogaster (Farny et al., 2009) ainsi que les chloroplastes de plante (Uniacke et Zerges, 2008).
L’induction des granules de stress se produit généralement à l’intérieur de cellules subissant un stress connu comme causant une diminution générale du taux d’initiation de la traduction (Kedersha et al., 1999). D’ailleurs, l’administration de drogues qui bloquent l’initiation de la traduction (Dang et al., 2006; Mazroui et al., 2006; Mokas et al., 2009) et la déplétion de facteurs d’initiation de la traduction spécifiques tel eIF4A (Mazroui 2007), eIF4B, eIF4H et PABP (Mokas et al., 2009) induisent également la formation de
GS, en absence de stress. Ceci démontre que la formation des GS est fonctionelement liée à l’inhibition de l’initiation de la traduction. En outre, la surexpression de protéines de liaison à l’ARN qui répriment la traduction provoque aussi la formation de GS (Mazroui et al., 2002; Gilks et al., 2004; Kedersha et al., 2005; Wilczynska et al., 2005; de Leeuw et al., 2007). Par contre, l’inactivation de certains facteurs l’initiation de la traduction tel l’eIF3 (Ohn et al., 2008) ou eIF4E, ainsi que l’entrave pharmacologique à la liaison du 60S (Mokas et al., 2009) n’induisent pas de GS. Ainsi, l’induction des GS ne serait possible qu’en inhibant l’initiation de la traduction à un stade bien précis et certains facteurs de l’initiation sont susceptibles d’être nécessaires à l’assemblage de GS.
En conditions de stress, les ARNm non traduits s’accumulent à l’intérieur de GS sous forme de RNP où ils seront protégés de la dégradation (Anderson et Kedersha, 2002, 2006; Stohr et al., 2006, Gareau et al., 2011). Ces granules à RNP sont des structures denses, plus au moins globulaires, sans membrane évidente (Collier et al., 1988) et de taille hétérogène (1-2μm). Lorsque le stress se prolonge, les GS fusionnent et leur taille augmente (Collier et al., 1988; Kedersha et al., 2000; Ivanov et al., 2003), laissant penser à une induction séquentielle. Les GS peuvent aussi se dissocier lors d’un stress prolongé (Bortezomib). Comme mentionné plus haut, la formation des GS lors de conditions de stress corrèle avec l’inhibition de l’initiation de la traduction. Cette inhibition générale de la traduction libèrerait des ribosomes pour la traduction rapide et efficace d’ARNm spécifiques dont les produits sont requis pour induire une résistance face au stress et ainsi assurer une survivre cellulaire. Ainsi, il semble donc exister un lien entre la formation des GS, les polysomes ainsi que les ribosomes libres. En effet, les inhibiteurs de la synthèse protéique qui stabilisent les polysomes, tels que l’émétine et la cycloheximide, semblent prévenir, voire supprimer la formation de GS. (Kedersha et al., 2000; Buchan et al., 2008). De plus, l’ajout d’émétine à des cellules déjà stressées provoque le désassemblage des GS préexistants et les inhibiteurs de la synthèse protéique qui déstabilisent les polysomes, tels que la puromycine, favorisent la formation des GS (Kedersha et al, 2000). Par contre, il n’est pas clair si le relâchement des RNP à partir des polysomes soit
des GS est un phénomène encore peu documenté et moins évident que leur assemblage, mais qui propose un retour à une physiologie cellulaire normale.
1.3.1 L’agent chemothérapeutique Bortezomib induit la formation
des granules de stress
Le protéasome est un gros complexe composé de plusieurs sous-unités et responsable de la dégradation des protéines, y compris les différents régulateurs du cycle cellulaire et des facteurs apoptotiques, par des mécanismes ubiquitine-dépendants et indépendants (Adams J. et al, 2004, Adams J. et al, 2004). Les inhibiteurs du protéasome sont connus pour induire l'apoptose dans les cellules en prolifération (Drexler HC. et al, 1997, Imajoh-Ohmi S. et al, 1995, Lopes UG. et al, 1997, Sloss CM. et al, 2008). Ainsi, l'inhibiteur de protéasome Bortezomib a été développé, est maintenant une drogue approuvée par la FDA pour le traitement des myélomes et autres tumeurs liquide (McConkey DJ. et al 2008, Richardson PG. et al, 2003, Richardson PG. et al, 2004, Richardson PG. et al, 2008, Sterz J. et al, 2008). Cependant, les tumeurs solides de différentes origines histologiques sont parfois réfractaires au traitement par Bortezomib, et cette résistance est également observée dans les lignées cellulaires cancéreuses issues de tumeurs solides in vitro (McConkey DJ. et al, 2008, Codony-Servat et al, 2006, Tang ZY et al, 2008, Rajkumar SV. et al, 2005). Pour expliquer ce phénomène, il a d’ailleurs été suggéré dans le passé que cette résistance passe par l'activation d'une réponse générale au stress (McConkey DJ. et al, 2008, Codoney-Servat J. et al, 2006, Tang ZY. et al, 2008, Rajkumar SV. et al, 2005).
Nous avons démontré in vitro qu’un traitement au Bortezomib engendre un état de stress induisant une réponse cellulaire de protection. En effet, des cellules traitées au Bortezomib présentent une inhibition de la traduction générale, accompagnée d’une induction de GS observés en immunofluorescence indirecte. Cette formation des GS corrèle avec la résistance des cellules cancéreuses au Bortezomib et semble se produire
selon les processus d’assemblage et de désassemblage des GS déjà décrits plus haut. De plus, nos investigations des mécanismes de formation des GS ont révélé HRI comme étant un facteur nécessaire pour la formation des GS en condition de Bortezomib. Par conséquent, la déplétion de HRI sensibilise les cellules cancéreuses à la mort cellulaire en réponse au Bortezomib, en partie en supprimant la formation des GS. (Fournier et al, 2010).
1.4 Fonctions et états d’activation de la protéine Heme Regulated
Kinase
La kinase HRI a largement été étudiée biochimiquement et a été initialement découverte chez les globules rouges. Ainsi, il est bien documenté que la synthèse des protéines dans des réticulocytes intacts et leurs lysats dépend de la disponibilité en hème. En condition de déficience en hème, l'inhibition de la synthèse des protéines béta globine corrèle avec l'activation de la kinase HRI (Clemens, 1996; Chen, 2000, Han et al., 2001). En effet, l’expression de protéines HRI dans des cellules d’insecte Sf9 provoque l'inhibition de la synthèse protéique globale. HRI contient deux sites distincts de liaison à l'hème. L’hème lié au domaine N-terminal est stable et co-purifie avec HRI jusqu'à homogénéité. En revanche, lorsque l'hème se lie au domaine d’insertion de la kinase de manière réversible, il inhibe l’activité de la kinase HRI, régulant ainsi l'activité d’HRI en fonction des concentrations intracellulaires d’hème (Chefalo et al, 1998, Rafie-Kolpin et al, 2000). Comme précédemment dit, la protéine HRI est essentiellement retrouvée dans les précurseurs des globules rouges sanguins. De plus, il a déjà été constaté que les niveaux d'ARNm d’HRI augmentent au cours de la différenciation érythroïde des cellules de souris érythroleucémique (MEL) (Crosby et al, 1994), suggérant indirectement le rôle important de cette protéine kinase dans les processus de régulation de l’expression génique. Cependant, si HRI est principalement exprimée chez les cellules érythroïdes, son ARNm, associé à une expression protéique, est aussi détecté dans les
cellules non érythroïdes (Berlanga et al, 1998). Ainsi, HRI semble également avoir un rôle dans les cellules non érythroïdes
1.5 États d’activation de la protéine Heme Regulated Kinase
La protéine HRI subit plusieurs étapes de stabilisation suite à sa traduction (Figure 3). En effet, la protéine nouvellement traduite et instable doit d’abord s’homodimériser pour ne pas être dégradée. Par la suite, cet homodimère s’énergise grâce à l’ATP, pour former l’espèce I, également nommée ProHRI. Ces deux dernières espèces de la protéine sont inactives et ne possèdent pas encore de rôles connus. En condition de stress oxydatif ou en absence d’hème, cette espèce I d’HRI s’autophosphoryle pour former l’espèce active, aussi nommée espèce II, et ainsi exécuter ses fonction d’inhibition de la traduction protéique (Bettina N. Bauer, et al, 2001). L’activation de HRI serait donc due à un changement conformationel imposé par le stress.
Figure 3 – Les différentes étapes d’activation de HRI. La protéine kinase HRI transite par plusieurs étapes avant d’être activée, dont une homodimérisation ainsi que plusieurs autophosphorylations séquencées (P et Pn). (Adapté de Bettina N. Bauer, et al, 2001)
Ainsi, les processus d’autophosphorylation sont essentiels pour la stabilisation et l’activation de la protéine kinase HRI. Plusieurs sites de phosphorylation tels que la sérine, la thréonine et la tyrosine ont d’ores et déjà été identifiés (Figure 4) (Rafie-Kolpin, et al, 2003). Ces multiples phosphorylations sont d’ailleurs la cause des différentes masses de la protéine observées en western blot selon en condition de stress. De plus, les expériences de mutagenèse ont mis en évidence deux acides aminés (K196, T485) comme étant essentiels pour les processus d’autophosphorylation, (Bettina N. Bauer, et al, 2001). Ainsi, l’étude et la comparaison des espèces différemment phosphorylées de la protéine kinase HRI en immunobuvardage renseignent directement sur l’état de stabilité et d’activation de la protéine dépendant des conditions appliquées aux cellules.
1.5 Objectifs de recherche
Mes objectifs de maîtrise initialement établis pouvaient se résumer par l’étude de la régulation et des fonctions de la protéine kinase HRI dans le contexte de la
Figure 4 – Les différents sites d’autophosphorylation de la protéine kinase HRI. La kinase HRI possède plusieurs sites connus d’autophosphorylation. De plus, deux sites sont essentiels aux processus d’autophosphorylation (flèches). (Adapté de Igarashi, J. et al, 2011)
caractéristiques de la protéine, en commençant par l’établissement de ce qui active HRI en condition de Bortezomib.
Ensuite, en considérant qu’un traitement au Bortezomib induit la formation de granules de stress dépendamment de la protéine HRI, je m’attarderai ensuite à étudier l’effet de l’altération des niveaux d’expression protéique de HRI sur l’efficacité de résistance cellulaire face à un traitement de Bortezomib. J’ai répondu à cette question de trois manières : 1) en utilisant des lignées cellulaires dont le niveau d’expression d’HRI diverge, 2) en inhibant artificiellement l’expression endogène d’une lignée résistante grâce à la création d’une lignée stable shRNA-HRI et 3) en observant l’effet d’une surexpression transitoire de la construction GFP-HRI chez les cellules cancéreuses.
Afin de valider les résultats obtenus in vitro, j’ai finalement procédé à une injection in ovo de la lignée cellulaire déplétée de manière stable en protéine HRI (shRNA-HRI), pour évaluer si l’expression inhibée de protéines HRI corrèle avec une plus faible résistance de la tumeur ainsi engendrée face à un traitement d’inhibition du protéasome par Bortezomib.
2.1 Lignées cellulaires et culture
Les cellules Mouse Embryonic Fibroblast (MEF), la lignée MEF présentant une variante mutée de la protéine eIF2α qui ne peut être phosphorylée, eIF2αS51A/S51A (EIF2AA) (Scheuner et al. 2001), les cellules de cancer du sein MCF-7 et Hs 578T, ainsi que les cellules de cancer cervical HeLa ont été cultivées dans du Dulbecco's Modified Eagle Medium (DMEM – Sigma-Aldrich) additionné de 10 % (v/v) de sérum fétal bovin (FBS - Sigma-Aldrich). Le milieu est également supplémenté en pénicilline (100 Unités/ml) et en streptomycine (50 μg/ml) (Sigma-Aldrich) afin de diminuer les risques de contamination bactérienne. Les cellules ont été cultivées dans des incubateurs à 37°C et 5 % de CO2. Les lignées cellulaires ont été passées 2 fois par semaine en les décollant avec de la trypsine (500 ng/ml) (GIBCO by life technologies) et en les diluant 1:10. Les cellules ont subi un maximum de 10 cycles de passage après décongélation.
2.2 Drogues et traitements
Les cellules sont d’abord lavées deux fois avec du PBS et sont ensuite traitées dans du milieu DMEM, selon les concentrations indiquées pour chacune des drogues. Les traitements s’effectuent dans un incubateur à 37oC, 5 % de CO2, selon les concentrations et temps de traitement suivants : Arsenite (Ars; 0,5mM, 0.5 h), Boretzomib (Bz; 2uM, 4 h) (LC Laboratories). Les traitements inhibiteurs de Dérivés Réactifs de l’Oxygène (DRO) se sont effectués avec le N-acétylcystéine (NAC) (Sigma-Aldrich) à raison de 50 mM pendant une période de 2 h de prétraitement. Les drogues inductrices d’activation d’HRI (Ars et Bz) étaient ensuite ajoutées directement dans le milieu. Après traitement, les cellules sont lavées deux fois avec du PBS et sont soit fixées, soit récoltées, dépendant de l’expérience en cours. L’agent de sélection pour les clones stables shRNA, G418 (GIBCO by life technologies), était ajouté, à une concentration de 1ug/ml pour sélectionner les cellules transfectées et 0,5 ug/ml pour le roulement des clones
sélectionnés, dans le milieu DMEM supplémenté. La culture de ces lignées stables était, après le processus de sélection, similaire à celle des lignées normales.
2.3 Microscopie à fluorescence
Les cellules ont été cultivées sur des lamelles de verres stériles de 18 x 18 mm et traitées selon les besoins. Les cellules ont été fixées dans une solution d'Acétone: Méthanol (7:3) durant 20 min à –20 °C. Les lamelles ont ensuite été séchées à l'air libre et hydratées dans du PBS. On commence d’abord par bloquer une demi-heure dans une solution de FBS 5 %. On effectue alors 3 lavages de 5 minutes dans du PBS-Tween 0,1 %, et les lamelles sont ensuite recouvertes d'une solution contenant les anticorps primaires dilués dans du FBS 1 % pendant 1 h 30 à TP. Les lamelles ont ensuite été lavées 3 fois 5 min dans du PBS-Tween 0,1 % à température pièce puis incubées 1 heure dans une dilution appropriée de l’anticorps secondaire (Tableau 1). Les noyaux sont ensuite coloré dans une solution de DAPI (50 ng/ml) (Sigma-Aldrich) dilué dans du PBS-Tween 0,1 % pendant 2 minutes puis les lamelles ont été relavées deux fois. L’excès de liquide a été retiré des lamelles et ces dernières ont été déposées inversées sur des lames de verre de manière à ce que les cellules baignent dans une petite quantité de solution protectrice (Vectashield) (Vector Laboratories inc.). Les lamelles ont finalement été scellées aux lames avec du vernis à ongle.
Les cellules ont ensuite été visualisées à l’aide d’un microscope confocal à fluorescence ZEISS en utilisant un objectif à immersion dans l’huile de 40X ou 63X. Les images sont ensuite adaptées pour présentation dans Adobe Photoshop CS5®.
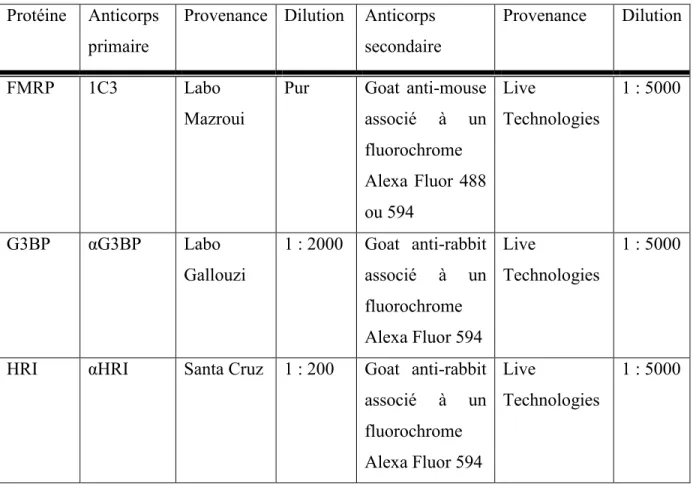
Tableau 1 – Caractéristiques des anticorps utilisés en immunofluorescence indirecte Protéine Anticorps
primaire
Provenance Dilution Anticorps secondaire
Provenance Dilution
FMRP 1C3 Labo
Mazroui
Pur Goat anti-mouse associé à un fluorochrome Alexa Fluor 488 ou 594 Live Technologies 1 : 5000 G3BP αG3BP Labo Gallouzi 1 : 2000 Goat anti-rabbit associé à un fluorochrome Alexa Fluor 594 Live Technologies 1 : 5000
HRI αHRI Santa Cruz 1 : 200 Goat anti-rabbit associé à un fluorochrome Alexa Fluor 594 Live Technologies 1 : 5000
2.5.1 Imagerie en temps réel
Les galeries photos en temps réel de cellules surexprimant GFP-HRI ont été réalisées de la manière qui suit. D’abord, les cellules ont été portées à une confluence de 70% dans des pétris de 3 cm à fond de verre (MatTek Corporation), pour être ensuite transfectées avec les constructions désirées selon le protocole de transfection standard (QUIAGEN). Après 24h, les cellules ont été lavées, recouverte de milieu de culture et observées en chambre de culture contrôlée, sous microscope. Des photos ont ensuite été prises à intervalle de 2 minutes et mises en mosaïque pour réaliser la galerie photo.
2.4 Analyses des protéines sur gel de polyacrylamide
2.4.1 Séparation en gel 1 dimension
Les échantillons de lysats cellulaires sont d’abord récoltés et solubilisés dans du tampon de Laemmli sample buffer 2X (100 mM Tris-HCl pH 6,8, 4 % (p/v) SDS, 0,2 % (p/v) Bromophenol Blue, 20 % (v/v) Glycérol, 200 mM DTT, 200 mM β-mercaptoéthanol), chauffés à 100oC pendant 5 minutes et passés à la seringue pour optimiser la lyse. On dépose ensuite chaque échantillon dans les puits d’un gel de condensation(5 % (4,95 % (p/v) acrylamide, 0,07 % (p/v) bis-acrylamide, 130 mM Tris pH 6,8, 0,1 % (p/v) SDS, 0,1 % (v/v) TEMED, 0,05 % (p/v) APS), qui chevauche un gel de resolution (12 % (11,46 % (p/v) acrylamide, 0,54 % (p/v) bis-acrylamide, 390 mM Tris pH 8,8, 0,1 % (p/v) SDS, 0,08 % (v/v) TEMED, 0,05 % APS). Les échantillons ont ensuite migré dans une solution de tampon d’électrophorèse (25 mM Tris-Base, 250 mM Glycine, 0,1 % (p/v) SDS) à un courant de 20 mA/gel de 1,5 mm et ce, pendant 2 h 30, permettant ainsi de séparer les protéines selon leur poids moléculaire.
2.4.2 Coloration des protéines au bleu de Coomassie
Une fois les échantillons migrés, on immerge le gel de polyacrylamide dans une solution de bleu de Coomassie (0,25 % (p/v) Coomassie Brillant Blue R-250, 4 % (v/v) méthanol, 10 % (v/v) acide acétique) pendant 60 minutes. On effectue ensuite plusieurs lavages successifs dans une solution de décoloration (45 % (v/v) méthanol, 10 % (v/v) acide acétique) jusqu’à obtention d’un gel transparent contrasté de bandes protéiques. On réhydrate finalement le gel avec de l’eau qu’on fixe ensuite sur papier buvard en faisant sécher grâce à un séchoir BioRad (modèle 583) à 85oC pendant 2 heures.
2.4.3 Immunobuvardage
Après migration, le gel de polyacrylamide est déposé sur membrane de nitrocellulose 0,45 μm (BioRad) dans un tampon de transfert (48 mM Tris base, 39 mM glycine, 20 % (v/v) méthanol, 0,0375 % (p/v) SDS) et est soumis à un courant de 100 mA toute la nuit afin de permettre le transfert des protéines.
Les protéines maintenant transférées et fixées sur la membrane de nitrocellulose sont ensuite colorées grâce à une solution de Rouge Ponceau S (0,5 % (p/v) Ponceau S, 1 % (v/v) acide acétique) pendant 5 minutes par souci de vérification de quantité et de qualité de transfert. La membrane est ensuite rincée avec de l’eau et immergée dans une solution de blocage (5 % (p/v) lait en poudre écrémé, 0,1 % (v/v) Tween 20, PBS) pendant 30 minutes. Suivant 3 lavages de 5 minutes dans une solution de lavage PBS-Tween 20 (0,1 % (v/v) PBS-Tween 20, PBS), la membrane est ensuite incubée pendant 1 h 30 avec l’anticorps primaire dilué dans une solution de blocage (Tableau 2). S’ensuivent 3 lavages de 5 minutes sont effectués grâce à la solution de lavage et l’anticorps secondaire est ensuite ajouté pour une incubation de 1 heure. La membrane est finalement lavée encore une fois à 3 reprises et l’anticorps secondaire est révélé avec une trousse de chemiluminescence ECL (PerkinElmer) et la membrane est exposée à un film Fujifilm 100NIF.
Tableau 2 – Caractéristiques des anticorps utilisés en western blot Protéine Anticorps
primaire
Provenance Dilution Anticorps secondaire
Provenance Dilution
HRI αHRI Santa Cruz 1 : 1000
HRP-GAR
Jackson 1 : 15000
EIF2α αEIF2α Cell
signaling (NEB)
1 : 1000 HRP-GAR
Jackson 1 : 15000
p-EIF2α αp-EIF2α Cell signaling (NEB)
1 : 500 HRP-GAR
Jackson 1 : 15000
Tubuline αTubuline Abcam 1 : 10000 HRP-GAM Jackson 1 : 5000 t-GFP αt-GFP ORIGENE 1 : 2000 HRP-GAM Jackson 1 : 5000
2.5 Surexpression protéique
Les surexpressions protéiques ont été réalisées de manière transitoire grâce au kit de transfection Effectene® de QUIAGEN. Les cellules sont d’abord cultivées jusqu’à une confluence de 70 %; le complexe de transfection/ADN est ajouté au milieu de culture pendant 24 heures. Les cellules sont ensuite lavées et supplémentées avec du milieu frais pour 24 autres heures et finalement récoltées ou fixées selon l’expérience. Les vecteurs plasmidiques utilisés ont été commandés chez ORIGENE et amplifiés grâce au kit QIAfilter Plasmid Midi Kit de QUIAGEN.
2.6 Réalisation de lignées stables exprimant des shRNA
Le même protocole de transfection transitoire est réalisé en utilisant les plasmides shRNA du kit HuSH™ commandés chez ORIGENE. Après 24 heures, la drogue de sélection (puromycine) est ajoutée au milieu selon la concentration normalement létale précédemment établie (1ug/ml). Cette concentration a été établie en réalisant une courbe de survie cellulaire. Ainsi, j’ai appliqué à plusieurs populations cellulaires différentes concentrations de puromycine et après avoir observé la mort cellulaire après 24 heures, j’ai pu établir la concentration létale de la drogue pour cette période de temps. Le milieu supplémenté de la drogue est changé tous les deux jours et ce, jusqu’à l’obtention de clones bien définis et visibles à l’œil, exprimant de fait et de manière stable le plasmide shRNA. Chaque clone ayant résisté au traitement létal de puromycine est considéré comme ayant acquis le gène de résistance associé à la construction HuSH™ et est ensuite repiqué un à un grâce à une micropipette. Ces clones sont cultivés de manière indépendante afin d’obtenir différentes populations uniques et ce, dans un milieu supplémenté de la drogue de sélection, mais à demi-concentration (0,5ug/ml). Un criblage de chacun des clones en western blot est ensuite effectué afin de vérifier l’efficacité de déplétion. Les clones présentant les meilleures déplétions sont conservés.
2.7 Cytométrie en flux
Les cellules sont d’abord cultivées en pétris de 10 cm, amenées à une confluence de 80% et traitées ou non selon le cas. Le surnageant (SN) est gardées à 4oC dans un Falcon, le pétris est lavé avec 5 ml de PBS et cette solution de lavage est ajouté au SN. On ajoute 0,5 ml de trypsine à 37oC pendant 5 à 10 minutes, pour ensuite y ajouter 2,5 ml de milieu DMEM et transvider le tout dans un nouveau Falcon. On centrifuge 5 à 10 minutes à 1000 RPM (TP), lave le culot avec 2,5 ml de PBS froid et recentrifuge. On relave le culot avec 1 ml de PBS froid, transfère dans un eppendorf et centrifuge 5 minutes à 1000 RPM en chambre froide. On ressuspend ensuite ce culot dans 500 µl de
1X binding buffer (10 mM HEPES/NaOH, pH 7.4, 140 mM NaCl, 2.5 mM CaCl2) pour finalement transférer le tout dans une collection de tubes FACS (Fluorescence-activated cell sorting – cytométrie en flux).
Pour la condition non traitée (calibration de l’appareil), le protocole suivant est suivi : a- 100l de notre suspension cellulaire (sans additifs),
b-100l de notre suspension cellulaire + 4l PI,
c-100l de notre suspension cellulaire + 4l Annexin V, d-100l de notre suspension cellulaire + 4l PI+4l Annexin V Et pour les échantillons expérimentaux :
e-100l de notre suspension cellulaire + 4l PI+4l Annexin V
On mélange délicatement les échantillons et incube 15 minutes à TP dans le noir. On met dans la glace, ajoute 400 µl de 1X binding buffer et fermons à l’aide d’un bouchon. On apporte ensuite le tout sur glace à la plateforme de cytométrie.
2.8 Immunoprécipitations
Les cellules sont cultivées jusqu’à 80 %, traitées par différentes drogues si l’expérience le nécessite et récoltées dans un tampon de lyse (50 mM Tris pH 7,4, 150 mM NaCl, 1 mM MgCl2, 0,5 % (v/v) NP-40; Au moment de la manipulation, on ajoute à 10 ml de cette solution : 200 mM PMSF, 0,5 mM DTT, ¼ de tablette d’inhibiteur de protéase, 40U/μl RNase inhibiteur). On passe ensuite les échantillons à la seringue pour optimiser la lyse.
Les billes de protéine A sépharose sont réhydratées dans du PBS pendant 30 minutes sur glace. On lave par la suite les billes et les resuspend dans un tampon de garde (50 mM Tris pH 7,4, 150 mM NaCl, 1 mM MgCl2, 0,5 % (v/v) NP-40). On couple ensuite ces billes avec les anticorps désirés pendant une nuit à 4oC sur tige rotatrice.
On prélève d’abord 1/100 de chacun des échantillons pour analyse protéique (Total). On élimine ensuite les débris cellulaires/matrice en effectuant une centrifugation 15 minutes à 10 000 RPM à 4oC et on récolte à nouveau 1/100 pour analyse protéique (Surnageant). Les échantillons sont incubés avec les anticorps précédemment couplés aux billes pendant 2 heures à température pièce sur tige rotatrice. On centrifuge les échantillons 5 minutes, 3000 RPM à 4oC et récoltons 1/100 du surnageant pour analyse protéine (non retenu). Le reste du surnageant est jeté, le culot est lavé à trois reprise avec du tampon de lyse et resuspendu dans du tampon Laemlli 2X.
2.9 Interférence à l’ARN transitoire
Les siARNs utilisés ont été achetés chez Dharmacon. Les cellules ont d’abord été amenées à une confluence de 80 % et ont ensuite été transfectées avec les siARN désirés grâce au Kit Hiperfect® de QUIAGEN selon le protocole fournit avec le kit. Les duplexes de transfection ont été utilisés à une concentration de 10 nM. Les cellules ont ensuite été fixées ou récoltées selon le but des expériences.
2.10 Injection in ovo (Chick Chorioallantoic Membrane Assay)
Le test par injection sur la membrane chorioallantoique de fœtus de poulet permet d’étudier les réalités de développement cellulaire in vivo (in ovo) et de les comparer aux résultats obtenus in vitro. Dans notre cas, ces études portaient bien évidemment sur le développement tumoral. Ainsi, nos cellules déplétées de manière stable en protéine HRI (shRNA-HRI) ont d’abord été cultivées in vitro. Parallèlement, des œufs d’embryons de poulet âgés de 10 jours ont subi une montée de la poche d’air interne à même la paroi supérieure de l’œuf. Une fenêtre y a alors été créée par retrait de la coquille, qui découvrait ainsi sous la poche d’air la membrane chorioallantoique du fœtus. Des suspensions cellulaires des lignées shRNA (shRNA-HRI et contrôle) étaient ensuite réalisée suivant une concentration cellulaire connue et équivalente et étaient ensuite
déposées grâce à une seringue sur diverses membrane chorioallantoique. Des masses tumorales étaient alors créées et après 7 jours d’incubation, les fœtus étaient sacrifiés, les tumeurs prélevées, pesées et comparées à des fins d’analyse. Les injections in ovo des cellules issues des lignées cellulaires shRNA ont été réalisées en collaboration avec le personnel du laboratoire du Dr. Gaudreault, qui possède l’expertise nécessaire pour de telles expériences.
Des expériences d’optimisation de la concentration de Bortezomib ont aussi été réalisées. Ainsi, en sachant qu’en clinique, on utilise environ 0,5 mg à 1 mg/kg, (Monique et al, 2009) nous avons d’abord calculé qu’un œuf fait en moyenne 75 g avec 2 ml de sang qui le parcourt. De plus, on désire injecter un volume de drogue de 100uL dans notre œuf. Ainsi, nous avons commencé avec une concentration de 0.5 mg/kg, soit 37.5 ug/œuf pour ensuite évaluer l’optimum effecteur (la concentration inférieure à la limite létale) à 80 ng/œuf, soit une concentration finale de 1 uM de Bortezomib. Cette concentration établit permettra la poursuite du projet.
3.1 Régulation, activation et fonctions de la protéine HRI
Pour mettre en lumière le rôle de la protéine HRI dans la voie de résistance cellulaire face au stress, il est important d’étudier les caractéristiques de celle-ci. Ainsi, lors de ma maîtrise, j’ai pu m’attarder de manière qualitative, mais également quantitative aux processus de régulation, d’activation et des fonctions associées à la protéine HRI.
3.1.1 HRI est sensible aux Dérivés Réactifs de l’Oxygène (DRO)
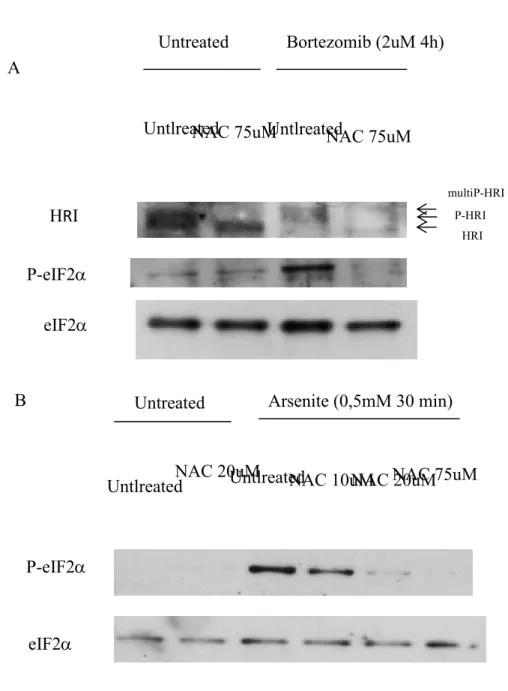
En sachant que la protéine HRI passe par un processus d’activation par autophosphorylation, j’ai d’abord voulu étudier cette voie d’activation, à savoir ce qui active le domaine autokinase de la protéine et lui confère ensuite son rôle d’inhibition de la traduction en condition de stress. Pour se faire et en sachant que l’activation de HRI en condition de stress oxydatif passe par la production de Dérivés Réactifs de l’Oxygène (DRO), j’ai procédé à un test d’inhibition de ces DRO dans les conditions d’inhibition du protéasome qui nous intéressent (Figure 5). J’ai donc traité les cellules HeLa avec le N-Acetylcysteine (NAC; inhibiteur des DRO), selon le protocole expliqué dans le matériel et méthodes, en effectuant d’abord un test d’optimisation de concentration (résultats non présentés) qui m’a permis d’établir la concentration idéale à 75uM de NAC. Après analyse des résultats, j’ai pu constater qu’un traitement à l’aide d’un antioxydant tel que le NAC permet de prévenir le shift d’activation d’HRI normalement occasionné par un traitement au Bortezomib, phénomène qui corrèle avec l’absence de phosphorylation du facteur d’initiation de la traduction eIF2α. De plus, il semble également que le traitement au Bortezomib diminue l’expression de la kinase HRI (Figure 5 – A). Ces résultats corroborent la possibilité que les Reactive Oxygen Species constituent des activateurs généraux de l’autokinase HRI, et que l’inhibiteur de protéasome Bortezomib induit en partie, un stress oxydatif par la production de DRO. Des tests contrôles en condition Arsenite ont également été réalisés afin de tester
(Figure 5 – B). Des immunobuvardage étudiants les shifts d’activation de la protéine HRI dans ces conditions de traitement par Arsenite sont présentement en cours. Après analyse des résultats, il est possible de constater un effet de diminution progressive de la phosphorylation du facteur eIF2α, inversement proportionnelle à la concentration d’inhibiteur des DRO utilisée, phénomène attendu comme le démontre la littérature (Lu and al, 2001). Il semble néanmoins qu’une concentration de 20uM soit suffisante pour diminuer de près de 80 % la phosphorylation, alors que, tel qu’établi lors des tests d’optimisation de concentration, il n’en nécessite que 75uM pour en arriver au même résultat en condition d’inhibition du protéasome grâce au Bortezomib.
Untlreated NAC 75uM
NAC 20uM P-eIF2
eIF2 HRI
Untreated Bortezomib (2uM 4h)
Untlreated NAC 75uM
NAC 75uM Untlreated P-eIF2 eIF2 Untlreated NAC 20uM Untreated NAC 10uM Arsenite (0,5mM 30 min) B
Figure 5 – Test d’inhibition des DRO. (A) Test d’inhibition des ROS en condition de stress par inhibition du protéasome grâce au Bortezomib. Le traitement des cellules soumises au Bortezomib avec le NAC à 75uM prévient l’activation de HRI ainsi que la phosphorylation subséquente de P-eIF2. (B) Contrôle d’efficacité du NAC en condition de traitement en stress oxydatif (Ars).
A
multiP-HRI P-HRI
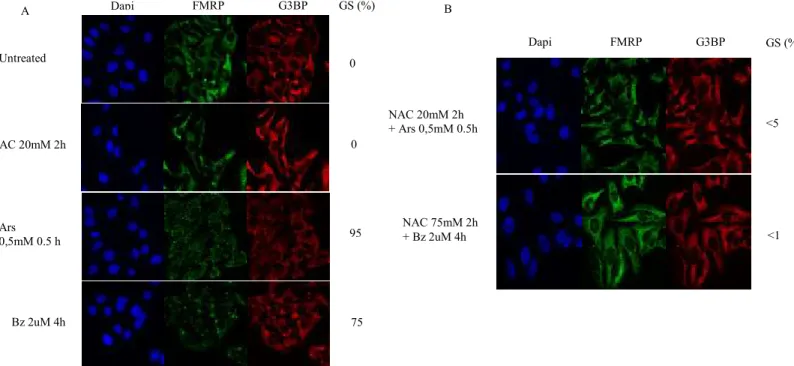
Pour confirmer les résultats obtenus en analyse protéique, j’ai réalisé le même type d’expérience, mais en procédant cette fois-ci à une visualisation par immunofluorescence (Figure 6). De fait, j’ai pu constater qu’un prétraitement au NAC selon les concentrations optimales pour chacune des conditions permettait de réduire de près de 100 % l’induction granulaire en condition de stress oxydatif (Ars) et d’inhibition du protéasome (Bz). En sachant que l’activation d’HRI et la phosphorylation d’eIF2α en découlant sont directement liées à l’induction des granules de stress, ces résultats corrèlent avec ceux obtenus en western blot. En effet, il semble que l’inhibition des DRO grâce à un antioxydant tel que le NAC, permet de contrer l’activation d’HRI, la phosphorylation du facteur eIF2α et l’induction de granules de stress en condition d’inhibition du protéasome. Ainsi, il semble que HRI soit au centre de cette réponse cellulaire face au stress et que cette réponse, médiée par l’activation de HRI, soit modulable selon l’intensité du stress. Nous avons donc voulu vérifier si l’abondance endogène de cette protéine modulait également l’intensité de la réponse cellulaire suite à un stress.
Ars 0,5mM 0.5 h Untreated NAC 20mM 2h Bz 2uM 4h GS (%) 0 0 95 75 Dapi FMRP G3BP NAC 20mM 2h + Ars 0,5mM 0.5h NAC 75mM 2h + Bz 2uM 4h GS (%) <5 <1 Dapi FMRP G3BP
Figure 6 – Effet des inhibiteurs des DRO sur la formation des GS. (A) Contrôles d’induction granulaire en condition de stress oxydatif (Ars) et d’inhibition du protéasome (Bz). (B) Effet d’un traitement avec un inhibiteur de ROS (NAC) sur l’induction granulaire suite à un traitement stressant. Autant en condition de stress oxydatif (déjà connu) que d’inhibition du protéasome (résultat nouveau),
3.1.2 L’abondance endogène de HRI modifie la réponse face aux
stress
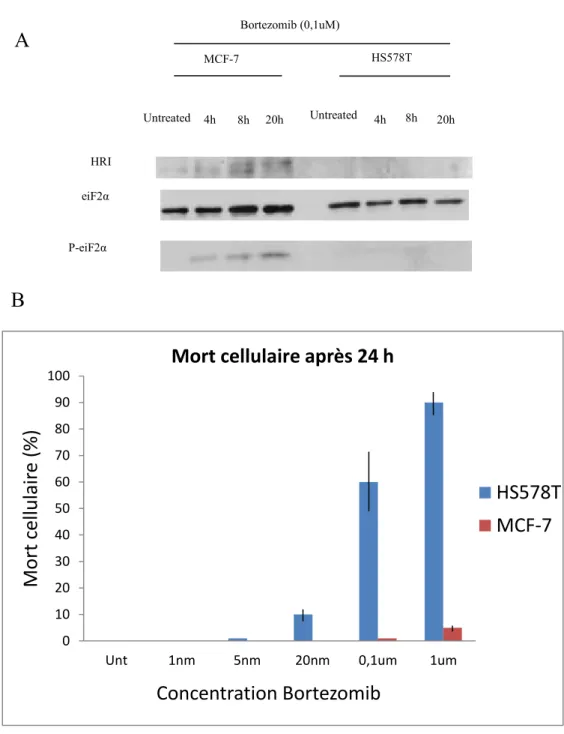
On avait déjà observé que la résistance des cellules cancéreuses corrèle avec la capacité de ces cellules à former des GS, qui serait donc dû à une expression et/ou activation différentielle de HRI. On a donc voulu vérifier si le pouvoir de former des GS corrèle avec l’activation et/ou l’expression de HRI. Pour se faire, j’ai procédé à un criblage de plusieurs lignées cancéreuses, généralement par paires de lignées issues de mêmes tissus afin de trouver et de pouvoir comparer deux lignées présentant deux niveaux d’expression opposés de la protéine HRI. Ce criblage (résultats non présentés) m’a permis d’identifier deux lignées issues de cancer du sein, soit les MCF-7, associés à un adénocarcinome métastasique et présentant un haut niveau relatif d’expression de la protéine HRI, et les Hs 578T, associés à un carcinome et présentant un niveau d’expression presque non détectable de HRI (Figure 7). Cette absence d’expression de HRI de la lignée HS578T corrèle avec une absence de phosphorylation du facteur eIF2α en condition de Bortezomib comparativement à la condition non traitée, expliquant donc l’absence de formation des GS dans ces cellules. Comme on peut s’y attendre, le Bortezomib induit l’activation de HRI, tel que le démontre le retard de sa migration sur gel SDS-PAGE, l’induction de la phosphorylation du facteur eIF2α (Figure 7 – A), et la formation des GS qui en résulte. En sachant que l’activation d’HRI en traitement de Bortezomib module une résistance par la voie de phosphorylation d’eIF2α comme nous l’avons déjà démontré (Gareau and all, 2012), j’ai ensuite voulu tester l’hypothèse qu’une lignée exprimant faiblement HRI soit plus sensible au Bortezomib. Ainsi, en utilisant les deux lignées cellulaires soumises à un traitement de 24 heures, j’ai effectivement pu constater une mort cellulaire nettement plus importante (près de 90 %) pour la lignée Hs 578T (Figure 7 – B). Ce résultat corrobore donc l’hypothèse voulant qu’une lignée cellulaire exprimant faiblement la protéine HRI soit plus sensible à un traitement d’inhibition du protéasome par le Bortezomib et que l’activation d’HRI est nécessaire.
0 10 20 30 40 50 60 70 80 90 100
Unt 1nm 5nm 20nm 0,1um 1um
Mor
t
cellu
lair
e (%)
Concentration Bortezomib
Mort cellulaire après 24 h
HS578T
MCF-7
Figure 7 – L’abondance physiologique d’HRI semble moduler la phosphorylation du facteur eIF2 α et la mort cellulaire en condition de traitement au Bortezomib. (A) Deux
lignées présentant des niveaux d’expression d’HRI variant illustrent que ces niveaux sont proportionnels au degré de phosphorylation du facteur eIF2a et (B) inversement proportionnel au pourcentage de mort cellulaire en condition de traitement au Bortezomib.
P-eiF2α eiF2α HRI Untreated 4h 8h 20h Untreated 4h 8h 20h MCF-7 HS578T Bortezomib (0,1uM)
A
B
3.2 Les lignées stables déplétées en HRI présentent un phénotype
analogue à celui de l’interférence à l’ARN transitoire
Après avoir constaté que les niveaux d’activation et d’expression de la protéine HRI corrèlent avec les capacités de résistance cellulaire face à un traitement par le Bortezomib, j’ai voulu vérifier s’il m’était possible de moduler cette résistance en altérant principalement la quantité de protéine HRI disponible. Des résultats précédents obtenus au laboratoire (non présentés) nous avaient déjà démontré que l’interférence transitoire à l’ARN à l’aide de siRNA ciblant l’ARN messager de HRI permet d’augmenter la population de cellules mortes suite à un traitement au Bortezomib. J’ai donc voulu vérifier si des lignées déplétées de manière stable en HRI allaient être viables et présenteraient le même phénotype que lors d’une interférence transitoire. Une réponse positive apporterait une preuve de plus à l’hypothèse que le niveau d’expression de HRI est lié à la résistance cellulaire au traitement d’inhibition du protéasome par le Bortezomib. De plus et surtout, si le phénotype correspond, cette lignée constituerait un excellent outil d’étude in vivo.
3.2.1 Les shHRI stables inhibent l’induction des granules de stress
et diminuent la croissance cellulaire
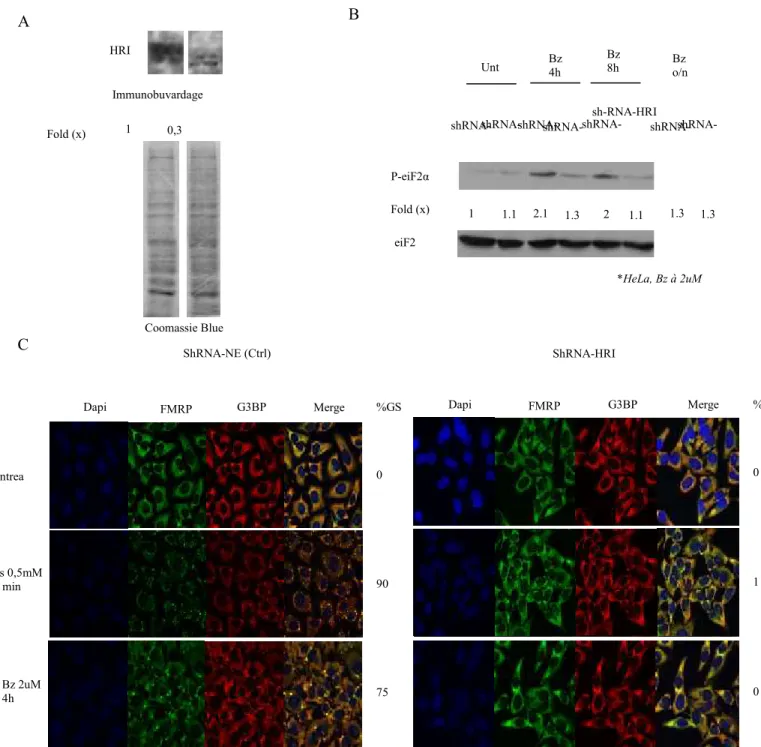
Ainsi, pour vérifier l’hypothèse de l’importance d’HRI dans la résistance cellulaire face au traitement de Bortezomib, j’ai procédé à la création de lignées stables déplétées de manière constitutive en HRI. Pour se faire, j’ai d’abord utilisé la lignée cellulaire bien connue HeLa et une sélection à la puromycine grâce à un gène de résistance intégré dans la construction HuSHTM – shHRI. À l’aide de cette lignée sh-HRI stable, j’ai pu, en la comparant avec une lignée HeLa transfectée de manière stable exprimant un sh-Non Effecteur (sH-NE), directement étudier l’effet de la protéine HRI en condition in vitro (Figure 8). J’ai d’abord réalisé un immunobuvardage avec un lysat de chacune des
était effectivement diminuée dans la lignée transfectée de manière stable avec la construction shRNA-HRI, sans toutefois être totalement empêchée (diminution de ≈70%) (Figure 8 – A). Pour étudier le rôle de HRI dans la phosphorylation du facteur eIF2α en condition de stress, j’ai ensuite analysé des lysats de cellules shRNA-NE et shRNA-HRI ayant subi différents temps de traitement au Bortezomib (Figure 8 – B). En considérant que la lignée shRNA-HRI possède une plus faible population de protéine HRI et que celle-ci est responsable de la phosphorylation d’eIF2α en condition de Bortezomib, j’ai pu confirmer mes attentes et constater que cette phosphorylation était bien liée au niveau d’expression de la protéine HRI. En effet, les niveaux de phosphorylation d’eIF2α sont sensiblement identiques en condition non traitée. Ces niveaux considérablement lorsque soumis au Bortezomib, corrélant avec l’hypothèse que la protéine HRI est responsable de la phosphorylation du facteur eIF2α en condition de traitement au Bortezomib. Aussi, et en tenant toujours compte du fait que le phénomène d’induction des GS par la voie de phosphorylation de eIF2α est modulé par la kinase HRI, j’ai pu vérifier par immunofluorescence que la lignée shRNA-HRI ne pouvait induire les GS (Figure 8 – C). Pour valider ce résultat, j’ai analysé deux types de traitement reconnus comme inducteurs de GS, l’Arsenite et le Bortezomib. Dans les deux cas, j’ai pu observer une absence totale des GS pour la lignée déplétée de manière stable en HRI, alors qu’une induction normale (75-90%) s’est produite chez la lignée shRNA-NE. Ces résultats corroborent ceux obtenus par interférence à l’ARN transitoire, à savoir qu’une lignée déplétée en protéine HRI de manière stable présentera une plus faible phosphorylation du facteur eIF2α en condition de stress par inhibition du protéasome. Cette déplétion semble également prévenir la formation de GS, phénomène vérifié en condition de stress oxydatif et d’inhibition du protéasome, et qui est normalement associé à une résistance cellulaire face à un stress physiologique.
1.1 1.3
2.1 1
Figure 8 – Une lignée déplétée en protéine HRI de manière stable présente une phosphorylation d’eIF2 α significativement plus faible et une absence d’induction des GS en condition de traitement au Bortezomib. (A) Confirmation de la suppression protéique grâce au HuSHTM – shHRI comparativement à la lignée contrôle shNE. L’intensité des bandes du coomassie contrôle est comparée par proportion de nombre de pixel total (B) Comparaison de la phosphorylation du facteur eIF2a pour les deux lignées suite à différents temps de traitement au
Coomassie Blue shRNA-NE (Ctrl) shRNA-HRI HRI P-eiF2α eiF2 α shRNA-NE
shRNA-HRI shRNA-NE shRNA-HRI shRNA-NE sh-RNA-HRI shRNA-NE shRNA-HRI Unt Bz 4h Bz 8h Bz o/n *HeLa, Bz à 2uM Fold (x) 1.1 2 1.3 1.3 ShRNA-NE (Ctrl) ShRNA-HRI Dapi FMRP G3BP Merge Untrea ted Ars 0,5mM 30 min Bz 2uM 4h %GS 0 90 75 Dapi FMRP G3BP Merge %GS 0 1 0 C B A Fold (x) 1 0,3 Immunobuvardage
3.2.2 Les shRNA-HRI stables semblent être moins résistantes au
traitement de Bortezomib
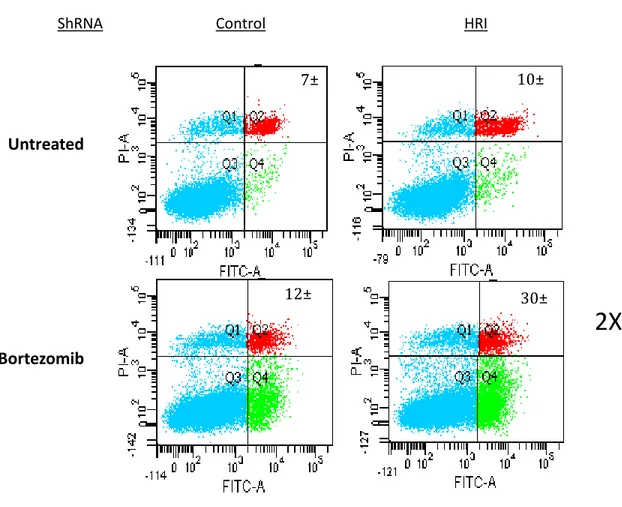
Pour confirmer la liaison entre la diminution d’expression de la protéine HRI et la résistance amoindrie des cellules face à un traitement d’inhibition du protéasome, j’ai ensuite testé la mort cellulaire des lignées shRNA-NE et shRNA-HRI, mesurée par cytométrie en flux, après traitement au Bortezomib et récolte (Figure 9). Ainsi, après avoir récolté ces lignées, soumises à un traitement de Bortezomib 2uM toute une nuit, j’ai pu constater que la mort cellulaire suite à ce traitement était doublé pour la lignée cellulaire shRNA-HRI comparativement à la lignée shRNA-NE. Ce résultat confirme donc une résistance cellulaire modulée par la protéine HRI, vraisemblablement par la voie de phosphorylation d’eIF2α et l’induction des GS.
Control HRI Untreated Bortezomib ShRNA : 7± 1 10± 2 12± 1 30±4
2X
Figure 9 – La déplétion de protéine HRI sensibilise les cellules cancéreuses à la mort cellulaire suite à un traitement de Bortezomib. Calculées en cytométrie en flux grâce au
test d’annexin V, les populations shRNA-NE et shRNA-HRI ont été comparées, ce qui a permis de conclure que la lignée déplétée en protéine HRI était d’une part plus sensible au traitement de Bortezomib, mais offrait également un pourcentage de mort cellulaire significativement plus élevé (2X) que la lignée contrôle.