Université d’Aix-Marseille – Faculté de Pharmacie – 27 bd Jean Moulin – CS 30064 - 13385 Marseille cedex 05 - France Tél. : +33 (0)4 91 83 55 00 - Fax : +33 (0)4 91 80 26 12
LE RESVERATROL
PARTIE 1 : A L’OFFICINE
PARTIE 2 : ALTERNATIVE NATURELLE
D’AVENIR POUR LE TRAITEMENT DU
CANCER ET LES MALADIES
NEURODEGENERATIVES
THESE
PRESENTEE ET PUBLIQUEMENT SOUTENUE DEVANT LA FACULTE DE PHARMACIE DE MARSEILLE
Le Jeudi 7 décembre 2017
PAR
ALEXANDRA COMMEAU ET MARION DE MATTEIS
Nées les 10/04/1982 à CAEN et le 30/03/1988 à MARSEILLE EN VUE D’OBTENIR
LE DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
JURY :
Président : Le docteur Philippe PICCERELLE Membres : Le docteur Frédérique GRIMALDI Le docteur Joëlle BOSCHI
Mise à jour : 1/12/2015
27 Boulevard Jean Moulin – CS 30064 - 13385 MARSEILLE Cedex 05 Tel. : 04 91 83 55 00 – Fax : 04 91 80 26 12
ADMINISTRATION :
Doyen : Mme Françoise DIGNAT-GEORGE
Vice-Doyens : M. Jean-Paul BORG, M. Philippe CHARPIOT, M. Pascal RATHELOT Chargés de Mission : M. David BERGE-LEFRANC, M. François DEVRED, Mme Caroline
DUCROS, Mme Pascale BARBIER Conseiller du Doyen : M. Patrice VANELLE
Doyens honoraires : M. Jacques REYNAUD, M. Pierre TIMON-DAVID, M. Patrice VANELLE Professeurs émérites : M. José SAMPOL, M. Jean-Pierre REYNIER
Professeurs honoraires : M. Guy BALANSARD, M. Jacques BARBE, M. Yves BARRA, Mme Claudette BRIAND, M. Jacques CATALIN, Mme Andrée CREMIEUX, M. Aimé CREVAT, M. Bernard CRISTAU,
M. Gérard DUMENIL, M. Alain DURAND, Mme Danielle GARÇON, M. Maurice JALFRE, M. Joseph JOACHIM, M. Maurice LANZA, M. José MALDONADO, M. Patrick REGLI, M. Jean-Claude SARI Chef des Services Administratifs : Mme Florence GAUREL
Chef de Cabinet : Mme Sandrine NOURIAN Responsable de la Scolarité : Mme Myriam TORRE
DEPARTEMENT BIO-INGENIERIE PHARMACEUTIQUE
Responsable : Professeur Philippe PICCERELLE
PROFESSEURS
BIOPHYSIQUE M. Vincent PEYROT
M. Hervé KOVACIC
GENIE GENETIQUE ET BIOINGENIERIE M. Christophe DUBOIS PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
Mise à jour : 1/12/2015
MAITRES DE CONFERENCES
BIOPHYSIQUE M. Robert GILLI
Mme Odile RIMET-GASPARINI Mme Pascale BARBIER
M. François DEVRED Mme Manon CARRE M. Gilles BREUZARD Mme Alessandra PAGANO
GENIE GENETIQUE ET BIOTECHNOLOGIE M. Eric SEREE-PACHA
Mme Véronique REY-BOURGAREL PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
BIOPHARMACIE ET COSMETOLOGIE
M. Pascal PRINDERRE M. Emmanuel CAUTURE Mme Véronique ANDRIEU Mme Marie-Pierre SAVELLI NUTRITION ET DIETETIQUE M. Léopold TCHIAKPE
A.H.U.
CULTURE ET THERAPIE CELLULAIRE M. Jérémy MAGALON
ENSEIGNANTS CONTRACTUELS
ANGLAIS Mme Caroline MONTET
DEPARTEMENT BIOLOGIE PHARMACEUTIQUE
Responsable : Professeur Philippe CHARPIOT
PROFESSEURS
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE M. Philippe CHARPIOT
BIOLOGIE CELLULAIRE M. Jean-Paul BORG
HEMATOLOGIE ET IMMUNOLOGIE Mme Françoise DIGNAT-GEORGE Mme Laurence CAMOIN
Mme Florence SABATIER-MALATERRE
MICROBIOLOGIE M. Jean-Marc ROLAIN
M. Philippe COLSON PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET
ZOOLOGIE
Mise à jour : 1/12/2015
MAITRES DE CONFERENCES
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE Mme Dominique JOURDHEUIL-RAHMANI M. Thierry AUGIER
M. Edouard LAMY
Mme Alexandrine BERTAUD Mme Claire CERINI
Mme Edwige TELLIER M. Stéphane POITEVIN HEMATOLOGIE ET IMMUNOLOGIE Mme Nathalie BARDIN
Mme Dominique ARNOUX Mme Aurélie LEROYER M. Romaric LACROIX
MICROBIOLOGIE Mme Michèle LAGET
M. Michel DE MEO
Mme Anne DAVIN-REGLI Mme Véronique ROUX M. Fadi BITTAR
Mme Isabelle PAGNIER Mme Sophie EDOUARD PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET
ZOOLOGIE
Mme Carole DI GIORGIO M. Aurélien DUMETRE Mme Magali CASANOVA Mme Anita COHEN
BIOLOGIE CELLULAIRE Mme Anne-Catherine LOUHMEAU
A.H.U.
HEMATOLOGIE ET IMMUNOLOGIE Mme Sylvie COINTE
DEPARTEMENT CHIMIE PHARMACEUTIQUE
Responsable : Professeur Patrice VANELLE
PROFESSEURS
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION M. Henri PORTUGAL Mme Catherine BADENS CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES
M. Philippe GALLICE
CHIMIE MINERALE ET STRUCTURALE – CHIMIE THERAPEUTIQUE
M. Pascal RATHELOT M. Maxime CROZET CHIMIE ORGANIQUE PHARMACEUTIQUE M. Patrice VANELLE
M. Thierry TERME PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE Mme Evelyne OLLIVIER
Mise à jour : 1/12/2015
PROFESSEURS ASSOCIES A TEMPS PARTIEL (P.A.S.T.)
GESTION PHARMACEUTIQUE, PHARMACOECONOMIE ET ETHIQUE PHARMACEUTIQUE OFFICINALE
M. Jean-Pierre CALISSI
MAITRES DE CONFERENCES
BOTANIQUE ET CRYPTOGAMIE, BIOLOGIE CELLULAIRE Mme Anne FAVEL
Mme Joëlle MOULIN-TRAFFORT
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Elisabeth SCHREIBER-DETURMENY Mme Catherine DEFOORT
M. Alain NICOLAY Mme Estelle WOLFF Mme Elise LOMBARD CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES
M. David BERGE-LEFRANC M. Pierre REBOUILLON
CHIMIE THERAPEUTIQUE Mme Catherine DIANA
Mme Sandrine FRANCO-ALIBERT Mme Caroline DUCROS
M. Marc MONTANA CHIMIE ORGANIQUE PHARMACEUTIQUE
HYDROLOGIE
M. Armand GELLIS M. Christophe CURTI Mme Julie BROGGI M. Nicolas PRIMAS M. Cédric SPITZ M. Sébastien REDON PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE M. Riad ELIAS
Mme Valérie MAHIOU-LEDDET Mme Sok Siya BUN
Mme Béatrice BAGHDIKIAN
MAITRES DE CONFERENCE ASSOCIES A TEMPS PARTIEL (M.A.S.T.)
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Anne-Marie PENET-LOREC CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES
M. Thierry ATHUYT
DROIT ET ECONOMIE DE LA PHARMACIE M. Marc LAMBERT DROIT ET COMMUNICATION PHARMACEUTIQUES A L’OFFICINE
ET GESTION DE LA PHARMAFAC
M. Philippe BESSON
AHU
CHIMIE ORGANIQUE PHARMACEUTIQUE Mme Manon ROCHE
ATER
Mise à jour : 1/12/2015
DEPARTEMENT MEDICAMENT ET SECURITE SANITAIRE
Responsable : Professeur Benjamin GUILLET
PROFESSEURS
PHARMACIE CLINIQUE Mme Diane BRAGUER
PHARMACODYNAMIE M. Benjamin GUILLET
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Athanassios ILIADIS
TOXICOLOGIE GENERALE M. Bruno LACARELLE
TOXICOLOGIE DE L’ENVIRONNEMENT Mme Frédérique GRIMALDI
MAITRES DE CONFERENCES
PHARMACODYNAMIE Mme Suzanne MOUTERDE-MONJANEL
PHYSIOLOGIE Mme Sylviane LORTET
Mme Emmanuelle MANOS-SAMPOL TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Hot BUN
M. Joseph CICCOLINI
Mme Raphaëlle FANCIULLINO TOXICOLOGIE GENERALE ET PHARMACIE CLINIQUE M. Pierre-Henri VILLARD
M. Stéphane HONORÉ
Mme Caroline SOLAS-CHESNEAU Mme Marie-Anne ESTEVE
A.H.U.
PHARMACODYNAMIE M. Philippe GARRIGUE
ATER
PHARMACODYNAMIE M. Guillaume HACHE
Mise à jour : 1/12/2015
CHARGES D’ENSEIGNEMENT A LA FACULTE
Mme Nathalie AUSIAS, Pharmacien-Praticien hospitalier M. Pierre BERTAULT-PERES, Pharmacien-Praticien hospitalier Mme Martine BUES-CHARBIT, Pharmacien-Praticien hospitalier M. Gérard CARLES, Pharmacien-Praticien hospitalier
Mme Nicole FRANCOIS, Pharmacien-Praticien hospitalier Mme Sophie GENSOLLEN, Pharmacien-Praticien hospitalier Mme Christine PENOT-RAGON, Pharmacien-Praticien hospitalier M. Stéphane PICHON, Pharmacien titulaire
M. Alain RAGON, Pharmacien-Praticien hospitalier
M. Badr Eddine TEHHANI, Pharmacien – Praticien hospitalier
1
REMERCIEMENTS
Tout d’abord je voulais remercier les professeurs Frédérique GRIMALDI et philippe PICCERELLE de nous avoir permis de soutenir cette thèse aussi rapidement et de faire partis de notre jury.
Ensuite évidemment merci à Joëlle BOSCHI qui m’aura fait découvrir cette molécule et pour son engouement si efficace lorsqu’il s’agissait de nous aider à avancer.
A celle qui m’a tout appris, Mme Elodie TRAPANI qui a su me faire confiance à mes débuts et encore aujourd’hui. Sans oublier l’équipe de la pharmacie avec qui j’apprends un peu plus tous les jours et avec qui on rigole toujours autant ! Je veux parler biensûr de ma co-auteure Alexandra qui est devenue une amie, Stéphanie ma « deuxième maman », Linda la plus patiente et la plus gentille et Jonathan qui a bien du courage au milieu de toutes ces filles !
Je voulais aussi remercier ma deuxième famille, mes amis, ma base, mon noyau. Je veux parler de ceux qui sont là depuis presque toujours même s’ils sont loin aujourd’hui. Elo, Nico, Flow, Rémi, Anto et Manon. Ce sont eux qui me supportent et me soutiennent tous les jours et sans qui je n’aurai pas pu faire toutes ces études.
En parlant d’études, merci à Jérémie qui m’en aura fait voir des vertes et des pas mûres, avec qui on s’est bien marré et aussi pas mal stréssé ! Sans oublier Charlotte « la tahitienne », « Jumeau » mais aussi Céline. A mes nouvelles amies Léa, Marjory et Laetitia que j’ai rencontrées trop tard mais avec qui pourtant j’ai partagé les mêmes bancs de fac et les mêmes soirées pharma, merci d’être toujours les plus adorables.
2
A ma famille pour finir, sans qui tout ceci n’aurait pas été possible, merci de m’avoir soutenue et de m’avoir poussée à faire tout çà. Merci d’être la plus aimante et la plus imparfaite des familles.
A ceux qui ne sont plus là.
3
J’aimerais remercier tout d’abord Dr Philippe Piccerelle et Dr Frédérique Grimaldi pour avoir accepter de faire parti de notre jury de thèse. Une mention spéciale pour Dr Joëlle Boschi pour sa disponibilité, ses connaissances, et son énergie sans faille.
Merci à ma titulaire Dr Elodie Trossero-Trapani pour m’avoir soutenue et ramenée dans le droit chemin et merci à mes collègues d’amour Stéphanie et Linda.
Merci à toi Marion De Matteis pour avoir accepté de partager ce projet et d’avoir supporté les aléas d’une jeune maman stressée.
Merci à mes amies de toujours Audrey Astier, Léa Goffinet, Aurélia Crueize, Delphine Jeanclaude, Sophie Simian-Salvay. Nous avons partagé de superbes moments ensemble sur les bancs de la fac et çà continue encore aujourd’hui pour ma plus grande joie.
Merci aux pétillantes Laetitia Nocentini et Audrey Lorenzon pour votre folie et votre amitié.
Merci à mon Doudou
Pour finir un grand merci à ma merveilleuse mère pour son soutien, son amour, sa présence.
4
« L’université n’entend pas donner aucune approbation ni improbation
aux opinions émises dans les thèses. Ces opinions doivent être
5 TABLE DE MATIERES 1 OBJET: ... 11 2 PRESENTATION : ... 12 2.1 Historique : ... 12 2.2 Origines du Resvératrol : ... 14 2.3 Propriétés Physiques : ... 16
2.4 Métabolisation et Biodisponibilité du resvératrol du vin : ... 17
2.4.1 Métabolisation des xénobiotiques ... 17
2.4.2 La biodisponibité du resvératrol... 19
2.4.3 Améliorer la biodisponibilité du resvératrol ... 22
PARTIE 1: LE RESVERATROL A L'OFFICINE 1 Anti-Oxydant ... 26
1.1 Classification des radicaux libres ... 27
1.2 Formation des radicaux libres ... 28
1.2.1 Formation des Espèces oxygénées actives ... 28
1.2.2 Formation des espèces azotées actives ... 30
1.3 Source de production des radicaux libres ... 31
1.3.1 Sources endogènes ... 31
1.3.1.1 La mitochondrie ... 31
1.3.1.2 Cytochromes P450 ... 33
1.3.1.3 NADPH oxydase ... 34
1.3.1.4 Xanthine oxydase (XO) ... 34
1.3.2 Sources exogènes ... 35
1.3.3 Formation des radicaux libres lors de l’oxydation d’hémoglobines ... 36
1.4 Effets des radicaux libres ... 36
1.4.1 Effets bénéfiques ... 36
1.4.1.1 Rôle dans la contraction musculaire ... 36
1.4.1.2 Rôle immunitaire ... 37
1.4.2 Effets délétères ... 37
1.4.2.1 Oxydation de l’ADN ... 37
1.4.2.2 Oxydation des protéines ... 38
1.4.2.3 Oxydation des lipides ... 39
1.5 Les défenses antioxydantes ... 39
6
1.5.1.1 Antioxydants enzymatiques : ... 40
1.5.1.2 Antioxydants non enzymatiques ... 41
1.5.1.3 Antioxydants exogènes ... 41 1.5.1.4 Vitamine E... 41 1.5.1.5 Vitamine C ... 42 1.5.1.6 Caroténoïdes ... 42 1.5.2 Autres antioxydants... 42 1.5.2.1 Le Coenzyme Q10 et cytochrome C ... 42 1.5.2.2 Flavonoïdes ... 43
1.6 Evaluation du stress oxydant ... 43
1.7 Resveratrol anti-oxydant ... 44
1.7.1 Effet sur la peroxydation lipidique ... 44
1.7.2 Effet direct sur les radicaux libres ... 47
1.7.3 Bloqueur d’espèces oxydantes actives ... 48
1.7.4 Effets sur l’oxydation protéique ... 49
2 Un rôle cardioprotecteur :... 50
2.1 Les maladies cardiovasculaires : ... 50
2.2 Le concept de « French Paradox » ... 51
2.3 Resvératrol et cardioprotection : ... 52
2.3.1 L’athérosclérose : ... 52
2.3.1.1 Inhibition de l’adhésion et de l’agrégation plaquettaire : ... 54
2.3.1.2 Inhibition de l’oxydation des LDL-cholestérol ... 54
2.3.2 Effet protecteur vasculaire : ... 54
2.3.2.1 Inducteur d’une vasodilatation : ... 54
2.3.2.2 Activité anti-inflammatoire : ... 56
2.3.2.3 Activité anti-oxydante : ... 56
3 Un anti-inflammatoire : ... 57
3.1 Rappel : l’inflammation : ... 57
3.1.1 Les cellules endothéliales : ... 58
3.1.2 Autres cellules : ... 58
3.1.3 Les médiateurs cellulaires : ... 59
3.1.3.1 Les eicosanoïdes : ... 59
3.1.3.2 Les radicaux libres ... 60
3.1.3.3 Les cytokines : ... 60
7
3.2.1 Inhibition de l’activité enzymatique de COX-2 : ... 62
3.2.2 Suppression de l’activation de l’expression des gènes de COX-2 : ... 63
3.3 Un inhibiteur de la NO synthase par le biais de NF-κB : ... 64
3.4 Un inhibiteur de TNF-α : ... 66
3.5 Un inhibiteur d’interleukines pro-inflammatoires : ... 66
3.6 Conclusion : ... 67
4 Inflammation à bas-bruit et microbiote. ... 68
4.1 Le microbiote intestinal ou flore intestinale: ... 68
4.2 Endotoxémie métabolique : ... 68
4.3 Les effets bénéfiques du resvératrol : ... 69
5 A l’officine : ... 70
5.1 La douleur : ... 70
5.2 Le stress oxydant ... 71
5.3 Le risque cardiaque : ... 71
6 Conclusion : ... 72
PARTIE 2: LE RESVERATROL, MOLECULE NATURELLE D'AVENIR POUR LE TRAITEMENT DU CANCER ET LES MALADIES NEURODEGENERATIVES. 1 Le cancer... 74
1.1 Définition : ... 74
1.2 Comprendre le cancer : ... 75
1.2.1 Développement du cancer ... 75
1.2.2 Modélisation : ... 76
1.2.3 Gènes supresseurs de tumeurs et oncogènes : ... 76
1.2.4 Fonctionnement normal de la cellule : le cycle cellulaire et la division cellulaire : ... 81
1.2.5 Caractéristiques de la cellule cancéreuse : ... 85
1.2.5.1 Instabilité génétique de la cellule cancéreuse : ... 86
1.2.5.2 Résistance de la cellule cancéreuse à l’apoptose : ... 87
1.2.5.3 Néo-angiogénèse et néo-vascularisation : ... 88
1.2.6 De la cellule cancéreuse à la tumeur : ... 91
1.2.7 Etapes évolutives et action de lutte contre le cancer : ... 93
1.2.8 Le système immunitaire : ... 94
1.2.8.1 Surveillance des tissus par le système immunitaire : ... 94
1.2.8.2 Les mécanismes d’échappement à la réponse immunitaire : ... 95
1.2.9 Les marqueurs tumoraux : ... 96
8
1.2.10.1 Les cancers solides : ... 97
1.2.10.2 Les cancers « liquides » ou sanguins : ... 97
1.2.10.3 Les cancers métastatiques ou disséminés : ... 98
1.2.10.4 Les cancers secondaires : ... 98
1.2.11 Prise en charge de la maladie cancéreuse (généralités) : ... 98
1.2.11.1 La chirurgie : ... 98
1.2.11.2 La radiothérapie : ... 99
1.2.11.3 La chimiothérapie : ... 99
2 Le resvératrol... 99
2.1 Son action préventive à tous les stades de la carcinogénèse : ... 100
2.1.1 Inhibition des évènements moléculaires et cellulaires impliqués dans l’initiation,la prolifération, la promotion et la progression tumorale.(3) ... 100
2.1.2 Action au niveau des mitochondries : ... 101
2.1.3 Inhibition de certains oncogènes responsables des altérations des voies métaboliques : ... 102
2.1.4 Améliorations des fonctions mitochondriales via SIRT-1 : ... 102
2.1.5 Réduction de certains marqueurs biologiques associés au développement tumoral : 103 2.1.6 Action sur les enzymes responsables du métabolisme des carcinogènes : ... 103
2.2 Son action sensibilisante des cellules tumorales à la chimiothérapie : ... 104
2.2.1 Limitation du développement des chimiorésistance : ... 105
2.2.2 Amélioration de l’index thérapeutique d’un médicament : ... 105
2.2.3 Précautions d’emploi du resvératrol avec certaines molécules de chimiothérapie : . 106 2.3 Son action sur l’apoptose et le cycle cellulaire : ... 107
3 Place du resvératrol dans le traitement des maladies neurodégénératives : ... 110
3.1 Les maladies neurodégénératives (MND) : ... 110
3.1.1 Définition : ... 110
3.1.2 Mécanismes cellulaires : ... 112
3.1.2.1 Agrégation toxique de protéines : ... 112
3.1.2.2 Augmentation de l’apoptose : ... 114
3.1.2.3 Augmentation du stress oxydant : ... 115
3.1.2.4 Dysfonctionnement du système ubiquinone-protéasome : ... 115
3.1.2.5 Traitements : ... 116
3.2 Place du resvératrol dans les MND : ... 118
9
TABLE DES ILLUSTRATIONS
Figure 1: Para-coumaryl-CoA et resveratrol, par l'action des enzymes phenylalanine
ammonia-lyase,Cinnamate-4-hydroxylase, CoA ligase et stilbene synthase ... 15
Figure 2:Métabolisation des xénobiotiques par l'entérocyte ... 18
Figure 3: concentration du resvératrol dans le sang (Cmax) chez un individu sain ayant reçu des doses de resvératrol de 25mg à 5000mg.(Walle 2011) ... 20
Figure 4:principales étapesde la production des EOA... 30
Figure 5: La chaine respiratoire mitochondriale ... 33
Figure 6: Sources principales de productions des radicaux libres au niveau cellulaire ... 35
Figure 7: diminution de l'oxydation des LDL par l'augmentation de la concentration en resvératrol . 45 Figure 8: différentes concentrations de resvératrol face à la péroxydation lipidique et la vitamine E comme référence anti-oxydante ... 46
Figure 9:Elimination du cholestérol facilitée par le resvératrol ... 47
Figure 10: Test au DPPH pour différentes concentrations du resvératrol avec la vitamine E comme témoin anti-oxydant ... 48
Figure 11: Diminution de la peroxydation protéique par augmentation de la concentration de resvératrol mise en évidence par un test ELISA. ... 49
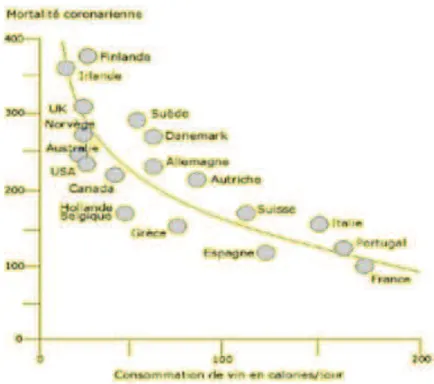
Figure 12: Relation entre la mortalité coronarienne des hommes en 1989 et la consommation de vin dans les pays industrialisés. ... 52
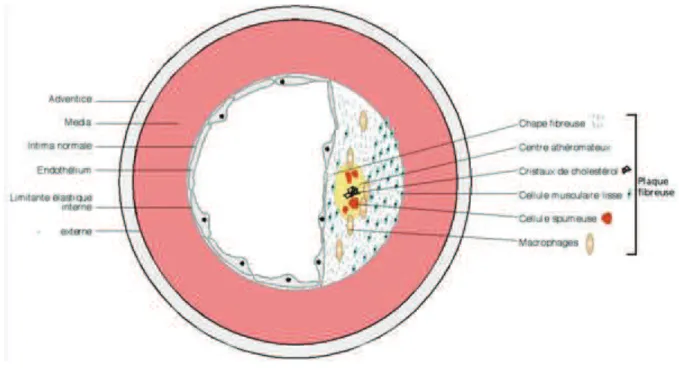
Figure 13: plaque athéroscléreuse (illustration d'après J. EMMERICH) ... 53
Figure 14: le resvératrol provoque une vasodilatation par induction de la eNOS ... 55
Figure 15: Résumé simplifié de l'inflammation ... 58
Figure 16: Action des cyclo-oxygénase 1 et 2 ... 59
Figure 17:Activité de COX-2 inhibée par le resvératrol. ... 62
Figure 18: Blocage par RSV (resvératrol) de AP-1 par blocage de c-Jun ainsi que de ERK1/2. ... 63
Figure 19: effets du resvératrol sur des cellules (Caco2: trait plein et SW480 :pointillés) produisant du monoxyde d’azote (NO) après un contact prolongé avec des lipopolysaccharides (LPS). ... 64
Figure 20: Mécanisme possible de l’activité inhibitrice du resvératrol sur le précurseur du facteur de transcription NF-κB, IκB. ... 65
Figure 21: hypothèse des mécanismes anti-inflammatoire du resvératrol lors d’un processus inflammatoire entre chondrocytes et macrophages(34) ... 67
Figure 22: Les différents types de tumeurs ... 74
Figure 23: Modélisation du processus de cancérogénèse ... 76
Figure 24: Mode d’action schématique du gène suppresseur de tumeurs PTEN ... 79
Figure 25 : Signalisation et réparation des dommages de l’ADN. ... 80
Figure 26: Signalisation de dommages importants de l’ADN. ... 81
Figure 27: Equilibre d’une cellule entre la vie et la mort. ... 82
Figure 28: Le cycle cellulaire. ... 84
Figure 29: L’angiogénèse. ... 89
Figure 30: L’angiogénèse tumorale. ... 90
Figure 31: 7 schéma representant les différentes étapes menant à l’apparition des cellules cancéreuses (source: Greg Circade). ... 91
Figure 32: Etapes évolutives d'un cancer ... 93
Figure 33: La surveillance de notre système immunitaire. ... 95
10
Figure 35: Différents types de marqueurs tumoraux en fonction de la localisation du cancer. ... 97
Figure 36: Les cibles moléculaires majeures du resvératrol ... 101
Figure 37: Chimiosensibilisation des tumeurs par le resvératrol. ... 106
Figure 38: Liste non exhaustive des maladies neurodégénératives (57) ... 111
Figure 39 : mécanismes de format ion des agrégats de protéines dans les MND (56) ... 113
11
1 OBJET:
Pour faire échos à ce que l’on connait et surtout, pour faire oublier ce nom un peu difficile à prononcer, on présentera le resvératrol comme étant la molécule majoritairement responsable d’un phénomène connu sous le nom de « French Paradox ».
De la famille des stilbènes, le resvératrol peut également être appelé 3,5,4’-
trihydroxystilbène dans la nomenclature de chimie organique ou 5-[2-(4-hydroxyphényl)- éthényl] benzène-1,3-diol dans la nomenclature IUPAC
C’est à la molécule de configuration trans- que l’on fait généralement référence en parlant de resvératrol du fait de sa prépondérance habituellement retrouvée dans les plantes. L’objectif de ce manuscrit est de présenter les actions principales d’une molécule utilisée depuis des siècles en médecine traditionnelle chinoise et d’en préciser ses perspectives d’avenir notamment dans le traitement des maladies chroniques tel que le cancer ou les maladies neurodégénératives.
12
2 PRESENTATION :
2.1 Historique :
Découvert pour la première fois à l’issue d’une étude sur le vérâtre blanc ou veratrum
album, en 1939 par un Japonais du nom de Takaoka (1), c’est en 1963 que Nonomura and al.
(2) le décrivent avec précision à partir de la renouée du japon ou polygonum cuspidatum de la famille des Polygonacées.
La renouée du Japon a très rapidement été utilisée comme plante mellifère et fixatrice des sols. Elle a ensuite, été largement plantée dans les sites miniers en Angleterre et en Allemagne. Elle se révèle aujourd’hui, envahissante et difficile à éliminer.
En médecine traditionnelle japonaise, le rhizome séché de la renouée du Japon ou
ko-jo-kon ou itadori-ko-jo-kon, était utilisé sous forme d’infusion « le thé d’itadori », pour traiter les
13
En médecine traditionnelle chinoise on utilise également les rhizomes sous le nom de
huzhang, surtout contre la jaunisse et pour favoriser le bon fonctionnement de la vésicule
biliaire (state administration of traditional chinese medicine 1999) mais également en tant qu'analgésique, antipyrétique, diurétique, expectorant dans le traitement de la bronchite, l'hépatite. (3).
Dans d’autres monographies, elle est efficace pour traiter l’angine, les hémorroïdes, les bronchites chroniques et ulcères (4).
Cette plante est la principale source de resvératrol dont la teneur est de l’ordre de 1 à 3 mg/g de racine (4).
Mais c’est sa découverte, en 1976, dans la pellicule du raisin puis finalement dans le vin rouge en 1992 (5) (puisque la fermentation du vin rouge se fait en présence des parties solides du raisin, pépins et peau), qui a fait naître le concept du « paradoxe français ».
Ce « paradoxe » est l’observation du faible taux de maladies cardiaques, par rapport au régime alimentaire relativement riche en graisse d’une partie de la population française comparativement au pays du nord de l’Europe.
Ce taux anormalement bas serait dû à la consommation de resvératrol et autres
Polyphénols, présents dans le vin. En effet, plusieurs études démontrent l’effet bénéfique de la consommation modérée de vin (1 à 2 verres de vin rouge par jour) sur les maladies
coronariennes (6).
Mais attention, il ne s’agit pas de tous les vins rouges : le cépage « pinot noir » est celui où l’on retrouve le taux de resvératrol le plus important avec des valeurs allant de 1 à 8mg/L (Opie et lecour 2007).
14
2.2 Origines du Resvératrol :
De manière générale, le resvératrol est produit par la plante en réponse à un stress. Qu’il soit d’origine chimique, physique (rayons UV par exemple) (7) voir un déficit en eau (8) ; le stress peut être biologique comme lors de la réponse à une infection par le champignon
Botrytis cinerea, ou pourriture grise bien connu des vignerons car il infecte en particulier les
grappes de raisins des vignes.
Ce champignon dispose de tout un panel d’enzymes capable de percer la paroi cellulaire des plantes et conduire ainsi à la décomposition des tissus (9).
La plante se défend par la production de resvératrol due à l’activation de la stilbène synthase.
D’un point de vue biochimique, le resvératrol est formé à partir de phénylalanine comme le montre la Figure 1, ci-après. Cette biosynthèse est le résultat d’une cascade enzymatique en quatre étapes.
· Tout d’abord la phénylalanine subit une désamination oxydative par l’action de la phénylalanine ammonium lyase, produisant de l’acide cinnamique et libérant un groupe amino.
· L’acide cinnamique est hydroxylé par la cinnamate-4-hydroxylase pour donner de l’acide para- coumarique.
· Lui-même converti en para-coumaryl-CoA, par l’adjonction d’un coenzyme A sous l’action de la CoA ligase.
15
· La dernière étape consiste en une condensation de ce para- coumaryl-CoA avec trois molécules de malonyl-CoA grâce à la stilbène synthase.
Figure 1: Para-coumaryl-CoA et resveratrol, par l'action des enzymes phenylalanine ammonia-lyase,Cinnamate-4-hydroxylase, CoA ligase et stilbene synthase
Les effets de ce stilbène ont été mis en évidence par une équipe de recherche au CNRS de l’université de Bourgogne (10), où on constate les dégâts provoqués par le resvératrol sur les cellules de Botrytis cinerea. Le resvératrol, en plus de stopper la prolifération fongique de
Botrytis cinerea, provoque un changement profond, au niveau structural, des cellules du
16
2.3 Propriétés Physiques :
Le resvératrol se présente sous deux formes isomères, trans- et cis-, avec un passage de la forme trans- (E) à la forme cis- (Z) par irradiation UV. Le trans-resvératrol est donc une molécule photosensible qu’une simple exposition à la lumière suffit à transformer de manière irréversible dans son isomère cis. C'est un composé instable supportant aussi assez mal la chaleur et les milieux oxydants.
L'isomère trans est la forme bioactive. Il a été montré que l'activité anti-oxydante du cis-resvératrol est 7 fois inférieure à celle du trans-cis-resvératrol.
17
2.4 Métabolisation et Biodisponibilité du resvératrol du vin :
Tout d’abord, avant de parler de biodisponibilité du resvératrol, on va s’intéresser plus généralement à la métabolisation des xénobiotiques.
2.4.1 Métabolisation des xénobiotiques
Les xénobiotiques sont des molécules non synthétisées par l’organisme. Il peut s’agir de médicaments, de drogues ou de composés chimiques provenant de l'environnement ou de l’alimentation, c’est le cas des polyphénols. Certains de ces composés peuvent être toxiques pour l’organisme qui cherche alors à s’en débarrasser, et le premier organe qui va filtrer ces molécules étrangères est l’intestin. En effet l’intestin dispose de cellules, les entérocytes, qui ont un pôle apical en contact avec la « lumière intestinale » et un pôle basal directement lié à la circulation sanguine.
Ces molécules traversent la barrière intestinale de différentes manières : soit via les jonctions entres les cellules c’est la voie « para-cellulaire » soit à travers la cellule, la voie « trans-cellulaire ». Une fois dans la cellule, les xénobiotiques sont alors métabolisés c’est-à-dire transformés afin de faciliter leurs passages dans le sang.
On distingue trois phases (figure 2) de métabolisation :
· fonctionnalisation (phase I)
· conjugaison (phase II)
18
Figure 2:Métabolisation des xénobiotiques par l'entérocyte
Phase I : Les enzymes de phase I oxydent, réduisent ou hydrolysent les molécules étrangères afin de les rendre plus polaires, donc moins hydrophobes, et de faciliter leur excrétion. Ce sont essentiellement les cytochromes P450 (CYP), qui assurent ces fonctions.
Phase II : Les réactions de conjugaison préparent les xénobiotiques en vue de leur excrétion. Les xénobiotiques (ou leurs dérivés issus de la phase I) sont conjugués avec des molécules comme l’acide glucuronique, le sulfate ou le glutathion. Les enzymes responsables de ces réactions sont les GSTs (glutathion-S-transférases),
UGTs (UDPglucuronosyltransférases) et SULTs (sulfotransférases).
Phase III ou phase 0: consiste à transporter ces différentes molécules vers l’extérieur de la cellule, que ce soit un retour dans la lumière intestinale des molécules inchangées (phase 0) ou un transport, basal ou apical, des molécules transformées (phase III).
Les protéines impliquées sont des transporteurs unidirectionnels de la famille ABC (ATP-Binding Cassette). On trouve principalement des ABC transporteurs au niveau des barrières naturelles de l’organisme (intestin, foie, rein et barrière hémato-encéphalique). Quatre sous-familles, parmi les sept décrites (A à G), prennent part au métabolisme des xénobiotiques, ce sont les ABC de type A, B, C et G (Szakacs et coll., 2006).
19
Certains de ces transporteurs possèdent plusieurs dénominations, comme par exemple MDR1/P-gp/ABCB1 (« MultiDrug Resistant protein 1/P-Glycoprotéine »), MRP1/ABCC1 (« Multidrug Resistance Related Protein 1 »), MRP2/ABCC2 ou BCRP/ABCG2 (« Breast Cancer Resistance Protein »).
Chaque sous-famille présente des affinités pour différents types de molécules. Les ABCB ou P-gp prennent surtout en charge des substrats hydrophobes ou amphiphiles neutres ou chargés positivement. Les ABCC ou MRP prennent en charge des anions organiques et des produits du métabolisme de phase II (glucurono-, sulfo- et glutathion-conjugués).
2.4.2 La biodisponibité du resvératrol
La biodisponibilité du resvératrol, c’est la proportion qui va effectivement agir dans l’organisme par rapport à la quantité absorbée. Malheureusement, elle est relativement faible après ingestion oral (11), dans un verre de vin par exemple.
Il est néanmoins assez bien absorbé au niveau intestinal (70%) (14) mais également très vite métabolisé. En effet, une étude récente de l’université de Hannover, Allemagne (12), met en évidence, in vitro, la rapidité d’absorption et de métabolisation du resvératrol par une culture de cellules Caco-2 ; ces cellules sont des cellules d’adénocarcinome du côlon humain capable d’exprimer les caractéristiques de cellules intestinales adultes.
La vitesse d’absorption ayant déjà été mesurée à entre 11,3-11,9 10.(-6) cm/s (ce qui est considéré comme rapide) (Kaldas, Walle,&Walle,2003), ici il est question de montrer à quel point le resvératrol est un excellent substrat pour les enzymes de métabolisation de phase II telles que sont la glucuronyl- et sulfotransferases, ce qui explique qu’il est rapidement transporté par la suite vers l’extérieur de la cellule.
A l’état naturel le resveratrol se trouve sous forme glycosylée (ou picéide), il convient donc de tenir compte de son absorption. Une partie du picéide est déglycosylé dans la lumière intestinale par la lactase phlorizine hydrolase, le reste traverse la membrane apicale via des
20
co-transporteurs sodium/glucose SGLT1. Le picéide incorporé est également déglycosylé en majeure partie par la β-D-glucosidase cytosolique dans les cellules de l’épithélium intestinal, comme le montrent des tests effectués sur cellules Caco-2 (13).
Resvératrol et picéide sont, en parallèle de ces mécanismes, ré-efflués vers la lumière intestinale via des transporteurs de type ABC (ATP-Binding Cassette) : MRP2/ABCC2 (Multidrug Resistance-associated Protein 2) et BCRP/ABCG2 (Breast Cancer Resistance Protein) (14). Ces deux enzymes sont impliquées dans la phase III du métabolisme de détoxification des xénobiotiques.
Dans le sang ce sont principalement les formes monoglucuronides (resvératrol-4’-O-D-glucuronide, resvératrol-3’-O-D-glucuronide) et monosulfates (resvératrol-3-sulfate) que l’on retrouve (Walle et coll., 2004; Boocock et coll., 2007). En effet le resvératrol est rapidement métabolisé par les enzymes de détoxification des xénobiotiques de phase II. Cet effet est retrouvé partiellement dès l’intestin grêle pour les glucuronides (Kuhnle et coll., 2000) et le sulfate (De Santi et coll., 2000b). D’après la figure, on se rend compte que malgré
l’augmentation de la dose administrée (jusqu’à 5g), la concentration maximale retrouvée dans le sang n’atteins qu’environ 500ng/mL.
Figure 3: concentration du resvératrol dans le sang (Cmax) chez un individu sain ayant reçu des doses de resvératrol de 25mg à 5000mg. (Walle 2011)
21
Le resvératrol est ensuite distribué dans l’organisme (Vitrac et coll., 2003) via le réseau artériel où il est fixé à l’albumine (Jannin et coll., 2004). Les organes accumulant le
resvératrol ou ses métabolites sont préférentiellement des organes impliqués soit dans l’absorption (système digestif), soit dans l’excrétion (foie, reins) (Vitaglione et coll., 2009).
L’accumulation dans le foie est particulièrement rapide et marquée, y compris sous forme aglycone. On retrouve donc du resvératrol dans différents liquides tels que la bile (et a fortiori les fèces) et l’urine, sa présence dans le sang n’étant que de courte durée.
L’entrée du resvératrol dans les cellules (hépatiques notamment) implique des processus de diffusion passive et des transporteurs actifs (Lancon et coll., 2004).
Au niveau hépatique, le resvératrol aglycone est métabolisé en resvératrol-4’-O-D-glucuronide, resvératrol-3’-O-D-glucuronide (De Santi et coll., 2000a) et resvératrol-3-sulfate (De Santi et coll., 2000b). Ceci est dû à l’action des enzymes de phase II du métabolisme de détoxification des xénobiotiques telles que certaines UGTs (UDP-GlucurosylTransférase) et SULT (SULfoTransférases).
L’expression de ces enzymes est d’ailleurs plus importante lorsque les cellules ont été mises en contact avec du resvératrol (Lancon et coll., 2007), suggérant une induction dépendante du resvératrol. Les métabolites ainsi produits sont ensuite expulsés de la cellule par des transporteurs/enzymes de phase III du métabolisme de détoxification des
xénobiotiques (BCRP, MRPs, MDR1).
Cette forte métabolisation conduit à la présence de seulement 1% de resvératrol libre dans le sang par rapport à la dose ingérée.
La multiplicité et la diversité des étapes impliquées dans l’absorption des
phytomicronutriments expliquent que des facteurs très variés peuvent affecter leur absorption (Borel, 2003). On conçoit ainsi qu’un facteur affectant l’extraction d’un phytomicronutriment
22
de sa matrice alimentaire puisse diminuer son absorption (Borel et al., 2013a). On conçoit aussi qu’un facteur qui complexeun micronutriment dans le tube digestif puisse diminuer son absorption. On conçoit enfin que des sujets qui n’expriment pas suffisamment certaines protéines nécessaires à l’absorption d’un phytomicronutriment puissent mal absorber ce phytomicronutriment.
Certains auteurs proposent cependant l’idée que ces métabolites circulants puissent régénérer le composé parent via des réactions de déconjugaison aux sites d’action (15, 16)
2.4.3 Améliorer la biodisponibilité du resvératrol
Pour améliorer la biodisponibilité d’un phytonutriment tel que le resvératrol, nous ne pouvons agir que sur certains facteurs :
a) La modification de la structure chimique :
Colin et Coll (2009) se sont rendu compte que l’ajout de groupements methyl permet d’améliorer la biodisponibilité du resvératrol.
b) L’augmentation de la dose absorbée :
On ne peut malheureusement pas augmenter la dose administrée de resvératrol indéfiniment afin d’augmenter son absorption, en effet on observe une saturation de la quantité absorbée, due notamment au nombre de transporteurs limités au niveau intestinal.
23
c) L’effet des nutriments et micronutriments absorbés en même temps :
Le resvératrol est rarement consommé seul, en effet il existe de nombreux nutriments et micronutriments présents dans la matrice alimentaire dans laquelle il est consommé. Il est donc logique de se pencher sur les interactions pouvant exister entre le resvératrol et les autres composés des aliments vis-à-vis de son absorption.
d) L’effet de la matrice alimentaire dans laquelle il est ingéré et de ses traitements technologiques :
Le resvératrol est soit ingéré dans sa matrice alimentaire naturelle, soit dans des suppléments dans lequel il est enrobé d’excipient. La question s’est donc posée de l’effet de ces différentes matrices sur la biodisponibilité des phytomicronutriments. En effet, dans une étude pharmacocinétique du resvératrol réalisée chez 11 volontaires sains, le resvératrol s'est avéré mieux absorbé par les produits de raisins naturels que par les comprimés, confirmant ainsi l'importance de la matrice pour sa biodisponibilité (Ortuno et al., 2010).
De ce fait, une étude assez récente en 2013 (17) effectuée à Marseille proposait une nouvelle formulation, donc une matrice technologique différente, afin d’optimiser la biodisponibilité du resvératrol. Mélangé à une solution de complexe lipidique, le trans-resveratrol extrait de P. Cuspidatum induit une concentration sanguine efficace pendant plusieurs heures alors que la poudre sèche du même resvératrol n’atteint cette concentration que pendant un court laps de temps.
Il a été calculé qu’on obtient avec cette nouvelle formulation un taux de resveratrol libre circulant dans le sang 8,8 fois plus élevé que la poudre simple.
24
e) L’utilisation de nanoparticules :
Comme dans l’industrie pharmaceutique où des nanoparticules sont utilisées pour augmenter l’absorption de médicaments, des nanoparticules commencent à être utilisées dans le but d’améliorer la biodisponibilité de phytomicronutriments.
Certains résultats semblent prometteurs. Il a été montré que des nanoparticules de chitosane augmentent d’un facteur 3 la biodisponibilité du resvératrol (Zu et al., 2014).
Malgré ces résultats encourageants, il est bien évident que des questions de sécurité
alimentaire se posent pour ces nanoparticules, comme pour les autres nanoparticules. Il faut en effet s’assurer qu’elles ne s’accumulent pas dans l’organisme (McClements, 2012). On peut aussi se poser la question de la distribution tissulaire des phytomicronutriments qui sont incorporés dans ces particules. Il est en effet probable que, transportés par ces particules, ils ne seront pas délivrés aux mêmes tissus, ou aux mêmes concentrations, que quand ils suivent leurs voies métaboliques naturelles. Malgré tout le potentiel de cette nouvelle technologie, des contrôles toxicologiques sont donc à effectuer avant de les employer pour améliorer la teneur tissulaire.
f) La voie d’administration :
Le taux de resvératrol circulant pourrait être augmenté artificiellement par
l’administration de resvératrol en injection intraveineuse ou en hydrogels dermiques, le métabolisme étant relativement faible au niveau de la peau (Hung et coll., 2008), mais étant donné la vitesse de métabolisation hépatique, des prises fréquentes seraient nécessaires pour maintenir un taux circulant suffisant pour induire des effets biologiques.
25
PARTIE I
LE RESVERATROL A
L’OFFICINE
26
1 Anti-Oxydant
Le stress oxydant est classiquement défini comme l’altération de la balance
oxydants/antioxydants en faveur des oxydants (Roberts et al, 2000). En d’autres termes, le stress oxydant se caractérise par un déséquilibre entre la production des radicaux libres (RL) et les capacités anti oxydantes de l’organisme.
Un radical libre est un atome ou molécule ayant un ou plusieurs électrons non appariés sur une orbitale. Cette absence d’appariement lui confère une grande réactivité et donc une durée de vie très coutre de l’ordre de 10-3 à 10-6 secondes.
En effet, un radical libre aura toujours tendance à remplir son orbitale en captant un électron pour devenir plus stable: il va donc se réduire en oxydant un autre composé (lipides, protéines, ADN...) (Halliwell, 1996b).
Afin de contrecarrer l’action des RL, notre organisme dispose d’un système de défense: les antioxydants enzymatiques et non enzymatiques.
Un antioxydant est une substance qui retarde ou empêche l’oxydation d’un substrat oxydable : protéines, hydrates de carbones, acides gras (Dekkers et al, 1996).
27
1.1 Classification des radicaux libres
Il existe trois principales catégories de radicaux libres :
· Les espèces oxygénées actives (EOA) : comme par exemple le radical superoxyde (O2●-) et le radical hydroxyle (OH●). Les EOA incluent des radicaux libres et des composés réactifs oxydants non radicalaires (sans électrons libres dans leur couche externe) comme le peroxyde d’hydrogène (H2O2), l’acide hypochloreux (HOCl), et l’ozone (O3).
· Les espèces azotées actives (EAA) : comme par exemple l’ion peroxynitrite (ONOO●), le dioxyde d’azote (N2O●), le monoxyde d'azote (NO●).
· Les espèces soufrées actives (ESA) : comme le radical thiyl(RS●)
· Les recherches s’intéressant au stress oxydatif lié à l’exercice physique mettent l’accent, la plupart du temps, sur l’étude des espèces oxygénées actives dans la mesure où les espèces azotées actives et les espèces soufrées actives peuvent être considérées comme secondaires vis à vis des EOA. En effet, celles-Ci sont produites après réaction des EOAavec d’autres molécules (Giles et al, 2002).Les principaux types et effets des radicaux libres sont présentés dans le tableau
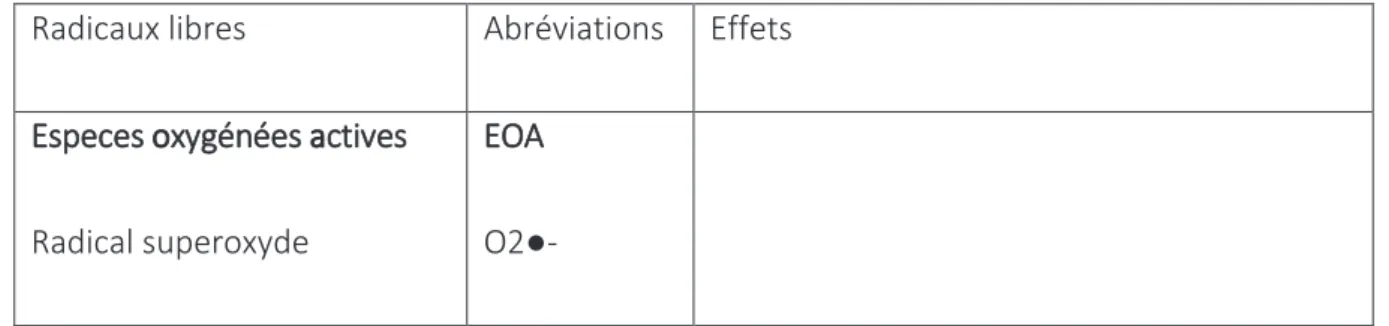
Tableau 1 : principaux types et effets des espèces réactives oxydantes Radicaux libres Abréviations Effets
Especes oxygénées actives
Radical superoxyde
EOA
28 Peroxyde d’hydrogène Radical hydroxyle Ozone H2O2 OH● O3
Oxydation des lipides, des protéines et de
l’ADN
Espèces azotées actives
Monoxyde d’azote Dioxyde d’azote Peroxynitrite EAA NO● N2O● ONOO●
Oxydation des lipides, des protéines et de
l’ADN
Espèces soufrées actives
Radical thiyl
ESA
RS● Oxydation protéique, ADN
Production EOA.
1.2 Formation des radicaux libres
1.2.1 Formation des Espèces oxygénées actives
La majeure partie de l'oxygène dans la chaine respiratoire mitochondriale subit une réduction tétravalente (addition de 4 électrons, réaction 1) conduisant à la production d'eau et d’énergie. Cette réaction est catalysée par le cytochrome C (coenzyme Q), accepteur terminal d’électrons présent dans le complexe IV de la chaîne du transport des électrons.
29
Toutefois, cette chaîne de transport laisse fuir une certaine proportion d'électrons qui vont réduire l'oxygène, mais en partie seulement. C'est ainsi qu'environ 2 % de l'oxygène subit une réduction monoélectronique (addition d'un seul électron, réaction 2) conduisant à la formation du radical superoxyde (O2●-) (réaction 2).
O2+ 1 e-→ O2●- (réaction 2).
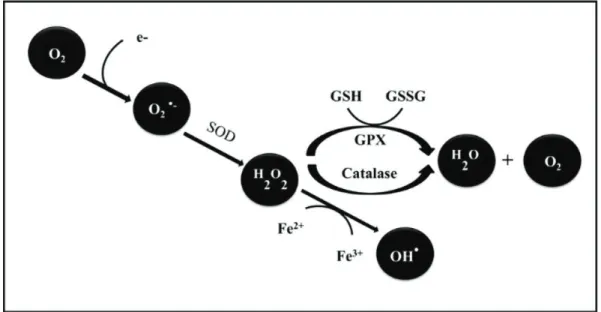
Le radical superoxyde, qui présente une certaine toxicité, est éliminé entièrement ou maintenu à un niveau de concentration basse par les enzymes superoxyde dismutases (SOD) qui catalysent sa disparition par dismutation (réaction 3)
SOD
2 H+ + O2●-+ O2●-→ H2O2+ O2 (réaction 3)
La concentration de H2O2 issue de la réaction 3 est régulée par des enzymes telles que la catalase et la glutathion peroxydase. La catalase accélère la réaction de dismutation de l'eau oxygénée en oxygène et en eau (réaction 4). La glutathion peroxydase (GPX) accélère la réaction d'oxydation du glutathion (GSH) par l’intermédiaire de l'eau oxygénée pour former la glutathion oxydée(GSSG) (réaction 5).
Catalase
30
GPX
H2O2+ GSH → 2 H2O + GSSG (réaction 5)
La majeure partie de la toxicité de l'eau oxygénée provient de sa capacité à générer le radical hydroxyle OH● en présence de cations métalliques tels que Fe2+ selon la réaction dite de «Fenton » (réaction 6).
H2O2+ Fe2+→ OH-+ Fe3++ OH● réaction de Fenton (réaction 6)
Figure 4:principales étapesde la production des EOA 1.2.2 Formation des espèces azotées actives
Le NO● est synthétisé par voie enzymatique à partir d’un atome d’azote de l’acide aminé L-arginine et d’une molécule d’oxygène. Les réactions du NO● avec l’oxygène et l’O2●-forment respectivement le dioxyde d’azote (NO2●) et l’anion peroxynitrite (ONOO●-) (réaction 7 et 8).
31
Les conséquences délétères de ces deux dérivés sont considérées comme des effets indirects du NO● (Marnett et al, 2003).
2NO●+ O2→2NO2● (réaction 7)
NO● + O2●-→ONOO●-(réaction 8)
1.3 Source de production des radicaux libres
1.3.1 Sources endogènes 1.3.1.1 La mitochondrie
Les éléments clés dans le fonctionnement de la mitochondrie sont d’une part, les réactions enzymatiques d’oxydation des substrats et d’autre part, la chaîne du transport des électrons ou chaîne respiratoire.
L’oxydation des substrats par le cycle de Krebs ou la β-oxydation entraîne la réduction du NAD+ en NADH et du FAD en FADH2. Ces intermédiaires sont appelés équivalents réducteurs et fournissent des électrons à la chaîne respiratoire. Cette dernière est composée de cinq complexes: NADH-ubiquinone oxydoréductase (complexe I), succinate déshydrogénase (complexe II), ubiquinol cytochrome C réductase (complexe III), cytochrome C oxydase (complexe IV) et ATP synthase (complexe V).
Ces complexes contiennent de multiples centres d’oxydo-réduction: flavines, quinones, centres fer-soufre, hèmes et ions cuivres.
Nous allons présenter dans la suite le fonctionnement de chaque complexe de la chaine du transport des électrons.
32
Le complexe I: Il oxyde le NADH+, H+ en NAD+réduisant ainsi l’ubiquinone (coenzyme Q) en coenzyme QH2 et pompe des protons (4 H+) de la matrice vers l'espace intermembranaire.
Le complexe II: Il oxyde le succinate en fumarate et continu à réduire le coenzyme Q en coenzyme QH2.
Le complexe III: Il transfère 2 électrons de QH2 aux molécules de cytochrome C (localisé dans l’espace intermembranaire mitochondrial) entraînant ainsi la ré-oxydation de QH2. Il Transfère également 2 protons à travers la membrane.
Le complexe IV: Grâce à son site de liaison avec l’oxygène, il transfère des électrons de cytochrome C à l’oxygène moléculaire pour former de l’eau. Il transfère également des protons à travers la membrane. On dit alors que le cytochrome C établit une navette des électrons du complexe III au complexe IV.
Le complexe V: Il permet le passage des protons de l’espace intermembranaire vers la matrice. Ce faisant, il récupère l’énergie que les autres enzymes de la chaîne utilisent pour accumuler les protons dans l’espace intermembranaire qui crée un gradiant de protons. Cette énergie est couplée à la réaction de phosphorylation de l’ADP par un phosphate inorganique assurant ainsi la synthèse de l'ATP.
En résumé, dans la chaine de transport des électrons, les NADH, H+ et le FADH2 transmettent leurs électrons au complexe I et II, respectivement. Ils sont ensuite transférés au complexe III par le coenzyme Q, capable de transporter deux électrons. Enfin, le cytochrome C transporte les électrons, un par un, du complexe III au complexe IV qui réduit O2 en H2O (figure 5).
33
Figure 5: La chaine respiratoire mitochondriale
CoQ : Coenzyme Q10 ; C : Cytochrome C
La chaine respiratoire mitochondriale est considérée comme la première source de radicaux libres dans les organismes aérobies. Il existe deux sites précis de formation des radicaux libres: les complexes I et III.
Production des EOA par le complexe I
Le complexe I a la forme générale d’un L inversé, avec une partie hydrophobe enfouie dans la membrane et un bras vertical qui se prolonge dans la matrice mitochondriale (figure 5). Le transfert des électrons du NADH,H+ à l’ubiquinol (QH2) se fait à travers une chaine de centres redox. Le site exact de production des EOA dans le complexe I est encore mal connu. Cependant, la majeure partie des radiaux O2●- produits vont dans la matrice, ce qui est en faveur d’une fuite des électrons au niveau du bras vertical de ce complexe (Kushnareva et al, 2002).
1.3.1.2 Cytochromes P450
Les cytochromes P450 (CYP) sont des enzymes qui catalysent l’hydroxylation de leur substrat (RH), en utilisant le NADPH comme donneur d’électrons (réaction10):
34
RH + O2 + NADPH+ + H+ → ROH + H2O + NADP+ (réaction 10)
La majorité des CYP450 est localisée dans le réticulum endoplasmique alors que d’autres se localisent au niveau de la mitochondrie (Slaughter et al, 1995). Il existe chez l’homme de multiples isoformes des CYP450 qui sont chacune spécifique d’un ou plusieurs substrats. La réaction catalysée par le CYP450 peut parfois conduire à la formation d’O2●- lorsque l’O2 subit une réduction monovalente.
1.3.1.3 NADPH oxydase
La nicitinamide adénine dinucléotide phosphate oxydase (NADPH oxydase) est une enzyme membranaire qui catalyse la réduction mono-électronique de l’oxygène en
utilisant le NADPH ou le NADH comme donneur d’électrons entrainant la formation des radicaux superoxydes (Maghzal et al, 2012) (réaction 11) :
NADPH + 2 O2 → NADP+ + H+ + 2 O2●- (réaction 11)
1.3.1.4 Xanthine oxydase (XO)
La xanthine oxydase est une enzyme qui génère des radicaux libres (RL) en réduisant l’hypoxanthine en xanthine et la xanthine en acide urique (Harrisson et al, 2002). Cette enzyme est présente dans le sang, les cellules endothéliales et aussi dans le foie. La
localisation cellulaire de la XO est essentiellement cytoplasmique. La production des RL par la XO est faible au repos, mais elle joue un rôle important lors de l’ischémie-reperfusion (Heunks et al, 1999).
35
Figure 6: Sources principales de productions des radicaux libres au niveau cellulaire
RL : radicaux libres, XO : xanthine oxydase, NADPH : nicitinamide adénine
dinucléotide phosphate, CYP : Cytochromes P450, : production des RL, : attaque radicalaire.
1.3.2 Sources exogènes
Les radicaux libres peuvent être d’origine exogènes pour lesquelles l’on peut identifier plusieurs sources (Ames et al, 1992 ; Finkel et al, 2000). Les ultraviolets et les rayonnements ionisants sont responsables de la formation de l’oxygène singulet (1O2) (Hideg et al, 2002). Diverses toxines issues de l’environnement peuvent causer ou promouvoir la formation de radicaux libres citons entre autres les oxydes d’azotes présents dans la fumée de cigarette, les métaux toxiques (chrome, vanadium) ainsi que le fer et le cuivre issus de l’alimentation et certains composés phénolés (Valavannidis et al, 2009 ; Valko et al, 2006). Ces sources exogènes liées à l’environnement restent cependant minoritaires en comparaison des sources endogènes.
36
1.3.3 Formation des radicaux libres lors de l’oxydation d’hémoglobines
L’hémoglobine est une molécule qui a comme principal rôle de transporter l'oxygène des poumons aux tissus de l’organisme et de transporter le gaz carbonique dans le sens inverse. Dans le globule rouge, l’oxyhémoglobine, par une réaction d’oxydation intramoléculaire spontanée, pourrait génèrer de la méthémoglobine et l’ion superoxyde (Wallace et al, 1982) (réaction 13).
HbFe2+O2 → HbFe3+ + O2●- (Réaction 13)
1.4 Effets des radicaux libres
1.4.1 Effets bénéfiques
Les RL sont connus essentiellement pour leurs effets délétères, mais ils sont également indispensables au fonctionnement de notre organisme. Cependant les bienfaits des RL nécessitent de basses concentrations dans le milieu cellulaire. Ci-dessous sont présentés quelques exemples physiologiques impliquant la présence nécessaire des RL.
1.4.1.1 Rôle dans la contraction musculaire
Les RL sont impliqués dans le mécanisme de la contraction musculaire. Certaines études scientifiques ont montré que les RL agissent sur le couplage excitation-contraction au niveau des fibres musculaires (Close et al, 2005). Dans ce contexte, Favero et al (1995) ont montré que les radicaux H2O2 favorisent la libération du Ca2+ au niveau du réticulum sarcoplasmique et stimulent l’ouverture des canaux calciques.
37
1.4.1.2 Rôle immunitaire
Les radicaux libres jouent un rôle dans le déroulement de la réaction immunitaire. Ils sont produits par les cellules phagocytaires pour être utilisés dans la lutte contre les
bactéries. La phagocytose des bactéries et des parasites par les macrophages ou les
polynucléaires s'accompagne d'une production d'espèces réactives de l'oxygène si brutale et intense qu'elle est connue sous le nom de « burst oxydatif », c'est-à-dire explosion oxydative. Au sein du phagosome, l'activation de la NADPH oxydase et l'action des superoxydes dismutases (SOD) et de l’oxyde nitrique synthase (NOS) aboutissent à un mélange très corrosif de O2●-, OH●, H2O2 et ONOOH. Ce mélange réactionnel détruit par oxydation l'ensemble des composants bactériens (Favier et al, 2003).
1.4.2 Effets délétères 1.4.2.1 Oxydation de l’ADN
Les attaques radicalaires de l’ADN peuvent être classées en cinq catégories selon le type de dommage causé:
· Les modifications des bases azotées en particulier la guanine. Cela entraine un non-appariement des bases, ou un mauvais appariement, ou encore un blocage de la réplication de l’ADN (Halliwell, 1999).
· La formation de sites abasiques due à la rupture de la liaison N-glycosidique entre le désoxyribose et la base azotée (Kryston et al, 1999).
· Les coupures des brins résultant essentiellement d’une déshydrogénation du désoxyribose.
38
· La formation d’adduits due aux aldéhydes issus de la peroxydation lipidique en particulier le 4-hydroxy-2-nonénal (4-HNE) et la malondialdéhyde (MDA) (Marnett, 1999).
· Les pontages ADN-protéines : les RL peuvent agir indirectement en attaquant les protéines qui sont en contact de l’ADN : histones, enzymes et facteurs de la réplication ou de la transcription … Les protéines oxydées réagissent alors avec l’ADN formant des pontages ADN-protéines (Oleinick et al, 1987).
Les conséquences des RL sur l’ADN peuvent participer à une mutagénèse, à un arrêt des divisions cellulaires par blocage des mécanismes de réplication, à un arrêt de la synthèse protéique par blocage des mécanismes de transcription/traduction, et enfin à une mort cellulaire (Dizdaroglu et al, 2002 ; 2012 ; Cooke et al, 2003).
1.4.2.2 Oxydation des protéines
Les modifications des protéines par les RL provoquent l’introduction d’un groupe carbonyle dans la protéine (Levine et al, 1990). L’oxydation des protéines peut avoir lieu à deux niveaux différents : celui qui casse les liaisons peptidiques et modifie la chaine
peptidique et celui qui modifie les peptides par addition de produits issus de la peroxydation lipidique. Ces modifications conduisent à une altération structurale des protéines dont les conséquences sont majeures : perte de fonction catalytique, augmentation de la sensibilité aux protéases… (Stadtman et al, 2000).
39
1.4.2.3 Oxydation des lipides
L’oxydation des lipides ou peroxydation lipidique, correspond à la détérioration oxydative de doubles liaisons d’acides gras insaturés que l’on trouve dans les acides gras polyinsaturés (AGPI). Ceux-ci pourraient subir des attaques radicalaires et génèrent des peroxydes lipidiques qui sont eux même très réactifs.
L’oxydation des lipides, en particulier des résidus d’acides gras polyinsaturés, conduit à la formation de produits primaires : peroxydes, radicaux libres, diènes conjugués très instables et rapidement décomposés en produits secondaires (aldéhydes, alcools, cétones). Au niveau cellulaire, tous les composants de la cellule sont touchés et tout particulièrement les
membranes plasmique, mitochondriale et lysosomale. La peroxydation lipidique induit ainsi une perturbation dans la structure et la composition de la membrane cellulaire qui se
manifeste le plus souvent par une augmentation de la perméabilité membranaire.
1.5 Les défenses antioxydantes
D’après Halliwell (1996a), les mécanismes d’action d’un antioxydant peuvent comprendre :
· Le piégeage direct des RL
· L’inhibition des enzymes responsables de la production des RL
40
1.5.1 Antioxydants endogènes 1.5.1.1 Antioxydants enzymatiques :
a) Superoxyde dismutase
La SOD assure l’élimination de l’anion supersoxyde, première espèce toxique formée à partir de l’oxygène. Elle assure ainsi la première ligne de défense contre le stress oxydant. La SOD a besoin d’oligo-élements comme le cuivre et le zinc (Cu-ZnSOD présente dans le cytosol) ou le manganèse (MnSOD présente dans la mitochondrie) pour fonctionner correctement. La SOD existe aussi dans le milieu extracellulaire (Fridovich, 1995).
b) Glutathion peroxydase et glutathion réductase
La GPX est une enzyme séléno-dépendante, dont il existe plusieurs isoformes, réparties différemment dans la cellule. Elle catalyse la réaction de transformation des H2O2.
c) Catalase
La catalase est également responsable de l'élimination d'H2O2 par une transformation en H2O et O2. Contrairement à la GPX, l'affinité de la catalase pour l'H2O2 est élevée seulement lorsque la teneur en peroxyde d'hydrogène est élevée (Matés, 2000). Cette enzyme est abondante dans le foie et les globules rouges. Elle se retrouve préférentiellement dans les peroxysomes et en plus faible quantité dans le cytosol.
41
1.5.1.2 Antioxydants non enzymatiques
a) Le glutathion réduit (GSH)
Le GSH peut agir directement avec les RL
b) L’acide urique
Il s’agit d’un produit issu du catabolisme des bases puriques. L’acide urique, présent à des concentrations beaucoup plus élevées que l’acide ascorbique, apporte les deux tiers de la capacité antioxydante du plasma (Johnson et al, 2009). Il représente en effet à lui seul 60% de l’activité antioxydante mais plus de 80 % en considérant la somme des concentrations de deux acides ascorbique et urique (Whitehead et al, 1992). En cas de stress oxydant, la concentration de l’acide urique augmente.
1.5.1.3 Antioxydants exogènes 1.5.1.4 Vitamine E
La vitamine E est l'antioxydant liposoluble qui a la plus grande concentration molaire cellulaire. On ne dénombre pas moins de huit formes de vitamine E dont la plus active est l'alpha-tocophérol (Meydani, 1995). Elle permet de diminuer la peroxydation lipidique dans la membrane cellulaire et au sein du cholestérol (LDL) (Meydani et al, 1993). Elle agit en
neutralisant les radicaux libres, devenant elle-même un radical non toxique selon la réaction (réaction 16) :
42
Le tocophérol porteur d'un radical peut réagir avec un nouveau radical libre pour former une espèce neutre, ou être régénéré par la vitamine C.
1.5.1.5 Vitamine C
Cette vitamine n’est pas synthétisée par l’organisme. Sa concentration dépend en grande partie de l’alimentation. Elle joue un rôle important dans la protection de divers substrats biologiques comme l’ADN, les protéines et les acides gras. Lors de son oxydation en acide déshydroascorbique, elle passe à une forme radicalaire intermédiaire (radical ascorbyle) qui joue un rôle essentiel dans la régénération de la vitamine E (Evans, 2000).
1.5.1.6 Caroténoïdes
Ils sont majoritairement représentés par la β-carotène, appelée aussi « pro-vitamine A ». La plupart des caroténoides et vitamine A interagissent avec l’oxygène singlet et ainsi
empêchent l’oxydation de plusieurs substrats comme les acides gras polyinsaturés (Di Mascio et al, 1991).
1.5.2 Autres antioxydants
1.5.2.1 Le Coenzyme Q10 et cytochrome C
L’ubiquinone ou Q10 est connu pour son rôle dans la production de l’énergie au niveau de la mitochondrie. Il agit sous sa forme réduite "ubiquinol" comme antioxydant (Stocker et al, 1991). L’ubiquinol protège les membranes de la peroxydation lipidique par une diminution de la formation et de la propagation de radicaux peroxyls. L’ubiquinone est également
impliquée dans la régénération de la vitamine E ce qui amplifie son rôle protecteur contre les RL (Frei et al, 1990).
43
Le cytochrome C présent dans l'espace intermembranaire joue un rôle de détoxification en captant l'électron libre d’O2●- produit au niveau de la chaîne respiratoire mitochondriale. Ainsi réduit, il cède cet électron au complexe IV formant du cytochrome C oxydé et de l’eau (Pereverzev et al, 2003).
1.5.2.2 Flavonoïdes
Ils font partie de la famille des polyphénols. In vitro, les flavonoïdes peuvent inhiber la lipoperoxydation (notamment des LDL) et piéger des RL tels que OH●, NO3-, et anion hypochlorite (HClO) (Rice-Evans et al, 1996 ; Halliwell et al, 2007). In vivo, leur action antioxydante n’est pas encore bien établie. Cependant, certaines études ont montré un effet économisant des flavonoïdes sur la vitamine E et la β-carotène (Halliwell, 2007).
1.6 Evaluation du stress oxydant
Sans développer les méthodes complexes d’évaluation de la balance oxydation.anti-oxydation, nous allons noter qu’il existe 3façons principales de l’évaluer :
· La mesure de la production des radicaux libres
· La mesure des paramètres anti-oxydants :
il existe un test simple : le test au DPPH. Le DPPH est un radical libre stable et coloré dont l’absorbance maximale se situe entre 515-517nm dans le domaine du visible. Le composé à tester est ajouté à la solution de DPPH ; la réaction
attendue est la réduction du DPPH en DPPH-H. Après un laps de temps
relativement court on mesure à nouveau l’absorbance de la solution obtenue par spectroscopie UV-visible. On peut ainsi définir un pourcentage de réduction selon cette équation :
Pr = ( Aantiox / Acontrol) x 100
Ce test, largement utilisé, est rapide et facile à réaliser; il permet donc de comparer un grand nombre de composés.
44
· La mesure des marqueurs des dommages radicalaires (protéines, lipides et acides nucléiques)
La peroxydation lipidique est l'effet le plus anciennement connu des effets des radicaux libres et le plus simple à mesurer lors de l’étude du stress oxydant. Un certain nombre de produits de dégradation des lipides et des lipoprotéines peut se retrouver après une peroxydation. Dans le cadre de l’étude du stress oxydant, les diènes conjugués et les aldéhydes sont les paramètres les plus importants dans le sang (Moore et al, 1998).
Maintenant que nous avons mis en évidence ce qu’on entend communément comme étant « un milieu oxydant » et d’avoir précisé quels étaient réellement les enjeux du point de vue physiologique, nous allons nous intéresser plus particulièrement au resveratrol.
1.7 Resveratrol anti-oxydant
1.7.1 Effet sur la peroxydation lipidique
Une étude menée en 2009 (18) afin de montrer la relation entre les effets anti-oxydants du resvératrol et sa capacité à diminuer la peroxydation du cholestérol. En effet force est de constater qu’il existe bien un lien entre la diminution de cette peroxydation et l’augmentation de la concentration de resvératrol. Pour cela deux méthodes ont été réalisée :
· La première par l’utilisation du CuSO4 :
L’agent oxydant ici est l’ion métal cuivre qui induit la transformation des lipoproteines en LDL polyinsaturés par la formation de doubles liaisons (19). Le profil cinétique de cette oxydation est caractérisé par une phase appelée phase de latence « lag phase » suivi de la phase de propagation où le taux de doubles liaisons est le plus élevé, et enfin la phase de décomposition. Avec cette méthode on s’intéresse à la phase de latence juste avant le point
45
culminant de l’oxydation. Sur la figure A on peut constater que l’augmentation de la concentration de resvératrol diminue significativement l’oxydation des LDL.
Figure 7: diminution de l'oxydation des LDL par l'augmentation de la concentration en resvératrol
· La seconde par radiation du milieu :
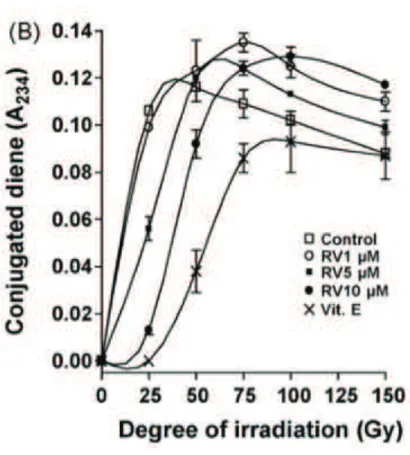
Une autre technique est utilisée, cette fois plus sélective et quantitativement plus précise en terme de production de radicaux libre, sans l’utilisation d’ion métal (20).
On a oxydé le milieu par radiation, induisant la formation de radicaux hydroxyle et radicaux superoxyde. On constate de même la peroxydation des lipides. Dans la figure 7 nous avons en revanche les 3 phases de la peroxydation lipidique, différentes concentrations de resvératrol et un oxydant de référence : la vitamine E.
On remarque, de même, une augmentation de la phase de latence avec la concentration en resvératrol. La vitamine E reste malgré tout un bien meilleur anti-oxydant dans ce cas.
46
Figure 8: différentes concentrations de resvératrol face à la péroxydation lipidique et la vitamine E comme référence anti-oxydante
De plus, il a été observé que le resvératrol aidait, par son activité anti-oxydante, à l’élimination du cholestérol. Il a été démontré dans une autre étude que l’oxydation des macrophages, jouant le rôle d’éboueurs du cholestérol dans des conditions normales, ne jouaient plus ce rôle sous stress oxydatif (21).
L’étude qui nous intéresse a cherché à démontrer le rôle bénéfique du resveratrol vis-à-vis de cet échec. Pour cela, on a utilisé des macrophages de souris sous stress oxydatif induit par des ions métalliques (ici le fer). On observe clairement une élimination du cholestérol restaurée par le resvératrol, toujours à dose dépendante. (figure 9).
47
Figure 9:Elimination du cholestérol facilitée par le resvératrol
Nous nous intéresserons plus en détail de cet effet sur le cholestérol en deuxième partie, sur les effets cardioprotecteurs du resvératrol.
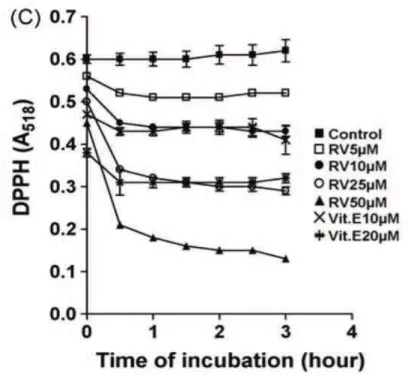
1.7.2 Effet direct sur les radicaux libres
Lors de cette même étude, des chercheurs ont voulu appuyer l’effet anti-oxydant du resvératrol en utilisant le test au DPPH. Ici, on a utilisé les concentrations en resvératrol à 5, 10, 25 et 50 µM ainsi que celles en vitamine E à 10 et à 20 µM. Ce que l’on peut constater avec le figure 9 c’est que l’absorbance du radical DPPH diminue avec l’augmentation en concentration de resvératrol, tout comme avec la vitamine E. d’ailleurs, fait intéressant, pour des concentrations similaires on constate la même réduction du radical pour la vitamine E et pour le resvératrol.