UNIVERSITÉ DU QUÉBEC
À
MONTRÉALCOMPARAISON DE L'EFFICACITE DE LA LEVODOPA ET DE LA LEVODOPA EN COMBINAISON A UN AGONISTE DOPAMINERGIQUE SUR
LA MOBILITE DANS LA COMMUNAUTE, SUR LE NIVEAU D'ACTIVITE PHYSIQUE ET SUR LE NIVEAU D'ACTIVITE DURANT LA NUIT CHEZ LES
PERSONNES AYANT LA MALADIE DE PARKINSON
MÉMOIRE
PRÉSENTÉ COMME EXIGENCE PARTIELLE DE LA MAITRISE EN KINANTHROPOLOGIE
RÉDIGÉE PAR GENEVIÈVE FAUCHER
UNIVERSITÉ DU QUÉBEC À MONTRÉAL Service des bibliothèques
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé le formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles supérieurs (SDU-522- Rév.0?-2011). Cette autorisation stipule que «conformément
à
l'article 11 du Règlement no 8 des études de cycles supérieurs, [l'auteur] concèdeà
l'Université du Québecà
Montréal une licence non exclusive d'utilisation et de publication de la totalité ou d'une partie importante de [son] travail de recherche pour des fins pédagogiques et non commerciales. Plus précisément, [l'auteur] autorise l'Université du Québecà
Montréalà
reproduire, diffuser, prêter, distribuer ou vendre des copies de [son] travail de rechercheà
des fins non commerciales sur quelque support que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une renonciation de [la] part [de l'auteur]à
[ses] droits moraux nià
[ses] droits de propriété intellectuelle. Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de commercialiser ou non ce travail dont [il] possède un exemplaire.»REMERCIEMENTS
Je tiens à commencer mon mémoire en remerciant les gens qui ont été de près ou de loin impliqués dans mon projet de maitrise. D'abord, mes fabuleux participants sans qui cette belle aventure n'aurait pas été possible. Je vous dis merci pour votre engagement et surtout pour votre confiance envers mon projet de maitrise. Ensuite, je tiens à remercier mes professeurs Christian Duval, Antony Karelis, les spécialistes, Philippe Huot et Simon Brière pour votre support académique et grande expertise. Merci à mes collègues de laboratoire Margaux Blamoutier, Sarah Bogard, Étienne Goubault et Hung Nguyen pour vos encouragements et votre soutien. Spécialement pour toi Margaux, tes précieux conseils et le partage de ton savoir, m'ont permis d'affronter plusieurs obstacles. Finalement, un merci très chaleureux à ma famille et mes ami(e)s. Votre généreux appui a été indispensable au succès de mes études.
DÉDICACE
À
mon étoile,TABLE DES MATIÈRES
LISTE DES TABLEAUX ... vii
LISTE DES ABRÉVIATIONS ET ACCRONYMES ... viii
RÉSUMÉ ... ix
INTRODUCTION ... . CHAPITRE I REVUE DE LITTERATURE ... 1
1. 1 Maladie de Parkinson ... 1
1.2 Épidémiologie ... 1
1.3 Étiopathologie ... 2
1.4 Physiopathologie ... 2
1.5 Symptômes moteurs ... .4
1.6 Symptômes non moteurs ... 6
1. 7 Options de traitement ... 7 1.8 Levodopa ., ... : ... 7 1.8.1 Avantages ... 8 1.8.2 lnconvénients ... 8 1.8.2.1 Absorption ... 8 1.8.2.2 Dyskinésies ... 9 1. 9 Agonistes dopaminergiques ... 10 1.9.1 Avantages ... l2 1.9.2 lnconvénients ... l2 CHAPITRE II RATIONNEL ... 13 CHAPITRE III Questions et hypothèses de recherche ... 16
CHAPITRÉ IV MÉTHODOLOGIE ... 18
4.1 Sujets ... 18
4.2 Critères d'inclusion et d'exclusion ... 18
4.3 Recrutement ... 19
4.4 Procédures ... 19 4.5 Instruments de mesure ... 19 4.5.1 MoCA ... .-... 19
4.5.3 Journal de bord ... 21 4.5.4 Sensewear body media Armband ... 21
4.5.5 GPS ... 23
4.6 Protocole ... 25
4. 7 Rencontre 1 ... 25
4.8 Rencontre Il ... 26
4.9 Rencontre Ill ... 26
4.10 Variables indépendantes et dépendantes ... 27
4.1 0.1 Variables indépendantes ... 27
4.1 0.1.1 Traitements pharmacologiques ... 27
4.10.2 Variables dépendantes ... 27
4.1 0.2.1 Mobilité dans la communauté ... 27
4.1 0.2.2 Niveau d'activité diurne ... 28
4.1 0.2.3 Niveau d'activité nocturne ... 28
4.11 Statistiques ... 29 4.11.1 Analyse ... 29 4.12 Échéancier. ... 3l CHAPITRE V RÉSULTATS ... 30 CHAPITRE VI DISCUSSION ... .' ... 36 5.1 Paramètres diurnes ... 36 5.2 Paramètres nocturnes ... 39 6.1 Forces de 1 'étude ... 4l 6.2 Faiblesses de 1 'étude ... 42
6.3 Futures études ... .45 CONCLUSION ... 47 ANNEXES ... 48 ANNEXE A Affiche de recrutement. ... 49 ANNEXE B Texte de recrutement. ... 50 ANNEXEC Formulaire d'information et de consentement ... 52
ANNEXED Montreal Cognitive Assessment ... : ... 60
ANNEXEE EQ-5D ... 59
ANNEXEF
Informations socio démographique ...
..
...
.
..
.
... 59
ANNEXEG
Certificat
d
'
accomplissement ...
.
...
...
...
...
..
....
...
..
...
59
ANNEXEH
Instruction
aux
participants ...
.
...
65
ANNEXE!
Journal de Bord
...
.
...
...
....
...
.
...
65
ANNEXEJ
Détails des rencontres
...
...
..
...
...
...
...
...
..
...
....
...
...
...
65
BIBLIOGRAPHIE
.
....
.
..
..
.
.
...
.
.
.
.
.
...
.
.
...
.
...
.
..
.
..
...
...
....
...
74
LISTE DES TABLEAUX
Tableau 5.1 Caractéristiques
descriptives de
1
'
échantillon
.
.
...
...
....
.
.
..
...
.. 31
Tableau 5.1
(Suite) Caractéristiques
descriptives de l
'
échantillon
...
... 32
Tableau 5.2
Caractéristiques
descriptives des
groupes
de traitement.. ...
32
Tableau 5.3
Jour-
Comparaison
des moyennes
entre
les
groupes
de traitements ...
33
Tableau 5.4 Nuit- Comparaison
des moyennes
entre
les
groupes
de traitements ...
34
Tableau 5.5
Jour- Résultats des
corrélations
Rhode
Spearman ...
...
...
.. 34
Tableau 5.6
Nuit
-Résultats des
corrélations
Rhode
Spearman ...
....
...
. 34
AD AP
AVQ
BHE DE EQ-5D GABA GPS IMC Jr Km2 LEDD LDOPA METs Mg MP MoCA NIA NbLISTE DES ABRÉVIATIONS ET ACCRONYMES
Agonistes dopaminergiques Activité physique
Activité de la vie quotidienne Barrière hémato encéphalique Dépense énergétique
Euro Questionnaire 5 dimensions
Acide g-Aminobutyrique
Global positioning system
Indice de masse corporelle
Jour
Kilomètre carré
Levodopa equivalency daily doses Levodopa
Équivalent métabolique
(l MET= 3,5ml 02 /kg/min)
Milligramme MP
Montreal Cognitive Assessment
Non applicable
RÉSUMÉ
Ce projet exploratoire visait à déterminer si l'efficacité de la levodopalcarbidopa ainsi que celle de la combinaison de la levodopalcarbidopa à un agoniste dopaminergique pouvait avoir une influence distincte sur la mobilité dans la communauté, sur le niveau d'activité physique et sa répartition à l'intérieur d'une journée ainsi que sur le niveau d'activité durant la nuit des personnes ayant la maladie de Parkinson (MP). Au total, 23 participants ayant la MP ont été recrutés. Douze d'entres eux ont été gardés pour les analyses statistiques (12 hommes, âge: 71ans ±6, poids: 80,3kg ±14, indice de masse corporelle (IMC) : 26,9 ±4,4, nombre d'années depuis le diagnostic : 7 ans±3,8,
levodopa
equivalency daily doses
(LEDD) : 848,5 mg/jr ±490,8). Les variables de la mobilité dans la communauté ont été enregistrées avec un appareilGlobal positioning system
(GPS). Cet appareil a été porté toute la journée, du leverjusqu'au coucher et a permis de mesurer l'aire de mobilité (km\ le nombre de fois où l'individu est sorti à l'extérieur de son domicile, le nombre d'endroits fréquentés et les distances (km) parcourues à pied et en véhicule. Ensuite, pour mesurer le niveau d'activité physique et sa répartition à l'intérieur d'une journée ainsi que le niveau d'activité durant la nuit, le brassard SenseWear de Bodymedia a été utilisé. Cet appareil a été porté pendant 24h sauf les moments où l'individu était en contact avec l'eau (douche, bain, piscine, etc.) et il a permis de mesurer la dépense énergétique (kcal),. le nombre de pas, et l'intensité des activités (METs). Des corrélations Rho de Spearman ont été effectuées pour déterminer si le LEDD avait des liens avec l'aire de mobilité (km\ le nombre de pas, la dépense énergétique, le nombre de sorties à 1 'extérieur du domicile, la mesure de variation du ni veau d'activité physique dans une journée et avec l'efficacité de sommeil, le pourcentage de sommeil, la dépense énergétique et le nombre de pas durant la nuit. Des ajustements de Bonferroni ont été appliqués pour corriger la valeur P. Nous n'avons pu établir de liens qui associent le LEDD avec des variables de la mobilité dans la communauté, du niveau d'activité physique et du niveau d'activité durant la nuit. De plus, aucune différence significative n'a été observée entre les groupes de traitement à la suite des analyses non paramétriques Mann-Whitney (p<O,OS). Ces résultats non significatifs et 1' absence de tendances nous portent à croire que pour des états symptomatiques similaires, la combinaison d'un agoniste dopaminergique à la levodopa ne semble pas avoir un effet plus positif que la levodopa elle-même, sur le comportement actif des gens dans leur quotidien.
MOTS CLÉS : Parkinson, médication, traitement, aire de II;lObilité, activité physique, GPS, armband, accéléromètre, vieillissement
INTRODUCTION
La MP est un trouble neurodégénératif progressif qui implique non seulement le système dopaminergique (Cenci & Lindgren, 2007; Dauer & Przedborski, 2003; Wolters & Braak, 2006), mais aussi les systèmes cholinergique, noradrénergique et sérotoninergique (Wolters & Braak, 2006). Les symptômes moteurs de la MP sont le tremblement, la rigidité, la bradykinésie, l'akinésie et des troubles liés aux instabilités posturales (Bartels & Leenders, 2009; Dauer & Przedborski, 2003; Hoehn & Yahr, 1998; Jellinger, 2015; Wu et al., 2014). Les symptômes non moteurs affectent entre autres les fonctions du système nerveux autonome, les fonctions cognitives, sensitives, visuelles, 1 'odorat et le sommeil (Bartels & Leenders, 2009; Defebvre, 2007; Jellinger, 2015; Rajshekhar & Bhattacharyya, 2008). En début de maladie, pour pallier à la symptomatologie, des traitements pharmacologiques sont disponibles. Parmi les plus utilisés, il y a la levodopa et les agonistes dopaminergiques. D'entrée, la levodopa est un précurseur de la dopamine et elle est généralement combinée à un inhibiteur ·périphérique (bensérazide ou carbidopa) de dopa décarboxylase afin d'augmenter sa biodisponibilité au cerveau (P. Lewitt & Oertel, 1999; Stowe et al., 2008). En termes d'efficacité sur 1 'amélioration des symptômes moteurs, ce traitement serait le plus efficace (Nutt & Wooten, 2005; Tarsy, 2006). Par contre, au fil du temps, la prise de levodopa peut mener à 1 'apparition de complications motrices dont celles associées aux mouvements involontaires (dyskinésies) et celles dues aux différentes formes de fluctuations motrices dont le phénomène wearing OFF et de façon imprévisible, aux fluctuations (ON-OFF) (Stowe et al., 2008). Pour leur part, les agonistes dopaminergiques sont connus pour soulager les symptômes de la maladie en plus d'avoir l'avantage de retarder l'arrivée des complications motrices. Leur mécanisme d'action s'effectue directement via les récepteurs dopaminergiques (Holloway et al., 2004). Ces agents possèdent une demi-vie plasmatique supérieure à celle de la levodopa et du coup, permettent une stimulation plus constante des
récepteurs dopaminergiques (Susan H. Fox et al., 2011; Lévy-Chavagnat, 2009). Par contre, ils détiennent une moins bonne efficacité que la levodopa sur le traitement des
symptômes moteurs et allouent davantage d'effets secondaires des symptômes non
moteurs (Parkinson Study, 2000).
Bien que chaque approche pharmacologique possède des qualités thérapeutiques démontrées en clinique qui leur sont propres, aucune comparaison directe n'a été faite quant à leur efficacité sur la mobilité dans la communauté, un élément essentiel de la qualité de vie. Donc, ce projet exploratoire vise à comparer l'efficacité des approches thérapeutiques comme la levodopa et la combinaison d'un agoniste dopaminergique à la levodopa sur la mobilité des individus dans leur communauté, sur le mveau d'activité physique et sa variabilité à l'intérieur d'une journée et sur le mveau d'activité durant la nuit des personnes ayant la MP. À l'aide d'une méthodologie novatrice, nous enregistrerons pendant 14 jours, la mobilité dans la communauté avec un GPS et mesurerons le niveau d'activité physique et le niveau d'activité durant la nuit à 1 'aide d'un Sense Wear Armband durant la même période.
- - - - - -
--CHAPITRE!
REVUE DE LITTÉRATURE
1.1 Maladie de Parkinson
En 1817, James Parkinson a écrit "An essay on the shaking patsy". Son travail permit de découvrir un trouble neurologique qui fut à 1 'époque, principalement
caractérisé par le tremblement au repos ainsi que par 1 'incapacité progressive liée
aux comportements moteurs (Parkinson, L 8 17). Ainsi, les symptômes de la maladie affectaient principalement le système moteur et pouvaient sensiblement contraindre les capacités fonctionnelles de l'individu dans sa vie de tous les jours. Aujourd'hui, grâce à des recherches, la MP se caractérise non seulement par des troubles moteurs engendrés par la perte progressive des neurones dopaminergiques de la substance noire pars compacta, mais aussi par des troubles non moteurs liés à l'inclusion de Corps de Lewy dans des neurones du tronc
cérébral. Ainsi, le niveau d'autonomie peut dépendre de la sévérité des atteintes
motrices et non motrices.
1.2
Épidémiologie
Dans les pays industrialisés, il a été dénombré qu'environ 1% de la population
âgée de 60 ans et plus développe la MP (Alves, Forsaa, Pedersen, Dreetz Gjerstad, & Larsen, 2008; A. Rajput, 1992). La prévalence de cette dernière tend à augmenter avec l'âge (de Lau & Breteler, 2006; Stanley Fahn, 2003; Taba & Asser, 2004). La MP peut être diagnostiquée auprès de toutes ethnicités (Alves et al., 2008; de Lau & Breteler, 2006; Samii, Nutt, & Ransom, 2004) cependant, le nombre d'individus touchés peut varier dépendamment de la localisation
- - - --- -- - - -
-2
générale, pour tout groupe d'âge confondu, l'incidence touche environ de 1,5 à 19 individus pour 100 000 habitants (Wirdefeldt, Adami, Cole, Trichopoulos, & Mandel, 2011). Actuellement, ce trouble neurodégénératif progressif se classe au deuxième rang après la maladie d'Alzheimer comme étant la pl us répandue (Bartels & Leenders, 2009; Dauer & Przedborski, 2003).
1.3 Étiopathologie
La MP se caractérise principalement comme étant idiopathique. Toutefois des études suggèrent que des facteurs environnementaux ou génétiques pourraient avoir une influence (Bartels & Leenders, 2009; Donald Caine, 2005; Rajshekhar & Bhattacharyya, 2008; Wolters & Braak, 2006). L'origine pourrait également être liée à un dysfonctionnement mitochondrial et un stress oxydatif qui serait exacerbé par l'interaction entre des facteurs environnementaux et une prédisposition génétique. Dans une même famille, si un individu est diagnostiqué avec la MP alors les risques de développer la maladie pour les autres membres deviennent plus élevés. Il semblerait aussi que les jumeaux monozygotes aient un risque plus élevé attribué à un dysfonctionnement dopaminergique ~ue les jumeaux dizygotes (Piccini, Burn, Ceravolo, Maraganore, & Brooks, 1999; Wirdefeldt et al., 2011). Quant aux facteurs environnementaux, 1 'exposition aux pesticides ainsi qu'aux toxines exogènes pourrait être des motifs conduisant l'individu
à
développer la maladie (Bartels & Leenders, 2009; Firestone et al., 2005).1.4 Physiopathologie
La MP est une neuropathologie qui affecte progressivement plusieurs régions de l'encéphale. Selon le modèle de (Wolters & Braak, 2006), les lésions débutent
3
dans la partie caudale du mésencéphale pour ensuite s'étaler à travers différentes régions du cortex cérébral. Donc, avant de voir apparaître le déficit dopaminergique nigrostriatal, la pathologie de lewy prend place dans des neurones du tronc cérébral impliquant notamment les systèmes cholinergiques,
sérotoninergiques, et noradrénergiques (Braak, Ghebremedhin, Rüb, Bratzke, &
Del Tredici, 2004; Rao, Hofmann,
&
Shakil, 2006; Savitt, Dawson,&
Dawson,2006; Wolters & Braak, 2006). Ainsi, les répercussions sont principalement d'ordres non moteurs et affectent entre autres les fonctions végétatives,
cognitives, émotionnelles, comportementales ainsi que la mémoire. Plus tard dans la maladie, les lésions s'étendent
à
travers le système extra pyramidal et affectentla substance noire
pars
compac
ta
dans les parties caudales du tronc cérébral, qui fait partie des noyaux gris centraux. Les principaux noyaux constituants les noyaux gris centraux sont le putamen et le noyau caudé, qui ensemble forment lestriatum, le globus pallidus (interne et externe), le noyau sous thalamique ainsi que la substance noire
par
s co
mpa
c
ta
et
pàrs r
éticu
la
.
Ensemble, ces noyaux participent au contrôle de la motricité volontaire par l'e~tremise d'un réseau de boucles sous-corticales. Cependant, lors de la perte progressive de neurones dopaminergiques de la substance noirepars
compacta,
.
qui par le fait même,conduit au manque de dopamine au niveau du striatum (Poirier & Sourkes, 1965),
le bon fonctionnement des voies nigrostriatales est entravé (Bartels & Leenders, 2009; N utt & Wooten, 2005) et engendre au final, un changement de 1 'ac ti vi té thalamo corticale (José A Obeso et al., 2000) conduisant ainsi à 1 'apparition des troubles moteurs, dont ceux liés
à
la lenteur des mouvements ouà
1 'absence deceux-ci (Bartels & Leenders, 2009). Ces troubles moteurs seraient donc
susceptibles de limiter la capacité de l'individu à produire des mouvements dans
son environnement et par le fait même, restreindre potentiellement ses
4
1.5 Symptômes moteurs
Lors de 1 'apparition des symptômes moteurs, il semblerait qu'environ 60 % des
neurones dopaminergiques de la ·substance noire
par
s c
ompa
c
ta
aient déjà étéperdus (Dauer & Przedborski, 2003) ce qui pourrait possiblement influencer la
mobilité de l'individu dans sa communauté. Les symptômes moteurs de la MP
peuvent varier d'un individu à l'autre et prendre différentes formes selon le niveau
d'atteinte. Toutefois, les symptômes communs à la MP sont le tremblement au
repos, la bradykinésie, 1 'akinésie, la rigidité ainsi que les symptômes axiaux
notamment liés aux instabilités posturales (Aives et al., 2008). Lors de
1 'apparition des symptômes moteurs, 1 'atteinte est souvent unilatérale et limite
modérément les capacités fonctionnelles de l'individu puis progressivement, elle
devient bilatérale avec un niveau de dysfonction qui varie selon les stades (l, II, III, IV, V) de la maladie (Hoehn & Y ahr, 1967).
Dans environ 70 % des cas, le tremblement au repos est le premier signe clinique
qui se manifeste chez les gens ayant la MP (Samii et al., 2004). Ce symptôme est
présent au repos et est absent lors des mouvements volontaires (Dauer &
Przedborski, 2003; Obeso, Olanow, & Nutt, 2000). Habituellement, le
tremblement débute unilatéralement et prend de 1 'ampleur selon différentes
circonstances notamment en présence de stress ou d'anxiété ou encore, lors des tâches demandant de la concentration (José A. Obeso et al., 2000; Samii et al., 2004).
La bradykinésie représente la lenteur des mouvements (Alves et al., 2008) et
affecte 1 'exécution de quelconques tâches motrices comme le simple fait de manger ou de se vêtir (Dauer & Przedborski, 2003). Lors de son apparition, les
individus possèdent souvent de la difficulté avec les tâches de précisions et
5
(Samii et al., 2004). Dans certains cas, 1 'akinésie peut également être présente et
se traduit par une absence complète de mouvements (José A. Obeso et al., 2000).
La rigidité s'observe lors d'une résistance s'opposant au mouvement passif
(Alves et al., 2008; Dauer & Przedborski, 2003). Elle se manifeste compte tenu
d'une augmentation de la tension musculaire et est encouragée lors des efforts
mentaux et des mouvements controlatéraux (Samii et al., 2004).
Plus tardivement, d'autres symptômes moteurs s'inscrivent aux caractéristiques de
la maladie notamment ceux liés aux instabilités posturales et aux troubles de la
marche. Ces signes plus axiaux affectent 1 'équilibre et la marche puis conduisent graduellement 1 'individu à des risques de chutes plus accrus (Defebvre, 2007;
Samii et al., 2004). Aussi, des manifestations motrices non désirées sont
répertoriées pour le patient compte tenu du traitement chronique antiparkinsonien
par la levodopa. Il sera alors question de complications motrices telles que les
fiuctuations motrices ainsi que dyskinésies.
Les troubles moteurs dénotés avec la MP sont susceptibles d'influencer la
capacité des gens à bouger dans leurs activités de la vie quotidienne (Gelb, Oliver, & Gilman, 1999; Schrag, Jahanshahi, & Quinn, · 2000). Ils sont également susceptibles de diminuer la mobilité de l'individu dans sa communauté puisque
lorsque les symptômes s'aggravent, il a été montré que les déplacements à
l'extérieur du domicile sont réduits et que le temps passé à l'intérieur de la maison augmente (Liddle et al., 2014). Donc, ceci pourrait éventuellement rendre
l'individu propice à un mode de vie plus sédentaire (Jones, Wieler, Carvajal,
Lawrence, & Haennel, 2012), diminuant ainsi son niveau d'activité physïque dans
une journée. Donc, les symptômes moteurs de la MP semblent jouer un rôle
important sur la mobilité de 1' individu dans sa communauté ainsi que sur son
6
1.6
Symptômes
non moteurs
La MP engendre non seulement des symptômes moteurs, mats aussi des symptômes non moteurs entre autres d'ordre cognitif, psychiatrique, sensitif et végétatif (Jellinger, 2015). Selon des phases préalablement établies par des auteurs (Wolters & Braak, 2006), les signes et symptômes non moteurs peuvent survenir bien avant que les troubles moteurs ne se manifestent (Beitz, 20 l4) et que ceux-ci pourraient avoir un effet non négligeable sur la qualité de vie du patient (Committee, 2002; Hely, Morris, Reid, & Trafficante, 2005).
Dans l'évolution de la maladie, des auteurs (Braak et al., 2003; Braak et al., 2004) mentionnent que les premières lésions impliquent habituellement le système olfactif et ceci engendre généralement dans 90 % des cas, des troubles de 1 'odorat (Haehner et al., 2009). Ensuite, les dysfonctions liées au système nerveux autonome engendrent principalement des troubles comme 1 'hypotension orthostatique, la dégradation gastro-intestinale, la mauvaise thermorégulation,
1 'augmentation de la transpiration, des dysfonctions sexuelles et notamment de la vessie (Bartels & Leenders, 2009).
Les troubles neuropsychiatriques eux, peuvent mener l'individu à la dépression,
1 'anxiété, la démence ou aux hallucinations (Bartels & Leenders, 2009; Lohle, Stor.ch, & Reichmann, 2009). Ces dysfonctions sont non négligeables étant donné qu'environ 20 à 40 % des personnes avec la MP développeront des troubles cognitifs, dont la démence (Bosboom, Stoffers, & Wolters, 2004) et que ceux-ci sont étroitement liés à la réduction de la qualité de vie du patient (Schrag,
Jahanshahi, et al., 2000) ainsi qu'à l'augmentation du stress chez l'aidant (Aarsland, Larsen, Karlsen, Lim, & Tandberg, 1999).
Dans la majorité des cas, les gens ayant la MP auront des troubles du sommeil (Tandberg, Larsen, & Karlsen, 1998). Ces troubles peuvent apparaître bien avant
, - - - -- -
-7
le début des symptômes moteurs et parmi eux, il y a 1 'insomnie, la somnolence diurne et les comportements anormaux durant la phase de sommeil paradoxal (Boeve,
2010
;
Boeve et al.,1998;
Claassen et al.,2010;
Iranzo et al.,2006)
.
D'ailleurs, un regard important devrait être porté sur ce type de symptômes puisque des auteurs ont observé que les troubles du sommeil pouvaient avoir un impact sur la qualité de vie des gens (Scaravilli, Gasparoli, Rinaldi, Polesello, & Bracco,2003).
Pour leur part, les troubles sensitifs génèrent de la douleur. Très fréquemment, environ 2 patients sur 3 souffrent des symptômes de douleur chronique (Nègre
-Pagès, Regragui, Bouhassira, Grandjean, & Rascol,
2008).
1. 7 Options de traitement
Au stade initial de la MP, différents traitements figurent parmi les options thérapeutiques, dont la levodopa et les agonistes dopaminergiques, qui sont les plus fréquents. Au besoin, d'autres agents comme les anticholinergiques ou l'amantadine peuvent être utilisés afin de contrer la symptomatologie. Dans le cadre de cette étude, nous nous intéresserons à la levodopa ainsi qu'aux agoni stes dopaminergiques.
1. 8 Levodopa
Vers la fin des années
60,
la levodopa s'est montrée efficace comme traitement antiparkinsonien (Cotzias, Van Woert, & Schiffer,1967).
Depuis ce temps, la levodopa est encore vue comme étant le traitement le plus efficace sur la symptomatologie même en début de MP (Ferreira et al.,2013).
La levodopa est un8
précurseur de la dopamine. Généralement, elle est combinée à un inhibiteur bensérazide ou carbidopa afin de réduire les effets de la décarboxylation en périphérie. Ceci favorise donc une plus grande accessibilité de levodopa pour. le cerveau (P. Lewitt & Oertel,
1999).
1.8.1
AvantagesDepuis la fin des années
60
,
il semblerait que la levodopa demeure encore le médicament le plus favorable en termes d'efficacité sur la gestion des symptômes moteurs de la MP (S Fahn et al.,2004;
Kaplan & Tarsy,2013
; P. A
. LeWitt, 2008; Miyasaki, Martin, Suchowersky, Weiner, & Lang,2002)
.
En plus, l'ajout de l'inhibiteur dopa décarboxylase permet de réduire les effets indésirables tels que les nausées, le vomissement, les perturbations cardiaques que la dopamine peut entraîner si elle siège en périphérie (P. Lewitt & Oertel,1999).
D'autres agents tels que le catéchol-0-méthyltransférase (COMT) et le monoamine oxydase B(MAO-B) peuvent être combinés à la levodopa afin d'augmenter son efficacité
grâce à l'inhibition périphérique ou centrale de la synthèse de levodopa en
dopamine (P. A. LeWitt,
2008).
Dans la majorité des cas, la levodopa convient à tout type d'individu (S Fahn et al.,2004)
et peut être utilisée en clinique pour aider au diagnostic (de Noordhout, 2009; P. A. Le Witt,2008).
1.
8
.
2
Inconvénients1.8.2.
1 Absorption
La levodopa possède une demi-vie relativement courte. Des auteurs parlent d'environ
90
minutes au niveau plasmatique quand elle est combinée à un9
inhibiteur (Nyholm et al., 2003). Quant à son absorption, elle peut être influencée par la quantité d'acide alimentaire que contiennent les repas (Nomoto et al., 2009) étant donné qu'elle s'effectue via un système de transport composé d'acides aminés (Contin & Martinelli, 2010; Wooten, 1987). Par contre, en modifiant d'une part le métabolisme de la levodopa par la prise d'une formule à libération contrôlée (Nyholm, 2006), le temps d'absorption est retardé (Contin
&
Martinelli, 20 10) en plus de prolonger la concentration plasmatique de levodopa (Hammerstad et al., 1994; PA Le Witt et al., 1989). D'autres part, comme il y a un délai d'absorption avec la prise de cet agent, les bénéfices thérapeutiques sont eux aussi retardés. Par conséquent, des chercheurs (Rajesh Pahwa et al., 2014) se sont penchés vers une formule qui permettrait non seulement d'atteindre rapidement les effets thérapeutiques, mais aussi de les maintenir dans le temps (Hauser et al., 2011). C'est le cas de cette formule à libération prolongée au nom de IPX066. Son utilisation serait d'ailleurs sécuritaire et efficace sur les symptômes de la MP en début de maladie (Rajesh Pahwa et al., 2014).1.8.2.2 Dyskinésies
Durant les 3 à 5 premières années de traitement par levodopa, les patients sont sous 1 'effet d'une période dite « 1 une de miel », car ils ressentent les effets du traitement antiparkinsonien (Wong et al., 2003). Par contre, au fil du temps, le traitement chronique par levodopa engendre souvent l'apparition de fluctuations motrices et de dyskinésies (Ahlskog & Muenter, 2001; P. Lewitt & Oertel, 1999; Olanow et al., 2004). Dans la progression de la maladie, le nombre de neurones dopaminergiques diminue, les vésicules présynaptiques des terminaisons axonales perdent leur capacité à entreposer la dopamine et ainsi la libérer de manière graduelle et continue (Blanchet, Grondin, Bédard, Shiosaki, & Britton, 1996; Metman, Konitsiotis, & Chase, 2000). Du coup, ceci entraîne une variation de la stimulation des récepteurs post-synaptiques et contribue potentiellement
à
10
l'apparition de fluctuations motrices et de dyskinésies (T. N. Chase, 1998; Nyholm, Lennerniis, Gomes-Trolin, & Aquilonius, 2002; Olanow & Koller, 1998).
Les fluctuations motrices apparaissent souvent avec le phénomène wearing-OFF qui survient lors d'une diminution de la réponse à la levodopa en fin de dose (Jankovic, 2005; Nutt & Nygaard, 2001) tandis que, les fluctuations ON-OFF
surviennent de façon plus imprévisibles (Stowe et al., 2008). Parmi les différentes formes de dyskinésies (choréique, dystonique, diphasique), les dyskinésies de «peak » dose sont les plus communes et surviennent alors que l'effet de la levodopa est
à
son « peak » (King, 2014; Nutt & Nygaard, 2001).Ces limitations majeures touchent environ 50 à 80 % des patients avec la MP ayant reçu un traitement par levodopa sur une période de plus de 5 à 10 ans (Marsden & Parkes, 1977; A. H. Rajput et al., 2002). En début de maladie, les dyskinésies apparaissent généralement suite à un niveau plasmatique élevé de Levodopa alors que, plus la maladie progresse, plus les dyskinésies surviennent
à
des niveaux de concentrations plasmatiques égales ou inférieur au besoin de l'organisme pour induire les effets antiparkinsoniens (P. Lewitt & Oertel, 1999).
1.9
Agonistes dopaminergiques
Les effets antiparkinsoniens d'un agoniste dopaminergique, plus précisément la bromocriptine, ont été découverts dans les années 70 (DB Caine, Leigh, Teychenne, Bamji, & Greenacre, 1974; DB Caine, Teychenne, et al., 1974). Les
agonistes dopaminergiques ont servis initialement de combinaison au traitement
par levodopa afin de pallier aux fluctuations motrices (Oertel & Quinn, 1997; Tarsy, 2006; Uitti & Ahlskog, 1996). Aujourd'hui, des auteurs ont montré que son utilisation pouvait être efficace lors d'un stade initial de la maladie (Susan H Fox
11
et al.,
2011).
Généralement, les agonistes dopaminergiques sont prescrits pour des individus âgés de60
ans et moins (Connolly & Lang,2014)
ou sont utilisés enthérapie combinée lors d'un stade plus avancé de la maladie lorsqu'un individu a
des complications motrices.
Les agonistes dopaminergiques agissent directement au mveau des récepteurs dopaminergiques post-synaptj;,ques (de Noordhout,
2009
;
Hel y, Fung, & Morris,2000)
.
De ce fait, la neurotransmission n'est pas entravée comme elle peut l'être sur la voie nigrostriée. Depuis la découverte des agonistes dopaminergiques,d'autres agents ont fait leur entrée parmi les options de traitements. Parmi eux, il existe : la bromocriptine, le pergolide, le pramipexole et le ropinirole. Tous, possèdent généralement des effets similaires les uns aux autres (Ahlskog,
1999)
.
Certains d'entre eux (bromocriptine, pergolide) proviennent d'une classe dérivée de l'ergot et d'autres non (pramipexole, ropinirole). La différence entre les deux classes ergotées réside dans les effets indésirables potentiels tels que, des œdèmes aux membres inférieurs, un risque de fibrose pleuropulmonaire ou retropéritonéale
ou encore un syndrome de Raynaud (Lévy-Chavagnat,
2009;
Thobois &Broussolle,
2007;
Wooten,2003).
Selon (Goetz, Poewe, Rascol, & Sampaio,2005)
,
certains agonistes dopaminergiques (bromocriptine, pergolide,pramipexole, ropinirole, lisuride) sont encore efficaces comme monothérapie pour traiter les symptômes du Parkinson toutefois, des précautions sont à prendre avec
le pergolide et peut être d'autres, car des troubles valvulaires ont été dénotés avec ces agents. En 1 'occurrence, il semblerait que le pergolide a été retiré du marché
américain et canadien compte tenu de ses effets secondaires sur les fonctions cardiaques (Kaplan & Tarsy, 2013).
12
1.9.1 Avantages
L'absorption des agonistes dopaminergiques est généralement plus facile pour les parois intestinales ainsi que pour le passage à la barrière hémato encéphalique
(Wooten, 2003). Ces derniers ne requièrent pas de métabolisme relié au transport
actif vers la barrière hémato encéphalique et du coup, ne rivalisent pas avec les acides aminés contenus dans 1 'alimentation (Wooten, 2003). L'utilisation d'un
agoniste dopaminergique procure une stimulation plus constante des récepteurs
dopaminergiques et ce type d'agent possède une demie vie plasmatique plus longue
à
la levodopa (T. Chase et al., 1989; Lévy-Chavagnat, 2009; Tho bois & Broussolle, 2007). La demi-vie serait d'environ 8 à 12h (Wooten, 2003). Ceci pourrait entre autres suggérer pourquoi les complications motrices sont moindres avec les agoni stes dopaminergiques gu 'avec la levodopa. En effet, à la suite d'un traitement avec des agonistes dopaminergiques, des effets bénéfiques ont été démontrés tels qu'une diminution de 1 'impact des fluctuations motrices ainsi qu'une diminution des risques liés aux dyskinésies comparativement à un traitement ayant recours à la levodopa (Holloway et al., 2004; Rascol et al., 2000).1.9.2 Inconvénients
L'effet des agonistes dopaminergiques sur les symptômes moteurs de la MP
seraient moins efficaces que la levodopa (Foley, Gerlach, Double, & Riederer, 2004; C. M. Fox et al., 2006; S. H. Fox & Lang, 2008). Ces agents sont également connus pour leurs effets secondaires non moteurs (Ferreira et al., 2013; Noyes, Dick, & Holloway, 2006) notamment des effets de somnolence diurne (Etminan, Samii, Takkouche, & Rochon, 2001; Hobson et al., 2002). D'ailleurs, ces agents ne peuvent convenir à tout type d'individus puisque certains de leurs effets
secondaires sont causés en dépit d'antécédents médicaux liés aux comportements
•
CHAPITRE Il
RATIONNEL
En début de MP, la levodopa et des agonistes dopaminergiques peuvent être utilisés (Susan H. Fox et al., 2011). Certains utilisent la levodopa, car elle possède une excellente efficacité sur les symptômes moteurs (Kaplan & Tarsy, 20 13). Son utilisation chronique peut toutefois mener à 1 'apparition de fluctuations motrices et de dyskinésies (Olanow et al., 2004). Dans ce cas, d'autres utilisent des agonistes dopaminergiques car il est moins probable de voir apparaître les fluctuations motrices et les dyskinésies (Holloway et al., 2004; Rascol et al., 2000) étant donné leurs demi-vies plasmatiques plus longues ainsi que leur sélectivité envers les récepteurs (Rascol et al., 1998). Par contre, ces agents ont tendance à exposer le patient aux effets indésirables des symptômes non moteurs (Ferreira et al., 2013) et possèdent un niveau d'efficacité sur les symptômes moteurs de la MP inférieur à celui de la levodopa (Foley et al., 2004; C. M. Fox et al., 2006; S. H. Fox & Lang, 2008).
D'une part, 1 'efficacité de la levodopa et des agoni stes dopaminergiques sur 1 'amélioration de la performance motrice a déjà été cliniquement démontrée (Gray et al., 2014; Parkinson Study, 2000). D'autre part, le contexte dans lequel les évaluations cliniques s'effectuent tient souvent compte d'un moment fixe dans le temps, pour un état actuel donné, sans nécessairement considérer comment 1 'efficacité du traitement agit sur la performance motrice de 1 'individu dans sa communauté. Ainsi, il pourrait advenir que les résultats observés en milieu clinique ne soient pas représentatifs de la réalité. Par exemple, les deux études de (J.-F. Daneault et al., 2015; J. F. Daneault et al., 2014) font la démonstration qu'une amélioration clinique ne se traduit pas nécessairement en amélioration de la motricité globale dans la vie de tous les jours. En effet, les auteurs ont démontré qu'à la suite d'un traitement par stimulation intracérébrale chez les gens ayant la MP, la sphère de mobilité (étendue des distances parcourues en km2) ainsi que le
14
niveau d'activité physique n'étaient pas forcément meilleurs, alors que les
évaluations cliniques traditionnelles ont montré des améliorations. Ceci pourrait donc suggérer que les bénéfices observés cliniquement n'ont pas forcément été
transposés à la participation sociale de l'individu dans son environnement, tel que
sa mobilité dans la communauté. Nous. pensons donc qu'une mesure directe de la
mobilité dans la communauté ainsi que du niveau d'activité physique nous
donnerait 1 'opportunité d'avoir une meilleure appréciation de 1 'efficacité des traitements utilisés. D'ailleurs, il n'y a jusqu'à ce jour, aucune étude qui s'est
intéressée à l'efficacité de la levodopa et des agonistes dopaminergiques sur la quantité de mobilité dans la communauté ainsi que sur le niveau d'activité durant la journée.
Depuis plusieurs années, il est documenté que les gens ayant la MP ont un niveau d'activité plus élevé durant la nuit comparativement à des personnes en santé (van Hilten et al., 1994). Des études ont également montré que la médication
dopaminergique pouvait contribuer à la réduction des symptômes de la MP durant
la nuit (Garcia-Borreguero, Larrosa, & Bravo, 2003; Hogl, Rothdach, Wetter, &
Trenkwalder, 2003).
À
cet effet, peu d'études se sont penchées sur les effets d'un traitement antiparkinsonien sur le sommeil, autrement mesuré que par 2 nuits en laboratoire avec la polysomnographie (Chahine et al., 2013; Hogl et al., 2003).Cet appareil traditionnellement utiJisé pour mesurer les paramètres du sommeil
peut comporter certains biais quant à la validité des données récoltées. Étant
donné que les individus dorment dans des conditions d'évaluations cliniques, il pourrait advenir que leur comportement ne soit pas habituel à celui qu'ils ont à la
maison. Dans ces circonstances, nous pensons que d'obtenir des mesures
quantitatives du sommeil capté directement dans le milieu de vie des individus
pendant 14 jours consécutifs, contribueraient à une meilleure compréhension des
effets de la levodopa/carbidopa et la levodopa/carbidopa en combinaison à un
15
Donc, dans le cadre d'une étude exploratoire, nous mesurerons pendant 14 jours consécutifs, la mobilité (étendue des distances parcourues en km2) dans la communauté en utilisant un GPS puis durant la même période, nous enregistrerons le niveau d'activité physique durant le jour et le niveau d'activité durant la nuit, à l'aide d'un brassard Sense Wear de Bodymedia .. À cet effet, n.ous pensons possiblement que la mobilité, le niveau d'activité physique et le niveau d'activité durant la nuit soient plus représentatifs du réel s'ils sont directement captés dans 1 'environnement de 1 'individu sans avoir de moment précis pour être évalué, comme c'est souvent le cas en clinique. Ainsi, pour chacun des
traitements utilisés nous espérons obtenir des résultats représentant
vraisemblablement la mobilité dans la communauté, le niveau d'activité physique, sa répartition
à 1
'intérieur d'une journée et le niveau d'activité durant la nuit chez les personnes ayant la MP.CHAPITRE III
QUESTIONS ET HYPOTHÈSES DE RECHERCHE
Nos questions de recherches sont :
1- Existe-t-il une différence sur la mobilité dans la communauté ainsi que
dans le niveau d'activité physique entre les personnes traitées par la levodopa et celles traitées par la levodopa en combinaison à un agoniste dopaminergique?
2- Est-ce que les personnes traitées par la levodopa en combinaison à un
agoniste dopaminergique ont un niveau d'activité physique plus stable durant la période d'éveil comparativement aux personnes traitées par la levodopa?
3- Est-ce qu'il existe une différence entre le niveau d'activité durant la nuit entre les personnes traitées par la levodopa et celles traitées par la
levodopa en combinaison à un agoniste dopaminergique ?
Considérant les données de la littérature actuelle, il est sensé d'avancer les
hypothèses suivantes :
Question l
H0Hypothèse nulle: aucune différence n'existe sur la quantité de mobilité dans la communauté et le niveau d'activité physique entre les personnes
traitées avec levodopa et celles traitées avec la levodopa en combinaison à
17
H1 Hypothèse alternative : Les personnes traitées avec la levodopa auront une plus grande mobilité dans la communauté et un plus haut niveau d'activité physique que celles traitées avec la levodopa en combinaison à
un agoniste dopaminergique
Question 2
H0 Hypothèse nulle : aucune différence n'existe dans la répartition du niveau d'activité physique durant la période d'éveil entre les personnes traitées avec la levodopa et celles traitées avec la levodopa en combinaison à un agoniste dopaminergique
H, Hypothèse alternative : Les personnes traitées avec la levodopa en
combinaison à un agoniste dopaminergique auront un niveau d'activité
physique plus stable durant la période d'éveil.
Question 3
H0 Hypothèse nulle : aucune différence n'existe dans le niveau d'activité durant la nuit entre les personnes traitées avec la levodopa et celles traitées
avec la levodopa en combinaison à un agoniste dopaminergique.
H, Hypothèse alternative: Les personnes traitées avec la levodopa en
combinaison
à
un agoniste dopaminergique auront un niveau d'activité- - - -- - - --- - - - -- - -- -- - -
-4.1 Sujets
CHAPITRE IV
MÉTHODOLOGIE
Les participants à l'étude étaient ceux diagnostiqués avec la MP selon le UK
Parkinson
'
s disease so
c
iety brain bank
c
riteria.
Les participants recrutés étaientdes hommes et des femmes âgés entre 54 et 85 ans. Ils étaient tous volontaires à participer au projet de recherche en plus de respecter les critères d'inclusions et d'adhérer au formulaire de consentement approuvé par le comité éthique du centre recherche de 1 'institut universitaire de gériatrie de Montréal.
4.2
Critères d'inclusion et
d'exclusion
Les critères d'inclusions étaient: être traité par un agent anti parkinsoninen depuis le diagnostic de la MP par un neurologue spécialisé dans les troubles du mouvement, n'avoir aucune intention de changer de médication au cours de
l'expérimentation, n'avoir aucun problème cognitif significatif (MoCA ;::20),
demeurer dur 1 'île de Montréal et être au stade 1 & 2 de 1 'échelle Hoehn & Yahr.
Les critères d'exclusions étaient: avoir des limitations physiques (douleur
chronique, blessures musculo-squelettiques, appareils orthopédiques) ou
psychologiques (hallucinations, idées délirantes) qui pourraient significativement influencer la mobilité ou la compréhension des instructions lors des différents tests, résider dans un foyer de soins de longue durée pour personne autonome ou non autonome, utiliser de manière régulière des dispositifs d'aide à la mobilité par exemple : cannes, fauteuil roulant, quadri porteur, béquilles.
19
4.3 Recrutement
Le recrutement s'est effectué à partir d'une ~anque de participants du réseau
Parkinson Québec. Notre équipe a également recruté des participants via
1 'affichage d'annonce, celle ci approuvée par le comité éthique du centre de
recherche de 1 'institut universitaire de gériatrie de Montréal.
4.4 Procédures
D'abord, le formulaire de consentement était
lu
et expliqué au participant. Ensuite, du temps était prévu pour répondre aux questions selon les besoins du participant et finalement, nous procédions à la signature des formulaires de consentement. Ensuite, des questionnaires étaient administrés (MoCA, EQ-50). Àce moment, si des résultats aux tests étaient insuffisants pour répondre aux critères d'inclusions, le participant était remercié de ses intentions envers le projet et l'expérimentation prenait fin. Finalement, l'expérimentation débutait lorsque les consignes relatives au projet étaient expliquées au participant.
4.5
Instruments de mesure
4.5.1 MoCA
Pour répondre à nos critères d'inclusions et évaluer les fonctions cognitives des
participants, le questionnaire Montreal cognitive assessment (MoCA) a été utilisé. Ce questionnaire est facile d'utilisation et s'administre en plus ou moins 10 minutes. Cette évaluation cognitive comporte 11 catégories liées aux aspects des fonctions visuo-spatiale, cognitives, exécutives, de la mémoire, du langage, de
20
1 'attention et de 1 'orientation. Le résultat total se calcule sur 30 points et un
résultat égal ou inférieur
à
20 indique le seuil de détection du déclin cognitif (Waldron- Perrine & Axelrod, 2012). La sensibilité du MoCA envers la détectiondes troubles cognitifs légers a été démontrée à 90 % contre 18 % au MMSE (Nasreddine et al., 2005). De plus, il semble que les thèmes les moins bien réussis
à
ce test sont ceux qui requièrent les fonctions notamment vues dans la neuro dégénérescence de la MP dont 1 'attention, les fonctions exécutives et le traitementvisuo-spatial. Ainsi, le MoCA semble être 1 'outil le plus sensible pour la détection de la dysfonction cognitive chez les gens avec la MP comparativement au MMSE (Zadikoff et al., 2008). La fiabilité inter et intra évaluateur en plus du test retest a également été démontrée pour une population ayant la MP (Gill, Freshman,
Blender, & Ravina, 2008). La validité du MoCA a aussi été montrée par des
auteurs qui suggèrent cet instrument comme étant un bon outil d'évaluation
cognitive pour détecter les troubles cognitifs légers ou la démence chez les gens ayant la MP (Hoops et al., 2009).
4.5.2 EQ-50
Pour évaluer la qualité de vie, le questionnaire EQ-5D a été utilisé puisque sa validité ainsi que fidélité ont été démontrées chez les personnes ayant la MP puis
reflète le degré de sévérité des impacts liés à la pathologie (Schrag, Selai,
Jahanshahi, & Quinn, 2000). Ce questionnaire compte 5 dimensions, dont la mobilité, l'autonomie, les activités habituelles, l'état physique et l'état psychologique. Un résultat faible indique une mauvaise perception de l'état de santé tandis qu'un résultat élevé révèle un bon état de santé selon la perception du patient. De plus, le questionnaire comprend une échelle visuelle catégorisant le
21
4.5.3 Journal de bord
Afin d'illustrer vraisemblablement le portrait des déplacements du participant, un journal de bord a été utilisé. Cet outil de support sert à valider tous les déplacements qu'ont effectués les participants dans une journée. Il nous a donc permis de constater si tous les déplacements inscrits par le participant ont été enregistrés par 1 'appareil GPS et vice versa. Le journal de bord comprend une plage horaire de 24h et la consigne est d'y inscrire les endroits fréquentés en fonction du départ et de l'arrivée de chaque lieu. De plus, si pour une quelconque raison, les données GPS n'étaient pas enregistrées, le journal de bord servait à constater la défaillance technique de 1 'appareil.
4.5.4 Sensewear bodymedia Armband
Pour mesurer le mveau d'activité physique de façon quantitative, le brassard SenseWear de Bodymedia a été utilisé. Cet appareil a été validé comme étant une mesure précise de la dépense énergétique quotidienne dans des conditions libres pour des adultes (Calabr6, Lee, Saint-Maurice, Yoo, & Welk, 2014; Johannsen et al., 2010) sur une période de 14 jours (Johannsen, Calabre et al. 2010). Le brassard SenseWear de Bodymedia modèle MF-SW (62mm, 55mm, l3mm) est muni d'accéléromètre tri axiale et de capteurs thermiques mesurant le flux de chaleur, la température corporelle et le réflexe psychogalvanique. Grâce aux algorithmes créés par le ·fabricant qui tient compte des différents signaux physiologiques captés par les senseurs, il était possible d'estimer le contexte dans lequel le brassard était porté ainsi que la dépense énergétique à partir d'une autre formule (Andre et al., 2006). Il a d'ailleurs été souligné par des auteurs que cet appareil était le seul parmi d'autres (Storm, Helier, & Mazzà, 2015) à posséder des capteurs thermiques réagissant aux changements physiologiques. Souvent, d'autres types d'appareils se fient à 1 seul paramètre, par exemple, la fréquence
22
cardiaque afin de calculer la dépense énergétique. Ainsi, nous pensons que cet appareil nous a fourni des données représentatives du niveau d'activité physique
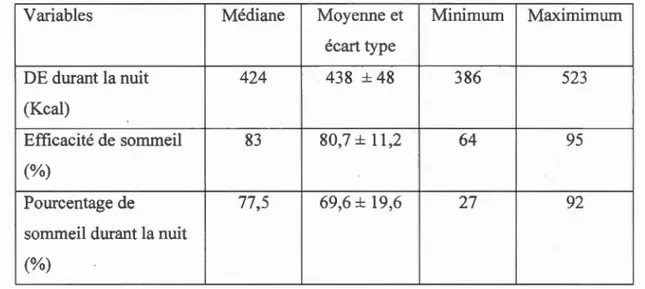
durant une journée, mais aussi du niveau d'activité durant la période de sommeil.
À cet effet, il a été recensé dans la littérature (Bahammam & Sharif, 2012; Sunseri et al., 2009) que le brassard Sense Wear de Bodymedia pouvait aussi bien récolter
des données relatives au sommeil qu'un appareil traditionnellement utilisé en
clinique comme la polysomnographie. Concrètement, le brassard SenseWear de Bodymedia possède la capacité de détecter avec précision, la période du début du sommeil, les moments de réveil ainsi que le temps total du sommeil (Sunseri et al., 2009). Ainsi, il était possible de calculer des paramètres liés au sommeil dont 1 'efficacité de sommeil, le pourcentage de sommeil durant la nuit, le nombre de pas et la dépense énergétique durant la nuit en fonction des différents statuts enregistrés par 1 'appareil. D'autres études se sont d'ailleurs intéressées
à
ce type de données (Bahammam & Sharif, 2012; Roane, Yan Reen, Hart, Wing, &Carskadon, 2015) et ont montré que le brassard Sense Wear de Bodymedia avait la
capacité de détecter les paramètres liés au sommeil.
Cet appareil se porte au tiers postéro supérieur de 1 'humérus gauche (triceps) et se configure en fonction du poids (kg), de la taille (cm), du genre (masculin, féminin), de l'âge (années) et du statut fumeur ou non du participant. La batterie de l'appareil dure approximativement 5 à 7 jours et prend environ 3 heures à charger via un câble USB. La capacité de la mémoire est d'environ 28 jours à la suite d'une utilisation régulière. L'utilisation de cet appareil comme outil de
recherche auprès d'une population ayant la MP a notamment été démontrée
(Cereda, Pezzoli, & Barichella, 2010; Jones et al., 2012) en plus d'être conseillée par des auteurs (Lavigne-Pelletier, 2014). En effet, une équipe de notre laboratoire
s'intéressant à la sphère de mobilité dans la communauté et à la dépense
énergétique des personnes âgées de 55
à
85 ans, suggérait que le SenseWear Armband était un outil commode auprès d'une population âgée puisqu'il est facile- - - -
-23
une longue période (14 jours). De plus, ayant été utilisé auprès de personnes avec
la MP, il semblerait que cet appareil soit bien toléré auprès des participants sur
une période 14 jours (Zhu, 2013).
Les participants ont porté 1 'apparei 1 pendant 14 jours consécutifs excepté les moments où ils étaient en contact avec l'eau (douche, bain, piscine). Dans ce cas-ci, les participants devaient retirer le brassard Sense Wear de Bodymedia et avaient
comme consignes de le remettre en place une fois 1 'absence de contact avec 1 'eau.
Les données relatives au niveau d'activité physique et au niveau d'activité durant
la nuit, ont été enregistrées chaque jour de l'étude, minuté par minute. D'abord, il
y avait parmi elles, la dépense énergétique (kcal), le nombre de pas et l'intensité
des activités (METs). Ensuite, il y avait 1 'efficacité de sommeil, le pourcentage de
sommeil, le nombre de pas et la dépense énergétique durant la nuit. Une fois
récoltées, elles ont été analysées avec le logiciel SenseWear version 8.1. Au total,
9 jours d
'enregistrement, dont 5 jours de la semaine, et4
jours de fin de semaineont été gardés pour chaque participant concernant la condition de jour tandis que
pour la nuit, il y avait seulement 7 nuits qui comportaient les données complètes. Quant aux données rejetées, elles pouvaient soit provenir d'une mauvaise utilisation de l'appareil lorsque le capteur n'était pas en contact avec la peau ou
d'un temps d'enregistrement insuffisant pour nos besoins.
4.5.5 GPS
Pour évaluer la mobilité dans la communauté, le dispositif GPS a été utilisé.
Comme abordé dans différentes études, ce système a permis de récolter plusieurs
données relatives à la mobilité (Boissy et al., 2011; Hirsch, Winters, Clarke, &
Mc Ka y, 20 14; Schenk et al., 2011). Concrètement, le GPS est un appareil de
géolocalisation qui permet d'enregistrer des données relatives aux déplacements
24
durant une longue période (Shoval et al., 2011). Autrement dit, il permet de localiser une position géographique sur la terre en longitude, latitude et altitude.
L'appareil WlMU-GPS (Wireless lnertial Measurement Unit with GPS) est
composé d'un capteur ayant différentes unités de mesure inertielles (IMU) (accéléromètre triaxial, gyroscope triaxial, magnétomètre triaxial), d'un dispositif
de positionnement GPS, d'un module de communication (Zigbee et USB), d'un
module de datalogging via une carte micro SD ainsi que d'un module
d'alimentation (batterie et chargeur) (Boissy et al., 20 11). L'appareil GPS (3X4
cm) possède une durée d'enregistrement d'environ 14 heures ainsi qu'une
mémoire de 8 Go. Cet outil de mesure a été porté par 1 'utilisateur pendant 14 jours
consécutifs dans son milieu de vie. Ainsi, l'utilisation de l'appareil GPS dans le milieu de vie d'un individu nous a permis de mesurer de manière objective, tous les déplacements spatiaux dans les différentes aires de vies. Ici, le terme 'aires de vie' fait référence aux différents niveaux d'environnements géographiques allant
de celui où la personne dort
à
l'extérieur de la ville passant par (la chambreà
coucher, la maison, l'extérieur de la maison, le quartier, la ville et l'extérieur de laville) (Peel et al 2005). Ce concept d'aires de vie a même été suggéré par des
auteurs comme étant une mesure entre autres liée aux aspects fonctionnels et
neuropsychologiques de la mobilité (Peel et al., 2005). Ainsi, il a été possible de mesurer les paramètres de la mobilité avec le GPS en fonction des déplacements
spatiaux qu'effectue un individu ayant la MP dans ses différentes aires de vies.
Les participants ont porté 1 'appareil pendant 14 jours consécutifs du moment de
réveil jusqu'au coucher. La fréquence d'acquisition des données GPS s'est
effectuée à 1 Hz. Une fois récoltées, elles ont été transférées dans le logiciel
WIMUstudio afin d'être nettoyées, interpolées et filtrées puis ont fini par être analysées dans le logiciel Matlab. Les données analysées ont été celles qui avaient
un minimum de 500 minutes d'enregistrements dans une journée. Au total, 6 jours de données ont ~ardés pour chaque participant, ce qui comprenait 4 jours de la
25
pouvaient être attribuables au manque de batterie de 1 'appareil ou à une absence de signal localisateur (FIX).
4.6 Protocole
Durant 14 jours consécutifs, les participants ont porté 2 appareils: le brassard SenseWear de Bodymedia ainsi que le GPS. Les participants avaient comme consignes de porter les 2 appareils en tout temps, excepté les moments où ils étaient en contact avec l'eau/humidité (douche/bain, piscine, sauna, spa) et lorsque l'appareil était sur la recharge (GPS). Durant ce temps, les participants devaient vaquer à leurs activités de la vie quotidienne sans se préoccuper des appareils. Au total, il y a eu 3 rencontres d'établies avec le participant qui se sont déroulées à leur domicile.
4.7 Rencontre
1
Pour commencer 1 'expérimentation, 1 'équipe de recherche (2 personnes) se rendait au domicile du participant. La durée de la rencontre était d'environ 90 minutes. Tout d'abord, les formulaires de consentements étaient lus et signés. Ensuite, un questionnaire MoCA sur l'aptitude cognitive était effectué afin de répondre aux
critères d'inclusions. Le questionnaire EQ-5D était également rempli avec le
participant afin de quantifier sa perception liée à sa qualité de vie. Par la suite, les
appareils (GPS, SenseWear Armband) étaient présentés et remis au participant.
Les informations quant à l'usage de ces appareils étaient données aux participants en plus d'être détaillées dans le cahier «instructions aux participants». Ces derniers avaient comme consigne de porter le SenseWear Armband en tout temps
à l'exception des moments où ils sont en contact avec de l'eau (douche/bain, piscine, sauna, spa). Le GPS, quant
à
lui, devait être porté dans une petite pochette26
plastifiée autour de la taille durant toute la journée puis mis à la recharge lorsque le participant se mettait au lit. Le journal de bord était également expliqué au participant afin d'établir le portrait des déplacements dans une journée. Aussi, dans le but de s'assurer du bien-être du participant à 1 'égard du protocole de 1 'expérimentation, 1 'équipe de recherche parlait de 1 'aspect du confort et des inconvénients liés à l'instrumentation. Parmi les inconforts liés au SenseWear Armband, il pouvait y avoir l'irritation du brassard
à
long terme si celui-ci est trop serré ou bien la sensation de frottement entre 1 'appareil et les vêtements lorsque ceux-ci sont étroitement en contact. Quant aux inconforts liés au GPS, le participant pouvait avoir à dissimuler 1 'appareil GPS sous les vêtements si pour une raison quelconque, il ne désirait pas qu'il soit visible ou bien, si la ceinture de taille était trop serrée, le participant pouvait être inconfortable. Finalement, les deux autres rendez-vous étaient fixés avec le participant.4.8 Rencontre II
La deuxième rencontre avait lieu au domicile du participant et durait environ 30 minutes. Celle-ci permettait la maintenance des appareils en plus du transfert des données de la semaine 1. L'équipe de recherche s'assurait également du confort et bien-être du participant quant au port des appareils ainsi que consigne de 1 'étude.
4
.
9
Rencontre III
La troisième visite était effectuée au domicile du participant et avait comme but le transfert des données de la 2e semaine ainsi que la récupération des appareils, aide-mémoire et journal de bord. Puis, 1 'expérimentation prenait fin lors des remerciements pour l'implication du participant envers le projet. S'il y a lieu, le
27
participant donnait ses coordonnées afin d'obtenir les résultats de 1 'étude une fois publiée.
4.1 0 Variables indépendantes
et dépendantes
4
.
1
0.1
Variables indépendantes4.1
0.1.1
Traitements pharmacologiques1- levodopa/ carbidopa
2- levodopa/ carbidopa en combinaison à un agoniste dopaminergique
4
.
1 0.2
Variables dépendantes4.1
0.2.1
Mobilité dans la communauté(A) Aire de mobilité: (ellipse km2). Elle représente la zone des
déplacements en km2 à 1 'extérieur de la maison et est calculée selon la déviation standard elliptique de tous les hotspots autour du hotspot domiciliaire.
(B) Hotspot: Le hotspot représente un point d'intérêt défini par un regroupement de points ayant dépassé un seuil de
120
secondes dans un espace géospatial de 100 mètres. Le nombre total de hotspot fait référence au nombre d'endroits fréquentés pendant lequel l'individu est resté plus de 2 minutes. Le hotspot relié au28
domicile du participant est identifié grâce au temps passé en majeure partie dans un même endroit géospatial.
(C) Nombre de sorties à L'extérieur du domicile: Nombre de fois où 1 'individu portant 1 'appareil a quitté la maison dans une journée.
(D) Transit à pied: Le transit à pied représente la distance en kilomètre des déplacements à pied et est calculé en fonction de la vitesse du déplacement spatiale inférieure à lü km/h.
(E) Transit en véhicule: Le transit en véhicule représente la
distance en kilomètre des déplacements effectués en véhicule
et est calculé en fonction de la vitesse du déplacement spatial égal ou supérieur à lü km/h.
4.1 0.2.2 Niveau d'activité diurne
( F) Nombre de pas par jour
( G) Dépense énergétique journalière (kilocalories)
4.10.2.3 Niveau d'activité nocturne
( H) Nombre de pas par nuit
29
(1) Efficacité de sommeil
( K) Pourcentage de sommeil
(L) Mesure de variabilité de l'intensité des activités en METs
4
.
11
Statistiques4.11.1 Analyse
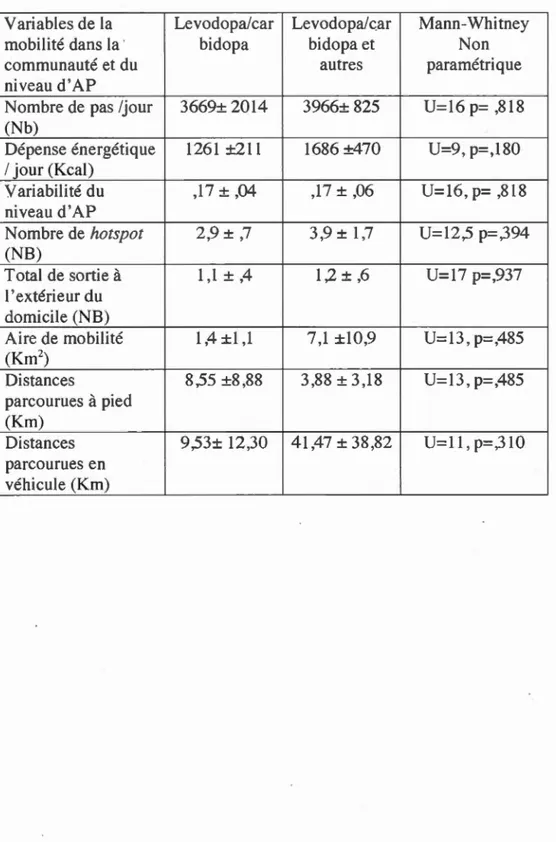
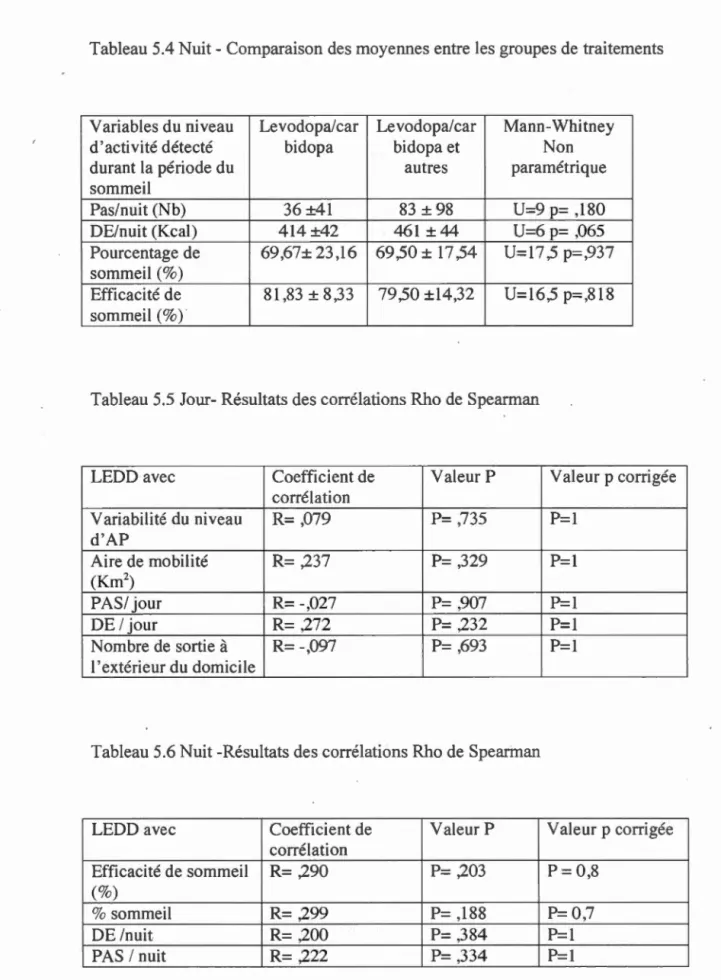
Pour évaluer la mobilité dans la communauté et le mveau d'activité physique
durant la journée, nous avons choisi d'effectuer des tests statistiques non
paramétriques Mann & Whitney en raison de la taille de notre échantillon (n= 12) qui ne reflétait pas une distribution normale. Les analyses statistiques ont été
effectuées avec le logiciel SPSS 20.0 concernant la comparaison des moyennes
pour 1 'aire de mobilité, le nombre de hotspot, le transit à pied, le transit en
véhicule, le nombre de pas par jour et pour la dépense énergétique journalière
afin de voir s'il y avait une différence entre les groupes de traitement quant à la mobilité·dans la communauté et au niveau d'activité physique des gens traités par
la levodopa et ceux traités par la levodopa en combinaison à un agoniste
dopaminergique. Le seuil de significativité était établi à 0,05. Ensuite, pour déterminer si des liens s'observaient entre la quantité de LEDD et les variables de
la mobilité dans la communauté et du niveau d'activité physique, nous avons
choisi d'effectuer des corrélations de Spearman puis un ajustement de Bonferonni
(en multipliant la valeur P par le nombre de comparaisons). Le seuil de