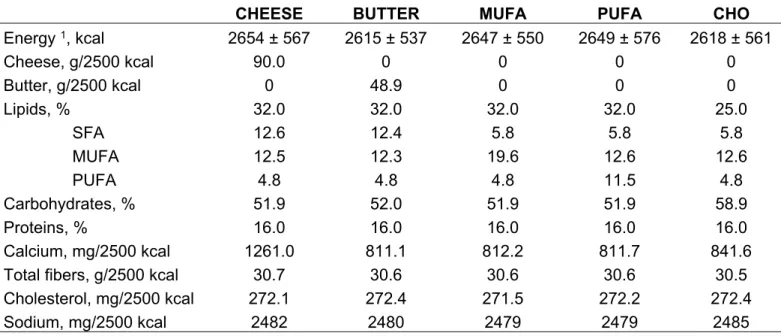
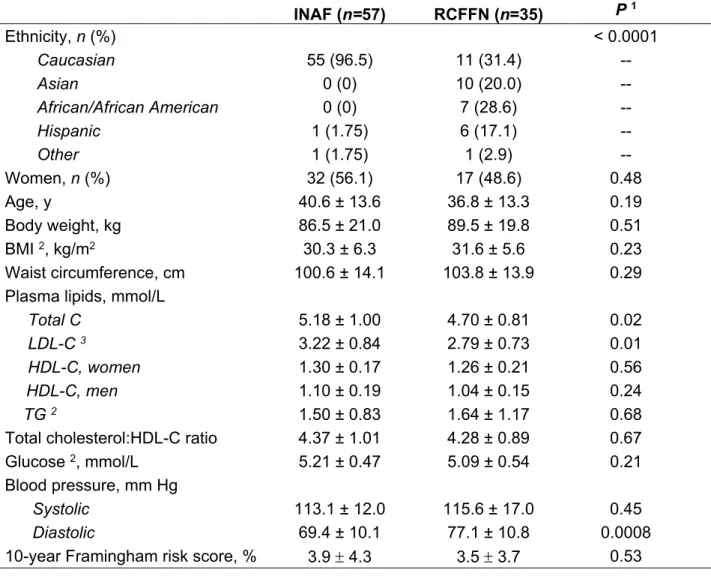
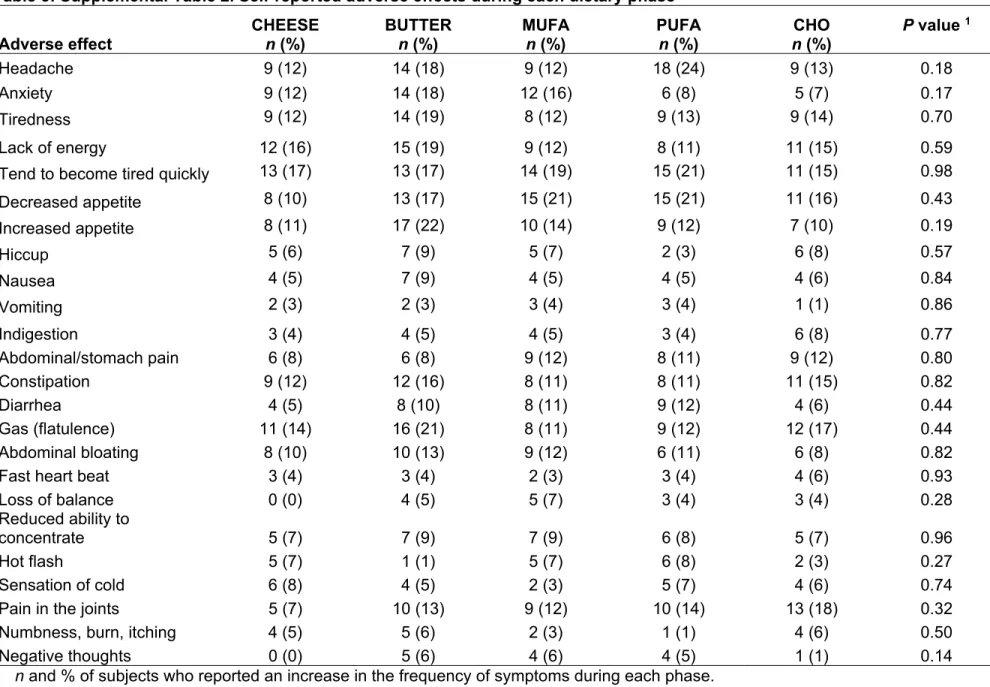
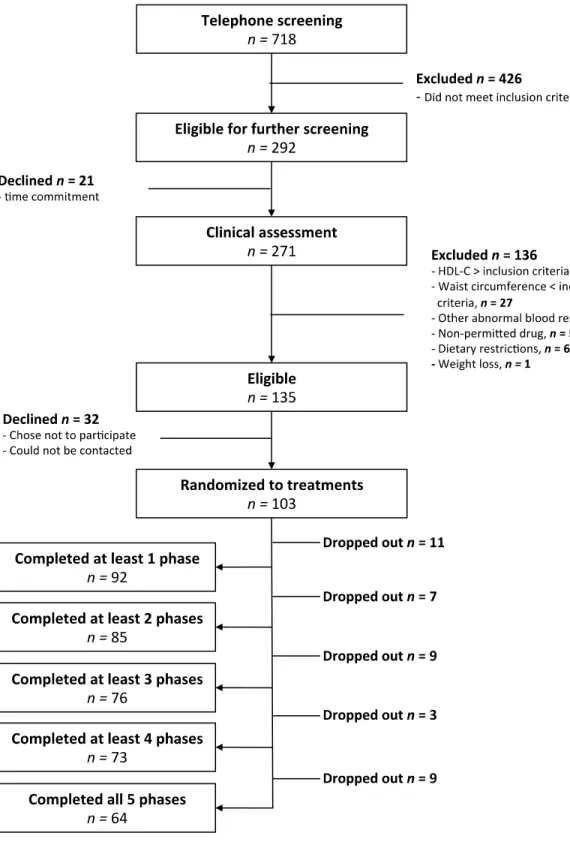
Comparaison des impacts des acides gras
saturés de différents produits d’origine
laitière sur les marqueurs de risque
cardiométabolique
Mémoire
Maude Tessier-Grenier
Maîtrise en nutrition
Maître ès sciences (M. Sc.)
Québec, Canada
© Maude Tessier-Grenier, 2017
Comparaison des impacts des acides gras
saturés de différents produits d’origine
laitière sur les marqueurs de risque
cardiométabolique
Mémoire
Maude Tessier-Grenier
Sous la direction de :
Benoît Lamarche, directeur de recherche
Patrick Couture, codirecteur de recherche
iii
Résumé
Les maladies cardiovasculaires (MCV) font partie des plus importantes causes de mortalité au Canada. Elles sont caractérisées par différentes affections touchant le cœur et/ou les vaisseaux sanguins, dont un ensemble de facteurs de risque y sont impliqués. De nombreux facteurs de risque tels que les niveaux de lipides plasmatiques et l’hypertension pourraient être modulés entre autres par l’alimentation et de saines habitudes de vie. Toutefois, le rôle de certains nutriments tels que les lipides alimentaires et leurs répercussions sur les MCV est mitigé dans la littérature scientifique. Précisément, des études de cohortes ont démontré que l’incidence des MCV pouvait être augmentée par la consommation d’acides gras saturés (AGS), tandis que d’autres études ont établi que l’impact de l’apport alimentaire en gras saturés sur la santé cardiovasculaire pouvait potentiellement dépendre de la source d’AGS consommée. Ce mémoire présente les résultats d’une étude clinique multicentrique dont l’objectif principal était de vérifier l’impact des AGS provenant de différents produits laitiers, soit le fromage et le beurre, sur différents marqueurs de risque cardiométabolique. Les résultats de cette étude suggèrent que la consommation d’AGS provenant du fromage n’a pas les mêmes répercussions sur les niveaux de cholestérol des lipoprotéines de faible densité (C-LDL) que la consommation d’AGS provenant du beurre. L’effet de la consommation d’AGS du fromage sur le C-LDL est d’ailleurs modulé en fonction des niveaux de base de C-LDL des hommes et des femmes ayant pris part à l’étude. Ce devis de haute qualité scientifique apporte de nouvelles perspectives relativement à l’effet des AGS sur les marqueurs de risque cardiométabolique. Toutefois, plus d’études sont requises afin de mieux comprendre l’effet de la matrice alimentaire sur d’autres marqueurs du risque cardiovasculaire.
iv
Abstract
Cardiovascular diseases (CVD) are one of the most important causes of death in Canada. They are characterized by various conditions affecting the heart and/or the blood vessels, of which a set of risk factors are involved. Many risk factors such as blood lipids levels and hypertension could be modulated, notably by diet and healthy lifestyles. However, the impact of certain nutrients such as dietary lipids and their implications in CVD remains controversial in the scientific community. Precisely, cohort studies have shown that the incidence of CVD can be increased by the consumption of saturated fatty acids (SFA), while other studies have found that the impact of dietary SFA on cardiovascular health could potentially depend on the source of SFA consumed. This thesis presents the results of a multicenter clinical study which had as a main objective to investigate the impact of SFA from different dairy products, namely cheese and butter on various cardiometabolic risk factors. Results of this study suggest that consumption of SFA from cheese does not have the same impact on low-density cholesterol (LDL-C) levels that consumption of SFA from butter. The effect of SFA consumption from cheese on LDL-C is also modulated according to baseline LDL-C levels of the men and women who participated in the study. This high-quality scientific study provides new insights into the effect of SFA on cardiometabolic risk. However, more studies are needed to better understand the effect of the food matrix on other cardiovascular risk markers.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations et des sigles ... viii
Avant-propos ... ix Introduction générale ... 1 Chapitre 1 – Problématique ... 3 1- Maladies cardiovasculaires ... 3 1.1- Définition ... 3 1.2- Prévalence ... 3 1.3- Physiologie des MCV ... 3
1.4- Facteurs de risque des MCV ... 4
1.4.1- Marqueurs de risque lipidiques ... 5
1.4.1.1- Triglycérides et cholestérol des lipoprotéines plasmatiques ... 6
1.4.1.2- Apolipoprotéine B ... 10
1.4.1.3- Ratio C total/C-HDL ... 10
1.4.2- Hypertension artérielle ... 10
1.4.3- Inflammation ... 11
1.4.4- Contrôle glycémique et résistance à l’insuline ... 12
1.5- Prévention des MCV ... 12
2- Rôle de l’alimentation dans la prévention des MCV ... 13
2.1 Les glucides alimentaires ... 13
2.2- Les lipides alimentaires ... 14
2.2.1- Métabolisme ... 14
2.2.2- Acides gras mono-insaturés ... 15
2.2.3 Acides gras polyinsaturés ... 17
2.2.4- Acides gras saturés ... 19
3- Impact de la source d’acide gras saturé et la matrice alimentaire sur la santé cardiométabolique ... 21
4- Objectifs et hypothèse ... 27
Chapitre 2- Comparaison de l’impact des acides gras saturés du fromage et du beurre sur les facteurs de risque cardiométabolique: une étude clinique randomisée contrôlée ... 28
Chapitre 3- Discussion générale et conclusion ... 56
vi
Liste des tableaux
Chapitre 1
Tableau 1: Critères diagnostiques du syndrome métabolique ... 5 Tableau 2: Niveau de risque cardiovasculaire et cibles de traitement recommandées ... 6 Tableau 3: Résumé des études ayant comparé une consommation d’AGS du fromage à une consommation d’AGS du beurre ... 26
Chapitre 2
Table 1: Mean nutritional composition of the five pre-determined experimental diets ... 49 Table 2: Characteristics at screening of subjects having completed at least one diet ... 50 Table 3: Anthropometric measures, plasma lipid profile and non-lipid cardiovascular risk factors at the end of each dietary intervention in the 92 subjects ... 51 Table 4: Supplemental Table 1. Anthropometric measures, plasma lipid profile and non-lipid cardiovascular risk factors at the end of each dietary intervention (Intent-to-treat analysis with multiple imputation of missing data) ... 52 Table 5: Supplemental Table 2. Self-reported adverse effects during each dietary phase 53
vii
Liste des figures
Chapitre 1
Figure 1: Processus du développement de l’athérosclérose ... 4 Figure 2: Transport des lipides exogènes ... 7 Figure 3: Métabolisme des lipides alimentaires ... 15
Chapitre 2
Figure 1: Flow chart diagram ... 54 Figure 2: Interaction between baseline LDL-C concentrations and diet induced change in LDL-C ... 55 Figure 3: Predicted vs. observed changes in blood lipids with SFAs from BUTTER and CHEESE ... 55
viii
Liste des abréviations et des sigles
ADN : Acide désoxyribonucléique AGMI : Acide gras mono-insaturé AGPI : Acide gras polyinsaturé AGS : Acide gras saturéAJCN : American Journal of Clinical Nutrition ApoB : Apolipoprotéine B
AVC : Accident vasculaire cérébral
EPA : Acide eicosapentaénoïque (Eicosapentaenoic acid)
C : Cholestérol
CETP : Cholesteryl ester transfer protein CRP : Protéine C réactive (C-reactive protein) DASH : Dietary Approaches to Stop Hypertension
DHA : Acide docosahexaénoïque (Docosahexaenoic acid) HDL : Lipoprotéine de haute densité (High-density lipoprotein) HOMA : Homeostatic model assessment
hs : Haute sensibilité (high-sensitivity) HTA : Hypertension artérielle
ICT : Ischémie cérébrale transitoire
IDL : Lipoprotéine de densité intermédiaire (Intermediate-density lipoprotein) IR : Résistance à l’insuline (Insulin resistance)
INAF : Institut sur la nutrition et les aliments fonctionnels LDL : Lipoprotéine de faible densité (Low-density lipoprotein) MCV : Maladies cardiovasculaires
NCEP : National Cholesterol Education Program OMS : Organisation mondiale de la santé PREDIMED : PREvención con DIeta MEDiterránea
RCFFN : Richardson Center for Functional Foods and Nutraceuticals TG : Triglycérides
TNF-α : Facteur de nécrose tumorale-alpha (Tumor Necrosis Factor-alpha) VLDL : Lipoprotéine de très faible densité (Very-low-density lipoprotein)
ix
Avant-propos
Il y a deux ans déjà, j’ai été accueillie chaleureusement à l’Institut sur la nutrition et les aliments fonctionnels (INAF), dans l’équipe du Dr. Benoît Lamarche, afin de pouvoir réaliser un de mes objectifs de carrière ; faire une maîtrise en nutrition. Au cours des 6 dernières sessions, mon travail a porté sur l’étude des effets de différentes sources d’acides gras saturés d’origine laitière sur les marqueurs de risque cardiovasculaire traditionnels. L’écriture de ce mémoire, portant sur la prévention des maladies cardiovasculaires par l’alimentation, n’est ainsi qu’une infime partie de toutes les étapes que j’ai franchies, accompagnée par mon directeur de maîtrise et mes collègues.
Durant plus d’un an, j’ai pu participer à la phase d’intervention du projet consistant entre autres à recruter les participants, à les encadrer presqu’à tous les jours et à interagir avec eux. C’est après plusieurs mois de saisie de données que nous avons pu débuter les analyses statistiques, afin de découvrir enfin l’effet de nos interventions nutritionnelles sur la santé cardiovasculaire de nos participants. Durant ma maîtrise, j’ai aussi eu la chance de présenter mes résultats de recherche par affiche dans plusieurs congrès dont l’Experimental Biology 2016, se déroulant à San Diego en Californie, au mois d’avril 2016. J’ai finalement écrit un article scientifique qui a très récemment été publié dans la revue The
American Journal of Clinical Nutrition (AJCN).
Évidemment, toutes ces réalisations n’auraient pu être possibles sans l’implication de nombreux joueurs. Pour mettre sur pied et veiller au bon déroulement d’un projet d’aussi grande envergure, cela nécessite l’aide de plusieurs personnes. Merci aux techniciennes en diététique et à l’équipe des soins infirmiers sans qui nos participants n’auraient pu manger durant le projet, et sans qui nous n’aurions aucune donnée à analyser ! Je tiens également à remercier Dr. Benoît Lamarche pour sa patience, pour la transmission de son savoir, pour ses explications claires ainsi que pour son support dans la réalisation des étapes de ma maîtrise. Merci aussi à toute l’équipe de recherche, en particulier à Iris Gigleux pour la coordination du projet et à Didier Brassard pour son importante implication dans la phase d’intervention du projet.
En terminant, merci à ma famille et à mon conjoint de m’avoir encouragée à poursuivre des études universitaires.
1
Introduction générale
Les maladies cardiovasculaires (MCV) sont l’une des principales causes de décès au Canada. Plusieurs études épidémiologiques ont démontré une association entre les lipides plasmatiques et le risque de développer une MCV (1, 2). En effet, le risque de mortalité par maladies coronariennes ischémiques chez les hommes et les femmes d’âge moyen est de 50% plus faible lorsque le cholestérol total est plus bas de 1 mmol/L (3). De plus, une augmentation de 0,026 mmol/L dans les concentrations plasmatiques de cholestérol des lipoprotéines de haute densité (C-HDL) pourrait également être associée à une diminution du taux de mortalité par MCV de 3,7 à 4,7% (4). D’autres facteurs tels que la tension artérielle, certains marqueurs inflammatoires et la résistance à l’insuline sont également reconnus pour jouer un rôle dans le risque de MCV, en influençant la fonction endothéliale (5-7). Par exemple, la résistance à l’insuline fait partie intégrante du syndrome métabolique, qui est caractérisé par une constellation de facteurs de risque directement reliés au diabète de type 2 et aux MCV (8).
Il a été démontré que des modes d’alimentation sains pouvaient prévenir le développement de MCV, en modulant les lipides plasmatiques et autres facteurs de risque non-lipidiques (9). Par conséquent, les lignes directrices pour la prévention de MCV ciblent actuellement différentes stratégies alimentaires comme la réduction d’acides gras saturés (AGS) dans la diète, car ils sont principalement reconnus pour augmenter la concentration sanguine du cholestérol des lipoprotéines de faible densité (C-LDL) (10-13).
Par contre, l’impact des AGS alimentaires sur les MCV est devenu controversé dans la dernière décennie. Une récente méta-analyse d’études observationnelles a démontré que les AGS n’étaient pas associés avec la mortalité toute cause confondue, la mortalité par MCV, par maladie coronarienne ou par accident vasculaire cérébral (AVC) (14). D’autre part, une revue systématique d’études randomisées contrôlées a démontré que la réduction d’AGS dans la diète pouvait diminuer le risque de développer une MCV de 17% (15). La controverse entourant la consommation d’AGS et la santé cardiovasculaire provient aussi du fait que les marqueurs de risque cardiovasculaire n’ont pas tous été étudiés avant l’émission des recommandations en lien avec la réduction d’AGS dans la diète (16).
De récentes études suggèrent également que les AGS de différentes sources pourraient affecter différemment le risque de MCV (17). Différents aliments provenant du lait
2
sembleraient également moduler les facteurs de risque cardiométabolique différemment. De Goede et al. (18) ont démontré que le fromage ferme avait le potentiel de réduire le C-LDL et le C-HDL, en comparaison au beurre. La matrice alimentaire qui accompagne les AGS du fromage pourrait être l’un des facteurs expliquant les effets divergents sur les lipides plasmatiques, par rapport au beurre. Puisque les produits d’origine laitière constituent une source majeure d’AGS dans la diète occidentale (19) et que leur impact sur le risque CV demeure incertain, nous avons mené une étude clinique randomisée contrôlée à l’Institut sur la nutrition et les aliments fonctionnels (INAF), avec la participation du Richardson Center for Functional Foods and Nutraceuticals (RCFFN) au Manitoba.
L’objectif premier de cette étude était d’étudier l’impact des AGS de différentes sources d’origine laitière, soit le fromage et le beurre, sur les lipides plasmatiques, la tension artérielle et d’autres marqueurs de risque non-lipidiques. Comme objectif secondaire, nous avons comparé l’impact de ces mêmes sources d’AGS à d’autres sources de lipides, soit les acides gras mono-insaturés (AGMI) et les acides gras polyinsaturés (AGPI).
Ce mémoire se divise en trois chapitres. Le premier chapitre représente la problématique, soit le lien entre les MCV et les acides gras alimentaires, ainsi que l’impact de la source d’AGS d’origine laitière sur la santé cardiovasculaire. Par la suite, les objectifs et l’hypothèse sont présentés. Le chapitre 2 présente l’article soumis au journal The American Journal of
Clinical Nutrition (AJCN), qui porte sur la comparaison de l’impact d’une consommation
d’AGS du fromage et du beurre sur les facteurs de risque cardiométabolique. Finalement, le chapitre 3 présente la discussion et la conclusion générale du projet.
3
Chapitre 1 – Problématique
1- Maladies cardiovasculaires
1.1- Définition
Les MCV se définissent par un ensemble d’affections touchant le cœur (maladies coronariennes) et/ou les vaisseaux sanguins. Les maladies coronariennes regroupent différents troubles directement liés au cœur tels que les malformations congénitales, l’angine, l’arythmie, la fibrillation auriculaire, l’insuffisance cardiaque, les maladies coronariennes ischémiques et la crise cardiaque (infarctus du myocarde). Le terme « maladie cardiovasculaire » est donc un terme plus général qui englobe les maladies coronariennes, mais également d’autres conditions telles que l’hypertension, l’accident vasculaire cérébral (AVC) et les artériopathies périphériques (20, 21).
1.2- Prévalence
Les MCV constituent l’une des principales causes de décès au Canada. En 2012, l’Organisation mondiale de la santé (OMS) estimait que le tiers des décès était causé par une MCV, tous âges confondus. Chez la population âgée de 70 ans et plus, c’est près de la moitié des décès qui étaient attribuables à une MCV. Ces statistiques risquent toutefois de demeurer stables d’ici les 15 prochaines années, selon les prédictions de l’OMS (22). 1.3- Physiologie des MCV
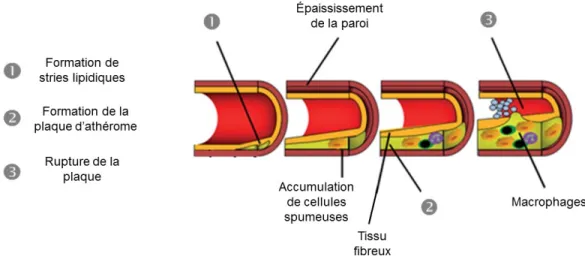
Le processus par lequel se développent les MCV est complexe et surtout, multifactoriel. Outre les cas de malformations congénitales se développant in-utéro et les vasculites, qui sont des atteintes inflammatoires, la plupart des maladies de l’appareil circulatoire sont initiées par un processus appelé l’athérosclérose. Globalement, ce processus se traduit par la formation de plaques athéromateuses sur les parois de vaisseaux sanguins coronariens ou périphériques appelées endothélium (23). La pathogénèse de l’athérosclérose peut être résumée en trois grandes étapes, imagées sur la figure 1. Premièrement, notons la formation de stries lipidiques via une dysfonction endothéliale. Par une séquence d’activation de molécules pro-inflammatoires, les LDL accumulées s’oxydent et sont captées par les macrophages qui se transforment en cellules spumeuses. Deuxièmement, la plaque d’athérome se forme, via la migration des cellules endothéliales et du muscle vasculaire vers le centre des vaisseaux sanguins. Dans ces conditions, du tissu fibreux riche en
4
collagène, en lymphocytes-T et en macrophages se forme, réduisant ainsi le diamètre des vaisseaux sanguins. Finalement, la présence de ces macrophages et de ces lymphocytes-T stimulent entre autres la sécrétion de substances inflammatoires, capables de détruire la matrice extracellulaire, amenant ainsi progressivement la destruction du tissu fibreux, l’accumulation de plaquettes sanguines et la formation de caillots sanguins, pouvant ainsi bloquer le passage du flux sanguin et occasionner un AVC ou un infarctus du myocarde (23).
Figure 1: Processus du développement de l’athérosclérose Figure adaptée de Ellertsen et al. (24).
1.4- Facteurs de risque des MCV
Il existe plusieurs facteurs de risque, modifiables ou non-modifiables, favorisant le développement de MCV. Parmi les facteurs modifiables, notons l’hypertension artérielle (HTA), le cholestérol sanguin, le diabète, l’embonpoint ou l’obésité, la consommation excessive d’alcool, la sédentarité, le tabagisme et le stress (25). Toujours selon la Fondation des maladies du cœur et de l’AVC, les facteurs de risque non-modifiables sont l’âge, le sexe, les antécédents familiaux, l’origine ethnique et la présence d’AVC ou d’ischémie cérébrale transitoire (ICT) antérieurs (25). Au cours des dernières décennies, plusieurs chercheurs se sont intéressés au syndrome métabolique, ce groupe de facteurs de risque qui augmentent le risque de MCV, d’AVC et de diabète. Bien que la définition de ce syndrome ne soit pas encore standardisée dans le monde, celle de la Fédération internationale du diabète (IDF) semble être la plus acceptée au Canada (13, 26). En plus
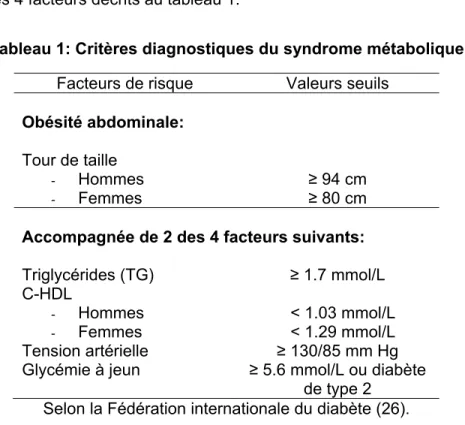
5
de souffrir d’obésité abdominale, définie par un tour de taille ≥ 80 cm chez les femmes et ≥ 94 cm chez les hommes, une personne porteuse du syndrome métabolique doit également présenter 2 des 4 facteurs décrits au tableau 1.
Tableau 1: Critères diagnostiques du syndrome métabolique Facteurs de risque Valeurs seuils
Obésité abdominale: Tour de taille - Hommes - Femmes ≥ 94 cm ≥ 80 cm Accompagnée de 2 des 4 facteurs suivants: Triglycérides (TG) ≥ 1.7 mmol/L C-HDL - Hommes - Femmes < 1.03 mmol/L < 1.29 mmol/L Tension artérielle ≥ 130/85 mm Hg Glycémie à jeun ≥ 5.6 mmol/L ou diabète
de type 2 Selon la Fédération internationale du diabète (26).
Finalement, le risque de développer une MCV peut se calculer à l’aide du score de Framingham, qui tient compte à la fois de facteurs de risque modifiables et non-modifiables (27). Cet outil permet d’attribuer aux adultes de 30 ans et plus un niveau de risque variant de faible à élevé, et de guider les médecins sur le traitement pharmacologique et sur les cibles des niveaux de cholestérol sanguin à atteindre (tableau 2).
1.4.1- Marqueurs de risque lipidiques
Les marqueurs de risque lipidiques font partie des facteurs de risque contrôlables dans le développement des MCV. Les lipides qui proviennent de l’alimentation sont composés à 95% de triglycérides (TG) (28). Autrement, les lipoprotéines plasmatiques, soit les LDL et les HDL, sont composées en majeure partie de lipides provenant de source endogène c’est-à-dire, produits par le foie.
6
Tableau 2: Niveau de risque cardiovasculaire et cibles de traitement recommandées Niveau de risque Initiation du traitement
pharmaceutique
Cible recommandée Élevé
Niveau de risque CV ≥ 20%
Traitement à considérer chez tous
ces patients C-LDL < 2 mmol/L OU Baisse du C-LDL de > 50% OU Apo B < 0,8 g/L OU C non-HDL < 2,5 mmol/L Modéré Niveau de risque CV entre 10 et 19% Traitement à considérer si C-LDL ≥ 3,5 mmol/L OU C non-HDL ≥ 4,3 mmol/L OU Apo B ≥ 1,2 g/L OU
♂ ≥ 50 ans / ♀ ≥ 60 ans et facteur de risque de MCV Faible Niveau de risque CV < 10% Traitement à considérer si LDL-C ≥ 5,0 mmol/L ou autres conditions médicales Baisse du C-LDL de > 50%
Selon les lignes directrices Canadiennes pour la prise en charge de la dyslipidémie et la prévention de MCV chez l’adulte (13).
1.4.1.1- Triglycérides et cholestérol des lipoprotéines plasmatiques
La plupart des gras alimentaires consommés se présentent sous forme de TG. C’est d’ailleurs sous cette forme qu’ils sont stockés dans l’organisme humain. Ces TG sont composés d’une molécule de glycérol à laquelle sont attachés trois acides gras libres par une liaison ester. Les acides gras libres qui les composent peuvent être saturés, mono-insaturés ou polymono-insaturés. C’est entre autres ce niveau de saturation des acides gras qui affecte les caractéristiques physiques et la façon dont les lipides seront stockés dans l’organisme humain. Après la digestion des TG dans le petit intestin, ceux-ci sont intégrés aux lipoprotéines plasmatiques afin de leur permettre de circuler à travers le corps. Les niveaux de TG plasmatiques correspondent à la somme des TG contenus à la fois dans les chylomicrons et dans les différentes lipoprotéines circulantes, soit les lipoprotéines de très faible densité (VLDL), les lipoprotéines de densité intermédiaire (IDL), les LDL et les HDL (28).
Les lipoprotéines sont classifiées de par leur densité et contenu en cholestérol et en protéines. De manière générale, plus une lipoprotéine est riche en cholestérol et pauvre en protéines, moins elle est dense. La majeure partie de la digestion des gras alimentaires s’effectue dans l’intestin. Par la suite, les gras alimentaires se joignent aux lipides
7
endogènes dans les cellules intestinales et avec différentes protéines, ils entrent dans la composition des chylomicrons. Ce type de lipoprotéine, composé principalement de lipides (cholestérol, TG et phospholipides) et de protéines sert principalement de véhicule pour le transport des lipides dans la lymphe et le sang. Le métabolisme des lipoprotéines est représenté sur la figure 2. Après que les cellules du corps aient capté les TG alimentaires par la formation de chylomicrons, ces derniers migrent vers le foie, où d’autres types de lipoprotéines sont créés. Les LDL et les HDL sont les lipoprotéines qui sont présentes en plus grande quantité dans le plasma sanguin. Suite à leur fabrication dans le foie, les VLDL délaissent des TG dans les tissus, augmentant ainsi leur proportion en cholestérol. Il en résulte des molécules de LDL. À mesure que les LDL circulent à travers le plasma, les différentes cellules de l’organisme captent leur contenu lipidique via différents récepteurs spécifiques situés à leur surface, dans le but de construire de nouvelles membranes, de fabriquer différentes hormones ou de le stocker. Parallèlement au transport du cholestérol, les HDL, principalement responsables du transport inverse du cholestérol, sont fabriquées par le foie, l’intestin et dans la circulation sanguine. Elles ont donc pour principal rôle de déloger le cholestérol des tissus périphériques pour le retourner dans le tissu hépatique, afin qu’il soit éliminé par la bile (29, 30).
Figure 2: Transport des lipides exogènes Figure adaptée de Genest et al. (31).
8
Les analyses sanguines permettent de doser directement le contenu en cholestérol des lipoprotéines. Cependant, pour le C-LDL, celui-ci est habituellement calculé à partir des dosages de C-HDL, de cholestérol total et de TG plasmatiques. Cette mesure permet une bonne estimation du C-LDL réel, pour autant que les niveaux de TG plasmatiques soient ≤ 4,5 mmol/L. Autrement, une mesure directe du C-LDL peut être effectuée lorsque les niveaux de TG plasmatiques sont trop hauts (29).
L’hypertriglycéridémie à jeun, causée par des facteurs à la fois génétiques et non-génétiques, se définit par des niveaux de TG plasmatiques au-dessus du 95e percentile pour l’âge et le sexe (32). Selon le National Cholesterol Education Program (NCEP) sur la détection, l’évaluation et le traitement du cholestérol sanguin élevé chez les adultes, cela se traduit par des niveaux de TG sériques allant de 1,7 à plus de 5,6 mmol/L (33). Le rôle de l’hypertriglycéridémie à jeun comme facteur de risque indépendant dans la progression de l’athérosclérose et du développement des MCV demeure controversé. Seulement pour les maladies coronariennes, une méta-analyse regroupant plus d’un million de sujets a montré une augmentation du risque de 37% par augmentation d’un écart-type dans les valeurs de TG plasmatiques, après ajustement pour les marqueurs de risque non-lipidiques. Cette association devenait toutefois non-significative lorsque les auteurs ajustaient pour les niveaux de C-HDL et de cholestérol non-HDL (34). Des auteurs d’une méta-analyse regroupant 17 études prospectives, ont quant à eux démontré que le risque de développer une MCV était plus élevé de 22% et de 44%, respectivement chez les hommes et les femmes qui avaient des niveaux de TG plus élevés de 1 mmol/L, après ajustement pour les concentrations de C-HDL (35). L’association entre l’augmentation des TG plasmatiques et le développement de la plaque d’athérome serait entre autres lié au catabolisme des lipoprotéines riches en TG, contribuant ainsi à la formation de cellules spumeuses dans l’espace endothélial (32). Malgré cela, l’hypertriglycéridémie à jeun est actuellement difficilement reconnue comme un facteur de risque indépendant des MCV.
Les effets du cholestérol contenu dans les lipoprotéines sur le risque de MCV ont été décrits pour la première fois dans les années 1970, dans l’étude populationnelle de Framingham. Chez une cohorte de près de 3000 hommes et femmes, il a été démontré que les personnes qui avaient des niveaux plus faibles de C-HDL (< 0,9 mmol/L) étaient plus à risque de développer une maladie coronarienne que celles qui présentaient des niveaux plus élevés (36). L’importance de considérer les niveaux plasmatiques de C-HDL dans l’évaluation des facteurs de risque a également été corroborée par d’autres groupes de chercheurs qui ont
9
étudié les marqueurs de risque de maladies coronariennes sur de grandes populations (37-39). Certaines études ont démontré que les concentrations de C-HDL pouvaient être augmentées par la pratique régulière d’activité physique et la consommation modérée d’alcool (40, 41). De plus, certaines classes de médicaments telles que les statines, les fibrates, les inhibiteurs de la protéine de transfert des esters de cholestérol (CETP:
cholesteryl ester transfer protein) et les inhibiteurs de l’absorption intestinale de cholestérol
ont également été reconnues pour augmenter le C-HDL (42, 43). Toutefois, des études randomisées contrôlées ayant évalué l’effet de ces substances pharmacologiques, plus particulièrement les inhibiteurs de la CETP, n’ont trouvé aucune association entre l’augmentation des niveaux sériques de C-HDL induite par ces substances, et le risque de MCV (44, 45). Des marqueurs de risque cardiovasculaire plus émergents tels que la taille des particules de HDL et les caractéristiques fonctionnelles de celles-ci incluant l’efflux de cholestérol et les capacités antioxydantes, seraient donc plus efficaces que les concentrations plasmatiques pour prédire le risque de MCV (46, 47).
Par ailleurs, des niveaux élevés de C-LDL ont été associés à un risque plus élevé de développer une maladie coronarienne dans plusieurs études observationnelles (48). Tel que mentionné précédemment, la molécule de LDL contient principalement du cholestérol estérifié. À jeun, environ 70% du cholestérol total circulant dans le plasma est contenu dans les LDL. Lorsque le cholestérol de ces lipoprotéines n’est pas utilisé pour la construction de membranes ou pour la synthèse d’hormones stéroïdiennes, d’autres récepteurs présents à la surface des cellules épithéliales peuvent capter le surplus. Par différents processus, les molécules de LDL présentes en excès dans la paroi vasculaire s’oxydent et deviennent alors partie prenante de la formation de la plaque d’athérome (29). C’est pourquoi de nombreuses études épidémiologiques démontrent que pour chaque 1 mmol/L de diminution du C-LDL, le risque relatif de MCV diminue de 20 à 22% (13). Des études cliniques ont également mesuré l’effet de la prise de statines pour diminuer les facteurs de risque de MCV, dont les concentrations de C-LDL. Ces interventions ont démontré que les statines, comparativement à un placebo, apportaient des effets bénéfiques sur la réduction des taux de mortalité par MCV et la diminution de l’incidence de MCV (49). C’est pourquoi la prescription de ces médicaments font actuellement partie des lignes directrices canadiennes pour le traitement de l’hypercholestérolémie (13).
10
1.4.1.2- Apolipoprotéine B
L’apolipoprotéine (apo) B est la principale protéine présente à la surface des LDL. En plus de permettre une bonne stabilité à la lipoprotéine lors de sa circulation dans le sang, elle offre une spécificité à chaque complexe de lipoprotéine, permettant ainsi leur reconnaissance par les récepteurs spécifiques. L’apoB-100 est la principale protéine retrouvée à la surface des LDL (30). Le dosage sanguin d’apoB permet une bonne estimation du nombre de particules LDL en circulation puisque celles-ci représentent plus de 90% de tous les apoB circulants, et que chaque molécule de LDL ne contient qu’une seule apoB (50). Parmi toutes les apolipoprotéines connues, la mesure de l’apoB est la seule qui est actuellement suggérée par les recommandations canadiennes pour établir le traitement adéquat face au risque de MCV, et/ou pour établir la cible à atteindre en fonction du risque (13). En effet, il a été démontré que des niveaux élevés d’apoB pouvaient augmenter le risque de maladie coronarienne ischémique, indépendamment du C-LDL (51). Plus récemment, un groupe de chercheurs a démontré que l’apoB permettait d’améliorer l’évaluation du risque de futurs événements coronariens, au-delà du C-LDL et du cholestérol non-HDL (52). Il est donc très pertinent de considérer le dosage de l’apoB lorsque l’on veut étudier les facteurs de risque cardiovasculaire.
1.4.1.3- Ratio C total/C-HDL
Comme son nom l’indique, le ratio représente le rapport entre le cholestérol total circulant dans le plasma par l’entremise des différentes lipoprotéines et le cholestérol contenu uniquement dans les HDL. Ce marqueur est également un excellent indice du risque de développer une maladie coronarienne (1, 53, 54). Une étude américaine et populationnelle a d’ailleurs identifié le ratio cholestérol total/HDL comme un marqueur additionnel au C-LDL et au cholestérol non-HDL en lien avec la prédiction du risque de maladies coronariennes (55).
1.4.2- Hypertension artérielle
L’hypertension artérielle se définit par une augmentation de la pression qu’exerce le sang sur les artères. La tension artérielle systolique correspond à la force exercée par le sang sur les parois internes des artères lorsque le cœur se contracte, alors que la tension artérielle diastolique est caractérisée par la pression du sang lorsque le cœur est au repos (25). Le diagnostic de l’hypertension est basé sur la moyenne de deux ou plusieurs mesures de la
11
pression artérielle et ce, mesurées au minimum lors de deux visites subséquentes chez le médecin. Les valeurs diagnostiques sont de ≥ 140 mm Hg de pression systolique et/ou ≥ 90 mm Hg de pression diastolique, et la pathologie se divise en 3 stades, soit de léger à sévère. Les liens entre l’HTA et les MCV ne sont plus à démontrer (56). À long terme, lorsque la pression à l’intérieur des artères est trop élevée, cela entraîne une dysfonction de l’endothélium qui tapisse l’intérieur de ces vaisseaux, diminuant ainsi le potentiel de dilatation du vaisseau sanguin. Ayant ainsi un potentiel de dilatation réduit, les vaisseaux sanguins peuvent moins s’adapter aux dépôts de cholestérol sur les parois, contribuant ainsi au développement de la plaque d’athérome et éventuellement à la rupture de celle-ci. 1.4.3- Inflammation
L’inflammation est un processus physiologique par lequel le corps se défend en réponse à des agressions, dans le but de rétablir l’homéostasie aux sites endommagés. Lorsqu’il y a agression, le système immunitaire active des récepteurs qui permettent la libération de médiateurs chimiques appelés pro-inflammatoires. La plupart des réactions inflammatoires se résolvent rapidement, sans dommage. Toutefois, certaines réactions sont plus difficiles à réguler, et il peut arriver que l’inflammation devienne chronique et participe alors au développement ou à la progression de maladies (57). Parmi les réponses caractéristiques à l’inflammation chronique, notons le dysfonctionnement du système immunitaire, la perte de la fonction de barrière et le dysfonctionnement de certains tissus et organes, entraînant ainsi une plus grande perméabilité et une libération de stimuli inflammatoires tels que le facteur de nécrose tumorale (TNF-α; Tumor Necrosis Factor-alpha) et l’interleukine-6 (58). L’inflammation chronique « de faible intensité » est souvent qualifiée de silencieuse, car ses manifestations cliniques sont souvent absentes ou non-observables. Elle s’accompagne toutefois d’une élévation de marqueurs inflammatoires sanguins produits par le foie, tel que la protéine C réactive (CRP; C-reactive protein). Chez des individus en santé, les concentrations sériques de CRP sont habituellement très faibles, c’est pourquoi le dosage doit être réalisé à partir de méthodes de dosage ultra-sensibles, et que le terme «
high-sensitivity » (hs)-CRP est souvent utilisé (59).
Il est maintenant accepté que l’inflammation joue un rôle dans le développement de plusieurs désordres médicaux, notamment l’athérosclérose (60) et le syndrome métabolique (61). Tel qu’expliqué plus haut dans la physiologie des MCV, les différentes voies inflammatoires participent à la rupture de la plaque d’athérome, notamment par la formation
12
de thrombus souvent responsable d’infarctus du myocarde et d’AVC (60). Plusieurs études prospectives ont également suggéré que des niveaux élevés de CRP pouvaient prédire le risque de développer une MCV (62, 63). L’adiponectine est une hormone qui est sécrétée par le tissu adipeux (64). Elle est reconnue quant à elle, entre autres pour ses propriétés anti-inflammatoires incluant l’inhibition de la production de la cytokine TNF-α (65). L’adiponectine pourrait également jouer un rôle dans la prévention du risque cardiovasculaire, par le biais de l’inhibition de la transformation des macrophages en cellules spumeuses, suite à l’accumulation de cholestérol dans les vaisseaux sanguins (66). 1.4.4- Contrôle glycémique et résistance à l’insuline
L’Homeostatic Model Assessment (HOMA) est une méthode peu coûteuse, utilisée pour quantifier la résistance à l’insuline (IR; insulin resistance) et la fonction des cellules bêta du pancréas, dont le but premier est la sécrétion d’insuline. Ce modèle se définit par une formule mathématique développée par Matthews et collaborateurs (67), à partir des valeurs de glycémie et d’insulinémie à jeun. La formule permet une bonne estimation du degré de résistance à l’insuline, défini par l’état pathologique qui survient lorsque les niveaux de glucose sanguin augmentent et que les cellules des tissus périphériques ne répondent plus adéquatement à l’insuline produite par le pancréas dans le but de diminuer les taux de glucose sanguin. Outre son rôle dans le développement du diabète, la résistance à l’insuline participe au métabolisme des lipides et des lipoprotéines, en induisant une production excessive de lipoprotéines intestinales riches en TG d’origine hépatique et intestinale (68, 69). En plus d’induire une hyperglycémie, la résistance à l’insuline serait en partie responsable du développement du syndrome métabolique, notamment par sa contribution dans l’augmentation de la tension artérielle et au développement de l’obésité abdominale (70). Des niveaux élevés d’insuline plasmatique à jeun seraient un marqueur important de la résistance à l’insuline. Toutefois, bien que certaines études aient démontré que des niveaux d’insuline sérique élevés peuvent être associés à une augmentation du risque de développer une maladie cardiaque ischémique (71), le lien entre l’hyperinsulinémie, la progression des maladies coronariennes, la fonction vasculaire ainsi que l’inflammation doit être mieux établi (72).
1.5- Prévention des MCV
Tel que mentionné précédemment, plusieurs facteurs de risque des MCV sont modifiables. Entre autres, les lignes directrices canadiennes pour la prise en charge des dyslipidémies
13
suggèrent l’arrêt tabagique, la consommation modérée d’alcool (de 1 consommation par mois à 3 par jour) et une durée de sommeil variant de 6 à 8 heures par nuit. De plus, les lignes directrices encouragent la pratique d’activité physique modérée à intense à raison de 150 minutes par semaine, via des périodes d’au minimum 10 minutes. La Société canadienne de cardiologie Canadian Cardiovascular Society suggère également des modifications au niveau des habitudes alimentaires, dans une optique d’atteinte d’un poids santé, d’amélioration du profil lipidique et de la réduction du risque de MCV (13). À l’heure actuelle, les principales recommandations nutritionnelles canadiennes et américaines visent l’élimination des gras trans et la diminution des AGS dans la diète (12, 13). De plus, les évidences suggèrent le remplacement des AGS par des AGPI dans le but d’améliorer les bénéfices cardiovasculaires (73, 74). Plusieurs types de patrons alimentaires sont également recommandés afin de diminuer le risque de MCV. Par exemple, l’alimentation méditerranéenne basée sur la consommation de fruits, légumes, noix, graines, produits céréaliers à grains entiers et d’huile d’olive est considérée comme une recommandation de choix pour la réduction du risque de MCV (12, 13). Ensuite, des études montrent que la diète Portfolio riche en amandes, fibres solubles, protéines de soya et phytostérols, ainsi la diète Dietary Approaches to Stop Hypertension (DASH) basée sur une consommation élevée de fruits et légumes et faible en sodium, pourraient également prévenir le risque de développer une MCV (75, 76). Finalement, notons que l’adhérence à ces patrons ou recommandations alimentaires est primordiale pour profiter des bénéfices de ces recommandations. Le choix d’un patron alimentaire devrait tenir compte des barrières culturelles, écologiques, environnementales et économiques de chaque individu. De plus, les conditions de santé uniques à chaque personne telles que les allergies, les intolérances et les troubles gastro-intestinaux devraient être évaluées par les professionnels de la santé avant d’entreprendre des démarches de modification des habitudes alimentaires à long terme (13).
2- Rôle de l’alimentation dans la prévention des MCV
2.1 Les glucides alimentaires
Les glucides constituent la première source d’énergie que le corps utilise. Ils se divisent en trois grandes familles, soit les monosaccharides ou les sucres simples, les disaccharides et les polysaccharides. Le glucose est le principal monosaccharide que le corps utilise et fabrique. Il est peu retrouvé à l’état naturel dans les aliments, mais cette molécule entre
14
dans la composition de tous les autres types de glucides. Afin d’obtenir du glucose, soit la première et la seule source de glucides que le cerveau peut utiliser pour fonctionner, les glucides complexes tels que les di- et les polysaccharides doivent subir une série de transformations dans le tube digestif (28).
C’est dans les années 1950 que les premières études associant la consommation de lipides aux MCV ont été publiées (77). À partir de cette décennie, les industriels se sont tranquillement tournés vers des produits faibles en gras, et les grands organismes de santé publique ont privilégié dans leurs recommandations la consommation de diètes riches en glucides, afin de viser une diminution de la consommation de lipides.
Or, les plus récentes recommandations américaines suggèrent une limite supérieure de consommation d’AGS à 10%, contrairement à celles de l’American Heart Association et de l’American College of Cardiology, qui visent un maximum de 5-6% de l’apport total énergétique. En effet, dans le contexte d’études épidémiologiques sur l’obésité et la résistance à l’insuline, il a été démontré que la diminution du risque de MCV était moins marquée avec la réduction de la consommation d’AGS, comparativement à la diminution de la consommation de glucides, particulièrement de sucres simples et raffinés (78). De manière générale, une grande consommation de sucres simples serait reconnue entre autres pour augmenter les TG plasmatiques de même que le risque de développer un diabète de type 2, deux marqueurs de risque de MCV (35, 79). En résumé, les dernières études sur le remplacement des AGS par des sucres simples semblent suggérer une association neutre voire négative sur le risque CV (78).
2.2- Les lipides alimentaires 2.2.1- Métabolisme
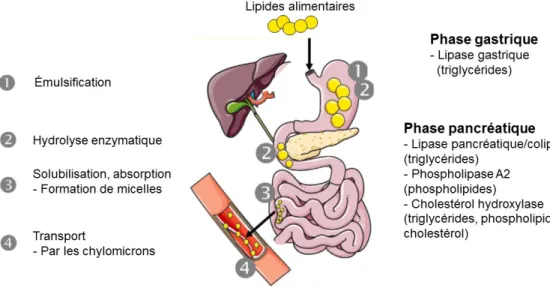
Les lipides alimentaires sont des nutriments qui fournissent au corps de l’énergie pour bien fonctionner. Parce que la plupart d’entre eux sont hydrophobes et que les enzymes digestives sont hydrophiles, la digestion de ces molécules de gras demande plus de temps et d’étapes au corps humain. La figure 3 résume les 4 grandes étapes de la digestion des lipides dans le corps humain. La majeure partie de la digestion des lipides s’effectue dans le petit intestin. Une fois les lipides émulsifiés par la bile, ceux-ci deviennent plus disponibles pour être hydrolysés par les enzymes pancréatiques. La lipase pancréatique s’attaque ainsi à chaque molécule de triglycéride et de phospholipide afin de les scinder en acides gras.
15
Par la suite, certaines petites molécules d’acides gras peuvent diffuser à l’intérieur des cellules intestinales, puis être directement absorbées dans la circulation sanguine. Cependant, la majorité des acides gras alimentaires ainsi que les triglycérides sont incorporés aux micelles, qui après leur passage dans les entérocytes deviennent disponibles pour le transport, par l’entremise des lipoprotéines formées dans le foie (28).
Figure 3: Métabolisme des lipides alimentaires Figure adaptée de Michalski et al. (31, 80). 2.2.2- Acides gras mono-insaturés
Les AGMI sont caractérisés chimiquement par la présence d’une seule double liaison entre deux carbones de la chaîne d’acide gras. L’AGMI le plus abondant dans l’alimentation est l’acide oléique, qui présente une double liaison entre les atomes carbones 9 et 10, d’où son appellation plus commune d’oméga-9. On retrouve des oméga-9 principalement dans les aliments végétaux tels que l’avocat, l’olive et leurs huiles, les huiles de canola et d’arachide, ainsi que certaines noix et graines telles que l’amande, la pacane, l’arachide, l’acajou et le macadamia (28). La présence d’une ou plusieurs insaturations ou doubles liaisons sur une molécule d’acide gras rend celle-ci plus sensible à l’oxydation. Depuis quelques années, plusieurs chercheurs s’intéressent aux effets des AGMI sur la prévention des MCV. Bien que la consommation modérée d’AGMI fasse partie des recommandations canadiennes pour le traitement des dyslipidémies et la prévention des MCV, certaines controverses perdurent, limitant ainsi l’application de recommandations par d’autres organismes de santé (13). Traditionnellement, les principaux marqueurs du risque cardiovasculaire étudiés et pris
16
en compte dans les recommandations se limitaient aux concentrations de lipides plasmatiques. De ce fait, plusieurs études randomisées et contrôlées ont démontré une amélioration du profil lipidique plasmatique des participants en santé, après la consommation d’AGMI, en comparaison avec des AGS ou des glucides (81, 82). Toutefois, l’effet des AGMI sur les marqueurs de risque plus émergents tels que les concentrations postprandiales de lipides plasmatiques et les caractéristiques fonctionnelles des lipoprotéines plasmatiques n’a pas été suffisamment étudié, ce qui limite l’émission de lignes directrices précises quant à la quantité d’oméga-9 recommandée dans la diète occidentale (81).
La diète méditerranéenne a pour principale source de lipides l’huile d’olive, riche en oméga-9 (83). Les études cliniques randomisées et contrôlées qui ciblent la consommation d’huile d’olive, jumelée ou non à une diète méditerranéenne sont nombreuses. Depuis quelques années, plusieurs études épidémiologiques et cliniques ont démontré que l’huile d’olive aurait des bienfaits importants au niveau de la prévention de la mortalité, des MCV, du diabète, du syndrome métabolique, de l’obésité et du cancer (84-86). En 2015, une revue de littérature a mené à la conclusion que la consommation régulière d’huile d’olive était associée à une augmentation de la longévité, notamment grâce à son rôle cardioprotecteur (84). Cet effet serait principalement attribuable à l’acide oléique et aux composés phénoliques, tous deux contenus en grandes proportions dans l’huile d’olive (87). Bien que les mécanismes d’action spécifiques soient encore nébuleux, il a été démontré dans plusieurs études que la consommation d’huile d’olive, seule ou dans un contexte d’alimentation méditerranéenne, améliorait les facteurs de risque de MCV, tels que les concentrations de lipides plasmatiques à jeun et de marqueurs inflammatoires, la fonction endothéliale, la tension artérielle et le stress oxydatif (85, 88, 89). Parmi les études cliniques marquantes qui ont mesuré les effets de l’huile d’olive sur les marqueurs de risque cardiovasculaire, notons l’étude PREDIMED (PREvención con DIeta MEDiterránea) (90). En 2006, des chercheurs ont sélectionné une sous-cohorte de 772 hommes et femmes de l’étude PREDIMED afin d’étudier principalement les différences dans les marqueurs de risque cardiovasculaire entre les 2 groupes qui devaient consommer une diète méditerranéenne enrichie en huile d’olive extra-vierge ou en noix, et le groupe témoin (88). Ils en sont venus à la conclusion que la diète méditerranéenne était responsable d’effets bénéfiques sur la santé du cœur, en comparaison avec la diète contrôle faible en lipides. En effet, le ratio cholestérol total/C-HDL était significativement diminué après la diète
17
méditerranéenne riche en huile d’olive ou en noix versus la diète contrôle, et la concentration plasmatique du C-HDL était augmentée. Il est toutefois important de se rappeler que les principes de la diète méditerranéenne ne sont pas uniquement basés sur une consommation riche en huile d’olive, mais encouragent également la consommation de vin rouge en modération, la diminution des aliments transformés, ainsi qu’un mode de vie actif. Il est donc impossible d’attribuer les effets positifs de cette diète qui ont été démontrés dans l’étude PREDIMED, seulement sur la consommation d’huile d’olive riche en AGMI.
En résumé, l’effet des AGMI sur la prévention des MCV nécessite d’être mieux investigué via des études cliniques randomisées contrôlées, bien qu’il semble que le remplacement des AGS par des AGMI comme l’huile d’olive, améliore le profil lipidique.
2.2.3 Acides gras polyinsaturés
Les AGPI quant à eux possèdent deux ou plusieurs doubles liaisons entre deux carbones de leur chaîne d’acides gras. Les deux principaux AGPI retrouvés dans l’alimentation qui ont fait l’objet de plusieurs études, entre autres sur la santé cardiovasculaire, sont les oméga-6 et les oméga-3. Il existe trois principales catégories d’oméga-3, soit l’acide eicosapentaénoïque (EPA) et l’acide docosahexaénoïque (DHA), tous deux issus de sources marines, et l’acide linolénique, provenant de sources végétales (28). Certains acides gras oméga-3 et oméga-6 sont dits essentiels, car l’organisme ne peut les produire par lui-même, et leurs fonctions sont vitales pour l’être humain. Par exemple, l’acide linoléique oméga-6 et l’acide linolénique oméga-3 agissent en tant que précurseurs pour la formation de plus longues chaînes d’acides gras insaturés, indispensables pour la formation de membranes cellulaires. Les oméga-3 et les oméga-6 sont également impliqués à plusieurs niveaux dans le développement neuronal (30).
Les oméga-6 sont retrouvés principalement dans les huiles végétales de maïs, de tournesol, de carthame et de soya, ainsi que dans certaines noix et graines comme la graine de tournesol, la noix de pin et la noix de Grenoble. L’EPA et le DHA quant à eux sont présents en grandes quantités dans les poissons gras tels que le saumon, la truite, le hareng, la sardine et le maquereau, alors que la noix de Grenoble, les graines de Chia et de lin ainsi que l’huile de lin sont de bonnes sources d’acide linolénique (28). Actuellement, les lignes directrices pour la prévention des MCV recommandent principalement de substituer les AGS de la diète par des AGPI (12, 13).
18
C’est dans les années 1930 que les premiers chercheurs ont établi que les acides gras oméga-6 avaient une grande importance dans la diète. Originalement reconnus pour diminuer les niveaux de C-LDL lorsqu’il sont consommés en remplacement des AGS, les acides gras oméga-6 se sont rapidement introduits dans le régime occidental, entre autres via l’importante commercialisation de margarines riches en oméga-6 (91). Cependant, au fil des années, des conclusions de nouvelles études ont noté une plus grande susceptibilité de la LDL à s’oxyder lorsque son contenu en acide linoléique s’élevait, augmentant ainsi le risque de MCV par athérosclérose (91). De plus, la poursuite des recherches en lien avec la consommation d’AGPI oméga-6 sur la santé cardiovasculaire a permis de mieux identifier le processus inflammatoire par la voie des eicosanoïdes. Ces acides gras, dont l’acide arachidonique fait partie, sont des dérivés du métabolisme de l’acide linoléique. Toutefois, il a été démontré dans les dernières années que l’acide arachidonique était impliqué dans plusieurs réponses physiologiques telles que l’inflammation et la thrombose. Suite à ces découvertes, l’effet des oméga-6 à eux seuls sur la diminution du risque cardiovasculaire fut remis en question (91).
Dans les années 1970, des populations du Groenland, du nord du Canada et de l’Alaska ont attiré l’attention des chercheurs, notamment grâce à leur faible taux de mortalité cardiovasculaire. En effet, ces populations consommaient dans leur diète, de grandes quantités de lipides sous forme d’AGPI oméga-3 EPA et DHA (92). Plus tard, certaines méta-analyses d’études prospectives ont confirmé que le risque relatif de mortalité par cause cardiovasculaire était diminué avec la consommation de suppléments d’acides gras oméga-3 issus de sources marines, chez des patients atteints ou non de maladie coronarienne (93-95). Toutefois, les résultats d’une méta-analyse datant de 2012 ont démontré qu’une supplémentation en AGPI oméga-3 ne pouvait pas être associée à un risque réduit de mortalité toutes causes confondues, par cause cardiovasculaire, d’infarctus du myocarde ou d’AVC (96). La plupart des études épidémiologiques démontrent également des effets contradictoires de la consommation d’oméga-3 sur la diminution du risque de MCV, incluant maladies coronariennes, infarctus du myocarde et AVC (97).
Des études randomisées contrôlées suggèrent que la consommation d’oméga-3 de sources marines soit associée à des impacts cardiovasculaires plus significatifs que l’acide linolénique (98-100). Les mécanismes par lesquels les oméga-3 peuvent réduire le risque de mortalité par cause cardiovasculaire sont nombreux. Parmi ceux-ci, notons la diminution des concentrations sanguines de TG et l’inhibition de la synthèse endogène de ceux-ci, la
19
réduction des niveaux d’eicosanoïdes et d’autres marqueurs impliqués dans les différentes voies de l’inflammation, et l’inhibition de l’agrégation plaquettaire impliquée dans le développement de l’athérosclérose, via l’accumulation de plaquettes sanguines (101-103). Finalement, les études ayant documenté la consommation d’AGPI en lien avec le risque cardiovasculaire devraient autant considérer le ratio d’oméga-3/oméga-6 dans la diète que les différentes sources d’oméga-3, soit végétales et marines, puisque leurs rôles semblent être différents sur les facteurs de risque cardiométabolique (97).
2.2.4- Acides gras saturés
Les AGS sont composés d’atomes de carbones et d’hydrogènes tout comme les autres acides gras, mais la principale différence est que ces groupes hydrocarbonés sont reliés entre eux par des liaisons simples, les rendant ainsi plus stables à la chaleur. Les principales sources alimentaires d’AGS sont les produits d’origine animale tels que les produits laitiers (lait entier, crème, beurre, fromage, crème glacée), les viandes de bœuf et de porc ainsi que plusieurs produits transformés. Quelques aliments de source végétale offrent également une quantité appréciable d’AGS, comme l’huile de coco, l’huile de palme et les produits transformés faits à partir de ces huiles végétales (28). Il a été démontré il y après d’un demi-siècle, que la consommation d’AGS augmentait le risque de développer une MCV. Dans les années 50, l’équipe du chercheur Ancel Keys a conçu l’étude des sept pays (77) dans le but de répondre à des questions sociétales mettant en lien les différents modes de vie et patrons alimentaires de plusieurs pays et le risque cardiovasculaire. Les chercheurs ont émis l’hypothèse que les différences populationnelles dans la fréquence de maladies coronariennes sont en relation avec le mode de vie, spécifiquement de la composition de la diète incluant la consommation d’acides gras, et les caractéristiques physiques telles que les niveaux de cholestérol sanguin. Cette étude prospective a permis de démontrer que sur quinze années, les populations vivant dans les régions méditerranéennes et caractérisées par une consommation d’AGS inférieure à 7% de l’apport énergétique total, montraient les plus faibles taux de maladies coronariennes de l’ensemble des sept pays étudiés (104). Bien que cette étude ait été critiquée par d’autres scientifiques, Ancel Keys fait partie des pionniers à avoir établi le lien entre l’alimentation et la santé cardiovasculaire. De plus, l’étude des sept pays constitue une introduction à de nombreuses études réalisées par plusieurs autres chercheurs au cours des années suivantes, sur le sujet des AGS. Le lien entre la consommation d’AGS et les MCV est
20
toutefois devenu controversé dans la littérature au cours des décennies qui ont suivi la publication de l’étude des sept pays.
Il est bien connu que la consommation d’AGS a une influence sur différents marqueurs de risque cardiovasculaire. À ce sujet, une méta-analyse d’études cliniques randomisées contrôlées a démontré qu’une substitution de 5% des calories totales sous forme de glucides par 5% des calories provenant d’AGS pouvait augmenter les concentrations plasmatiques de C-LDL de 5% (11). De plus, le remplacement des glucides par des AGS mène à une augmentation dans les taux de C-HDL, laissant ainsi le ratio cholestérol total/C-HDL neutre. Bien que les AGS augmentent les concentrations de C-LDL (11, 105), il semble injuste d’affirmer que la consommation d’AGS soit directement liée à une augmentation du risque cardiovasculaire, en se basant uniquement sur des études prospectives. En effet, un groupe de chercheurs a effectué une méta-analyse de 21 études prospectives incluant près de 350 000 sujets, dans le but de vérifier les associations entre la consommation d’AGS et le risque de maladies coronariennes, d’AVC et de MCV. Les analyses ont permis de démontrer qu’il n’y avait à l’heure actuelle, pas d’évidence suffisante pour conclure que la consommation d’AGS était associée à un risque augmenté de maladie coronarienne ou de MCV, incluant les AVC (106). Cette méta-analyse de Siri-Tarino et collaborateurs a toutefois été critiquée, jugeant que les interprétations des résultats sont exagérées et que des lacunes méthodologiques auraient possiblement été incluses dans l’étude (107). Selon Scarborough et collaborateurs (107), l’ajustement statistique pour les concentrations sériques de cholestérol total, effectué dans près de la moitié des études incluses dans la méta-analyse de Siri-Tarino et collaborateurs, masque l’effet de la consommation d’AGS sur les marqueurs de santé étudiés. Toujours selon ce groupe de chercheurs européens, ce biais aurait inévitablement dû être discuté et mentionné comme une faiblesse potentielle de l’étude.
Plus récemment, les résultats d’une méta-analyse d’études randomisées contrôlées publiée dans The Cochrane Library, ont suggéré que la réduction d’AGS dans la diète pouvait diminuer le risque d’événements cardiovasculaires de 17% (15). Toutefois, cette même étude considérant plus de 50 000 hommes et femmes ne permet pas d’identifier la consommation d’AGS comme partie intégrante du risque de mortalité toutes causes confondues, et par cause cardiovasculaire. Puisque les lignes directrices qui visent la santé cardiovasculaire suggèrent des modifications dans la consommation du type d’acides gras, une revue systématique et méta-analyse incluant 45 études prospectives et 27 études
21
randomisées contrôlées a été menée par Chowdury et ses collègues (108). Le but était de clarifier les évidences de l’association entre les acides gras et les maladies coronariennes. Sur un regroupement de plus de 275 000 participants de toutes les études incluses dans la méta-analyse, le risque de développer une maladie coronarienne fut augmenté non significativement de 3% dans le troisième tiers de consommation d’AGS en comparaison avec le premier tiers.
Peu d’études ont évalué l’association entre la consommation d’AGS et les marqueurs de risque non-lipidiques. Néanmoins, Rasmussen et collaborateurs (109) ont démontré par le biais d’une étude randomisée contrôlée que la consommation d’AGS n’avait pas d’impact sur la tension artérielle. Récemment, une revue de littérature traitant de la relation entre les AGS et l’inflammation a été publiée, dans le but de fournir un résumé des données et des observations en lien avec la consommation d’AGS et les mécanismes responsables de l’inflammation chronique de faible intensité. La conclusion des auteurs indique que c’est l’interaction entre plusieurs habitudes de vie qui détermine si la consommation d’AGS contribue au développement de l’inflammation de faible intensité (110). Autrement dit, ces scientifiques suggèrent que ce soit un ensemble de déterminants qui dictent le risque de MCV, et non un facteur à lui seul. Ils recommandent également que les lignes directrices pour la prévention des MCV reconsidèrent les recommandations en lien avec la réduction d’AGS dans la diète et priorisent une approche moins réductionniste, qui engloberait ainsi les habitudes de vie et non seulement les habitudes alimentaires (110).
En résumé, l’élévation du C-LDL engendrée par la consommation d’AGS semble actuellement être le seul facteur considéré comme probant dans les recommandations visant à diminuer la consommation d’AGS et/ou à les remplacer par d’autres types de lipides reconnus comme étant plus bénéfiques pour la santé cardiovasculaire. C’est d’ailleurs dans ce contexte que les recommandations pour la prévention des MCV suggèrent actuellement le remplacement des AGS dans la diète par des AGPI et des AGMI.
3- Impact de la source d’acide gras saturé et la matrice alimentaire sur
la santé cardiométabolique
Tel que mentionné précédemment, les recommandations générales en lien avec la diminution des AGS dans la diète pour la prévention de MCV sont remises en doute. Dans les dernières décennies, des auteurs d’études épidémiologiques ont étudié l’impact de la source d’AGS sur la santé cardiovasculaire et ils ont découvert que ce ne sont pas tous les
22
types d’AGS qui ont la même association avec le risque de MCV. Par exemple, Hu et collaborateurs (111) ont mené une étude prospective sur 14 ans, ayant pour objectif d’examiner les associations entre les apports de différents types d’acides gras en fonction de leur source, et le risque de maladie coronarienne. Plus de 80 000 femmes de la grande étude de cohorte Nurses’ Health Study ont été incluses dans les analyses. Les auteurs ont ainsi pu démontrer que les apports en AGS à courtes et moyennes chaînes n’étaient pas significativement associés au risque de maladie coronarienne alors que les apports en AGS à chaînes longues étaient associés avec une augmentation du risque. Dans le même ordre d’idées, des auteurs d’une étude prospective ont voulu comprendre comment les différentes sources d’AGS pouvaient influencer les relations avec les événements cardiovasculaires. Après un suivi sur 10 ans, un modèle statistique de régression logistique basé sur les données de plus de 5 000 hommes et femmes, a indiqué que chaque augmentation de 5% de l’énergie sous forme d’AGS laitiers était associée à une diminution du risque de MCV de 38%. À l’inverse, chaque augmentation de 5% de l’énergie sous forme d’AGS de la viande était associée à une augmentation de 48% du risque de développer une MCV (17). Finalement, O’Sullivan et collaborateurs (112) ont méta-analysé 26 études prospectives publiées entre 1952 et 2012, en ayant pour objectif de déterminer la relation entre plusieurs groupes alimentaires riches en AGS et la mortalité chez plus de 1,8 million d’adultes en santé. Les consommations élevées de viande, de lait, de fromage ou de tout autre produit laitier n’ont pas pu être associées à la mortalité cardiovasculaire. Au contraire, la consommation de viandes transformées telles que les saucisses, le jambon, les viandes froides, les viandes séchées et les sauces à la viande prêt-à-manger, ont significativement été associées à une augmentation du risque de mortalité cardiovasculaire de 17%.
Les effets de la source d’AGS sur les marqueurs de risque cardiovasculaire ont également été étudiés par l’entremise d’études cliniques randomisées. Par exemple, une équipe de chercheurs du Danemark a démontré dans une étude où la diète était entièrement contrôlée, que la consommation d’une diète riche en AGS provenant de fromage (environ 125 g/2500 kcal) menait à une augmentation de 5% de C-HDL en comparaison avec une diète faible en lipides et riche en glucides. Dans le même sens, une diète riche en AGS provenant de la viande menait également à une augmentation de 8% de C-HDL comparativement à la diète riche en glucides. Toutefois, aucun effet de la source d’AGS n’a été perçu entre le fromage et la viande, pour la même quantité d’AGS (113). En raison de la discordance entre les résultats d’études épidémiologiques et du manque d’études cliniques sur le sujet, le rôle de
23
la source d’AGS sur le risque de MCV doit être investigué davantage, notamment par le biais d’études cliniques randomisées contrôlées.
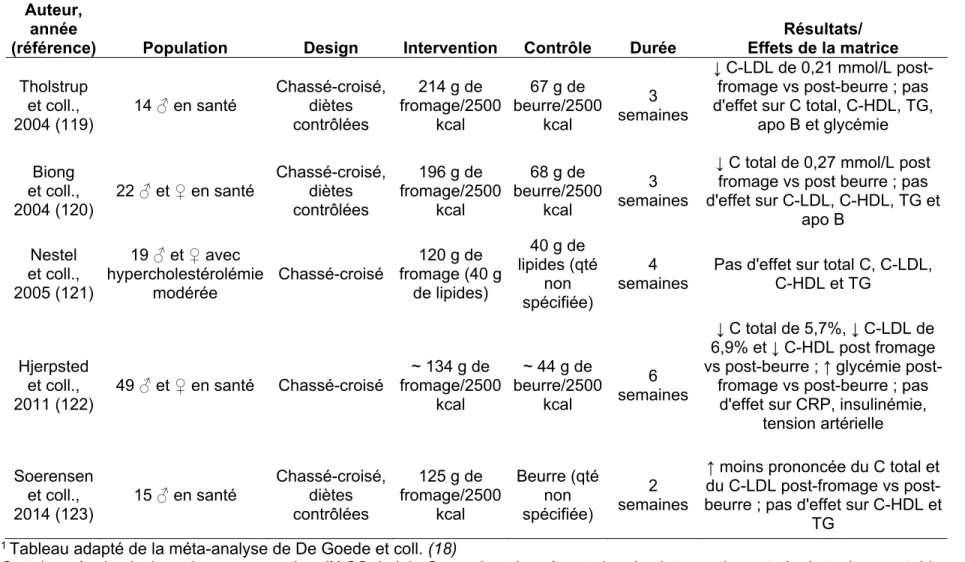
D’autres chercheurs se sont davantage intéressés à l’impact de la matrice alimentaire de certains aliments riches en AGS sur les MCV. Puisque les produits laitiers représentent une source majeure d’AGS dans la diète occidentale, différentes études, bien que peu nombreuses, ont mesuré l’effet de différentes sources de produits laitiers, spécifiquement le fromage et le beurre, sur différents marqueurs de risque cardiovasculaire (19). Le beurre et le fromage contiennent principalement des acides gras à chaîne longue (l’acide palmitique 16:0 et l’acide stéarique 18:0). Le beurre sans sel contient approximativement 80% de lipides (114) alors que le gras du fromage quant à lui, est encapsulé dans une matrice comprenant à la fois des protéines sous forme de caséine et du calcium (115). Le fromage est également une bonne source de vitamines A, B2 et B12 et de phosphore, contrairement au beurre qui est constitué de gras, d’eau et de quelques traces de solides du lait (116). Il a été proposé que le fromage par rapport au beurre pouvait diminuer le cholestérol sanguin grâce à son contenu en calcium, qui aurait la capacité de se lier aux acides gras dans l’intestin pour former des composés insolubles, et ainsi limiter l’absorption intestinale de lipides et en augmenter l’excrétion fécale (117). De plus, certains fromages sont fabriqués à partir d’un procédé appelé fermentation. Il a été démontré que la consommation de produits laitiers fermentés augmentait le contenu en bactéries dans l’intestin. Par la suite, les bactéries fermentent les glucides non digestibles, ce qui augmenterait la production d’acides gras à chaînes courtes, qui pourrait mener à une diminution des concentrations de cholestérol sanguin, entre autres par un mécanisme d’inhibition de la synthèse hépatique de cholestérol (118). En se basant sur ces hypothèses, 5 groupes de chercheurs ont étudié l’effet du fromage en comparaison avec le beurre, afin de mieux déterminer l’impact de la matrice alimentaire laitière sur certains facteurs de risque cardiométabolique. Le tableau 3 résume les principales caractéristiques de ces 5 études cliniques. En 2004, Tholstrup et collaborateurs (119) ont mené une étude en chassé-croisé, où l’objectif était de comparer les effets de diètes isoénergétiques riches en lait, fromage et beurre, sur les niveaux à jeun et postprandiaux de lipides sanguins, lipoprotéines, glucose et sur la réponse insulinémique. Les analyses sanguines en post traitement ont démontré que les concentrations sanguines de C-LDL étaient significativement plus élevées après la diète beurre qu’après la diète fromage. De plus, le cholestérol total tendait vers une plus haute augmentation après la diète riche en beurre, en comparaison à la diète fromage
24
(p=0.054). Dans la même année, un autre groupe de chercheurs a publié un article résumant les résultats de leur étude sur une population d’hommes et femmes en santé. Ils ont démontré que la consommation de près de 200 g de fromage quotidiennement durant 3 semaines diminuait le cholestérol total de 0,23 mmol/L en comparaison avec la consommation de beurre et ce, pour la même quantité d’AGS (120). Dans un contexte d’alimentation riche en lipides et en AGS, soit en moyenne 36,8% et 17,0% de l’énergie totale respectivement, Nestel et collaborateurs (121) ont évalué si le gras laitier du fromage augmentait le C-LDL autant que celui du beurre. Ils ont fourni à des sujets souffrant d’hypercholestérolémie modérée, définie par un cholestérol total moyen de 5,6 mmol/L, 40 g de lipides sous forme de beurre ou de fromage, pour une durée de 4 semaines par intervention. Deux semaines avant et entre les interventions, les participants devaient se soumettre à une diète faible en lipides et riche en glucides, en fonction des recommandations enseignées. Durant les phases d’intervention, les participants devaient compléter leur diète par eux-mêmes, avec des aliments au choix à travers une liste proposée pour différents groupes alimentaires. Cette intervention a permis de démontrer qu’en comparaison avec la diète faible en lipides, 40 g de lipides provenant du fromage menait à une moins grande augmentation de C-LDL en comparaison avec une consommation de 40 g de lipides sous forme de beurre. De plus, le beurre tendait à être plus hypercholestérolémiant par rapport au fromage, bien que cet effet n’ait pas été significatif. Toujours dans un contexte d’étude clinique randomisée en chassé-croisé, des chercheurs ont comparé l’effet d’un apport élevé en lipides provenant du fromage ou du beurre sur la tension artérielle, les concentrations plasmatiques de lipides, la protéine C réactive, l’insuline et le glucose sanguin (122). Les 49 hommes et femmes en santé devaient s’abstenir de consommer d’autres produits laitiers que ceux fournis durant l’étude et ce, durant les deux phases de 6 semaines d’intervention. Au niveau des lipides plasmatiques, la consommation quotidienne d’environ 135 g de fromage a diminué le cholestérol total de 5,7% et le C-LDL de 6,9% en comparaison avec une consommation d’environ 45 g de beurre par jour. Les concentrations sanguines de C-HDL ont également été diminuées après la consommation de fromage comparativement au beurre (p<0.005). Les auteurs ont été surpris de noter que la glycémie à jeun était plus élevée après une diète riche en fromage comparativement à une diète riche en beurre, sans y trouver d’explication. Finalement, aucun effet de la matrice laitière n’a été remarqué pour le CRP, la tension artérielle et l’insuline (122). L’étude la plus récente ayant investigué l’impact de la matrice laitière sur les facteurs de risque cardiovasculaires date de 2014. L’objectif principal de l’étude de