Profil en acides aminés des protéines microbiennes
chez le bovin laitier
Mémoire
Michaël Sok
Maîtrise en sciences animales
Maître ès sciences (M. Sc.)
Québec, Canada
Profil en acides aminés des protéines microbiennes
chez le bovin laitier
Mémoire
Michaël Sok
Sous la direction de :
Doris Pellerin, directeur de recherche
Hélène Lapierre, codirectrice de recherche
iii
Résumé
Une des références les plus utilisées dans l’évaluation de la composition en acides aminés (AA) du flux de protéines microbiennes (MCP) du duodénum nous provient de Clark et al. (1992, JDS : 2304). Néanmoins, cette référence comporte uniquement la composition en AA des bactéries associées à la phase liquide (BAL) du rumen, dont 7 des 18 études présentées ont été réalisées chez le mouton. Le présent travail propose d’investiguer plus en détails les protéines microbiennes, incluant les bactéries associées à la phase solide (BAS) et les protozoaires chez le bovin laitier. En effet, il a été démontré que moins de 40 % de la MCP duodénale pouvait provenir des BAL et que la composition en AA des BAS et des protozoaires diffère de celle des BAL (Jouany, 1996). Les objectifs sont dès lors de :
Effectuer une mise à jour de la composition en AA des bactéries du rumen ; Ajouter à la base de données les compositions en AA des protozoaires du rumen ; Mettre en lumière les différences de composition en AA des protozoaires et des
différents types de bactéries.
Sur base de recherches préliminaires et d’une révision approfondie de la littérature scientifique traitant du présent sujet, 26 publications ont été sélectionnées afin de construire une base de données repertoriant les bactéries plus 10 publications concernant les protozoaires. Les valeurs rapportées pour les bactéries ont été réparties selon le type de bactéries, soit les BAL ou les BAS. La composition en AA des bactéries et des protozoaires a été comparée par une analyse de variance incluant l'effet du type de microorganisme en utilisant les contrastes orthogonaux suivant :
1) bactéries vs protozoaires, 2) BAL vs BAS.
Les résultats obtenus ont été analysés et plusieurs conclusions ont pu être tirées. Notamment, en ce qui concerne le rapport entre la composition en AA essentiels des bactéries et celle des protozoaires. Le Trp (1,76 g/100 g AA) a montré le rapport le plus élevé
iv
tandis que la Lys (0,78 g/100 g AA) a montré le plus faible. Ces données suggèrent une importance particulière dans l’identification de la présence de protozoaires dans le flux de protéines duodénales afin de prédire correctement le flux duodénal en AA. En effet, l’inclusion des protozoaires dans le flux duodénal de MCP apporte une variation de plus de 4% dans l’estimation de ce flux pour tous les AA sauf pour Arg et Leu, comparativement à l’utilisation de la composition des bactéries rapportée par Clark et al. (1992, JDS: 2304).
v
Abstract
One of the most used references in the evaluation of the amino acid composition (AA) of the duodenum microbial protein (MCP) flow is from Clark et al. (1992, JDS : 2304). Nevertheless, this reference only includes the AA composition of the bacteria associated with the liquid phase (BAL) of the rumen, of which 7 of the 18 studies presented were carried out in sheep. The present work proposes to investigate in more detail microbial protein, including bacteria associated with the solid phase (BAS) and protozoa in dairy cattle. It has been shown that less that 40 % of duodenal MCP can be derived from BAL (Jouany, 1996). The objectives are therefore :
Updating the AA composition of rumen bacteria ;
Add to the database the AA composition of the rumen protozoa ;
Highlight differences in the composition of protozoa and different types of bacteria in AA.
Based on preliminary research and a thorough review of the scientific literature on the subject, 26 publications were selected to construct a database of bacteria plus 10 publications on protozoa. The values reported for the bacteria were distributed according to the type of bacteria, i.e. BAL or BAS. The AA composition of bacteria and protozoa was compared by an analysis of variance including the effect of the microorganism type using the following orthogonal contrasts:
1) Bacteria vs protozoa, 2) BAL vs BAS.
The results obtained were analyzed and several conclusions were drawn. In particular, as regards to the ratio between the essential AA composition of bacteria and that of protozoa. Trp (1.76 g/100g AA) showed the highest ration while Lys (0.78 g/100 g AA) showed the lowest. These data suggest a particular importance in the identification of the presence of protozoa in the duodenal protein flow in order to correctly predict the duodenal flow in AA.
vi
Indeed, the inclusion of protozoa in the duodenal MCP flow contributes a variation of more than 4 % in the estimation of this flow for all AA except for Arg and Leu, compared to the use of the composition of the bacteria reported by Clark et al. (1992, JDS: 2304)
vii
Table des matières
Résumé ... iii
Abstract ...v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations ... xi
Remerciements ... xii
Avant-propos ... xiii
Chapitre I : Introduction ... 14
Chapitre II : Revue des travaux antérieurs ... 16
2.1 Sources de protéines digérées ... 16
2.1.1 Protéines alimentaires ... 16 2.1.2 Sécrétions endogènes ... 17 2.1.3 Protéines microbiennes (MCP) ... 18 2.2. La microflore du rumen ... 19 2.2.1 Bactéries ... 19 2.2.2 Les protozoaires ... 22 2.2.3 Les mycètes ... 23
2.2.4 Les méthodes d’isolation des différents microorganismes du rumen ... 23
2.3. Le métabolisme de l’azote dans le rumen. ... 24
2.3.1 Dégradation des protéines dans le rumen ... 24
2.3.2 Contribution de l’urée et des sécrétions endogènes ... 26
2.3.3 Synthèse protéique microbienne ... 27
2.4. Prédiction de la synthèse microbienne et de son apport en AA ... 30
2.4.1 Modèle du « National Research Council » (2001) ... 30
2.4.2 Le modèle « Cornell Net Carbohydrate and Protein System » (CNCPS) ... 31
2.4.3 Le modèle INRAtion ... 31
2.4.4 Le modèle “Nordic Feed Evaluation System” (NorFor)... 32
2.4.5 Composition en AA proposée par Clark (1992) ... 33
viii
Références de la revue littérature et de l’introduction ... 36
Chapitre III : AMINO ACID IN RUMEN BACTERIA AND PROTOZOA ... 43
3.1 ABSTRACT ... 44
3.2 INTRODUCTION ... 45
3.3 MATERIALS AND METHODS ... 46
3.4 RESULTS AND DISCUSSION... 48
3.5 CONCLUSION ... 53
3.6 REFERENCES ... 54
ix
Liste des tableaux
Tableau 1: Composition en AA (en % en protéines brutes) des fractions protéiques des bactéries du rumen selon le CNCPS ... 31 Tableau 2: Composition d’AA (g / 100 d’AA) des protozoaires, des bactéries associées à la phase liquide (BAL) et des bactéries associées aux particules (BAP) ... 33 Tableau 3: Composition en AA de bactéries selon Clark et al. (1992) ... 34 Tableau 4 Number of values available and used from original publications, and the number of data excluded for each AA ... 58 Tableau 5: Variation in AA composition of rumen bacteria and protozoa (g AA/100 g AA) in cattle60 Tableau 6: AA composition of rumen bacteria and protozoa (g AA/100 g AA) in cattle ... 61 Tableau 7: Comparison of microbial protein AA composition obtained in the current study with basic references. ... 62
x
Liste des figures
Figure 1: Protéines alimentaires au sein du rumen.. ... 21
Figure 2: Dégradation des composés azotés dans le rumen.. ... 25
Figure 3: Schéma des sources d’N au rumen et au duodénum.. ... 26
Figure 4: Cycle de l’urée à l’aide d’isotopes de l’azote.. ... 27
xi
Liste des abréviations
AA : acides aminés
AANE : acides aminés non essentiels
Ala : alanine Arg : arginine Asp : asparagine Cys : cystéine Gln : glutamine Glu : glutamate Gly : glycine
PDR :protéine dégradable du rumen
Phe : phénylalanine
PNDR : protéine non-dégradable du rumen
Pro : proline
Ser : sérine
Thr : thréonine
Tyr : tyrosine
UNT : unités nutritives totales
Val : valine His : histidine Iso : isoleucine Leu : leucine Lys : lysine MCP : protéine microbienne Met : méthionineµ PB : protéine brute
xii
Remerciements
Tout d’abord, je remercie monsieur Doris Pellerin, mon directeur de maîtrise à l’Université Laval pour son encadrement et ses conseils.
Ensuite je tiens à remercier madame Hélène Lapierre, ma co-directrice de recherche qui m’a proposé cette maîtrise suite à un stage dans son laboratoire. Elle m’a permis de découvrir le monde de la recherche et de m’y épanouir. J’ai toujours été impressionné par son implication dans chacun de ses projets. Malgré son emploi du temps très chargé, elle a toujours pris le temps de partager son savoir, toujours d’une façon très pédagogique. Je vous remercie madame Lapierre pour votre aide lors de la rédaction de ce mémoire.
Je remercie également monsieur Daniel Ouellet pour ses corrections apportées à l’article ainsi que son aide lors de la période d’échantillonnage. Je tiens à souligner sa sympathie surtout lors du symposium.
Mes remerciements vont aussi à monsieur Mario Léonard, qui a élaboré d’astucieux matériels pour l’isolation des protozoaires, pour les heures passées lors d’échantillonnage à l’étable. Et surtout, merci pour ta sympathie et ta bonne humeur durant ces 2 années.
Je remercie également toute l’équipe de recherche et particulièrement madame Sylvie Dallaire qui a effectué les différentes hydrolyses.
Enfin, je remercie mes parents pour les encouragements malgré la distance. Ainsi que Richard et Claudia pour leur support.
xiii
Avant-propos
Ce mémoire est constitué de trois parties distinctes. La première partie introduit brièvement le contexte de cette étude. Elle est suivie d’un état de l’art reprenant les différentes informations reprises dans la littérature sur lesquelles s’appuie ce travail. Enfin, les résultats obtenus sont présentés sous forme d’article portant le titre « Amino acid composition of rumen bacteria and protozoa in cattle » accepté au « Journal of Dairy Science » et dont les auteurs sont les suivants : Sok, M., D. R. Ouellet, J. L. Firkins, D. Pellerin et H. Lapierre.
14
Chapitre I : Introduction
Les protéines sont composées de blocs appelés acides aminés (AA). Au total, il y a 20 AA qui sont utilisés par l’organisme animal pour fabriquer toutes les protéines dont le corps a besoin. Certains sont qualifiés d’essentiels, car l’animal ne peut pas les synthétiser, d’autres de semi-essentiels, car l’animal peut les synthétiser mais en quantité insuffisante pour maximiser les performances, tandis que d’autres sont désignés comme non-essentiels, car l’animal peut les fabriquer (D’Mello, 2003). Comme l’animal n’est pas capable de synthétiser les AA essentiels, ils doivent être apportés par l’alimentation. Chez les monogastriques, comme les porcs, les AA absorbés proviennent directement de la digestion de la protéine alimentaire, et correspondent donc à ce qui est donné dans leur ration. Par contre, pour les ruminants c’est une tout autre affaire. En effet, la microflore présente dans cet immense fermenteur qu’est le rumen est capable de dégrader les protéines ingérées et même ses blocs constituants, les AA, et de reformer ses propres protéines qui seront par la suite digérées (Firkins, 1996). Cette caractéristique en fait un avantage très important pour l’agriculture, car elle permet d’alimenter les ruminants avec des aliments riches en fibres, tels que les fourrages, non-comestibles et donc non-utilisés pour l’alimentation humaine. Cependant un défi est présent, car l’agriculteur est soucieux de savoir comment optimiser ce magnifique métabolisme. En effet le niveau de complexité de l’écosystème ruminal a exigé le développement de modèles afin de prédire l’impact de la microflore ruminale sur les apports en protéines et en énergie. De nombreux modèles ont ainsi été réalisés, par exemple il y a des modèles américains [NRC, 2001; CNCPS (Fox et al., 2004)], français [INRAtion, 1987 et Systali (Sauvant et al., 2013 et 2015)] et scandinaves [Norfor, 2011]. Chacun de ces modèles a pour même but d’optimiser les rations laitières, c’est-à-dire d’évaluer les apports par la ration afin de combler les besoins des animaux. L’équilibre des rations pour les protéines et les AA aura un impact non seulement au niveau des coûts de production, mais aussi au niveau écologique, car un meilleur équilibre des apports en l’azote (N) diminuera les rejets azotés (Lapierre et al., 2014).
15
La capacité du ruminant à pouvoir utiliser une source d’azote ingéré sous forme protéique ou non-protéique est liée directement à la flore microbienne présente dans le rumen. Suite à la fermentation qui se déroule dans le rumen, trois différentes fractions protéiques arrivent au duodénum : la protéine alimentaire qui n’a pas été dégradée par la microflore ruminale, la protéine endogène (secrétée par l’animal lui-même) et la protéine microbienne, qui représente généralement plus de 50% de l’apport protéique (Clark et al., 1992). La synthèse des protéines dans le rumen est influencée par des facteurs importants qui ont été étudiés in vitro (Satter et Slyter, 1974), mais qui ont aussi été reliés à l’efficacité de la synthèse microbienne mesurée in vivo (Nocek et Russell, 1988). Il est donc très important de bien caractériser cette fraction. Dans le cadre de ce mémoire, nous allons nous pencher sur la compréhension des apports en protéines et en AA, plus particulièrement sur l’apport provenant de la synthèse microbienne.
16
Chapitre II : Revue des travaux antérieurs
La première partie de la revue littérature est consacrée à l’apport protéique chez le ruminant, plus particulièrement le bovin laitier en discutant des différentes fractions protéiques arrivant au duodénum, après le passage au rumen, qui seront digérées dans le petit intestin. La deuxième partie se penchera sur l’importance de la protéine microbienne dans cet apport. Ensuite, je discuterai du profil en AA des bactéries et des protozoaires pour enfin terminer sur les différentes techniques d’isolation des bactéries et protozoaires.
2.1 Sources de protéines digérées
Les nutriments absorbés proviennent de la fermentation et la digestion dans le tractus gastro-intestinal (D’Mello, 2003). Le bovin laitier possède une grande cuve de fermentation appelée le rumen, grâce auquel il est capable d’utiliser des aliments riches en cellulose à contrario des monogastriques. En effet, les micro-organismes présents dans le rumen peuvent dégrader les fibres et certaines protéines alimentaires (Wattiaux et Howard, 2000). Trois fractions contribuent donc à la protéine arrivant au duodénum qui sera digérée dans le petit intestin. Chaque fraction a une composition en AA bien différente (Lapierre et al., 2006). Il est donc essentiel de déterminer la provenance des protéines au niveau du duodénum. En effet, leur origine a un impact sur l’aspect quantitatif de l’apport net en AA à l’animal.
2.1.1 Protéines alimentaires
Une partie des protéines alimentaires échappe à la dégradation ruminale et se retrouve non dégradée dans le petit intestin. Dépendant de la nature de la protéine, sa résistance à la dégradation ruminale va varier. En suivant les lignes directrices chez le bovin de boucherie du NRC (2016), des aliments tels que les fourrages présentent 60 à 80 % de dégradation de leur protéine versus 20 à 60 % pour les concentrés. L’estimation de la proportion de la protéine non dégradée dans le rumen (PNDR), équivalent du rumen undegradable protein (RUP) en anglais, varie selon les modèles d’alimentation et est évaluée selon des fractions déterminées à partir d’incubation in situ dans le rumen [e.g. fractions a, b et c : NRC (2001)] ou de solubilité dans des
17
tampons standardisés [e.g. fractions a1, a2, b1, b2, b3 et c : CNCPS, Fox et al. (2004)]. D’autres facteurs vont aussi affecter la proportion de protéine alimentaire qui échappera à la dégradation ruminale (NRC, 2001).
Des procédés technologiques sont parfois utilisés afin de protéger les protéines alimentaires de la dégradation des microorganismes du rumen et ainsi augmenter la fraction de la PNDR. Par exemple, plusieurs études ont évalué l’effet de traitements visant à diminuer la dégradabilité de la protéine du complément protéique le plus utilisé en production laitière, le tourteau de soya (Borucki Casto et al., 2007). Ainsi cet aliment fort utilisé peut être traité de différentes façons afin d’optimiser la proportion de PNDR. Dans le commerce, différentes sources sont disponibles et faciles à implémenter dans l’alimentation du bovin laitier (Borucki Casto et al., 2007). Il est important de noter qu’une revue de littérature a démontré qu’il ne fallait pas à tout prix tenter d’augmenter la PNDR, surtout si on le fait au détriment de la protéine microbienne (Santos et al., 1998) dont je discuterai dans la section suivante.
La composition en AA de la fraction PNDR serait un peu différente de la composition de la protéine alimentaire (Maxin et al., 2013). Cependant comme les références sur la composition des AA des fractions PNDR sont très limitées comparativement à celles sur la composition en AA des aliments, la composition des aliments est habituellement utilisée dans les modèles pour estimer la contribution du PNDR à l’apport en AA au flux duodénal (NRC, 2001; van Amburgh et al., 2015).
2.1.2 Sécrétions endogènes
Les sécrétions endogènes d’N sont des protéines qui proviennent de l’animal lui-même et qui sont relâchées dans le système digestif. Ces protéines comprennent principalement la salive, les sécrétions gastriques et pancréatiques, la bile et les cellules desquamées du système digestif, c’est–à-dire des cellules des muqueuses entraînées par l’abrasion du digesta (Tamminga et al., 1995). À cause de difficultés techniques, peu d’études ont estimé cette contribution au flux duodénal. Ouellet et al. (2002, 2010) rapportent que la contribution des sécrétions endogènes
18
d’N arrivant au duodénum représenterait entre 15 et 20 % du flux de N au duodénum. Ces mêmes chercheurs, en utilisant la technique de dilution de 15N, ont montré que la contribution des sécrétions endogènes est aussi une source importante d’N pour la synthèse protéique des bactéries ruminales (Ouellet et al., 2002).
Les sécrétions endogènes ne constituent pas un apport protéique net à l’animal. En effet, les sécrétions proviendraient d’un recyclage des AA qui ont été précédemment absorbés et qui sont apportés au système digestif via la circulation artérielle (Lapierre et al., 2016). Le NRC (2001) présente une valeur du flux duodénal qui s’élève à 1.9 g N/kg de matière sèche ingérée.
2.1.3 Protéines microbiennes (MCP)
Les protéines microbiennes (provenant de la croissance des microorganismes dans le rumen) se retrouvent habituellement dans une proportion supérieure à 50 % du flux protéique duodénal (Clark et al., 1992). Il est donc important de maximiser cette fraction, car elle n’est pas coûteuse à produire (St-Pierre et Glamocic, 2000) offrant la possibilité pour le producteur d’amoindrir ses coûts de production, surtout que cette protéine présente un bon profil en AA (NRC, 2001). Le profil en AA des protéines microbiennes est considéré comme constant, malgré quelques études qui mettent en avant un possible changement de profil en relation avec la ration donnée à l’animal (Volden et Harstad, 1998). Les protéines microbiennes étant le thème principal de ce mémoire, cette fraction est discutée plus en détail dans l’une des sections suivantes.
19
2.2. La microflore du rumen
L’atmosphère du rumen est composée d’un mélange de gaz de CO2 (65%) et de méthane (35%); il y un équilibre entre la phase gazeuse du CO2 et le bicarbonate de la salive (Jouany et al., 1994). Ce type d’atmosphère est un endroit idéal pour la prolifération d’une population microbienne en anaérobie. Bien que le terme générique « protéines microbiennes » soit utilisé sans regard au type de microorganismes dont elles sont issues, la population microbienne du rumen est très diversifiée (Dehority, 2003). Les protistes, microorganismes généralement unicellulaires, constituent la microflore du rumen. Les protistes sont divisés en eucaryotes et procaryotes.
Les eucaryotes comprennent les algues, les mycètes et les protozoaires. Les procaryotes comprennent les bactéries et les algues bleues. Cette flore microbienne dégrade approximativement 66% de la matière sèche digestible par l’animal (Hristov et al., 2004).
Plusieurs conditions dans le rumen sont nécessaires afin d’avoir un milieu favorable au développement de cette microflore :
- un milieu anaérobie (sans oxygène), avec présence de CO2 ; - un apport et un brassage continuel du contenu du rumen ; - une température constante entre 38 et 41°C ;
- un pH du contenu ruminal variant au maximum entre 5,5 et 7 ;
2.2.1 Bactéries
Chez le nouveau-né ruminant, l’animal possèderait un pré-rumen, c’est-à-dire un rumen qui ne serait pas encore développé. En effet, le pré-rumen du veau quand l’animal ne consomme que du lait, est très différent de celui du bovin laitier mature (Anderson et al., 1987). À partir du moment où le veau ingère du matériel solide, des micro-organismes, incluant des bactéries, entrent dans le rumen par le biais de la salive provenant de la mère, lors du moment où elle lèche le jeune veau au niveau du museau, et par contact avec l’environnement (Fonty et al., 1991). Ainsi, profitant de ce changement d’alimentation qui amène des substrats à fermenter au rumen,
20
il y a prolifération de micro-organismes. La concentration moyenne en bactéries dans le rumen s’élèvent à 1011 cellules par millilitre (Martin, 1994).
Il existe plusieurs types de bactéries, et une classification en fonction de leur paroi (gram positif ou gram négatif). Cependant dans le rumen selon Hungate (1966), il est préférable de les classer selon les substrats qu’elles dégradent et leurs produits finaux. En voici quelques exemples.
- Les bactéries cellulolytiques, par exemple, Bacteroides succinogenes et Ruminococcus
flavefaciens. Elles produisent des cellulases, enzymes qui hydrolysent les liaisons β 1-4
de la cellulose;
- Les bactéries hémicellulolytiques, par exemple, Bacteroides ruminocola, Treponema bryantii. Elles utilisent les pentoses comme substrat et elles dégradent la cellulose ainsi
que les hémicelluloses;
- Les bactéries amylolytiques, par exemple, Bacteroides amylophilus et Succinimonas
amylolytica. Elles utilisent l’amidon, le maltose et le glucose comme substrats.
- Les bactéries protéolytiques, par exemple, Streptococcus bovis et Clostridium
bifermentans. Les bactéries protéolytiques dégraderaient de l’ordre de 60 à 90 % de la
protéine brute alimentaire (Chouinard, 2015). Cependant les bactéries protéolytiques du rumen représenteraient que 12 à 38 % de la flore bactérienne. Ceci serait expliqué par le grand nombre d’espèces qui sont capables de réaliser une activité protéolytique de faible intensité (Wallace, 1996).
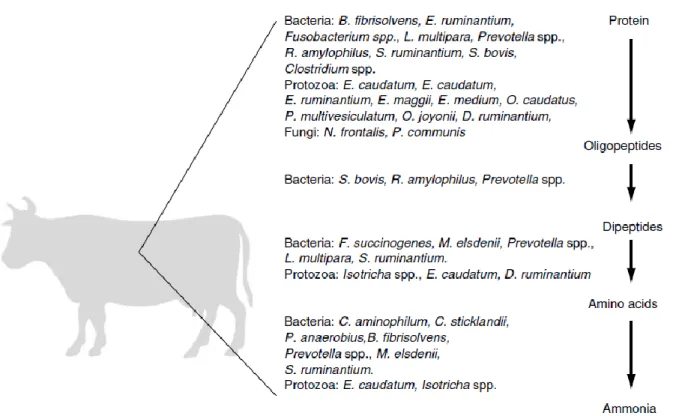
La source d’azote la plus importante pour la croissance des bactéries ruminales est l’ammoniac (Figure 1). « Dépendant de plusieurs paramètres de la ration, entre 60 à 90 % de l’azote consommé est converti en ammoniac et 50 à 70 % de l’azote bactérien proviendrait de l’ammoniac » (Mathison et Milligan, 1971; Pilgrim et al., 1971). Bryant et Robinson (1963) ont réalisé une sélection de bactéries et 92 % d’entre elles étaient capables d’utiliser l’ammoniac comme source d’azote.
21
Figure 1. Protéines alimentaires au sein du rumen. Traduite de Bryant et Robinson (1963) par Belbis (2007).
Il existe différentes populations de bactéries selon les substrats offerts. Par exemple, une alimentation riche en amidon favorise la croissance de Ruminobacter amylophilus qui fait partie des bactéries amylolytiques, et serait la population bactérienne la plus protéolytique isolée d’après Wallace et Cotta (1988). Aussi, des souches de Prevotella ruminocola auraient été obtenues lors d’une alimentation riche en fourrage et en concentrés (Wallace et Cotta, 1988). De plus, il est important de mentionner que des synergies entre les bactéries peuvent être mises en place suivant les bactéries impliquées dans la dégradation de protéines. Par exemple, certaines coopérations sont observées entre Prevotella ruminocola et Selenomonas ruminantium (Belbis, 2007).
Concernant le profil en AA des bactéries, il est plus pratique de les classer selon la fraction d’échantillonnage à laquelle elles sont associées (Broderick et Merchen, 1992) :
- Bactéries associées à la phase liquide : après échantillonnage, les bactéries provenant du liquide ruminal et qui ne sont pas accrochés à la phase solide de l’échantillon ;
22
2.2.2 Les protozoaires
Gruby et Delafond (1843) ont été les premiers à observer les protozoaires du rumen. Ils ont découvert l’importance de ces microorganismes au sein du métabolisme ruminal.
L’établissement des protozoaires dans le rumen s’effectue par contamination. En effet, les protozoaires présents dans le rumen étaient absents à la naissance. Le transfert se déroule généralement entre le jeune et sa mère par la salive et les aliments. Un jeune ruminant qui n’a jamais eu de contact avec un autre ruminant « infecté » de protozoaires, en sera exempt toute sa vie.
La concentration des protozoaires dans le rumen s’élèvent à 105 individus par ml (Towne et al., 1990).Dans le rumen, deux groupes de protozoaires sont présents : les entodiniomorphes et les holotrichs (Williams et Coleman, 1992). Les entodiniomorphes sont capables d’ingérer des particules solides telles quelles comme les grains d’amidon ou les bactéries. Par contre, les holotrichs sont capables d’utiliser des particules solubles alimentaires. Les protozoaires se nourrissent de bactéries ou de particules de la ration comme les chloroplastes afin de combler leur besoin protéique. En effet, les protozoaires sont incapables d’utiliser l’ammoniac.
Ces microorganismes ont un rôle de prédateur dans le rumen. En effet, une lyse des protozoaires mis en cultures a permis de mettre en évidence des bactéries viables dans les milieux de cultures (Gutierrez, 1958). Les protozoaires ciliés du rumen dégradent les protéines alimentaires (Kayouli et al., 1983) et réduisent l’apport de protéines microbiennes dans le duodénum du ruminant (Ushida et al., 1984). Ainsi, une défaunation des populations de protozoaires peut entraîner une diminution de la dégradation des protéines, ce qui a apporté, dans certains cas, une amélioration des performances de production (Eugène et al., 2004; Newbold et al., 2015; Kreuzer et al., 1987). Cet effet serait dû à une augmentation de la population bactérienne en l’absence de protozoaires, car avec une microflore complète, une partie des bactéries sont ingérées et digérées par les protozoaires (Williams et Coleman, 1992). Les protozoaires sont responsables d’environ 34 % de la digestion microbienne de la fibre (Lee et al., 2000).
23
2.2.3 Les mycètes
La concentration des mycètes du rumen s’élève à environ 1000 individus par ml (Williams et Withers, 1993). Dans le rumen, quatre genres de mycètes sont présent : Neocallimastix (pluri-flagellé), Piromyces, Caecomyces et Orpinomyces (uniflagellés) (Lowe et al., 1987). Ces mycètes sont capables de produire des enzymes qui sont responsables de la digestion des glucides de la paroi végétale. Les mycètes sont peu considérés et ils ont une très faible activité sur la fraction protéique (Michel et al., 1993).
2.2.4 Les méthodes d’isolation des différents microorganismes du rumen
Depuis 1973 jusqu’aujourd’hui, de nombreuses façons d’isoler les différents microorganismes du rumen ont été élaborées. Cependant les chercheurs ne disposaient pas forcément de toutes les connaissances dont l’on dispose à ce jour. Les scientifiques ne faisaient pas la différence entre les deux phases de bactéries, c’est-à-dire celles qui sont associées aux BAL et celles qui sont associées aux BAP présentes dans le rumen (Volden et al., 1999). Une ou 2 phrases sur la contamination des proto à leur isolation??
24
2.3. Le métabolisme de l’azote dans le rumen.
2.3.1 Dégradation des protéines dans le rumen
La protéine brute ingérée est constituée de protéine vraie et d’azote non-protéique (ANP). La protéine vraie est constituée de longues chaînes d’AA reliés entre eux par des liens peptidiques. L’ANP est un composé d’azote qui n’est pas sous forme de protéine vraie comme l’ammoniac, l’urée, des amides, des peptides et des acides aminés libres; ces composants sont hydrolysés par la microflore du rumen en ammoniac (NRC, 2001). La dégradation des protéines vraies s’effectue en deux étapes : 1) une hydrolyse à l’aide des enzymes microbiennes présentes dans le rumen (Wallace, 1994). Les protéines libèrent des polypeptides et des peptides, les acides aminés sont dégradés par désamination également. Ces enzymes nommées protéases et peptidases vont dégrader les protéines pour donner des polypeptides et ensuite des oligopeptides. Ces enzymes proviennent des bactéries protéolytiques, mais aussi des protozoaires qui ont également une importante capacité protéolytique (Wallace, 1996). Grâce à l’anaérobie constante de l’atmosphère ruminal et un pH situé entre 5,5 et 7, les protéases se retrouvent dans les conditions idéales afin de faire leur travail (Wallace et Brammal, 1985).
25
Si nous suivons la dégradation des protéines dans le rumen (Figure 2), on peut remarquer que les protéines alimentaires sont hydrolysées d’abord en oligopeptides puis en peptides plus courts pour finir en AA. Ces AA sont désaminés et fournissent le NH3 qui est une source d’N pour les microorganismes afin de synthétiser la protéine microbienne. En désaminant les AA, on obtient de l’ammoniac et des acides gras volatils (AGV) qui constituent l’énergie disponible pour les microorganismes. Parmi les AGV produits, on observe l’isobutyrate et l’isovalérate, qui proviennent de la dégradation de la valine et de la leucine. Ceux-ci feraient partie des facteurs de croissances de bactéries cellulolytiques. Ces bactéries utilisent le NH3 afin de synthétiser des protéines.
26
2.3.2 Contribution de l’urée et des sécrétions endogènes
Les protéines alimentaires ne sont pas la seule source d’azote contribuant à la synthèse microbienne. Comme il est illustré à la figure 3, les sécrétions endogènes sont utilisées par les microorganismes afin de former des protéines arrivant au duodénum (Ouellet et al., 2002).
Figure 3: Schéma des sources d’N au rumen et au duodénum. Tirée de Ouellet et al., (2002).
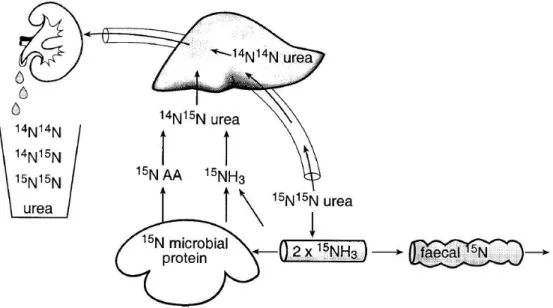
En ce qui concerne l’urée, il est important de bien comprendre son cycle. L’utilisation de l’urée doublement marquée en 15N et les isotopomères de l’urée [15N15N], [14N15N] et [14N14N] dans l’urine a permis aux chercheurs de caractériser le cycle de l’urée, incluant la synthèse et le retour au tube digestif (Figure 4). Un excès d’AA peut être catabolisé en urée par le foie de même que l’ammoniac absorbé dans la veine porte. En moyenne, environ un tiers de l’urée fabriquée par le foie est finalement excrété par les reins dans l’urine, tandis que les deux tiers sont recyclés dans le système digestif (Lapierre et Lobley, 2001).
27
Figure 4: Cycle de l’urée à l’aide d’isotopes de l’azote. Tirée de Lapierre et Lobley (2001).
2.3.3 Synthèse protéique microbienne
La Figure 5 présente les principales réactions lors de la synthèse des protéines microbiennes. Ce sont les bactéries cellulolytiques en majorité qui sont capables d’utiliser l’ammoniac provenant soit de l’ANP, des protéines alimentaires ou endogènes qui ont été dégradées, ou encore du recyclage de l’urée. À l’aide de l’ATP, les microorganismes vont synthétiser les protéines microbiennes à partir d’ammoniac. Habituellement, ce n’est pas la quantité d’ammoniac qui va limiter le processus, mais l’énergie sous forme d’ATP. Évidemment, s’il y a un manque en protéine dégradables dans le rumen (PDR), la synthèse microbienne sera limitée considérant l’apport réduit de NH3 (Wallace et Cotta, 1988).
28
Figure 5: Principales réactions de la synthèse des protéines microbiennes. Tiré de Chouinard (2015).
Il est difficile de mesurer l’efficacité de cette synthèse protéique car il faudrait reproduire chacun des paramètres qui sont primordiaux pour la prolifération des microorganismes (NRC 2001). Plusieurs études ont utilisé des techniques in vitro afin d’en connaître un peu plus (Casamiglia et al., 1995) sur les paramètres qui affectent la croissance bactérienne. Les paramètres les plus connus sont :
- La matière sèche ingérée (MSI) : la littérature rapporte qu’une corrélation positive importante entre la MSI et la croissance des microorganismes est observée (Clark et al. 1992; Gomes et al., 1994).
- L’apport de composé azoté : afin d’avoir une croissance optimale des microorganismes, les rations devraient avoir un minimum de 11 % de PB. La clé de l’utilisation efficace des protéines chez les ruminants est la capacité de l’animal à dégrader les protéines alimentaires afin de générer suffisamment d’azote dégradable (Pathak, 2008). Les composés azotés qui ont été libérés lors de la dégradation sont cruciaux au développement de la flore microbienne (Pathak, 2008).
- L’apport d’énergie : facteur habituellement limitant pour la croissance de microorganismes dans le rumen. Afin d’estimer le rendement de la protéine microbienne, on se base sur l’énergie métabolisable, l’énergie métabolisable fermentable, les glucides digestibles ou la matière sèche fermentable (Verbic et Babnik, 1997). Les glucides du
29
métabolisme microbien vont relâcher de l’ATP crucial pour la croissance des microorganismes.
- L’apport en vitamines et minéraux : par exemple, la concentration de souffre dans la ration alimentaire affecte la croissance de la flore microbienne. En effet, l’apport limité du souffre couplé à de grandes concentrations ANP aura un impact négatif sur la synthèse de protéines microbiennes (Sniffen et Robinson, 1987).
L’incorporation de ces différents paramètres dans l’estimation de la contribution des protéines microbiennes à l’apport en PM selon différents modèles de rationnement est présentée à la section 2.4.
30
2.4. Prédiction de la synthèse microbienne et de son apport en AA
Selon les principaux paramètres affectant la synthèse microbienne décrits dans la section 2.3.3, différents modèles de rationnement protéique ont proposé des approches différentes pour estimer la contribution des protéines microbiennes à l’apport en PM et en AA digestibles. Pour illustrer mon propos, quatre modèles ont été sélectionnés, les 2 modèles américains étant les plus utilisés en Amérique, tandis que les modèles européens INRAtion et NorFor offrent des approches différentes.
2.4.1 Modèle du « National Research Council » (2001)
Le guide « Nutrient requirements of Dairy Cattle : Seventh Revised Edition, 2001 » publié par le National Research Council, mieux connu sous le nom de NRC (2001) est actuellement en cours de révision. Cependant le NRC (2001) a utilisé comme base de calculs des prédictions des apports en protéines du MCP, les UNT (unités nutritives totales). Le rendement de MCP est 130 g/kg de UNT consommé, avec une exigence en PDR de 1,18 × le rendement en MCP. Ainsi, le rendement du MCP (g/kg DM) est calculé comme suit :
1. Si PDR consommé >= 1,18 × rendement du MCP = 0.130 × UNT
2. Si PDR consommé < 1,18 × rendement du MCP = 0.85 × PDR consommé
Pour l’estimation des apports en AA, le comité a considéré l’approche factorielle et la régression multi-variable. Finalement, il a opté pour l’approche de régression afin de s’affranchir du choix d’une composition en AA des protéines microbiennes et endogènes. Le flux duodénal en AAE est estimé par une approche empirique avec des régressions reliant le flux total en AAE au flux PNDR et MCP, et ensuite reliant le flux d’un AAE spécifique à la composition du flux PNDR pour cet AAE (NRC, 2001).
31
2.4.2 Le modèle « Cornell Net Carbohydrate and Protein System » (CNCPS) Le CNCPS est le modèle le plus utilisé faisant appel à une approche factorielle aux USA.
Le modèle utilise une approche basée sur deux fractions qui constituent la protéine microbienne, soit les parois cellulaires (cell wall) et la fraction « non-paroi cellulaire » (noncell wall), en attribuant à chaque fraction une composition en AA qui lui est propre. (Tableau 1).
Tableau 1: Composition en AA (en % en protéines brutes) des fractions protéiques des bactéries du rumen selon le CNCPS
Acide aminé Paroi cellulaire « Non-paroi cellulaire »
Arg 3,82 6,96 His 1,74 2,69 Iso 4,00 5,88 Leu 5,90 7,51 Lys 5,60 8,20 Met 2,40 2,68 Phe 4,20 5,16 Thr 3,30 5,59 Trp 1,63 1,63 Val 4,70 6,16 Fox et al., 2004 2.4.3 Le modèle INRAtion
INRAtion est un modèle français, utilisant le terme « MAMIC », qui signifie matières azotées microbiennes au duodénum, elle est mesurée en g/kg de MS arrivant au duodénum (Vérité et al., 1987). Ce modèle prédit :
145 g de MAMIC par kg de matière organique fermentescible (MOF)
La composition en AA des protéines microbiennes utilisées dans ce modèle provient de la thèse de LeHénaff (1991) où le profil en AA des BAL est rapporté.
32
2.4.4 Le modèle “Nordic Feed Evaluation System” (NorFor)
Le « Nordic Feed Evaluation System » (NorFor) est un modèle scandinave qui a été mis à jour en 2011 (NorFor, 2011). Il est considéré à l’heure actuelle comme étant un des modèles les plus complexes (Sauvant et Nozière, 2013). Concernant la prédiction de protéine microbienne, ce modèle se base sur le résultat d’une méta-analyse d’Archimède et al. (1997) qui présente une équation qui est utilisée pour estimer l’efficacité de la synthèse des protéines microbiennes dans le rumen, en prenant compte de paramètres tels que des fractions digestibles de l’amidon, du NDF, des protéines et d’autres glucides (Sauvant et Nozière, 2013).
Où r_mCP (g/d) : flux de MCP sortant du rumen
r_emCP : efficacité du MCP
rd_ST : dégradation de l’amidon dans le rumen rd_NDF : dégradation du NDF dans le rumen
rd_RestCHO : dégradation du reste d’hydrates de carbones dans le rumen rd_CFat : dégradation des graisses brutes
rd_CPcorr : dégradation de l’ammoniac ou de l’urée corrigée avec le CP dans le rumen rd_FPF : libération de la fermentation alimentaire produit dans le rumen
Contrairement au modèle français qui associe la totalité de la composition du flux microbien à la composition des BAL, le modèle NorFor inclut les trois fractions microbiennes dans une proportion 30:60:10 pour les BAL, les BAP et les protozoaires respectivement. La composition en AA de ces trois fractions est cependant basée sur une seule étude (Tableau 2).
33
Tableau 2: Composition d’AA (g / 100 d’AA) des protozoaires, des bactéries associées à la phase liquide (BAL) et des bactéries associées aux particules (BAP)
Fraction microbienne Contraste1
Item Protozoaires BAL BAP SEM 1 2
Ala 4,0 6,9 6,1 0,05 <0,001 <0,001 Arg 5,1 4,9 5,2 0,03 0,73 <0,001 Asp 12,8 11,7 11,3 0,03 <0,001 <0,001 Cys 2,3 1,3 2,3 0,06 <0,001 <0,001 Glut 14,4 12,9 12,6 0,04 <0,001 <0,001 Gly 3,7 4,9 4,6 0,02 <0,001 <0,001 His 2,1 2,5 2,3 0,02 <0,001 <0,001 Iso 6,8 5,6 6,0 0,03 <0,001 <0,001 Leu 7,7 7,4 8,2 0,04 0,05 <0,001 Lys 11,0 7,4 7,1 0,05 <0,001 <0,001 Met 2,4 2,3 2,6 0,02 0,94 <0,001 Phe 5,6 5,5 5,9 0,02 <0,001 <0,001 Pro 3,3 3,5 3,9 0,05 <0,001 0,002 Ser 4,1 4,9 4,4 0,05 <0,001 <0,001 Thr 4,7 5,6 5,2 0,02 <0,001 <0,001 Tyr 5,1 5,7 5,6 0,05 <0,001 0,09 Val 5,0 6,0 6,0 0,02 <0,001 0,72
1Probabilité du contraste : 1, Proto. vs BAL et BAP ; 2, BAL vs BAP. 2 Tiré de Volden et al., 1999.
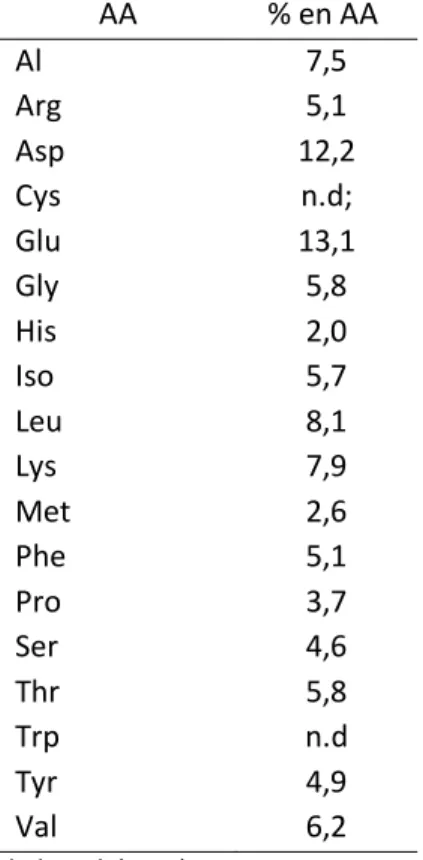
2.4.5 Composition en AA proposée par Clark (1992)
La référence la plus fréquemment utilisée pour la composition en AA du MCP selon Pacheco et al. (2012) provient de Clark et al. (1992). Ces derniers auteurs ont rapporté la composition en AA des bactéries du rumen provenant de bovins ainsi que d’ovins (Tableau 3). Cependant, le profil en AA rapporté provient seulement des bactéries qui sont associées à la phase liquide.
34
Tableau 3: Composition en AA de bactéries selon Clark et al. (1992)
AA % en AA Al 7,5 Arg 5,1 Asp 12,2 Cys n.d; Glu 13,1 Gly 5,8 His 2,0 Iso 5,7 Leu 8,1 Lys 7,9 Met 2,6 Phe 5,1 Pro 3,7 Ser 4,6 Thr 5,8 Trp n.d Tyr 4,9 Val 6,2 1Clark et al. (1992) 2n. d. : non défini .
35
Conclusions et objectifs de la recherche
Au vu des observations présentées, il semblait évident qu’une mise à jour de la composition en AA de la protéine microbienne devait être faite pour les raisons suivantes. La dernière revue, celle de Clark et al. (1992) remontait à près de 25 ans, incluait des échantillons prélevés chez les ovins et les bovins et rapportait uniquement des compositions en AA de BAL. Si dans nos prochains modèles de rationnement, nous voulons utiliser une approche factorielle, il est impératif de mettre à jour la composition en AA des microorganismes qui incluent toutes les fractions protéiques provenant des microorganismes, soit les FAB, PAB et protozoaires, tout en limitant les observations à celles qui sont faites chez le bovins. Les modèles alimentaires pourront utiliser ce profil dans leurs équations afin d’optimiser leur ration. L’objectif initial du projet était de réaliser une méta-analyse afin de déterminer s’il y a ou pas un effet de l’alimentation du bovin laitier sur le profil en AA des protéines microbiennes du rumen; cependant, le manque de précision concernant la description des rations ou le fait qu’une seule valeur de composition était rapportée pour toutes les rations d’une même étude nous a empêché d’atteindre cet objectif.
36
Références de la revue littérature et de l’introduction
Ahuja, S. P. et T. C. Sarmah 1979. Studies on the activity of rumen protozoa. II. Utilization of U-14C-L-leucine and U-14C-L-serine by rumen protozoa. Zentralbl Veterinarmed A. Sep. 26:551-557.
Anderson, K. L., T. G. Nagaraja, J. L. Morril, T. B. Avery, S. J Galitzer et J. E. Boyer. 1987. Ruminal microbial development in conventionally or early-weaned calves. J. Anim. Sci. 64:1215-1226.
Archimède, H., D. Sauvant et P. Schmidely. 1997. Quantitative review of ruminal and total tract digestion of mixed diet organic matter and carbohydrates. Reprod. Nutr. Dev. 37:173-189. Belanche, A., M. Doreau, J. E. Edwards, J. M. Moorby, E. Pinloche et C. J. Newbold. 2012. Shifts in the rumen microbiota due to the type of carbohydrate and level of protein ingested by dairy cattle are associated with changes in rumen fermentation. J. Nutr. 142:1684-1692. Belbis, H. G. 2007. Flore du rumen : origine, composition, évolution, conséquences,
physiopathologiques. Thèse de doctorat. École nationale vétérinaire d’Alfort, France. Borucki Castro, S. I., L. E. Phillip, H. Lapierre, P. W. Jardon et R. Berthiaume. 2007. Ruminal
degradability and intestinal digestibility of protein and amino acids in treated soybean meal products. J. Dairy Sci. 90:810-822.
Broderick, G. A. et N. R. Merchen. 1992. Markers for quantifying microbial protein synthesis in the rumen. J. Dairy Sci. 75:2618-2632.
Bryant M. P. et I. M. Robinson. 1963. Apparent incorporation of ammonia and amino acid carbon during growth of selected species of rumen bacteria. J. Dairy Sci. 46:150-154.
Casamiglia, S., M. D. Stern et J. L. Firkins. 1995. Effects of protein source on nitrogen metabolism in continuous culture and intestinal digestion in vitro. J. Ani. Sci. 73:1819-1827.
Chouinard, Y. 2015. Dégradation des composants azotés et synthèses des proteines microbiennes – cours de physiologie et nutrition des ruminants. Université Laval, Québec, Canada. Clark, J. H, T. H. Klusmeyer et M. R. Cameron. 1992. Microbial protein synthesis and flows of
nitrogen fractions to the duodenum of dairy cows. J. Dairy Sci. 75:2304-2323.
37
D’Mello, J. P. F. 2003. Amino acids in animal nutrition. 2e édition. The Scottish Agricultural College. Edinburgh, Royaume-Uni.
Eugène M., D. Sauvant, J. L. Weisbecker et H. Archimède. 2010. Effects of defaunation on digestion of fresh Digiratria decumbes grass and growth of lambs. Animal 4:439-445. Eugène, M., H. Archimède et D. Sauvant. 2004. Quantitative meta-analysis on the effects of
defaunation of the rumen on growth, intake and digestion in ruminants. Livest.Prod. Sci. 85:81-97.
Firkins, J. L. 1996. Maximizing microbial protein synthesis in the rumen. J. Nutr. 126:1347-1354. Fonty, G., J. P. Jouany, M. Chavarot, F. Bonnemoy et P. Gouet. 1991. Development of the rumen
digestive functions in lambs placed in a sterile isolator a few days after birth. Reprod. Nutr. Dev. 31:521-528.
Fox, D. G., L. O. Tedeschi, T. P. Tylutki, J. B. Russell, M. E. Van Amburgh, L. E. Chase, A. N. Pell, et T. R. Overton. 2004. The Cornell net carbohydrate and protein system model for evaluating herd nutrition and nutrient excretion. Anim. Feed Sci. Technol. 112:29-78.
Gomes, M. J., F. D. Hovell et X. B. Chen. 1994. Intake, rumen digestion, digestibility and microbial nitrogen supply in sheep fed Cynodon lemfuensis supplemented with Gliricidia sepium. Anim. Feed. Sci. Technol. 49:277-286.
Gruby, D. et H. M . O. Delafond. 1843. Recherches sur les animalcules se développant en grand nombre dans l’estomac et dans les intestins, pendant la digestion des animaux herbivores et carnivores. Compt. Rend. Acad. Sci. 17:1304-1308.
Gutierrez, J. 1958. Observations on Bacterial Feeding by the Rumen Ciliate Isotricha prostoma. J. of Protozool. 5:122–126.
Hoover, W.H. et S. R. Stokes. 1991. Balancing carbohydrates and proteins for optimum rumen microbial yield. J. Dairy Sci. 74:3630-3644.
Hristov, A. N., R. P. Etter, J. K. Ropp et K. L. Grandeen. 2004. Effect of dietary crude protein level and degradability on ruminal fermentation and nitrogen utilization in lactating dairy cows. J. Anim. Sci. 83:3219-3229.
38
Jouany J.-P. 1994. Les fermentations dans le rumen et leur optimisation. INRA Prod. Anim. 7:207-225.
Jouany, J.-P. 1996. Effect of rumen protozoa on nitrogen utilization by ruminants. J. Nutr. 126:1335-1346.
Kayouli, C., C. J. Van Nevel et D. Demeyer. 1983. Effet de la défaunation du rumen sur la dégradabilité des protéines du soja mesurée in sacco. Symp. Int. Metab. Nutri. Azotée. Clermont-Ferrand, France.
Kreuzer, M. et K. Kirchgeesne. 1987. Growth response of lambs supplied with rumen protected lysine (DHML-Ca) under various conditions of ruminal protozoa status and different energy conditions of the ration. Zeitschr. für Tierphysiol., Tierernähr. und Futtermittelk. 58:188-200.
Lapierre, H. et G. E. Lobley. 2001. Nitrogen recycling in the ruminant : A review. J. Dairy Sci. 84:223-236.
Lapierre, H., D. Pacheco, R. Berthiaume, D. R. Ouellet, C. G. Schwab, P. Dubreuil, G. Holtrop et G. E. Lobley. 2006. What is the true supply of amino acids for a dairy cow? J. Dairy Sci. 89:1-14.
Lapierre, H., D.R. Ouellet, A. Fournier et D. Pellerin. 2014. Comment maximiser l’utilisation de l’azote des vaches laitières: répercussions environnementales et monétaires. Pages 35-53 Dans 38e Symposium sur les bovins laitiers. CRAAQ, Québec, QC, Canada.
Lapierre, H., D.R. Ouellet, R. Martineau et J.W. Spek. 2016. Key roles of amino acids In cow performance and metabolism – Considerations For defining amino acid requirements. Cornell Nutrition Conference for Feed Manufacturers 2016.
https://ecommons.cornell.edu/xmlui/bitstream/handle/1813/44754/Post1LaPierre_Manuscript.pdf?sequence=1
&isAllowed=y (page consultée le 20 décembre 2016) .
Le Hénaff, L. 1991. Importance des acides aminés dans la nutrition des vaches laitières. Thèse de doctorat. Université de Rennes, France.
Lee, S. S., J. K. Ha et K. J. Cheng. 2000. Relative contributions of bacteria, protozoa, and fungi to in vitro degradation of orchard grass cell walls and their interactions. Appl. Environ. Microbiol. 66:3807-3813.
39
Lobley, G. E., 2002. Protein turnover – what does it mean for animal production ? In : Amino acids : meat, milk and more ! H. Lapierre et D. R. Ouellet (édi.), CSAS Symposium, Québec, Canada.
Lowe, S. E., K. Michael, K. Theodorou et P. J. Trinci Anthony. 1987. Isolation of anaerobic fungi from saliva and faeces of sheep. J. Gen. Microbiol. 133:1829-1834.
Martin, S. A. 1994. Nutrient transport by ruminal bacteria: a review. J. Anim. Sci. 72:3019-3031. Mathison, G. W. et L. P. Milligan. 1971. Nitrogen metabolism in sheep. Br. J. Nutr. 25:351-366. Maxin, G., D. R. Ouellet, et H. Lapierre. 2013. Ruminal degradability of dry matter, crude protein,
and amino acids in soybean meal, canola meal, corn, and wheat dried distillers grains. J. Dairy Sci. 96:5151-5160.
Michel, V., G. Fonty et L. Millet. 1993. In vitro study of the proteolytic activity of rumen anaerobic fungi. FEMS Microbiol. Lett. 110:5-10.
Newbold, C. J., G. de la Fuente, A. Belanche, E. Ramos-Morales et N. McEwan. 2015. The role of cialiate protozoa in the rumen. Front. Microbiol. 6:1-14.
Nocek, J. E. et J. B. Russell. 1988. Protein and energy as an integrated system. Relationship of ruminal protein and carbohydrate availability to microbial synthesis and milk production. J. Dairy Sci. 71:2070-2107.
Norfor – The Nordic Feed Evaluation System. 2011. H. Volden (éd.). Wageningen Academic Published, Netherlands.
NRC. 2001. Nutrient requirements of dairy catle. 7e edition révisée. The National Academies Press, Washington, DC, États-Unis.
NRC. 2012. Nutrient Requirements of Swine: 11e édition révisée. The National Academies Press, Washington, DC. États-Unis
NRC. 2016. Nutrient requirements of beef cattle. 8e édition révisée. The National Academies Press, Washington, DC, États-Unis.
Ouellet, D. R., M. Demers, G. Zuur , G. E. Lobley , J. R. Seoane, J. V. Nolan et H. Lapierre. 2002. Effect of dietary fiber on endogenous nitrogen flows in lactating dairy Cows. J. Dairy Sci. 85:3013-3025.
40
Ouellet, D.R., D. Valkeners, G. Holtrop, G.E. Lobley et H. Lapierre. 2007. Contribution of endogenous secretions and urea recycling to nitrogen metabolism. Proc. Cornell Nutrition Conference for Feed Manufacturers. Dpt. Anim. Science, Cornell University, NY: 1-24. Ouellet, D. R., R. Berthiaume, G. Holtrop, G. E. Lobley, R. Martineau et H. Lapierre. 2010. Effect
of method of conservation of timothy on endogenous nitrogen flows in lactating dairy cows. J. Dairy. Sci. 93:4252-4261.
Ørskov, E.R., N. A. Macleod et D. J. Kyle. 1986. Flow of nitrogen from the rumen and abomasum in cattle and sheep given protein-free nutrients by intragastric infusion. Brit. J. Nutr. 56:241-248.
Pacheco, D., R. A. Patton, C. Parys et H. Lapierre. 2012. Ability of commercially available dairy ration programs to predict duodenal flows of protein and essential amino acids in dairy cows. J. Dairy Sci. 95:937-963.
Pathak, A. K. 2008. Various factors affecting microbial protein synthesis in the rumen. Vet. World 1 6:186-189.
Pilgrim, A. F., F. V. Gray, R. A. Weller et C. B. Belling. 1970. Synthesis of microbial protein from ammonia in the sheep rumen and the proportion of dietary nitrogen converted into microbial nitrogen. Br. J. Nutr. 24:589-598.
Santos, F. A. P., J. E. P. Santos, J. T. Huber et C. B. Theurer. 1998. Effects of rumen-undegradable protein on dairy cow performance : A 12-year literature review. J. Dairy Sci. 81:3182-3213. Satter, L. D. et L. L. Slytter. 1974. Effect of ammonia concentration on rumen microbial protein
production in vitro. Br. J. Nutr. 32:199-208.
Sauvant, D. et P. Nozière. 2013. La quantification des principaux phénomères digestifs chez les ruminants : les relations utilisées pour rénover les systèmes d’unités d’alimentation énergétique et protéique. INRA Prod. Anim. 26:327-346.
Sauvant, D., G. Cantalapiedra-Hijar, L. Delaby, J. B. Daniel, P. Faverdin et P. Nozière. 2015. Actualisation des besoins protéiques des ruminants et détermination des réponses des femelles laitières aux apports de protéines digestibles dans l’intestin (PDI). INRA Prod. Anim. 28:347–368.
Sniffen, C. J. et R. H. Robinson. 1987. Microbial growth and flow as influenced by dietary manipulations. J.Dairy Sci. 70:425-441.
41
St-Pierre, N. R. et D. Glamocic. 2000. Estimating unit costs of nutrient from market prices of feedstuffs. J. Dairy Sci. 83:1402-1411.
Tamminga, S., H. Schulze, J. Van Bruchem, et J. Huisman. 1995. The nutritional significance of endogenous N-losses along the gastro-intestinal tract of farm animals. Arch. Anim. Nutr. 48:9.
Towne, G., T. G. Nagaraja, R. T. Brandt Jr. et K. E. Kemp. 1990. Dynamics of ruminal ciliated protozoa in feedlot cattle. Appl. Environ. Microbiol. 56:3174-3178.
Ushida, K., J.- P. Jouany, B. Lassalas et P. Thivend. 1984. Protozoal contribution to nitrogen digestion in sheep. Can. J. Anim. Sci. 64:20-21.
Van Amburgh, M. E., E. A. Collao-Saenz, R. J. Higgs, D. A. Ross, E. B. Recktenwald, E. Raffrenato, L. E. Chase, T. R. Overton, J. K Mills et A. Foskolos. 2015. The Cornell Net Carbohydrate and Protein System: updates to the model and evaluation of version 6.5. J. Dairy Sci. 98:6361-6380.
Verbic, J. and Babnik, D. 1997. Evaluation of the protein supply in ruminants 3. The proposal of a system for Slovenia. Sod. Kmet. 30:147-197.
Vérité, R., B. Michalet-Doreau, P. Chapoutot, J-L. Peyraud et C. Poncet. 1987. Révision du système des protéines digestibles dans l'intestin. Bull. Tech. INRA. 70:19-34.
Volden, H. et O. M. Harstad. 1998. Chemical composition of bacteria harvested from the rumen of dairy cows fed three diets differing in protein content and rumen protein degradability at two levels of intake. Acta Agric. Scand. Sect. A. Anim. Sci. 48:202-209.
Volden, H., W. Velle, O. M. Harstad, A. Aulie et O. V. Sjaastad. 1998. Apparent ruminal degradation and rumen escape of lysine, methionine, and threonine administered intraruminally in mixtures to high-yielding cows. J. Anim. Sci. 76:1232-1240.
Volden, H., O. M. Harstadet L. T. Mydland. 1999. Amino acid content and profile of protozoal and bacterial fractions isolated from ruminal contents of lactating dairy cows fed diets differing in nitrogen supplementation. Acta Agric. Scand. Sect. A Anim. Sci. 49:245-250.
Walker, N. D., C. J. Newbold et R. J. Wallace. 2005. Nitrogen metabolism in the rumen. Pages 71-101 dans : Nitrogen and phosphorus nutrition of cattle. Pfeffer E. et A. Hristov (éd.). CABI Publishing, Cambridge, MA, États-Unis
42
Wallace, R. J. et M. L. Brammal. 1985. The role of different species of bacteria in the hydrolysis of protein in the rumen. J. Gen. Microbiol.. 131:821-832.
Wallace, R. J. et Cotta M. A. 1988. Metabolism of nitrogen-containing compound. In : Hobson P. N. (éd.). The rumen microbial ecosystem. Elsevier Science Publishing, New York, États-Unis. Wallace, R. J. 1994. Amino acid and protein synthesisn turnover, and breakdown by ruminal micro-organisms. Pages 72-97 dans Principles of protein nutrition of ruminants. Asplund J. M. (éd.) CRC Press, FL, États-Unis.
Wallace, R. J. 1996. The proteolytic systems of ruminal microorganisms. Ann. Zootech. 45:301-308.
Wattiaux, M. A. et W. T. Howard. 2000. Digestion in the dairy cow. University Wisconsin, Madison, États-Unis. p. 1-4.
Whitehouse N. L., V. M. Olson, S. G. Schwab, W. R Chesbro, K. D Cunningham et T. Lykos. 1994 Improved techniques for dissociating particle-associated mixed ruminal microorganisms from ruminal digesta solids. J. Anim. Sci. 72:1335-1343.
Williams, A. G. et C. G. Harfoot. 1976. Factors affecting the uptake and metabolism of soluble carbohydrates by the rumen ciliate Dasytricha ruminantium isolated from ovine rumen contents by filtration. J. Gen. Microbiol. 96:125-136.
Williams, A. G. et G. S. Coleman. 1992. The rumen protozoa. 1e édition. Springer-Verlag, New York, États-Unis.
Williams A. G. et S. E. Withers. 1993. Changes in the rumen microbial population and its activities during the refaunation period after the production of ciliate protozoa into the rumen of defaunated sheep. Can. J. Microbiol. 39:61-69.
43
Chapitre III : AMINO ACID IN RUMEN BACTERIA AND PROTOZOA
Amino acid composition of rumen bacteria and protozoa in cattle
M. Sok,* D. R. Ouellet,† J. L. Firkins,‡ D. Pellerin,* and H. Lapierre†1
*University Laval, Québec, QC, Canada, G1V 0A6
†Agriculture and Agri-Food Canada, Sherbrooke, QC, Canada, J1M 0C8 ‡The Ohio State University, Columbus, Ohio, USA
44
3.1 ABSTRACT
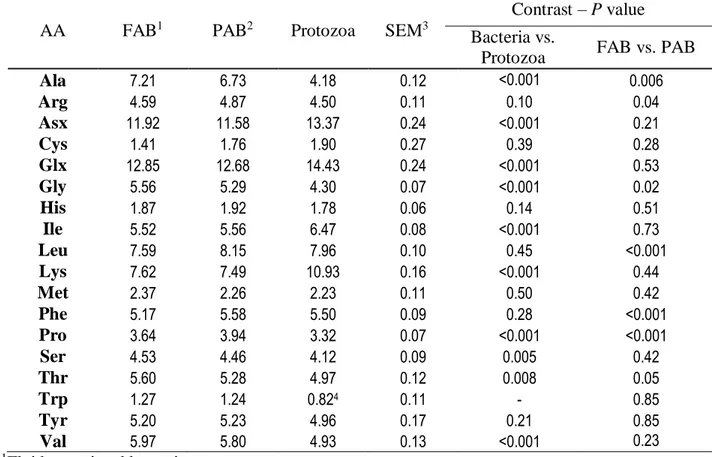
Because microbial protein (MCP) constitutes more than 50% of the protein digested in cattle, its AA composition is needed to adequately estimate AA supply. Our objective was to update the AA contributions of the rumen microbial AA flowing to the duodenum using only studies from cattle, differentiating between fluid-associated bacteria (FAB), particle-associated bacteria (PAB), and protozoa, based on published literature (53, 16 and 18 treatment means were used for each type of micro-organism, respectively). In addition, Cys and Met reported concentrations were retained only when an adequate protection of the sulfur groups was performed prior to the acid hydrolysis. The total AA (or true protein) fraction represented 82.4% of CP in bacteria. For 10 AA, including 4 essential AA (EAA), the AA composition differed between protozoa and bacteria. The most noticeable differences are a 45% lower Lys concentration and 40% higher Ala concentration in bacteria than in protozoa. Differences between FAB and PAB were less pronounced than differences between bacteria and protozoa. Assuming 33% FAB, 50% PAB, and 17% of protozoa in MCP duodenal flow, the updated concentrations of AA would decrease supply estimates of Met, Thr, and Val originating from MCP and increase those of Lys, and Phe by 5 to 10% compared with those calculated using the FAB composition reported by Clark et al. (1992). Therefore, inclusion of the contribution of PAB and protozoa to the duodenal MCP flow is needed to adequately estimate AA supply from microbial origin when a factorial method is used to estimate duodenal AA flow. Furthermore, acknowledging the fact that hydrolysis of 1 kg of true microbial protein yields 1.16 kg of free AA substantially increases the estimates of AA supply from MCP.
45
3.2 INTRODUCTION
Duodenal flow of AA is the sum of AA contribution from microbial crude protein (MCP), RUP, and endogenous protein flows. Considering that MCP contributes more than 50% to duodenal CP flow (Clark et al., 1992), the AA composition of rumen microorganisms must be accurately represented to determine the duodenal flow of AA when a factorial approach is used to estimate AA duodenal flow. To estimate the duodenal flow of AA, however, the NRC (2001) uses a regression approach based on the estimation of essential AA (EAA) duodenal flow from RUP and MCP to duodenal protein flow and the EAA concentration in the RUP fraction. In this way, their estimation of AA duodenal flow was independent of the microbial and endogenous AA composition. However, other models use a factorial approach and therefore need accurate AA composition in MCP. For example, INRAtion (Rulquin et al., 1998) uses the AA composition of fluid-associated bacteria (FAB; Le Hénaff, 1991), which was an average of AA composition obtained from 66 studies conducted in sheep and cattle. The Cornell Net Carbohydrate and Protein System (CNCPS: Fox et al., 2004) model differentiated between the cell wall and non-cell wall AA composition of rumen bacteria. In all models, accurate prediction of the different protein fractions flowing at the duodenum remains a key point of the prediction of duodenal AA flow.
One of the most quoted references for the AA composition of rumen bacteria is from Clark et al. (1992) from which 7 of the 18 studies had been performed in sheep. Even though, this reference is often used to assess the AA composition of the duodenal MCP flow in cattle (e.g. Pacheco et al., 2006). In addition, part of MCP flowing to the duodenum includes protozoa. Indeed, protozoa may contribute 10 to 30% of duodenal MCP (Sylvester et al., 2005), and their AA composition may differ from that of bacteria (Martin et al., 1996; Volden et al., 1999; Korhonen et al., 2002). Moreover, the particle-associated bacteria (PAB) represent a larger fraction of the bacteria flowing at the duodenum than the FAB (e.g. Reynal and Broderick, 2005; Brito et al., 2007 a and b). Altogether, these observations clearly indicate that the AA composition of FAB reported by Clark et al. (1992) should not be solely used to assess the contribution of AA from MCP to the AA duodenal flow. Accordingly the Nordic feed evaluation model (NorFor, 2011) uses a weighted average of the AA composition of 60:30:10 for PAB, FAB, and protozoa, respectively, but the AA composition used is based only on 2 studies.
46
Our hypothesis was that the AA compositions of protozoa and bacteria differ substantially for some AA, whereas the difference between FAB and PAB is more limited. Therefore, the
objectives of this study were 1) to update the AA composition of rumen bacteria using only data from cattle, differentiating between FAB and PAB; 2) include AA composition of rumen
protozoa in the database; and 3) determine if AA composition differs between protozoa and bacteria, the latter of which are differentiated into FAB and PAB. Because dietary characteristics affected some but not all AA concentrations of microbes (e.g. Hvelplund, 1986; Martin et al., 1996; Mabjeesh et al., 1997), one of our original objectives was to determine the impact of the dietary characteristics on AA profiles of MCP. However, this task could not be completed because the lack of information on composition (e.g. NDF, CP, and starch) of diets and
ingredients or, because in many studies, the AA composition of bacteria was reported as a single mean for all diets.
3.3 MATERIALS AND METHODS
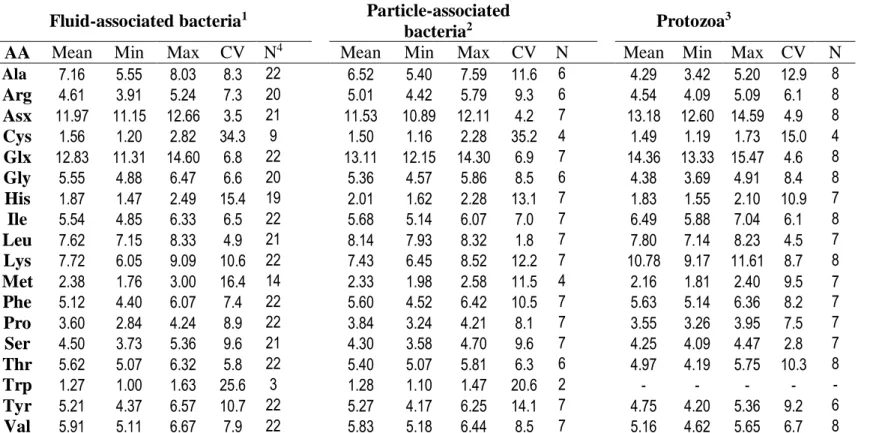
Based on an initial search on Scopus.com completed with a thorough review of referenced manuscripts using cattle, an initial database was built from 29 publications (66 treatment means; between 1967 and 2014) reporting AA composition of FAB, and 7 publications (17 treatment means; between 1996 and 2014) reporting AA composition of PAB, and 10 publications (26 treatments; between 1973 and 2006) reporting AA composition of protozoa. When the type of bacteria (i.e., FAB or PAB) was not clearly specified in the manuscript, we evaluated the procedure described in the original manuscript. For most of the studies, it corresponded to FAB, but 5 studies were discarded because the composition of a mixture of FAB and PAB had been reported (Cecava and Parker, 1993; Cunningham et al., 1994; Larsen et al., 2000; Shabi et al., 2000; Jensen et al., 2006). Concentrations of Met and Cys were only kept for studies specifying that the sulfur groups had been protected prior to hydrolysis; other AA of these studies were kept in the database. The addition of formaldehyde to the ruminal samples altered the ratio of true protein to CP and more specifically concentrations of some AA (Volden and Harstad, 1998). Therefore, data from 2 publications reporting use of formaldehyde (Reynal et al., 2005; Paz et al., 2014) were excluded from the database plus the data from Volden and Harstad (1998) for the AA composition measured
47
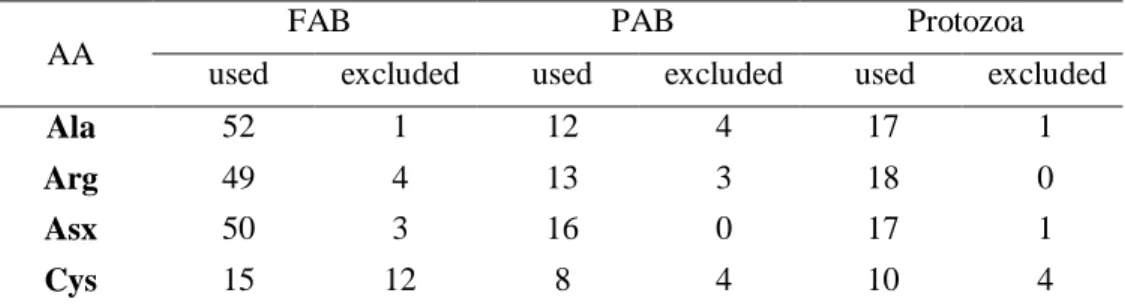
on bacteria extracted using formaldehyde. Two studies reporting Lys concentration lower than 9.0 g/100 g AA (Ibrahim and Ingalls, 1971; Reynal et al., 2005) were excluded from the protozoa dataset because these low Lys concentrations were a clear indication of contamination from bacteria, feed or both during the extraction process.
From this database, for each AA, the concentrations outside the range of the mean plus or minus 2 SD were considered outliers and discarded. However, for Cys, His, and Met, the acceptable range was only the mean plus or minus 1 SD: the CV of the reported concentrations of all other AA was below 15% whereas it was over 25% for these AA (even when keeping only the studies where a protection of the sulfur group had been made), indicating a technical problem in the analysis of these AA more than just a biological variation. All rumen digesta samples had been collected through rumen cannula, except for the study of Williams and Dinusson (1973) where a stomach tube has been used. The final database contained for FAB: 22 publications (53 treatment means; between 1967 and 2014); for PAB: 7 publications (16 treatment means; between 1996 and 2014), and for protozoa: 8 publications (18 treatment means; between 1973 and 2006). Three publications reported FAB, PAB, and protozoa AA concentrations, 4 reported FAB and PAB AA concentrations, 2 reported FAB and protozoa AA concentrations, 13 reported only FAB AA concentrations and 3 reported only protozoa AA concentrations (for these latter studies bacteria were for a mixture of FAB and PAB or had been isolated using formaldehyde). The number of values available and used from original publications, and the number of data excluded are given in Table 1 for each AA. When the sum of the 2 numbers does not add up to the number of total treatment means, it is either because the values were not reported or for Cys and Met, the sulfur group had not been protected prior to the hydrolysis. Because no value was reported for the Trp composition in protozoa in the final dataset, the value reported in Reynal et al. (2005) was used despite the fact that reported Lys concentrations was low for protozoa. Because data are reported as g AA/100 g AA, data discarded were replaced by the mean of the remaining data, and values were adjusted for the sum to yield 100 g AA/100 g AA. The true protein content of bacteria has been reported either as g AA/100 g CP or g AA-N/100 g total N. When reported as g AA/100 g CP, the ratio was divided by 1.16 to account for the addition of one molecule of water at the cleavage of each peptide bond during hydrolysis of microbial protein (Storm and Ørskov, 1983; Lapierre et al., 2016). When reported as g AA-N/100 g total N, the ratio was divided by 0.93 to