Impact de l'expression du CD200 sur les macrophages
dérivés de la moelle osseuse
Mémoire
Eliane Tardif-Pellerin
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Impact de l’expression du CD200 sur les macrophages
dérivés de la moelle osseuse
Mémoire
Éliane Tardif-Pellerin
Maîtrise en Sciences Cliniques et Biomédicales – avec mémoire
Maître ès sciences (M. Sc.)
Sous la direction de :
Élyse Bissonnette, Directrice
Résumé
Le macrophage constitue l’un des mécanismes de défense cellulaire contre les pathogènes. Le rôle principal du macrophage est l’initiation ainsi que la résolution de l’inflammation lors d’infection. Notre laboratoire s’intéresse au CD200, une molécule anti-inflammatoire présente sur les macrophages. Certaines études ont montré que le CD200 est impliqué dans la résolution de l’inflammation. Notre hypothèse était qu’une absence de CD200 augmente les fonctions inflammatoires des macrophages dérivés de la moelle osseuse (BMDMs) ce qui pourrait être causé par une modulation de la différenciation des BMDMs.
Pour ce faire, nous avons utilisé des BMDMs différenciés avec un facteur de stimulation des colonies de granulocytes et de macrophages (GM-CSF) pendant 9 jours à partir de moelle osseuse de rats Sprague Dawley déficients pour le CD200 (CD200 KO) (générés par notre équipe). L’impact de l’absence du CD200 sur la différenciation et l’activation des BMDMs par stimulation au lipopolyssaccharide (LPS) a été étudié. L’expression de molécules présentatrices d’antigènes a été mesurée par cytométrie en flux, la sécrétion de cytokines par ELISA et la phagocytose par essai fluorométrique avec Pseudomonas aeruginosa.
Au cours de la différenciation, les BMDMs augmentent l’expression de CD200 et CD200R. L’absence du CD200 altère l’expression des molécules associées à la présentation d’antigènes (MHCII, CD80 et CD86) lors de la différentiation. Par contre, l’absence du CD200 n’affecte pas la phagocytose. De plus, l’absence du CD200 diminue la sécrétion de cytokines suite à une stimulation au LPS. Ces résultats sont associés à une diminution de la surexpression du Toll-like receptor 4 (TLR-4), le récepteur du LPS.
En conclusion, l’absence de CD200 module la différenciation des BMDMs in vitro et, contrairement à notre hypothèse, l’absence du CD200 sur les BMDMs limite
Les mécanismes de réponse aux pathogènes que l’absence du CD200 affecte sont encore inconnus, mais pourraient impliquer la voie du TLR-4.
Abstract
The first line of cell defense against pathogens is the macrophages. The main function of this cell is to be able to maintain immune homeostasis. The CD200 is an anti-inflammatory molecule expressed by on many cell types, including macrophages. Some studies have shown that the CD200-CD200R pathway is involved in the resolution of inflammation. Our hypothesis was that the absence of CD200 on bone marrow derived macrophages (BMDMs) will change their differentiation pattern and increase their inflammatory functions.
BMDMs were differentiated from Sprague Dawley rat’s bone marrow with GM-CSF for 9 days, and the expression of CD200 and CD200R was measured by flow cytometry. The inflammatory response of BMDMs from wild type and CD200 knock-out rats (generated by our team) was measured after LPS stimulation. The expression of molecules associated with antigen presentation was quantified by flow cytometry. Cytokine secretion was measured by ELISA and phagocytosis activity was measured by a fluorescence assay with Pseudomonas aeruginosa.
BMDMs increased CD200 and CD200R expression during the differentiation process. The absence of CD200 altered the expression of antigen presentation molecules (MHCII, CD80 and CD86) during the differentiation, but did not modulate the phagocytosis function of BMDMs. In addition, CD200 KO BMDMs secreted lower levels of proinflammatory and anti-inflammatory cytokines following LPS exposition. These results are associated with a reduction of TLR-4 overexpression, the LPS receptor.
In conclusion, CD200 deficiency modulates the differentiation process of BMDMs and limits the expression of markers associated with pathogen-presentation and cytokines secretion. The implication of CD200 absence in pathogens response mechanism is still unknow but could include markers from the TLR-4 pathway.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vi
Liste des illustrations... viii
Liste des figures ... ix
Liste des tableaux ... x
Liste des abréviations ... xi
Remerciements ... xiii
Introduction ... 1
Immunité ... 1
Les cellules inflammatoires ... 3
Les macrophages pulmonaires ... 5
Développement des macrophages pulmonaires ... 6
Macrophages alvéolaires résidents ... 7
Macrophages infiltrants ... 8
Rôles des macrophages alvéolaires ... 10
Présentation d’antigènes ... 12
Phagocytose ... 13
Sécrétion de cytokines ... 14
Le CD200 et le CD200R ... 15
Localisation et structure ... 15
Le rôle du CD200 dans l’inflammation ... 16
Chapitre 1 : Hypothèse et objectifs ... 20
Chapitre 2 : Méthodologie ... 21 2.1. Modèle animal ... 21 2.2. Culture des BMDMs ... 21 2.3. Cytométrie en flux ... 22 2.4. ELISA ... 25 2.5. RT - qPCR ... 25 2.6. Phagocytose ... 26 2.7. Analyse statistique ... 27
Chapitre 3 : Résultats ... 28
Chapitre 4 : Discussion ... 49
Chapitre 5 : Perspective ... 56
Conclusion ... 58
Bibliographie ... 59
Annexe 1 : Analyse cytométrie de flux « jour 6 » et contrôles négatifs ... 63
Annexe 2 : BMDMs contrôles négatifs du « jour 9 » ... 64
Liste des illustrations
Illustration 1 : Voie de signalisation du LPS ... 2
Illustration 2 : Exemple d’infiltration cellulaire lors d’une infection pulmonaire ... 5
Illustration 3 : Origines des macrophages ... 6
Illustration 4 : Rôles des macrophages ... 11
Illustration 5 : Cytokines et chimiokines impliqués lors d’une infection ... 12
Liste des figures
Figure 1 : L’absence du CD200 diminue la prolifération des BMDMs. ... 34 Figure 2 : L’absence du CD200 diminue le nombre de BMDMs différenciés. ... 35 Figure 3 : Évolution de l’expression du CD200 lors de la différenciation des
BMDMs... 37 Figure 4 : L’absence du CD200 limite l’expression des marqueurs de costimulation et de présentation d’antigène lors de la différenciation des BMDMs. ... 38 Figure 5 : L’augmentation de l’expression du CD200R est indépendante de
l’absence de CD200 lors de différenciation des BMDMs. ... 41 Figure 6 : L’absence du CD200 diminue l’expression des marqueurs de
costimulation et de présentation d’antigène des BMDMs en réponse au LPS. ... 43 Figure 7 : L’expression du CD200R est indépendante de l’absence du CD200. ... 45 Figure 8 : Le CD200 n’influence pas les fonctions phagocytaires des macrophages. ... 46 Figure 9 : L’absence du CD200 inhibe la sécrétion de cytokines des BMDMs. ... 47 Figure 10 : L’expression du TLR-4 est influencée par l’absence du CD200. ... 48
Liste des tableaux
Tableau 1 : Clone, Concentration et dilution des anticorps utilisés pour la
Liste des abréviations
ADN : Acide désoxyribonucléiqueARNm : Acide ribonucléique messager
BMDM : Macrophage dérivé de la moelle osseuse CCL2 : Ligand de chimiokine 2 à motif C-C de type 2
CCR2 : Récepteur de CCL2 CD11b : Classe de différenciation 11 b CD11c : Classe de différenciation 11 c CD14 : Classe de différenciation 14 CD16 : Classe de différenciation 16 CD28 : Classe de différenciation 28 CD32 : Classe de différenciation 32 CD34 : Classe de différenciation 34 CD68 : Classe de différenciation 68 CD80 : Classe de différenciation 80 CD86 : Classe de différenciation 86 CD163 : Classe de différenciation 163 CD200 : Classe de différenciation 200 CD200R : Récepteur du CD200
CD200 KO : Rats Sprague Dawley déficients pour le CD200 CPA : Cellule présentatrice d’antigène
DC : Cellule dendritique DMSO : Diméthyle sulfoxide
DOK 1 / 2 : Protéine d’amarrage 1 / 2 EDTA : Éthylènediaminetétraacétique
ELISA : Méthodes immuno-enzymatiques ERK : Kinases réductrices extracellulaires FBS : Sérum de veau fœtal
GFP : Protéine de fluorescence verte IFN- : Interféron-
IL-1β : Interleukine 1β IL-6 : Interleukine 6
IL-10 : Interleukine 10
IL-18 : Interleukine 18
iNOS : Enzyme synthase de l’oxyde nitrique
ITIM: Immunorécepteur de motif tyrosine inhibiteur JNK : Protéine kinase c-Jun N-terminales
LBP : Protéine de liaison du lipopolyssacharide LPS : Lipopolyssacharide
LTB4 : Leucotriène B4
MA : Macrophages alvéolaires
MAP Kinase : Protéine Kinase à activation mitogène
M-CSF : Facteur de stimulation de colonie de macrophages MHCII : Molécule d’histocompatibilité de type 2
NF-κB : Facteur nucléaire kappa-B NK : Natural Killer
NKT : Lymphocyte T Natural Killer
NOD : Récepteur d’oligomérisation des nucléotides PAMP : Molécules associées aux pathogènes PBS : Tampon phosphate saline
PeCam1 : Molécule d’adhésion des cellules endothéliales plaquettaires PFA : Paraformaldéhyde
PRR : Récepteurs de reconnaissance de motifs moléculaires des pathogènes PTB : Domaine de liaison phosphotyrosine
RFU : Unité de fluorescence relative RIG-1 : Récepteurs de l’acide rétinoïque
RPMI : Roswell Park Memorial Institute Medium Sca1 : Antigen 1 des cellules souches
TCR : Récepteur de lymphocyte T
TGF-α : Facteur de croissance tissulaire TLR : Récepteur Toll-like
TNF : Facteur de nécrose tumorale TSB : Tryptone de soja
UV : Ultra-Violet
Remerciements
J’aimerais remercier mes directeurs de maîtrise Élyse Bissonnette et Jean-François Lauzon-Joset de m’avoir offert cette opportunité de travailler sous leur tutelle durant ces deux années. Merci d’avoir partagé votre abondance de connaissances et de conseils pratiques. Je remercie aussi mon tuteur, Dany Patoine, pour sa forte présence, son support et sa disponibilité pour répondre à mes nombreuses questions. Merci de m’avoir guidé depuis le début de mon stage jusqu’à la fin de ma maîtrise. De plus, je souligne la participation de mon ancien directeur de maîtrise, David Marsolais qui m’a épaulé durant les débuts et aidé à acquérir mes connaissances en cytométrie de flux. Merci aussi à toute son équipe, Pascale Blais-Lecours, Anne-Marie Lemay et Carole-Anne Huppé. Aussi je tiens à remercier Sylvie Pilote de m’avoir soutenue moralement durant tout ce processus, d’avoir été aussi à l’écoute et d'avoir été un support durant ce processus. Je remercie ma famille, mes proches et mon compagnon, Philippe Lavigne, d’avoir participé à ma réussite. Finalement, merci à mes petits qui m’ont fait comprendre que les macrophages ne sont en réalité que des soldats lançant des boules de feu aux bactéries.
Introduction
Immunité
Le poumon est un organe exposé en permanence à une multitude de pathogènes exogènes. Il est donc important de développer un système immunitaire compétent afin de défendre l’environnement pulmonaire contre une grande variété d’agents infectieux en tout temps. Il est nécessaire d’engendrer une réponse adaptée à chaque type de pathogènes. En effet, les poumons peuvent être infectés par des bactéries, des virus ou des parasites. Pour répondre à une infection, il existe une multitude de récepteurs à la surface des cellules qui reconnaissent différents récepteurs ou molécules particulières aux pathogènes. Ces récepteurs font partie de la famille des récepteurs de reconnaissance de motifs moléculaires des pathogènes (PRRs).1 Parmi cette famille, il y a les «Toll-like receptor » (TLRs), les
« nucleotide oligomerization receptors » (NODs), les récepteurs de lectine et les récepteurs de l’acide rétinoïque (RIG-1). Ces récepteurs se retrouvent en autres sur les macrophages.
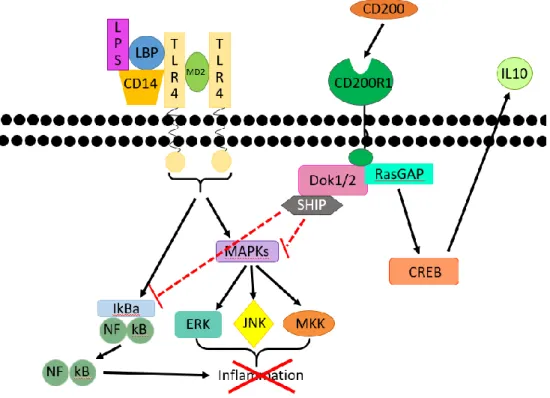
Dans le cas d’une infection bactérienne à Gram négative, une partie de la membrane externe des bactéries, les endotoxines ou lipopolyssacharide (LPS), engendre une très forte réponse inflammatoire lorsque reconnue par le TLR-4. Une stimulation du TLR-4 résulte en la formation d’un complexe immun impliquant la protéine de liaison du LPS (LBP) et la classe de différenciation (CD) 14 et engendre une activation des voies des « Mitogen-activated protein kinases » (MAP Kinases) qui contribue à la production de cytokines pro-inflammatoires (Illustration 1).
Illustration 1 : Voie de signalisation du LPS.
Le LPS est apporté à son récepteur le TLR-4 par le LBP. À l’aide de la protéine adaptatrice CD14 et le MD2, le TLR-4 est activé par son ligand et déclenche la cascade signalétique de la voie des MAP Kinases qui résultent en l’activation des kinases réductrices extracellulaires (ERK), des kinases c-Jun N-terminales (JNK) et des kinases mitogènes (MKK). Ces voies causent l’activation de facteurs de transcription qui mènent à l’expression de cytokines inflammatoires. De plus, cette voie de signalisation phosphoryle le « Nuclear factor-kappa B » (NF-κB), un facteur de transcription pro-inflammatoire puissant. Cette phosphorylation libère le NF-κB de sa protéine inhibitrice IκBα et induit la transcription de facteurs inflammatoires.2
L’activation du système immunitaire par un pathogène induit une réponse innée et adaptative. La réponse innée est la première ligne de défense. Elle est rapide, mais non-spécifique aux pathogènes. Elle induit une réponse inflammatoire, l’élimination des microbes ou cellules infectées et la réponse adaptative. Cette dernière prend plus de temps à s’instaurer, mais elle est spécifique au pathogène et implique une variété de cellules, dont les lymphocytes et induit une réponse mémoire. Au site d’infection, la réponse innée est principalement déclenchée par les macrophages.
médiateurs chimiques. De plus, l’activation des PRRs à la surface des macrophages induit la sécrétion d’agents inflammatoires, tels les cytokines, les chimiokines et les médiateurs lipidiques, qui induisent l’infiltration leucocytaire et l’initiation d’une forte attraction de neutrophiles. Ces molécules vont également recruter des monocytes et des macrophages au site d’inflammation pour éliminer le pathogène par phagocytose.3 Suite à la reconnaissance du pathogène, les cellules présentatrices
d’antigènes (CPAs), comme les macrophages et les cellules dendritiques (DCs) migrent dans les ganglions lymphatiques secondaires pour présenter l’antigène aux lymphocytes T.4 La combinaison de la présentation d’antigènes, l’activation des
marqueurs de costimulation et la stimulation par des cytokines et chimiokines inflammatoires induisent l’activation et la migration des lymphocytes T aux poumons pour répondre de façon plus spécifique aux pathogènes.5 En résumé, les
macrophages sont des cellules centrales de la réponse innée grâce à leur éventail de fonctions diversifiées. La réponse innée des macrophages sera donc le sujet principal de ce mémoire.
Les cellules inflammatoires
Les endotoxines à la surface des bactéries peuvent activer directement les macrophages pulmonaires, cellules de première ligne de défense, qui sécrètent des molécules pro-inflammatoires stimulant une variété de cellules immunitaires. Chaque cellule de l’immunité innée a un rôle particulier à remplir pour l’élimination du pathogène aux poumons. En effet, une infection par exemple par P. aeruginosa cause une production de multiples cytokines et de chimiokines pro-inflammatoires par les macrophages environnants qui causent le recrutement de neutrophiles.6 Les
neutrophiles sont des granulocytes polynucléaires qui ont pour rôle d’éliminer le pathogène (Illustration 2). Ils sont les premiers leucocytes à être recrutés. L’absence de neutrophiles lors d’une infection à Pseudomonas aeruginosa engendre la mortalité de tous les sujets infectés.7 Les neutrophiles sont considérés
l’oxygène et de cytokines incluant le facteur de nécrose tumorale (TNF).8 Ils sont
aussi d’excellents phagocytes permettant l’élimination des bactéries.9
Les antigènes bactériens sont reconnus par des CPAs comme les DCs. Les DCs sont des cellules immunitaires hématopoïétiques résidantes des tissus, principalement retrouvées dans les muqueuses et les organes lymphoïdes secondaires. Dans le poumon, ces cellules se retrouvent normalement sous les cellules épithéliales d’où elles étirent leurs dendrites entre les cellules épithéliales (Illustration 2).10 Leur rôle principal est de former un réseau de surveillance contre
les pathogènes étrangers, dans le but d’activer les lymphocytes spécifiques à l’antigène détecté. Une fois l’antigène capturé, les DCs augmentent l’expression d’autres protéines de surface, tel le CD80, le CD86 et la molécule d’histocompatibilité de type 2 (MHCII).11 L’expression de ces marqueurs combinée
à la présentation de l’antigène permet d’activer les lymphocytes T et d’initier l’immunité adaptative. Par contre, ce volet ne sera pas élaboré dans ce mémoire qui se concentre sur la réponse innée dont le recrutement des macrophages.
Un type cellulaire très important pour réguler l’inflammation pulmonaire est le macrophage alvéolaire qui est une cellule présente autant lors d’une infection que lors de condition homéostatique.12 Son rôle principal est de participer à l’initiation et
à la résolution de l’inflammation.12 Sa présence est nécessaire au recrutement des
neutrophiles comme précédemment expliqué.13 De plus, les macrophages
alvéolaires travaillent de concert avec les DCs pour l’apprêtement et la présentation d’antigènes afin d’activer l’immunité adaptative.13 Les macrophages sont des
cellules sentinelles nécessaires pour engendrer les réponses innées et adaptatives à l’infection.13 Comme il existe différents types de macrophages dépendamment de
Illustration 2 : Exemple d’infiltration cellulaire lors d’une infection pulmonaire.14
En condition d’homéostasie, les cellules prédominantes sont les macrophages et les DCs. En condition d’infection, il y a une forte infiltration de neutrophiles. Une infiltration de lymphocytes T cytotoxiques est remarquée ainsi qu’une forte augmentation de la présence de macrophages et DCs dans le but d’éliminer le pathogène.
Les macrophages pulmonaires
Il existe trois types de macrophages résidants dans les poumons soit les macrophages alvéolaires, les macrophages interstitiels et les macrophages vasculaires.15 Les macrophages alvéolaires sont résidants des alvéoles pulmonaires
ainsi que des voies aériennes et sont le type le plus facilement accessible pour les études scientifiques. Ceux-ci sont facilement extraits des poumons à l’aide d’un lavage bronchoalvéolaire qui permet d’échantillonner l’espace alvéolaire.16 Pour
cette raison, les données retrouvées dans la littérature portent principalement sur les macrophages alvéolaires. Lors d’une infection, des macrophages inflammatoires s’infiltrent en grand nombre dans les poumons pour répondre de concert avec les macrophages résidants.3 Les macrophages inflammatoires s’adaptent au milieu
la même origine de développement que les trois types de macrophages résidants en permanence aux poumons.17
Développement des macrophages pulmonaires
L’origine de différenciation des macrophages pulmonaires peut varier (Illustration 3). Lors d’une infection, il y a une infiltration de macrophages inflammatoires pour répondre à l’infection. Ils sont peu présents en temps normal et perdurent peu de temps dans le milieu. Les deux types de macrophages se différentient principalement par leur lieu d’origine (Illustration 3). Les macrophages dits « résidants » proviennent du sac vitellin au stade prénatal et du foie fœtal.18 Les
macrophages dits « infiltrants » proviennent de la moelle osseuse et se différencient en monocytes avant de devenir des macrophages et d’être activés lors d’infections.18
Illustration 3 : Origines des macrophages.
Les macrophages résidants proviennent du sac vitellin et du foie fœtal. Les macrophages résidants deviennent spécialisés à leur lieu de résidence. Les macrophages infiltrants sont d’origines postnatales et proviennent de la moelle osseuse. Les cellules hématopoïétiques se différencient en monocytes avant de se différencier en macrophages.19
Macrophages alvéolaires résidants
Durant l’ontogenèse, des macrophages se trouvent dans le sac vitellin de l’embryon humain ou animal avant l’initiation de l’hématopoïèse et avant que des monocytes puissent être détectés dans le sang fœtal (Illustration 3).6 À ce stade, les
macrophages de souris sont dits « immatures » dû à leur faible activité phagocytaire et à leur faible expression d’un marqueur typique de macrophage le F4/80, une molécule d’adhésion qui sert aussi à l’induction des lymphocyte T CD8.6,20 Une fois
rendus au stade fœtal du développement, les macrophages sont plus différentiés et ont des caractéristiques similaires aux macrophages tissulaires observés chez les adultes.21 Durant le développement du fœtus, les macrophages immatures migrent
du sac vitellin au futur site des organes et se développent en macrophages résidants de l’organe ou du tissu. Chez la souris, ils se définissent par une expression accrue des marqueurs de macrophages F4/80 et CD11b/c.21 Le CD11b et le CD11c sont
des intégrines servant à l’adhésion leucocytaire.22 Ils expriment aussi le CD163, un
récepteur scavenger («détrivore») servant à l’élimination de complexe hémoglobine-haptoglobine.23Après la naissance et tout au cours de la vie, un faible pourcentage
de macrophages résidants d’origines prénatales sont remplacés par des macrophages dérivés de la moelle osseuse. Les poumons sont particulièrement affectés par ce remplacement mineur de cellules.6 L’érosion des muqueuses et
l’apoptose naturelle des macrophages résidants causent un remplacement mineur de ces cellules d’origines prénatales par des macrophages d’origines postnatales. Par contre, de récentes études ont prouvé que les macrophages résidants ont la capacité de cesser leur sénescence et reprendre leur cycle cellulaire afin de maintenir leur nombre par une prolifération locale des cellules suite à une inflammation.6,22 C’est pour cette raison que cette population d’origine embryonnaire
perdure dans le temps sans être remplacée par des macrophages dérivés de la moelle osseuse. Par contre, leur nombre ne peuvent augmenter pour répondre à une infection. Il est nécessaire d’avoir une infiltration de macrophages non résidants afin de répondre à l’inflammation causée par les infections.
Macrophages infiltrants
Les macrophages dits inflammatoires ou infiltrants sont des macrophages dérivés de la moelle osseuse (BMDMs). Plus précisément, des cellules souches hématopoïétiques se différencient en une lignée de précurseurs myéloïdes qui se différencie en monocytes (Illustration 3), ainsi qu’en neutrophiles et en DCs.24,25 Les
précurseurs sont définis comme ayant une faible expression CD34 à leur surface et une forte expression de l’antigène 1 des cellules souches (Sca1) chez l’humain.26
Les précurseurs myéloïdes se différentient en progéniteur de granulocyte et monocyte et expriment fortement à ce stade le CD34, le CD16 et le CD14 et n’expriment plus de Sca1 chez l’humain.26,25 Le CD34 est une sialomucine et CD16
un récepteur de la partie constante Fc des immunoglobulines. Le CD14, quant à lui, est un corécepteur du TLR-4 pour le LPS.
Les monocytes sortants de la moelle osseuse se retrouvent dans la circulation sanguine et représentent 5 à 10% des leucocytes circulants chez l’humain.24 Les
monocytes sont recrutés à des sites d’inflammation par des stimuli inflammatoires tels TNF, l’interleukine 1β (IL-1β), l’IL-6 et l’IL-18.18 Pour sortir de la circulation
sanguine et entrer au site d’inflammation, les monocytes ont de multiples mécanismes d’adhésion qui régulent leur migration. Certaines chimiokines, tels le ligand de chimiokine 2 (CCL2) et la leucotriène B4 (LTB4), sont libérées près du site
d’inflammation pour activer leurs récepteurs couplés aux protéines GTP-ase. Ces dernières recrutent et activent une protéine intracellulaire, la taline, qui aide à l’adhésion des monocytes à l’endothélium sanguin.26 Une fois les monocytes
adhérés à la surface de l’endothélium sanguin, de multiples processus s’enclenchent pour permettre l’attachement et la migration à travers l’endothélium afin de se rendre au site d’infection du poumon.26 À ce stade, les monocytes
augmentent leur expression de CD11b, CD11c et « Platelet endothelial cell adhesion molecule » (PeCam1) afin de faciliter la migration.
Une fois l’endothélium sanguin traversé, la présence de cytokines (TNF, IL-1β, IL-6) additionnée à la présence de facteur de stimulation de colonie de macrophages (M-CSF) et de GM-CSF, enclenche une différenciation des monocytes en macrophages inflammatoires. Le M-CSF et le GM-CSF sont des facteurs de croissance pour les phagocytes mononucléaires et des régulateurs de différentiation, de prolifération et de survie pour les macrophages.27Les cellules inflammatoires recrutées répondent à l’inflammation en concert avec les macrophages résidants.28 À ce stade, les
macrophages inflammatoires murins n’expriment plus le récepteur de chimiokines de type 2 (CCR2), le récepteur du CCL2, mais continuent d’exprimer le CD11b. L’expression du MHCII, qui est une molécule de surface présentatrice d’antigènes, augmente suite à la différenciation en macrophage afin d’activer les lymphocytes T. La présence de M-CSF et de GM-CSF induit l’expression à la surface des macrophages de la protéine régulatrice du signal alpha (SIRPα), une molécule associée à la maturation des BMDMs. De plus, les macrophages inflammatoires augmentent leur expression de molécules de costimulation associées à la présentation d’antigène : le CD80 et le CD86. Une fois activés, les macrophages expriment le CD68, une glycoprotéine retrouvée sur la membrane lysosomale qui est essentielle pour l’activité phagocytaire des cellules.23
À l’opposé des macrophages résidants, les macrophages inflammatoires n’ont pas la capacité de proliférer et ont une courte durée de vie. Une fois l’infection contrôlée, les macrophages inflammatoires enclenchent leur mort cellulaire ou se polarisent en macrophages anti-inflammatoires qui promeuvent la réparation tissulaire et la sécrétion de cytokines anti-inflammatoires.29 Ce mécanisme permet la résolution de
l’inflammation ainsi que la diminution de cellules immunitaires inflammatoires au site d’infection. Ce changement phénotypique des macrophages est causé par la présence de plusieurs cytokines et facteurs endogènes ainsi que l’arrivée de lymphocytes T régulateurs dans l’environnement inflammatoire.29 Entre autre, lors
de la phase de résolution, il y a une diminution de la présence d’IFN- et de TNF et une augmentation de la présence d’IL-10.29 Les macrophages phagocytent alors les
cellules mortes en plus des débris. Une fois la résolution terminée, les macrophages entrent en phase apoptotique pour retourner aux conditions homéostatiques normales.
Rôles des macrophages alvéolaires
Dans les poumons, le macrophage constitue l’un des premiers mécanismes de défense cellulaire contre les agents pathogènes. Le rôle principal du macrophage est de maintenir l’homéostasie, tout en initiant et résolvant l’inflammation. Les macrophages ont une plasticité immune et ont l’agilité de s’adapter au milieu environnant.1 Les phénotypes des macrophages sont déterminés par leur
environnement et déterminent l’implication du macrophage dans l’homéostasie ou dans la défense de l’hôte. Selon la situation, le macrophage peut se polariser en macrophages pro- ou anti-inflammatoires. Cette polarisation engendre une différence dans les fonctions des macrophages afin de répondre aux stimuli initiaux. Les macrophages ont plusieurs fonctions très variées les unes des autres (Illustration 4). Au début d’une infection ou d’une inflammation, les fonctions principalement actives chez les macrophages sont la présentation d’antigène, la phagocytose et la sécrétion de cytokines et de chimiokines (Illustration 5). Ces trois fonctions seront expliquées plus en détail dans les paragraphes à venir.
Illustration 4 : Rôles des macrophages.
Les macrophages ont plusieurs rôles dans le but d’initier ou de résoudre une inflammation. En effet, les cellules peuvent faire de la présentation d’antigène, de l’endocytose, de la phagocytose et de la sécrétion de cytokines et chimiokines. Les macrophages ont aussi des capacités antimicrobiennes et de réparation tissulaire.30
Également, les macrophages ont aussi des actions antimicrobiennes afin de répondre à l’infection (Illustration 4). En plus de la phagocytose, les macrophages sont aussi capables d’endocytose, un procédé similaire à la phagocytose, mais qui est récepteur dépendant et ne fait entrer que des molécules au lieu d’un pathogène complet (Illustration 4). Lors de la résolution de l’inflammation, les macrophages se polarisent en un profil plutôt anti-inflammatoire. Une fonction qui émerge de cette polarisation est la réparation tissulaire (Illustration 4). Par exemple, lors de la résolution de l’inflammation aux poumons, les macrophages sécrètent du Fas-ligand qui activent l’apoptose des neutrophiles. Cette apoptose est la première étape clé à la résolution de l’inflammation.31 La sécrétion de facteur de croissance tissulaire
(TGF-β) par les macrophages alvéolaires permet le début de la réparation tissulaire et le remplacement des cellules endommagées (Illustration 5).31
Illustration 5 : Cytokines et chimiokines impliqués lors d’une infection.31
L’activation des macrophages, par la présence d’un pathogène, induit la libération de plusieurs cytokines et chimiokines ayant des rôles variés. Les principaux médiateurs chimiques impliqués dans la réponse aux infections induisent de l’inflammation, un recrutement de neutrophiles et l’activation de lymphocytes T. Par contre, les macrophages sécrètent aussi de l’IL-10 et du TGF-β afin de contrôler l’inflammation.
Présentation d’antigènes
La présentation d’antigènes est une fonction peu active en condition homéostatique et qui est plutôt associée aux macrophages infiltrants et aux cellules dendritiques lors de l’infection. Les macrophages détectent les pathogènes par la reconnaissance de « pathogen-associated molecules » (PAMPs), tels les flagellines ou le lipopolyssaccharide (LPS) à l’aide des PRRs.1 Les particules captées par les
macrophages peuvent être internalisées par phagocytose ou pinocytose.32 La
phagocytose est un processus d’internalisation de plus grosses particules ou des microbes entiers. La pinocytose, quant à elle, est un mécanisme d’internalisation de milieu extracellulaire qui agit sans spécificité. Ces deux procédés créent une vésicule à l’intérieur de la cellule. La vésicule fusionne avec un lysosome afin de digérer les protéines et molécules captées. Les antigènes captés par les
ici, voir référence33) afin d’être présentés à la surface de la cellule. Les antigènes
apprêtés sont ensuite liés au MHC qui se trouve à l’intérieur d’une vésicule qui sera exprimée à la surface de la cellule.32 Il existe deux types de MHC, le type I lie des
antigènes de provenance endogène/intracellulaire alors que le type 2 présente des antigènes exogènes/extracellulaires. Le complexe MHCII-antigène est reconnu par le lymphocyte T à l’aide du récepteur de lymphocyte T (TCR). Par contre, le MHCII n’a pas la capacité d’enclencher une reconnaisse immunitaire de l’antigène seul. Il est nécessaire d’avoir l’expression de molécules de costimulation CD80 et CD86. Le blocage d’une ou des deux molécules à l’aide d’anticorps a montré une faible activation de lymphocytes T lors de la présentation d’antigènes due à une inhibition de l’activation du CD28, le récepteur du CD80 et CD86.34 Ces deux molécules sont
donc essentielles à l’activation des lymphocytes T pour engendrer une réponse immune.
Phagocytose
Les macrophages sont aussi d’excellents phagocytes. La phagocytose est le mécanisme majeur pour l’élimination de pathogènes, de cellules apoptotiques ou mortes ou de débris cellulaires ou bactériens.35 Les cellules utilisant la phagocytose
peuvent internaliser des particules plus grandes que 0,5 µm dans leur phagosome. La phagocytose est activée par la reconnaisse des pathogènes à l’aide des PRRs. Les principaux récepteurs inclus le CD14 et les TLRs qui reconnaissent par exemple le LPS.35 Une fois la reconnaissance du pathogène par les PRRs effectuée, le
microorganisme est internalisé et forme une vacuole qui devient un phagosome précoce. La maturation du phagosome se fait par la fusion et fission de ce dernier avec des endosomes et lysosomes du cytosol.35 Graduellement, le phagosome
s’acidifie et crée un milieu oxydatif et optimal à la dégradation du pathogène. La fusion de la vésicule avec un lysosome permet l’apport d’hydrolase et d’enzyme de dégradation. Suite à la dégradation du pathogène, des protéines antigéniques sont récupérées par le macrophage afin d’en faire l’apprêtement et les présenter via le
MHCII à la surface de la cellule pour reconnaissance par les lymphocytes T. En condition homéostatique, l’activité phagocytaire est très faible, mais en présence de LPS l’activité phagocytaire des macrophages est augmentée.
Sécrétion de cytokines
En condition d’homéostasie, les macrophages sécrètent de faibles quantités de cytokines anti-inflammatoires tel l’IL-10 dans le but de maintenir l’équilibre dans le milieu (Illustration 5). L’IL-10 module les fonctions inflammatoires des cellules. Cette cytokine réduit la présentation d’antigène et renforce la protection cellulaire en plus de moduler la production de cytokines en limitant la sécrétion de cytokines pro-inflammatoires.36 Par contre, lors d’une infection, la stimulation par le pathogène
surpasse l’inhibition causée par l’IL-10 et les macrophages répondent aux pathogènes en libérant de forte quantité de plusieurs médiateurs (Illustration 5). Par exemple, les macrophages inflammatoires stimulés par un extrait de
Staphylococcus epidermidis sécrètent des niveaux élevés d’IL-1β, d’IL-6 et de
TNF.37 L’IL-6 est une cytokine qui promeut la différenciation des lymphocytes T ce
qui lui confère un rôle important de lien entre l’immunité adaptative et innée.38 Le
TNF est une cytokine impliquée dans l’inflammation systémique et est responsable de la phase aigüe de la réaction inflammatoire.39 Cette cytokine a plusieurs rôles
biologiques dont un rôle dans la croissance, la prolifération, l’expression de molécules d’adhésion et l’expression de molécules pyrogènes tel l’IL-1β et l’IL-6.39,40
L’activation du TLR-4 par le LPS provenant d’E. coli cause aussi la libération de ces cytokines pro- et anti-inflammatoires.41 Les macrophages ont comme rôle d’initier et
de contrôler l’inflammation lors d’infection. Les niveaux de sécrétion d’IL-10 sont augmentés par ces cellules suite à une stimulation au LPS. Mise à part la sécrétion d’IL-10 pour contrôler l’inflammation, il existe d’autres mécanismes pour réduire l’inflammation. Par exemple, certaines chimiokines, tel le CX3CL1, sont sécrétées par les macrophages dans le but de contrôler l’inflammation.42 Les chimiokines les
rôle le recrutement massif de neutrophiles.43 Il y a aussi des protéines à la surface
des macrophages, comme le CD200, qui participent à la résolution de l’inflammation. Cette molécule est l’objet principal de ce mémoire.
Le CD200 et le CD200R
Le CD200 est une immunoglobuline transmembranaire qui a des effets immunomodulateurs, lorsque liée à son récepteur, le récepteur du CD200 (CD200R). Cette voie immunorégulatrice joue un rôle important dans la résolution de l’inflammation.
Localisation et structure
Le CD200 est présent à la surface plusieurs types cellulaires, dont les cellules myéloïdes (mastocytes, neutrophiles, macrophages, DCs, éosinophiles), les cellules lymphoïdes (lymphocytes T et B) et les cellules non hématocytaires telles que les neurones, les cardiomyocytes, les cellules endothéliales et épithéliales, les trophoblastes et les kératinocytes.44 Anciennement appelé OX-2, le CD200 est une
glycoprotéine transmembranaire de type I immunorégulatrice faisant partie de la superfamille des immunoglobulines.45 Son domaine extracellulaire possède deux
sous-domaines immunoglobulines qui ont un arrangement typique V/C2.45 Par
contre, son domaine intracellulaire C terminal est trop court pour enclencher un signal de transduction.44,45 Le CD200 est une molécule qui est structurellement liée
aux molécules de costimulation, CD80 et CD86.46 De plus, cette protéine est une
molécule fortement conservée d’une espèce à une autre.
Le récepteur du CD200, le CD200R, est, pour sa part, présent exclusivement sur les cellules myéloïdes. Sa structure moléculaire est structurellement semblable à celle du CD200. Ce récepteur se trouve sur le même chromosome que son ligand et
l’homologie dans leur séquence d’ADN suggère qu’ils ont évolué ensemble par duplication (une mutation génétique qui se définit par le doublement d’une séquence d’ADN) et que ceux-ci proviendraient du même précurseur.45 Contrairement au
CD200, le CD200R possède un domaine cytoplasmique contenant 3 résidus tyrosine pouvant être phosphorylés. À l’opposé des autres récepteurs inhibiteurs faisant partie de la famille des « immunoreceptor tyrosine-based inhibitory motif » (ITIM), le CD200R contient une séquence NYXY dans son domaine cytoplasmique qui est reconnu pour recruter des protéines avec un domaine de liaison phosphotyrosine (PTB). 38,47,48 La séquence NYXY comporte trois résidus tyrosine
rapidement phosphorylables qui recrutent une des protéines adaptatrices, la protéine d’amarrage 1 ou 2 (Dok1 ou Dok2), qui sont des PTB servant de médiateur de signal de transduction.47,48 Le CD200R peut se retrouver sous plusieurs
isoformes chez la souris. En effet, la souris comporte quatre isoformes différents (CD200R1-4) du CD200R dont certains de ceux-ci ont des fonctions pro-inflammatoires et d’autres des fonctions anti-pro-inflammatoires.48 Ces isoformes n’ont
pas tous la même affinité avec le CD200 et donnent des intensités de réponses aux pathogènes ou aux maladies différentes.49 Par contre, l’humain et le rat n’ont qu’un
seul isoforme dans leur organisme et ont le même isoforme : le CD200R1. Cette similitude entre l’humain et le rat indique que ce dernier serait un meilleur modèle pour étudier le rôle du CD200 évitant toute variabilité dans la réponse inflammatoire causé par les multiples isoformes de son récepteur.
Le rôle du CD200 dans l’inflammation
Plusieurs études prouvent que la voie du CD200/CD200R a une activité inhibitrice au sein du système immunitaire.50 Ces glycoprotéines jouent un rôle clé pour le
maintien de l’homéostasie et la diminution de la réponse inflammatoire en réponse aux stimuli (pathogènes, allergènes, dommages tissulaires, etc.).50 Il a été observé
l’apoptose cellulaire).44,51 De plus, le CD200 augmente en réponse à une exposition
au Staphylococcus aureus dans le but d’inhiber l’inflammation.44 En contrepartie, de
faibles taux de CD200 sont associés à certaines pathologies comme l’arthrite rhumatoïde, les dégénérescences neurologiques, le Parkinson et l’endométriose.52– 54
Le CD200 est une molécule immunorégulatrice dont l’influence a été étudiée dans le contexte de plusieurs pathologies. La littérature montre deux méthodes utilisées pour étudier l’impact de la voie du CD200 / CD200R sur les fonctions inflammatoires, soit par addition d’un agoniste du récepteur du CD200 (CD200-Fc, aptamères, anticorps stimulants) ou par sa délétion (CD200 KO, CD200R KO et anticorps bloquants). Premièrement, les études par addition montrent que l’interaction entre le CD200 et son récepteur, CD200R1, a un rôle immunosuppresseur en inhibant les réactions inflammatoires des maladies inflammatoires chroniques ou des évènements traumatiques qui causent de l’inflammation aigue.45,50 En effet, une
administration de CD200-Fc (la molécule recombinante du CD200 joint à la section Fc de l’immunoglobuline IgG1) à des cellules microgliales de rat diminue
l’inflammation induite par la voie du TLR-4 en réponse au LPS en diminuant la sécrétion de TNF en plus d’augmenter la sécrétion d’IL-10.55,56 (Illustration 6)
Illustration 6 : Interaction de la voie du CD200 / CD200R avec la voie du TLR-4.50
Le CD200R, activé par son ligand, engendre une cascade de signalisation qui inhibe la voie des MAPKs ainsi que la libération de NfκB au noyau. Cette inhibition induit une diminution de l’inflammation qui peut se décrire par une diminution de la libération de TNF et d’IL-6. De plus, la voie de signalisation du C200 / CD200R induit la libération de CREB au noyau qui induit la production d’IL-10 : une cytokine anti-inflammatoire.
Il a aussi été montré qu’une administration de CD200 augmente la phagocytose de microparticules fluorescentes chez des BMDMs de souris.56 Notre laboratoire a
également démontré que dans un modèle d’asthme chez le rat, l’administration de CD200-Fc augmente les niveaux d’IL-10 et diminue la sécrétion d’IL-13 ainsi que l’hyperréactivité bronchique.57 Des conclusions similaires ont été observées dans
les études par délétion du CD200 / CD200R. En effet, ces études prouvent que, dans un contexte inflammatoire, l’inhibition ou l’absence du CD200 augmente l’infiltration de leucocytes ainsi que la production de cytokines et chimiokines.58
De plus, une forte expression en CD200 induit une inhibition de la phagocytose chez des patientes atteintes d’endométriose.53 Dans un cas de neurodégénérescence de
microglie en culture, il a été remarqué que la diminution d’expression de CD200 était associée à une augmentation de l’expression de MHCII.59 Une corrélation a aussi
été montrée entre l’absence de CD200 et la suppression de costimulation dans des cas d’allogreffes et de rejet de greffons.46 Cette revue de littérature supporte que le
CD200 a des effets anti-inflammatoires et ceci fut prouvé autant en supplémentation qu’en délétion du CD200 dans divers contextes inflammatoires.
En revanche, ces études ont été faites majoritairement chez la souris. Comme dit précédemment, la souris comporte quatre isoformes différents du CD200R. Ces études ne prenaient pas en considération les isoformes du C200R qui sont encore peu étudiés et qui peuvent même avoir des effets proinflammatoires dépendamment de l’isoforme.60 Cette ambiguïté complique l’interprétation des résultats de ces
études. Étant donné que le rat est le seul modèle d’étude qui comporte le même isoforme que l’humain, il est donc crucial d’observer l’influence du CD200 chez le rat plutôt que la souris. De plus, un nouveau modèle de rat déficient pour le CD200 a été récemment généré dans notre laboratoire. L’influence de la délétion du CD200 pourra être étudiée sur la différenciation des BMDMs en macrophages inflammatoires issus de ce nouveau modèle.
Chapitre 1 : Hypothèse et objectifs
L’implication du macrophage dans les pathologies inflammatoires est souvent sous-estimée. Il a été démontré par notre laboratoire que les fonctions immuno-régulatrices des macrophages alvéolaires étaient déficientes dans l’asthme.61 De
plus, il existe de nombreuses évidences démontrant l’importance du CD200 et de son récepteur dans le contrôle et la réduction de l’inflammation. En autre, notre laboratoire a démontré que l’activation du CD200R diminue la réponse inflammatoire dans un modèle d’asthme.57 Ces deux études portent à croire que la présence du
CD200 sur les macrophages est nécessaire au contrôle de l’inflammation. L’importance de ce rôle du CD200 a mené à l’hypothèse que l’absence du CD200 augmente les fonctions inflammatoires des BMDMs ce qui pourrait être causé par une modulation de la différenciation des BMDMs. Cette hypothèse se divise en trois volets. L’absence du CD200 : augmente l’expression de marqueurs de différenciation et d’activation des BMDMs; augmente la sécrétion de cytokines des BMDMs en contexte inflammatoire; et diminue la phagocytose des BMDMs.
Afin de répondre à ces hypothèses, l’expression du CD200 a été caractérisée sur les BMDMs lors de leur différenciation et activation. L’impact de l’absence du CD200 a été étudié sur des marqueurs de différenciation et des marqueurs d’activation suite à une stimulation au LPS. De plus, l’impact de l’absence du CD200 a aussi été étudié sur la phagocytose et la sécrétion de cytokines après une exposition au LPS.
Chapitre 2 : Méthodologie
2.1. Modèle animal
Des rats mâles Sprague Dawley âgés de 70 à 150 jours ont été obtenus chez Charles River (Charles River, Wilmington, Massachusetts, États-Unis). Les rats déficients en CD200 (Knock-Out CD200 ; CD200 KO) ont été générés au Centre hospitalier Universitaire de Montréal (CHUM, Montréal, Québec, Canada). Les rats ont été hébergés en cages ventilées dans un environnement exempt de virus et pathogène à l’animalerie du CRIUCPQ. Les animaux ont vécu sous un cycle de 12 heures de lumière et noirceur et l’eau ainsi que la nourriture étaient distribuées ad
libitum. Le protocole a été approuvé par le comité d’éthique de l’Université Laval en
concordance avec le « Guide du conseil Canadien de protection des animaux ».
2.2. Culture des BMDMs
Des rats Sprague Dawley sauvages (WT) ou déficients pour le CD200 (CD200 KO) ont été euthanasiés par injection intrapéritonéale d’un mélange de kétamine (NarketanTM, Vétoquinol Prolab, Princeville, Québec, Canada) et de xylazine
(RompunTM, Bayer, Mississauga, Ontario, Canada). Les fémurs ont été extraits
selon les méthodes standards puis désinfectés à l’éthanol 70% durant 5 minutes et rincés au PBS. La moelle osseuse a été extraite à l’aide d’une seringue 20 G et récupérée dans 50 mL de PBS. Les cellules ont été centrifugées pendant 5 minutes à 500 G à 4°C et resuspendues dans 4 mL de tampon de lyse d’érythrocyte (100 mM NaHCO3 + 1,5 M NH4Cl + 10 mM EDTA disodium). La réaction a été arrêtée
après 4 minutes avec 30 mL de PBS. Par la suite, les cellules ont été filtrées à l’aide de filtres cellulaires 70 µM (VWR International, Mississauga, Ontario, Canada) et centrifugées à nouveau pour être resuspendues dans 10 mL de FBS. Les cellules souches ont été comptées au bleu trypan et congelées dans du FBS additionné de
10 % de Diméthyle sulfoxide (DMSO, Sigma-Aldrich, Oakville, Ontario, Canada) à une concentration entre 10 et 20 millions de cellules par mL.
Les cellules ont été décongelées puis resuspendues dans du RPMI (VWR) supplémenté avec 10 % de FBS et 1 % d’antibiotique/antimycotique (Wisent BioProducts) avant d’être centrifugées durant 5 minutes à 4°C. Les cellules ont été mises dans 10 mL de RMPI complet et ont été comptées. Le volume a été ajusté afin d’obtenir une concentration de 2 millions de cellules par mL. Ensuite, 6 millions de cellules par puits dans des plaques de cultures ont été incubées dans un milieu supplémenté avec 20 ng/mL de GM-CSF (Preprotech, Rocky Hill, Connecticut) pour 6 jours à 37°C avec 5% de CO2. Le milieu supplémenté avec du GM-CSF 20 ng/mL
a été changé après 6 jours et les cellules ont été incubées durant 2 jours supplémentaires. Au jour 8, le milieu a été changé et les cellules ont été stimulées durant 24 heures avec du LPS 10 ng/mL (Sigma Aldrich) ou avec du PBS. Au jour 9, le surnageant a été récupéré pour mesurer les cytokines par ELISA et congelées à -20°C pour des analyses futures (voir section 2.4). Les cellules ont été trypsinisées (Trypsin 1X + 0.25% EDTA, Wisent Bioproducts) pour analyse par cytométrie en flux (voir section 2.3) ou pour essai de phagocytose (voir section 2.6).
2.3. Cytométrie en flux
Une fois les BMDMs trypsinisés, ils ont été resuspendus une fois avec du Staining
Buffer (PBS + 1% FBS) et centrifugés à 500 G à 4°C durant 5 minutes dans une
plaque 96 puits à fond conique (Corning, New York, New York, États-Unis). Les cellules ont été resuspendues dans 25 µL de Staining Buffer supplémenté d’anticorps anti-CD32 (pour bloquer les récepteurs Fc) (Tableau 1) et incubées sur glace 5 minutes. Ensuite, il est ajouté aux cellules 25 µL d’anticorps primaire dilué dans du Staining Buffer (Tableau 1). Des marquages uniques ont été faits pour
anti-MHCII, anti-SIRPα, anti-CD200, anti-CD200R (Tableau 1) durant 30 minutes avant d’être lavées deux fois avec du Staining Buffer et centrifugées entre chaque lavage 5 minutes à 500 G et 4°C. De la streptavidine (Tableau 1) a été ajoutée au marquage CD200R durant 20 minutes et lavée avec du Staining Buffer deux fois avant de resuspendre les cellules dans 200 µL de PBS. Les cellules ont été analysées par cytométrie en flux sur l’appareil LSRFortessa (BD, San Jose, Californie, États-Unis) avec le logiciel FACSDiva Software V.7.0 (BD). Les données ont été analysées à l’aide du logiciel FlowJo V.10.6.1 (BD). Un exemple d’analyse est illustré en annexe 1.
Tableau 1 : Clone, Concentration et dilution des anticorps utilisés pour la cytométrie.
Anticorps Compagnie Clone Concentration du produit Dilution utilisée « Purified mouse »Anti-rat CD32 BD D34-485 0,5 mg/mL 1/400 BV786 « Mouse »Anti-rat CD80 (B7-1) BD 3H5 0,2 mg/mL 1/200 CD86-PE Vio 770 Rat Miltenyi Biotech 24F 30 µg/mL 1/10 PerCP « Mouse » Anti-rat RT1B (MHCII) Biolegend OX-6 0,2 mg/mL 1/200 BV605 « Mouse »Anti-rat CD172 (SIRPα) BD OX-41 0,2 mg/mL 1/200
PE Anti-rat CD200 Biolegend OX-2 0,2 mg/mL 1/200 Biotin Anti-rat CD200R Biolegend OX-102 0,45 mg/mL 1/200 Streptavidin APC/Cy7 Biolegend - 0,2 mg/mL 1/400
2.4. ELISA
Les surnageants précédemment récupérés ont été décongelés sur glace. Des méthodes immuno-enzymatiques (ELISA) pour les cytokines TNF, IL-6 et IL-10 ont été effectuées avec les Duoset (R&D, Minneapolis, Minnesota, États-Unis) selon les directives du manufacturier. Les échantillons ont été préalablement dilués. Pour l’ELISA de TNF les surnageants ont été dilués 10 fois pour la stimulation de LPS 10 ng/mL et 5 fois pour le contrôle. Les surnageants pour l’ELISA d’IL-6 ont été dilués 5 fois pour la stimulation de LPS 10 ng/mL et 2 fois pour le contrôle alors que les surnageants pour l’ELISA d’IL-10 n’ont pas été dilués. La densité optique a été mesurée avec le lecteur de plaque VERSAmax (Molecular Devices, Californie, États-Unis) et avec le logiciel SoftMax Pro software V.5 (Molecular Devices).
2.5. RT - qPCR
L’ARN total a été extrait par filtration sur colonne à l’aide du Rneasy mini kit (Qiagen, Hilden, Allemagne) selon les recommandations du manufacturier. L’ARN a été quantifié par densité optique à l’aide du lecteur de plaque Synergy H1 hybrid reader (Biotek, Winooski, Vermont, États-Unis) et le logiciel Gen5 V.2.00 (Biotek). 1 µg a été utilisé pour exécuter une transcription inverse avec Iscript Adv cDNA Syn Kit RT-qPCR (Bio-Rad, Hercules, Californie, États-Unis) selon les recommandations de la compagnie. Les amorces d’iNOS et TLR-4 ont été obtenues chez Integrated DNA Technologies (séquence des amorces voir annexe 1) (IDT, Newark, New Jersey, États-Unis). 10 µL de SYBR Green (SsoAdvanced Universal SYBR Green Supermix, BioRad, Hercules, Californie, États-Unis) et 0,6 µL d’amorces (10 nM) a été ajouté à 5 µL de l’échantillon d’ADN complémentaire pour ensuite compléter avec de l’eau à 20 µL de réaction. L’ADN complémentaire a été analysé avec le Rotor Gene 6000 (Corbett, Qiagen). Les niveaux d’expression d’iNOS et TLR-4 ont été normalisés avec les gènes GNB2L1 et RPLP0 (IDT) (séquence d’amorce voir annexe 1).
2.6. Phagocytose
Tout d’abord, une culture bactérienne de 25 mL de Pseudomonas aeruginosa transfectée avec le gène de « Green Fluorescence Protein » (GFP) et d’ampicilline résistante (ATCC, 15692GFP) a été incubée durant 18 heures à 37°C dans bouillon de Tryptone de soja (TSB) (Sigma Aldrich) supplémenté de 300 µg/mL d’ampicilline (Invitrogen). Après l’incubation, 1 mL de culture de P. aeruginosa a été transféré à 25 mL de TSB + ampicilline. Les bactéries ont été incubées en phase exponentielle de croissance jusqu’à ce que la densité optique atteigne 0,40 ± 0,05.
D’autre part, les BMDMs trypsinisés ont été comptés et mis à une concentration de 2 millions de cellules par mL. Tandis que la lignée cellulaire immortalisée de macrophages alvéolaires issue de rats Sprague-Dawley, NR8383 (ATCC, Manassas, Virginie, États-Unis) a été utilisée comme contrôle positif pour les expériences de phagocytose. Les NR8383 ont été cultivées dans du milieu F-12K (F12K, Wisent BioProducts, Québec, Québec, Canada) supplémenté de 15 % de sérum de veau fœtal (FBS, Thermo Fisher Scientific, Waltham, Massachusetts, États-Unis) et 1 % de pénicilline/streptomycine (Thermo Fisher).
Lors de l’essai de phagocytose, 200 000 cellules ont été mises par puits dans une plaque 96 puits à tour noir et fond transparent. Les cellules ont été incubées 2 heures à 37°C avec 5% de CO2 pour permettre l’adhérence des cellules. Suite à l’incubation
des cellules, 20 µL de culture bactérienne ont été ajoutés aux cellules pour avoir un ratio d’une cellule pour 50 bactéries. Les plaques ont été centrifugées 2 minutes à 500 G et à 4°C. Les BMDMs ont ensuite été incubés avec les bactéries durant 1 heure à 37°C et à 5% de CO2. Les BMDMs ont été centrifugés 5 minutes à 500 G et
à 4°C. Les cellules ont été nettoyées avec du PBS et centrifugées une seconde fois. Le PBS a été retiré et remplacé avec 50 µL de bleu de trypan (Invitrogen) 1%
bactéries adhérées à l’extérieur des BMDMs et la PFA permet de fixer les cellules afin d’arrêter la phagocytose de P. aeruginosa. Les cellules ont été incubées 15 minutes sur glace avant de lire la RFU des cellules avec l’appareil Synergy H1 hybrid reader (Biotek) et le logiciel Gen5 V.2.00.
2.7. Analyse statistique
Toutes les données sont exprimées par la moyenne ± SEM. La taille de l’échantillon par groupe est de n=4 et l’expérience a été répétée 3 fois. Les groupes ont été comparés en utilisant la méthode par Two-Way ANOVA à mesures répétées (modèle mixte) (GraphPad Prism v8, San Diego, Californie, États-Unis). Une différence a été considérée significative à une valeur de p ≤ 0,05.
Chapitre 3 : Résultats
La différenciation des BMDMs dure 9 jours. Le nombre de cellules a été quantifié par compte à l’hémacytomètre (Figure 1). Chez les WT, l’analyse des résultats montre qu’il y a moins de cellules lorsqu’elles sont stimulées au LPS. En effet, après 9 jours de culture, 3,26 ± 0,22 millions de cellules WT non stimulées ont été récupérées alors que 2,42 ± 0,24 millions de cellules WT stimulées au LPS ont été récupérées. De plus, le nombre de cellules CD200 KO est moins élevé que celui des WT que ce soit avec ou sans stimuli. Sans une stimulation au LPS, 1,59 ± 0,23 cellules CD200 KO ont été récupérées et 1,21 ± 0,18 cellules CD200 KO stimulées au LPS ont été récupérés. Il y a donc une différence significative de 1,67 million de cellules entre les groupes non-stimulés WT et CD200 KO et aussi une différence significative de 1,21 million de cellules entre les groupes stimulés au LPS. Ces résultats indiquent que l’absence du CD200 interfère avec le nombre de cellules progénitrices et/ou avec la différenciation des cellules en BMDMs.
En complément à ce résultat, la proportion de cellules différenciées en BMDMs a été quantifiée par analyse en cytométrie de flux (Figure 2 a). Ces résultats montrent qu’une stimulation au LPS n’influence pas significativement le pourcentage de différenciation des BMDMs WT. Sans stimulation au LPS 47,75 ± 2,69 % des cellules sont des BMDMs et avec une stimulation au LPS 39,83 ± 2,54 % des cellules sont des BMDMs (Figure 2 b). Par contre, les BMDMs CD200 KO différencient moins que les BMDMs WT. En effet, 31,6 ± 1,7 % des cellules CD200 KO non-stimulés sont des BMDMs ce qui est significativement différent des WT. Par contre, les pourcentages de BMDMs CD200 KO différenciés avec une stimulation LPS ne sont pas différents des WT. En rapportant ces résultats au nombre total de cellules récoltées au jour 9, il est possible d’obtenir le nombre total de BMDMs différenciés (Figure 2 c). Cette transformation permet de montrer qu’après 9 jours d’incubation, 1,46 ± 0,11 million de BMDMs WT sans stimulation sont récupérés et que 0,93 ±
montrent une différence significative entre les deux groupes ce qui indique qu’une stimulation au LPS affecte le nombre final de BMDMs. De plus, la différenciation des BMDMs est affectée par l’absence du CD200. À la fin de la différenciation, il y a en moyenne 0,48 ± 0,06 million de BMDMs CD200 KO non stimulés qui ont été récoltés. Cette différence significative se reproduit aussi avec une stimulation au LPS. En effet, il est récolté 0,39 ± 0,04 million de BMDMs CD200 KO ce qui engendre une différence significative (p 0,01) de 0,54 million de BMDMs. Ces résultats suggèrent que le CD200 joue un rôle dans la différenciation des BMDMs.
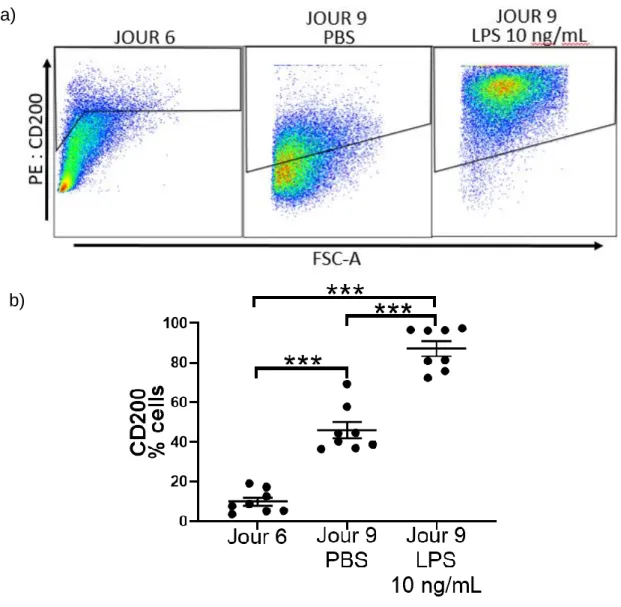
Afin de savoir si les BMDMs expriment le CD200, son expression a été quantifiée sur les cellules de la moelle osseuse lors de leur différenciation en macrophages par cytométrie en flux (Figure 3). L’expression du CD200 sur les cellules de la moelle osseuse varie durant leur différenciation en BMDMs. Seulement 8,9 ±1,8 % des cellules expriment le CD200 au jour 6 et la présence de CD200 à la surface des cellules est significativement augmentée au jour 9 de la différentiation (Figure 3). De plus, presque la totalité des cellules, soit 87,1 ± 3,7 %, expriment le CD200 suite à une stimulation au LPS comparativement à seulement 46,1 ± 4,1% avant la stimulation au LPS. Puisque les BMDMs expriment le CD200 durant leur différenciation et leur activation, l’influence de son absence a été investiguée sur l’expression de marqueurs associés à l’activation et à la présentation d’antigène.
Suivant les 9 jours de différenciation, les BMDMs augmentent l’expression de SIRPα, un marqueur de macrophages et un inhibiteur de la phagocytose, par rapport au jour 6 (21,6 ± 2,3 % vs 90,8 ± 1,6 %) (Figure 4 a). De plus, les cellules amplifient de manière significative l’expression des molécules impliquées dans la présentation d’antigène. Après 9 jours de différenciation, 50,6 ± 3,3 % des BMDMs expriment le MHCII (Figure 4 b), 44,6 ± 3,1 % le CD80 (Figure 4 c) et 61 ± 7,8 % le CD86 (Figure 4 d) comparativement au jour 6 où 7,1 ± 0,5 % des cellules expriment le MHCII
(Figure 4 b), 5,95 ± 1,4 % le CD80 (Figure 4 c) et 20,4 ± 2,2 % le CD86 (Figure 4 d). Suite à l’obtention de ces résultats, l’impact de l’absence du CD200 sur la différenciation des BMDMs a été déterminé. L’expression de SIRPα est plus faible sur les cellules CD200 KO au jour 6 et est moins augmentée au jour 9 comparativement aux cellules WT avec une différence de 26,8 ± 5,9 % entre les deux groupes (Figure 4 a). De plus, les BMDMs CD200 KO n’augmentent pas leur expression de MHCII lors de la différenciation. En effet, seulement 4,8 ± 1% des cellules sont positives pour le MHCII ce qui donne une différence d’expression de 45,8 % entre les deux groupes (Figure 4 b). L’expression des marqueurs de costimulation, CD80 et CD86, est significativement moins élevée sur les cellules CD200 KO comparées aux cellules WT, avec une diminution de 17,33 ± 4,2 % et de 23 ± 9 %, respectivement (Figure 4 c et d). Ces résultats suggèrent que, lors de la différenciation, l’absence du CD200 a un impact sur l’expression des marqueurs de différenciation (SIRPα et MHCII), de costimulation (CD80 et CD86) et de présentation d’antigènes (MHCII).
Ensuite, l’influence de la présence du CD200 sur l’expression du récepteur, le CD200R, a été évaluée (Figure 5 a). Chez les BMDMs WT, le CD200R est exprimé à la surface de la majorité des cellules (85 ± 1,8 %) dès le début de la différenciation (Figure 5 b). Son expression augmente légèrement au jour 9 comparativement au jour 6 (98,3 ± 0,3 %) (Figure 5 b). Il est intéressant de noter que l’intensité de son expression sur chaque cellule augmente significativement de 6 fois lors de la différenciation (Figure 5 c). Par contre, l’expression du CD200R n’est pas influencée par l’absence du CD200 (Figure 5).
En plus d’observer que l’absence du CD200 diminue l’expression des marqueurs lors de la différenciation, il est intéressant d’étudier l’impact de l’absence du CD200 sur ces mêmes marqueurs dans un contexte d’activation à l’aide d’une stimulation
au LPS. Tout d’abord, chez les BMDMs WT, l’expression des marqueurs de surface SIRPα et MHCII reste stable malgré la présence de LPS. En effet, 87,1 ± 2,8 % des cellules sont positives pour le SIRPα et 50,8 ± 3.3 % sont positives pour le MHCII avant la stimulation au LPS alors qu’après la stimulation, 87,6 ± 3,0 % et 58,6 ± 4,3 % sont observés respectivement (Figure 6 a et b). En contrepartie, une stimulation au LPS, sur les BMDMs WT, a augmenté l’expression du CD80 à 84,3 ± 3,6 % et l’expression du CD86 à 93,6 ± 1,49 % (Figure 6 c et d). Contrairement aux BMDMs WT, les BMDMs CD200 KO n’ont pas augmenté l’expression du CD80 suite à l’activation par le LPS (Figure 6 c). De même, l’augmentation de l’expression du CD86, suite à la stimulation au LPS, est significativement moins importante à la surface des cellules CD200 KO que les cellules WT (Figure 6 d). En effet, comme cité plus haut, 93,6 ± 1,49 % des BMDMs WT+LPS expriment le CD86, alors que 59,4 ± 4,1 % des CD200 KO expriment ce marqueur. L’expression du SIRPα et du MHCII n’est pas modulée avec la stimulation au LPS chez les BMDMs KO et donc leurs expressions restent plus faibles chez les CD200 KO que chez les BMDMs WT (Figure 6 a et b). La proportion de cellules CD200R positive n’est pas modulée post-stimulation au LPS chez les BMDMs WT et CD200 KO (Figure 7 a). Cependant, l’expression moyenne du CD200R (MFI, Figure 7 b) est diminuée suite à la stimulation au LPS. Chez les BMDMs WT, une diminution significative de 1,5 fois est remarquée suite à une stimulation au LPS, mais aucune différence n’est remarquée entre les groupes WT et CD200 KO. En résumé, ces résultats suggèrent que l’expression du CD200 contribue à l’augmentation de l’expression des molécules normalement exprimées suivant une stimulation au LPS.
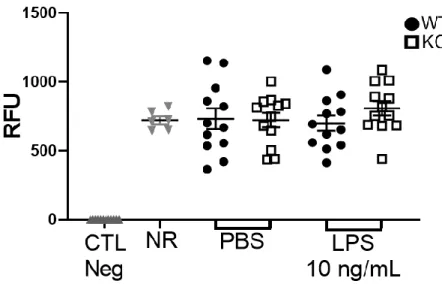
Après avoir caractérisé l’influence de l’absence du CD200 sur les marqueurs de surfaces des macrophages, deux fonctions de ce type cellulaire ont été étudiées soit la phagocytose et la sécrétion de médiateurs. Le CD200, étant immunorégulateur, pourrait jouer un rôle dans ces fonctions du macrophage.62 La phagocytose de
bactéries vivantes par les BMDMs WT est comparable à celle du contrôle expérimentale de cellules NR8383. Les cellules NR8383 proviennent d’une lignée
cellulaire immortelle de macrophages alvéolaires de rat Sprague Dawley. En effet, les BMDMs WT ont démontré une intensité de fluorescence de 732,1 ± 74,7 RFU et le contrôle positif de NR8383 une intensité de 722,3 ± 28,8 RFU (Figure 8). Une stimulation au LPS n’influence pas la phagocytose des BMDMs WT, la fluorescence mesurée après la phagocytose des bactéries est de 699,8 ± 55,3 RFU chez les BMDMs WT-LPS (Figure 8). Donc, une stimulation au LPS n’influence pas la fonction phagocytaire des BMDMs. De plus, les résultats démontrent que le CD200 n’influence pas la phagocytose (Figure 8). Les BMDMs CD200 KO phagocytent à la même intensité que les WT que ce soit sans stimulation (721,6 ± 52,8 RFU ; Figure 8) ou avec une stimulation au LPS (807,3 ± 51,88 RFU ; Figure 8). En résumé, une déficience en CD200 n’a pas d’effet sur la phagocytose de Pseudomonas
aeruginosa par les BMDMs stimulés ou non au LPS.
Par la suite, la sécrétion de médiateurs a été étudiée suite à une stimulation au LPS. Les résultats montrent que l’absence du CD200 sur les BMDMs diminue la sécrétion de cytokines. En effet, suite à une stimulation au LPS, les BMDMs WT augmentent la sécrétion de cytokines pro-inflammatoires (IL-6 et TNF; Figure 9 a et b) et anti-inflammatoires (IL-10; Figure 9 c). Chez les BMDMs CD200 KO, la stimulation au LPS augmente la production d’IL-6, de TNF et d’IL-10, mais à un moindre niveau que les WT (Figure 9). En comparant les deux groupes, les BMDMs CD200 KO sécrètent 3 fois moins d’IL-6, 2,7 fois moins de TNF et 2 fois moins d’IL-10. L’expression d’iNOS, un autre médiateur inflammatoire, a été étudié par RT-qPCR. Les niveaux de base d’iNOS chez les BMDMs WT sont très faibles, mais après une stimulation au LPS, son expression est très fortement augmentée (Figure 9 d). Par contre, l’absence de CD200 ne module pas l’expression d’iNOS. Ces résultats supportent l’idée qu’une absence en CD200 chez les BMDMs diminue la réponse inflammatoire au LPS.