Synthèse, caractérisation et étude des propriétés
anti-inflammatoires de nouvelles urées aromatiques
substituées ainsi que de quelques-uns de leurs
bioisostères
Mémoire
Sébastien Tremblay
Maîtrise en sciences pharmaceutiques - avec mémoire
Maître ès sciences (M. Sc.)
Synthèse, caractérisation et étude des propriétés
anti-inflammatoires de nouvelles urées
aromatiques substituées ainsi que de
quelques-uns de leurs bioisostères
Mémoire
Sébastien Tremblay
Sous la direction de :
Dr René C.-Gaudreault, directeur de recherche
Dr Stéphane Gobeil, codirecteur de recherche
Résumé
Les maladies inflammatoires et auto-immunes sont parmi les maladies les plus morbides et mortelles puisqu’elles sont responsables de plus de 60% des décès mondialement. La plupart des médicaments traitant ces pathologies sont peu efficaces et/ou sont responsables d’un grand nombre d’effets secondaires. Ce projet de recherche comporte deux objectifs principaux, soient la synthèse de nouveaux dérivés d’urées aromatiques substituées (UAS) ainsi que de leurs bioisostères, et l’évaluation du potentiel anti-inflammatoire de ces derniers afin d’identifier ceux qui sont efficaces contre certains mécanismes responsables des processus inflammatoires. Notre hypothèse est que des modifications structurales apportées à ces urées permettra d’augmenter leur potentiel anti-inflammatoire dans des modèles
in vitro et in vivo.
La synthèse d’une chimiothèque renfermant des structures entièrement nouvelles et diversifiées a été développée. Les molécules ont été synthétisées, purifiées par chromatographie liquide et caractérisées par RMN 1H, 13C, point de fusion et par HPLC-MS. Par la suite, des essais biofonctionnels ont été réalisés sur différentes lignées cellulaires primaires et cancéreuses. La majorité de nos composés n’ont pas d’effet marqué sur la prolifération cellulaire et n’influencent pas la progression du cycle cellulaire, ce qui témoigne de leur innocuité potentielle. Le potentiel anti-inflammatoire des molécules a ensuite été évalué sur des kératinocytes humains, où nous avons déterminé leur capacité à inhiber la production d’interleukine 6 (IL-6), une cytokine étroitement liée à l’inflammation. Certains de nos composés inhibent à plus de 80% la production d’IL-6. Le mécanisme anti-inflammatoire que pourrait avoir nos composés a ensuite été étudié et une cible thérapeutique potentielle a ensuite été déterminée et évaluée. En plus d’UASs montrant une forte inhibition de l’expression d’IL-6 certaines inhibent l’activité de l’époxyde hydrolase soluble (sEH) à plus de 80% à 250 nM.
Ce projet de maîtrise a également permis le développement de méthodes de synthèse des UASs et de leurs bioisostères à la fois simples, rapides et efficaces. Ces molécules montrent une activité anti-inflammatoire indiscutable dont les relations structure-activité et le mécanisme d’action anti-inflammatoire ont été étudiés.
Abstract
Inflammatory and autoimmune diseases are among the most morbid and deadly treats to human health. The aims of our project are to synthesize, characterize and screen a chemolibrary of new aromatic substituted ureas (UASs) as well as some of their bioisosteres to identify “hit compounds” that are effective against inflammatory processes. Our hypothesis is that structural modifications of these ureas will improve their anti-inflammatory potential both in vitro and in vivo.
The synthesis of a chemolibrary containing entirely new and diversified structures has been developed. The molecules have been synthesized, purified by flash chromatography and fully characterized by 1H, 13C NMR and HPLC-MS. Subsequently, their antiproliferative activity was examined on various normal and cancer cell lines. The anti-inflammatory potential of these molecules was evaluated by investigating their potential to inhibit IL-6 production using an ELISA assay. More than a hundred urea derivatives have been synthesized, the latter proposing completely new and diversified structures. Some of our compounds inhibit by more than 80% of IL-6 production in human keratinocytes. The majority of these compounds showed no marked antiproliferative effects on the cell lines tested so far, suggesting their potential innocuity. Moreover, all the synthesized compounds do not impact the cell-cycle progression.
Structural analyzes predicted that the new compounds could inhibit an enzyme involved in inflammation namely the soluble epoxide hydrolase (sEH). Several UASs reduce sEH) activity by displaying more than 80% inhibition at the nanomolar level. Moreover, UAS-1025 has an IC50 of 3.6± 0.7 nM on the human sEH and UAS-1008 an IC50 of 6.9± 0.7 nM on the murine sEH.
This research has led to the development of simple, fast and efficient synthetic methods to produce potent anti-inflammatory UASs and their bioisosteres. Several
of these molecules exhibit significant anti-inflammatory and anti-psoriatic activities whose structure-activity relationships and mechanism of action are currently under study.
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... IX Liste des figures ... X Liste des abréviations ... XIII Remerciements ... XVI Avant-propos ... XVII
Introduction générale ... 1
1. L’inflammation ... 1
1.1. Historique ... 1
1.2. Les maladies inflammatoires ... 2
1.3. Les maladies inflammatoires auto-immunes ... 4
1.3.1. Incidence et prévalence des maladies auto-immunes ... 5
1.4. Les traitements en usage clinique ... 5
1.4.1. Les anti-inflammatoires stéroïdiens ... 6
1.4.2. Les anti-inflammatoires non-stéroïdiens ... 7
1.4.3. Mécanisme d’action anti-inflammatoire des AINS ... 9
1.4.4. Coûts associés aux traitements des maladies inflammatoires chroniques ... 11
1.5. Le psoriasis ... 12
1.5.1. Épidémiologie ... 12
1.5.2. Traitements ... 14
1.6. L’interleukine-6 et l’inflammation chronique ... 15
2. Les urées aromatiques substituées (UASs) ... 15
2.1. Origine des UASs et travaux antérieurs ... 15
3. Les bioisostères ... 19
3.1. Isostères et bioisostères ... 19
3.2. Utilité des bioisostères ... 22
3.3. Applications dans la conception de médicaments ... 22
3.4. Bioisostères d’urées ... 23
3.4.1. Thiourées ... 24
3.4.2. Squaramides ... 25
4. Mode d’action anti-inflammatoire possible des UASs et des bioisostères ... 25
4.1. L’époxyde hydrolase soluble ... 26
Chapitre 1 ... 29
Hypothèses et objectifs de recherche ... 29
1. Hypothèses de recherche ... 30
Chapitre 2 ... 33
Synthèse et étude des propriétés anti-inflammatoires d’urées aromatiques substituées et de ses dérivés thiourées ... 33
Avant-propos ... 34
Résumé ... 35
New substituted phenyl cycloalkylureas as potent IL-6 expression inhibitors ... 36
Supporting information ... 45
Chapitre 3 ... 60
Mode d’action anti-inflammatoire potentiel des UASs et de ses bioisostères thiourées – Inhibition de l’époxyde hydrolase soluble (sEH) humaine et murine ... 60
Avant-propos ... 61
Résumé ... 62
New urea-based compounds as potent soluble epoxyde hydrolase inhibitors ... 63
Supporting information ... 79 Discussion et conclusion ... 96 1. Discussion générale ... 97 2. Conclusion ... 101 Perspectives ... 103 Références ... 105
Liste des tableaux
IntroductionTableau 1. Groupes d’isostères selon Irving Langmuir, en 1919. (p.20)
Tableau 2. Groupes d’isostères selon Grimm et la loi de déplacement d’hydrure, en
1925. (p.20)
Tableau 3. Groupes d’isostères selon Erlenmeyer, basés sur le nombre d’électrons
périphériques. (p.21)
Chapitre 2
Table 1. Antiproliferative activity of compounds 3a-6f, 3a’-6f’ and ibuprofen on
HT-29, A549, HaCaT and HDFn cell lines. (p.40)
Table 2. Effect of tBCEU, cHCEU, ibuprofen and compounds 3a-b, 4e, 5b-c, and 6a-e on cell cycle progression. (p.42)
Table 3. Effect on IL-6 expression of 10 µM solution of tBCEU, cHCEU, compounds 3a-b, 4a-6f, 3a’-b’, 4a’-6f’, dexamethasone (1 µM) and ibuprofen. (p.43)
Chapitre 3
Table 1. Evaluation of all substituted phenylureas at 250 nM on human sEH. (p.68) Table 2. Evaluation of all new substituted phenylcycloalkylthioureas at 250 nM on
human sEH. (p.69)
Table 3. IC50 of compounds on human and murine soluble epoxide hydrolase for compounds showing significant inhibitory activity at 250 nM. (p.70)
Table 4. Enzymology kinetic parameters of compounds 1i, 2f and TPPU. (p.71) Table 5. The docking score and binding interaction of compounds 2e, 2f and 1i on
Liste des figures
IntroductionFigure 1. Les cinq signes de l’inflammation (chaleur, rougeur, gonflement, douleur
et perte de fonctions), représenté par Willoughby. (p.1)
Figure 2. Structure de la prednisolone (à gauche) et de la dexaméthasone (à droite),
deux puissants anti-inflammatoires stéroïdiens. (p.6)
Figure 3. Schéma des voies anti-inflammatoires des AIS et des AINS. (p.7)
Figure 4. Structure de l’ibuprofène, du diclofénac, de l’acide acétylsalicylique et du
naproxène, des AINS non-sélectifs. (p.8)
Figure 5. Structure du célécoxib, de l’étoricoxib et du rofécoxib, trois AINS sélectifs
pour l’isoforme COX-2. (p.8)
Figure 6. Voie de synthèse de l’AA à partir des phospholipides par la PLA2. (p.9)
Figure 7. Voie de synthèse de PGG2 et PGH2 à partir de l’AA par les COXs (COX-1 ou COX-2). (p.(COX-10)
Figure 8. Schéma décrivant l’effet des AINS sur la synthèse des thromboxanes,
prostaglandines et prostacyclines. (p.11)
Figure 9. Formes de psoriasis. Psoriasis en goutte (A), érythrodermique (B), en
plaques (C), pustuleux (D) et inversé (E). (p.14)
Figure 10. Structure de la 4-tBCEU et de la 4-ICEU, deux molécules
anticancéreuses. (p.16)
Figure 11. Voie de signalisation reliant la b-tubuline aux cytokines pro-inflammatoires telles que l’IL-6 et le TNFa. (p.16)
Figure 12. Structure générale des CEUs et des EUs. (p.17)
Figure 13. Analyses histologiques des coupes de peaux psoriasiques modèles
colorées au trichrome de Masson. Substituts sains (A-C), substituts psoriasiques
(D-F), substituts témoins (A et D), substituts traités avec la tBEU (B et E) et substituts
traités avec MTX (C et F). (p.18)
Figure 14. Mesure de l’épiderme pour les substituts sains (H) et psoriasiques (P)
Figure 15. Structure de la procaïnamide et de la cimétidine, respectivement des
bioisostères de la procaïne et de la métiamide. (p.23)
Figure 16. Structure de différents bioisostères du groupement urée. (p.24)
Figure 17. Métabolisme de l’acide arachidonique par les cytochromes P450 et la
sEH. (p.26)
Figure 18. Structure de AR9281, AUDA et GSK2256294, trois inhibiteurs de
l’activité enzymatique de la sEH. (p.27)
Chapitre 1
Figure 1. Schéma de synthèse potentielle pour l’obtention des UASs et des
thiourées. (p.31)
Chapitre 2
Scheme 1. Structure of tBCEU and cHCEU. (p.38)
Scheme 2. Synthesis of substituted phenyl cycloalkylureas and cycloalkylthioureas.
(p.39)
Chapitre 3
Figure 1. Results from SwissTargetPrediction for compound 6e, 6d, 1e and 3e.
(p.66)
Scheme 1. Synthesis of substituted phenyl alkylureas and alkylthioureas. (p.67) Figure 2. Representation of the docking of 2e (A and B), 2e+ICU (C), 2f (D and E)
and 1i (F and G) in 2D (A, D and F) or in 3D (B, C, E and F) into the sEH active site. (p.76)
Figure S1: SwissTargetPrediction report of compound 1e. (p.90)
Figure S2: SwissTargetPrediction report of compound 3e. (p.91)
Figure S4: SwissTargetPrediction report of compound 6e. (p.93)
Figure S5: Michaelis-Menten curves for compounds 2f, 1i and TPPU at 0, 5, 25 or
100 nM. (p.94)
Discussion et conclusion
Figure 1. Structure du sorafénib, lenvatinib, linifanib et des UASs, des molécules
possédant un groupement urée. (p.97)
Figure 2. Structure du DCU, de l’ACU et des UASs possédant un groupement
Liste des abréviations
Produits chimiques et solvantsCHCl3 Chloroforme
DCM Dichlorométhane
DMF Diméthylformamide
DMSO Diméthylsulfoxyde
TEA Triéthylamine
AcOEt Acétate d’éthyle
MeCN Acétonitrile
MeOH Méthanol
EtOH Éthanol
TCA Acide trichloroacétique
SRB Sulforhodamine B
CEU Chloroéthylurée
UAS Urées aromatiques substituées
Unités
Hz Hertz
M Molaire
MHz Mégahertz
m/z Ratio masse sur charge
nm Nanomètre
ppm Parties par million
équiv. Équivalents
m/v Masse sur volume
v/v Volume sur volume
mAu Unités d’absorbance x 10-3
Å Angstrom
N Normale
Méthodes d’analyse
APCI « Atmospheric pressure chemical ionization »
ESI « Electrospray ionization »
RP-HPLC Chromatographie liquide à haute performance en phase inversée
RMN Résonance magnétique nucléaire (NMR)
RMN 1H Résonance magnétique nucléaire du proton (1H NMR)
RMN 13C Résonance magnétique nucléaire du carbone (13C NMR)
CCM Chromatographie sur couche mince (TLC)
UV Ultraviolet
SM Spectromètre de masse (MS)
SMHR Spectromètre de masse à haute résolution (HRMS)
HPLC-MS Chromatographie liquide couplée à un spectromètre de masse
Résonance Magnétique Nucléaire
δ Déplacement chimique
dd Doublet de doublets
s Singulet
broad s Singulet large
m Multiplet
q Quadruplet
quint. Quintuplet
app. quint. Quintuplet apparent
t Triplet
J Constante de couplage
Autres
FDA Food and Drug Administration
l Longueur d’onde n Fréquence T.P/RT Température pièce t-Bu tert-Butyl c-Hex cyclo-Hexyl Et Éthyle Me Méthyle c-Pr cyclo-Propyl c-BuMe cyclo-ButylMethyl c-Pn cyclo-Pentyl
PPA Protéines de phase aiguë
CAM Membrane chorio-allantoïque
Remerciements
Je tiens tout d’abord à remercier mon superviseur de recherche, le Dr René C.-Gaudreault, ainsi que mon co-directeur de recherche, le Dr Stéphane Gobeil. Leur support mais surtout leur confiance durant cette étape de ma vie m’ont permis d’avancer au meilleur de mes capacités. Une mention également au Dr Sébastien Fortin ainsi qu’à madame Marie-France Côté, professionnelle de recherche, pour leurs précieux conseils.
J’aimerais également remercier tous les organismes subventionnaires, qui sans eux mener ce projet de maîtrise n’aurait pu être mené à terme. Ces nombreux organismes subventionnaires sont les Fonds de recherche du Québec - Nature et technologies (FRQNT), la Fondation du CHU de Québec ainsi que l’Instituts de recherche en santé du Canada (IRSC).
Par la suite, l’ambiance au travail n’aurait pas été la même sans mes collègues de l’équipe du Dr Fortin, soient Mathieu, Daphnée, Mitra, Chahrazed et Corinne. Un merci particulier aux deux stagiaires dont j’ai eu la chance d’être le superviseur, Ariane et Lily, qui m’ont permis d’acquérir des compétences en pédagogie et en vulgarisation scientifique, compétences qui me seront très utiles sur le marché du travail.
D’un côté plus personnel, j’aimerais remercier toute ma famille pour leur support tout au long de mes études. Mes parents, Serge et Sandra, mes grands-parents, Adélard et Louise, ainsi que mes frères William et Benjamin et ma sœur Laurianne, qui m’a également permis d’être le parrain d’un merveilleux petit garçon, Xavier.
Finalement, j’aimerais remercier la personne avec qui je passe les meilleurs moments de ma vie, mon conjoint Alexandre. Tu as su me donner tout le support moral nécessaire pour accomplir ce projet. Les soirs où je suis arrivé plus tard, les quelques journées de fin de semaine où je n’étais pas présent, je te promets que cela en a valu la peine, et tu sais que c’est parce que j’adorais mon projet et que je voulais le pousser le plus loin possible.
Avant-propos
Mes travaux de recherche ont permis d’écrire le chapitre 2 de ce mémoire, qui fera également l’objet d’un article scientifique qui sera soumis bientôt au journal
Bioorganic and Medicinal Chemistry letters. Le premier manuscrit est intitulé New substituted phenyl cycloalkylureas as potent IL-6 expression inhibitors. La
contribution de chaque auteur par rapport à cet article est détaillée en avant-propos du chapitre 2. Ce chapitre a été inclus à ce mémoire puisqu’il correspond aux objectifs initiaux fixés pour mon projet de maîtrise.
Le chapitre 3 est quant à lui constitué d’un article qui sera également soumis sous peu à un journal de chimie médicinale avec comité de pairs. Ce chapitre sort en dehors des objectifs initiaux fixés pour mon projet. Toutefois, étant premier auteur de cette publication, et puisque les résultats qui y sont rapportés découlent de ceux présents dans le chapitre 2, ce manuscrit a été inclus dans ce mémoire sous forme de chapitre complet correspondant à la forme qui sera soumise au journal.
Introduction générale
1. L’inflammation
1.1. Historique
Les premiers écrits concernant l’inflammation datent de l’ancienne Égypte ou encore des cultures grecques, où l’on décrivait la formation de pus.1 Cependant, ce n’est qu’au 1er siècle avant Jésus-Christ que l’inflammation a réellement été caractérisée. En effet, Aulus Celsus, un écrivain romain, caractérisait l’inflammation par la présence de rougeur, de gonflement, de chaleur ainsi que de douleur. Cette description a ensuite été améliorée, au 2ième siècle après Jésus-Christ, par Claudius Galien, un des pères de la médecine moderne, qui ajouta comme caractéristique la perte de fonction des tissus affectés par l’inflammation. L’inflammation regroupe donc cinq caractéristiques principales, tel que le présente la figure conçue par Willoughby et Spector.2
Figure 1. Les cinq signes de l’inflammation (chaleur, rougeur, gonflement, douleur
et perte de fonctions), représenté par Willoughby.
Cette définition est toujours valide, puisque la définition actuelle de l’inflammation est une « réaction locale qui cause de la rougeur, de la chaleur, de l’enflure et de la
d’associer des voies de signalisation, des cellules ainsi que des composés chimiques ayant un lien direct avec l’inflammation et ses effets sur le corps humain.
1.2. Les maladies inflammatoires
Lorsque le corps humain perçoit un signe de dérèglement de l’homéostasie, soit par une infection ou un traumatisme quelconque, il réagit rapidement et intensément, c’est la réaction de phase aiguë. Cette réaction permet de contrôler la quantité de protéines de phase aiguë (PPA) qui sont produites par le foie sous l’influence de certaines cytokines. Lorsque les cellules sont touchées par l’inflammation, elles surexpriment et sécrètent des cytokines qui se retrouverons dans la circulation sanguine provoquant ainsi la production de PPA par le foie.4
Selon la classification internationale des maladies (CIM-10), il existe plus de 3000 maladies qui portent le suffixe -itis, ce dernier caractérisant les maladies reliées à l’inflammation. Des pathologies telles que le psoriasis, l’arthrite rhumatoïde, la sclérose en plaques, le diabète et le cancer sont toutes associées à des dérégulations inflammatoires.5 Il existe deux types d’inflammations, soient l’inflammation aiguë et l’inflammation chronique. L’organisation mondiale de la santé (WHO) a déterminé qu’en 2008, c’est 33 millions de décès qui ont été causés par une maladie chronique, ce qui représente 58% des décès totaux.6
La durée des symptômes ainsi que les agents causant les pathologies diffèrent selon le type d’inflammation. En ce qui concerne l’inflammation aiguë, la durée est de quelques secondes allant jusqu’à quelques jours au maximum, tandis que pour l’inflammation chronique, la durée est de quelques mois et pouvant s’échelonner sur toute une vie. Les agents causaux pour une inflammation aiguë sont principalement des dommages chimiques (acides, bases ou agents oxydants) ou physiques (coupure, brûlure ou engelures), ou encore une réponse immunitaire suite à des agents infectieux tels que les virus et les bactéries. L’inflammation aiguë permet de prévenir des dommages plus grands au tissu affecté, de détruire l’agent pathogène
ayant causé cette inflammation et d’avoir une guérison plus rapide en activant les voies de réparation cellulaires. Par conséquent, elle permet d’apporter au site de l’inflammation des leucocytes et des cellules plasmatiques produisant des anticorps, déclenchant ainsi le processus de destruction de l’agent pathogène ou de réparation du tissu affecté. Lors d’une inflammation aiguë, trois principaux processus sont initiés. Le premier est une augmentation du flux sanguin au site de l’inflammation, causé par la dilatation des vaisseaux sanguins, provoquant ainsi de la rougeur et de la chaleur. Le second est un changement au niveau structural des vaisseaux sanguins, permettant aux leucocytes de traverser le vaisseau sanguin par diapédèse. Cet écoulement de cellules plasmatiques aura comme conséquence l’accumulation de fluide, causant de l’œdème. Finalement, l’inflammation aiguë cause le relargage de chimiokines (e.g., IL-8, CXCL8) au site de l’inflammation, ce qui entraîne de la douleur à l’hôte. En ce qui concerne l’inflammation chronique, les agents causaux sont l’auto-immunité ou encore une infection persistante. Souvent, les tissus affectés par une inflammation chronique vont passer par quatre processus : réponse immunitaire, phagocytose, nécrose et réparation. Au niveau cellulaire, l’inflammation aiguë impliquera les neutrophiles et les macrophages, et l’inflammation chronique les lymphocytes, les cellules plasmatiques, les macrophages et les fibroblastes.7
Les maladies inflammatoires chroniques peuvent survenir pour trois principales raisons : une infection persistante, une exposition de longue durée à des agents toxiques ou encore une maladie inflammatoire reliée au système immunitaire. Pour la troisième raison, les scientifiques ont encore à ce jour de la difficulté à déterminer son étiologie, outre le fait que le système immunitaire est fortement suractivé dans de tels cas, ce qui mène aux maladies auto-immunes.8
L’inflammation chronique persiste même lorsque la blessure est totalement guérie, soit après la phase aigüe de l’inflammation et peut rester, tel que mentionné précédemment, sur une période très prolongée. Également, l’inflammation
chronique peut démarrer d’elle-même, sans qu’il y ait eu d’inflammation aiguë. À ce stade, un traitement médical sera nécessaire afin d’en limiter les dommages. C’est d’ailleurs ce type d’inflammation qui mène aux maladies inflammatoires débilitantes telles que l’athérosclérose, l’arthrite rhumatoïde ou encore la fibrose pulmonaire. Il a été démontré qu’une inflammation chronique peut mener à des problèmes de santé encore plus graves. En effet, les gens souffrant d’obésité ou d’une maladie inflammatoire chronique, sont beaucoup plus à risque de développer du psoriasis. Également, les gens souffrant d’athérosclérose sont plus à risque de faire une crise cardiaque ou des accidents vasculaires cérébraux, causés par la formation de plaques athéromateuses obstruant les artères et des artérioles. Finalement, certains cancers ont une plus forte tendance à se développer lors d’une inflammation chronique ou suite à celle-ci, en raison des dommages causés à l’ADN lors de l’inflammation.9 En effet, il a été déterminé que l’inflammation chronique contribue à près de 25% des cancers. Lors du processus inflammatoire, les cellules vont relarguer des espèces réactives d’oxygène (ROS) et des espères réactives d’azote (RNS). Les ROS et RNS sont capables d’endommager l’ADN.10
1.3. Les maladies inflammatoires auto-immunes
Les maladies auto-immunes découlent d’un problème relié à la réponse immunitaire du corps humain. Ainsi, elles peuvent se déclencher dans presque toutes les parties du corps comme au foie, au rein, à la peau, au cerveau, au cœur, au poumon et plusieurs autres. Par conséquent, les symptômes d’une inflammation chronique auto-immune peuvent varier grandement, tout dépendant de l’organe touché. Pour qu’un traitement de ces pathologies soit au maximum de son efficacité, les patients doivent consulter des médecins spécialistes de l’organe impliqué. Puisque ce type de maladie touche parfois plusieurs organes et qu’elle implique plusieurs spécialistes de la santé, il a été difficile de créer une catégorie pour ces pathologies. Ce n’est que vers la fin du 20ième siècle que les médecins spécialistes ont mis en évidence le lien immunitaire entre toutes ces maladies, que ce soit au niveau des
poumons ou de la peau, pouvant maintenant caractériser ces pathologies comme étant inflammatoires auto-immunes.11
1.3.1. Incidence et prévalence des maladies auto-immunes
Dans les sociétés occidentales, les maladies inflammatoires reliées au système immunitaire touchent entre 5 et 7% de la population.12 Selon la méta-analyse basée sur 30 études de la prévalence et l’incidence des maladies auto-immunes, le pourcentage d’augmentation de la prévalence est de 12,5/an et l’incidence de 19,1/an. À titre d’information, la prévalence concerne les cas déjà existants, et correspond au ratio du nombre de cas par rapport à la population. L’incidence, quant à elle, concerne les nouveaux cas, et correspond donc au ratio du nombre de nouveaux cas par rapport à la population totale. Lorsque ces données sont analysées, il est possible de remarquer que la prévalence des maladies auto-immunes neurologiques (e.g., sclérose en plaques) augmente de 3,7%, gastro-intestinales (e.g., maladie de Crohn, maladie cœliaque) d’environ 6,2% et les maladies rhumatismales (e.g., arthrite rhumatoïde) de près de 7,1%. Cette augmentation rapide rend la recherche sur l’inflammation et le développement d’anti-inflammatoires encore plus pertinente et d’actualité.
1.4. Les traitements en usage clinique
Il existe à ce jour différents traitements des maladies inflammatoires, soient les anti-inflammatoires non-stéroïdiens (AINS), les anti-anti-inflammatoires stéroïdiens (AIS) ou encore des agents dits « biologiques », également appelés les antirhumatismaux modificateurs de la maladie (ARMM). Les AINSs ainsi que les AISs sont principalement utilisés pour diminuer les symptômes reliés à l’inflammation, tandis que les ARMMs servent à ralentir ou empêcher l’attaque des tissus et des articulations par les cytokines impliquées dans les phénomènes inflammatoires. Par conséquent, au Canada les ARMMs comme l’adalimumab (HumiraÒ), l’étanercept (EnbrelÒ), l’infliximab (RemicadeÒ), le méthotrexate (MethotrexateÒ) et plusieurs autres sont utilisés pour traiter la polyarthrite rhumatoïde. Puisque les molécules
développées au sein de notre laboratoire ne sont pas des agents biologiques, ce mémoire traitera principalement des AINS ainsi que des AIS.
1.4.1. Les anti-inflammatoires stéroïdiens
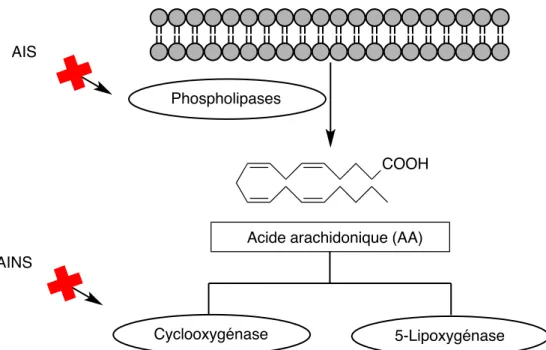
Les anti-inflammatoires stéroïdiens (AIS), également appelés corticoïdes ou glucocorticoïdes, comme la prednisolone et la dexaméthasone (Figure 2), peuvent agir en tant qu’agents anti-inflammatoires en empêchant les phospholipases de type A2 de libérer l’acide arachidonique (AA) présent dans les membranes lipidiques. Les AIS bloquent notamment la synthèse des prostaglandines et des leucotriènes dans la voie de signalisation en amont comparativement aux AINS (Figure 3).
Figure 2. Structure de la prednisolone (à gauche) et de la dexaméthasone (à droite),
deux puissants anti-inflammatoires stéroïdiens.
H H HO O HO O OH H H F HO O HO O OH H
Figure 3. Schéma des voies anti-inflammatoires que peuvent inhiber les AIS et les
AINS.
Les AIS causent rarement des problèmes à courts termes, mais c’est l’inverse lorsque le traitement est à long terme. Les AIS peuvent amincir la peau, affaiblir la densité osseuse et le système immunitaire, créer une dépendance chez le patient ou encore donner des brûlures d’estomac. Un effet à long terme associé à la prise de corticoïdes est le syndrome de Cushing. Les patients atteints de ce syndrome ont une prise de poids excessive, s’accompagnant également d’une fonte des muscles des bras et des jambes.13 Par conséquent, les AIS sont prescrits sur de courtes durées, et il est fortement recommandé d’éviter l’automédication.14
1.4.2. Les anti-inflammatoires non-stéroïdiens
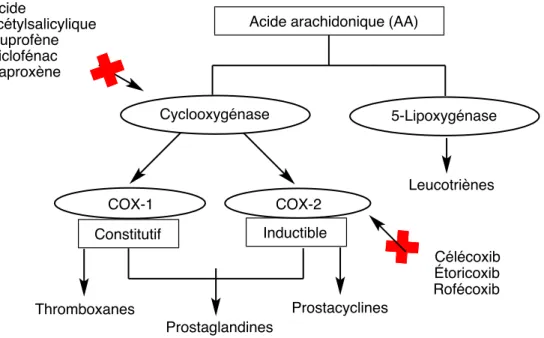
Les anti-inflammatoires non-stéroïdiens sont parmi les médicaments les plus prescrits au niveau mondial. On rapporte qu’il y a eu plus de 111 millions de prescription en 2000 aux États-Unis. Les AINS diminuent l’inflammation en inhibant l’activité de la cyclo-oxygénase 1 (COX-1) et de la cyclo-oxygénase 2 (COX-2). Ces enzymes permettent la synthèse des prostaglandines et des thromboxanes à partir de l’acide arachidonique (Figure 3). Cependant, il a été démontré que plusieurs
COOH
Acide arachidonique (AA)
Cyclooxygénase 5-Lipoxygénase
Phospholipases AIS
effets secondaires sont reliés à l’utilisation des AINS, et surtout lorsque ces derniers agissent sur l’inhibition de l’isoforme COX-1. Les premiers AINS commerciaux développés tels que l’ibuprofène, le diclofénac, l’acide acétylsalicylique et le naproxène (Figure 4) sont sélectifs, c’est-à-dire qu’ils inhibent non-sélectivement COX-1 et COX-2. Les effets délétères associés à la prise de ces médicaments à long terme, telle que l’hypertension artérielle et l’insuffisance rénale, ont rapidement été démontrés.
Figure 4. Structure de l’ibuprofène, du diclofénac, de l’acide acétylsalicylique et du
naproxène, des AINS non-sélectifs.
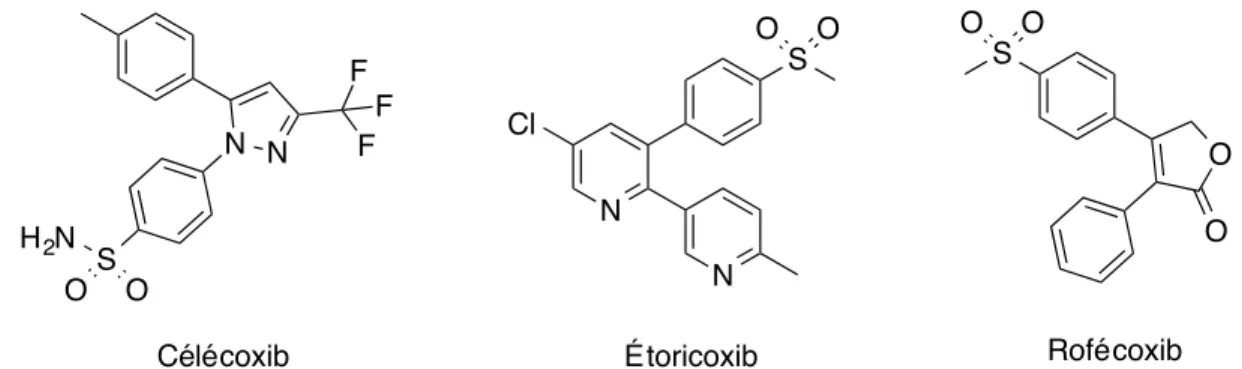
En effet, la toxicité gastro-intestinale reliée à l’inhibition de COX-1 et des prostaglandines a mené, en 1999, à la mise en marché du célécoxib (CelebrexÒ), premier AINS inhibant sélectivement COX-2. Toutefois, ces inhibiteurs de COX-2 ne sont pas dénués de toxicité et d’effets secondaires. Par exemple, il a été démontré que le célécoxib, l’étoricoxib (Arcoxia) ainsi que le rofécoxib (Vioxx)(Figure 5) sont associés à une augmentation de risques cardio-vasculaires.15-16
Figure 5. Structure du célécoxib, de l’étoricoxib et du rofécoxib, trois AINS sélectifs
pour l’isoforme COX-2.
N N S O O H2N F F F SO O N N Cl SO O O O
Célécoxib Étoricoxib Rofécoxib
OH O Cl Cl NH OH O O O OH O Ibuprofène Diclofénac Acide
acétylsalicylique
O
OH O Naproxène
Les effets secondaires associés à l’utilisation d’AINS ont été très étudiés, et les essais cliniques ont montré des effets négatifs sur le système digestif et le système cardiovasculaire tels que le risque accru d’ulcère gastroduodénaux et l’augmentation du risque de crise cardiaque.17-18 Au Canada, le problème est d’autant plus important étant donné que 37% des patients canadiens plus âgés reçoivent potentiellement au moins un médicament inapproprié, dont 17% suggèrent la prise de diclofénac, même si ce dernier est lié à plus de risques cardiaques que le naproxène.19-20
1.4.3. Mécanisme d’action anti-inflammatoire des AINS
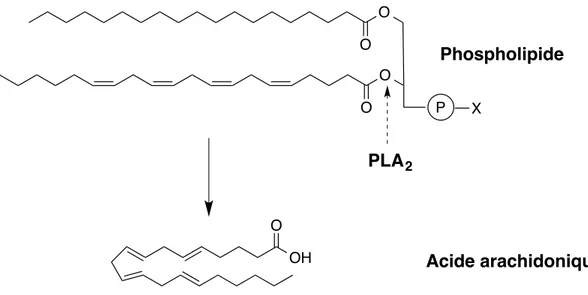
Lorsque les cellules sont activées par différents stimuli suite à une réponse inflammatoire, les membranes lipidiques produisent rapidement de l’acide arachidonique (AA), un médiateur lipidique. Ce dernier est initialement sous forme estérifiée dans les membranes cytosoliques, et doit être activé par la phospholipase A2 (PLA2) afin de se libérer de la membrane lipidique.21-22 La PLA2 hydrolyse le lien ester en position deux des phospholipides (Figure 6).
Figure 6. Voie de synthèse de l’AA à partir des phospholipides par la PLA2.
L’AA libérée sert ensuite de substrat pour les cyclooxygénases (COX), les lipoxygénases (LOX) et les cytochromes (CYP) menant à la formation de
O O O O P X PLA2 Phospholipide Acide arachidonique O OH
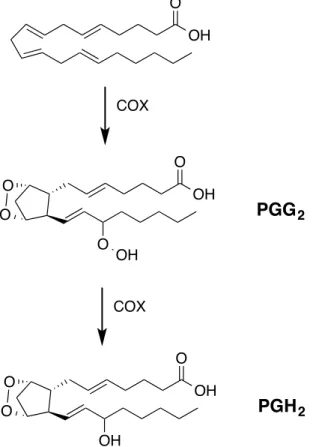
prostanoïdes et de leucotriènes. La grande majorité des cellules ont la capacité de convertir l’AA en prostanoïdes.23 Dans la voie de synthèse des prostanoïdes, l’AA subit deux transformations par les COXs. La première consiste en une double oxygénation en position 11R et 15S menant à la PGG2, et la seconde est effectuée par une hydroperoxydase, menant ainsi à la PGH2 (Figure 7).
Figure 7. Voie de synthèse de PGG2 et PGH2 à partir de l’AA par les COXs (COX-1 ou COX-2).
Par conséquent, l’activité des COXs est presqu’ubiquitaire. Cependant, seulement la COX-1 est produite d’une façon continue par le corps humain, et n’est pas influencée par les conditions physiologiques, d’où son appellation d’enzyme constitutive. Contrairement à COX-1, COX-2 est appelée inductible puisqu’elle est produite seulement lorsqu’il y a des signes inflammatoires tels que la présence de certaines cytokines ou de facteurs de croissance. Les métabolites normalement synthétisés à partir de l’acide arachidonique sont les prostaglandines/thromboxanes
Acide arachidonique COX O OH O OH O O O OH PGG2 COX O OH O O OH PGH2
ainsi que les leucotriènes, qui sont reliés à l’inflammation bronchique, à l’hypertension, au contrôle de la pression artérielle ou encore au contrôle de l’agrégation plaquettaire. Les prostaglandines sont synthétisées par les deux isoformes, tandis que les thromboxanes le sont seulement par COX-1 et les prostacyclines seulement par COX-2 (Figure 8).
Figure 8. Schéma décrivant l’effet des AINS sur la synthèse des thromboxanes,
prostaglandines et prostacyclines.
1.4.4. Coûts associés aux traitements des maladies inflammatoires chroniques
Puisque les maladies inflammatoires chroniques regroupent le cancer, le diabète, les maladies cardiovasculaires et plusieurs autres, et qu’elles causent plus de la moitié des décès, la charge économique associée au traitement des patients est très élevée. Aux États-Unis, il a été démontré que 70% des personnes ayant plus de 65 ans utilisent des AINS sur une base hebdomadaire. Également, plus de la moitié d’entre eux en prennent quotidiennement. Le coût total des AINS associés à ces ordonnances a été de 4,8 milliards de dollars US, et celui des AINS en vente libre
Acide arachidonique (AA)
Cyclooxygénase 5-Lipoxygénase COX-1 COX-2 Constitutif Inductible Acide acétylsalicylique Ibuprofène Diclofénac Naproxène Célécoxib Étoricoxib Rofécoxib Prostaglandines Thromboxanes Prostacyclines Leucotriènes
cardiovasculaires, en 1998, atteignaient 21 milliards de dollars.25 Des études plus récentes (2011) ont estimé que les maladies chroniques représentaient un fardeau économique de plus de 190 milliards de dollars, en raison de la perte de productivité et du coût des traitements.26 En 2016, les maladies chroniques ont causé la mort prématurée de plus de 225 000 canadiens, 25% étant associé à des maladies cardiovasculaires et 31% aux cancers.27 La charge économique, mais également la charge sociale associées aux maladies chroniques et aux effets secondaires suite à la prise de médicaments rend le développement de nouveaux anti-inflammatoires encore plus alarmant.
1.5. Le psoriasis
Les premiers cas répertoriés de psoriasis datent de 300 ans avant J.-C. Dans le recueil de livres médicaux Corpus Hippocraticum, où l’on décrit les symptômes de la lèpre, semble plutôt décrire le psoriasis. Ceci n’est pas étonnant, puisque les deux pathologies ont souvent été confondues, causant ainsi un rejet des personnes psoriasiques par le reste de la société. Le mot psoriasis découle du terme « psora », qui signifie démangeaison, et a été nommé ainsi par le « père de la médecine » Hippocrate.28
Le psoriasis est une maladie chronique qui est causée par plusieurs facteurs. Ces derniers peuvent être génétiques, immunologiques ou encore environnementaux. Cette pathologie auto-immune est étudiée depuis plusieurs décennies, ayant permis la découverte de plusieurs médicaments pouvant traiter, du moins partiellement, le psoriasis. Les travaux réalisés ont également permis de mieux comprendre la pathogénèse de cette pathologie. Initialement, le psoriasis était seulement considéré comme étant un trouble d’hyperprolifération de l’épiderme, laissant de côté tout le côté génétique et environnemental.
Le psoriasis est une pathologie cutanée touchant entre 1,5 et 5% de la population dans les pays développés comme le Canada et les États-Unis.29 Il a été déterminé que c’est plus d’un million de Canadiens qui souffrent de psoriasis. Même si le psoriasis est une pathologie présente mondialement, certaines régions du globe sont plus à risque. En effet, les personnes vivant proche de l’équateur sont moins enclins à avoir cette maladie cutanée que celles vivant au nord.30
Le psoriasis peut être présent aussi bien chez les nouveau-nés que chez les personnes âgées. Il peut se déclencher à tout moment, et peut être présent autant chez les femmes que chez les hommes. La qualité de vie des personnes atteintes se voit être diminuée, en raison de l’inconfort causé par l’inflammation et l’hyperprolifération kératinocytaire. Cette dernière entraîne la formation de plaques rougeâtres qui desquament et qui empoisonnent par le fait même la vie des patients. Il a également été déterminé que de 10 et 30% des patients psoriasiques développeront éventuellement de l’arthrite psoriasique, ce qui leur cause des douleurs additionnelles, de la rougeur et de la rigidité au niveau des articulations. Le psoriasis peut se développer sous différentes formes, soit le psoriasis en plaques, qui est la forme la plus fréquente, en goutte, pustuleux, inversé ou encore érythrodermique (Figure 9).
Figure 9. Formes de psoriasis. Psoriasis en goutte (A), érythrodermique (B), en
plaques (C), pustuleux (D) et inversé (E).
1.5.2. Traitements
En raison de la haute prévalence de la pathologie, et par conséquent du grand intérêt en recherche scientifique, il existe à ce jour plusieurs traitements palliatifs pour le psoriasis. Il y a tout d’abord différents traitements topiques, tels que les corticostéroïdes (bétaméthasone, clobetasol, flurandrenolide), les dérivés de la vitamine D3 (calcipotriol, calcitriol) et un dérivé de la vitamine A (tazarotène). On utilise également des combinaisons de calcipotriol et de bétaméthasone31, des combinaisons de bétaméthasone et d’acide salicylique (les kératolytiques) ainsi que des protecteurs cutanés (composés de glycérol, de gelée de pétrole et de paraffine). De plus, on utilise également des traitements systémiques, tels que la cyclosporine A, le methotrexate ou encore la phytothérapie avec des plantes telles que la
Oldenlandia diffusa, Rehmannia glutinosa et la Salvia miltiorrhiza.32-33 Finalement,
des traitements dits « biologiques » tels que l’ustekinumab, l’etanercept, l’adalimumab et le secukinumab ont récemment vus le jour, ces derniers inhibant différentes cytokines telles que TNF-a, IL-12, IL-17 et IL-23.34-36
A B C
1.6. L’interleukine-6 et l’inflammation chronique
L’interleukine-6 est une cytokine produite au sein même d’un site inflammatoire et joue un rôle très important puisqu’elle stimule la production des protéines de phase aiguë comme la protéine C-réactive ou le sérum amyloïde A. Ces protéines servent à la restauration cellulaire ainsi qu’à l’homéostasie en recrutant les cellules immunitaires au site de l’inflammation.37-38 Par conséquent, plusieurs travaux ont démontré le lien existant entre la quantité d’IL-6 produite et le psoriasis. En effet, il a été prouvé qu’il y avait beaucoup moins d’IL-6 présent sur les peaux normales comparativement à celles psoriasiques. De plus, la quantité d’IL-6 présente dans le plasma des patients normaux est indétectable (<1,5 ng/mL), tandis qu’elle peut atteindre 7,5 ng/mL chez certains patients psoriasiques.39 Par conséquent, l’interleukine-6 est un biomarqueur utile pour la détermination d’un potentiel anti-inflammatoire en général, et peut se révéler utile également pour la détermination du potentiel antipsoriasique d’une molécule. Il a été prouvé que différents anticorps tels que olokizumab, sirukimab et tocilizumab viennent bloquer l’action des récepteurs de l’interleukine-6, ces derniers ayant démontré un potentiel antipsoriasique certain, prouvant ainsi que les inhibiteurs d’IL-6 sont une voie à ne pas négliger pour le traitement du psoriasis.40-41
2. Les urées aromatiques substituées (UASs)
2.1. Origine des UASs et travaux antérieurs
Ce projet de maîtrise sur de nouvelles urées aromatiques substituées anti-inflammatoires se fonde sur les travaux des 30 dernières années du professeur René C.-Gaudreault et de son équipe. Leurs travaux portaient principalement sur les relations structure-activité (RSA) de nombreuses urées ainsi que de leurs dérivés, analogues et bioisostères tels que les 2-amino-oxazolines et les imidazolidones. Tout d’abord, l’équipe a travaillé pendant plusieurs années au développement d’urées aromatiques ayant un potentiel anticancéreux, comme la
N-(4-tert-butyl)phenyl-N’-(2-chloroethyl)urée (4-tBCEU) ou encore la N-4-iodophenyl-N’-(2-chloroethyl)urée (4-ICEU) (Figure 10).
Figure 10. Structure de la 4-tBCEU et de la 4-ICEU, deux molécules
anticancéreuses.
Il a été démontré que le mode antiprolifératif de ces dernières est lié à l’alkylation de l’acide glutamique en position 198 de la b-tubuline, ce qui conduit à la dépolymérisation des microtubules et à l’anoïkose des cellules cancéreuses.42-43 De plus, il est connu que l’alkylation de la b-tubuline a un effet sur ASK1, une kinase régulatrice du signal d’apoptose.44 ASK1 vient par la suite activer p38, une kinase activée par un agent mitogène (MAPK), qui joue un rôle central en ce qui a trait à l'apoptose cellulaire, mais également en ce qui concerne la production de cytokines pro-inflammatoires (Figure 11). 44-46
Figure 11. Voie de signalisation reliant la b-tubuline aux cytokines pro-inflammatoires telles que l’IL-6 et le TNFa.
N H N H Cl O N H N H Cl I O 4-tBCEU 4-ICEU Alkylation de la b-tubuline Apoptose Production de cytokines pro-inflammatoires ASK1 p38
La kinase p38 est liée à plusieurs maladies inflammatoires, telles que l’arthrite rhumatoïde, le psoriasis ou la maladie d’Alzheimer. Ces pathologies dépendent toutes de la production de cytokines pro-inflammatoires comme l’IL-6 et le TNFa. 45-47 Puisque les CEUs ont un effet sur l’alkylation de la b-tubuline et que cette dernière est liée aux cytokines pro-inflammatoires, l’équipe du Dr C.-Gaudreault a émis l’hypothèse que les CEUs pourraient avoir un impact sur la production d’IL-6, ainsi que sur d’autres facteurs pro-inflammatoires (TNFa, IL-17 et IL-1b).48
Une recherche pilote en collaboration avec la compagnie pharmaceutique Fujisawa pharmaceuticals ainsi que la Dre Roxanne Pouliot a été effectuée afin de déterminer l'effet des CEUs sur une peau psoriasique modèle. Le témoin positif utilisé fut les CEUs et le témoin négatif fut les mêmes molécules, mais sans l'atome de chlore, qui est responsable des propriétés alkylantes des molécules. Cette classe de molécules sans halogène porte le nom d'éthylurées (EUs). Il s'est avéré que le témoin négatif était dépourvu de cytotoxicité, mais capables de « normaliser » de la peau psoriasique tant humaine (in vitro) (études effectuées chez Fujisawa) que de la peau psoriasique modèle (études effectuées chez Dre Pouliot) selon des protocoles déjà établis (Figures 12 à 14). 49-52
Figure 12. Structure générale des CEUs et des EUs. N H N H Cl O R Chloroéthylurées (CEUs) N H N H O R Éthylurées (EUs)
Figure 13. Analyses histologiques des coupes de peaux psoriasiques modèles
colorées au trichrome de Masson. Substituts sains (A-C), substituts psoriasiques
(D-F), substituts témoins (A et D), substituts traités avec la tBEU (B et E) et substituts
traités avec MTX (C et F).
Figure 14. Mesure de l’épiderme pour les substituts sains (H) et psoriasiques (P)
par un test ANOVA (p < 0.05, n = 3, N = 3, 90 mesures par condition). Les données présentées correspondent à la moyenne ± l’écart-type (***) = p-value < 0.0001. Des différences significatives ont pu être observées au niveau de l'épaisseur de l'épiderme entre les substituts sains et les substituts psoriasiques (60.2±8.9 vs. 105.9±21.0 µm). De plus, lorsque les substituts psoriasiques sont traités avec la
tBEU ou le MTX, une diminution significative de l’épaisseur de l’épiderme fût
observée comparativement avec les substituts psoriasiques non traités (60.6 ± 11.9 and 59.5 ± 11.5 vs 105.9 ± 21.0 µm). Quant aux substituts sains, aucune différence significative n’a été observée entre les substituts sans traitement et avec traitements (60.2 ± 8.9 vs 62.8 ± 11.1 and 60.6 ± 9.0 µm).
Ces résultats prometteurs ont ainsi donné l’idée à Dr C.-Gaudreault d’effectuer des variations non seulement au niveau du cycle aromatique, mais également au niveau de la partie aliphatique, soit de substituer le groupement éthyle par différents groupements alkyles et cycloalkyles. De plus, la substitution du groupement urée par un de ses bioisostère permettra d’obtenir une plus grande chimiothèque et d’ainsi effectuer des relations structure-activité plus poussées.
3. Les bioisostères
3.1. Isostères et bioisostères
Les isostères ont été défini en 1919 par Irving Langmuir comme étant des composés ou groupes d’atomes ayant le même nombre d’atomes et d’électrons. Cette définition part du fait que, selon la théorie de valence, lorsque les composés ont le même nombre d’atomes, ces derniers ont également le même nombre d’électrons, qui devraient par conséquent s’arranger de la même façon, et avoir des propriétés physiques semblables (Tableau 1).53 Selon cette description, le dioxyde de carbone (CO2) est un isostère du protoxyde d’azote (N2O).
Tableau 1. Groupes d’isostères selon Irving Langmuir, en 1919. Groupe Isostères 1 H-, He, Li+ 2 O2-, F-, Ne, Na+, Mg2+, Al3+ 3 S2-, Cl-, Ar, K+, Ca2+ … … 10 CO2, N2O, N3-, CNO -… … 20 MnO4-, CrO4
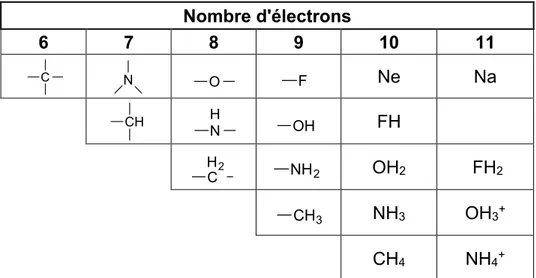
2-Quelques années plus tard, Grimm (1925) énonça la loi de déplacement d’hydrure. Cette loi qualifie d’isostères les atomes situés jusqu’à quatre déplacements du tableau périodique, si ces derniers viennent s’unir avec un ou des atomes d’hydrogènes. De cette façon, les combinaisons se comportent comme des pseudo-atomes, semblables aux éléments à leur droite dans le tableau périodique (Tableau
2).54
Tableau 2. Groupes d’isostères selon Grimm et la loi de déplacement d’hydrure, en 1925. Nombre d'électrons 6 7 8 9 10 11 Ne Na FH OH2 FH2 NH3 OH3+ CH4 NH4+ C N CH O H N H2 C F OH NH2 CH3
Erlenmeyer, en 1932, a complété la définition de Langmuir et de Grimm, en affirmant que les isostères sont des atomes, ions ou molécules dont le nombre d’électrons de valence peut être considéré comme étant identique (Tableau 3).
Tableau 3. Groupes d’isostères selon Erlenmeyer, basé sur le nombre d’électrons périphériques.
Nombre d'électrons périphériques
4 5 6 7 8 N+ P S Cl ClH P+ As Se Br BrH S+ Sb Te I IH As+ PH SH SH2 Sb+ PH2 PH3
De façon plus générale, on peut qualifier d’isostères deux composés chimiques dont les molécules ont des volumes, des formes et des densités électroniques comparables. En plus de compléter la définition, Erlenmeyer proposa trois explications supplémentaires au concept d’isostères. Premièrement, les éléments présents dans la même famille du tableau périodique seraient des isostères. Ensuite, il ajouta quelques groupes qui semblent différents à première vue mais que lorsqu’utilisés chimiquement, ont des propriétés similaires. C’est le cas entre autres pour les pseudohalogènes, tel que chlorure (Cl) est isostère du cyanure (CN) et du thiocyanate (SCN). Troisièmement, il ajouta le concept d’équivalence de cycles. Par exemple, il était connu que le benzène et le thiophène possédait des propriétés semblables, puisque les anticorps étaient incapables de distinguer les deux composés.
La définition de bioisostère a été proposée en 1950 par Harris Friedman, et caractérisait des substituants ou groupes possédant des propriétés chimiques ou physiques similaires, ce qui leur conférait des propriétés biologiques similaires. De plus, il affirmait également que lorsque des composés avaient des effets contraires,
un effet antagoniste, ces derniers devaient également être considérés comme étant des bioisostères, en autant qu’ils agissent sur le même site actif.55
3.2. Utilité des bioisostères
Suite à la découverte et à la classification des bioisostères, ces derniers sont devenus rapidement utilisés pour la conception de nouveaux médicaments. Le but principal à la synthèse de bioisostères est d’augmenter les propriétés physiques ou biologiques désirées, sans qu’il y ait de grand changement dans la structure chimique. Toutefois, lorsque les bioisostères sont synthétisés, ceux-ci ne sont pas toujours plus efficaces que la version précédente, puisque le changement structural imposé provoque un changement au niveau de la taille, de la forme, de la distribution électronique, de la polarité ainsi que sur plusieurs autres facteurs, ceux-ci ayant tous un rôle à jouer concernant l’activité de la molécule face à sa cible thérapeutique.
3.3. Applications dans la conception de médicaments
Le développement de bioisostères a été adopté comme une approche tactique fondamentale utile pour aborder un certain nombre d'aspects associés à la conception et au développement de médicaments. Le remplacement de certains groupements par d’autres permet aux chimistes médicinaux d’optimiser leur composé phare, tout en ayant le même effet pharmacologique et les mêmes propriétés biologiques. Par conséquent, les bioisostères servent entre autres à augmenter l’efficacité, améliorer ou diminuer la sélectivité, modifier les propriétés pharmacocinétiques (e.g. solubilité et hydrophobicité), modifier la stabilité, modifier ou éliminer les toxicophores, diminuer les effets secondaires et encore simplifier la voie de synthèse du composé biologiquement actif. Différents exemples d’applications des bioisostères peuvent être retrouvés dans la conception de médicaments. Par exemple, lorsque le groupement ester de la procaïne, un anesthésique local, est remplacé par un groupement amide, nous obtenons la procaïnamide, qui est un médicament contre l’arythmie cardiaque. Également, lorsque le groupement thiourée de la métiamide, un anti-ulcéreux, est remplacé par
un groupement cyanoguanidine, le nouveau composé (cimétidine) perd sa toxicité envers les granulocytes, qui menait parfois à l’agranulocytose, qui se caractérise par la diminution de granulocytes dans le sang (Figure 15).56-57
Figure 15. Structure de la procaïnamide et de la cimétidine, respectivement des
bioisostères de la procaïne et de la métiamide. 3.4. Bioisostères d’urées
Il existe plusieurs groupements chimiques qui peuvent servir de bioisostères pour le groupement urée (Figure 16). Certains de ces bioisostères ont déjà démontré un potentiel anti-inflammatoire, tels que les thiourées ainsi que les squaramides. La synthèse de ces derniers se devait donc d’être effectuée afin de comparer leur effet sur l’inhibition de la production d’IL-6 par rapport aux urées préalablement synthétisées. H2N O O N H2N N H O N Procaïne Procaïnamide S N H N H S N N N H S N N N N Métiamide Cimétidine N H
Figure 16. Structure de différents bioisostères du groupement urée.
3.4.1. Thiourées
Les thiourées sont très similaires aux urées, à l’exception de la substitution du carbonyle par un thiocarbonyle. Au niveau des propriétés chimiques, il y a quelques différences entre les urées et les thiourées. Premièrement, l’électronégativité de l’oxygène est plus élevée que celle du soufre, ce qui change la polarité des molécules synthétisées. Également, le pKa des urées est plus élevé que celui des thiourées, ce qui change les propriétés de solubilisation des composés dans différents solvants selon le pH.58 Certains groupes de recherche ont démontré que la présence du groupement thiourée menait à l’obtention de molécules anti-inflammatoires.59-60 Par conséquent, la synthèse des thiourées était un choix évident pour l’évaluation des relations structures-activités.
O NH2 H2N N NH2 H2N Cyanoguanidine S NH2 H2N Thiourée NH2 H2N N+ O O -Diaminonitroéthène O O H2N NH2 Squaramide N N S NH 2 Amino thiadiazole N H N NH 2 Amino imidazole N O NH 2 Amino oxazole N NH O NH2 Aminopyrimidinone CN
3.4.2. Squaramides
Les squaramides sont une forme de dérivés de l’acide squarique. Même si la structure chimique des squaramides peut sembler, à première vue, non reliée à celle des urées les propriétés chimiques et biologiques des squaramides sont quand même semblables.61 Premièrement, les squaramides sont d’excellents donneurs de liaisons H, ce qui est également le cas pour les urées. Également, les squaramides possèdent deux atomes d’hydrogène donneurs d’électrons, tout comme le groupement urée. Toutefois, l’effet combiné de deux carbonyles dans un squaramide par rapport à un seul carbonyle dans une urée permet de former des interactions plus fortes, et ce pour une plus grande possibilité d’angles. De plus, le caractère donneur et accepteur de la liaison hydrogène remarquable des squaramides s’explique par une augmentation de l’aromaticité lors de la formation de la liaison hydrogène, un phénomène qui distingue ce groupe des groupes à base d’urée.61 Également, plusieurs groupes de recherche ont démontré le potentiel du groupement squaramide en tant qu’anti-inflammatoire. En effet, plusieurs molécules possédant un groupement squaramide ont le potentiel en tant que traitement pour la maladie pulmonaire obstructive chronique (MPOC), une maladie inflammatoire chronique. Ces molécules sont des agonistes sélectifs de CXCR2, un récepteur de l’interleukine 8 impliqué dans le développement de la maladie inflammatoire.62-63 Le potentiel en tant qu’agent anti-inflammatoire des squaramides a expliqué la synthèse de ce bioisostère d’urées avec les groupements aromatiques et aliphatiques utilisés lors de la synthèse des UASs.
4. Mode d’action anti-inflammatoire possible des UASs et des
bioisostères
La détermination du mécanisme d’action anti-inflammatoire que possède nos composés est devenue une priorité afin d’orienter la conception et la synthèse des molécules de deuxième génération. Pour déterminer une cible potentielle sur laquelle nos composés agissent, nous avons utilisés l’aide d’un logiciel de prédiction de cible fourni par le « Swiss Institute of Bioinformatics ».64-65 Lorsque nous avons
d’IL-6 dans l’algorithme prédictif, ce dernier prédit toujours la même cible comme étant celle la plus probable, soit la lipid-phosphate phosphatase (EPHX2), également appelée époxyde hydrolase soluble (sEH). Suite à cette découverte, nous avons mis en branle une série d’essais biofonctionnels afin de confirmer les résultats de la simulation du SwissTargetPrediction.
4.1. L’époxyde hydrolase soluble
Pour comprendre la place de la sEH dans les voies inflammatoires, il faut premièrement savoir qu’elle fait partie de la cascade métabolique de l’acide arachidonique, tout comme les cyclooxygénases et les lipoxygénases. Dans la voie qui nous intéresse, les cytochromes P450 insèrent des groupements époxyde à différents endroits de l’acide arachidonique, ce qui donne différents régioisomères d’époxyeicosatriénoique (EETs). Ces EETs sont des médiateurs lipidiques à courte demi-vie qui seront rapidement hydrolysés par la sEH pour devenir des DHETs (dihydroxyeicosatriénoiques) (Figure 17).66
Figure 17. Métabolisme de l’acide arachidonique par les cytochromes P450 et la
sEH.
Il est connu que les EETs ont des effets biologiques bénéfiques, entre autres parce qu’ils ont des effets anti-inflammatoires, vasodilatateurs et également des effets de
protection cardiaque et rénale.67-70 Il est également connu que les produits
hydrolysés, les DHETs ont des effets biologiques similaires à ceux des EETs, mais à des niveaux beaucoup moins élevés. Les DHETs sont beaucoup plus stables,
mais ils sont moins bioactifs que les EETs.71 Par conséquent, une inhibition de la
sEH entrainera une augmentation des niveaux d’EETs, et une augmentation des effets anti-inflammatoires de ce substrat. Ainsi, inhiber la sEH et donc simultanément augmenter les EETs ouvre la porte à plusieurs voies potentielles thérapeutiques. Certains inhibiteurs de la sEH ont entré en phase clinique, c’est le cas entre autres pour les composés AR9281, AUDA et GSK2256294 (Figure 17). Il est possible de remarquer que les composés AR9281 et AUDA possèdent un groupement urée, tout comme la nouvelle famille de composés présentés dans ce mémoire.
Figure 18. Structure de AR9281, AUDA et GSK2256294, trois inhibiteurs de
l’activité enzymatique de la sEH.
Le composé AR9281, qui possède une IC50 de 8 nM sur l’enzyme sEH humaine, a
été en études cliniques de phase II, où il n’a pas démontré d’efficacité. Toutefois, ce dernier a produit une diminution de la pression sanguine dans un modèle
d’hypertension.72-73 En ce qui a trait au composé AUDA, ce dernier a une IC
50 de
3-100 nM. Ce composé est présentement en évaluation dans des essais cliniques de
phase II en tant que traitement pour la crise cardiaque.74-75 Le composé
N H NH O N O AR9281 N H NH O OH O AUDA H N N H O N N N HN N F F F GSK2256294
GSK2256294 est présentement en études cliniques de phase I afin de traiter la
maladie pulmonaire obstructive chronique (MPOC). Cette molécule possède une
IC50 de l’ordre du picomolaire, ce qui est très inférieur aux deux autres composés.
76-77 Puisque des molécules inhibitrices de l’activité enzymatique de la sEH sont en
études cliniques, et que certaines d’entre elles comportent un groupement urée, la détermination de l’effet de nos composés sur cette même enzyme est devenue cruciale. Par conséquent, un chapitre supplémentaire s’est ajouté à mon projet de maîtrise, qui a mené à une publication présentée dans le chapitre 3 de ce présent mémoire.
Chapitre 1
1. Hypothèses de recherche
L’étude pilote en collaboration avec l’entreprise Fujisawa Pharmaceuticals ainsi que la Dre Roxanne Pouliot a permis de mettre en évidence le potentiel anti-inflammatoire d’urées ne contenant pas d’atome de chlore, retirant ainsi le potentiel alkylant et anticancéreux des composés. Suite à cette étude pilote, nous pensons que la modification des groupements présents sur le noyau aromatique ainsi que sur la partie aliphatique présents à gauche et à droite du groupement urée permettra d’obtenir des molécules ayant un très grand potentiel anti-inflammatoire. Afin d’obtenir une grande chimiothèque de composés possédant des variations au niveau du cycle aromatique, à la chaîne aliphatique mais également au niveau du groupement uréique et ainsi pouvoir effectuer des études de relations structure-activité, la synthèse d’une nouvelle famille de composés potentiellement anti-inflammatoire se devait d’être effectuée. Par conséquent, la synthèse de bioisostères d’urées, tels que les thiourées et les squaramides, permettrait d’optimiser l’efficacité ainsi que les propriétés biopharmaceutiques de nos composés.
2. Objectifs
À partir de l’hypothèse que les UASs ainsi que ses bioisostères ont un potentiel anti-inflammatoire supérieur à celui des EUs, l’objectif général de mon projet de recherche est d’effectuer la synthèse d’une grande famille de composés ayant des structures inédites regroupant les UASs, les thiourées ainsi que les squaramides. Suite à leur synthèse, le potentiel anti-inflammatoire des composés est ensuite évalué sur des kératinocytes de peau humaine.
L’objectif de la première partie de ma maîtrise, correspondant au chapitre 2, est d’effectuer la synthèse, la purification, la caractérisation et la détermination du potentiel anti-inflammatoire des UASs et de ses dérivés thiourées. Pour y arriver, la voie de synthèse proposée est celle de la synthèse des CEUs précédemment publiée (Figure 1), à l’exception de l’utilisation de différents alkylisocyanates ou alkylisothiocyanates plutôt que du chloroéthylisocyanate.78 Ce projet de maîtrise a également comme objectif d’optimiser la synthèse des nouveaux composés en modifiant la quantité d’aniline et d’isocyanate, en modifiant le solvant réactionnel, la température et le temps de réaction.
Figure 1. Schéma de synthèse potentielle pour l’obtention des UASs et des
thiourées.
La seconde partie de ce mémoire, le chapitre 3, a pour objectif la détermination d’un mécanisme d’action anti-inflammatoire probable pour notre nouvelle série de composés. Pour cette partie, il faut tout d’abord identifier une cible potentielle sur
NH2 R X C N R1 (1,5 eq.) T.P, 18h. R N H NH R1 X DCM X = O ou S
R = 3 ou 4-iodo, 3 ou 4-tert-butyl, 3 ou 4-cyclo-hexyl R1 = ethyl, cyclo-propyl, cyclo-butylmethyl, cyclo-pentyl
l’inflammation, et également prouver que nos composés touchent effectivement cette cible. Cette partie mènera également à la détermination des composés possédant le meilleur potentiel anti-inflammatoire par cette voie. Finalement, des études de relations structure-activité pourront être effectuées suite aux résultats obtenus.
Chapitre 2
Synthèse et étude des propriétés
anti-inflammatoires d’urées aromatiques substituées et
de ses dérivés thiourées
Avant-propos
Le chapitre 2 inclut un article scientifique qui sera soumis au journal Bioorganic and
Medicinal Chemistry Letter.
Mon directeur de recherche, le Dr René C.-Gaudreault ainsi que mon co-directeur de recherche, le Dr Stéphane Gobeil, ont tous deux supervisés les travaux menant à cette publication.
J’ai contribué à cet article en effectuant la synthèse, la purification et la caractérisation de tous les composés présents dans cet article. Au niveau biologie, j’ai participé à toutes les expériences de cytotoxicologie, d’impact sur le cycle cellulaire ainsi que de détermination du potentiel anti-inflammatoire par méthode immuno-enzymatique de type ELISA. Ces expériences ont été réalisées avec l’aide de madame Marie-France Côté et de monsieur Joël Boutin. J’ai contribué à la rédaction du manuscrit en assemblant les informations nécessaires à la création de tableaux et figures ainsi qu’à la rédaction de plusieurs paragraphes. J’ai également rédigé la partie expérimentale et la section informations supplémentaires de cette publication. J’ai également contribué à cet article en y joignant les spectres RMN 1H et 13C, HPLC ainsi que SM et SMHR.