ETUDE DE LA VIRULENCE DU STAPHYLOCOCCUS AUREUS ISOLÉ DE MAMMITES BOVINES
par
Elodie Demontier
Mémoire présenté au Département de biologie en vue de l’obtention du grade de maître ès sciences (M. Sc.)
FACULTÉ DES SCIENCES UNIVERSITÉ DE SHERBROOKE
Le 22 avril 2020
Le jury a accepté le mémoire de Madame Elodie Demontier dans sa version finale.
Membres du jury
Professeur François Malouin Directeur de recherche Département de biologie
Professeure Sheela Ramanathan Codirectrice de recherche
Département de médecine et des sciences de la santé
Professeure Carole Beaulieu Évaluatrice interne Département de biologie
Professeur Viktor Steimle Président-rapporteur Département de biologie
iv SOMMAIRE
La mammite bovine est une maladie inflammatoire pouvant se manifester sous une forme clinique ou sous-clinique (asymptomatique) et l’infection peut évoluer soit vers une forme chronique soit vers la guérison. Les infections intramammaires (IIM) sont responsables d’importantes pertes économiques pour l’industrie laitière principalement dues à la diminution du rendement et de la qualité du lait, à l’impossibilité de vente, aux coûts des traitements, et aux réformes hâtives.
Staphylococcus aureus est un pathogène opportuniste au fort potentiel de virulence présent de
façon commensale sur la peau et les muqueuses d’un large panel d’hôtes. Il s’agit de la bactérie pathogène la plus prévalente dans les cas d’IIM chez le bovin laitier. Grâce à ses nombreux facteurs de virulence, il va pouvoir échapper au système immunitaire de l’hôte et résister aux traitements antibiotiques ce qui le rend difficile à traiter et à éliminer. Plusieurs études se sont focalisées sur la caractérisation phénotypique et génotypique d’isolats de S. aureus impliqués dans les IIM. Tandis que d’autres études se sont basées sur leur origine clonale (e.g. types spa et MLST) pour essayer de trouver des corrélations entre certains types de souches et l’évolution de l’infection. Deux précédentes études dans le laboratoire ont permis d’aboutir à des corrélations partielles entre certains gènes de virulence et certaines caractéristiques d’isolats sur la durée et le type d’IIM induit. Cependant, certains paramètres d’importance étaient manquants.
Ainsi, la présente étude avait pour objectif principal d’étudier la virulence de S. aureus isolés de mammite bovine déjà caractérisés selon leur origine clonale. Pour se faire, au moins trois isolats de S. aureus appartenant aux types spa majoritaires dans les troupeaux bovins canadiens ont été sélectionnés et comparés dans des modèles in vitro et in vivo reflétant les IIM. Dans un premier temps, le rôle protecteur du biofilm envers les antibiotiques d’usages vétérinaires a été déterminé pour les S. aureus déjà caractérisés. À l’exception de la souche sa3493 (t267) ayant une résistance borderline à la pirlimycine (4 μg/mL), toutes les souches étaient sensibles en
v culture planctonique aux antibiotiques testés. Les cultures en biofilm ont montré que les types
spa avec une forte production de biofilm (t605 et t13401) ne sont pas ou très peu affecté par les
antibiotiques dans ce mode de culture contrairement à ceux produisant un biofilm modéré ou faible. Le gène bap (corrélation avec une forte production de biofilm) a aussi été recherché et a été associé uniquement au type t605. De même, les days in milk (DIMs) les plus longs ont été associés au type t605, les reliant au tarissement. Dans un second temps, les capacités d’adhérence et de persistance des isolats ainsi que leur cytotoxicité ont été étudiées en fonction de leur origine clonale sur un modèle d’IIM sur les cellules épithéliales de la glande mammaire bovine (MAC-T). Seule la souche sa3456 (t2445) a montré une capacité forte à persister dans les MAC-T. Enfin, les principaux types spa retrouvés dans les IIM bovines ont été comparés dans un modèle d’IIM sur des souris en lactation. Les souches de types spa t529 et t359 avaient une meilleure faculté de colonisation de la glande mammaire comparativement aux t605, t13401 et t267, alors qu’aucune corrélation forte n’a été trouvée entre les types spa et le niveau local d’inflammation (mesure de la MPO). L’analyse des cytokines induites lors de l’infection ont permis de faire ressortir deux grands groupes : (1) les souches t605, t13401 et t267, et (2) celles t529. Ainsi, le groupe t529 semble induire davantage de cytokines impliquées dans la réponse immunitaire en phase aiguë comparativement à l’autre groupe, suggérant que le potentiel à induire des IIM cliniques est plus important.
L’ensemble de ces résultats montre que les types spa sont de bons indicateurs pour prédire l’évolution de la maladie et l’efficacité des traitements lors des IIM. Pouvoir anticiper l’évolution de la maladie et anticiper les cas difficiles permettrait une meilleure gestion du troupeau en cas d’IIM bovine à S. aureus.
Mots-clés : Staphylococcus aureus, mammite bovine, type spa, biofilm, sensibilité aux antibiotiques, cellules épithéliales bovines, persistance, réponse immunitaire, inflammation.
vi REMERCIEMENTS
Je tiens à remercier en premier lieu mon directeur de recherche, le professeur François Malouin, de m’avoir donné l’opportunité de travailler sur ce projet, pour son expertise scientifique et la confiance qu’il accorde à ses étudiants dans la gestion de leur projet, ce qui m’a permis de développer des savoir-faire et des expertises de qualité en toute autonomie.
Je remercie également ma codirectrice, la Pre Sheela Ramanhatan pour ses conseils avisés dans toutes les questions concernant l’immunité. Merci aussi aux membres de mon comité-conseil, Pr Viktor Steimle et Pre Carole Beaulieu.
Je remercie le professionnel de recherche Eric Brouillette pour son aide et son expertise en expérimentation animale, et le professionnel de recherche Jean-François Lucier pour son expertise en bio-informatique. Merci aussi au Pr Simon Dufour de l’Université de Montréal pour sa contribution à la vérification d’une de nos hypothèses.
Je voudrais aussi remercier Céline Ster, PhD, pour son soutien scientifique et sa présence bienveillante qui, je pense, a aidé plus d’un étudiant. Ma gratitude va également à tous mes collègues de travail pour la bonne ambiance de travail et les discussions enrichissantes qu’elles soient d’ordre scientifique ou non. Je remercie aussi ma famille pour leur soutien et je dédie ce mémoire à mon fils, Alessio, dont la naissance m’a donné encore plus de force pour poursuivre mes buts.
Enfin, merci au Réseau canadien de recherche sur la mammite bovine et la qualité du lait (RCRMBQL, Université de Montréal, St-Hyacinthe, Qc, Canada) et au réseau Op+Lait, le FRQNT le Regroupement stratégique pour un lait de qualité optimale (Université de Montréal, St-Hyacinthe, Qc, Canada) dont la bourse CREATE a permis de financer en partie ce projet.
vii TABLE DES MATIÈRES
SOMMAIRE ………...………. iv
REMERCIEMENTS ……….………...… vi
LISTE DES ABRÉVIATIONS ……….….. xi
LISTE DES TABLEAUX ………...……… xiv
LISTE DES FIGURES ………...……….… xv
CHAPITRE 1 : INTRODUCTION GÉNÉRALE ………...…… 1
1.1 Les infections intramammaires bovines ………....……….… 1
1.1.1 Qu’est-ce que la mammite bovine ? ...……….…...….…. 1
1.1.2 Les IIM bovines à Staphylococcus aureus …..………...……. 2
1.1.2.1 L’étiologie des IIM à S. aureus ………. 2
1.1.2.2 La colonisation et l’invasion de la glande mammaire bovine ………..…. 3
1.1.2.3 La virulence de S. aureus dans les IIM bovines ……… 3
1.1.2.4 La réponse immunitaire de l’hôte lors des IIM à S. aureus ……….……. 5
1.1.2.4.1 Généralités ……….………..…...… 5
1.1.2.4.2 Le système immunitaire innée ……….…... 6
1.1.2.4.3 Le système immunitaire adaptatif ………...……… 8
1.1.2.4.4 Les cytokines ……….……... 8 1.2 Staphylococcus aureus ……….………..… 10 1.2.1 Description de S. aureus ………... 10 1.2.2 La pathogénicité de S. aureus ………..…..….…. 11 1.2.2.1 Définition et généralités ……….…………... 11 1.2.2.2 Le biofilm ……….…….… 11 1.2.2.3 La pénétration intracellulaire ………..……... 13 1.2.2.4 Les toxines ………...…………..… 14
viii
1.2.2.4.2 Les superantigènes (SAg) ………….………..……...……. 14
1.2.2.4.3 Les leucocidines (Luk) ………....… 15
1.2.2.4.4 Les hémolysines ………..…… 16
1.2.2.5 Les exoenzymes ………. 16
1.2.2.6 Les MAMP ……….... 17
1.2.2.7 La protéine A, la staphyloxanthine et vWbp ………...……….. 17
1.3 Les origines clonales des S. aureus impliqués dans les IIM bovines …….... 18
1.3.1 Les différents types de classification ………..………... 18
1.3.1.1 Généralités ………..…………...… 18
1.3.1.2 Le typage spa …..………….……….….…..….…… 19
1.3.1.3 Le typage MLST ….……….……….……… 19
1.3.2 Les types clonaux dans les troupeaux bovins laitiers ……….. 21
1.3.3 Les types clonaux dans les troupeaux bovins laitiers du Canada ………… 23
1.3.3.1 Les études réalisées au Canada ……...………….…………...………….. 23
1.3.3.2 Le type spa t529 ………...…..……... 24
1.3.3.3 Les types spa t267 et t359 …..………...……… 25
1.3.3.4 Le type spa t605 ……..………...……..…. 26
1.3.3.5 Le type spa t2445 …………...………..………...……….. 28
1.3.3.6 Le type spa t13401 ………..…...……...………… 29
1.4 Hypothèses et objectifs de recherche ……..…………...……… 29
CHAPITRE 2: ARTICLE SCIENTIFIQUE 1 ……...……….……….………... 32
Antibiotic susceptibility of different Staphylococcus aureus spa types recovered from cow quarter milk samples and tested in planktonic and biofilm cultures……… 32
2.1 Avant-propos ….……….………..…………. 32
2.2 Contribution des auteurs .……….…….. 33
2.3 Résumé en français …..……….………. 34
2.4 Title page ..………..……….….. 36
ix
2.6 Introduction …..………..……… 37
2.7 Materials and methods ………..………. 39
2.7.1 Bacterial isolates ………..…………...…………. 39
2.7.2 DNA extraction ………..………..………… 41
2.7.3 Detection of bap gene ………..……… 42
2.7.4 Biofilm quantification in vitro ………..……..……. 42
2.7.5 Antibiotics ………..…….……. 43
2.7.6 Antibiotic susceptibility of planktonic cells ………..………….. 43
2.7.7 Susceptibility of strains embedded in a biofilm ………...……… 44
2.7.8 Statistical analysis ………..……….. 45
2.8 Results ……..………..……… 46
2.8.1 Biofilm production in vitro and detection of the bap gene ……..………… 46
2.8.2 Association of spa types with parity, days in milk, and somatic cell score ……….. 47
2.8.3 Antibiotic susceptibilities ………...… 48
2.9 Discussion …...………..…. 53
2.10 Acknowledgements …..………..………..… 59
2.11 References …...………..……...… 60
CHAPITRE 3 : ARTICLE SCIENTIFIQUE 2 ……...….…………..………...…... 65
Characterization of Staphylococcus aureus bovine mastitis isolates representing the main Canadian spa types using in vitro and in vivo models of mastitis ...… 65
3.1 Avant-propos …..………... 65
3.2 Contribution des auteurs ……….……….……….. 66
3.3 Résumé en français ……..……….………. 67
3.4 Title page ...……….……….. 69
3.5 Abstract ……..………..……….. 70
3.6 Introduction …….………..………. 71
x
3.7.1 Bacterial isolates ……….………. 74
3.7.2 Hemolysis assay ………..………. 77
3.7.3 S. aureus cellular adherence and intracellular persistence ……..…………. 77
3.7.4 S. aureus cytotoxicity assay ……….………..……….. 78
3.7.5 Mouse intramammary infection models ……….……….. 79
3.7.6 MPO assays ………...………. 80
3.7.7 Preparation of mammary gland homogenates for cytokines and chemokines assay ………..………. 80
3.7.8 Statistical analysis ………..……….. 81
3.8 Results ..………..……… 81
3.8.1 Hemolytic activity …….………...……… 81
3.8.2 S. aureus cellular adherence and intracellular persistence …...…...………. 83
3.8.3 Colonization of mouse mammary glands ………..….….…… 84
3.8.4 Inflammation of mammary glands during IIM ………..……….…. 85
3.8.5 Cytokines analysis ………..…………. 87
3.9 Discussion ……...………..……. 90
3.10 Conclusion ………..…….……… 95
3.11 Acknowledgements ..………...…………..…………... 96
3.12 References ………...……….………… 96
CHAPITRE 4 : DISCUSSION GÉNÉRALE ET CONCLUSION .……...………. 101
4.1 Discussion générale ……….…..……….…... 101
4.2 Conclusion ………..……….………..… 111
ANNEXES ………..……….… 113
xi LISTE DES ABRÉVIATIONS
Ac : Anticorps
Ag : Antigène
AUC : the aera under the curve
Bap : Biofilm associated protein
BMEC : Bovine Mammary Epithelial Cells
CC : complexe clonal (clonal complex) CCS : compte des cellules somatiques CFU : colony forming unit
Clf : clumping factor
CMI : concentration minimale inhibitrice CNS : Coagulase Negative Staphylococci
DIM : Day in milk (jours en lait)
DMEM : Dulbecco’s Modified Eagle Medium
D-PBS : Dulbecco’s phosphate buffer saline
Eap : extracellular adherence protein
FnBP : fibronectin-binding protein hld : δ-hemolysin ou δ-lysin
ica : intercellular adhesion
IIM : Infection intramammaire
Ig : Immunoglobuline
IgBDs : immunoglobulin-binding domains
IL : Interleukine
IMI : Intramammary infection
IM : invasion media
INF : Interféron JEL : jours en lait
xii
LB : lymphocyte B
LT : lymphocyte T
LTA : acide téichoïque
lukM ou F : leukocidin M ou F
MAC-T : Mammary Alveolar Cells-large T antigen
MAMPs : microbe-associated molecular patterns
MHC : complexe majeur d’histocompatibilité MIC : minimal inhibitory concentration
MLST : multi-locus sequence type
MPO : Myélopéroxydase NK : natural killer
PCA : principal component analysis
PCR : polymerase chain reaction
PBS : Phosphate buffered saline
PIA : Polysaccharide intercellular adhesin
PNAG : poly-N-acetylglucosamine
RCRMBQL : Réseau canadien de recherche sur la mammite bovine et la qualité du lait SAgs : superantigènes (superantigens)
SaPI : Staphylococcus aureus pathogenicity island S. aureus : Staphylococcus aureus
SCC : somatic cell count
SE : staphylococcal enterotoxin ou entérotoxine staphylococcale seg : staphylococcal enterotoxin G
SEl : staphylococcal-like enterotoxin ou toxine staphylococcale similaire aux
entérotoxines
sen : staphylococcal enterotoxin N spa : staphylococcal protein A
ST : sequence type
xiii TGF: transforming growth factor (tumor growth factor)
Th: lymphocyte T helper ou T auxiliaire TLR : toll-like receptor
TNF : tumor necrosis factor ou facteur de nécrose tumorale
TSST-1 : toxine staphylococcale du choc toxique 1 UFC : unité formatrice de colonies
xiv LISTE DES TABLEAUX
CHAPITRE 1 : INTRODUCTION GÉNÉRALE
Table 1 Gènes de ménage utilisés pour le typage MLST dans l’espèce bactérienne S. aureus
p. 20
CHAPITRE 2 : ARTICLE SCIENTIFIQUE 1
Table 2 Characteristics of strains used in this study p. 40
CHAPITRE 3 : ARTICLE SCIENTIFIQUE 2
Table 3 Characteristics of strains used in this study p. 75
ANNEXES
Table 4 Type MLST des souches de S. aureus appartenant aux principaux types
spa retrouvés dans les cas d’IIM dans les troupeaux bovins laitiers
canadiens
xv LISTE DES FIGURES
CHAPITRE 1 : INTRODUCTION GÉNÉRALE
Figure 1 Le recrutement des cellules immunitaires innées au site de l’inflammation en réponse à l’invasion de l’agent pathogène
p. 7
Figure 2 Synthèse des processus et des acteurs de l’immunité d’importance impliqués dans l’évolution de la mammite bovine à S. aureus et dans l’élimination du pathogène
p. 10
Figure 3 Schémas d’un biofilm exopolysaccharidique dépendant du gène ica et d’un biofilm protéique dépendant du gène bap chez S. aureus
p. 12
Figure 4 Méthode d’attribution d’un type spa à un isolat de S. aureus p. 19 Figure 5 Méthode d’attribution d’un type MLST à un isolat de S. aureus p. 21
Figure 6 Domaines de la protéine Bap p. 27
Figure 7 Formation des fibres amyloïdes-like chez S. aureus bap positif p. 28
CHAPITRE 2: ARTICLE SCIENTIFIQUE 1
Figure 8 Mean of biofilm ratio produced in vitro for S. aureus strains of the main Canadian spa types
p. 47
Figure 9 Days in milk (DIM) for both high biofilm-producer t605 (bap+) and t13401 (bap-) strains
p. 48
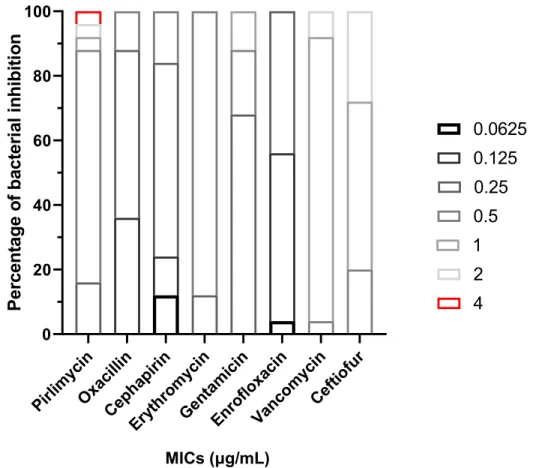
Figure 10 Percentage of bacterial inhibition at different antibiotic concentrations for the height antibiotics tested
p. 49
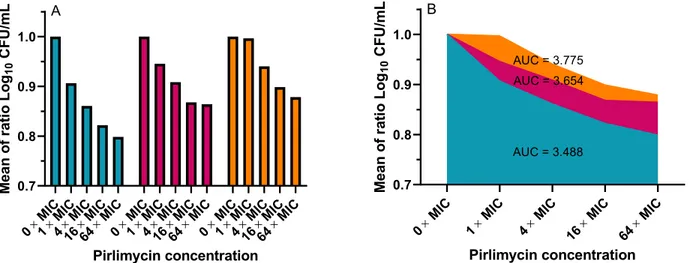
Figure 11 Influence of pirlimycin concentrations on bacterial survival after biofilm formation
xvi Figure 12 Influence of the amount of biofilm on the resistance to antibiotics by the
calculation of the area under the curve
p. 51
Figure 13 Influence of the increase of pirlimycin concentration on bacterial growth for both fractions planktonic and biofilm
p. 53
CHAPITRE 3: ARTICLE SCIENTIFIQUE 2
Figure 14 Diameters of S. aureus β-hemolysin measured on sheep blood agar for the main Canadian spa types
p. 82
Figure 15 Adherence and intracellular persistence of different S. aureus spa types on bovine mammary gland epithelial cells (MAC-T)
p. 83
Figure 16 Bacterial load in mammary glands 20 h post-intramammary infection p. 85 Figure 17 Inflammation levels as measured by MPO activity in infected mammary
glands 20 h post-infection
p. 86
Figure 18 Level of expression of cytokines detected in infected mammary gland 20 h post-infection
p. 88
Figure 19 Principal component analysis of cytokines expression detected in infected mammary gland 20 h post-infection
p. 89
ANNEXES
Figure 20 Cytotoxicité des S. aureus isolés de cas de mammite bovine sur les cellules MAC-T
p. 113
Figure 21 Superantigènes retrouvés parmi les S. aureus isolés de cas de mammite bovine canadienne
p. 114
Figure 22 Arbre phylogénétique des souches de S. aureus isolés de cas de mammite bovine selon leur origine clonale
1 CHAPITRE 1
INTRODUCTION GÉNÉRALE
1.1 LES INFECTIONS INTRAMAMMAIRES BOVINES 1.1.1 Qu’est-ce que la mammite bovine ?
La mammite bovine est une inflammation de la glande mammaire et des éléments anatomiques qui lui sont associés (e.g. le trayon) (Contreras et Rodríguez, 2011) en réponse à l’entrée dans le canal de bactéries pathogènes (Oviedo-Boyso et al., 2007). C’est une des causes principales de l’utilisation des thérapies antibiotiques (e.g. la pirlimycine) dans les troupeaux bovins laitiers. Les infections intramammaires (IIM) peuvent se manifester sous une forme clinique qui va être symptomatique (e.g. la fièvre, la rougeur) et aiguë, ou sous une forme sous-clinique qui se caractérise par l’absence de symptômes apparents, la bactérie pouvant ainsi se disséminer insidieusement dans le troupeau. Une augmentation du compte des cellules somatiques (CCS) dans le lait et la détection de la bactérie pathogène à l’analyse bactériologique permettent d’identifier l’infection. Ce sont des infections qui peuvent aussi s’installer de façon chronique chez la vache.
Aux coûts des traitements antibiotiques s’ajoutent des pertes liées à la diminution du rendement et de la qualité du lait, et dans la forme la plus aiguë de la maladie la vache peut subir une réforme hâtive (Bannerman et al., 2008; Bascom et Young, 1998; Esslemont et Kossaibati, 1997). La mammite bovine est donc une pathologie qui cause de nombreuses pertes économiques pour l’industrie laitière dans le monde estimées à 35 milliards de dollars par an (Bannerman et al., 2008; Wellenberg et al., 2002). Au Canada, l’industrie laitière estime ses pertes à plus de 400 millions de dollars, soit environ 15% de ses revenus nets totaux.
2 Plusieurs bactéries pathogènes peuvent induire une IIM chez le bovin comme Streptococcus
uberis, Klebsiela pneumoniae ou Escherichia coli. Mais la bactérie pathogène la plus souvent
rencontrée dans les IIM bovines est Staphylococcus aureus (Bardiau et al., 2014; Watts, 1988) et elle est impliquée à la fois dans les mammites cliniques et sous-cliniques.
1.1.2 Les IIM bovines à Staphylococcus aureus 1.1.2.1 L’étiologie des IIM à S. aureus
L’agent étiologique le plus fréquemment isolé dans les cas de mammite bovine est la bactérie à Gram positif Staphylococcus aureus (Bardiau et al., 2014; Watts, 1988). L’émergence de la maladie et la dissémination de la bactérie pathogène dans le troupeau bovin laitier se fait par contact, essentiellement lors de la traite via les mains de l’éleveur, les chiffons, la machine de traite, mais aussi par contact direct avec les vaches infectées (Zadoks et al., 2002, 2011) ou la litière souillée par du lait contaminé. S. aureus peut causer des mammites cliniques ou sous-cliniques, chroniques ou non, mais cet agent pathogène opportuniste est connu pour avoir une tendance à causer plutôt des IIM sous-cliniques. C'est une réelle problématique pour les éleveurs, car l’absence de symptôme au niveau macroscopique permet à la bactérie de se diffuser insidieusement dans le cheptel et elle ne va être détectée que lors du compte des cellules somatiques (CCS) qui vont être anormalement élevées et nettement supérieures à 200 000 cellules par millilitre de lait (Curone et al., 2018), mais aussi lors de prélèvement de lait où la bactérie va être détectée. Dans les cas de mammites cliniques, l’apparition des symptômes comme de la fièvre, la rougeur, un lait grumeleux ou l’abattement de la vache permettent de détecter rapidement la maladie, d’isoler l’animal et de commencer la thérapie antibiotique. Cependant, les IIM à S. aureus restent difficiles à traiter, l’efficacité du système immunitaire et des traitements antibiotiques étant réduite du fait de la capacité de pénétration intracellulaire de cette bactérie et de sa faculté à former du biofilm (Oviedo-Boyso et al., 2007).
3 1.1.2.2 La colonisation et l’invasion de la glande mammaire bovine
Lors des IIM à S. aureus, la première étape est la colonisation du canal du trayon. Celle-ci débute avec la propulsion d’un petit nombre de bactéries dans le trayon pendant la traite ou pendant une infusion intramammaire (Akers et Nickerson, 2011). S. aureus se retrouve ensuite dans la citerne où il va se multiplier dans le lait avant de se disséminer dans les conduits et les citernes, adhérer à la surface des cellules épithéliales de la glande mammaire, et commencer la colonisation du tissu mammaire. La capacité de la bactérie à adhérer aux cellules épithéliales est primordiale dans le processus de colonisation de S. aureus et l’établissement de l’infection (Baselga et al., 1994; Rainard et al., 2018) en empêchant que la bactérie pathogène soit évacuée lors des traites journalières. Le processus d’adhésion passe par la reconnaissance des récepteurs TLR2 présents à la surface des cellules épithéliales par l’acide lipotéichoïque (LTA) et le peptidoglycane présents à la surface de S. aureus (Aitken et al., 2011).
L’adhérence est aussi l’étape qui précède l’invasion des cellules épithéliales de la glande mammaire de l’hôte par S. aureus afin d’échapper aux actions du système immunitaire (e.g. phagocytose) et des traitements antibiotiques (Craven et Anderson, 1984; Hébert et al., 2000). Lors du processus d’invasion, la fibronectin-binding protein (FnBP) de S. aureus s’accroche à l’intégrine α5β1 de la cellule épithéliale (Boulanger et al., 2006). Quand leur affinité est assez
élevée, un signal de translocation va permettre d’endocyter S. aureus par un réarrangement du cytosquelette de la cellule hôte (Boulanger et al., 2006). La protéine d’adhérence extracellulaire (Eap) de S. aureus joue également un rôle important dans le processus d’endocytose par la cellule épithéliale (Boulanger et al., 2006).
1.1.2.3 La virulence de S. aureus dans les IIM bovines
Lors de la colonisation de la glande mammaire, S. aureus va sécréter un certain nombre de facteurs de virulence visant à maintenir l’infection et à favoriser sa survie dans son hôte. La survie de la bactérie passe par des stratégies d’évitement du système immunitaire et de
4 protection contre les traitements antibiotiques. Cependant, aucune corrélation forte n’a pu être établie entre les facteurs de virulence impliqués dans la pathogenèse de S. aureus et la manifestation de la maladie.
Les clones de S. aureus impliqués dans les cas de mammites bovines sont connus pour être aptes à envahir les cellules épithéliales de la glande mammaire in vitro (Almeida et al., 1996; Hamill
et al., 1986; Usui et al., 1992) et in vivo chez la vache et la souris (Boulanger et al., 2006; Hébert et al., 2000). La faculté pour cet agent pathogène à envahir les cellules de son hôte a été reliée
dans la littérature à l’établissement d’une infection intramammaire chronique (Kerro Dego et
al., 2002; Rainard et al., 2018). Les MAMPs (microbe-associated molecular patterns)
impliquées dans le processus d’adhérence (LTA et peptidoglycane) ont été associées au maintien de l’inflammation dans les cas des IIM chroniques (Rainard et al., 2018).
S. aureus est capable de libérer un certain nombre d’enzymes visant à dégrader des éléments
constituant la membrane des cellules (e.g. lipase), intervenant dans l’antibiorésistance (e.g. β-lactamase) ou des enzymes ayant d’autres fonctions (e.g. coagulase) et il peut posséder des hémolysines. Ces facteurs de virulence sont généralement associés aux blessures présentes sur l’épithélium de la glande mammaire et à l’inflammation locale (Rainard et al., 2018). Ce sont ces dommages tissulaires qui sont responsables de la présence de sang dans le lait à cause de la perte d’étanchéité du tissu mammaire, et ils participent aussi à la manifestation des signes cliniques dans la forme aiguë de la maladie (Rainard et al., 2018).
Les toxines jouent un rôle important dans la virulence des clones de S. aureus impliqués dans la mammite bovine. Ainsi, dans le cas spécifique de l’IIM bovine, la leucocidine (Luk) M a été associée à la forme clinique de la maladie (Pichette-Jolette et al., 2019) et LukMF’ (spécifique au bovin) est connue pour protéger l’agent pathogène de la phagocytose et pour être associée à l’apparition de signes cliniques plus intenses (Hoekstra et al., 2018; Rainard et al., 2018; Vrieling et al., 2015, 2016). Les entérotoxines, les entérotoxines-like et TSST-1 sont classées comme superantigènes (SAgs). Par leur mode d’action, elles vont être capables de stimuler
5 différentes sous-familles de lymphocytes T (LT) chez la vache laitière. Cependant, lorsque plusieurs SAgs sont exprimés par la bactérie, une ou plusieurs sous-familles de LT identiques peuvent être stimulées (Wilson et al., 2018). Ainsi, une souche de S. aureus possédant un grand nombre de SAgs va induire une surstimulation des lymphocytes T, entraînant une réaction immunitaire plus forte et une manifestation clinique de la maladie (Wilson et al., 2018).
La capacité de production de biofilm des souches de S. aureus est d’importante dans la manifestation de la maladie. Ainsi, les souches produisant des quantités intermédiaires de biofilms sont généralement associées à l’apparition de dommages tissulaires plus importants et à un meilleur contrôle de l’agent pathogène par le système immunitaire, conduisant à son élimination (Gogoi-Tiwari et al., 2017; Pereyra et al., 2017). En contrepartie, une souche de S.
aureus caractérisée comme forte productrice de biofilm est reliée à des dommages tissulaires
moindres, à une réponse immunitaire plus tardive avec des phases où le système immunitaire sera de nouveau stimulé traduisant une moins bonne maîtrise de l’infection conduisant à une manifestation chronique de l’IIM (Gogoi-Tiwari et al., 2017; Pereyra et al., 2017; Pichette-Jolette et al., 2019; Veh et al., 2015). Un fort taux de PNAG (poly-N-acetylglucosamine) a aussi été corrélé aux souches infectant les troupeaux et à l’IIM persistante (Grunert et al., 2018).
1.1.2.4 La réponse immunitaire de l’hôte lors des IIM à S. aureus 1.1.2.4.1 Généralités
L’efficacité de la réponse immunitaire est variable suivant la race bovine (Curone et al., 2018), et la vache holstein, l’espèce la plus répandue dans les troupeaux bovins canadiens, est dite très sensible aux infections. Cette sensibilité accrue est due à la forte sélection subie par l’espèce dans le but d’augmenter les rendements de lait. Ainsi, le stress métabolique dû au vêlage et à la production du colostrum aboutit à une réponse immunitaire moins efficace, ce qui est probablement aussi le cas lors d’une infection pour cette race (Curone et al., 2018).
6 Les nombreuses études ayant pour but de déterminer le rôle du système immunitaire dans les IIM bovines à S. aureus ont permis de mettre en évidence certains processus ou certains acteurs du système immunitaire d’importance dans l’évolution de la maladie ou l’élimination de l’agent pathogène. Pourtant, aucune corrélation forte entre la réponse immunitaire de l’hôte et le potentiel de virulence de S. aureus n’a pu être établie. Même si la réponse immunitaire innée semble jouer un rôle d’importance, l’immunité adaptative a aussi un rôle à jouer.
1.1.2.4.2 Le système immunitaire innée.
L’immunité innée comprend tous les éléments constitutifs formant la première ligne de défense contre les agents pathogènes (e.g. la peau, les muqueuses) et des facteurs induits (e.g. la réponse inflammatoire, la phagocytose). Dans les cas de mammites bovines, qu’ils soient cliniques ou sous-cliniques, l’adhérence de S. aureus avec les récepteurs TLR2 des cellules épithéliales de la glande mammaire va enclencher la réponse inflammatoire locale par la sécrétion de cytokines pro-inflammatoires et de chimiokines induisant le recrutement des cellules immunitaires sur le site de l’infection grâce à une augmentation du flux sanguin et une augmentation de la perméabilité de l’endothélium vasculaire (Figure 1). Dans les heures suivant l’infection, le compte des cellules somatiques va augmenter pour atteindre plusieurs millions de cellules par millilitre de lait (CCS normal autour de 200 000 cellules par millilitre). Elles regroupent entre autres des macrophages, des leucocytes et des cellules NK (natural killer) (Boutet et al., 2006). Les leucocytes sont attirés sur le site de l’infection notamment par des composants du complément comme C5a (Oviedo-Boyso et al., 2007; Rainard et al., 2018). Parmi les leucocytes, les macrophages et les neutrophiles vont avoir un rôle d’importance dans le contrôle et l’élimination de l’agent pathogène, mais aussi dans le phénomène inflammatoire.
En effet, les macrophages correspondent au type cellulaire le plus abondant dans le lait et le tissu mammaire sain (Curone et al., 2018). Lors de l’infection, ils vont avoir pour rôle de phagocyter S. aureus, les débris tissulaires et les cellules endommagées, mais aussi de recruter les neutrophiles sur site par l’intermédiaire de cytokines chimiotactiques comme IL-8
7 (interleukine 8). Après la phagocytose, ils vont exposer par le MHC de classe II (complexe majeur d’histocompatibilité) les antigènes (Ag) qui seront reconnus par les lymphocytes T et B (LT et LB), et les cellules dendritiques aboutissant à la libération de cytokines.
Figure 1 : Le recrutement des cellules immunitaires innées au site de l’inflammation en réponse à l’invasion de l’agent pathogène (Modifiée d’Oviedo-Boyso et al., 2007).
Les neutrophiles sont les premières cellules à migrer sur site et correspondent au type cellulaire dominant dans les IIM (Oviedo-Boyso et al., 2007). Cependant, leur augmentation en nombre ne semble pas avantager la race holstein dans la lutte contre les S. aureus causant les IIM (Bannerman et al., 2008). Les neutrophiles vont intensifier la réponse inflammatoire sur le site de l’infection et constituent, à ce titre, un réel marqueur de l’inflammation, notamment par la libération de myélopéroxydase (MPO), une péroxydase hémique (Serteyn et al., 2003). Lorsqu’elle se lie aux microorganismes, elle va produire de l’acide hypochloreux (HOCl), des radicaux, des superoxydes et d’autres espèces capables de faire de la chloration ou de la nitration qui vont pouvoir attaquer de nombreuses molécules (e.g. hèmes, groupes aminés, lipides insaturés) perturbant la perméabilité de la membrane lipidique et altérant de nombreuses
Migration à travers l’endothélium Chimiokines Bactéries Macrophage Cytokines
(TNF-α, IL-1β) Cellulesendothéliales
Neutrophile Lumière du
8 fonctions enzymatiques, dont celles de la chaîne respiratoire, ce qui entraîne la mort de la bactérie (Serteyn et al., 2003). Cependant, en trop grande concentration, les neutrophiles et la MPO vont avoir également un effet délétère sur les cellules de l’hôte en maintenant l’inflammation et en intensifiant les dommages sur les tissus (Serteyn et al., 2003).
1.1.2.4.3 Le système immunitaire adaptatif
L’immunité adaptative est médiée par les lymphocytes T et B (LB et LT). Les LT se subdivisent en deux catégories, les LT helper (Th ou CD4+) stimulent les LB pour qu’ils produisent les Ac (Th2) qui reconnaissent et neutralisent spécifiquement les Ag. Ils produisent aussi des INF-γ (interféron gamma) pour activer les macrophages (Th1) et les LT cytotoxiques (Tc ou CD8+) qui vont détruire les cellules infectées. Les LB dits mémoires sont formés de façon spécifique contre les Ag rencontrés lors de l’infection primaire. Ayant une durée de vie longue dans l’organisme, ils vont réagir rapidement lors d’une seconde exposition à l’Ag qui lui est spécifique.
Les principaux acteurs impliqués dans l’immunité adaptative lors des IIM à S. aureus sont les lymphocytes cytotoxiques CD8+ et l’augmentation de la production d’IgG2 (Oviedo-Boyso et
al., 2007). Le premier est caractéristique d’une réponse immunitaire dirigée contre des bactéries
intracellulaires, tandis que le second est surtout rencontré à la suite d'une stimulation avec un antigène polysaccharidique et ils sont connus pour avoir une meilleure efficacité contre les agents pathogènes encapsulés (Eurofins Biomnis).
1.1.2.4.4 Les cytokines
Les cytokines et les chimiokines sont des protéines ou des glycoprotéines solubles sécrétées par une grande variété de cellules telles que les cellules immunitaires (e.g. les neutrophiles) et les cellules tissulaires (e.g. les cellules épithéliales) (Oviedo-Boyso et al., 2007). Elles régulent le
9 recrutement des cellules immunitaires sur le site de l’inflammation et l’inflammation par l’intermédiaire des cytokines pro- et anti-inflammatoires.
Chez la vache laitière, les taux d’expression des cytokines varient dépendamment de la race, et la race holstein, plus sensible aux infections, est plus susceptible de développer une inflammation chronique due à une forte production des cytokines pro-inflammatoires IL-1β et TNF-α comparativement à d’autres races telle que la race Rendena (Curone et al., 2018). Ces deux cytokines sont souvent associées aux IIM à S. aureus (Bannerman, 2009; Bannerman et
al., 2004, 2008; Oviedo-Boyso et al., 2007) (Figure 2). Deux autres cytokines ont été associées
aux IIM causées par S. aureus : IL-12 qui est anti-inflammatoire et INF-γ qui est pro-inflammatoire, mais qui peut aussi avoir des propriétés anti-inflammatoires en inhibant la production des cytokines pro-inflammatoires IL-1 et IL-8 (Mühl et Pfeilschifter, 2003). Les cytokines IL-12 et INF-γ sont impliquées dans l’activation des neutrophiles et des macrophages (Bannerman, 2009; Bannerman et al., 2004, 2008), et favorise la réponse immunitaire de type Th1 (Bannerman et al., 2008; Trinchieri, 1997). Certains facteurs de croissance normalement présents dans une glande saine comme TGF-α et TGF-β1 voient leur concentration augmenter dans le lait lors d’une IIM à S. aureus, et sont respectivement pro-inflammatoires et anti-inflammatoires (Bannerman et al., 2008).
Lors d’une IIM à S. aureus, le système immunitaire de la vache va donc adopter de préférence des stratégies visant à combattre des bactéries intracellulaires (CD8+, IgG2) et le système immunitaire inné, notamment par le biais des neutrophiles, va jouer un rôle crucial dans l’apparition de l’inflammation et son maintien (Figure 2). En cas d’emballement du système immunitaire dû aux stratégies d’évitement de S. aureus ou de sa virulence (e. g. SAg) par exemple, des effets délétères pour l’hôte vont aggraver la maladie (e.g. la perte d’étanchéité des tissus).
10 Figure 2 : Synthèse des processus et des acteurs de l’immunité d’importance impliqués dans l’évolution de la mammite bovine à S. aureus et dans l’élimination du pathogène. Adaptation du texte d’Oviedo-Boyso et al. (2007) sur le schéma modifié de Delouis et Richard (1991) et de Dufreneix (2015).
1.2 STAPHILOCOCCUS AUREUS
1.2.1 Description de S. aureusStaphylococcus est une bactérie à Gram positif, catalase positive, d’un diamètre d’environ 0,5 à 1,5 μm. C’est une bactérie commensale qui se retrouve principalement dans les microbiotes cutanés et les muqueuses, mais elle est aussi présente dans l’environnement (Novick, 2003). Cependant, S. aureus est aussi connu pour être un agent pathogène opportuniste chez la majorité des êtres vivants, dont l’humain [e.g. les maladies nosocomiales (Barie et al., 2018; Fry et Barie, 2011)] et les troupeaux [e.g. la mammite bovine (Bardiau et al., 2014; Watts, 1988; Zadoks et al., 2002, 2011)]. Ainsi, S.
Cellule épithéliale mammaire (MEC) Cellule épithéliale myoépithéliale Fibroblaste Adipocyte Vaisseau sanguin Macrophage Neutrophile C5a CD8+ IgG2 TNF-α IL-1β IL-12
11
aureus va profiter d’une faiblesse immunitaire de son hôte ou d’une plaie ouverte pour
l’infecter.
1.2.2 La pathogénicité de S. aureus 1.2.2.1. Définition et généralités
La pathogénicité ou la virulence d’une bactérie pathogène ou d’un agent pathogène opportuniste correspond à l’aptitude de celle-ci à induire l’apparition d’une pathologie chez l’hôte. Les facteurs de virulence sont tous les processus et produits mis en place et sécrétés par la bactérie qui participent à la pathogénicité. Les facteurs inclus dans cette catégorie peuvent être des composants de la paroi bactérienne, des facteurs impliqués dans le processus d’invasion bactérienne dans les cellules de l’hôte, et des substances sécrétées par la bactérie.
Les facteurs de virulence, outre le fait d’induire la pathologie, vont aider l’agent pathogène dans le processus d’évasion du système immunitaire et des antibiothérapies. Les deux principales stratégies d’évitement de S. aureus sont sa capacité à former du biofilm et sa capacité à pénétrer dans les cellules épithéliales ou dans les cellules phagocytaires de son hôte. Cependant, d’autres facteurs de virulence pourraient également être impliqués dans ces stratégies d’évitement. Cependant, la pathogenèse de S. aureus lors des IIM bovines est assez complexe à élucider en raison de la multiplicité des facteurs de virulence présents chez S. aureus et explique la difficulté de son élimination dans la glande mammaire.
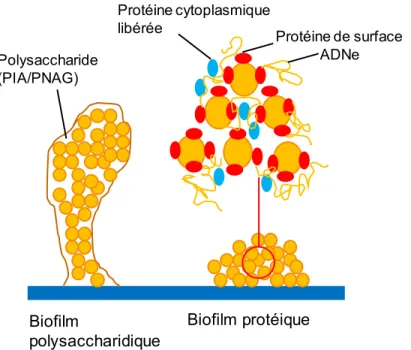
1.2.2.2 Le biofilm
Le biofilm correspond à une communauté de cellules bactériennes contenues dans une matrice de polymères autoproduite qui est attachée à une surface biotique ou abiotique. Sa mise en place comprend donc une phase d’adhérence de la bactérie sur la surface biotique ou abiotique par l’intermédiaire de constituants présents à la surface de la bactérie (e.g. l'acide téichoïque), une
12 phase de sécrétion où des facteurs adhésifs et les constituants du biofilm (e.g. PIA, PNAG) vont être excrétés, et enfin une phase de dispersion (e.g. les protéases) pour permettre à la bactérie de continuer la colonisation de l’hôte.
S. aureus est capable de former plusieurs types de biofilm, soit un biofilm dépendant des
exopolysaccharides (PIA et PNAG) et induit par les gènes icaADBC (intercellular adhesion locus) (Tremblay et al., 2014), soit un biofilm indépendant des exopolysaccharides, de type protéique, induit par la présence du gène bap (Taglialegna et al., 2016a) codant pour la protéine Bap (Biofilm associated protein) (Figure 3).
Figure 3 : Schémas d’un biofilm exopolysaccharidique dépendant du gène ica et d’un biofilm protéique dépendant du gène bap chez S. aureus (Inspirée de Zapotoczna et al., 2016).
Les souches bactériennes possédant le gène bap ont été associées à une capacité pour la souche de S. aureus de produire une forte quantité de biofilm (Snel et al., 2015; Taglialegna et al., 2016a). La première souche de S. aureus possédant le gène bap étudiée avait été isolée sur un
Biofilm polysaccharidique Biofilm protéique ADNe Protéine de surface Protéine cytoplasmique libérée Polysaccharide (PIA/PNAG)
13 cas de mammite chronique et avait été associée à la persistance de la maladie (Cucarella et al., 2001, 2004).
Le biofilm joue un rôle important dans l’évasion du système immunitaire par l’agent pathogène, notamment à la phagocytose, mais aussi pour la survie des bactéries pathogènes aux antibiothérapies, car les molécules vont difficilement diffuser dans la matrice de biofilm et seules les bactéries situées vers la surface seront tuées, ce qui va laisser au centre du biofilm des bactéries vivantes qui pourront poursuivre l’infection et la colonisation de l’hôte (Davies, 2003; Jacques et al., 2010).
1.2.2.3 La pénétration intracellulaire
S. aureus est décrite comme étant un agent pathogène extracellulaire. C’est-à-dire qu’il va
adhérer aux cellules, les lyser, et récupérer ainsi les nutriments qui les composent. Or, il a été montré que cette bactérie pathogène opportuniste peut également être retrouvée à l’intérieur des cellules épithéliales de l’hôte (e.g. les cellules épithéliales de la glande mammaire bovine) ou à l’intérieur des cellules phagocytaires (e.g. les neutrophiles) (Almeida et al., 1996; Boulanger et
al., 2006; Hamill et al., 1986; Hébert et al., 2000; Usui et al., 1992).
L’adhérence aux cellules de l’hôte permet à S. aureus de persister dans son hôte et d’y proliférer tout en évitant de se faire éliminer par le flux de lait lors de la traite, tandis que sa faculté de pénétration intracellulaire va participer au processus d’évasion du système immunitaire, notamment en échappant à la phagocytose, mais aussi de survivre aux traitements antibiotiques.
S. aureus exprime de nombreux facteurs de virulence impliqués dans l’adhérence et l’invasion
incluant la fibronectine (FnBP) (Craven et Anderson, 1984; Hébert et al., 2000) qui va se lier au fibrinogène et au collagène, et les clumping factor (Clf) A et B, l’acide téichoïque (LTA), la protéine d’adhérence extracellulaire (Eap), et des composants du biofilm (Boulanger et al.,
14 2006). Une fois que S. aureus a adhéré à la cellule de l’hôte et que leur affinité est assez élevée, le cytosquelette de la cellule hôte se réarrange et ce qui va permettre l’endocytose de l’agent pathogène dans les cellules épithéliales de la glande mammaire (Boulanger et al., 2006).
1.2.2.4 Les toxines
S. aureus peut exprimer un certain nombre de toxines pouvant être classées en plusieurs
catégories. Elles participent à différents aspects de la virulence comme l’évasion du système immunitaire, les lésions tissulaires, au l’exacerbation des symptômes de l’hôte.
1.2.2.4.1 Les toxines exfoliatives
Les toxines exfoliatives sont essentiellement retrouvées dans les S. aureus isolés de cas de maladie de la peau parmi lesquelles l’érythrodermie bulleuse avec épidermolyse chez les nouveau-nés et les jeunes enfants ou l’impétigo (Akiyama et al., 2003; Asanin et al., 2019). Toutes ces maladies ont un degré de morbidité très varié puisque certaines de ces pathologies vont se résorber d’elles-mêmes (e.g. les furoncles) tandis que d’autres vont nécessiter des traitements antibiotiques (e.g. la pneumonie), voir même avoir un potentiel de létalité élevé (e.g. la fasciite nécrosante) (Andrey et al., 2010; Asanin et al., 2019; Barie et al., 2018). Cependant, lors des IIM bovines ce sont plutôt les autres types de toxines qui vont être impliqués dans la pathologie.
1.2.2.4.2 Les superantigènes (SAg)
Les entérotoxines thermostables sont généralement incriminées dans les intoxications alimentaires, mais elles jouent aussi un rôle crucial dans la virulence de S. aureus isolés de cas de mammite bovine, dans l’évasion du système immunitaire de l’hôte et sont désignées sous l’appellation de superantigènes. Ce terme regroupe également la toxine du choc septique (TSST-1) et des entérotoxines-like. À ce jour, 26 SAg ont été recensés chez S. aureus (Wilson et al.,
15 2018) correspondant aux entérotoxines staphylococcales (SEA-SEE, SEG-SEJ et SER-SET), des toxines similaires aux entérotoxines-like staphylococcales (SElK-SElQ, SElU-SElX, SElY et SElZ) et TSST-1. Les gènes sont essentiellement localisés sur des îlots de pathogénicité (e.g. le cluster egc ou SAPIbov) ou sur des éléments génétiques mobiles (Wilson et al., 2018).
Ce sont des toxines d’importance au niveau des études de virulence, car il a été montré qu’environ 80% des souches de S. aureus commensales et pathogènes possèdent dans leur génome une moyenne de 6 gènes codant pour des SAg (Bröker et al., 2016; Grumann et al., 2014; Wilson et al., 2018), et dans le cas de la mammite bovine à S. aureus, les souches peuvent exprimer de 7 et 11 SAg pendant une infection naturelle (Wilson et al., 2018).
Le mode d’action des SAgs excrétés par la bactérie implique la liaison lymphocyte T-macrophage comme cible. En effet, les SAgs ont la capacité de se lier de façon non spécifique à la chaîne β du domaine variable d’un des récepteurs des lymphocytes T et à une molécule du CMH de classe II. Cette interaction forcée entre les cellules présentatrices d’antigènes (Ag) et les lymphocytes T entraîne une surstimulation de ces derniers (principalement les CD4+). Il en résulte une libération sans contrôle de cytokines incluant les interleukines (-1, -2 et -6), l’interféron gamma (INF-γ), le facteur de nécrose tumorale (TNF-α), et des chimiokines comme CCL2 et CCL3 aboutissant à des concentrations en cytokines pro-inflammatoires tellement importantes qu’elles vont avoir un effet délétère pour l’hôte en exacerbant ses symptômes (Wilson et al., 2018).
1.2.2.4.3 Les leucocidines (Luk)
Les leucocidines sont des exotoxines sécrétées par S. aureus lors de l’infection. Ce sont des toxines leucotoxiques et cytotoxiques qui participent à l’évasion du système immunitaire et aux dommages tissulaires. Dans le cas de la mammite bovine à S. aureus, les leucocidines LukM et LukF sont spécifiques aux souches d’origine bovine (Rainard et al., 2018) et ont une grande importance dans la pathogénicité. Dans l’étude de Pichette-Jolette et al. (2019), la présence du
16 gène lukM a été associée à la mammite clinique, tandis que les gènes lukMF’ ont été associés à l’évasion en protégeant S. aureus de la phagocytose et en induisant des signes cliniques plus intenses chez la vache (Hoekstra et al., 2018; Rainard et al., 2018; Vrieling et al., 2015, 2016).
1.2.2.4.4 Les hémolysines
Les hémolysines sont impliquées dans la lyse des érythrocytes de l’hôte ce qui permet à la bactérie de récupérer les nutriments qui les composent. Elles ont donc des effets cytotoxique et hémolytique, et leur mécanisme d’action vise soit à former des pores dans la bicouche phospholipidique de la cellule (e.g. érythrocyte, leucocyte, plaquette), soit à hydrolyser les phospholipides présents dans la bicouche (e.g. érythrocyte). Il existe 3 types d’hémolysine chez
S. aureus, l’hémolysine α, l’hémolysine β et l’hémolysine γ. Les hémolysines α et γ vont avoir
pour mode d’action la formation de pores dans la membrane de la cellule, tandis que l’hémolysine β va venir hydrolyser les sphingomyélines, des lipides présents dans la membrane cellulaire des érythrocytes. Elles sont associées à différents stades de maladie pouvant aller jusqu’à la septicémie.
1.2.2.5 Les exoenzymes
Les exoenzymes (e.g. les nucléases, lipases, coagulase) sont d’autres facteurs importants à prendre en compte dans la pathogénicité des souches de S. aureus. Lorsqu’elles sont sécrétées, elles participent aux blessures locales et à l’inflammation. Des dommages tissulaires trop importants entraînent une perte d’étanchéité entre les cellules ce qui induit une augmentation de la gravité de l’infection et se manifeste par la présence de sang dans le lait dans le cas d’IIM clinique (Rainard et al., 2018).
Les exoenzymes peuvent aussi être impliquées dans la résistance aux antibiotiques. C’est le cas de la lactamase dont la sécrétion va induire une résistance à la famille antibiotique des lactamines (pénicillines, céphalosporines, monobactames, carbapénèmes, inhibiteurs des
β-17 lactamases) en hydrolysant le noyau β-lactame présent dans la structure de cette classe d’antibiotique, la rendant inefficace dans son action bactéricide, en contrant l’annulation de la synthèse du peptidoglycane.
1.2.2.6 Les MAMP
Les MAMP (microbe-associated molecular patterns) ou PAMP (pathogen-associated
molecular patterns) sont des petites molécules présentes à la surface de la bactérie qui sont
capables de reconnaître des récepteurs de type TLR (toll-like receptor) présents à la surface des cellules de l’hôte. S. aureus étant une bactérie à Gram positif, elle possède à sa surface de l’acide lipotéichoïque (LTA) et du peptidoglycane qui sont capables de reconnaître les récepteurs TLR2. Cette reconnaissance est une première étape dans le processus d’adhérence de la bactérie aux cellules hôtes, notamment pour l’adhérence sur les cellules épithéliales (Aitken et al., 2011). Dans les cas d’IIM persistantes, les MAMP sont impliqués dans le maintien de l’inflammation (Rainard et al., 2018).
1.2.2.7 La protéine A, la staphyloxanthine et vWbp
La protéine A (SpA), codée par le gène spa, est spécifique à S. aureus, ce qui en fait un mode de typage reconnu internationalement pour cette espèce bactérienne. Ce mode de typage se nomme le typage spa. Cependant, cette protéine fait partie des facteurs virulence. SpA est localisée sur la surface de la bactérie et elle est sécrétée dans le milieu (Forsgren et Nordström, 1974; O’Halloran et al., 2015). Cette protéine est constituée de 4 ou 5 domaines de liaison à l’immunoglobuline (immunoglobulin-binding domains : IgBDs) répétés (O’Halloran et al., 2015; Sjödahl, 1977). Il est connu que la liaison entre SpA et les IgM humains entraîne la prolifération et l’épuisement des cellules B, ce qui empêche le développement de la réponse immunitaire adaptative (O’Halloran et al., 2015).
18 La staphyloxanthine est un pigment de type caroténoïde responsable de la couleur dorée caractéristique de S. aureus. Ce pigment est associé à la virulence des souches, car il a une action antioxydante aidant la bactérie à survivre aux espèces réactives de l’oxygène (e.g. le péroxyde d’hydrogène : H2O2) libérées par le système immunitaire et plus particulièrement par les
neutrophiles.
La protéine de liaison au facteur de von Willebrand (vWbp) est sécrétée par la majorité des S.
aureus en plus de la coagulase (Viana et al., 2010). Cette protéine interagit avec la glycoprotéine
mature nommée facteur de von Willenbrand (vWf) qui est impliquée dans la cascade de réaction de la coagulation (Bjerketorp et al., 2002, 2006; Viana et al., 2010). Le gène vwb, codant pour vWbp, est porté par des îlots de pathogénicité mobiles (SaPIs). Chez les ruminants et les équidés, les vWbp codés par SaPI sont connues pour posséder une région N-terminale unique spécifique pour activer la prothrombine (Viana et al., 2010). Ainsi, il pourrait s’agir d’un facteur de coagulation adapté aux animaux qui pourrait représenter un mécanisme important d’adaptation à l’hôte au niveau de la pathogénicité de S. aureus (Viana et al., 2010).
1.3 LES ORIGINES CLONALES DES S. AUREUS IMPLIQUÉS DANS LES IIM BOVINES
1.3.1 Les différents types de classification 1.3.1.1 Généralités
Il existe plusieurs types de classification pour les isolats de S. aureus reconnus internationalement. Les deux méthodes de typage les plus utilisées dans les études de caractérisation sont le typage MLST (multilocus sequence typing) et le typage spa. Ces deux techniques de typage permettent de retrouver l’origine clonale des souches de S. aureus grâce à des banques de données. Les études incluant du typage cherchent généralement à trouver des corrélations entre certains facteurs de virulence et un type clonal afin de trouver des stratégies
19 de diagnostic fiable sur le type d’IIM et anticiper les coûts relatifs au soin et à la diminution de rendement.
1.3.1.2 Le typage spa
Le typage spa est un mode de classification internationale se basant sur la séquence polymorphique VNTR de 24 pb (paires de bases) située sur la région 3’ d’un gène spécifique à
S. aureus nommé spa et codant pour la protéine SpA (staphylococcal protein A). Ainsi, chaque
changement dans la séquence répétée ou dans le nombre de répétitions conduit à assigner un unique code de répétition à la souche sous la forme d’un nombre correspondant au type spa de la souche soumise (Figure 4).
Figure 4 : Méthode d’attribution d’un type spa à un isolat de S. aureus
Inspirée du tutoriel de Bionumerics (https://www.applied-maths.com/). Séquence et répétition du gène spa prises sur Ridom spa Server (https://spaserver.ridom.de/). r signifie repeat.
1.3.1.3 Le typage MLST
Le typage MLST permet d’attribuer une origine clonale à un isolat de S. aureus en utilisant la séquence de fragments internes (environ 450 à 500 pb) de généralement 7 gènes de ménage
GAGGAAGACAACAACAAACCTGGT AAAGAAGACGGCAACAAACCTGGC r07 r23 r07 r23 t267 Gène spa 1. Séquence du gène 2. Répétitions successives 3. Type spa CTCCTTCTGTTGTTGTTTGGACCA TTTCTTCTGCCGTTGTTTGGACCG AAAGAAGACAACAACAAGCCTGGT r12 r21 TTTCTTCTGTTGTTGTTCGGACCA AAAGAAGACAA TTTCTTCTGTT r12 r21 r17 r34 r34 r34 r33 r34
20 (housekeeping genes) (Table 1). Pour chacun de ces gènes de ménage, les différences trouvées correspondent à des allèles distincts ce qui permet de définir un profil allélique à l’isolat étudié (Figure 5). Ce profil allélique va correspondre à un nombre unique correspondant au sequence
type (ST) de la souche bactérienne (Figure 5).
Table 1 : Gènes de ménage utilisés pour le typage MLST pour l’espèce bactérienne S. aureus (Modifié d’Enright et al., 2000).
Gènes Séquences/amorces Longueur
(pb)
Fonction
arcC 5' TTG ATT CAC CAG CGC GTA TTG TC -3' 5' AGG TAT CTG CTT CAA TCA GCG -3'
456 Carbamate kinase
aroE 5' ATC GGA AAT CCT ATT TCA CAT TC -3' 5' GGT GTT GTA TTA ATA ACG ATA TC -3
456 Shikimate
dehydrogenase glpF 5’ CTA GGA ACT GCA ATC TTA ATC C -3'
5' TGG TAA AAT CGC ATG TCC AAT TC -3'
465 Glycerol kinase
Gmk 5' ATC GTT TTA TCG GGA CCA TC -3' 5' TCA TTA ACT ACA ACG TAA TCG TA -3'
429 Guanylate kinase
Pta 5' GTT AAA ATC GTA TTA CCT GAA GG -3' 5' GAC CCT TTT GTT GAA AAG CTT AA -3'
474 Phosphate
acetyltransferase Tpi 5' TCG TTC ATT CTG AAC GTC GTG AA -3'
5' TTT GCA CCT TCT AAC AAT TGT AC -3'
402 Triosephosphate isomerase yqiL 5' CAG CAT ACA GGA CAC CTA TTG GC -3'
5' CGT TGA GGA ATC GAT ACT GGA AC -3'
516 Acetyl coenzyme A acetyltransferase
Toutes les souches possédant 5 gènes identiques sur les 7 nécessaires à l’attribution du ST peuvent être regroupées dans un même complexe clonal (CC). Cette classification permet donc de donner le ST du clone ancestral, mais aussi d’établir le cheminement évolutif des clones au
21 sein du CC, sachant que le génotype ancestral correspond au génotype qui est différent d’un seul loci sur les 7 gènes parmi les autres génotypes appartenant au même CC (Durand, 2009).
Figure 5 : Méthode d’attribution d’un type MLST à un isolat de S. aureus.
Séquence du gène arcC obtenue lors du séquençage du génome entier de la souche sa2539 en
paired-end 125 (Genome Québec, McGill University, Montréal, QC, Canada). Le profil
allélique pour chaque gène de ménage et le ST ont été obtenus avec PubMLST : https://pubmlst.org/bigsdb?db=pubmlst_saureus_seqdef.
1.3.2 Les types clonaux dans les troupeaux bovins laitiers
La mammite bovine à S. aureus constitue un problème majeur pour l’industrie laitière du fait des importantes pertes économiques qu’elle occasionne chaque année. De ce fait, dans l’optique de mieux comprendre pourquoi la mammite peut être clinique ou sous-clinique, persistante ou non, et d’anticiper les coûts financiers, différentes études à travers le monde se focalisent sur la diversité clonale des S. aureus infectant les troupeaux bovins laitiers dans différents pays ou
Isolat sa2539 (t529)
arcC aroE glpF gmk pta tpi yqiL
6 72 12 43 49 67 59
ST151
1. Séquencer les 7 gènes de ménages (e. g. arcC)
2. A chaque différence trouvée dans la séquence d’un même gène est attribué un allèle
4. Le profil allélique donne le sequence type (ST) de la souche de S. aureus 3. Les 7 allèles trouvés forment le profil allélique de la souche de S. aureus
TTATTAATCCAACAAGCTAAATCGAACAGTGACACAACGCCGGCAATGCCATTGGATACTTGTGGTGCAATGTCACAGGGTATGATAGGC TATTGGTTGGAAACTGAAATCAATCGCATTTTAACTGAAATGAATAGTGATAGAACTGTAGGCACAATCGTTACACGTGTGGAAGTAGATA AAAATGATCCACGATTTGATAACCCAACTAAACCAATTGGTCCTTTTTATACGAAAGAAGAAGTTGAAGAATTACAAAAAGAACAGCCAGA CTCAGTCTTTAAAGAAGATGCAGGACGTGGTTATAGAAAAGTAGTTGCGTCACCACTACCTCAATCTATACTAGAACACCAGTTAATTCG AACTTTAGCAGACGGTAAAAATATTGTCATTGCATGCGGTGGTGGCGGTATTCCAGTTATAAAAAAAGAAAATACCTATGAAGGTGTTGAA GCG arcC arcC 6
22 régions. La répartition et les caractéristiques des isolats de S. aureus issus d’IIM bovines à travers le monde sont donc bien documentées.
Ces études ont montré que les isolats de S. aureus prélevés lors d’IIM bovine sont spécifiques aux régions ou pays et qu’ils sont souvent associés à un type d’hôte, ce qui permet de détecter des modes de contamination d’origine zoonotique ou anthropozoonotique. Ainsi, ce type d’étude permet de mettre en évidence certaines problématiques sanitaires propres à une région ou à un pays. Par exemple, au Brésil ou en Corée, la découverte de clones d’origine humaine en forte proportion est révélatrice d’une lacune dans les procédures d’hygiène employées par l’éleveur lors des traites journalières. Cependant, elles peuvent aussi souligner des améliorations au cours du temps lorsque la proportion des clones d’origine humaine diminue fortement. C’est le cas au Brésil où les études de Silva et al. (2013) et de Bonsaglia et al. (2018) montrent une diminution de 34,1% des isolats de type spa t127/ST1/CC1, un complexe clonal associé aux souches bactériennes d’origine humaine.
Ces études mettent aussi en évidence des problématiques plus sérieuses inhérentes à certaines régions du monde, comme en Irlande où la proportion de S. aureus isolés de cas d’IIM bovine résistants aux antibiotiques est excessivement élevée [52%, (Budd et al., 2015)], et cette résistance est associée aux complexes clonaux CC97 majoritairement et CC5, le 1er étant relié
aux SARM chez l’humain et aux IIM bovines (Käppeli et al., 2019), le 2ième étant associé aux
SARM (Budd et al., 2015).
Des relations ont pu également être faites entre certaines origines clonales de souches de S.
aureus et les troupeaux bovins laitiers. Ainsi, les types spa t529, t267 par exemple sont
couramment associés aux problèmes d’IIM bovines (Käppeli et al., 2019; Pichette-Jolette et al., 2019; Veh et al., 2015). De même, les complexes clonaux CC705, CC151, ST151, CC8 ou CC97 sont associés aux troupeaux et aux IIM à S. aureus (Käppeli et al., 2019). Le complexe clonal CC151 a été relié à la possession de plusieurs superantigènes (Wilson et al., 2018).
23 La prévalence de certaines origines clonales de S. aureus causant des IIM bovines peut être assez similaire dans des régions ou des pays très éloignés géographiquement, et sans qu’il y ait eu d’échanges entre les cheptels. C’est le cas, par exemple, de la région de Zurich (Suisse) et du Canada, où l’origine clonale majoritaire est identique (t529) (Käppeli et al., 2019; Pichette-Jolette et al., 2019).
1.3.3 Les types clonaux dans les troupeaux bovins laitiers du Canada 1.3.3.1 Les études réalisées au Canada
Au Canada, plusieurs études de ce type ont été menées depuis le début des années 2010 et, ce notamment grâce à l’élaboration d’une base de données commune regroupant des milliers d’isolats bactériens récoltés sur 91 troupeaux bovins laitiers de différentes régions du Canada pendant 2 ans (2007 et 2008) (Reyher et al., 2011), dont de nombreux isolats de S. aureus font partie. Ces isolats sont regroupés dans la collection d’agents pathogènes de mammite du Réseau Canadien de Recherche sur la Mammite Bovine et la Qualité du Lait (RCRMBQL) (Faculté de Médecine Vétérinaire, Université de Montréal, Saint-Hyacinthe, Québec, Canada) (Reyher et
al., 2011). Ils proviennent tous de prélèvements effectués sur les quartiers contenant au moins
une colonie dans 10 μL (100 CFU/mL) (Reyher et al., 2011).
Deux études, prémices de celle qui va être exposée dans ce mémoire, ont été effectuées dans notre laboratoire à partir de cette collection, visant toutes deux à faire des caractérisations génotypique et phénotypique, du typage spa, du profilage VNTR (variable numbers of tandem
repeat, le nombre d’unités de répétition sur un même locus va varier d’une souche à l’autre
permettant, par exemple, de pouvoir suivre une souche dans le temps, et la détection se fait par PCR), ainsi que des mesures de biofilm afin d’essayer de trouver un lien entre la manifestation de la maladie et sa persistance ou non chez la vache et une ou plusieurs caractéristiques inhérentes aux isolats étudiés (Pichette-Jolette et al., 2019; Veh et al., 2015). Ces études ont permis de mettre en lumière certaines caractéristiques intéressantes, mais n’ont pas pu établir
24 de façon formelle un lien de cause à effet entre les types d’isolats et la maladie. Cependant, elles ont permis de mettre en évidence les origines clonales les plus prévalentes dans les troupeaux bovins laitiers canadiens en fonction de leur type spa, ce qui a permis la mise en place du projet présenté dans ce mémoire.
Au total, parmi les centaines d’isolats étudiés dans ces deux études, 6 types spa seulement se sont révélés prévalents. Les types spa dits prévalents regroupent 10 isolats et plus. Il s’agit des types spa t529 (32,6%), t267 (19,0%), t359 (10,2%), t605 (5,1%), t2445 (3,1%) et t13401 (2,8%), les pourcentages de répartition correspondent à ceux donnés dans l’étude de Pichette-Jolette et al. (2019) qui est la plus récente.
Malgré le fait que ces deux études n’ont pu établir de corrélation forte entre certains facteurs de virulence, la quantité de biofilm sécrété et le type spa sur la persistance ou non de la maladie ou l’lIIM clinique ou sous-clinique, elles ont parmi d’associer certains de ces facteurs à des origines clonales. D’autres articles venant d’études réalisées dans d’autres pays ont aussi permis de documenter certaines caractéristiques inhérentes aux différents types spa retrouvés au Canada.
1.3.3.2 Le type spa t529
Le type spa t529 est le plus prévalent au Canada avec presque un tiers des isolats de S. aureus isolés. Le gène codant pour seg est corrélé avec les isolats de type t529 avec 87,2% des souches le possédant, et 97,0% des isolats t529 possèdent sen et seg (Veh et al., 2015). Le gène seg a été corrélé avec une plus faible capacité à produire du biofilm (Pichette-Jolette et al., 2019) et les isolats t529 sont associés à une production moyenne de biofilm dans la cohorte. Les S. aureus exprimant le gène seg voient leur probabilité d’induire une IIM persistante chez la vache diminuer pendant la lactation et le tarissement (Veh et al., 2015). Ces isolats possèdent aussi à 44,6% le gène lukM et parmi les séries VNTR (suivi des isolats dans le temps) 94,0% des isolats possédant ce gène rencontrent au moins un épisode de mammite clinique contre 80,0% de sous-cliniques pour les autres séries le possédant (Pichette-Jolette et al., 2019). De plus, la présence