T
T
H
H
E
E
S
S
E
E
En vue de l'obtention du
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Immunologie
JURY
Pr Yoost VAN MEERWIJK Président du Jury Pr Pierre TIBERGHIEN Rapporteur
Dr Alain LE MOINE Rapporteur
Dr Abdelhadi SAOUDI Directeur de Thèse
École doctorale : Biologie-Santé-Biotechnologie Unité de recherche : INSERM-U563
Directeur(s) de Thèse : Dr Abdelhadi SAOUDI Rapporteurs : Pr Pierre TIBERGHIEN
Dr Alain LE MOINE
Présentée et soutenue par Laurence Ordonez Le 24 Septembre 2009
Titre : ETUDES PHENOTYPIQUES ET FONCTIONNELLES DES SOUS-POPULATIONS T CD45RC CHEZ L’HOMME:
REMERCIEMENTS
Je souhaite remercier en tout premier lieu Abdel Saoudi qui a dirigé cette thèse dans la continuité de mon stage de D.E.A. Tout au long de ces cinq années, tu as su me faire partager avec enthousiasme et bienveillance ta passion pour la recherche. Je te remercie aussi pour ta confiance, ta disponibilité et ton écoute compréhensive.
Je tiens à remercier le Dr Yoost Van Meerwijk, qui m'a fait l'honneur de présider le jury de thèse de doctorat.
Je suis très reconnaissante au Dr Alain Le Moine et au Pr Pierre Tiberghien d'avoir accepté le rôle de rapporteur et d’avoir évalué ce travail. J’ai beaucoup apprécié vos discussions scientifiques lors de ma soutenance et je vous remercie de l’intérêt que vous avez montré pour ce travail.
Je tiens ensuite à remercier tous mes collègues, complices des bons comme des mauvais jours.
Isa, je voudrais te remercier de m’avoir initié aux joies de la recherche chez l’Homme lors de mon DEA. Merci pour ta gentillesse et ta disponibilité. J’aimerais aussi remercier Marianne, qui m’a très souvent acheté à coup de gâteau au chocolat et de confiture aux fraises. Merci beaucoup pour ton aide précieuse. Merci aussi à Céline, Anne, Christophe et Laure pour votre présence amicale et pour votre soutien lors des baisses de régimes…notamment lors de pauses café/clopes. Je vous souhaite à tous une bonne continuation et beaucoup de bonheur. Bien sûr, je n’oublie pas notre grande Christine, qui a trouvé son bonheur ailleurs mais qui nous manque beaucoup. Un grand merci à Len, pour tous les moments passés à discuter, avec toi, de la science et de l’avenir incertain. Merci pour ta très grande disponibilité, pour ton soutien constant…et pour les nombreuses corrections de mon anglais écrit. Merci aussi à ton homologue Polonais, Maciek. Nous n’avons eu que trop peu l’occasion de parler ensemble, mais heureusement les séances de grand nettoyage de la salle de culture m’ont permis de te connaître. J’ai beaucoup apprécié nos discussions et ton grand sens de l’humour.
Merci aussi à toutes les autres personnes de la grande famille RL avec qui j’ai aussi partagé de très bons moments : Sabine, Flo, Béa, Tanja, Nico, Lise, Cécile, Carine et Greg.
Je tiens à remercier Roland et Daniel pour vos discussions et vos conseils avisés relatifs à la science et à la recherche.
J’ai eu également le plaisir de collaborer avec Jean-François Subra à Angers, Jan Damoiseaux à Maastricht, Olivier Andréoletti à l’ENVT et nos statisticiennes favorites
Valérie Lauwers-Cances et Christelle Cristini. Je vous remercie tous pour votre grand professionnalisme.
Je remercie aussi toutes les personnes de l’animalerie avec un salue particulier à Patrick pour avoir si bien pris soin de mes souris « si délicates ». Merci aussi à Talal et Florence pour toutes ces lames d’histo.
Cette thèse m’a aussi permis de rencontrer des personnes exceptionnelle avec qui j’ai pu partager les très bons moments comme les mauvais. Je tiens à remercier Christine, Audrey, Fatima, Lucile et Mariléna d’avoir simplement été là, toujours sincères et vraies. Je ne vous oublierais pas et je compte sur vous pour la suite de nos aventures. Notre « cottage » vous attend très bientôt.
Je souhaiterais aussi remercier mon amie Laetitia qui a toujours été là et qui m’a permis de libérer l’excédent d’énergie, durant la rédaction de cette thèse, en me faisant courir des heures malgré mes ampoules douloureuses.
Je remercie aussi mes parents et Patricia pour m’avoir soutenue pendant ces longues années de thèses. Un pensée émue pour ma grand-mère qui m’a toujours si bien compris et pour Lucas mon petit frère que j’adore.
Merci aussi à mes plus vieilles amies Audrey, Nathalie et Céline de m’avoir soutenue tout au long de ces 12 années d’amitiés.
Pierre, il est impossible de résumer en quelques lignes tout ce que tu m’as apporté et que tu continue de m’apporter tous les jours. Merci d’être tel que tu es, surtout ne change rien.
RÉSUMÉ _________________________________________________________________ 5
LISTE DES ILLUSTRATIONS ______________________________________________ 7
LISTE DES ABRÉVIATIONS _______________________________________________ 9
AVANT PROPOS _________________________________________________________ 11
INTRODUCTION _________________________________________________________ 12
I. RÉPONSE IMMUNITAIRE NORMALE __________________________________ 12
1. L'activation des lymphocytes T _________________________________________ 12 1.1. Le contact entre CPA et lymphocyte T________________________________ 12 1.2. Transduction du signal et voies de signalisation ________________________ 14 a. Voie de signalisation calcique____________________________________ 16 b. Voie de la PKCθ_______________________________________________ 16 c. Voie des MAPKinases __________________________________________ 17 d. Voie de la Pi3K _______________________________________________ 18 1.3. Co-stimulation____________________________________________________ 18 1.4. CD45____________________________________________________________ 21 a. Rôle de CD45 dans l’activation des lymphocytes T __________________ 21 b. Les différents isoformes de CD45 ________________________________ 24 c. Rôle des différents isoformes de CD45 ____________________________ 25 d. Régulation de CD45 ___________________________________________ 29
2. Les sous-populations lymphocytaire T ___________________________________ 31 2.1. Lymphocytes T CD4 effecteurs ______________________________________ 31 a. Caractéristiques des lymphocytes Th1, Th2 et Th17 _________________ 31 b. Les facteurs influençant la différenciation des lymphocytes T CD4 ____ 33 2.2. Lymphocytes T CD8 effecteurs ______________________________________ 38 a. La dichotomie Tc1/Tc2 _________________________________________ 38 b. Les Tc17 _____________________________________________________ 39 2.3. Les lymphocytes T mémoires________________________________________ 40 a. Phénotype et propriétés fonctionnelles des TCM et des TEM____________ 40
b. La génération et le maintien des TCM et des TEM_____________________ 44
1. Tolérance immunologique______________________________________________ 48 1.1. Tolérance centrale_________________________________________________ 48 1.2. Tolérance périphérique ____________________________________________ 51 a. Tolérance périphérique passive __________________________________ 51 b. Tolérance périphérique dominante _______________________________ 53 c. Les lymphocytes T CD4 régulateurs ______________________________ 55 d. Les lymphocytes T CD8 régulateurs ______________________________ 61
2. Auto-immunité : les vascularites à ANCA_________________________________ 65 2.1. Rôle de l’immunité humorale dans les vascularites à ANCA ______________ 67 2.2. Rôle de l’immunité cellulaire dans les vascularites à ANCA ______________ 69 III. REPONSE IMMUNE PATHOLOGIQUE : REJET DE GREFFE _____________ 73
1. Transplantation d’organe solide_________________________________________ 73 1.1. Rejet Hyper-aigu (ou rejet aigu médié par les anticorps)_________________ 73 1.2. Rejet cellulaire aigu _______________________________________________ 73 1.3. Rejet chronique ___________________________________________________ 74
2. Les mécanismes du rejet de greffe _______________________________________ 74 2.1. Les alloantigènes __________________________________________________ 74 a. Les molécules du CMH _________________________________________ 75 b. Les antigènes mineurs d'histocompatibilité ________________________ 76 2.2. Les voies de présentation des alloantigènes ____________________________ 78 a. La présentation directe des alloantigènes __________________________ 78 b. La présentation indirecte des alloantigènes ________________________ 80 c. La présentation semi directe ____________________________________ 81 2.3. Mécanismes effecteurs du rejet de greffe allogénique____________________ 81 a. initiation du rejet ______________________________________________ 81 b. Les lymphocytes T alloréactifs ___________________________________ 82
OBJECTIFS______________________________________________________________ 90
RÉSULTATS _____________________________________________________________ 91
I. Le niveau d’expression de CD45RC permet d’identifier des sous-populations T fonctionnellement distinctes dont la distribution varie entre des individus sains et des
II. Le niveau d’expression de CD45RC sur les lymphocytes T humains est un
biomarqueur du risque de rejet d’allogreffe rénale. ____________________________ 104
DISCUSSION générale ET PERSPECTIVES _________________________________ 127
I. Sous-populations T CD45RC humaines dans l’auto-immunité ________________ 127
II. Sous-populations T CD45RC humaines et allotransplantation ________________ 130
1. Le niveau d’expression de CD45RC permet de prédire le rejet de greffe rénale chez l’Homme _________________________________________________________ 130
2. Le niveau d’expression de CD45RC permet de prédire la GvHD dans un modèle de souris humanisées ______________________________________________________ 135
III. PROPRIÉTÉS RÉGULATRICES DES SOUS-POPULATIONS T CD45RC
HUMAINES _____________________________________________________________ 141
IV. ÉTUDE DU CONTRÔLE GÉNÉTIQUE DES SOUS-POPULATIONS T CD45RC HUMAINES ET DE FOXP3 _______________________________________________ 147
RESUME
Les allogreffes permettent de traiter de nombreuses pathologies liées à des déficiences de fonctions vitales ou des cancers. L’utilisation de traitements immunosuppresseurs a permis d’améliorer considérablement le taux de réussite des greffes. Mais, en déprimant l’ensemble du système immunitaire, ils entraînent des effets secondaires importants. Actuellement, tous les receveurs sont soumis à de tels traitements, indépendamment du risque de rejet du greffon. Il est donc essentiel de posséder un outil diagnostique permettant d’identifier les lymphocytes T alloréactifs pathogènes, cellules responsables de ces pathologies, et ainsi de prédire le rejet afin de pouvoir limiter l’utilisation de ces immunosuppresseurs.
Chez le rat, l’intensité d’expression membranaire de CD45RC définit 2 populations de lymphocytes T CD4 et CD8. Les lymphocytes T CD4 et CD8 CD45RChigh sont pathogènes et sont capables d’induire une maladie auto-immune multi-organes ainsi que la réaction du greffon contre l’hôte (GvHD), alors que les lymphocytes T CD45RClow préviennent ces pathologies. De plus, la proportion de ces populations varie en fonction des souches de rats et cette variabilité est contrôlée génétiquement. Ceci souligne la possibilité d’utiliser le rapport CD45RChigh/CD45RClow au sein des lymphocytes T, pour prédire l’apparition de maladies auto-immunes ainsi que le développement de la GvHD et du rejet de greffe allogénique.
Au cours de ma thèse, j’ai montré que CD45RC permet de séparer les lymphocytes T humains en sous-populations phénotypiquement et fonctionnellement distinctes. Le niveau d’expression de CD45RC est hétérogène aussi bien à la surface des lymphocytes T CD4 que des lymphocytes T CD8 et la proportion de ces populations est très variable d’un individu à un autre. Les cellules T CD45RChigh produisent des cytokines de type 1, alors que les cytokines de type 2, régulatrice et l’IL-17 sont produites essentiellement par les cellules T CD45RClow, en réponse à une stimulation polyclonale. Étant donné la production exclusive des cytokines de type 2 et d’IL-17 par les CD45RClow, nous avons étudié l’implication de cette sous-population dans les vascularites à ANCA, une pathologie où ces cytokines jouent un rôle important. Et nous avons montré que les patients atteints de cette pathologie possèdent une plus forte proportion de CD45RClow que des individus sains. De plus, l’étude des réponses alloréactives montre que ces sous-populations possèdent aussi des propriétés alloréactives différentes. En effet, comme chez le rat, les lymphocytes T CD45RChigh contiennent les cellules alloréactives pathogènes. Nous avons alors analysé le profil CD45RC d’échantillons sanguins provenant de patients receveurs de greffe rénale avant la greffe, et nous avons montré que l’incidence de rejet se révèle plus importante chez les receveurs possédant une forte proportion de CD45RChigh.
ABSTRACT
Allotransplantation is the treatment of choice for several several diseases linked to vital function deficiency or cancer. The use of immunosuppressive therapy has drastically increased the graft success rate. However, by weakening all the immune system, they induce important secondary effects. Nowadays, all recipients receive such treatments, independently of the risk of graft rejection. Therefore, one of the new challenges in transplantation is the identification of simple, reliable and noninvasive surrogate markers for the deleterious alloreactive immune responses. This would represent a crucial step toward the development of clinical approaches to improve the care of organ allograft recipients. This has potentially major clinical implications for tailoring immunosuppressive treatments according to the patient needs.
In rats, the level of CD45RChigh expression on CD4 and CD8 T cells defines two subsets. The CD45RChigh subsets within CD4 and CD8 T cells are pathogenic and induce wasting disease as well as graft versus host disease (GvHD) upon adoptive transfer whereas the CD45RClow
T cell subset prevents these diseases. Moreover, the relative proportion of these populations varies between rat strains and this variability is genetically controlled. These data highlight the possibility to use the CD45RChigh
/CD45RClow
ratio within T cell to predict autoimmunity as well as GvHD and allograft rejection.
During my PhD, I have shown that CD45RC expression allows the segregation of human CD4 and CD8 T cells in phenotypically and functionally different subsets that are highly variable between individuals. Under polyclonal stimulation, CD45RChigh
T cells produce type 1 cytokines, while type 2 and regulatory cytokines, as well as IL-17 are mainly produced by the CD45RClow subset. Taking into account the exclusive production of type 2 cytokines and IL-17 by CD45RClow T cells, we studied the involvement of this subset in ANCA vasculitis, a pathology where these cytokines play an important role. We showed that patients affected by this disease have a higher proportion of CD45RClow
than healthy individuals. Moreover, we have shown that these CD45RC subsets exhibit different alloreactive properties and that CD45RChigh
T cells contain alloreactive pathogenic cells. Then, by analyzing the relative proportion of CD45RC subsets in blood samples from graft recipients before transplantation, we showed that the rejection incidence is higher in recipients with a high proportion of CD45RChigh
CD8 T cells.
Therefore, the expression level of CD45RC can be used as a diagnostic tool to predict graft rejection in the context of solid organ transplantation and may allow stratification of patients for immunosuppressive therapy.
LISTE DES ILLUSTRATIONS
Figure 1. Contact entre cellule dendritique et lymphocyte T.
Figure 2. Représentation schématique des voies de transduction du signal mises en place suite
à l’engagement du TCR.
Figure 3. Structure de la molécule CD45.
Figure 4. Rôle de CD45 dans l’activation des lymphocytes T : régulation des protéines
tyrosines kinases.
Figure 5. Altération de l’expression de CD45 et maladies.
Figure 6. Régulation de CD45 par l’homodimérisation différencielle des différents isoformes.
Figure 7. Hétérogénité des sous-populations T CD4.
Figure 8. Les voies cytotoxiques de lymphocytes T CD8.
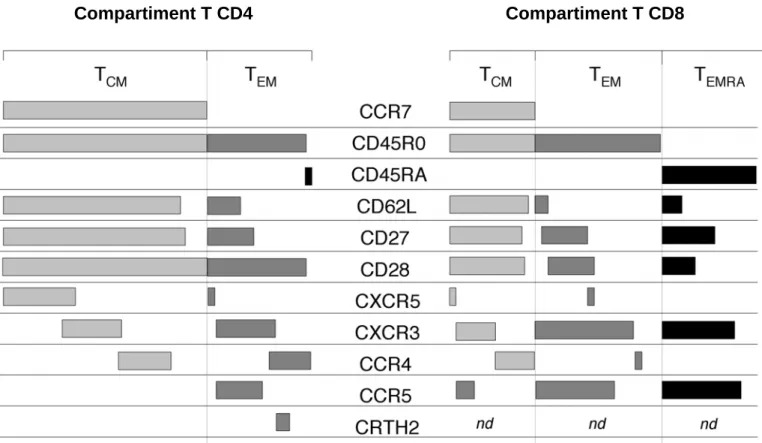
Figure 9. Sous-populations de lymphocytes T mémoires.
Figure 10. Hétérogénéité phénotypique des lymphocytes T mémoires humains.
Figure 11. Modèle de la génération des lymphocytes T mémoires selon l’intensité du signal
de la stimulation antigénique.
Figure 12. Les voies de la tolérance.
Figure 13. Mécanismes passifs de la tolérance périphérique passive des lymphocytes T.
Figure 14. Marqueurs des lymphocytes T CD4 régulateurs naturels.
Figure 15. Mécanismes suppresseurs majeurs des lymphocytes T régulateurs.
Figure 16. Origine multifactorielle des maladies auto-immunes.
Figure 17. Sites vasculaires impliqués dans les différentes vascularites.
Figure 18. Organes impliqués dans les vascularites à ANCA (AAV).
Figure 19. Modèle schématique des mécanismes innés et adaptatifs supposés impliqués dans
la pathogénèse des vascularites à ANCA.
Figure 23. Les sous-populations T CD8 CD45RC ne contrôlent ni la prolifération ni la
sécrétion d’IFN-γ par les lymphocytes T CD4.
LISTE DES ABREVIATIONS
AAV Vascularite à ANCA
AICD Activation Induced Cell death
ANCA Anti-Neutrophil Cytoplasmic Antibodies AIRE Auto-immune regulator
BN Brown Norway
CD Classe de Différenciation
CMH Complexe Majeur d'Histocompatibilité CPA Cellule présentatrice d’antigène
CSH Cellules souches hématopoïétiques
CSS Syndrome de Churg-Strauss
CTL Cytotoxic T lymphocyte
CTLA-4 Cytotoxic T Lymphocyte Antigen-4
DC Cellule dendritique
DTH Réaction d’hypersensibilité retardée
EAE Encéphalomyélite Auto-immune Expérimentale Fc Fragment constant des immunoglobulines GvHD Réaction du greffon contre l’hôte
GvT Réaction du greffon contre la tumeur HvG Réaction de l’hôte contre le greffon
HLA Human Leucocyte Antigen
HO Heme Oxygenase
IDO Indoleamine 2,3 dioxygenase
IFN-γ Interféron-γ
Ig Immunoglobuline
IL Interleukine
ILT Immunoglobulin Like Transcript
ITAM Immunoreceptor tyrosine-based activation motifs
LEW Lewis
MAPK Mitogen-Activated Protein Kinase miHA Antigène mineur d'histocompatibilité
mTEC Medullar thymic epithelial cell
NK Cellule Natural Killer
NO Monoxyde d’azote
PBMC Peripheral Blood mononuclear cells
PR3 Protéinase 3
SCID Severe combined immunodeficiency
STAT Signal Transducer and Activator of Transcription
TCR Récepteur du lymphocyte T
TGF-β Transforming Growth Factor-β
Th Lymphocyte T Helper
Tc LymphocyteT cytotoxique
TCM Lymphocyte T central mémoire TEM Lymphocyte T effecteur mémoire
TLR Toll Like Receptor
TNF Tumor Necrosis Factor
Treg Lymphocyte T régulateur
AVANT PROPOS
Souvent confronté aux attaques extérieures (infection virale ou bactérienne) et parfois à la déficience de ses propres cellules (cancer) ou encore lors de greffe allogénique, l’organisme se défend en activant son système immunitaire. La première barrière de défense de l’organisme est orchestrée par l’immunité innée. Dépourvue de mémoire, elle veille en permanence afin de détecter les pathogènes, les cellules anormales, tumorales ou infectées. Dans de nombreuses situations, les cellules de l’immunité innée comme les cellules dendritiques, les macrophages ou les cellules NK sont suffisantes pour éradiquer l’agent pathogène. Cependant, le défaut de spécificité de ces cellules limite leur efficacité. Les cellules de l’immunité innée requièrent alors l’aide de cellules hautement spécifiques aux antigènes comme les lymphocytes T.
Afin de faire face au très large spectre d’agents pathogènes, les récepteurs des lymphocytes T sont générés aléatoirement par recombinaison génique. Cependant, ce processus conduit à l’émergence de lymphocytes T autoréactifs et donc potentiellement dangereux pour l’organisme. Des mécanismes de tolérance centrale et périphérique se mettent alors en place pour éliminer ou inactiver ces cellules. Cependant, des mutations génétiques, des agents pathogènes ou des substances chimiques peuvent entraîner un dysfonctionnement de ce processus et le développement de pathologies auto-immunes.
Les lymphocytes T peuvent être responsables d’autres pathologies immunes. En effet, le vaste répertoire T obtenu par réarrangement aléatoire des gènes du TCR peut aussi contenir des lymphocytes T alloréactifs. Lors d’une allogreffe, les cellules du tissu ou de l’organe greffés sont reconnues comme étrangères par ces lymphocytes T alloréactifs et peuvent entraîner le rejet du greffon. Lors de greffe de cellules souches hématopoïétiques (CSH), une deuxième complication peut apparaître. Il s’agit de la réaction du greffon contre l’hôte (GvHD) où les lymphocytes T contenus dans le greffon peuvent détruire les tissus du receveur conduisant parfois au décès de l’individu.
Afin de mieux comprendre le développement de ces pathologies, il apparaît important de disposer d’un marqueur biologique permettant d’identifier ces lymphocytes T pathogènes. L'expression de la molécule CD45RC sur les lymphocytes T serait un candidat potentiel pour distinguer des sous-populations ayant des propriétés autoréactives et allogéniques différentes. Mon travail de thèse a consisté à étudier l’implication des sous-populations T CD45RC dans l’auto-immunité, le rejet de greffe et la GvHD. Avant de présenter les résultats de cette étude,
INTRODUCTION
I. RÉPONSE IMMUNITAIRE NORMALE
Dans un contexte inflammatoire, lors de la rencontre entre un lymphocyte T et une cellule présentatrice d’antigène (CPA), la reconnaissance par le TCR (T Cell Receptor) d’un complexe CMH (Complexe Majeur d’Histocompatibilité)/peptide entraîne l’activation du lymphocyte T. L’engagement du TCR et de différentes molécules membranaires conduit à une série de modifications moléculaires à la membrane plasmique, dans le cytoplasme, et dans le noyau permettant au final au lymphocyte T d’acquérir ses fonctions effectrices. Ces évènements conditionneront la mise en place et la spécificité des fonctions effectrices des lymphocytes T. Ces mécanismes finement régulés permettront une réponse immunitaire adaptée aux stimuli antigéniques ainsi que la mise en place d’une protection à long terme appelée mémoire immunologique. Ce chapitre a pour objectif de présenter les mécanismes d’activation d’un lymphocyte T par une CPA, les principales voies de signalisation en aval du TCR ainsi que les fonctions effectrices des lymphocytes T.
1. L'activation des lymphocytes T
L’interaction moléculaire entre le TCR de la cellule T et le CMH porté par la CPA active différentes voies de signalisation. Ces voies de signalisation auront pour finalité d’activer plusieurs facteurs de transcription qui décideront de la réponse de la cellule T: prolifération, différenciation, production de cytokines ou encore mise en place du potentiel cytotoxique.
1.1. Le contact entre CPA et lymphocyte T
Les CPA sont des cellules du système immunitaire capables de présenter aux lymphocytes T, des antigènes sous forme de peptides portés par les molécules du CMH. Les CPA constituent une famille hétérogène de cellules regroupant les lymphocytes B, les macrophages et les cellules dendritiques (DC). Elles ont en commun la capacité d’internaliser efficacement les antigènes extracellulaires, d’apprêter les antigènes exogènes ou endogènes en peptide de 10 à 20 acides aminés, de les charger sur les molécules du CMH et de présenter le
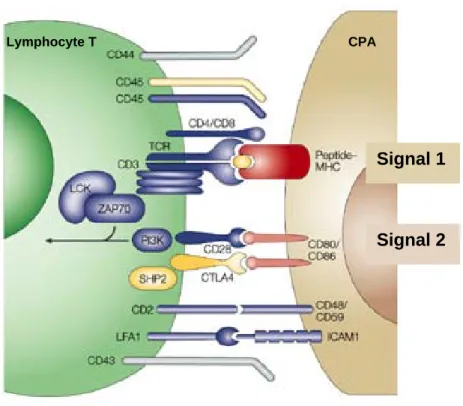
Figure 1. Contact entre cellule dendritique et lymphocyte T.
Les cellules présentatrices d’antigène (CPA) matures adhèrent aux lymphocytes T naïfs par l’interaction de CD2 et LFA-3 (CD48). La liaison de faible affinité entre LFA-1 et ICAM-1 est alors facilitée. La liaison du TCR au complexe CMH/peptide donne au lymphocyte T le signal 1. Puis la liaison de CD28 à CD80/CD86 apporte le signal de costimulation (signal 2) qui va conduire à l’activation complète du lymphocyte T.
D’après Huppa JB et al. (1).
Signal 1
Signal 2
complexe CMH/peptide à la surface cellulaire (2). Cependant, de nombreuses évidences définissent les cellules dendritiques comme les principales CPA professionnelles. En effet, les DC possèdent les capacités les plus appropriées pour présenter les antigènes aux lymphocytes T naïfs et induire leur différenciation en cellules effectrices. Par exemple, les complexes CMH/peptide sont 10 à 100 fois plus nombreux sur les DC que sur les autres CPA telles que les lymphocytes B et les monocytes (3). Les cellules dendritiques capturent les antigènes dans les tissus périphériques et migrent ensuite vers les organes lymphoïdes secondaires pour devenir des cellules présentatrices d’antigènes compétentes initiant ainsi une réponse immunitaire spécifique d’antigène (4). La reconnaissance du complexe CMH peptide de la DC par la cellule T constitue le signal 1 de l’activation du lymphocyte T (Figure 1). L’agrégation T-DC est entraînée par de nombreuses molécules d’adhésion, sur l’une et l’autre des cellules, telles que CD2/ LFA-3 (Leucocytes Function Ag-3), ICAM-1 (Intercellular Cell Adhesion Molecule-1 ou CD54) et ICAM-2 (CD50) /LFA-1, ICAM-3/DC-SIGN. L’ensemble de ces interactions stabilisent le contact entre DC et lymphocytes T pour permettre l’association entre le TCR et le complexe CMH/peptide. Parallèlement, l’engagement du corécepteur CD4 ou CD8 qui se lie respectivement au domaine ß2 du CMH de classe II (CMH-II) ou au domaine α3 du CMH de classe I (CMH-I) augmente l’affinité du TCR pour
le complexe CMH/peptide. Cet engagement potentialise alors l’activation de la cellule T d’un facteur 100 (5). En retour, les lymphocytes T peuvent activer les DC via CD40 ligand (CD40L). La liaison de CD40L à CD40 conduit alors à l’augmentation de l’expression des molécules de costimulation CD80/CD86 et la sécrétion de cytokines telles que l’IL-1, le
TNF-α, l’IL-12 et des chimiokines (6).
1.2. Transduction du signal et voies de signalisation
La liaison du TCR avec le complexe CMH/peptide entraîne tout d’abord le recrutement et l’activation des Src kinases, Lck et Fyn. Ces protéines kinases vont phosphoryler les tyrosines des motifs ITAMs (Immunoreceptor Tyrosine-based Activation Motifs) des domaines intracytoplasmiques des chaînes du complexe CD3 (Figure 2) (7). La tyrosine kinase ZAP-70 se fixe alors à ces ITAMs phosphorylés via son domaine SH2 (Src homology 2). Parmi les plus importantes cibles de ZAP-70, figurent la protéine transmembranaire adaptatrice LAT (Linker for the Activation of T cells) et la protéine adaptatrice cytosolique SLP-76 (SH2 domain containing Leucocytes Phosphoprotein of
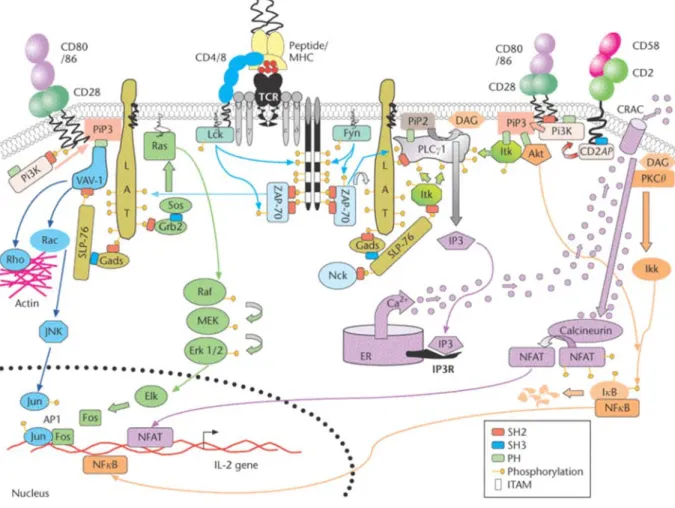
Figure 2. Représentation schématique des voies de transduction du signal mises en place suite à l’engagement du TCR.
Lors de l’activation d’un lymphocyte T, quatre voies principales sont engagées, chacune identifiée par une couleur différente : la voie Ca2+
/calcineurine en violet, la voie de la PKCθ
en orange, la voie Ras/Erk en vert et la voie Vav-1/Jun en bleu. Toutes les protéines adaptatrices sont en marron. Toutes ces voies de signalisation convergent vers le noyau de la cellule T où des facteurs de transcription vont pouvoir induire l’expression de certains gènes (IL-2, …).
76 kDa). Ces 2 protéines jouent un rôle central dans la mise en place et la connexion des différentes voies de transduction du signal. En effet, la phosporylation sur de nombreuses tyrosines de ces protéines conduit à l’activation de différentes voies de signalisation dépendantes de la PLC-γ (Phospholipase C-γ) et de la Pi3K (Phosphatidylinositol-3-OH
Kinase). Suite à l’activation du TCR, la PLC-γ est recrutée au niveau du complexe SLP-76,
Vav1 et LAT où elle est ensuite phosphorylée par la kinase Itk (IL-2-inducibleT-cell kinase)). Une fois activée, la PLC-γ hydrolyse le phosphatidylinositol 4,5-biphosphate (PIP2) conduisant à la formation de deux seconds messagers : l’inositol-1,4,5-triphosphate (IP3) médiant la voie de signalisation calcique et le diacylglycérol (DAG) responsable de l’activation de la voie de la PKC-θ (Protein Kinase C-θ) et de la voie des MAPK
(Mitogen-Activated Protein Kinase).
a. Voie de signalisation calcique
L’IP3 se fixe à des récepteurs de la membrane du réticulum endoplasmique ouvrant ainsi des canaux calciques qui vont relarguer le calcium dans le cytoplasme (Figure 2) (9). Cette augmentation rapide mais transitoire de calcium conduit à l’ouverture de canaux calciques de la membrane plasmique du lymphocyte T, les CRAC (Calcium Release Activated Calcium Channels). L’ouverture des CRAC permet une entrée du calcium depuis le milieu extracellulaire, maintenant ainsi une concentration cellulaire en calcium élevée. Le calcium se fixe alors sur la calmoduline. Le complexe calcium/calmoduline active alors la calcineurine, une phosphatase, qui va à son tour déphosphoryler le facteur de transcription NFAT (Nuclear Factor of activated T cells) et ainsi conduire à sa translocation au noyau. Dans le noyau, NFAT coopère avec de nombreux autres facteurs de transcription conduisant à l’expression différentielle de nombreux gènes dont celui de l’IL-2. La voie calcique, en agissant sur les protéines du cytosquelette, contribue aussi à l’immobilisation de la cellule T lors de la rencontre avec une CPA, formant ainsi la synapse immunologique mature .
b. Voie de la PKCθ
Le DAG mais aussi Lck vont favoriser l’activation de la PKCθ (isoforme θ de la
immunologique (Figure 2) (10). Une fois activée, la PKCθ active la kinase IKK qui à son tour
phosphoryle IκB du complexe IκB/NFκB induisant ainsi la dégradation d’IκB. Ceci permet la
translocation nucléaire du facteur de transcription NFκB. La PKCθ induit aussi l’activation du
facteur de transcription AP-1 (Activator Protein-1), mais les mécanismes impliqués dans cette voie sont encore mal connus. L’activation de NFκB et du complexe AP-1 conduit alors à
l’activation de gènes impliqués dans la survie, la différenciation, l’homéostasie et les fonctions effectrices des lymphocytes T (11).
c. Voie des MAPKinases
La voie des MAP kinases, utilisée par toutes les cellules de l’organisme, fait partie des voies de signalisation les plus anciennes et les plus conservées dans l’évolution. Elle permet de réguler divers processus cellulaires allant de la différenciation cellulaire à l’apoptose. Chez les mammifères, les MAPK sont impliquées dans tous les aspects de la réponse immunitaire, allant de l’initiation de la réponse innée à l’activation de la réponse adaptative jusqu’à la mort cellulaire (12). Il existe 3 groupes majeurs de MAPK chez les mammifères : ERK 1 et 2
(extracellular signal-regulated protein kinases), les p38 MAPK et les JNK (c-Jun NH2-terminal kinases). L’activation des MAPK résulte de l’enchaînement d’une cascade de phosphorylations sur des résidus sérine ou thréonine. Les MAPK sont phosphorylées par des MAP kinase kinases (MAPKK) qui sont elles-mêmes phosphorylées par des MAP kinase kinase kinases (MAPKKK).
Suite à l’engagement du TCR, la protéine LAT va recruter et fixer la protéine adaptatrice GRB2 (Figure 2) (7). GRB2 est elle-même constitutivement associée à SOS, une GEF (Guanine nucleotide Exchange Factor) qui permet l’activation de la GTPase Ras. La protéine Ras active alors les MAPKKK induisant la cascade des MAP kinases qui conduit à la translocation nucléaire de ERK 1 et 2. Les kinases ERK vont activer le facteur de transcription Elk qui contribue à l’activation du complexe de transcription AP-1 (c-Jun/c-Fos) via la régulation de c-Fos. La costimulation par CD28 permet l’activation de Vav-1 conduisant à la phosphorylation de c-Jun par JNK qui pourra alors s’associer à c-Fos.
De plus, le DAG, en induisant le recrutement à la membrane de la GEF RasGRP, permet aussi l’activation de Ras. Récemment, il a été montré que RasGRP catalyse l’activité
d. Voie de la Pi3K
Une quatrième voie de transduction du signal implique l’intervention d’une lipide kinase, la phosphatidylinositol-3 kinase (PI3K) qui phosphoryle le PIP2 membranaire pour générer du PIP3 (Figure 2) (14). La Pi3K est un hétérodimère composé d’une sous-unité catalytique de 110 kDa (p110) et d’une sous-unité régulatrice de 85 kDa (p85). Après activation du TCR, la Pi3K est recrutée à la membrane plasmique via le domaine SH2 de sa sous-unité p85. Il a été montré que la Pi3K pouvait se fixer aux tyrosines phosphorylées des queues cytoplasmiques des molécules de costimulation CD28 et ICOS . Le recrutement de la sous-unité p85 via les tyrosines phosphorylées ne contribue pas seulement à sa localisation à la membrane plasmique, mais permet aussi son activation. L’activation de la Pi3K se fait dans les secondes qui suivent l’activation du lymphocyte T, précédant même le flux calcique.
Le lipide membranaire PIP3 permet le recrutement à la membrane plasmique de nombreuses enzymes à domaine PH (Pleckstrin Homology) dont la sérine-thréonine kinase AKT qui semble la plus importante. AKT joue un rôle important, notamment dans la croissance et la prolifération cellulaires, la survie et la production de cytokines. Les Tec kinases, protéines qui possèdent aussi des domaines PH, dont Itk peuvent aussi être recrutées à la membrane et être activées. Elles permettent alors d’activer la PLC-γ et donc de créer une
connexion entre la voie de la Pi3K et la voie calcique. Il a aussi été suggéré que AKT et ITK pouvaient réguler la différenciation en Th1 et Th2 respectivement (15).
De plus, la voie de la Pi3K semble impliquée dans la sensibilité des T effecteurs à la suppression des lymphocytes T régulateurs (16).
1.3. Co-stimulation
Le signal fournit par le TCR n’est pas suffisant pour l’activation complète du lymphocyte T. En effet, la liaison du TCR en l’absence de signal de co-stimulation induit généralement l’apoptose ou un état d’anergie dans lequel les lymphocytes T sont incapables de produire de l’IL-2 et de proliférer (17). La co-stimulation apporte un signal supplémentaire requis pour dépasser l’état d’anergie et pour l’activation productive des lymphocytes T (signal 2) (Figure 1). Un grand nombre de co-récepteurs ont été décrits dont les mieux caractérisés
sont les molécules de la superfamille des immunoglobulines, CD28, et ICOS (Inducible Costimulatory Molecule) (18, 19).
De nombreuses études ont montré que CD28 favorise la prolifération des lymphocytes T, la production de cytokines et la survie cellulaire via notamment la production d’IL-2 (20). La liaison de CD28 à ses ligands B7.1 (CD80) ou B7.2 (CD86) présents sur les CPA augmente considérablement l’amplitude de la réponse en optimisant la plupart des voies de signalisation induite par la liaison du TCR. Un des effecteurs clés est la Pi3K. Les souris déficientes pour CD28 développent une réponse immunitaire amoindrie face à divers agents infectieux. La signalisation via CD28 permet de réguler le seuil d’activation et de diminuer fortement le nombre de TCR engagés nécessaire pour l’activation T. La fonction principale de CD28 est d’augmenter et soutenir la réponse T initiée par le TCR, en promouvant la survie cellulaire, l’expansion clonale et la différenciation (18). Une autre molécule est capable de se lier à CD80/CD86, mais possède une activité opposée à CD28 : il s’agit de CTLA-4
(Cytotoxic T lymphocyte Antigen-4). L’expression de CTLA-4 est restreinte aux lymphocytes T activés et mémoires. L’engagement du TCR et de CD28 conduit à une translocation rapide de CTLA-4, des lysosomes vers la membrane plasmique. Cette molécule joue un rôle régulateur de la réponse T en inhibant la synthèse d’IL-2 et la progression dans le cycle cellulaire. La liaison de la molécule PD-1, sur les lymphocytes T avec son ligand PD-L1 présents sur les CPA semble jouer un rôle équivalent à celui de CTLA-4 (18).
Même si ces études montrent l’importance de la costimulation via CD28, toutes les réponses immunes ne sont pas toutes affectées par la perte de CD28 montrant que d’autres molécules peuvent co-stimuler les lymphocytes T. En effet, il existe de nombreuses autres molécules de costimulation parmi lesquelles figurent CD2, CD5, CD30, 4-1BB, OX40, et LFA-1 et ICOS (Inducible Costimulator).
ICOS, à l'inverse de CD28, n'est pas exprimé sur les lymphocytes T naïfs (19). En effet, l’expression d’ICOS est rapidement induite sur les lymphocytes T après activation et est influencée à la fois par la signalisation du TCR et de CD28. ICOS-L est exprimé constitutivement sur les cellules dendritiques, les monocytes et les lymphocytes B non stimulés, mais également sur des cellules non-hématopoïétiques comme le rein, le foie, le cœur ou le cerveau (21). Même si la régulation d’ICOS-L n’est pas très bien connue, certaines données suggèrent que l’expression d’ICOS-L puisse être induite par l’IFN-γ, le TNF-α et le
Figure 3. Structure de la molécule CD45.
Les domaines fonctionnels clés sont représentés. CD45 existent sous plusieurs isoformes obtenus après épissage alternatif des exons 4, 5 et 6 qui codent pour trois régions désignées A, B et C du domaine extracellulaire. Le domaine extracellulaire contient de multiples sites de glycosilation et de sialyation. L’isoforme le plus lourd (CD45RABC) et le plus léger (CD45RO) sont montrés de façon schématique. La région intracytoplasmique contient deux domaine phosphatase (PTP) D1 et D2 dont seul D1 est actif.
D’après Hermiston et al. (22).
Domaine riche en cystéine Domaine Fibronectine type III Domaine juxtamembranaire Domaine PTP active D1 Domaine PTP inactive D2 Domaine riche en proline
pour la régulation de la production de cytokines par les lymphocytes T récemment activés et par les lymphocytes T effecteurs. En effet, la liaison de ICOS à ICOS-L peut entraîner une augmentation de la production d'IL-4, d’IL-5, d’IL-6, d’IFN-γ, de TNF-α, et de GMCSF (23).
De plus, ICOS intervient aussi dans l’inhibition de l’apoptose.
1.4. CD45
Comme nous l’avons vu précédemment, la signalisation par le TCR entraîne un ensemble de signaux qui activent de multiples voies effectrices. Afin de contrôler l’amplitude et la durée de la réponse T, l’activation de ces voies est régulée par de nombreuses protéines, dont CD45 fait partie.
a. Rôle de CD45 dans l’activation des lymphocytes T
La molécule CD45 appartient à la famille des protéines à activité tyrosine phosphatase (PTPs) et constitue un composant essentiel dans la voie de signalisation des lymphocytes T et B (24). CD45 est une des glycoprotéines les plus abondamment exprimées à la surface des cellules nucléées d'origine hématopoïétique (plus de 10% de la surface cellulaire). La région intracytoplasmique contient deux domaines tyrosine phosphatase en tandem : D1 et D2, mais seule la partie D1 possède une activité phosphatase et est nécessaire pour la signalisation via le TCR (Figure 3) (25). D2 permettrait la stabilisation et une activité optimale de CD45 (26-28).
L'utilisation de cellules déficientes en CD45 et l'étude de souris invalidées pour le gène codant pour CD45 ont montré que cette molécule est un régulateur important de la maturation et de l'activation lymphocytaire. Chez l'homme et la souris, la perte d'expression de CD45 est associée à une immunodéficience sévère combinée (29, 30). Les souris CD45-/-ont un profond défaut de maturation thymique dû à une augmentation du niveau basal de l'apoptose, et à un dysfonctionnement de la signalisation du pré-TCR et du TCR conduisant à une accumulation des thymocytes au stade double négatif et double positif. Ceci provoque une lymphopénie périphérique avec diminution de 80 % du nombre normal de lymphocytes T
Figure 4. Rôle de CD45 dans l’activation des lymphocytes T : régulation des protéines tyrosines kinases.
L’activité de la protéine Lck est un équilibre dynamique, entre les conformations actives et inactives, dû à l’activité réciproque de CD45 et Csk. Au repos, la tyrosine 505 (Y505) de la Lck est phosphorylée par Csk, ce qui engendre une fixation à son propre domaine SH2 et une conformation repliée inactive. Après engagement du TCR, CD45 déphosphoryle Y505, permettant un dépliement de la Lck et constituant ainsi un réservoir de Lck pré-activées. La Lck peut alors s’autophosphoryler sur Y394 et devient active. La Lck active phosphoryle les motifs ITAM des chaînes du complexe CD3. Les ITAM phosphorylés recrutent et activent la protéine tyrosine kinase ZAP-70 qui phosphoryle et active des protéines adaptatrices et d’autres enzymes aboutissant à l’activation cellulaire. Pour limiter l’activité kinase de la Lck, CD45 déphosphoryle ensuite le site actif Y394, et le domaine Y505 est phosphorylé par Csk, maintenant la Lck dans une conformation inactive.
CD45 joue un rôle important dans l’activation lymphocytaire en régulant l’activité des Src kinases telles que Lck et Fyn (Figure 4). L’activité de la kinase Lck est contrôlée par la phosphorylation de 2 résidus tyrosines : une tyrosine inhibitrice située dans le domaine
COOH terminal (Y505) et une tyrosine activatrice dans le domaine à activité kinase (Y394). La phosphorylation de Y505 de la Lck par la kinase Csk (C-terminal Src kinase) entraîne la fixation de la Lck à son propre domaine SH2. Ce repliement bloque le site de liaison au substrat rendant ainsi la Lck inactive. Après engagement du TCR, CD45 déphosphoryle Y505, permettant un dépliement de la Lck qui s'auto-phosphoryle sur la tyrosine 394 et devient alors active.
En déphosphorylant la Y394, CD45 peut aussi fonctionner comme un régulateur négatif de la Lck (32-35). Mais le blocage dans le développement thymique, la très faible réponse à la stimulation du TCR et le sauvetage par le transgène Lck Y505 muté (non phosphorylable) dans les souris CD45-/- sont en faveur d’un rôle activateur prédominant de CD45. Ces rôles, qui semblent paradoxaux, peuvent être conciliés dans un modèle où l’activité de CD45 serait contrôlée par sa localisation par rapport à son substrat. Lorsque les lymphocytes T sont au repos, CD45 déphosphoryle la tyrosine inhibitrice générant ainsi un réservoir de Lck pré-activées. Après reconnaissance par le TCR, CD45 serait exclu de la synapse immunologique permettant ainsi une activité soutenue de la Lck lors de la phase d’initiation de la transduction du signal. Récemment, des travaux de McNeil et al. ont montré que l’introduction d’un transgène CD45RO permettant une faible expression de CD45 dans des souris CD45 déficientes entraîne une signalisation via le TCR diminué alors qu’une expression intermédiaire (entre la souris CD45-/- et la CD45+/+) entraîne une hyperactivation des lymphocytes T (36, 37). À des faibles niveaux d’expression de CD45, l’activité inhibitrice de la pY505 domine, alors qu’à des niveaux d’expression intermédiaire, il y a une augmentation de pY394 qui active Lck. Il semblerait donc que CD45 régule Lck de façon différentielle. Ces données suggèrent que la sensibilité des lymphocytes T à la stimulation suit une courbe gaussienne selon l’activité de CD45, avec un pic de réponse qui se situe au niveau juste en dessous de l’expression normale de CD45. Il faut tout de même noter que l’étude ne concerne que l’isoforme CD45RO et qu’il se peut que cette activité soit variable selon les isoformes.
constitutivement associées à la région cytoplasmique des récepteurs. Les JAKs actives agissent comme des régulateurs positifs de la signalisation des cytokines, en phosphorylant les protéines STATs (signal transducer and activator of transcription). Les protéines STATs phosphorylées vont dans le noyau et régulent l'expression de gènes impliqués dans la réponse aux cytokines et aux chimiokines (prolifération, différenciation, ...) (39). Ainsi, la perte du gène cd45, entraîne une hyper-phosphorylation de JAK2 et STAT3 ainsi qu’une augmentation de leur activation, en réponse à l’IL-3 ou à l’IFN-α. (38). Elle peut aussi entraîner une
érythropoïèse et la formation de colonies de neutrophiles et macrophages en réponse à l’IL-3, à partir de progéniteurs de la moelle osseuse. De plus, cette hypersensibilité à l’IFN-α protège
les souris CD45-/- de l’infection létale par le Coxsackevirus B3.
Une étude récente a attribué une nouvelle fonction à CD45. En effet, l’activation des monocytes et granulocytes humain induit un clivage de la queue cytoplasmique de CD45, qui est alors relarguée dans le milieu (40). La fixation de ce fragment de CD45 aux lymphocytes T activés est alors capable d’inhiber leur prolifération, suggérant que le domaine intracellulaire de CD45 peut fonctionner comme un régulateur intercellulaire de l’activation T.
b. Les différents isoformes de CD45
Il existe plusieurs isoformes de CD45 qui proviennent de l'épissage alternatif des exons 4, 5 et 6, codant pour des domaines contenus dans l'extrémité extracellulaire de la molécule (Figure 3) (24, 41). Dans la nomenclature, les exons 4, 5 et 6 ont été désignés respectivement par les lettres A, B et C. L’isoforme de plus haut poids moléculaire (CD45RABC) contient les 3 exons et l’isoforme de plus bas poids moléculaire (CD45RO) est le résultat de l'épissage de ces trois exons; la lettre R signifiant « restreint à ». L'exon 5
contient une séquence particulière dans son promoteur, qui empêche son excision lors de l'épissage alternatif (42). Par conséquent, tous les isoformes, sauf CD45RO, expriment au moins le domaine B : CD45RABC, CD45RAB, CD45RBC, CD45RB.
L'hétérogénéité du domaine extracellulaire de CD45 est également accentuée par différentes glycosylations. Les trois domaines variables extracellulaires A, B et C portent plusieurs sites de glycosylation à liaisons O-glycosidiques (O-glycosylations). Le domaine constant extracellulaire porte, quant à lui, des sites de glycosylation à liaisons N-glycosidiques (N-glycosylations). Les motifs de glycosylation de CD45 dépendent non seulement de la variabilité d'expression des exons A-B-C, mais aussi du type cellulaire, du
stade de développement ou de l'état d'activation de la cellule. Ceci suggère un intérêt fonctionnel à ces glycosylations (43). Ainsi, la molécule CD22 (lectine de type I), exprimée par les lymphocytes B, peut interagir avec les acides sialiques contenus dans les N-glycosylations de CD45 exprimées par les cellules T, contribuant à l'adhésion cellulaire (44). Il a été également montré que les résidus oligomannosidiques des N-glycosylations de CD45 exprimé par les thymocytes immatures CD4+CD8+CD3low, interagissent spécifiquement avec la protéine sérique liant le mannose (mannan binding protein). Ceci peut conduire à la modulation du développement et de la maturation des thymocytes (45).
L'expression cellulaire des différents isoformes est fortement régulée. Différents facteurs activateurs, en cis ou en trans, contrôleraient l'épissage alternatif des exons codant pour les domaines extracellulaires de CD45, et réguleraient les niveaux d'expression physiologique de chaque isoforme. Des facteurs activateurs en cis, ont été montrés comme gouvernant la commutation de l'isoforme de CD45 RA->R0, pendant l'activation des lymphocytes T (46). Chez le rat, l'intensité d'expression de l'isoforme CD45RC sur les lymphocytes T CD4 et T CD8 est contrôlée génétiquement par des facteurs trans-activateurs situés en dehors du locus de CD45, sur les chromosomes 9 (locus Cec1) et 20 (locus Cec2). Ainsi, les lymphocytes T des rats Lewis (LEW), contiennent plus de cellules exprimant fortement CD45RC (CD45RChigh), tandis que les lymphocytes T des rats Brown-Norway (BN) contiennent plus de cellules exprimant faiblement CD45RC (CD45RClow) (47, 48). Récemment, Oberdoerffer et al. ont montré que la protéine ribonucléaire hnRNPLL (heterogeneous ribonucleoprotein L-like) était un régulateur inductible important de l’épissage alternatif de CD45 (49). En effet, l’expression de hnRNPLL est augmentée dans les lymphocytes T activés et se fixe alors sur les transcripts CD45 pour permettre l’épissage alternatif. La déplétion ou la surexpression de hnRNPLL dans des lignées T et B et dans des lymphocytes T primaires entraîne l’altération de l’expression de CD45RA et CD45RO.
c. Rôle des différents isoformes de CD45
Même si les fonctions exactes des différents isoformes ne sont pas encore connues, leur niveau d’expression a été associé à différentes fonctions. L'expression cellulaire des différents isoformes de CD45 dépend du type cellulaire, du stade de développement ou de
a
Associations significativement significative de polymorphismes de CD45 C77G ou A138G avec des maladies.
Figure 5. Altération de l’expression de CD45 et maladies.
Fréquence de variants C77G et A138G chez des groupes de malades et de contrôles. D’après Tchilian EZ et al. (56).
Maladie/Population Nombre Total patients (fréquence allele, %) Nombre Total controles (fréquence allele, %) Exon 4 C77G Hépatite Autoimmmune Iran 70 (0.0) 140 (0.4) Allemagne 178 (3.2)a 207 (0.7) Diabetes Allemagne 228 (0.2) 196 (1.3) Allemagne 165 (1.2) 220 (1.1) Graves' disease Allemagne 297 (1.3) 196 (1.3) Sclérose en plaques Allemagne 327 (3.2)a 303 (0.0) Allemagne 76 (3.3)a 119 (0.4) Allemagne 454 (0.8) 347 (1.4) Italie 194 (1.3)a 222 (0.0) Italie 448 (1.2) 529 (0.9) Suède 1044 (1.4) 630 (1.5) Royaume-Uni 330 (2.6) 197 (2.0) Etats-Unis 122 (1.6) 244 (0.4) Etats-Unis 450 (1.7) 253 (1.2) Maladie/Population Nombre Total patients (fréquence allele, %) Nombre Total controles (fréquence allele, %) Exon 4 C77G Histiocytose à cellules de Langerhans Italie 41 (3.7)a 199 (0.3) VIH Royaume-Uni 197 (2.8)a 236 (0.9) Sclérose systémique Allemagne 67 (3.7)a 205 (0.7) Lupus erythémateux systémique Allemagne 98 (2.0) 205 (0.7) Exon 6 A138G – Japon Graves' disease 175 (9.0)a 176 (23.7) Hashimoto thyroiditis 126 (19.8) 176 (23.7) Hepatitis B 113 (11.9)a 176 (23.7) Hepatitis C 173 (19.4) 176 (23.7)
contenant le domaine A, (cellules CD45RA+). Mais suite à l’activation, l’isoforme CD45RO est exprimé à la surface cellulaire. CD45RO est aussi exprimé par les cellules mémoires. La forte expression de l’isoforme contenant l'exon B (CD45RBhigh
chez la souris) ou l'exon C (CD45RChigh
chez le rat), sur les lymphocytes T CD4, est associée à un phénotype de type 1, avec production d'IL-2 et d'IFN-γ. Tandis qu’une faible expression de CD45RB (CD45RBlow chez la souris) ou CD45RC (CD45RClow chez le rat) est associée à un phénotype de type 2, avec la production d'IL-4, d'IL-10 et d'IL-13 (47, 57, 58). De plus, le transfert de lymphocytes T CD4 CD45RChigh
, chez des animaux histocompatibles athymiques, provoque des manifestations auto-immunes (syndrome de dépérissement, thyroïdite, diabète), alors que le co-transfert de cette sous-population avec des lymphocytes T CD4 CD45RClow
prévient le développement de ces maladies (59-61). Le traitement de souris avec un anticorps monoclonal agoniste anti-CD45RB, induit la surexpression de CTLA-4 sur les lymphocytes T CD4, associée à la survie d'une greffe d'organe (62). Les différents isoformes de CD45 sont associés à des différences de phosphorylation des protéines intracellulaires et d’activité de Lck, mais les résultats sont assez contradictoires selon les groupes (63-69). Chez l'homme, l'expression aberrante de CD45 a été associée à plusieurs maladies incluant la cholestasie infantile, le lupus systémique érythémateux, l'arthrite rhumatoïde, la maladie d'Alzheimer (Figure 5) (70-74). La mutation remplaçant une cytosine par une guanine en position 77 (C77G) dans l'exon 4, prévient l'épissage de cet exon et altère l'expression de l'isoforme CD45RA (75). Cette mutation dont la fréquence varie de 1 à 4 % dans la population humaine, conduit à un maintien de l'expression de CD45RA sur les cellules T de phénotype CD45RO+ (cellules activées ou mémoires). Ces lymphocytes T présentent une hyperactivation consécutive à une augmentation de l'activité tyrosine kinase de la protéine Lck, après stimulation par le TCR (76-78). Ce polymorphisme d'expression est associé à une augmentation de la fréquence de maladies auto-immunes comme la sclérose en plaques, le diabète, le lupus systémique érythémateux, et de maladies infectieuses (VIH) (75). À l'inverse, la mutation A138G de l'exon 6, dont la fréquence dans la population peut atteindre 22 %, est associée à une protection contre les maladies auto-immunes (thyroïdite) et infectieuses (hépatite B). Cette mutation conduit à une augmentation de l'expression de CD45R0 sur les lymphocytes T.
Figure 6. Régulation de CD45 par l’homodimérisation différencielle des différents isoformes.
L’isoforme CD45RABC existe de façon prédominante sous la forme monomérique où la phosphatase est active alors que l’isoforme CD45RO facilite la dimérisation. L’efficacité de l’homodimérisation de CD45RO rend CD45 moins active, augmentant ainsi le seuil du signal de transduction et permettant alors de diminuer la réponse immunitaire.
d. Régulation de CD45
L’organisation du domaine extracellulaire, très conservé dans l’évolution et semblable à celle des récepteurs à activité tyrosine kinase, laisse présumer que l’expression de CD45 pourrait être régulée par l’interaction avec un ligand. Cependant, malgré de nombreuses recherches, aucun ligand spécifique n’a été identifié. Il a été montré que des anticorps monoclonaux dirigés contre différents épitopes de CD45, diminuaient l'activité phosphatase de la molécule (79). De nombreuses glycoprotéines, telles que CD22 (80), galectine-1 (81), glucosidase II (82) et MGL une lectine C (83), se fixent de façon non spécifique aux glycoprotéines des lymphocytes T comme CD45. La façon dont elle régule l’activité de CD45 n’est pas claire. Une des possibilités serait que ces protéines régulent la localisation de CD45 à la surface cellulaire et ainsi la dimérisation et l’accessibilité à ses substrats (22, 43).
En effet, il a été proposé, à partir du modèle d'un autre récepteur protéine tyrosine phosphatase (RPTPα), que la dimérisation de CD45 régule l'activité tyrosine phosphatase de
la molécule par inhibition du site catalytique (Figure 6) (84, 85). L'homo-dimérisation pourrait être spontanée ou influencée par le domaine extracellulaire puisque les isoformes de faible poids moléculaire dimérisent plus rapidement et plus efficacement en comparaison aux isoformes lourds. Cependant, ce mécanisme de régulation n'est pas encore bien vérifié, et les études sont contradictoires (22). L'étude structurale récente de CD45, montre que le domaine intracellulaire de la molécule ne peut pas se dimériser (86).
Un autre mécanisme de régulation, alternatif ou additionnel, serait la modification de la localisation cellulaire de CD45. Par exemple, des études de cinétique de ségrégation proposent que l’exclusion de CD45 des sites d’engagement du TCR est un des premiers évènements de l’initiation de la transduction du signal. Différents modèles de régulation de la localisation de CD45 semblent possibles : l’exclusion stérique, l’interaction intracellulaire
Figure 7. Hétérogénité des sous-populations T CD4.
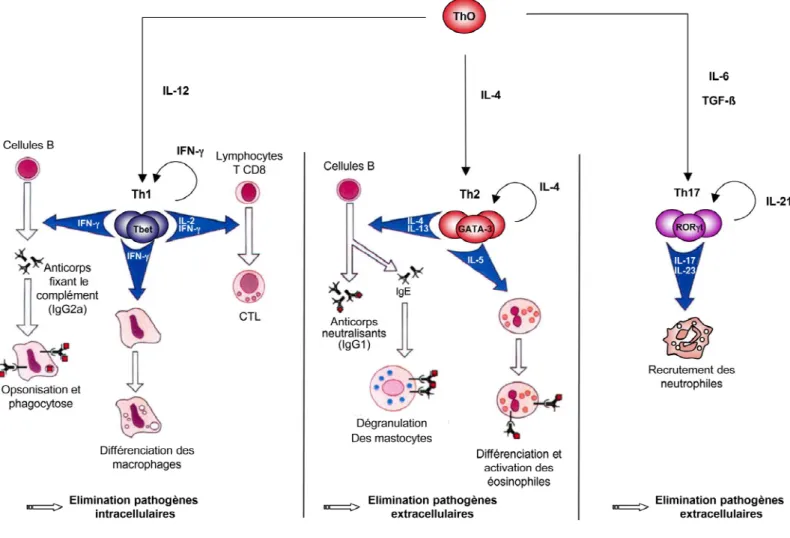
Le processus de différenciation des lymphocytes T CD4 est initié par le signal fournit par les CPA aux lymphocytes T dans les ganglions lymphatiques, conduisant à leur division et leur différenciation. La défense de l’hôte est orchestrée par trois populations majeures, les Th1, Th2 et Th17. Les sous-populations de lymphocytes T CD4 matures et leur facteur de transcription sont représentés. Les cytokines jouent un rôle important dans l’induction des différents lignages. En présence d’IL-12, d’IL-4 ou d’IL-6/TGF-ß, les Th0 vont se différencier en lymphocytes Th1, Th2 et Th17 respectivement. Les lymphocytes T CD4 matures doivent ensuite quitter les ganglions lymphatiques et migrer vers les tissus infectés pour exercer leur fonction. Certains lymphocytes peuvent migrer vers les follicules B pour promouvoir la commutation isotypique des anticorps qui conviendra le mieux à la réponse immunitaire.
2. Les sous-populations lymphocytaire T
2.1. Lymphocytes T CD4 effecteurs
Après leur activation par les DC, les lymphocytes T CD4 naïfs peuvent se différencier en trois sous-populations effectrices Th1 (T helper 1), Th2 et Th17 (Figure 7). Ces différentes populations se caractérisent par leur profil de sécrétion de cytokines qui leur permet d’orchestrer la réponse immunitaire face à différents pathogènes (88-90).
a. Caractéristiques des lymphocytes Th1, Th2 et Th17
Les Th1 et Th2
En 1986, Mosmann et al. montrent que des clones de lymphocytes T CD4 murins peuvent être divisés en 2 populations distinctes, les Th1 et les Th2, selon leur profil de production de cytokines (88).
• Les lymphocytes T CD4 Th1 sécrètent de l'IFN-γ, de l’IL-2, du TNF-α, et du TNF- ß. Il
est classiquement admis que les lymphocytes Th1 favorisent plus particulièrement l'éradication des pathogènes intracellulaires (virus, bactéries et parasites intracellulaires), (Figure 7). La cytokine caractéristique des Th1, l’IFN-γ possède deux rôles clés (87, 89). Tout
d’abord, elle permet l’activation des macrophages et augmente ainsi leur activité phagocytaire, l’expression des CMH-I et II, l’induction d’IL-12, de NO (Nitric Oxide) et la production d’anion superoxide, importants pour l’élimination des pathogènes intracellulaires (91, 92). L'IFN-γ favorise la commutation isotypique en IgG2a et IgG3 chez la souris (93, 94)
correspondant probablement aux IgG1 et IgG3 chez l’Homme. Cette cytokine va donc favoriser la production d’IgG qui en se fixant aux Fcγ-récepteur et au complément entraîne
l’opsonisation et la phagocytose de certains pathogènes. Cependant, les Th1 sont aussi responsables de la réaction d'hypersensibilité retardée où l’IFN-γ et le TNF-ß induisent une
forte inflammation et des lésions tissulaires. De plus, les Th1 peuvent acquérir des capacités cytolytiques suite à l’expression de FasL à leur surface. Les cytokines qu'elles produisent
de nombreux syndromes auto-immuns comme la sclérose en plaques, le diabète et le lupus érythémateux disséminé (95). Mais ces données ont récemment été remises en question par la découverte des Th17 (96). Les Th1 semblent aussi impliqués dans les maladies inflammatoires de l’intestin comme la maladie de Crohn (95).
• Les lymphocytes T CD4 Th2, quant à eux, sont impliqués dans l'élimination de pathogènes extracellulaires comme le toxoplasme, les leishmanias, ou les parasites intestinaux (les helminthes), (Figure 7). Ils sont caractérisés par la production d'IL-4, d’IL-5 et d’IL-13. Les lymphocytes Th2, en produisant l’IL-4, favorisent la commutation isotypique en IgE, isotype qui joue un rôle prépondérant dans la dégranulation des mastocytes. Les Th2 aide aussi les lymphocytes B à produire la sous-classe IgG1 chez la souris et son homologue IgG4 chez l’Homme, sous classes qui ne fixent pas le complément. L’IL-5 est la principale cytokine responsable de la différenciation, de l’activation et du recrutement des éosinophiles. Quant à l’IL-13, elle est, comme l’IL-4, importante pour stimuler la croissance et la différentiation des lymphocytes B en plasmocytes producteurs d’IgE. Mais les lymphocytes Th2 peuvent aussi être à l’origine de maladies allergiques. En effet, les IgE et les mastocytes provenant de l’activation de Th2 spécifiques d’allergènes peuvent entraîner des réactions allergiques et de l’asthme (97-99). Les individus atteints d’atopie sévère ont des taux élevés d’IgE spécifiques d’allergènes. Chez certains patients, il existe une forte corrélation entre le taux sérique d’IgE et la fréquence de Th2 spécifique d’allergènes qui peuvent se disséminer dans le sang périphérique (97).
Les Th17
Récemment, le paradigme Th1/Th2 a été étendu à la suite de la découverte d’une troisième sous-population effectrice de lymphocytes T CD4 producteur d’IL-17, les Th17 (Figure 7) (100, 101). Cette population joue un rôle dans l’élimination de certains pathogènes spécifiques qui requièrent une inflammation massive et que les Th1 et Th2 ne peuvent pas contrôler. Les Th17 sont caractérisés par la production d’IL-17 (IL-17A), d’IL-17F, d’IL-21 et d’IL-22. Chez la souris, les Th17 peuvent aussi produire du TNF-α et de l’IL-6. La
cinétique d’apparition des lymphocytes Th17 sur le site de l’inflammation est rapide. Grâce à l’induction de nombreuses chimiokines, les lymphocytes Th17 peuvent relier l’immunité innée et adaptative et attirer d’autres sous-populations T auxiliaires sur le site de l’inflammation.L’IL-17 et l’IL-17F sont des cytokines pro-inflammatoires. Ces cytokines
stimulent les fibroblastes, les macrophages, les cellules endothéliales et les cellules épithéliales, à produire de multiples médiateurs pro-inflammatoires, comme l’IL-1, l’IL-6, le TNF-α, l’oxyde nitrique, des métalloprotéases et des chimiokines. Toutes ces molécules
conduisent à l’induction d’une inflammation (102). Ces cytokines sont aussi responsables du recrutement de neutrophiles, eux-mêmes producteurs d’IL-17 (103). De nombreux modèles expérimentaux ont permis de montrer l’implication des lymphocytes Th17 et des cytokines dans des maladies infectieuses, des réactions d’auto-immunité, d’alloréactivté, d’allergie et des cancers. Des études chez l’Homme suggèrent l’importance des Th17 dans le psoriasis, l’arthrite rhumatoïde, la sclérose en plaques, la colite, l’asthme ainsi que certaines infections bactériennes et fongiques (100). Récemment, un rôle protecteur des Th17 a été apporté dans un modèle de colite (104). En effet, le transfert de cellules CD45RBhigh CD25-CD4+, provenant de souris IL-17A déficientes, chez des souris RAG-/-, accélère et aggrave la maladie et cela est associé à une augmentation de la réponse Th1.
b. Les facteurs influençant la différenciation des lymphocytes T CD4
Chaque sous-population est capable de promouvoir son propre développement et d’inhiber le développement des autres sous-populations via les cytokines qu’elles sécrètent. L'orientation des réponses immunitaires est donc sous le contrôle d'un équilibre entre les voies Th1 Th2 et Th17, et un déséquilibre vers l'une de ces voies est donc susceptible d'affecter le développement de la réponse immunitaire protectrice.
Immédiatement après l’engagement du TCR, de nombreux facteurs influencent la différenciation vers un lignage Th1, Th2 ou Th17: les cytokines présentes dans l’environnement (105), la nature et la dose de l'antigène (106), le type de cellules présentatrices d'antigène (107), et leurs degrés de différenciation ou de maturation (108). Les facteurs les mieux décrits restent les cytokines présentes dans l’environnement lors du processus de différenciation.
deux sous unité, p35 et p40. Cette cytokine est sécrétée par les CPA activées telles que les macrophages, les monocytes et les DC (109, 112). L’IL-12 se fixe sur son récepteur dont les deux chaînes IL-12Rß1 et IL1-2Rß2 sont induites par l’activation via le TCR. Cela va induire l’activation de JAK2 puis Stat4 nécessaire à la différenciation optimale des cellules T naïves en cellules Th1 productrices d’IFN-γ (95). L’IL-12 joue un rôle central en promouvant la
différenciation des lymphocytes T CD4 naïfs en cellules effectrices Th1 matures. De plus, l’IL-12 stimule les cellules NK (Natual Killer) et les lymphocytes T CD8 à produire de
l’IFN-γ. L'IL-4 inhibe l'expression de l'IL-12 par les DC, ainsi que l'expression de la chaîne ß2 du
récepteur à l’IL-12 par les lymphocytes T CD4 (113).
L’IFN-γ est une cytokine pléïotropique qui joue un rôle essentiel à la fois dans la
réponse immunitaire innée et adaptative (95, 110). Même si les NK, les T CD8 et CD4 Th1 sont les sources les plus importantes d’IFN-γ, les macrophages, les cellules dendritiques, les
lymphocytes T CD4 naïfs et les lymphocytes B sont aussi des producteurs de cette cytokine. L’IFN-γ se fixe sur son récepteur composé de 2 chaîne R1 et R2 et active les Janus kinases
Jak1 et Jak2 qui vont à leur tour activer STAT1. Stat1 induit alors l’expression de T-bet, facteur de transcription essentiel au développement des Th1 (114), qui va remodeler la chromatine du gène de l’IFN-γ et permettre sa transactivation (115). Ceci conduit à une
augmentation d’IFN-γ dans l’environnement local créant ainsi une boucle de régulation
positive de la différenciation Th1. T-bet induit aussi l’expression d’IL12-Rß2, permettant à l’IL-12 produite par les CPA, d’activer STAT4 (116). STAT4 et T-bet induisent l’expression d’IFN-γ qui renforce alors l’engagement en Th1 via STAT1. En parallèle, T-bet va réprimer
GATA-3, un facteur clé de la différenciation Th2 (117), ainsi que le gène de l’IL-4 (118) et inhiber ainsi la différenciation Th2. Des données récentes suggèrent que la fonction majeure de T-bet serait de réguler négativement GATA-3 plutôt que de favoriser la transcription du gène de l’IFN-γ (119). Les souris invalidées pour le gène T-bet sont incapables de développer
une réponse Th1 après infection par Leishmania major. Les souris déficientes pour l’IFN-γ,
IFN-γR1, IFN-γR2 ou STAT1 ont des réponses immunitaires affaiblies, conduisant à une
augmentation de la susceptibilité à certains pathogènes (120-122). Chez l’Homme, une mutation dans un des composants de la voie de signalisation de l’IFN-γR est associée à une
immunodéficience profonde face à des bactéries intracellulaires (123, 124). La production de l'IFN-γ, par les lymphocytes T CD4, peut être également induite par la stimulation du TCR
indépendamment de la voie IL-12/STAT-4, et favorise une réponse Th1 (125).
L’IL-18 sert de co-facteur pour l’induction des Th1 via l’IL12 et pour l’augmentation de la production d’IFN-γ par les Th1 effecteurs. L’IL-18 est produite essentiellement par les