UNIVERSITE TOULOUSE III – PAUL SABATIER Ecole doctorale Biologie, Santé, Biotechnologies
INSERM U563, Centre de Physiopathologie de Toulouse, Purpan
T H E S E
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III Discipline: Microbiologie - Virologie
présentée et soutenue par Elsa SUBERBIELLE
le 18 avril 2008
Sujet de thèse :
DYSFONCTIONNEMENT NEURONAL OU INFLAMMATION, LES
DEUX FACETTES DES CONSEQUENCES DE LA PERSISTANCE DU
BORNAVIRUS DANS LE SYSTEME NERVEUX CENTRAL : ETUDE A
L'AIDE D'OUTILS DE PROTEOMIQUE ET D'IMMUNOLOGIE
Directeur de thèse: Docteur Daniel DUNIA
JURY
Professeur Michel CLANET Professeur Thomas MICHIELS Docteur Noël TORDO
Docteur Hubert LAUDE Docteur André SOBEL
Président Rapporteur Rapporteur Rapporteur Examinateur
REMERCIEMENTS
3 ans et demi déjà ! Par rapport à une vie c’est très court, mais les circonstances de cette période en font un tournant majeur dans la mienne : l’engagement dans une voie qui n’était pas la plus évidente à la suite de mes études, et cette motivation à toujours aller plus loin, soulevant de nouvelles questions, incertitudes et projets.
Et pourtant, dans cet équilibre bancal, on s’épanouit. Et certaines personnes, qui ont croisé ce cheminement professionnel ou personnel m’ont tant apporté !
Je voudrais donc, d’abord, remercier les membres du jury de thèse d’avoir accepté si promptement la lourde tâche qui leur incombait de fait.
Je tiens à remercier le Professeur Michel Clanet, de me faire l’honneur d’accepter la présidence du jury.
Je remercie ensuite le Professeur Thomas Michiels et les Docteurs Hubert Laude et Noël Tordo d’avoir accepté d’être rapporteurs de cette thèse et d’avoir su ménager une brêche temporelle dans leur emploi du temps de globe-trotters pour lire mon travail, voire le faire voyager.
Je tiens également à remercier le Professeur André Sobel pour sa participation au jury de ma thèse en qualité d’examinateur, et d’apporter ainsi son expertise en neurobiologie.
Je voudrais exprimer ma reconnaissance éternelle à mon directeur de thèse, Daniel Dunia, repère de tous les instants, à l’écoute attentive, sereine et critique de mes questionnements scientifiques, et de mes doutes.
Je te remercie, Daniel, pour ta présence et ta vision ouverte et fondatrice de l’équipe et pour avoir toujours su nous faire une place dans tes « deux journées », professionnelle et paternelle.
Je voudrais également remercier tous les membres présents et passés de « l’équipe BDV ». A la relève studieuse et mélomane, Christine et Grégoire, et à Carine pour son calme communicatif et ses goûters revivifiants. A « mes post-docs à môaa » ,Valérie et Céline, qui m’ont initiée aux joies des disciplines que je présente aujourd’hui, avec beaucoup de simplicité, de patience et de second degré, parce qu’il en faut souvent pour comprendre des nuages de points fluidiques et éveiller nos neurones fatigués.
Notre équipe, c’est plus largement notre grande équipe du département Autoimmunité et Immunorégulation. Je vous remercie tous pour nos échanges scientifiques, bien sûr, et les apports de chacun dans une des spécialités qui fondent notre « biodiversité » : apport du journal et surtout de prévisions horoscopiques et ludiques, très utiles pour prédire l’issue de la journée : « pour le prix Nobel, demain est un autre jour, en amour, calme plat, surveiller votre ligne, attention au chocolat». Je pense également à la bonne humeur qui anime l’ensemble et à toutes celles et ceux qui ont partagé ces moments au cours de leur pause à « fumer un café » ensemble, même après la tombée de la nuit.
Je n’oublie pas que ma tête est mise à prix par les familles des quelques milliers de rats qui m’ont confié la leur, ce qui me condamne à avoir en toute circonstance une garde rapprochée féline ainsi qu’une certaine créativité dans l’esquive des questions sur ce à quoi ressemblent mes semaines, de la part de potentiels prétendants devenus conscients de mes capacités chirurgicales.
Enfin, je n’oublie pas tous celles et ceux, famille ou amis, qui m’apportent chaque jour leur soutien chaleureux et unanime depuis toutes ces années et plus encore, ont traversé avec moi épreuves, doutes et joies. Je ne vous remercierai jamais assez d’être là, en dépit même des kilomètres qui nous séparent parfois.
Ce n’est pas parce que les choses nous semblent inaccessibles, que nous n’osons pas ; C’est parce que nous n’osons pas, qu’elles nous semblent inaccessibles.
TABLE DES MATIERES
ABREVIATIONS ...11
LISTE DES TABLEAUX ...13
LISTE DES FIGURES ...15
PREAMBULE...19
INTRODUCTION ...21
I. BIOLOGIE CELLULAIRE DU NEURONE ET NEUROPLASTICITÉ...23
A Biologie cellulaire du neurone et transmission du message nerveux...23
1. Les cellules du système nerveux central : ...23
2. Transmission synaptique ...25
3. Notion de potentialisation à long terme (LTP) et plasticité ...35
B Les niveaux de régulation de la plasticité neuronale...40
1. Facteurs de neurogenèse et de synaptogenèse...41
2. L’intervention du cytosquelette dans la neuroplasticité ...51
3. Transport et expression locale des ARNm au niveau synaptique...66
4. Régulation de l’expression des ARNm au niveau nucléaire ...75
II. LE VIRUS DE BORNA...87
A Introduction ...87
B Le génome du Bornavirus...91
1. Organisation génomique...91
2. La régulation de la transcription ...91
C Les protéines virales ...94
1. La nucléoprotéine N ...94 2. La phosphoprotéine P...97 3. La protéine X...99 4. La protéine de matrice M ... 101 5. La protéine d’enveloppe G... 102 6. La polymérase virale L... 103
D Cycle viral du Bornavirus ... 105
1. Entrée et dissémination du virus en culture cellulaire ... 105
2. Réplication et transcription virales... 105
E Physiopathologie de l’infection par le Bornavirus... 116
1. Infection naturelle ... 117
2. Modèles animaux expérimentaux... 120
3. Mécanismes moléculaires à l’origine des troubles comportementaux ... 131
RESULTATS... 137
I. ANALYSE DES MÉCANISMES IMMUNOPATHOLOGIQUES MIS EN JEU LORS DE L’INFECTION PAR LE BORNAVIRUS... 139
A Introduction et objectifs du projet ... 139
1. Le système nerveux central, organe immunologiquement privilégié ?... 139
2. Activation du système de réponse à interféron de type I dans le SNC ... 141
3. Inflammation et système nerveux central ... 143
4. Modes d’action des lymphocytes T CD8 dans le SNC ... 144
5. Les neurones, cibles potentielles pour les lymphocytes T CD8 cytotoxiques ?.. 145
B Méthodologie expérimentale :... 147
1. Culture de neurones primaires et infection par le Bornavirus ... 147
2. Purification de lymphocytes T à partir du SNC de rats infectés par le BDV ... 147
C Élaboration d’un outil de caractérisation des lymphocytes T CD8+ spécifiques de l’épitope immunodominant du BDV... 148
1. Production du premier pentamère de molécules de CMH-I de rat ... 149
2. Développement du système de neuroinflammation induite par le BDV ... 149
3. Utilisation du pentamère pour caractériser la spécificité de LT pour le BDV chez le rat ... 151
D Analyse phénotypique des infiltrats inflammatoires lors de l’infection aiguë par le Bornavirus ... 153
E Analyse de l’expression des molécules du CMH1 par des neurones primaires infectés par le BDV ... 155
1. Méthodologie... 155
2. Résultats ... 155
F Étude dynamique des interactions neurones - lymphocytes T ... 157
1. Objectif... 157
2. Évaluation des capacités lytiques des lymphocytes T infiltrants sur les neurones 157 3. Analyse par imagerie cellulaire temps réel ... 159
G Conclusion générale du projet ... 161
II. ANALYSE DES EFFETS DE L’INFECTION PAR LE BORNAVIRUS SUR LE PROTÉOME NEURONAL 173 A Introduction et objectif du projet ... 173
B Etude du protéome en neurobiologie : état rapide de la question ... 174
1. Intérêt des approches protéomiques ... 174
2. Notions méthodologiques en protéomique ... 177
3. « Protéome d’expression » des neurones : ... 182
4. Neurogenèse et différenciation neuronale ... 183
5. Guidage axonal ... 183
6. Facteurs de plasticité neuronale ... 184
7. Analyses en situation pathologique ... 184
C Approche expérimentale... 185
1. Fractionnement protéique par chromatographie en phase liquide à deux dimensions... 187
2. Application de la PF2D aux cultures de neurones infectés par le BDV... 189
D Analyse de l’impact de l’infection par le virus de Borna sur le protéome neuronal 191 1. Vue générale des changements dans le protéome des neurones infectés ... 191
2. Protéines impliquées dans les mécanismes de synaptogenèse et de neurotransmission... 193
3. Protéines associées au cytosquelette neuronal... 195
4. Protéines associées à la dynamique des ARNm et remodelage de la chromatine 197 DISCUSSION ET PERSPECTIVES ... 201
I. LE BORNAVIRUS, UN OUTIL POUR UNE MEILLEURE COMPRÉHENSION DES MÉCANISMES IMMUNOPATHOLOGIQUES DANS LE SYSTÈME NERVEUX CENTRAL ? ... 203
A Les lymphocytes T CD8 sont-ils les effecteurs majeurs d’une réponse immune délétère pour le SNC ?... 203
B Le caractère résolutif de la maladie de Borna : nouvelles voies d’investigation de la réponse immune régulatrice dans le SNC ?... 205
II. LES VOIES MOLÉCULAIRES DE L’IMPACT DU VIRUS DE BORNA SUR LE PROTÉOME
NEURONAL: DISCUSSION ET PERSPECTIVES... 209
A Comment le virus de Borna peut-il interférer avec les différents niveaux de la plasticité neuronale ? ... 209
1. L’interférence du Bornavirus avec les mécanismes de plasticité synaptique est-elle liée à un défaut de mobilisation de l’actine F? ... 210
2. Quelles sont les conséquences d’une interférence dans la dynamique du cytosquelette des microtubules pour le SNC ?... 211
B Retentissement des altérations fonctionnelles du neurone sur le cycle viral... 212
C L’impact du virus sur la dynamique d’expression des ARNm serait-il le premier niveau d’interférence ? ... 214
D Effets du Bornavirus sur l’expression du facteur MeCP2: une voie d’investigation pour l’avenir? ... 216
REFERENCES BIBLIOGRAPHIQUES ... 219
ANNEXES ... 237
I. ARTICLE SOUMIS N°1 ... 239
ABREVIATIONS
ABP protéines de liaison à l’actineADN acide désoxyribonucléique
AMPA acide -amino-3-hydroxy-5-methyl-4-isoxazolepropionique AMPc adénosine monophosphate cyclique
ARN acide ribonucléique
ARNm ARN messager
ARN NNS ARN négatif, simple brin, non segmenté ATP adénosine triphosphate
BDNF facteur de croissance dérivé du cerveau
BDV virus de Borna
CaMK protéine kinase dépendant du Ca2+ et de la calmoduline CAT chloramphénicol acétyle transférase
CMH complexe majeur d’histocompatibilité
CREB protéine de liaison à l’élément de réponse à l’AMPc CTL cellule T cytotoxique
DAG diacyglycérol
EPSP potentiel excitateur postsynaptique
ERK 1/2 protéine kinase régulée par les signaux extracellulaires 1/2 FGF facteur de croissance fibroblastique
GABA gamma aminobutyrate
GAP43 Neuromoduline
GFAP protéine gliale acide fibrillaire GMPc guanosine monophosphate cyclique GTP Guanosine triphosphate
HBV virus de l’hépatite B HCV virus de l’hépatite C HSV virus de l’herpes simplex
IFN Interféron
IFNAR récepteur à l’interféron
IL interleukine
kb kilobase
LCMV virus de la chorioméningite lymphocytaire LIMK kinase à domaine de type LIM
LT lymphocyte
LTP potentialisation à long terme de la transmission synaptique MARCKS protéine myristoylée riche en alanine et substrat de la kinase C MBP protéine liant les microtubules
MEC matrice extracellulaire
MeCP2 Protéine de liaison aux dinucléotides cytidine-guanine méthylées mGluR récepteurs métabotropiques au glutamate
mEPSP potentiel excitateur postsynaptique miniature
NI non infecté
PA potentiel d’action
PDK protéine kinase dépendant des phosphoinositides PI3K phosphatidylinositole 3-kinase
PKA protéine kinase A
PKC protéine kinase C
PMA phorbol 12-myristate 13-acétate PSD Densité postsynaptique
NES signal d’export nucléaire
NLS séquence de localisation nucléaire NMDA N-methyl-D-aspartate
NSF facteur sensible au N-éthylmaleimide PCR réaction de polymérisation en chaîne RBP protéine de liaison à l’ARN
RISC Complexe inhibiteur induit par les ARN intérférents RNP complexes ribonucléoprotéiques
SNAP protéines d’attachement au facteur sensible au N-éthylmaleimide
SNARE récepteurs aux protéines d’attachement au facteur sensible au N-éthylmaleimide SNC système nerveux central
Syt synaptotagmine
TNF Facteur de nécrose tumorale
TTX tétrodotoxine
TBK-1 protéine kinase 1 liant l’activateur de NF-
κ
B associé au membre de la familleVS vésicules synaptiques
WB électrophorèse et transfert de protéines sur membrane YB1 Protéine de liaison aux éléments sensibles aux nucléases
LISTE DES TABLEAUX
TABLEAU 1: Critères de classification des neurones...22
TABLEAU 2: Fonctions des astrocytes...24
TABLEAU 3: Exemples de neurotransmetteurs ...26
TABLEAU 4: Protéines associées à l’actine dans le cone de croissance du neurone. ...60
TABLEAU 5: Protéines associées aux microtubules dans le cône de croissance du neurone....62
TABLEAU 6: Symptômes de la maladie de Borna dans les espèces animales infectées naturellement par le BDV ... 118
TABLEAU 7: Impact de la déficience en IFNAR sur les infections virales du SNC de la souris. ... 142
LISTE DES FIGURES
Figure 1: Les cellules du système nerveux central...22 Figure 2: Représentation schématique d’une synapse glutaminergique et d’une synapse GABAergique du système nerveux central ...24 Figure 3: Synapse glutaminergique visualisée en microscopie électronique...26 Figure 4: Représentation schématique de la zone active présynaptique et du cycle des vésicules synaptiques. ...28 Figure 5: Molécules de la matrice extracellulaire présentes au niveau de la fente synaptique et autour de la synapse. ...30 Figure 6: Relai des informations nécessaires au remodelage du cytosquelette d’actine entre les zones pré- et postsynaptiques: ...30 Figure 7: Représentation schématique de la potentialisation à long-terme (LTP) de l’activité neuronale...36 Figure 8: Modèle schématique de la fonction de la réponse au BDNF dans le rafinement de la densité synaptique. ...46 Figure 9: Les voies de signalisation cellulaires activées par la réponse au BDNF/TrkB. ...46 Figure 10: Molécules d’adhésion engagées dans la spécialisation des zones synaptiques...48 Figure 11: Les filaments d’actine et les microtubules sont des polymères de structure polaire.
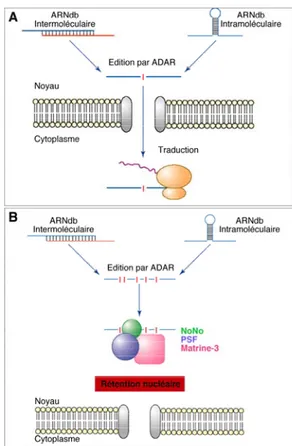
...52 Figure 12: Représentation schématique de la régulation de la polymérisation de l’actine, ...56 Figure 13: Voies de signalisation des protéines associées aux microtubules dans le développement du cône de croissance...58 Figure 14: Représentation schématique de l’architecture cytosquelettique des domaines constitutifs du cône de croissance du neurone...58 Figure 15: Modèle hypothétique de réorganisation du cytosquelette au cours de la croissance orientée du cône de croissance. ...62 Figure 16: Modèle dynamique de transport et de traduction locales des ARNm au niveau des dendrites...68 Figure 17: Voies de signalisation et de contrôle de la traduction locale synaptique des ARNm en réponse à l’activité du neurone. ...68 Figure 18: Modèle représentant les effets du système des microARN au niveau synaptique :équilibre entre dégradation et traduction en réponse à la stimulation neuronale. ...74 Figure 19: Représentation schématique de la génération et du devenir des ARN édités. ...74
Figure 20: Formation des complexes transcriptionnels dépendant de l’activité. ...78
Figure 21: Régulation du remodelage de l’architecture dendritique par MeCP2 en réponse à l’activation neuronale. ...82
Figure 22: Régulation du remodelage de la chromatine et de la transcription par MeCP2. ...82
Figure 23: Description du virus de Borna comme “le virus qui rend triste” avec l’allégorie de la folie. ...86
Figure 24: Représentation schématique d’une particule de Bornavirus. ...88
Figure 25: Organisation génomique du Bornavirus. ...90
Figure 26: Carte des motifs identifiés au sein des protéines du BDV...96
Figure 27: Cycle viral du Bornavirus... 104
Figure 28: Principe des constructions de génétique inverse utilisées pour l’étude du Bornavirus. ... 108
Figure 29: Modèles proposés de synthèse de l’extrémité 3' asymétrique du génome du BDV en l’absence de matrice génomique à extrémités complémentaires. ... 110
Figure 30: Mécanismes cellulaires senseurs des structures ARN db/sb et immunité innée. ... 114
Figure 31: Exemples d’antagonistes viraux qui inhibent/limitent la production d’interféron a/b par les cellules infectées. ... 114
Figure 32: Voies d’interférences du Bornavirus avec le fonctionnement neuronal. ... 134
Figure 33: Propriétés de sept virus qui infectent le système nerveux central et induisent des troubles neurologiques. ... 140
Figure 34: Détection des lymphocytes T CD8 spécifiques du Bornavirus par le complexe pentamère de CMH-I de rat (Pro5® MHC class I). ... 150
Figure 35: Analyse phénotypique des lymphocytes T composant les infiltrats inflammatoires lors de l’infection aigue par le Bornavirus... 152
Figure 36: Expression des molécules du CMH de classe I par des neurones primaires dans le cadre de l’infection par le Bornavirus. ... 154
Figure 37: Induction de l’activité des caspases 3/7 par lyse spécifique de neurones infectés, par les lymphocytes isolés au cours de l’infection par le BDV. ... 158
Figure 38: Caractérisation de l’interaction neurone-lymphocyte T en microscopie confocale en temps réel. ... 160
Figure 39: Comparaison de l’efficacité d’identification des protéines par trois techniques en protéomique... 178
Figure 40: Représentation schématique du dispositif de fractionnement protéique par la technique PF2D ProteomeLab de Beckman Coulter. ... 186
Figure 41: Représentation schématique du protocole expérimental employé pour étudier le protéome des neurones infectés par le BDV... 188 Figure 42: Analyse de l’impact de l’infection par le Bornavirus sur le protéome neuronal au niveau du profil chromatographique en PF2D. ... 190 Figure 43: Le Bornavirus affecte l’expression de protéines importantes pour la synaptogenèse et la neurotransmission... 192 Figure 44: Le Bornavirus affecte l’architecture fine du réseau d’actine au niveau des contacts entre les neurites. ... 194 Figure 45: Le Bornavirus ralentit la dynamique des polymérisation et de réorganisation des microtubules en réponse au nocodazole... 196 Figure 46: Interférence du Bornavirus avec la régulation de l’expression des ARN messagers neuronaux par les facteurs MeCP2 et YB-1. ... 198 Figure 47: Impact du Bornavirus sur l’état d’acétylation de l’histone H2B neuronal... 200 Figure 48: Vue générale des niveaux d’interférence du Bornavirus avec les fonctions neuronales engagées au cours des phénomènes de neuroplasticité... 208
PREAMBULE
L’infection par le Bornavirus offre un modèle de choix pour l’étude des conséquences pathologiques liées à la réplication virale dans une structure originale et complexe comme le système nerveux central. Le Bornavirus se distingue en effet par l'extrême diversité des maladies neurologiques consécutives à l'infection, qui vont d'une méningo-encéphalite à des troubles du comportment sans inflammation associée.
Durant ma thèse, l’objectif principal de mes travaux de recherche a consisté en l’analyse du protéome de cultures de neurones primaires infectées par le Bornavirus. Il s’agissait d’identifier les cibles protéiques neuronales du virus, de manière à apporter un éclairage nouveau concernant les mécanismes physiopathologiques mis en jeu au cours de l’infection. Toutes les protéines identifiées au cours de cette analyse présentaient toutes le point commun d'être impliquées à des niveaux divers dans la physiologie neuronale, que ce soit au niveau de la croissance ou de la différenciation neuronales, ou encore au niveau des réponses adaptatives du neurone.
Il me semblait donc important de prendre le temps, dans une partie introductive, de replacer ces différentes protéines dans leur contexte fonctionnel, tout en appréhendant certains aspects de la physiologie neuronale. Il était cependant impossible d’être exhaustif sur ces processus, tant les avancées et hypothèses mécanistiques sont nombreuses et sont par ailleurs l’objet de disciplines variées et relativement éloignées de ma formation de base en virologie. J'ai donc opté pour une démarche volontairement simplificatrice et dans l’introduction, mon objectif a consisté à poser les jalons essentiels pour la compréhension des fonctions neuronales qui impliquent les protéines identifiées lors du criblage protéomique. Afin de souligner cet aspect pour lecteur, toutes les protéines mentionnées dans l'introduction et identifiées également lors de mon étude de protéomique seront écrites en caractères gras. J’espère ainsi fournir une base de connaissances à laquelle le lecteur pourra se référer au fil de sa progression dans l’ouvrage de thèse.
Dans une deuxième partie introductive, je présenterai ensuite un résumé de l’état des connaissances actuelles concernant la biologe de l'infection par le Bornavirus. Enfin, je détaillerai les objectifs de mon travail de thèse et je discuterai les divers résultats obtenus.
Figure 1: Les cellules du système nerveux central D’après (Knott et Molnar, 2000)
Tableau 1: Critères de classification des neurones
Critère Types de neurones
Morphologie :
fonction du nombre de prolongements
Multipolaire : plus de deux prolongements, un axone et des dendrites
Bipolaire : un axone et une dendrite
Pseudo-unipolaire : un prolongement court qui se divise en deux pour donner une forme en T, une branche allant vers le SNC, l’autre vers le SNP
Unipolaire : un seul prolongement Signal transmis aux
cellules connectées
Excitateur : le neurone dépolarise la membrane de la cellule qu’il contacte
Inhibiteur : le neurone hyperpolarise la membrane de la cellule qu’il contacte
Fonction Moteurs : contrôle un muscle ou une glande
Sensoriel : perçoit et transmet un stimulus
Interneurone : établit des connexions avec d’autres neurones Localisation Central : dans le cerveau ou la moelle épinière
Périphérique : nerfs et ganglions à l’extérieur du cerveau et de la moelle épinière
I.
Biologie cellulaire du neurone et neuroplasticité
A Biologie cellulaire du neurone et transmission du message nerveux
1. Les cellules du système nerveux central :
Le système nerveux central comprend le cerveau, et la corde spinale. Dans les deux cas, deux types de cellules le constituent : les neurones et les cellules gliales (Figure 1)(Knott and Molnar, 2000).
Les neurones sont des cellules post-mitotiques, hautement spécialisées qui forment entre elles un réseau complexe. Ils sont capables de transmettre un signal à distance dans le système nerveux grâce au développement de structures cellulaires propres, dont les plus marquantes sont la synapse et les longs prolongements qui partent du corps cellulaire (axones et dendrites). Le développement de ces structures cellulaires permet d’ailleurs de classer les neurones en différents types. Ils peuvent également être classés plus précisément en fonction de leur localisation dans le système nerveux, ou en fonction du signal qu’ils transmettent. (Tableau 1) (Knott and Molnar, 2000)
Les cellules gliales sont de loin les cellules les plus nombreuses du cerveau : on considère qu’il y a environ 100 milliards de neurones dans un cerveau humain adulte et 10 à 50 fois plus de cellules gliales (Robitaille, 2001). Les cellules gliales peuvent être séparées en deux catégories : la microglie et la macroglie. La microglie correspond aux cellules immunitaires résidentes du système nerveux central (SNC), elles sont issues de la lignée des monocytes-macrophages. Ces cellules participent à la surveillance immunitaire du cerveau. La macroglie est composée majoritairement des astrocytes et des oligodendrocytes, les astrocytes étant de loin les plus nombreux. Les oligodendrocytes sont responsables de la synthèse de la myéline et ils forment des prolongements qui s’enroulent autour des axones pour former la gaine de myéline. La myélinisation améliore la vitesse de transmission du message nerveux électrique et à d’autres rôles dans l’entretien des
Tableau 2: Fonctions des astrocytes.
Isolement des neurones (corps cellulaire, prolongements et synapse)
Régulation de la composition ionique et du pH
Maintien de l’intégrité tissulaire
Capture et métabolisation des neurotransmetteurs
Présence de récepteurs aux
neurotransmetteurs sur les astrocytes Signalisation calcique au sein d’un astrocyte en réponse à l’activité neuronale
Echanges cellulaires
Signalisation calcique entre les astrocytes grâce aux gap-jonctions et au relargage d’ATP
Relargage de neurotransmetteurs par les astrocytes
Modulation de la transmission synaptique
Modulation de l’efficacité de la transmission synaptique et de la plasticité synaptique D’après (Robitaille, 2001) et (Pascual, 2005)
Figure 2: Représentation schématique d’une synapse glutaminergique et d’une synapse GABAergique du système nerveux central
structures axonales. À titre de comparaison, dans le système nerveux périphérique cette fonction est attribuée aux cellules de Schwann.
Les astrocytes sont présents dans tout le SNC et ont des fonctions variées (Tableau 2) (Pascual et al., 2005; Robitaille, 2001). Principalement, les astrocytes participent au maintien de l’homéostasie du SNC. Ils sont notamment capables d’occuper l’espace entre les neurones et réduisent ainsi l’espace extracellulaire. Ceci permet de limiter la diffusion de substances dans le SNC et permet aussi aux astrocytes de réaliser facilement des échanges nutritionnels et informatifs de l’environnement avec les neurones. En particulier, grâce aux récepteurs aux neurotransmetteurs exprimés à la surface des astrocytes, leurs fonctions peuvent être régulées suivant l’activité des neurones avec lesquels ils sont en contact. Les astrocytes interviennent également à plusieurs niveaux dans le contrôle de la transmission synaptique (Auld and Robitaille, 2003). Ils stimulent la formation de synapses (Christopherson et al., 2005). Les astrocytes sont également capables de relarguer des neurotransmetteurs et ils participent ainsi à la régulation de l’efficacité de la transmission synaptique (Pascual et al., 2005). Les astrocytes ont donc un rôle à ne pas négliger dans la modulation de la transmission synaptique.
2. Transmission synaptique
En dépit de la grande diversité des neurones et de leurs neurotransmetteurs, la transmission synaptique suit un schéma unique mettant en jeu trois sous-unités structurales : la zone présynaptique, l’espace synaptique et la zone postsynaptique. Ces trois ensembles constituent l’unité fonctionnelle qu’est la synapse.
a. Les types de synapses
La synapse est le site de connexion entre un neurone et une cellule cible, souvent un autre neurone. Les synapses majoritaires sont de synapses dites chimiques (Figure 2). Elles permettent de convertir un stimulus de nature électrique (potentiel d’action) en un signal chimique (à l’aide de neurotransmetteurs) qui sera à nouveau converti en signal électrique.
Le neurotransmetteur, signal chimique, doit répondre à certains critères énoncés (Hyman, 2005) : cette molécule doit être produite à l’intérieur du neurone, retrouvée dans
Tableau 3: Exemples de neurotransmetteurs : , D’après (Huyman, 2005)
Classe chimique Neurotransmetteur
Ester Acétylcholine
Gamma aminobutirate (GABA) Glycine Glutamate Acides aminés Aspartate Dopamine Noradrénaline Sérotonine Amines biogènes Histamine Enképhalines Dynorphine Substance P Peptides (quelques exemples)
Neuropeptide Y
Anandamide (endocannabinoïde)
Lipides 2-arachidonylglycérol (endocannabinoïde)
Figure 3: Synapse glutaminergique visualisée en microscopie électronique. D’après (Kennedy, 2000)
ses boutons terminaux, relâchée à l’arrivée d’un potentiel d’action et doit produire un changement d’état chimique et électrique du neurone post-synaptique sur le récepteur duquel elle se fixe par reconnaissance spécifique. Après son émission, elle doit être désactivée rapidement et une application expérimentale de cette molécule sur un neurone doit avoir le même effet que si elle avait été relarguée par un autre neurone. Les neurotransmetteurs appartiennent à des classes chimiques variées, mais restent de nature simple en termes d’organisation moléculaire (Tableau 3).
b. L’organisation structurale de la synapse
La structure de la synapse a été mise en évidence dans les années 1950 par des études de microscopie électronique (Figure 3). C’est une structure asymétrique polarisée qui est constituée de 3 compartiments distincts : une zone présynaptique et ses vésicules synaptiques (VS), un espace extracellulaire ou fente synaptique, et une zone postsynaptique dense aux électrons (Figure 2)(Ahmari and Smith, 2002).
La zone présynaptique
Appelée aussi bouton présynaptique du fait de sa forme renflée, elle correspond à une terminaison axonale d’1µm de diamètre. Elle abrite, de manière très organisée, les vésicules synaptiques remplies de neurotransmetteurs.
Pas moins de 200 protéines composent cette structure. Cet important réseau protéique permet d’organiser les vésicules synaptiques au sein de 2 aires : une zone active et une zone péri-synaptique. La zone active est constituée des vésicules synaptiques prêtes à fusionner avec la membrane synaptique et à relarguer leurs neurotransmetteurs (6-8 VS par bouton). La zone péri-synaptique est plus en retrait de la fente synaptique. Elle permet le stockage des vésicules synaptiques en réserve (200 VS par bouton), et de reconstituer la zone active en nouvelles vésicules au cours de la neurotransmission (Gundelfinger et al., 2003; Murthy and De Camilli, 2003; Stevens, 2003; Ziv and Garner, 2004) (Figure 4). Elle est aussi essentielle à la transmission synaptique puisqu’elle comprend au niveau membranaire de nombreux canaux ioniques, et récepteurs ou transporteurs spécifiques des neurotransmetteurs.
Les vésicules prêtes à fusionner et les VS de réserve sont des structures dynamiques tout au long des phénomènes de neurotransmission et font l’objet d’un recyclage actif.
Figure 4: Représentation schématique de la zone active présynaptique et du cycle des vésicules synaptiques.
Les vésicules synaptiques sont transloquées de la zone de réserve à la zone active de fusion grâce à un ensemble de protéines motrices et de protéines d’ancrage mettant en jeu le réseau d’actine. Des protéines de la surface vésiculaires (v-SNARE) s’associent aux protéines de la membrane plasmiques (t-SNARE) formant le complexe SNARE, ce qui entraîne le regroupement (« docking ») des VS et leur préparation à la fusion. L’exocytose des VS suit l’ouverture des canaux ioniques voltage-dépendant. Le recyclage des VS selon le mode endocytaire dépendant de clathrine est représenté ici.
Les protéines motrices et d’ancrage des VS sont indiquées sur la figure, ainsi que le SNARE, et les filaments d’actines.
Le déplacement des VS au sein de la synapse repose sur la régulation du cycle de polymérisation/dépolymérisation de l’actine, composant cytosquelettique majeur de la zone présynaptique (dos Remedios et al., 2003).
La fente synaptique
La fente synaptique correspond à l’espace entre la zone présynaptique et la zone postsynaptique d’une synapse. Elle a une largeur à peu près constante de 20nm, un espace étroit qui permet aux neurotransmetteurs libérés par le bouton présynaptique d’atteindre rapidement les récepteurs postsynaptiques.
La fente synaptique est remplie d’une matrice extracellulaire dense visible au microscope électronique. Des études biochimiques ont permis d’identifier les protéines présynaptiques et postsynaptiques qui interagissent au niveau de la fente synaptique et stabilisent la synapse (Figure 5). Entrent dans la composition de cet espace : des composants de la MEC (laminine, fibronectine), des molécules d’adhésion cellulaire (intégrines, membres de la famille des immunoglobulines comme N-CAM) et des métalloprotéases (Dityatev and Schachner, 2006; Murthy and De Camilli, 2003). Ces protéines jouent un rôle crucial dans l’assemblage des contacts synaptiques. Cet assemblage est dynamique. Ces protéines sont également essentielles dans le remodelage concomitant des zones pré- et postsynaptiques en relayant les informations morphologiques des réseaux d’actine de ces deux zones (Dillon and Goda, 2005) (Figure 6).
La zone postsynaptique
La zone postsynaptique contient une région d’aspect très dense au microscope électronique du fait d’une forte affinité pour les métaux lourds. Cette région est de ce fait appelée densité postsynaptique (PSD) (Figure 3). Cette zone est déterminée par les récepteurs aux neurotransmetteurs qui la composent. Pour simplifier cette description, je focaliserai mon exposé sur les synapses glutaminergiques qui sont les principales synapses excitatrices du SNC et aussi les plus décrites. Il s’agit le plus souvent de l’extrémité d’une dendrite, ou épine dendritique, d’une épaisseur de 50-60nm et d’un diamètre de 300-500nm. C’est une structure extrêmement spécialisée grâce à un réseau de protéines très développé jouant des rôles aussi bien dans le maintien dynamique de l’architecture que dans le fonctionnement postsynaptique et le relai de l’information électrique et chimique (Choquet and Triller, 2003).
Figure 5: Molécules de la matrice extracellulaire présentes au niveau de la fente synaptique et autour de la synapse.
D’après (Dityatev and Schachner, 2003)
Figure 6: Relai des informations nécessaires au remodelage du
cytosquelette d’actine entre les zones pré- et postsynaptiques:
Quelques exemples de molécules de la matrice extracellulaire sont représentées avec leur lien au cytosquelette d’actine. Au niveau post-synaptique, 3 niveaux de relais moléculaires sont indiqués, les protéines de signalisation RhoGEFs, RhoGAPs, les enzymes qu’elles recrutent, les RhoGTPases, les effecteurs et les protéines liant l’actine qui remodèlent les filaments.
Des études protéomiques ont révélé plus de 200 protéines entrant dans sa composition (Li et al., 2004).
Principalement elle se compose d’abord des récepteurs membranaires aux neurotransmetteurs. Les récepteurs au glutamate sont de deux types : récepteurs ionotropiques, et des récepteurs métabotropiques (mGluRs). Les récepteurs ionotropiques sont les α-amino3-hydroxy-5-méthyl-4-isoazolepropionate récepteurs (AMPARs), et les N-méthyl-D-aspartate récepteurs (NMDARs). Ce sont des canaux ioniques constitués de 4 sous-unités, dont l’ouverture dépend de la liaison des ligands, ce qui permet la conversion du message chimique transporté par les neurotransmetteurs en message électrique qui est ensuite relayée par les différents canaux ioniques dépendant du voltage ou du calcium le long de la membrane neuronale. Ils existe enfin d’autres récepteurs, notamment les récepteurs aux neurotrophines NTRs comme les récepteurs tyrosine kinase (Trk B, ou ephrin). La présence de ces récepteurs à la membrane postsynaptique est régulée de manière très stricte par des mécanismes engendrant leur internalisation et leur déplacement à d’autres membranes du neurone ou au contraire leur concentration en certaines zones de la synapse, pour moduler l’efficacité de la neurotransmission (Triller and Choquet, 2005).
Tous sont reliés au niveau membranaire à de nombreuses protéines adaptatrices et à des kinases comme les Membrane-associated guanylate kinases (MAGUKs) dont la protéine PSD95 est la plus représentée (Schubert and Dotti, 2007). Ces protéines sont impliquées dans la mobilisation et la conversion de l’énergie nécessaire pour l’activité intense à la synapse. L’ATP est ainsi converti en AMPc qui est le second messager primordial à la transmission du signal chimique. De même l’ouverture de canaux calciques fait du Ca2+ intracellulaire le deuxième second messager majeur. D’autres protéines permettent l’ancrage membranaire et le recrutement des enzymes kinases telles que la PKA (cAMP-dependent protein kinase) (Figure 6), la Ca2+/calmodulin-dependent kinase II (CamKII) ou la calcineurin/phosphatase 2B ainsi que les Rho-GTPases. Ces enzymes agissent sur le niveau de phosphorylation d’un très grand nombre de substrats dont les protéines d’ancrages, les protéines associées au cytosquelette et d’autres messagers impliqués dans la cascade de signalisation qui vont activer le neurone jusqu’au niveau du noyau. Elles sont des moteurs majeurs de la plasticité synaptique.
Le troisième composant majeur de la zone postsynaptique est le cytosquelette d’actine F et un large panel de protéines associées qui vont moduler son organisation et son cycle de polymérisation/dépolymérisation (Schubert and Dotti, 2007). L’actine F est d’abord organisée en filaments courts et droits de 4 à 6 nm de diamètre et de 20 nm de long qui sont ancrés en regard de la jonction synaptique et s’étendent dans l’extrémité dendritique. Un
deuxième réseau est présent dans toute l’extrémité de la dendrite alors que sa zone d’étranglement est constituée d’un troisième réseau d’actine F.
Ces trois types de composants de la densité post-synaptique, en plus d’éléments cellulaires classiques de la machinerie de biosynthèse de novo protéique, des chaperonnes et du protéasome permettent la transmission du message nerveux.
c. Les mécanismes moléculaires de la transmission synaptique
Les neurones sont des cellules à activité électrique autonome. Ce sont des cellules excitables, capables de générer des potentiels d’action (PA) qui sont transmis le long des prolongements neuronaux (Koester and Siegelbaum, 2000). Ces PA sont produits par l’activation rapide de canaux à sodium (Na+) dépendant du potentiel, qui entraîne un influx
d’ions Na+ dans la cellule, responsable d’une dépolarisation membranaire.
La dépolarisation membranaire correspond à un changement d’état du potentiel de membrane qui est d’environ –60mV au repos et atteint un pic maximal de +40mV lors de la stimulation. Suivant la dépolarisation, une période de repolarisation de la membrane a lieu grâce à une sortie ions potassium (K+) par d’autres types de canaux ioniques.
La dépolarisation du neurone entraîne une cascade d’événements chimiques qui conduit à terme à l’exocytose de vésicules synaptiques. En effet, l’activation de canaux calciques dépendant du potentiel, engendre l’influx de Ca2+ qui est l’élément déclencheur de
l’exocytose des VS. Les vésicules synaptiques libèrent leur neurotransmetteur. Dans le cas particulier du glutamate, ce dernier est reconnu par ses récepteurs sur la zone postsynaptique. À sa fixation sur les canaux ionotropes (AMPARs et NMDARs), un processus plus ou moins complexe conduit à l’ouverture des canaux formés par ces récepteurs et au flux entrant de Na+, plus ou moins compensée par un efflux de K+. Si la
résultante globale est une dépolarisation membranaire suffisante, un PA est nouvellement généré et se transmet sur le neurone postsynaptique par le biais de l’activation de nouveaux canaux sodiques membranaires (Tsuzuki and Ozawa, 2005).
Dans certains cas, l’exocytose des VS peut avoir lieu sans excitation préalable du neurone. Elle génère alors l’activité électrique de base du réseau neuronal et semble jouer un rôle dans le maintien de la synapse.
Enfin, il existe aussi un mécanisme de neurotransmission inhibitrice dont l’acide γ-aminobutyrique (GABA) est le principal messager au niveau du SNC. Sa fixation sur les
récepteurs GABAergiques entraîne une hyperpolarisation de la membrane du fait d’un influx d’ions chlorure Cl- ou d’une sortie d’ions K+ selon les récepteurs GABA
A ou GABAB
respectivement. Ces récepteurs sont présents à la membrane postsynaptique et à une moindre mesure à la membrane présynaptique pour les GABAB.
Dans tous les cas l’activité neuronale sera contrôlée à la fois par des neurones excitateurs et inhibiteurs.
La transmission synaptique implique des remodelages importants du cytosquelette d’actine que ce soit au niveau pré ou post-synaptique :
Au niveau présynaptique : Exocytose et recyclage des vésicules synaptiques
Au niveau du pool de réserve des VS, le cytosquelette d’actine maintient ces VS regroupées, jusqu’à l’influx calcique. Ce dernier active des protéines destabilisatrices de l’actine qui fragilisent le réseau et laisse les VS synaptiques accéder au pool de la zone active et à l’exocytose (Figure 4).
Les vésicules synaptiques sont ainsi recrutées à la membrane synaptique, grâce à un processus encore mal connu qui semble mettre en jeu les protéines Rab, leur interaction avec la Guanosine triphosphate (GTP) et la protéine RIM associée au cytosquelette d’actine (Murthy and De Camilli, 2003). La synaptotagmine et la synaptobrévine/VAMPs, composants membranaires des VS, permettent ensuite l’ancrage de ces dernières à la membrane présynaptique et leur rapprochement via SNAP25 et la syntaxine, formant le complexe de fusion SNARE. À ce niveau, les complexine I et II lient le SNARE et sont indispensables à sa formation bien que son rôle ne soit pas bien défini (Marz and Hanson, 2002; Pabst et al., 2002). L’ensemble forme un complexe ternaire « d’amorçage » de la fusion, mais reste instable et aucune des protéines n’intéragit directement avec les autres. La stabilisation du complexe va permettre cette interaction et initier la fusion. Munc18 se dissocie d’abord de la syntaxine par un mécanisme inconnu. La phosphorylation inhibitrice de la PKC, kinase dépendante du Ca2+ pourrait intervenir de même qu’un intermédiaire comme Munc13.
Le rapprochement des éléments du complexe qui en découle permet le passage à une conformation stable dite « serrée », et à l’exocytose des neurotransmetteurs.
Le complexe SNARE se dissocie ensuite du fait d’une action ATPasique et de certaines protéines associées.
Le recyclage des vésicules synaptiques est ensuite nécessaire pour reconstituer le pool actif de vésicules synaptiques. L’endocytose des VS peut se réaliser selon deux modes :
- un mode « kiss and run » indépendant de la clathrine, - un mode classique avec des vésicules à clathrine.
Ces modes d’internalisation seraient en fait des voies d’exo-endocytose différentes dans lesquelles les VS seraient en fait préengagées avant même leur fusion. Néanmoins la dynamine est commune aux deux voies et permet la fission membranaire en exerçant une compression des membranes GTP dépendante.
Le mode classique, souvent engagé lors de stimulations d’intensité importante, met en jeu le remodelage du cytosquelette d’actine. Syt1 recrute la protéine AP2 nécessaire à l’endocytose dépendante de clathrine. Le recrutement de l’actine/dynamin binding protein 1 (Abp1 ou ablim1 ), permettrait de coordiner la machinerie endocytaire avec le cytosquelette des zones actives et périsynaptiques et de reconstituer le pool de réserve en VS. Ce mécanisme ferait intervenir la polymérisation d’actine dépendant de l’activation de LIMK et l’inhibition des facteurs déstabilisant l’actine F. Les VS seraient ainsi « entraînées » avec l’actine en polymérisation ou transportées via les myosines (Dillon and Goda, 2005).
Le mode « kiss and run » n’engage qu’une fusion transitoire et incomplète des VS , ne faisant pas intervenir le cytosquelette d’actine. Ce mécanisme mal connu permettrait le recyclage rapide de vésicules prêtes à être à nouveau libérées pour maintenir une partie de ce pool actif (Galli and Haucke, 2004).
La capture de neurotransmetteurs par les vésicules synaptiques nouvellement recyclées nécessite l’acidification (pH<5,6) de la lumière de la VS grâce à une pompe à protons ATPasique. Cette même pompe permet le passage des neurotransmetteurs attirés par le gradient électrochimique induit. La nature de ces pompes/transporteurs de neurotransmetteurs varie en fonction de ces derniers. Ainsi l’expression du transporteur serait déterminante du type de neurotransmetteur relargué par le neurone (Sudhof, 2004).
Au niveau postsynaptique : transmission du signal et renforcement de la synapse Dans les premières millisecondes suivant l’excitation d’un neurone, ont lieu des modifications du potentiel de membrane associées à la neurotransmission.
La dépolymérisation de l’actine F à la synapse réduit le nombre de ses récepteurs au Glutamate (Allison et al., 1998). Quelques secondes seulement après l’excitation du
neurone, a lieu un profond remodelage de l’actine ce qui se répercute sur la forme de l’épine dendritique et modifie 30% de ses dimensions (Fischer et al., 1998). Ce processus, activité dépendant est essentiel au maintien de la synapse et à son renforcement au cours de la neurotransmission. L’activation des récepteurs au glutamate dans une limite physiologique ou aux neurotrophines (Trk), entraînent l’activation d’enzymes comme la LIMK et la CaMKII qui phosphorylent certaines protéines régulatrices de la polymérisation de l’actine. Cela favorise la stabilisation de l’actine dendritique et le recrutement de composants de la fraction postsynaptique comme la protéine PSD95 (Schubert and Dotti, 2007).
La stabilisation de l’actine F dans la zone postsynaptique induite par l’activité, conduit à sa redistribution au niveau du bouton synaptique. En parallèle de l’augmentation de son niveau général, l’actine se condense en regard de la jonction synaptique avant de revenir à sa situation de départ, dite au repos, après 5 minutes. Ce phénomène conduit à l’expansion de l’extrémité dendritique autour de la terminaison axonale. Remarquablement, le phénomène se réalise aussi en miroir au niveau présynaptique (Dillon and Goda, 2005).
D’un point de vue fonctionnel, ce processus pourrait participer au renforcement de la synapse et à l’activation des récepteurs AMPA, du fait du lien étroit entre la densité de ces derniers, la robustesse de la synapse et la taille de l’épine dendritique (Matsuzaki et al., 2001).
3. Notion de potentialisation à long terme (LTP) et plasticité
Depuis de nombreuses années, les bases moléculaires qui conduisent l’animal et l’homme en particulier à fournir une réponse adaptative chacun à son environnement sont étudiées. L’apprentissage et la mémoire sont deux composantes majeures de cette réponse (Lynch, 2004).
Au niveau synaptique cette plasticité de réponse consiste au maintien (potentialisation) ou au silence (dépression) de l’activité synaptique pendant un temps plus long qu’un simple passage de l’information électrique.
En 1973, l’équipe de Bliss observe un phénomène particulier qu’ils nommeront potentialisation à long terme (LTP). Lorsqu’ils stimulent de manière soutenue et répétée les neurones de la région CA1 de l’hippocampe de lapins, les cellules granulaires postsynaptiques de l’hippocampe répondent avec des PA plus intenses et surtout durable (Bliss and Gardner-Medwin, 1973).
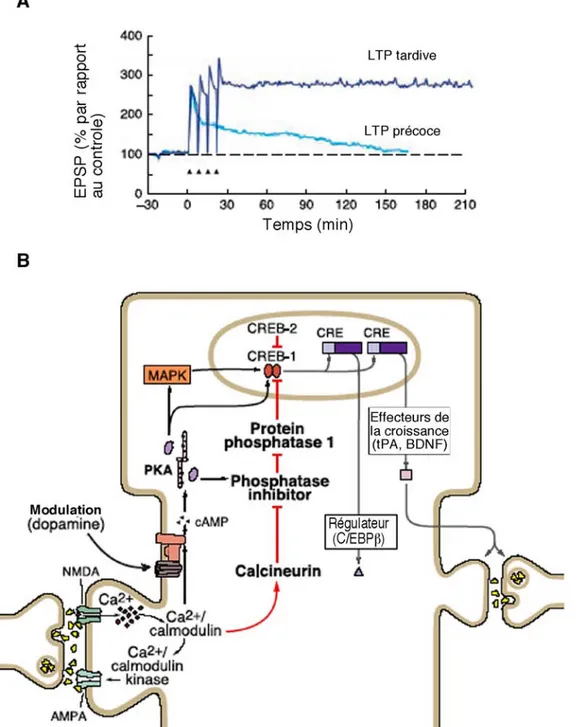
Figure 7: Représentation schématique de la potentialisation à long-terme (LTP) de l’activité neuronale.
(A) Activité électrique caractérisant les deux phases de LTP, précoce et tardive, en termes de potentiels post-synaptiques excitatoires (EPSP) normalisés par rapport au controle en l’absence de stimulation. La LTP précoce dure une dizaine de minutes comparée à la LTP tardive qui se maintient sur plus de 24H. (B) Schéma des événements moléculaires de la phase tardive de la LTP, engageant l’activation de la PKA et de l’expression génique au niveau nucléaire. Certaines voies de régulation sont également indiquées.
a. LTP postsynaptique
La LTP est communément subdivisée en deux phases : une phase précoce indépendante de la synthèse protéique, et une phase tardive qui est sensible à l’action des inhibiteurs de la biosynthèse des protéines (Kandel, 2001), dont la progression dépend
du niveau de stimulation appliqué (Figure 7).
Au niveau moléculaire, la première phase ou LTP1, découle directement de l’activation des récepteurs au glutamate NMDARs. L’influx calcique provient alors de ces récepteurs et, dans certains cas, du réticulum endoplasmique activé par l’influx calcique. Le Ca2+ active alors deux kinases majeures : la CAMKII et de manière plus sélective, la protéine
kinase dépendant du calcium PKC. Lors de la LTP1, le renforcement synaptique est donc induit par les modifications post-traductionnelles et surtout la phosphorylation des nombreux substrats de la CamKII et engendre notamment le remodelage du cytosquelette d’actine.
Si la stimulation est plus robuste, d’autres mécanismes s’ajoutent au précédent. La phase durable de la LTP peut ainsi être subdivisée en 2 : LTP2 et 3 (Figure 7). Elles nécessitent toutes deux la synthèse de novo de protéines qui vont réguler et renforcer encore la transmission synaptique, mais dans la LTP2 il y a seulement l’activation locale de la traduction, alors que la LTP3 fait appel au niveau nucléaire et à la transcription de nouveaux gènes (Miyamoto, 2006; Raymond, 2007). Ces trois phases sont complémentaires et semblent avoir lieu plus ou moins ensemble au niveau des synapses mais leurs contributions respectives à plasticité synaptique engagent des voies de signalisation différentes.
En effet, lors de la LTP2, l’influx calcique dépendant de l’activation des NMDARs, est renforcé par l’activation de celui du RE. Le recrutement des mGluRs serait nécessaire pour la synthèse de l’Inositol (145) P3 et du diacylglycérol par l’activation de la PLC qu’ils
occasionnent. En plus de la CamKII, et de la PKC, une autre kinase dépendante des Inositol (145) P3, la phosphoinositide (PI) 3-kinase est activée. La phosphorylation des
substrats conduit à celle de ERK2 (Extracellular-regulated kinase) et l’activation de la cascade signalétique des mitogen-associated protein (MAP) kinases qui sont des régulateurs important de la synthèse dendritique. De plus les mTOR (mammalian target of rapamycin) engagés dans la voie de la PI3K concourrait à l’activation de la traduction locale en activant certains facteurs de traduction.
La LTP2 est une transition entre la potentialisation précoce et une potentialisation plus durable occasionnée par la LTP3. En effet, cette phase n’est atteinte expérimentalement que lorsque la stimulation est forte et soutenue. Elle dépend d’un influx majeur Ca2+ provenant de
l’activation des NMDARs, et de l’activation de canaux calciques voltage-dependant (L-type VDCCs) qui sont présents surtout au niveau somatique. La LTP1 et la LTP2 seraient aussi distinctes de la LTP3 du fait de la compartimentalisation des signaux qu’elles nécessitent.
La LTP3 engage une troisième protéine kinase, qui dépend du messager AMPc, la PKA. La PKA est un coactivateur de la transcription médiée par le CRE (Calcium responsive element), en activant CREB (la CRE binding protein) par phosphorylation. La cascade signalétique ERK-MAPK y concourent également.
La transcription génique et l’expression protéique dépendante de l’activité synaptique est donc engendrée au niveau de gènes porteurs de la cassette CRE (CAAT box enhancer binding protein (C /EBP), cFos) et de nombreux autres et d’autres signaux de régulation comme le serum response element (SRE) (Raymond, 2007).
Dans la phase tardive de la LTP, d’autres mécanismes sont évoqués pour la conduction rapide du message au noyau, notamment au niveau du flux calcique. En effet, les longues distances à parcourir depuis la synapse jusqu’au noyau et la rapidité de mise en place de la synthèse protéique (30 minutes à une heure) sont peu compatibles avec une cascade de signalisation nécessitant plusieurs étapes de phosphorylation avant l’activation de CREB (Adams and Dudek, 2005). Au cours de la LTP3, l’influx calcique mobilisé par les VDCCs permettrait l’activation directe de kinases nucléaires ou pouvant se transloquer rapidement dans le noyau comme la CamKIV (Miyamoto, 2006), la CamKI, ERK1 ou NFAT qui engendrerait l’activation de CREB.
b. LTP présynaptique :
La potentialisation présynaptique se traduit par l’augmentation de la libération de neurotransmetteurs grâce à deux mécanismes :
- l’augmentation de l’excitabilité présynaptique. Celle-ci passe par l’augmentation de l’influx calcique du fait de la phosphorylation activatrice des canaux ioniques par certaines kinases.
- la régulation du cycle exo-endocytose des vésicules synaptiques par des kinases. Ici encore les kinases impliquées dans ces processus sont la CaMKII, la PKC et la PKA. Concernant les vésicules synaptiques, les phosphorylations peuvent intervenir au niveau :
- des protéines associées au cytosquelette et engagées dans le recrutement des VS (cas de la synapsine 1 (Evergren et al., 2007), de MARCKS, principal substrat de la PKC, lient sous leur forme non phosphorylée les lipides membranaires des VS, et le cytosquelette, ou SNAP25)
- des protéines du complexe SNARE et des protéines impliquées dans sa stabilisation comme Munc13 et Munc18 phosphorylée par la PKC (Craig et al., 2003).
- des protéines impliquées dans l’endocytose de VS comme la dynamine dont la déphosphorylation par la calcineurine active l’endocytose (Tan et al., 2003).
Au niveau du recyclage des vésicules synaptiques, un message rétrograde dépendant du NO (oxyde nitrique) provenant de la fraction postsynaptique et de l’activation des NMDARs activerait l’endocytose des VS.
Les changements pré- et post-synaptiques répondraient par ailleurs à un modèle dit « unifié » de LTP. Pour cela, le cycle d’exo-endocytose des VS connaîtrait un relai progressif du mode « kiss-and-run », qui favorise la reconstitution rapide d’un pool de VS prêt à être libéré au détriment d’une faible quantité de neurotransmetteurs émis, par le mode de fusion complète qui favorise un relarguage massif de neurotransmetteurs, mais est plus demandeur en termes d’énergie. Au cours de la LTP, des modules dits silencieux riches en AMPARs (notamment GluR1), qui requièrent un signal intense en termes de neurotransmission seraient alors activés et favoriseraient les évènements suivants de la LTP (Lisman et al., 2003). L’activation de ces récepteurs dépend en premier lieu de l’activité d’une PKC atypique, la PKMζ (Ling et al., 2006; Pastalkova et al., 2006). Les remodelages de l’architecture de la synapse engendreraient ensuite l’inclusion de la surface dendritique périsynaptique dans la synapse et la meilleure exposition de ses récepteurs à la synapse. Au niveau du remodelage synaptique la LTP engendre de profonds changements de l’architecture de la synapse au niveau du cytosquelette d’actine. En effet, on assiste à l’augmentation très marquée de la quantité d’actine F aux niveaux pré- et postsynaptique et à un maintien de cette structure pendant plus de 5 semaines dans le gyrus denté in vivo. Un remodelage plus général de l’actine des neurones en contact permet la formation nouvelles synapses (Dillon and Goda, 2005).
En conclusion, la neurotransmission qui est la fonction première du neurone est un phénomène complexe mettant en jeu la conversion d’un message électrique en message chimique et la réalisation de cascades signalétiques complexes. La LTP est le mécanisme fondateur de la plasticité synaptique. Cette dernière permet d’envisager toute l’étendue de
l’adaptation de la réponse neuronale à la diversité des stimuli et leur intégration au niveau du réseau des neurones. Pourtant, ramenés à l’échelle des individus, ces mécanismes sont extrêmement conservés des invertébrés mollusques aux mammifères et sont directement associés à l’émergence de fonctions comme l’apprentissage, ou la mémoire (Kandel, 2001). Cette extrême conservation témoigne du caractère fondamental de ces processus dans l’adaptation de la réponse de l’individu à son milieu et à sa survie. Le cerveau des mammifères est ainsi flexible et capable de changer de fonction et de structure en réponse à des stimuli internes ou externes. C’est ce qui définit la plasticité neuronale.
B Les niveaux de régulation de la plasticité neuronale
La plasticité neuronale est la résultante de l’ensemble des mécanismes moléculaires mis en place pour l’acquisition des caractéristiques spécifiques de la cellule neuronale, à leur maintien, et l’adaptation constante de la réponse du neurone en fonction des variations de son environnement intrinsèque et extrinsèque.
En effet, elle commence à partir du moment ou la cellule a acquis le très haut niveau de différenciation en neurone, état post-mitotique. Cette nécessité d’adaptation constante découle de la perte même de sa capacité mitotique, qui oblige le neurone à élaborer d’autres stratégies nécessaires à sa survie utile au sein de l’organisme. En effet, à l’échelle de l’organisme, le cerveau d’un animal possède seulement un pool restreint de cellules souches neuronales capables de remplacer une perte potentielle de neurones. Tout au long de la vie, seules sont consolidées les connexions interneuronales utiles alors que celles qui ne sont pas suffisamment sollicitées dégénèrent. C’est là la base des phénomènes d’apprentissage et de mémoire.
On comprend donc l’importance de connaître les mécanismes moléculaires de la neuroplasticité, et leurs dérégulations observées au cours de certaines pathologies neurologiques ou comportementales/psychiatriques.
Même si la connaissance de ces processus reste parcellaire, la potentialisation à long terme de l’activité synaptique en fait partie et reflète 3 niveaux majeurs de plasticité neuronale.
En effet, l’adaptation de la neurotransmission par son renforcement (LTP) ou sa fragilisation (LTD) montre trois niveaux majeurs de régulation :
- Au niveau de la synapse, une régulation très localisée. Neurotransmetteurs, récepteurs et éléments de signalisation doivent être présents pour former une synapse fonctionnelle.
Comment une synapse se forme-t’elle ? comment est-elle fonctionnelle ? sont les questions à se poser pour comprendre ce premier niveau de la plasticité neuronale.
- au niveau plus général du remodelage permanent du cytosquelette. Le cytosquelette revêt une importance capitale pour le neurone, d’abord au niveau synaptique pour amener, maintenir et renforcer deux extrémités polarisées de neurones différents en contact. Ensuite d’un point de vue général, le cytosquelette donne au neurone son architecture très étendue dans l’espace, autorisant le transport de molécules et d’organites entre les neurites et un corps cellulaire séparés par de longues distances. Enfin il permet la migration des neurones vers leurs couches de destination au cours du développement du cerveau. Le remodelage dynamique constant du cytosquelette d’actine et des microtubules en particulier est nécessaire à la survie à long-terme du neurone.
- Au niveau de l’expression protéique et de la dynamique des ARNm. Ces mécanismes font appel à des bases communes à toute cellule, mais l’agencement des acteurs de leur régulation montre une particularité neuronale. En parallèle de la régulation générale du métabolisme de base de la cellule, une régulation extrêmement fine et rapide dépend de l’activité électrique du neurone et permet une réponse adaptative de l’expression protéique en fonction des besoins de la synapse. Il s’agit aussi de régler le problème de la distance entre noyau et extrémité neuritique grâce à des mécanismes de re-localisation de la machinerie traductionnelle au niveau synaptique.
Il est impossible d’être exhaustif sur ces processus, tant les avancées et hypothèses mécanistiques sont nombreuses et sont l’objet de disciplines aussi variées qu’éloignées de la virologie qui est ma formation de base. De ce fait, dans les études qui suivent, je ne développerai que certains aspects des niveaux de la neuroplasticité, nécessaires à la compréhension de mes travaux sur l’interférence du virus avec la fonction neuronale.
1. Facteurs de neurogenèse et de synaptogenèse
La neurogenèse correspond au processus que subit un précurseur neuronal, cellule souche embryonnaire ou précurseur au sein du tube neural en développement, pour passer
d’une cellule pluripotente et mitotique à un neurone, c’est-à-dire une cellule post-mitotique à très haut niveau de différenciation. Cela prend en compte aussi la migration des neurones nouvellement différenciés au sein des différentes couches du SNC, qui fait partie intégrante du processus de maturation.
La synaptogenèse est le processus dynamique qui vise à produire de nouvelles synapses, à les remodeler ou les rétracter en fonction des besoins et de l’adaptation fonctionnelle des neurones à l’environnement. La synaptogenèse fait donc partie de la neurogenèse dont elle est le principal niveau de plasticité. Pour la suite de cette partie, je focaliserai mon exposé sur les facteurs de synaptogenèse. En effet, tous les facteurs pré- et postsynaptiques qui relaient le signal chimique jusqu’au remodelage du cytosquelette en font partie et ont déjà été évoqués en I.A.2. b et c. D’autre part, le modèle viral que nous étudions affecte principalement des neurones postmitotiques dont le niveau de maturation correspond à la migration terminale des neurones corticaux et surtout l’élaboration du réseau synaptique.
La synaptogenèse fait intervenir plusieurs mécanismes cellulaires plus ou moins spécifiques de la fonction neuronale:
- la mise en place de la neurotransmission, ce qui implique l’expression de récepteurs et de neurotransmetteurs de manière appropriée d’un point de vue spatio-temporel. Cela nécessite aussi une communication entre les deux neurones constituant la synapse grâce à un maintien homéostatique de la matrice extracellulaire synaptique ;
- l’émission polarisée de substances de guidage axonal et dendritique par un neurone et, de l’autre côté, la perception de ces signaux par un autre neurone en vue de la formation d’une nouvelle synapse. En effet, ce premier système de « communication à distance » vise à favoriser l’établissement adapté des meilleures synapses, et à les consolider en établissant une première reconnaissance par les deux parties prenantes de la faisabilité d’une telle association.
- Des mécanismes transversaux qui permettent de répercuter la première perception de ces signaux sur la morphologie dendritique et axonale. Ils concourent également à l’établissement des cascades signalétiques engagées lors de la neurotransmission.
Il s’agit alors de processus de remodelages du cytosquelette d’actine et des microtubules, ainsi que de la modulation de l’expression protéique. Ces mécanismes sont à la base de la plasticité synaptique. Ces processus seront évoqués dans les sections séparées de celle-ci du fait de leur importance fondamentale dans la neuroplasticité, à cause de leur intervention à tous les niveaux de cette dernière et non pas seulement de la synaptogenèse.
a. Expression des neurotransmetteurs et récepteurs au cours de la synaptogenèse
Le glutamate et ses dérivés
Il existe une grande diversité de neurotransmetteurs au sein du système nerveux central (SNC) (cf. :I. A. 2. a.). Néanmoins c’est le glutamate qui tient la place du premier neurotransmetteur en termes d’importance quantitative des synapses dans le SNC (Hertz, 1968). Le glutamate est pourtant présent dans tout l’organisme. Ses fonctions au sein du SNC sont extrêmement variées du fait qu’il est à la fois métabolite et précurseur d’autres neurotransmetteurs comme la glutamine et l’acide γ-amino butyrique (GABA), dont les effets sont diamétralement opposés de ceux du glutamate (Hertz, 2006).
Le glutamate est accumulé au niveau vésiculaire et mitochondrial, et libérée par exocytose, non seulement au niveau des neurones mais surtout au niveau des astrocytes qui possèdent également les transporteurs vésiculaires du glutamate VGLUT1 et VGLUT2. L’aspartate aminotransférase, en équilibre avec la glutamate déshydrogénase permet la synthèse mitochondriale de glutamate. En fonction de la balance énergétique de la cellule et de son activation, elles permettent d’orienter la synthèse de neurotransmetteur en fonction des besoins (McKenna et al., 2000).
La synthèse de novo de glutamate utilise 20% du métabolisme total cérébral du glucose. Les étapes initiales nécessitent encore l’apport des astrocytes, et mettent en jeu des voies d’échange de métabolites entre neurones et astrocytes mal connues.
Les astrocytes ont donc une importance primordiale au cours de la neurotransmission du fait de leur intervention dans le métabolisme du glutamate.
D’une part, les astrocytes possèdent des transporteurs au glutamate (EAAT1 et 2) qui permettent la recapture du glutamate libre dans la fente synaptique. La recapture neuronale ne concerne qu’une quantité limité de glutamate qui assure juste l’apport nécessaire à la neurotransmission. Ainsi, les astrocytes concourrent au recyclage et la réutilisation du glutamate qui compte pour 30% du pool total de glutamate libéré à la synapse.
L’accumulation d’un excès de glutamate libre dans la fente synaptique a des effets excitotoxiques, car elle active les récepteurs métabotropes du groupe 1 (mGluR1) qui induit