T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Odontologie
JURY
Jacques DEJOU PU/PH Université Marseille, rapporteur Georges DORIGNAC PU/PH Université Bordeaux II, rapporteur
Geneviève GREGOIRE PU/PH Université Toulouse III, directrice Serge MAZERES Docteur d’Université, Ingénieur de recherche
Ecole doctorale :
Unité de recherche : Interface biomatériaux-tissus biologiques Directeur(s) de Thèse : G.GREGOIRE
Rapporteurs :
Présentée et soutenue par Emmanuelle NOIRRIT-ESCLASSAN Le 26 mars 2009
Titre :
Etude de l’interface et de l’étanchéité endocanalaire après collage de tenons fibrés radiculaires
A mes parents, à mon frère
Maman, tu savais…Béatrice avait dit ! A ma famille
A Rémi, mon complément, mon soutien tout au long de ce « sacré » parcours
A François et Aurélien, qui m’apprennent à apprivoiser mes petits patients ; il n’y a pas que des histoires de dents dans la vie !
A notre Directrice, Madame le Professeur Geneviève GREGOIRE,
Vous nous avez inspiré ce sujet de recherche et vous nous avez dirigée avec la compétence, la volonté et le sens du détail qui vous caractérisent.
A votre contact nous avons pris conscience de la rigueur de la recherche, de la satisfaction de mener à bien un travail et de le voir publié.
Merci de nous avoir fait progresser et de nous avoir guidée avec patience.
A notre Jury et Rapporteur, Monsieur le Professeur Georges DORIGNAC,
Nous vous sommes extrêmement reconnaissante d’avoir accepté de juger notre travail.
Vous avez marqué notre parcours universitaire. Votre rigueur, votre culture odontologique et pédiatrique ainsi que votre charisme sont pour nous des modèles depuis nos premières années d’internat.
Au sein du Collège d’Odontologie Pédiatrique vous avez instauré un climat chaleureux et convivial, propice à l’écoute et à l’échange, pour tous ceux qui aiment soigner les enfants, enseigner et chercher.
Soyez assurés de notre profond respect.
A notre Jury et Rapporteur, Monsieur le Professeur Jacques DEJOU,
Votre compétence et votre expertise dans le domaine des biomatériaux sont pour nous une référence.
Nous sommes très honorée de votre présence au sein de ce jury. Soyez vivement remercié d’avoir accepté de juger notre travail.
A notre Jury, Monsieur le Docteur Serges MAZERES,
Nous vous remercions très sincèrement d’avoir accepté de siéger dans notre jury.
Merci de nous avoir fait découvrir et apprécier la complexité de la spectrophotométrie. Vous avez toujours répondu à nos interrogations avec patience, disponibilité et indulgence. Vos remarques clairvoyantes nous ont éclairées sur un univers scientifique qui n’était pas le nôtre. Nous souhaitons poursuivre avec vous dans cette voie de la recherche où les champs à explorer sont immenses.
Je témoigne toute ma gratitude à Madame le Professeur Anne-Marie SAUTEREAU pour avoir initié la troisième partie de ce travail et pour son soutien lors de la préparation de mon concours de MCU-PH.
Je tiens également à remercier très chaleureusement Monsieur Simon CAYEZ du CIRIMAT pour sa précieuse aide technique, son enseignement de l’utilisation du Microscope Electronique à Balayage et l’entretien de ce bon vieux MEB (que de réparations !).
Je remercie les membres du laboratoire Interface biomatériaux-tissus dentaires et en particulier Firas Dabsie, pour leur concours éclairé et constant dans l'élaboration de la partie expérimentale concernant la filtration de fluide.
J’adresse mes vifs remerciements à Messieurs Maxime COURNOT, Pierre-Antoine GOURRAUD et Philippe GUIGNES pour leur précieuse aide dans le traitement statistique de mes données. Ils ont fait preuve de patience et de pédagogie.
Merci également à Monsieur Frédéric N’GUYEN pour sa contribution à la constitution des échantillons.
Mes pensées vont bien sûr vers Monsieur Bernard TERRIE qui a initié ce travail et m’a bien souvent proposé son aide pour des manipulations. Sa compétence, sa discrétion, sa méticulosité, son sens clinique et sa gentillesse font de lui un modèle que je tente de suivre. Je lui saurai toujours gré de m’avoir accordé sa confiance avant son départ. Puisse ce travail honorer sa mémoire.
Je dédie également ce travail à Monsieur Jean-François LAURET qui a marqué mes études brestoises par son ouverture d’esprit et son sens de l’observation.
PLAN
1. Introduction
1
2. Etanchéité radiculaire consécutive au collage de tenons fibrés : Analyse
bibliographique
10
1. Les méthodes d’évaluation de l’étanchéité 11
2. La dentine et ses spécificités radiculaires 26
3. Les systèmes adhésifs dentinaires 35
4. La colle 50
5. Les tenons fibrés 52
3. Evaluation expérimentale de l’herméticité du collage radiculaire
endocanalaire d’un tenon fibré
65
1. Etude des interfaces dentine radiculaire/colle/système adhésif/tenon fibré par
microscopique électronique à balayage 68
2. Etude de l’étanchéité radiculaire par méthode de filtration de fluide 95 3. Etude spectrophotométrique de l’interface entre un système adhésif
monocomposant et la dentine radiculaire 107
4. Conclusion
148
5. Bibliographie
151
PLAN DETAILLE
Introduction 8
1
èrepartie :
Etanchéité radiculaire consécutive au collage de tenons fibrés
Analyse bibliographique
1. Les méthodes d’évaluation de l’étanchéité 11
1.1. Mesures qualitatives 13
1.1.1. L’étude de la pénétration de bactéries et de toxines bactériennes 13
1.1.2. La pénétration de marqueurs radioactifs 14
1.1.3. Les techniques de microscopie 14
1.2. Mesures semi-quantitatives 19
1.2.1. Diffusion passive de colorants 19
1.2.2. Diffusion passive de traceurs chimiques 20
1.3. Mesures quantitatives 22
1.3.1. Conductance hydraulique et filtration de fluide 22 1.3.2. Dissolution des tissus durs ou extraction de marqueurs 23
1.3.3. Méthodes électro-chimiques 23
1.4. Conclusion 23
2. La dentine et ses spécificités radiculaires 26
2.1. Composition de la dentine 26
2.2. Boue dentinaire 28
2.3. Aspect tubulaire de la dentine 29
2.3.1. Dentine intra- et inter-tubulaire 29
2.3.2. Densité tubulaire 30
2.3.3. Orientation des tubules dentinaires 33
2.3.4. Diamètre tubulaire 34
3. Les systèmes adhésifs dentinaires 35
3.1. Les systèmes avec mordançage total 36
3.1.1. Principe 36
3.1.2. Mécanisme d’adhésion 37
3.1.2.1. Couche hybride 37
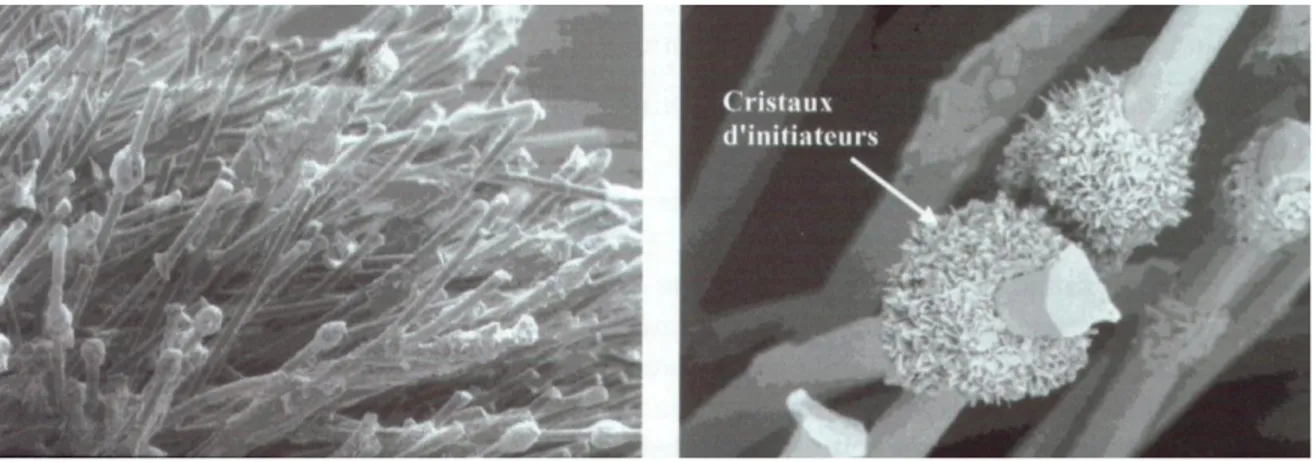
3.2. Les auto-mordançants 41 3.2.1. Principe 41 3.2.2. Composition chimique 41 3.2.2.1. Monomères 41 3.2.2.2. Systèmes initiateurs 45 3.2.2.3. Solvants 46 3.2.2.4. Additifs 47 3.2.2.4.1. Charges 47
3.2.2.4.2. Colorants et agents anti-microbiens 47
3.2.3. Mécanisme d’adhésion 48
3.2.3.1.Couche hybride 48
3.2.3.2.Tags de résine 49
3.3. Influence de l’eugénol sur l’adhésion 49
4. La colle 50
5. Les tenons fibrés 52
5.1. Composition 52 5.1.1. Fibres 53 5.1.2. Matrice 54 5.2. Traitement de surface 55 5.2.1. Silanisation 55 5.2.2. Air-abrasion 56 5.2.3. Système Cojet® 56 5.2.4. Mordançage acide 57 5.3. Propriétés 57 5.3.1. Propriétés mécaniques 57
5.3.1.1. Dissipation des contraintes 58
5.3.1.2. Résistance à la traction et à la fatigue 58
5.3.1.3. Module élastique 59
5.3.1.4. Augmentation de la rétention par le collage 59
5.3.2. Caractéristiques physiques 60
5.3.3. Propriétés esthétiques 62
5.3.4. Propriétés biologiques 62
5.3.5. Indications et forme du tenon 62
5.3.5.1. Longueur 63
5.3.5.2. Diamètre 63
5.3.5.3. Forme 63
2
èmepartie :
Evaluation expérimentale de l’herméticité du collage radiculaire
endocanalaire d’un tenon fibré
A. Etude des interfaces dentine radiculaire/colle/système adhésif/tenon
fibré par microscopie électronique à balayage
1. Matériel 69
1.1 Tenons fibrés FRC Postec 69
1.2 Monobond S 70
1.3 Colle Variolink II 70
1.4 Système adhésif 70
1.4.1 Monocomposant dual : Excite DSC* 70
1.4.2 Automordançant dual: AdheSE DC * 72
2. Méthode 73
2.1 Traitement endodontique 73
2.2 Division randomisée 74
2.3 Collage du tenon 74
2.3.1 Système adhésif Excite DSC* 74
2.3.2 Système adhésif AdheSE DC* 75
2.4 Evaluation microscopique 76
2.4.1 Observation de la couche hybride 76
2.4.2 Evaluation de la morphologie des tags de résine 78
2.5 Analyse statistique 80
3. Résultats 81
3.1 Evaluation de la couche hybride 81
3.2 Evaluation des tags de résine 84
4. Discussion 90
B. Etude de l’étanchéité radiculaire par filtration de fluide,
après obturation endodontique et collage d’un tenon fibré FRC Postec :
comparaison entre témoins et deux systèmes adhésifs : Excite DSC et
AdheSE DC, alliés à la colle Variolink II
1. La filtration de fluide 96
2. Matériel et méthode 98
A. Préparation des échantillons 98
2.1. Obturation endodontique de la racine 98
2.2. Randomisation 98
2.3. Préparation du logement canalaire et collage du tenon 99
2.3.1. préparation du logement canalaire 99
2.3.2. collage du tenon avec l’Excite DSC 99
2.3.3. collage du tenon avec l’AdheSE DC 100
B. Mesures de la filtration de fluide 100
3. Résultats 102
C. Etude spectrophotométrique de l’interface entre un système adhésif
monocomposant et la dentine radiculaire
1. Objectif 108
2. Définitions 108
2.1 Fluorescence 108
2.1.1 Etats excités ; transition énergétique 109 2.1.2 Excitation, émission, déplacement de Stokes 113
2.1.3 Coefficient d’absorption molaire 115
2.1.4 Rendement quantique de fluorescence 116
2.2 FRET : Förster Resonance Energy Transfer 117
2.3 Marqueurs fluorescents 118
2.3.1 Avantages des marqueurs fluorescents 119
2.3.2 Principaux marqueurs fluorescents utilisés en recherche dentaire 119
3. Caractérisation de la sonde par le FRET 120
3.1 Matériel 121
3.1.1 Spectrofluorimètre 121
3.1.2 MSF : Microspectrofluorimètre 122
3.1.3 Echantillons dentaires 122
3.1.4 Adhésif Excite DSC 123
3.1.5 Marqueur fluorescent : fluorescéine (FITC) sur polysaccharide
Dextran 123
3.2 Etude spectrofluorimétrique 125
3.2.1 Caractérisation des spectres d’excitation et d’émission
de la dentine 125
3.2.2 Caractérisation du système adhésif Excite DSC 126 3.2.2.1 Caractérisation des spectres d’excitation et d’émission 126 3.2.2.2 Préparation du mélange Excite DSC-Dextran fluorescéine 127 3.2.2.3 Validation du mélange Excite DSC-Dextran FITC 128
3.2.3 Couple Dextran FITC-Excite DSC 130
3.2.3.1 Effet de la photopolymérisation sur le FITC et sur le
mélange ExciteDSC-Dextran FITC 130
3.2.3.2 Chémopolymérisation du mélange Excite-Dextran FITC 131
3.2.3.3 Effet du mordançage dentinaire 132
3.2.3.4 Conclusions 138
3.2.4 Couple FITC-dentine : Caractérisé par le rayon de Förster : R0 139
3.3 FRET : Mise en évidence d’un FRET entre dentine et Excite FITC : étude au
spectrofluorimètre et au microspectrofluorimètre 140
Le but de tout matériau d’obturation dentaire coronaire ou radiculaire est de fournir une reconstitution durable tant sur le plan mécanique que biologique, avec un scellement biocompatible parfait à l’interface entre les tissus dentaires et l’obturation. Les tests permettant d’évaluer la qualité de ce scellement vont donc étudier la résistance mécanique des interfaces mais aussi le passage de fluides et/ou de bactéries et de leurs toxines: en effet, toute perte d’étanchéité peut être à l’origine d’une reprise de carie, d’une atteinte pulpaire, d’une lésion péri-apicale… mettant en jeu le pronostic dentaire.
De nombreuses études se sont attachées au problème d’interface et de perméabilité au niveau de la dentine coronaire ou radiculaire externe, mais les problèmes inhérents au collage sur la dentine radiculaire endocanalaire ont peu retenu l’attention. L’adhésion à ce niveau est en effet un véritable challenge du fait de la capacité variable du système de collage à déminéraliser et infiltrer les parois dentinaires, du manque de contrôle de l’humidité, de l’influence de la densité et de l’orientation variable des tubules dentinaires le long du canal radiculaire et enfin de l’accessibilité durant la manipulation des matériaux.
Pour étudier l’interface obtenue après collage endocanalaire d’un tenon fibré translucide au moyen de deux adhésifs différents, un monocomposant précédé d’un mordançage acide et un automordançant en deux étapes, associés à une même colle, nous avons choisi trois approches expérimentales. Dans un premier temps, la continuité de la couche hybride et la morphologie des tags de résine sont analysées en microscopie électronique à balayage. Dans un second temps, la perméabilité de l’ensemble est mesurée par une technique de filtration de fluide. Enfin, nous avons cherché à mettre en évidence un transfert d’énergie de résonance entre deux substances fluorescentes, la dentine et la fluorescéine afin d’obtenir des données sur l’interface dentine-système adhésif au niveau moléculaire.
1
èrepartie:
Etanchéité radiculaire
consécutive au collage de tenons fibrés
Analyse bibliographique
1. Les méthodes d’évaluation de l’étanchéité
De nombreuses méthodes [146, 249] ont été utilisées pour évaluer l’étanchéité des interfaces lors d’obturations radiculaires. La plupart sont basées sur la recherche de micropercolation [217], qui se produit selon KIDD [138] lorsqu’il y a passage de bactéries, fluides, molécules ou ions entre les parois d’une cavité dentaire et le matériau d’obturation. Les tests d’étanchéité menés in vitro vont permettre de donner une valeur quantitative de percolation théorique maximale pouvant se produire ou non in vivo [46].
Nous pouvons, à partir des résultats de GRIFFITHS [112], résumer dans un diagramme la topographie des différentes voies de microperméabilité au niveau de l’interface résine adhésive / dentine, à partir des fluides pulpaires (figure 1):
o (1) Absence de microperméabilité : l’interface est scellée par l’imprégnation de la résine au sein de la couche hybride, par les tags de résine dans les tubules dentinaires et les branches latérales.
o (2) Microperméabilité le long des tags de résine, à travers les branches latérales et la couche hybride.
o (3) Microperméabilité à travers la base poreuse de la couche hybride (a)
o (4) Microperméabilité autour des tags de résine et le long de l’interface (b) entre la couche hybride et la résine adhésive, avec un tag de résine détaché du tubule.
Figure 1 : les différents types de microperméabilité du fluide pulpaire au niveau d’une interface dentinaire adhésive [112]
Ces différentes techniques d’évaluation de l’étanchéité peuvent être classifiées en : - mesures qualitatives - mesures semi-quantitatives - mesures quantitatives a 1 2 3 4 b Adhésif t u b u l e Branches latérales Dentine
1.1 Mesures qualitatives
1.1.1. L’étude de la pénétration de bactéries et de toxines bactériennes
Description de la technique :
Le système comprend en général deux chambres séparées, entre les extrémités apicales et coronaires d’une dent obturée. La turbidité du bouillon dans la chambre apicale est la première indication de contamination par des micro-organismes et donc de perte d’herméticité [27, 35]. Le liquide dans la chambre apicale peut également contenir un indicateur ; par exemple un indicateur de pH comme le phénol rouge à 0,01% passe du rouge au jaune lorsque se produit une contamination bactérienne. En effet, la production d’acide par fermentation des hydrates de carbone, par Streptococcus salivarius par exemple, modifie le pH du milieu [2]. Les souches bactériennes et fongiques utilisées varient selon les études (tableau 1).
auteurs Souches bactériennes utilisées
Chailertvanitkul [38, 39] Streptocoques anaérobies, Fusobacterium nucleatum Barthel [18] Streptococcus epidermidis
Adamo [2] Streptococcus salivarius
Timpawat [253] Enterococcus faecalis
Carratù [35] Porphiromonas mirabilis, S. epidermidis
Miletic [171] Candida albicans, Streptococcus mutans, S. mitis, Prevotella melaninogenica, Lactobacillus acidophilus
Michailesco [169] Actinomyces odontotylicus, Lactobacillus acidophilus, Pseudomonas fluorescens
Maltezos [154] Streptococcus salivarius
Tableau 1 : Exemples d’études de percolation bactérienne et fongique avec les différentes souches utilisées
Des endotoxines peuvent également être utilisées : ce sont des lipopolysaccharides de la membrane externe de bactéries Gram négatives.
L’espace permettant le passage de bactéries fait au minimum 0,5 à 1 µm de large. En revanche, la percolation de toxines nécessite des hiatus de taille inférieure. [249]
D’après ADAMO [2] et TIMPAWAT [253], cette technique d’évaluation serait d’une plus grande valeur biologique et clinique que la méthode de pénétration d’un colorant ou d’un isotope. En effet, la capacité des micro-organismes vivants à modifier leur forme et leur taille
pour se mouvoir activement et se multiplier peut jouer un rôle important qui ne peut être représenté par aucune solution aqueuse avec un marqueur [18].
Limites :
Mesure qualitative : présence ou absence de contamination.
Méthode inutilisable si le ciment a une activité anti-bactérienne [154, 229]. Résultats dépendants du type de bactéries et/ou champignon utilisé [271].
1.1.2. Pénétration de marqueurs radioactifs
Description de la technique :
Différents isotopes sont utilisés comme marqueurs : le 45Ca, 131I, 35S, 22Na, 32P, 86Rb, 14C. Les auteurs de ces études [97, 122, 123, 228] ont détecté la présence de ces isotopes par autoradiographie [249].
Par comparaison, les plus petites molécules d’isotopes mesurent seulement 40 nm alors que la taille des plus petites molécules de colorants est de l’ordre de 120 nm.
Limites :
Les résultats peuvent varier en fonction du type de l’isotope (haute ou basse énergie, affinité pour le substrat comme le 45Ca), la distance entre la source de radiation et l’émulsion, la longueur d’exposition, le rinçage [256]. L’interprétation est très dépendante de la relation entre le faisceau principal des rayons X et l’angle cavosuperficiel. [249]. En conclusion, l’évaluation de la percolation est très dépendante de la technique.
De plus, l’évaluation du degré de percolation est subjective, même si certains auteurs [104] utilisent des systèmes de scores pour essayer d’initier une notion quantitative [249].
1.1.3. Les techniques de microscopie :
L’observation à fort grossissement des interfaces permet la localisation des défauts d’herméticité et une analyse morphologique fine des interfaces. Cette technique utilisée en corrélation avec d’autres méthodes (coloration, marquage fluorescent…) donne une image globale du comportement des matériaux d’obturation.
Microscopie électronique à balayage (MEB)
Description de la technique :
Cette technique de microscopie est basée sur le principe des interactions électrons-matière. Un faisceau d'électrons balaie la surface de l'échantillon à analyser qui, en réponse, réémet certaines particules. Le nombre de particules réémises varie en fonction de la topographie, la composition et la texture de la surface observée. Différents détecteurs permettent d'analyser ces particules et de reconstruire une image de la surface.
Les premiers MEB ont été commercialisés dans les années 1960. La résolution a été considérablement améliorée (de l’ordre de 1 nm) par l’apparition du « Field-Emission Instruments Scanning Electron Microscopy » (FEISEM) (MEB à émission de champ). Alors que le MEB utilise des voltages d’accélération de l’ordre de 15 à 25 kV, induisant des dommages par le faisceau d’électrons, le FEISEM travaille à des voltages de 2 à 6 kV, permettant une meilleure résolution et une préservation des structures biologiques [132]. Cependant, ces observations se font sous un vide plus important [270].
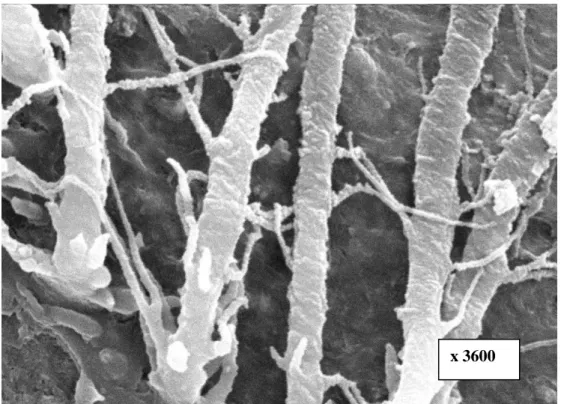
Lors de l’étude des systèmes adhésifs, le MEB permet la visualisation en surface de la couche hybride et des tags de résine après dissolution partielle des structures dentinaires [207]. Des marqueurs tels que le nitrate d’argent peuvent être utilisés concomitamment pour visualiser la perméabilité d’une interface sous MEB [205].
CHERSONI [43] utilise le MEB dans la technique des répliques pour étudier les mouvements de fluide depuis la dentine à travers les adhésifs. Elle consiste en une prise d’empreinte de la surface de dentine enduite d’adhésif polymérisé après élimination de la couche inhibée par l’oxygène, avec un polyvinyl siloxane de basse viscosité (NAHON [180] a montré que la prise d’empreinte ne modifie pas l’intégrité de l’adhésif).Une réplique en résine époxy ou en polyether pour les canaux radiculaires est obtenue à partir de l’empreinte, puis métallisée à l’or et au palladium pour être examinée au MEB. La qualité du recouvrement par l’adhésif et la transsudation de gouttelettes de fluide dentinaire sont alors observées. Le nombre de gouttelettes par μm² d’adhésif polymérisé peut être enregistré et apporter des données quantitatives. [42]
Limites :
C’est une méthode destructive : la dissolution de la dentine pour observer la couche hybride provoque une perte d’informations concernant la structure dentinaire et l’étude de la zone de transition adhésif-dentine [26, 270].
La déshydratation nécessaire et la mise sous vide peuvent provoquer des artefacts, des contractions entraînant des fractures, des délaminations.
Microscopie électronique en transmission (MET)
Description de la technique :
Cette technique de microscopie est basée sur le principe de diffraction des électrons et peut atteindre un grossissement de 5 000 000. Le principe du microscope électronique en transmission a été mis au point en 1931 par Max Knoll et Ernst Ruska, ce dernier a d'ailleurs reçu le prix Nobel de physique en 1986 pour cette invention.
Son principe peut être compris à partir de celui d’un microscope photonique classique : une gerbe d’électrons est condensée sur une partie d’échantillon (de l’ordre de quelques nanomètres au dixième de millimètre). Les électrons qui interagissent fortement avec la matière traversée sont repris par un jeu de lentilles formant une image agrandie de l’objet. La limite de résolution serait de l'ordre de grandeur du picomètre dans un cas idéal. Mais en raison des fortes aberrations, elle n'est en réalité que de quelques Ångstroms, ce qui est tout de même plus précis que le microscope électronique à balayage.
Limites :
La préparation des échantillons pour une observation au microscope électronique en transmission est une phase très importante. C'est elle qui détermine en partie la qualité des résultats obtenus. Le faisceau d'électrons devant traverser l'échantillon, son épaisseur doit être idéalement de l'ordre de quelques nanomètres (10 à 100). La préparation d’échantillons ultra-fins de tissus minéralisés au microtome est complexe. Comme pour le MEB, les échantillons doivent être fixés, déshydratés, métallisés.
Le MET permet l’observation ultra-structurale de la couche hybride (configuration du réseau collagénique et diffusion de la résine au sein de ce réseau…). Cependant, cette technique nécessite l’immersion totale de l’échantillon dentaire dans de la résine époxy qui se substitue alors à l’eau contenue dans la dentine. La pénétration de traceurs comme le nitrate d’argent est alors biaisée. [205]
Microscopie laser confocale
Description de la technique :
Mise au point en 1955 et appliquée pour la première fois en recherche odontologique par WATSON et BOYDE [277], cette technique de microscopie utilise un faisceau laser qui induit l’émission de fluorescence des marqueurs fluorescents employés (rhodamine B, fluorescéine, jaune lucifer…). Le balayage du faisceau laser se fait sur la totalité de l’échantillon. Un moteur de haute précision, dont le pas est de 25 à 40 nm, permet de déplacer la platine du microscope par rapport à l’objectif dans l’axe xz pour obtenir une succession de coupes sur des plans focaux successifs dans la profondeur de l’objet. Les fluorochromes excités par le laser réémettent des photons de longueur d’onde supérieure, qui traversent un miroir dichroïque puis un filtre d’émission ou un prisme calibrant la longueur d’onde émise. Un dispositif de diaphragme ne laisse passer que les photons provenant spécifiquement du plan focal analysé et les envoie sur un photomultiplicateur. Les images recueillies par le dispositif confocal correspondent à des plans optiques définis [260].
En odontologie, cette technique permet par exemple
- la visualisation de la sub-surface de l’interface (environ 100 microns sous la surface de l’échantillon), avec une préparation minimale de l’échantillon [112] qui peut être conservé humide [205].
- l’observation de la microstructure dentinaire [133].
- l’enregistrement de séries d’images suivi d’une reconstruction tri-dimensionnelle [205].
- la visualisation et l’individualisation de différents constituants d’un système adhésif après incorporation de marqueurs fluorescents, aidant ainsi à déterminer quel composant est responsable de la formation des tags de résine et de la couche hybride. [207].
- l’étude de microperméabilité de la couche hybride par addition de fluorochromes dans la chambre pulpaire [22, 112, 207, 277] (évaluation de la pénétration interne de marqueur vers la surface de collage et de la capacité de scellement des tubules dentinaires depuis la zone pulpaire).
Limites :
Il est impératif de connaître le comportement des marqueurs fluorescents et leurs propriétés chimiques pour interpréter les images de manière optimale : le FITC (fluorescéine isothiocyanate) est soluble dans l’eau, comme l’acriflavine, mais le premier pénètre la dentine et pas le composite alors que le second pénètre la dentine et le composite mais pas la couche hybride. La rhodamine B ne se dissout pas dans l’eau mais dans les composés organiques (promoteur, agent de silanisation). Ainsi, si le FITC pénètre la dentine, il peut se produire une filtration qui gêne la distinction des parties colorées [207].
Afin d’éviter le mélange des marqueurs fluorescents, les différents composants doivent être polymérisés séparément [207]. Ils doivent émettre à des longueurs d’onde différentes afin d’être clairement individualisés [270].
Microscopie optique ou photonique
Cette technique d’observation peut être utilisée après coloration de l’adhésif [109] ou des structures collagéniques (coloration de Masson-Goldner) [238, 239].
Microscopie à force atomique
Le microscope à force atomique explore la surface d’échantillons biologiques à l’aide d’une pointe effilée dont l’extrémité a un rayon de quelques nanomètres, portée par un ressort très souple. La précision des déplacements de cette pointe, dans les trois plans de l’espace, couplée à une utilisation dans des solutions physiologiques, permet de visualiser aussi bien des structures biologiques complexes que des molécules uniques, et cela dans leur état fonctionnel puisque aucune déshydratation n’est nécessaire. Les résolutions latérale et verticale peuvent atteindre quelques angströms [93, 159].
Ce type de microscopie a permis d’observer la microstructure et les propriétés mécaniques de la dentine [140, 141].
Microscopie par génération d’harmoniques (de 2ème
ou de 3ème
génération)
Elle permet l’observation microstructurale des tubules dentinaires, de l’organisation des fibres de collagène et leur reconstruction tridimensionnelle avec une résolution latérale de l’ordre de 1 micron et longitudinale (axe des z) de l’ordre de 3 microns.
L’échantillon n’est pas détruit et peut être observé en solution aqueuse, évitant les artefacts liés à la déshydratation. Il n’est pas nécessaire d’utiliser des marqueurs chimiques. La pénétration du laser au sein de l’échantillon élimine les artefacts liés à la préparation de surface [67].
1.2. Mesures semi-quantitatives
1.2.1 Diffusion passive de colorants
Le but d’un marqueur est de mettre en évidence un flux à l’interface entre matériau d’obturation et tissus dentaires.
Description de la technique :
Cette méthodologie, décrite pour la première fois par Grossman en 1939, utilise l’immersion d’une dent obturée pendant un temps déterminé dans un marqueur colorant qui peut être de l’éosine, du bleu de méthylène, de l’encre noire d’Inde, du Procion brillant bleu, vert ou rouge, du violet de gentiane, de la fuchsine basique, de la fluorescéine, de la rhodamine B, du violet crystal….
Le phénomène de capillarité joue un grand rôle, principalement dans l’évaluation de la percolation apicale, car l’apex dentaire est immergé dans le marqueur qui pénètre par tous les espaces entre les parois canalaires et le matériau d’obturation [32]. La dent est ensuite rincée, puis sectionnée longitudinalement ou transversalement. La pénétration linéaire du marqueur est alors observée, souvent après grossissement.
Les marqueurs doivent être stables sur le plan de la couleur, quelles que soient les conditions d’expérimentation. Ils ne doivent pas se lier aux substances dentaires ni aux matériaux d’obturation [249].
La taille moléculaire du traceur, son pH et sa réactivité chimique modifient son degré de pénétration [4, 61]. Le bleu de méthylène par exemple a un poids moléculaire inférieur à celui d’une toxine bactérienne, mais se dissout durant la déminéralisation.
Cette méthode est simple, rapide, ne requérant pas d’équipement complexe, peu coûteuse, ne dépendant pas de réaction chimique ou d’irradiation.
Limites :
L’étude de la pénétration d’un colorant peut être gênée par de l’air piégé le long de l’obturation canalaire [49, 98, 285]. C’est pourquoi il est recommandé d’utiliser cette méthode sous une pression réduite [281].
La plupart des études mesurent la percolation dans un seul plan de l’espace [257] et seulement sur certaines sections de la dent [249].
Des vides de longueur identique mais de diamètre et de volume différents conduisent à des mesures de pénétration linéaire identiques, alors qu’un diamètre plus important permet un passage bactérien et une diffusion de toxines plus larges [284].
La méthode est destructive.
L’évaluation objective est difficile. Le meilleur critère d’évaluation semble être la quantité maximale de pénétration de marqueur par dent [58].
1.2.2 Diffusion passive de traceurs chimiques
Description de la technique :
Ces marqueurs dépendent de réactions chimiques entre plusieurs produits. En général, deux composants incolores produisent un précipité opaque, souvent un sel d’argent, détecté par des techniques radiographiques. Si une seule des deux molécules pénètre l’interface, il n’y a pas de précipitation.
Exemples de marqueurs :
sulfate de baryum [146], hydroxyde de calcium [151],
et principalement les solutions de nitrate d’argent [62, 286] avec immersion dans la solution à l’abri de la lumière puis immersion dans une solution de développement photographique pour réduire les ions argent.
Les techniques de développement (temps de développement…) et l’évaluation de l’étanchéité varient beaucoup d’un auteur à l’autre.
C’est une méthode très « sévère » car l’ion argent est très petit (0,059 nm de diamètre) comparé à une bactérie (0,5 à 1 µm). Cette petite taille associée à sa forte réactivité (il se lie intimement à toute fibrille collagène exposée et non enveloppée de résine) rend le nitrate d’argent parfaitement approprié pour détecter les nanoporosités au sein de la couche hybride. (DE GOES 53 2004)
Limite :
Le pH bas (entre 3 ,4 et 4,5) de la solution de nitrate d’argent à 50% serait susceptible d’induire au cours du temps d’immersion, une déminéralisation (en particulier au niveau de la dentine partiellement déminéralisée par le mordançage), amenant à des résultats faux-positifs. [53] En revanche, le methenamine d’argent ne présente pas cet inconvénient car son pH est plus élevé (8,1 à 25°C dans l’étude de DE GOES [53]).
L’application du vernis d’isolation nécessite une déshydratation pendant environ 15 minutes, ce qui pourrait élargir l’espace entre dentine et restauration en endommageant la dentine [3]. La technique au methenamine d’argent ne nécessite pas d’application d’isolant car il y a une moindre proportion d’argent, le pH est plus élevé et cette technique permet de visualiser spécifiquement le collagène des zones dentaires hypominéralisées voir non minéralisées.
1.3. Mesures quantitatives
1.3.1 Conductance hydraulique et filtration de fluide
Description de la technique :
Mise au point par OUTHWAITE [188] en 1976, ces techniques de mesure sont utilisées pour évaluer l’étanchéité après thérapeutique par restauration adhésive ou non.
La technique repose sur la mesure du flux qui traverse un tube pendant un laps de temps donné et pour une différence de pression donnée. L’échantillon est relié de manière hermétique à un tube de diamètre défini, rempli d’eau sous pression. La pression appliquée force l’eau à travers les espaces vides. Une bulle, insérée dans l’eau d’un tube capillaire, est utilisée pour mesurer la percolation : si l’obturation est hermétique, la bulle ne bouge pas malgré la pression ; s’il y a percolation, la bulle bouge et son déplacement est mesuré [211] soit visuellement, soit avec un appareil automatisé type FLODEC (De Marco Engineering, Genève, Suisse) [54]. ORUCOGLU [186] a développé une nouvelle mesure de la filtration de fluide par ordinateur, basée sur la réfraction de la lumière selon le mouvement de la bulle d’air dans la micropipette. Le mouvement de la bulle d’air est observé par des diodes laser contrôlées par ordinateur.
Le calcul du flux d’un fluide de viscosité η (ici l’eau) à travers un tuyau cylindrique de rayon r et de longueur l est donné par l’équation suivante : Jν= π r4 ΔP / 8ηl
où ΔP représente la différence de pression entre les deux extrémités du tuyau.
La mesure de la conductance hydraulique est basée sur la loi de Poiseuille : pour un flux laminaire à travers un tuyau cylindrique de rayon r, la loi de Poiseuille exprime la valeur du coefficient de conductance hydraulique Lp en fonction du rayon r du tuyau et de sa longueur l, ainsi que de la viscosité η du fluide (ici l’eau) : Lp= r² / 8ηl
La conductance hydraulique Lp peut être calculée par la loi de Darcy (FOGEL 81 1988) :
Lp = Jν / A. ΔP
- Lp est exprimée en µl /min/ cm H²O (ou en L/s/Pa selon le système international),
- Jν représente la quantité de flux en µl /min
- A représente la surface testée de l’échantillon, - ΔP est la pression hydrostatique en cm H²O.
La loi de Poiseuille est l’analogue en hydraulique de la loi d’Ohm en électricité. Le flux d’eau est proportionnel à la différence de pression ΔP aux extrémités du tuyau comme l’intensité I dans un élément conducteur d’électricité est proportionnelle à la différence de potentiel électrique ΔU : le coefficient de proportionnalité dans le premier cas est la conductance hydraulique, dans le deuxième cas c’est l’inverse de la résistance électrique R du conducteur (I= ΔU/R).
Avantages [146, 170, 211, 285]:
Cette technique, reproductible car non destructive, permet d’évaluer le scellement coronaire et apical sur une longue période, sans destruction de l’échantillon.
L’enregistrement automatique des résultats donne des résultats quantitatifs précis de petits volumes (de l’ordre du microlitre) en évitant les erreurs liées à l’opérateur.
La sensibilité du système peut être ajustée en modifiant la pression ou le diamètre interne du tube contenant la bulle.
1.3.2 Dissolution des tissus durs ou extraction de marqueurs
Description de la technique :
Les dents sont dissoutes dans des acides (acide nitrique à 65% par exemple), qui « relarguent » le marqueur (bleu de méthylène par exemple) depuis l’interface. L’absorbance de la solution est mesurée par spectrophotométrie. [32]
C’est une méthode rapide nécessitant un matériel simple, qui prend en compte, comme la méthode de filtration de fluide, la porosité de l’interface entre le matériau d’obturation et la surface radiculaire dentaire. La mesure est quantitative. [271]
1.3.3 Méthodes électro-chimiques
Description des techniques :
Elles ont été utilisées en 1976 pour la première fois par JACOBSON et VON FRAUNHOFER [131] pour mesurer l’étanchéité d’un traitement endodontique.
Elles nécessitent deux électrodes reliées à un générateur : l’une, l’anode, en acier ou en cuivre est insérée au contact de la partie coronaire de la restauration radiculaire et baigne dans
un bain séparé d’électrolytes ; l’autre, la cathode, en acier inoxydable (platine…) est plongée dans le bain d’électrolytes (NaCl, KCl par exemple), dans lequel est immergée l’apex de la racine à tester. Les deux électrodes sont connectées via un potentiostat à un ordinateur analysant les fréquences. Un potentiel électrique est appliqué entre les deux électrodes. Le courant passant à travers la racine est mesuré pour calculer l’impédance. Courant et impédance permettent de déterminer la résistance spécifique à chaque échantillon [211, 249]. Plus les valeurs d’impédance sont élevées, moins il y a de passage de fluide entre les parties apicales et coronaires d’une racine obturée [136]. En courant continu, la loi d’Ohm définit la résistance comme R=U/I. En déterminant I, l’intensité du courant et U, la différence de potentiel électrique, on calcule R, la résistance du système. S’il y a perte d’étanchéité, et donc passage d’ions entre l’obturation et les parois canalaires, un courant électrique est détectable.
Cette technique permet une évaluation tridimensionnelle de la pénétration des électrolytes et donc de l’étanchéité. Elle n’est pas destructive [129].
Figure 2 : Echantillon dans la cellule électro-chimique pour évaluer la perméabilité d’une obturation canalaire, d’après POMMEL [211]
Limite :
Cette technique n’est pas utilisable pour des restaurations métalliques. [129] Bain d’électrolytes Cat h o d e anode Racine obturée
1.4 Conclusion
Aucune méthode n’est reconnue universellement et aucune méthode ne reproduit parfaitement le mécanisme complexe qui conduit à une infection apicale dans le cadre d’une obturation radiculaire.
Ces techniques diffèrent entre elles selon plusieurs critères : - la reproductibilité des mesures
- la destruction ou non de l’échantillon
- l’enregistrement des résultats qui peut être opérateur dépendant - la possibilité de localiser le défaut
- la simplicité du protocole
- la modélisation des paramètres physiologiques - l’évaluation cinétique de l’étanchéité
- le coût
C’est pourquoi il est nécessaire d’avoir recours à plusieurs techniques pour évaluer la perméabilité d’un matériau d’obturation dentaire.
2. La dentine et ses spécificités radiculaires
Connaître les propriétés du substrat dentinaire est essentiel pour une meilleure appréhension des principes et des effets des différents procédés de collage.
La dentine a une structure composite complexe associant phases minérale, organique et aqueuse. Sa composition et sa structure évoluent avec l’âge et les pathologies. Ces variations influent sur les propriétés dentinaires telles que la perméabilité, la surface d’adhésion, l’humidité et affectent donc la force de collage, la dureté et la résistance au cisaillement [160].
2.1. Composition de la dentine
A la différence de l’émail, tissu dépourvu de cellules et essentiellement minéral, la dentine est un substrat hétérogène hydraté.
En poids, la dentine est composée d’environ - 70% d’hydroxy-apatite (phase minérale), - 20% de phase organique
- 10% d’eau. [276]
En volume [160], la dentine est constituée d’environ :
o 50% de phase minérale sous la forme de cristaux de phosphates de calcium (hydroxyapatite principalement, mais aussi octocalcium phosphate, whitlockite, brushite, monétite), de carbonates et de sulfates de calcium.
o 30% de phase organique dont : 90% de collagène de type I :
Le collagène est une protéine fibreuse dont la principale caractéristique est la structure rigide hélicoïdale à trois brins : trois chaînes polypeptidiques de collagène, appelées chaînes α, sont enroulées les unes autour des autres en une hélice régulière pour former une molécule de
collagène d’environ 300 nm de longueur et 1,5 nm de diamètre. Après leur sécrétion dans l’espace extracellulaire, les molécules de collagène de type 1 s’assemblent en polymères ordonnés pour former des fibrilles de collagène, qui sont des structures longues de plusieurs microns et minces de 10 à 300 nm. Ces fibrilles sont groupées en faisceaux plus importants : les fibres de collagène, de plusieurs microns de diamètre. L’assemblage des fibrilles de collagène est rendu plus résistant par la formation de liaisons transversales covalentes à l’intérieur et entre les molécules de collagène. Les chaînes α du collagène sont extrêmement riches en glycine et en proline, qui sont deux acides aminés essentiels pour la formation d’une triple hélice hélicoïdale. Le collagène de type 1 est pauvre en hydroxylysine et en glucides ; les fibrilles sont larges [8].
10% de citrates, lactates, phosphoprotéines, protéoglycannes, glycoprotéines, glycosaminoglycannes (chondroïtine-4-sulfate, chondroïtine-6-sulfate, acide hyaluronique, dermatane-sulfates, kératane-sulfates), protéines plasmatiques, phospholipides, glycérol, cholestérol et acides gras.
o 20% de fluides dentinaires, issus de la pulpe et similaires au plasma.
Différents types de dentine sont décrits :
o La dentine primaire est élaborée durant la formation de la dent. Une couche d’odontoblastes sécréteurs, cellules allongées, polarisées, sécrète du collagène à partir de la jonction amélo-cémentaire. Le corps de ces cellules s’éloigne de cette jonction, se rétracte apicalement en direction de la pulpe, au fur et à mesure de la sécrétion puis de la minéralisation du collagène dentinaire, créant un canal, le tubule dentinaire.
o La prédentine [13, 135] se compose de matière organique non minéralisée, située entre les cellules sécrétrices et la dentine minéralisée. D’épaisseur constante, elle est constituée de nombreuses fibres de collagène, perpendiculaires à l’axe des tubules, et d’une substance fondamentale riche en glycosaminoglycannes et glycoprotéines.
o La dentine secondaire apparaît après formation complète de la racine et provoque un rétrécissement progressif de la chambre pulpaire. Elle se caractérise par une structure tubulaire régulière similaire à la dentine primaire. La déposition de cette dentine secondaire n’est pas uniforme : au niveau des dents antérieures maxillaires, elle se produit d’abord sur les murs palatins de la chambre pulpaire avant les autres zones ; au niveau des molaires, la déposition est plus importante sur le plancher pulpaire [250].
o La dentine tertiaire, encore appelée dentine réactionnelle, réparatrice ou irrégulière, se dépose dans des zones localisées de la chambre pulpaire en réponse à des agressions comme des caries ou des abrasions. Elle correspond à une réponse de protection de la pulpe et présente une structure moins régulière avec des tubules moins nombreux et moins alignés [250].
o La dentine sclérotique correspond à l’occlusion des tubules de la dentine cervicale par dépôt minéral (cristaux d’hydroxy apatite et cristaux de whitlockite) en réponse à une agression chronique de type érosion. VAN MEERBEEK [269] suggère que la déminéralisation de cette dentine sclérotique est plus difficile tant au niveau intra- que inter- tubulaire, avec la création d’une couche hybride plus fine et peu ou pas de tags.
D’un point de vue mécanique, la dentine radiculaire apicale présente une meilleure résistance à la traction que la dentine radiculaire coronaire. Par conséquent, il paraît préférable cliniquement que le tenon s’ancre au-delà de la moitié coronaire de la racine. Ainsi, les stress fonctionnels et para-fonctionnels sont transmis à une partie de la racine plus résistante, diminuant le risque de fracture radiculaire [157].
2.2. Boue dentinaire
Toute instrumentation dentinaire provoque la formation d’une boue dentinaire, qui recouvre la surface dentinaire et pénètre dans les tubules sur plusieurs microns. Décrite dès le 17ème siècle par VAN LEEUWENHOEK [187], elle se compose d’un mélange de débris organiques et minéraux, et de bactéries ; elle est très faiblement adhérente à la dentine sous-jacente (de l’ordre de 5 MPa) [191]. PASHLEY [191] suggère que sa composition varie en fonction de la profondeur dentinaire et donc de la structure dentinaire dont elle est issue.
Le traitement de la boue dentinaire varie selon le type d’adhésif utilisé : soit elle est totalement éliminée par un mordançage à l’acide phosphorique, soit elle est modifiée par un adhésif auto-mordançant.
2.3. Aspect tubulaire de la dentine
La dentine est parcourue de tubules contenant les prolongements cytoplasmiques des odontoblastes sur environ un tiers de leur longueur. Ces tubules parcourent toute l’épaisseur de la dentine et de la prédentine, depuis la pulpe jusqu’à la jonction avec l’émail ou le cément. Ils convergent vers la chambre pulpaire, d’où une variation de leur densité et de leur orientation en fonction des régions dentaires.
2.3.1 Dentine intra- et intertubulaire
Dentine intratubulaire ou péritubulaire
La lumière tubulaire est bordée par de la dentine hyperminéralisée dite péritubulaire ou intratubulaire, contenant principalement des cristaux d’apatite avec une matrice organique réduite (10% en volume contre 30% dans la dentine intertubulaire) [216]. GOTLIV [103] et WEINER [278] ne retrouvent aucune trace de collagène au sein de la dentine péritubulaire.
Dans la dentine radiculaire, l’anneau de dentine intratubulaire est d’une largeur généralement faible et peut même être absent à certains endroits [103, 242].
GOTLIV [103] observe de la dentine bovine par spectrométrie de masse d'ions secondaires à temps de vol (TOF-SIMS) :
les régions dans lesquelles la dentine péritubulaire est présente sont plus riches en ions calcium, magnésium, potassium et sodium.
l’anneau riche en ion calcium (dentine péritubulaire) présent dans la dentine coronaire est absent au niveau de la dentine radiculaire apicale, pour laquelle les ions détectés sont distribués de façon homogène. Dans les autres régions radiculaires proches de la jonction amélo-cémentaire, des anneaux étroits de dentine péritubulaire sont présents ; les ions et acides aminés observés montrent la même distribution qu’au niveau coronaire.
La distribution ionique est homogène sur des dents antérieures ou postérieures, qui ont fait ou non leur éruption : la dentine péritubulaire se forme donc à un stade de développement précoce et n’est pas spécifique de la dent mâture.
Dentine intertubulaire
Les tubules sont séparés par la dentine intertubulaire composée d’une matrice de collagène type I renforcée d’apatite, enveloppant les tubules perpendiculairement à leur grand axe [143]. Dans les régions proches de la jonction amélo-dentinaire, ELBAUM [67] observe des fibrilles de collagène orientées parallèlement au grand axe des tubules.
Les différences de composition minérale entre dentines intra- et inter-tubulaires influent sur les propriétés mécaniques de la dentine. Selon l’étude de MARSHALL [160], la dureté de la dentine intratubulaire n’est pas dépendante de la région dentinaire et présente un module de Young uniforme. Les variations de microdureté de la dentine en fonction des zones dentaires pourraient donc être attribuées à des modifications de la dentine intertubulaire et non pas à une augmentation locale du nombre de tubules dentinaires.
Les adhésifs dentinaires adhèrent mieux aux surfaces fortement minéralisées, ce qui fait de la dentine intratubulaire un meilleur substrat que la dentine intertubulaire.
La dentine d’une dent vivante est hydratée : les tubules contiennent les prolongements odontoblastiques baignant dans un liquide extra-cellulaire, le fluide dentinaire. La pression pulpaire hydrostatique positive estimée à environ 15 cm H2O [273] entraîne un flux de fluide
dentinaire qui rend la dentine humide en surface une fois l’émail éliminé.
Les variations de densité et de diamètre tubulaire expliquent les modifications du degré de perméabilité en fonction des régions dentinaires. D’autres facteurs testés in vitro contribuent à faire varier la perméabilité dentinaire : l’irrégularité tubulaire liée à des dépôts intratubulaires minéraux ou organiques (collagène) [48], les conditions de conservation [100]. De nombreuses études cherchent à mettre en évidence le rôle des prolongements odontoblastiques dans l’évaluation de la perméabilité dentinaire.
2.3.2 Densité tubulaire
Une large variabilité de densité tubulaire est observée entre les différentes dents d’un même individu, au sein d’une même dent et selon les individus [75]. Les dents âgées présentent des tubules dentinaires plus ou moins sclérosés par la croissance de la dentine intratubulaire. L’âge des patients joue donc un rôle direct dans les propriétés mécaniques de la dentine radiculaire. Les dents antérieures présentent une densité tubulaire plus élevée que les
Dans la littérature, de nombreuses études ont évalué la densité tubulaire, mais la localisation de la région dentaire étudiée n’est pas toujours spécifiée. (Tableau 2)
Références Densité tubulaire
(103/mm²) Localisation dentaire Tronstad (1973) [259] 7-60 - Garberoglio (1976) [90] 19-45 - Mjör (1979) [173] 15-65 occlusal Pashley (1989) [192] 20-43
Pashley (1991) [190] 15-20 jonction amélo-dentinaire 45-60 Proche de la pulpe
Söderholm (1991) [235] 10-30 -
Schellenberg (1992) [230] 13-96 Murs pulpaires
Fosse (1992) [84] 18-52
Heymann (1993) [124] 30 A 2 mm de la pulpe
Olsson (1993) [185] 24,5-51,1
Ferrari (2000) [75] 36 1/3 coronaire canalaire radiculaire 28 1/3 moyen canalaire radiculaire 22 1/3 apical canalaire radiculaire Harran Ponce (2001) [118] 15 Jonction amélo-dentinaire
44 Parois de la chambre pulpaire
21 1/3 cervical, jonction cémento-dentinaire 38 1/3 cervical, parois canalaires radiculaires 15 1/3 moyen, jonction cémento-dentinaire 20 1/3 moyen, parois canalaires radiculaires 13 1/3 apical, jonction cémento-dentinaire 19 1/3 apical, parois canalaires radiculaires Mannocci (2004) [157] 30 1/3 coronaire de la racine
17 1/3 moyen de la racine
Tableau 2 : Variations de la densité tubulaire dentinaire selon les études
Au niveau de la dentine radiculaire, la densité tubulaire au niveau du tiers cervical est significativement supérieure (p<0,01) à celle des tiers moyen et apical [75, 81].
Au niveau de la dentine coronaire, la densité tubulaire en regard de la pulpe est significativement supérieure à celle de la dentine radiculaire, quels que soient les sites évalués [75].
La densité des tubules dentinaires dans la dentine radiculaire varie de 4900 à 57000 /mm², diminuant progressivement depuis la couronne en direction apicale [157]. Des différences significatives du nombre de tubules apparaissent également entre la dentine périphérique et interne [81, 157].
MJÖR [174] (figure 3) étudie l’ultrastructure dentinaire au microscope à force atomique et confirme que :
Les différences de densité tubulaire de l’extérieur vers l’intérieur sont plus marquées dans la partie coronaire que radiculaire.
Dans la racine, le nombre moyen de tubules dans la partie moyenne (zone F sur le schéma) est significativement différent du nombre observé au niveau périphérique (zone C) et à 50 µm de la prédentine (zone H).
Des comparaisons statistiques montre des différences significatives entre les nombres moyens de tubules lorsque l’on compare la partie moyenne de la dentine dans les zones coronaires et dans la zone radiculaire.
La densité tubulaire au niveau pulpaire est moindre au niveau radiculaire, en particulier à l’apex.
Aucune différence de densité tubulaire n’est notée entre des dents jeunes et âgées, hormis au niveau de l’apex de dents qui viennent de faire leur éruption.
La densité moyenne varie de 9 à 24 par 100 µm, ce qui équivaut à 8100 à 57600 tubules par mm². Au niveau radiculaire, cette densité varie de 20 à 14 /100 µm soit 40000 à 19600 / mm² en direction apicale au niveau pulpaire.
Alors que le nombre de tubules dentinaires est directement lié au nombre d’odontoblastes, la courbure du tubule, ses dimensions et l’épaisseur de l’anneau de dentine intra-tubulaire varient d’une région dentaire à une autre.
2.3.3 Orientation des tubules dentinaires
MJÖR [174] décrit des tubules dentinaires avec un trajet rectiligne au niveau radiculaire alors qu’ils présentent une courbure sigmoïde au niveau coronaire. Ce trajet sinueux correspond aux mouvements de la cellule odontoblastique [192].
L’orientation des tubules est légèrement apicale à l’extrémité radiculaire ; elle devient progressivement plus horizontale vers la couronne et est approximativement verticale sous les pointes cuspidiennes [201].
Lors de la déminéralisation par un gel d’acide, trois zones apparaissent [160]: .1. zone de collagène complètement déminéralisée
.2. zone de dentine partiellement déminéralisée .3. zone non déminéralisée
Figure 3 : densité tubulaire et distribution des branches fines, d’après MJÖR et NORDAHL [174]:
moitié gauche : densité tubulaire (nombre de tubules pour 100 µm) ; les lignes pointillées indiquent la zone de mesure sur trois niveaux : interne (à 50 µm de la prédentine) ; moyenne et externe (à 250 µm de la jonction avec l’émail ou le cément)
moitié droite : distribution des « branches fines » zone A : sous le sillon occlusal
zone B : partie principale de la dentine
coronaire et pulpaire au niveau radiculaire : peu
de branches fines, mais présence de nombreuses microbranches
zone C : 250 µm externe au niveau coronaire et radiculaire : présence des trois types de
branches tubulaires
zone D : tubules dentinaires correspondant à la jonction amélo-cémentaire
zone E : zone de transition de part et d’autre de D
zone F : partie principale de la dentine
radiculaire : abondance de fines branches et de
microbranches, présence occasionnelle de branches principales
zone G : cément zone H : prédentine
L’extension de la déminéralisation varie en fonction de l’orientation des tubules : lorsque la déminéralisation se produit perpendiculairement aux tubules, la zone partiellement déminéralisée est moins épaisse que lors d’une déminéralisation selon l’axe des tubules. L’orientation des tubules influe aussi sur la résistance au cisaillement [275].
2.3.4 Diamètre tubulaire
Le diamètre tubulaire diminue en direction apicale [75]. Au niveau coronaire, les tubules dentinaires sont plus larges près de la pulpe (3-4 m) qu’à la jonction émail dentine (0,5 à 1
m) [90].
MJÖR [174] (figure 3) distingue trois types de branches au niveau des tubules dentinaires, en fonction de leur diamètre, de leur localisation et de leur direction :
Branches principales : les plus larges, elles font entre 0,5 et 1 µm de diamètre. Elles sont nombreuses dans la dentine proche des jonctions amélo-dentinaire et cémento-dentinaire. On les distingue plus facilement dans la couronne que la racine. Elles présentent une forme en Y et sont souvent considérées comme des branches terminales. Au niveau radiculaire, les tubules diminuent en diamètre et semblent disparaître lorsqu’ils passent la jonction cémento-dentinaire.
Branches fines : ce sont de minces branches s’étendant depuis les parois tubulaires selon un angle d’environ 45°, à un intervalle de 3 à 5 m. Elles pénètrent dans la dentine intertubulaire et s’anastomosent souvent avec d’autres branches fines provenant d’autres tubules, en particulier dans la zone centrale de la dentine radiculaire. Elles ont un diamètre de 300 à 700 nm et sont retrouvées en abondance dans la dentine radiculaire et dans les régions dentinaires de faible densité tubulaire.
Microbranches : de petits pores présents dans la dentine intertubulaire dans toutes les zones dentinaires, avec un diamètre de 25 à 200 nm (100 à 150 nm en majorité) proviennent de microbranches s’étendant perpendiculairement aux tubules dentinaires à travers la dentine intratubulaire vers la matrice intertubulaire. Ils semblent s’anastomoser avec d’autres microbranches.
La dentine intertubulaire est donc entrecroisée de structures tubulaires de dimension variable. Ces différentes structures en forme de branches sont à rapporter aux extensions cytoplasmiques présentes lors de la formation de la dentine.
3. Les systèmes adhésifs dentinaires
Depuis 1955 [29], les systèmes adhésifs ont connu une évolution remarquable en termes d’efficacité et de simplification d’utilisation [178].
1955 1ère génération promoteur avec faible force d’adhésion
2ème génération agent adhérant à la dentine et l’émail avec une meilleure adhésion à l’émail mordancé
3ème génération mordançage dentinaire, suppression partielle et modification de la boue dentinaire
4ème génération technique du mordançage total et formation d’une couche hybride et de tags de résine
5ème génération simplification de la procédure clinique : systèmes monocomposants et promoteurs
auto-mordançants
2001 6ème génération systèmes adhésifs en un temps avec collage correct sur l’émail comme la dentine
Les performances des techniques adhésives au niveau des canaux radiculaires constituent un véritable défi en rapport avec :
les capacités variables des systèmes de collage pour déminéraliser et infiltrer les parois dentinaires,
la difficulté clinique de contrôle de l’humidité,
l’influence de la densité et de l’orientation des tubules dentinaires le long du canal radiculaire,
3.1 Les systèmes avec mordançage total
3.1.1 Principe
Après préparation mécanique, les parois dentinaires sont mordancées par un gel d’acide phosphorique puis rincées.
Ce mordançage
1. débarrasse les parois dentinaires de la boue dentinaire,
2. ouvre les tubules dentinaires en forme de cônes renversés en déminéralisant partiellement la dentine intra- puis intertubulaire.
3. augmente la surface de collage en accroissant le diamètre des tubules dentinaires de 202% ( 10) au niveau du tiers coronaire, 156% ( 27) au tiers moyen et 113% ( 19) au tiers apical d’une préparation pour logement radiculaire d’un tenon selon FERRARI [75].
4. expose un fin réseau microporeux de fibres de collagène. [69, 181]
Un promoteur (primer), généralement à base de monomères hydrophiles (comme l’HEMA : 2-hydroxyethylmethacrylate) et de solvants aqueux ou organiques (éthanol, acétone) [117], améliore la capacité des résines hydrophobes à pénétrer les microporosités de la dentine conditionnée en remplaçant l’eau du réseau de collagène. L’infiltration de ce réseau par la résine adhésive permet ensuite une rétention micromécanique par la formation d’une couche hybride, de tags et de branches latérales de résine [116].
Dans les systèmes adhésifs récents, le promoteur et la résine sont combinés dans un même flacon : ce sont les systèmes monocomposants utilisés après mordançage total.
La présence d’eau dans l’adhésif réhydrate la surface dentinaire : elle maintient le caractère spongieux du substrat dentinaire en évitant le collapsus des fibres de collagène qui empêche la diffusion des monomères. L’eau a un bon pouvoir de pénétration et permet l’action des monomères acides. Cependant, elle s’évapore lentement, donc s’élimine plus difficilement. Et l’eau non éliminée peut gêner la pénétration et la polymérisation de la résine.
Les solvants organiques déplacent l’eau en excès et transportent simultanément les monomères dans les tubules ouverts et les espaces du réseau de fibres de collagène. Ils sont volatiles et peuvent être éliminés par un jet d’air, laissant juste les monomères [109].
3.1.2 Mécanisme d’adhésion
L’adhésion dentinaire est principalement de nature micromécanique, basée sur l’infiltration de la dentine mordancée et la formation d’une couche hybride (zone d’interdiffusion résine-dentine) et de tags de résine avec des branches latérales [181].
Les adhésifs dentinaires avec mordançage total nécessitent une étape de mordançage par un gel d’acide phosphorique, suivie d’un rinçage soigneux. Le séchage qui s’ensuit doit préserver un certain degré d’humidité pour éviter le collapsus des fibres de collagène [137] qui nuirait à la création de la couche d’interdiffusion dentine-résine.
Dans un deuxième temps, l’application d’un promoteur (monomères en solution dans un solvant aqueux ou organique (acétone ou éthanol) remplace l’eau du réseau de collagène afin de le transformer en un réseau hydrophobe. Enfin, la résine adhésive est appliquée.
A ces systèmes en trois temps se sont substitués des systèmes monocomposants pour lesquels promoteur et adhésif sont contenus dans un même flacon. Le mélange de monomères amphiphiliques (à base de méthacrylate ou d’acide itaconique) avec des groupes fonctionnels hydrophobes et hydrophiles [109] est directement appliqué sur le substrat mordancé en une ou plusieurs couches, en « massant » pour pénétrer la dentine. Les radicaux hydrophiles ont une affinité pour la surface dentinaire de collage et les radicaux hydrophobes ont une affinité pour le matériau de restauration. Après polymérisation, l’adhésif est entrecroisé micromécaniquement dans les mailles des fibres de collagène, mises à nu par le mordançage, et les cristaux d’hydroxyapatite. [26]
3.1.2.1 Couche hybride
C’est un enchevêtrement de monomères d’adhésif avec des fibrilles de collagène et quelques cristaux résiduels d’hydroxyapatite [181].
![Figure 1 : les différents types de microperméabilité du fluide pulpaire au niveau d’une interface dentinaire adhésive [112]](https://thumb-eu.123doks.com/thumbv2/123doknet/2232453.16120/15.892.128.783.216.773/figure-micropermeabilite-fluide-pulpaire-niveau-interface-dentinaire-adhesive.webp)
![Figure 2 : Echantillon dans la cellule électro-chimique pour évaluer la perméabilité d’une obturation canalaire, d’après POMMEL [211]](https://thumb-eu.123doks.com/thumbv2/123doknet/2232453.16120/27.892.262.641.561.801/figure-echantillon-electro-chimique-evaluer-permeabilite-obturation-canalaire.webp)
![Figure 4 : Structure générale d’un monomère d’adhésif auto-mordançant [178] Groupement polymérisable Groupement adhésif Groupement d’espacement](https://thumb-eu.123doks.com/thumbv2/123doknet/2232453.16120/45.892.104.788.911.1087/structure-generale-mordancant-groupement-polymerisable-groupement-groupement-espacement.webp)