Évaluation fonctionnelle de nouvelles molécules afin de stimuler la production de microparticules et d’augmenter l'épaisseur des tissus reconstruits par génie tissulaire
Mémoire
Akram Ayoub
Maîtrise en Biologie Cellulaire et Moléculaire Maître ès sciences (M.Sc.)
Québec, Canada
III
Résumé:
La production de tissus par génie tissulaire est un domaine dont la finalité clinique est en pleine expansion. De nombreux facteurs restent cependant à améliorer afin de permettre leur utilisation extensive. Nos objectifs étaient d’évaluer la capacité d’extraits d’algue et des molécules isolées de sérum à optimiser différentes étapes de la production des tissus par génie tissulaire. Nos hypothèses étaient que l'ajout des extraits d’algue diminue le temps de fabrication des peaux reconstruites en stimulant la production et le dépôt de matrice alors que les protéines isolées du sérum stimulent la production de microparticules (MP) par les cellules du derme, ces MP ayant été démontrées avoir une action sur la croissance des cellules endothéliales et donc sur la vascularisation des greffons.
V
Summary:
Skin production by tissue engineering method is a field whose clinical purpose is expanding. However, many factors need to be improved to enable their extensive use. Our objectives were to evaluate the ability of seaweed extracts and serum molecules to optimize different stages of tissue-engineered skin production. Our hypotheses were that adding seaweed extracts reduces the manufacturing time of reconstructed skin by stimulating the production and the deposition of the extracellular matrix while serum- isolated proteins stimulate the production of microparticles (MP) by the dermal cells, the MP stimulating growth of endothelial cells and thus, potentially, vascularization of the grafts.
VII
Table des matières:
Résumé:... III Summary: ... V Liste des figures et tableaux:... IX Liste des abréviations: ... XI Remerciements: ... XIX
Chapitre 1: introduction: ... 1
1.1 La peau: ... 1
1.1.1 Le rôle de la peau: ... 1
1.1.2 Les couches de la peau des mammifères: ... 2
1.2 La cicatrisation d'une plaie: ... 8
1.2.1 Les phases de la cicatrisation : ... 8
1.2.2 Les myofibroblastes-description : ... 16
1.2.3 Les myofibroblastes dans la cicatrisation des plaies: ... 17
1.2.4 Définition des microvésicules ... 19
1.3 Le génie tissulaire et la technique d'autoassemblage: ... 24
1.3.1 Qu’est-ce que c'est le génie tissulaire ? ... 24
1.3.2 L’isolement cellulaire: ... 25
1.3.3 La matrice extracellulaire et son rôle important en génie tissulaire: ... 25
1.3.4 Les échafaudages : ... 28
1.4 Dépôt du collagène par les fibroblastes ... 32
1.4.1 La stimulation de la production de collagène par les Fb humains : ... 32
1.4.2 Le dépôt de collagène : ... 32
1.5 Le laminarane : ... 34
1.5.1 Définition ... 34
1.5.2 Les actions des composants du Saccharina longicruris : ... 35
1.5.3 Effet des extraits de l’algue S. longicruris sur les fibroblastes: ... 36
Objectifs et hypothèses ... 37
Chapitre 2 : Matériel et méthodes: ... 38
2.1 La culture cellulaire:... 38
VIII
2.1.2 Les myofibroblastes: ... 38
2.2 Laminarane et traitement des cellules: ... 39
2.3 Production de derme par la méthode d’autoassemblage: ... 40
2.4 Histologie: ... 41
2.5 Traitement des cellules cultivées en monocouche : ... 41
2.6 Traitement du derme reconstruit par autoassemblage: ... 41
2.7 Western blot: ... 42
2.8 Dosage des métalloprotéinases (MMPs):... 42
2.9 Les techniques de séparation des protéines présentes dans le sérum: ... 43
2.9.1 Chromatographie sur un échangeur fort d'anions ... 43
2.9.2 Chromatographie proteominer®: ... 44
2.9.3 Précipitation protéique avec différentes concentrations de (NH4)2SO4 ... 45
2.9.4 Série successive de purification par chromatographie sur un échangeur fort d’anions suivie d’une précipitation des protéines avec différentes concentrations de sulfate d’ammonium : ... 45
2.10 Quantification des MP par marquage à l'iodure de propidium: ... 46
2.11 Évaluation qualitative des extraits sérique par gel d’électrophorèse: ... 48
2.12 Dosage des protéique par la méthode de micro BCA : ... 48
2.13 Les analyses statistiques ... 48
Chapitre 3: Résultat: ... 49
3.1 : Détermination des protéines sériques stimulant la production de MP: ... 49
La chromatographie proteominer® : ... 49
La chromatographie sur un échangeur fort d'anion : ... 50
La précipitation protéique avec différentes concentrations de (NH4)2SO4 : ... 52
Purification successive: ... 53
3.2 : Détermination de l’effet du laminarane sur le dépôt de MEC ... 56
Quantification du collagène type 1 déposé: ... 56
Evaluation de l’épaisseur des dermes obtenus ... 58
Dosage de l'activité biologique des métalloprotéinases: ... 60
Chapitre 4: Discussion et conclusion: ... 61
IX
Liste des figures et tableaux:
Figure 1 : Représentation schématique de la peau humaine et de ses principaux composants. ... 2
Figure 2: Caractéristiques des couches de l'épiderme. ... 4
Figure 3: la structure du derme. ... 5
Figure 4: phénotype des fibroblastes. ... 6
Figure 5: La structure de l'hypoderme ... 7
Figure 6 : schéma présentant les différentes phases de la cicatrisation et les intervenants cellulaires et matriciels. [21] ... 9
Figure 7 : Schéma général des composant présents au cours des premier jours de la cicatrisation . 10 Figure 8: la phase inflammatoire. ... 11
Figure 9 : la phase Proliférative 1. ... 13
Figure 10: la phase Proliférative 2. ... 14
Figure 11: la phase de maturation et remodelage. ... 15
Figure 12: Myofibroblastes isolés du foie. ... 16
Figure 13: Schéma montrant les mécanismes de différenciation des cellules en myofibroblastes. Les cellules à l’origines des myofibroblastes sont très variées en fonction des tissus.[26] ... 18
Figure 14: Définition des MV ( MVB: multivesicular bodies)[34] ... 19
Figure 15: tableau de comparaison entre les MP et les exosomes, ... 20
Figure 16: Schéma de la synthèse du collagène ... 27
Figure 17: la technique d’autoassemblage développée au LOEX. ... 31
Figure 18: Saccharina longicruris ... 34
Figure 19: extrait de LM utilisé lors de la culture des Fb... 39
Figure 20: Méthode de fabrication des feuillets dermiques par double ensemencement des Fb ... 40
Figure 21: Tableau qui montre le nom des extraits obtenus par chromatographie sur un échangeur fort d’anions. ... 43
Figure 22: Les extraits obtenus par la technique de proteominer®. ... 44
Figure 23: Extraits obtenus par précipitation avec différentes concentrations de sulfate d’ammonium. ... 45
Figure 24: Purification successive par la méthode de chromatographie sur un échangeur fort d’anions et la précipitation par le sulfate d’ammonium. ... 46
Figure 25: Exemple de résultats obtenus par la méthode de quantification des MP par cytométrie en flux (FACS) ... 47
Figure 26:Résultat de la chromatographie proteominer® ... 49
Figure 27: chromatographie sur un échangeur fort d'anion ... 50
Figure 28: DO des extraits protéiques. ... 51
Figure29: gel sur SDS-Page coloré au bleu de Coomassie des extraits obtenus par chromatographie sur un échangeur fort d'anions. ... 51
Figure 30 : Induction de la production de MP sous l’action des extraits obtenus par précipitation au sulfate d’ammonium ... 52
Figure 31: Induction de la production de MP sous l’action des extraits obtenus par purification successive ... 53
X
Figure 32: Dosage protéique des échantillons de sérum selon les différentes étapes de la
purification. ... 54 Figure 33: Gel d’électrophorèse SDS-Page ... 55 Figure 34: Evaluation par WB du dépôt de collagène I suite aux différents traitements de Fb
dermiques (Fb14). ... 56 Figure 35: Evaluation par WB du dépôt de collagène I suite aux différents traitements de Fb
dermiques.Évaluation par WB de la quantité de collagène I déposé suite à la stimulation de Fb (Fb14, Fb12 et Fb18) cultivés pendant 35 jours en présence de différentes concentrations de LM. Un test statistique ANOVA a été réalisé avec un réplicat de 3. ... 57 Figure 36:Analyse histologique des dermes reconstruites... 59 Figure 37: Activité MMP dans les surnageants de culture. ... 60
XI
Liste des abréviations:
(NH4)2SO4 : ammonium sulfate.
3D : trois dimensions.
ABA
: acide abscissique phytohormones
ARNm: acide ribonucléique messager. bFGF: basic fibroblast growth factor.
BSA : Bovine serum albumin (albumine sérique bovine). CAPS : acide 3-(Cyclohexylamino)-1-propanesulfonique CE: cellules endothéliales.
CTGF: Connective Tissue Growth Factor. CXCL12: stroma cell derived factor-12. DME: Dulbecco's Modification of Eagle's. DO : densité optique.
DP : degré de polymérisation. EGF: epidermal growth factor. Fb: fibroblastes.
FGF: Fibroblast Growth Factor. GAG : glycosaminoglycanes.
HEPES : acide 4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique. HS : Héparane sulfate.
XII
IGF: Insulin-like Growth Factor. IgG : Immunoglobuline G. KD : kilo dalton.
KGF: Keratinocyte Growth Factor. LM: laminarane.
LOEX : Laboratoire d'Organogénèse Expérimentale. MEC: matrice extracellulaire.
MeOH : Méthanol.
MET: transition épithéliale-mésenchymateuses. miARN: micro acide ribonucléique
mM : millimolar. MMP: Matrix MetalloProteinase. MP : Microparticules. MV: microvésicules. MVB: multivesicular bodies nm: nanomètre.
PBS : tampon phosphate salin. PCL : polycaprolactone.
PDGF: platelet-derived growth factor. PG : protéoglycanes.
XIII PI : iodure de propidium.
PLA : acide polylactique.
PMP: Microparticules des plaquettes. PVA : Polyvinyle AcétateAcetate.
SDS-PAGE: Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis. SVF : sérum de veau fœtal.
TE: Tampon d‘échantillon.
TEMED: Tétraméthyléthylènediamine. TGF: transforming growth factor. U/ml : unité par millilitre.
VEGF: Vascular endothelial growth factor Vitamine C : acide ascorbique.
WB : western blot. Wmyo: Myofibroblastes.
XV Je ne me suis jamais senti seul…. Ton esprit été toujours avec moi. Mon père.
Je te promets que tu seras toujours fier de moi... Ton amour a fait de moi un homme. Ma mère.
XVII "C’est dans un laboratoire, dans la salle d’opération d’un hôpital, à la caserne, dans une chaire d’université, à l’usine, à l’atelier, dans le foyer familial et au sein de l’immense panorama du travail, c’est là que Dieu nous attend chaque jour."
XIX
Remerciements:
En premier, je tiens à remercier ma directrice de recherche, Dre Véronique Moulin, qui m’a donné la chance d'être là où je suis... Véronique, j'ai toujours dis que tu as acheté un billet de loterie quand tu m'as accepté dans ton laboratoire après un appel via Skype... j'espère que c’était une loterie gagnante pour toi autant que pour moi. Tout au long de ces deux belles années, tu m'as apporté aide et courage : cela m'a permis de progresser.
J’ai beaucoup apprécié que tu ais pris le temps pour me guider et de me faire comprendre la recherche comme il faut, et le plus important, tu m'a appris à aimer ce que je fais... À chaque fois que je te vois derrière ton bureau, j'oublie la fatigue et je reçois une flamme d’énergie incroyable. Ton énergie toujours positive et ton âme optimisme m'a appris que, malgré tout, il y a toujours de bonnes choses qui vont nous arriver.
Dre Moulin, vous m’avez incité à travailler plus dur que jamais et pour cela, je vous remercie encore du fond du cœur. Vous avez été géniale ! Encore une fois merci, je vous souhaite bonnes chances.
Sébastien Larochelle... Pour tes idées, tes expériences et surtout ton exigence qui m’ont aidé vraiment à repousser mes limites. Une gros merci.
Un gros merci à tous les gens du LOEX, je suis fier d'être membre de cette belle famille. Je remercie tous mes amis et co-locataires pour la belle ambiance de la résidence Boisgomin.
Un remerciement tout spécial à ma famille : Édouard pour tout aide que tu m'as donné, Nahla, pour ta présence malgré la distance, Dia pour tes encouragements constants, Charbel, Georges, et Sally... Tous, vous êtes magnifiques. Vous m’avez aidé à être meilleur.
Finalement, je voudrais remercier ma belle Caroline, Caro… comme tu le dis : si tu veux, tu peux... Merci chérie de ton support constant.
1
Chapitre 1: introduction:
1.1 La peau:
La peau est la couche externe des vertébrés. Chez les mammifères, la peau est le plus grand organe. Composé de plusieurs couches de tissu, elle protège les os, les muscles, les ligaments et les organes internes. La peau est la première ligne de défense du corps contre les facteurs externes.[1] Par exemple, la peau joue un rôle très important dans la perte d'eau excessive, dans la protection de l'organisme contre les agents externes, contre les bactéries, dans la régulation de la température, la sensation, et la protection contre les irradiations comme les rayons ultra-violets qui viennent du soleil.[2] La peau gravement endommagée peut guérir par la formation de tissu cicatriciel. L'épaisseur de la peau varie d'un endroit à l'autre et d'un organisme à un autre.[3]
1.1.1 Le rôle de la peau:
Protection: une barrière anatomique pour défendre le corps, l'organisme. Certaines des cellules présentes dans la peau font partie du système immunitaire.[4]
Sensation: contient une variété de terminaisons nerveuses qui sont sensibles au changement de la température à l'extérieur du corps, à la pression, au toucher et aux vibrations.[5]
Thermorégulation: les glandes sudoripares de la peau aident à la perte de chaleur, tandis que les vaisseaux sanguins, en régulant considérablement le flux sanguin cutané aident à conserver ou évacuer la chaleur du corps.[4, 5]
Contrôle de l'évaporation: La peau constitue une barrière relativement sèche et semi-imperméable à la perte de liquide.[4, 5]
Stockage : la peau agit comme un centre de stockage de lipides et d’eau.[4, 5]
Absorption: L'oxygène, l'azote et le dioxyde de carbone de l’atmosphère peuvent diffuser dans l'épiderme en petites quantités.[4, 5]
2
Résistance à l'eau: La peau agit comme une barrière résistante à l'eau de sorte que les nutriments essentiels ne sont pas éliminés.[4, 5]
1.1.2 Les couches de la peau des mammifères:
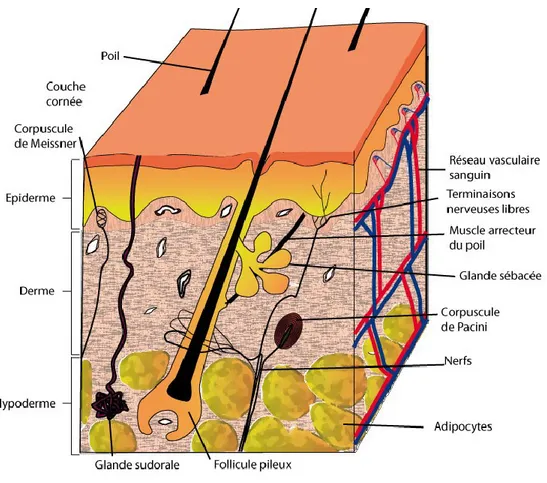
La peau de mammifères est composée de trois tissus.:[6-9] (Figure 1)
Figure tirée du site web biologie de la peau (http://biologiedelapeau.fr/)
3 1.1.2.1 L'épiderme :
L’épiderme est en contact direct avec le monde externe, est étanche et sert de barrière à l'infection.
Il forme une barrière protectrice à la surface de l'organe, est responsable du maintien de l'eau dans le corps et empêche l’entrée des agents étrangers. C'est une couche qui est composée de kératinocytes à différents stades de prolifération et de différenciation. L'épiderme aide aussi la peau à réguler la température du corps grâce à la présence de pores et de la transpiration.[10, 11]
Les kératinocytes sont les cellules principales de l’épiderme, constituant 95% des cellules, mais les cellules de Merkel, les mélanocytes et les cellules de Langerhans sont également présents. L'épiderme peut être subdivisé en plusieurs couches. (Figure 2) (en commençant par la couche la plus externe):[11, 12]
La couche cornée. La couche granuleuse. La couche épineuse. La couche basale.
4
Figure 2: Caractéristiques des couches de l'épiderme. Figure tirée du site web www.cosmeticofficine.com
Les kératinocytes de la couche basale se multiplient par mitose et les cellules-filles générées migrent vers l’extérieur en suivant une différenciation programmée comportant des caractéristiques propres à chaque couche de l’épiderme. Au cours du processus, les kératinocytes perdent peu à peu leur noyau, forment des jonctions intercellulaires et produisent des protéines de kératines et des lipides qui contribuent à la formation d'une couche cornée imperméable. Les kératinocytes de la couche cornée sont finalement éliminés à la surface par desquamation.[11]
L'épiderme ne contient pas de vaisseaux sanguins et les cellules dans les couches les plus profondes sont nourries par diffusion à partir des capillaires sanguins de la couche supérieure du derme.[8]
5
1.1.2.2 Membrane basale:
L'épiderme et le derme sont séparés par un mince dépôt matriciel appelé membrane basale produite en collaboration par les deux tissus. Sa structure est divisée en deux zones : la lame basale, un mince feuillet de glycoprotéines sécrétées par les cellules épithéliales, et la lame réticulaire qui est un feuillet de matériel extracellulaire sécrété par les cellules du tissu conjonctif sous-jacent. La membrane basale contrôle le trafic des molécules entre le derme et l'épiderme, mais elle sert également comme réservoir permettant une libération contrôlée des cytokines et des facteurs de croissance pendant le remodelage physiologique ou les processus de réparation.[11-13]
1.1.2.3 Le derme
Le derme est la couche cutanée placée sous l'épiderme. La plupart des structures spécialisées de la peau, dont les vaisseaux sanguins, les vaisseaux lymphatiques, les follicules pileux, les glandes sudoripares, les glandes sébacées (sébum) et les terminaisons nerveuses sont situées dans le derme. Le derme fournit une résistance à la traction et une élasticité à la peau grâce à une matrice extracellulaire (MEC) composée de fibres de collagène, de micros fibrilles et de fibres élastiques, incorporés dans des protéoglycanes (Figure 3).[14]
Il abrite de nombreux mécanorécepteurs (terminaisons nerveuses) qui fournissent le sens du contact et de la chaleur. Les vaisseaux sanguins dans le derme fournissent la nourriture et permettent l'enlèvement des déchets provenant des cellules du derme ainsi que de l'épiderme.[15, 16]
Figure 3: la structure du derme. Source : Nicole Grondin enseignante soins esthétiques Marie-Rivier. Figure tirée du site web http://www.urgomedical.fr/Accueil#
6
1.1.2.3.1 Fibroblastes:
Les fibroblastes (Fb) sont des cellules qui synthétisent la MEC constituée majoritairement de collagène. Ils jouent un rôle essentiel dans la cicatrisation des plaies.[17]
1.1.2.3.2 Origine embryologique:
La fonction principale des Fb est de maintenir l'intégrité de la structure des tissus conjonctifs par la sécrétion continue des protéines de la MEC. La composition de la MEC détermine les propriétés physiques des tissus conjonctifs.
Les Fb sont dérivés du mésenchyme primitif. Ils expriment la protéine de filament intermédiaire vimentine qui est souvent utilisée comme marqueur pour distinguer les Fb des autres cellules non mésenchymateuses. Cependant, ce test n'est pas spécifique in vitro car les cellules épithéliales en culture in vitro peuvent aussi exprimer la vimentine.[13, 18] Les Fb dans certaines situations peuvent former des épithéliums en subissant une transition mésenchymo épithéliale (MET). Ce processus est considéré dans des situations de développement tissulaire, ainsi que dans les processus de cicatrisation des plaies et de tumorigenèse.[14, 19]
1.1.2.3.3 Phénotype des fibroblastes:
En microscopie optique, les cellules se présentent avec un noyau moucheté elliptique allongé, avec un cytoplasme ramifié peu abondant plus ou moins basophile. (Figure 4) Les Fb peuvent migrer lentement sur un substrat sous forme de cellules individuelles.[8]
Figure 4: phénotype des fibroblastes. Source : national physical laboratory. Figure tirée du site web http://www.npl.co.uk/
7
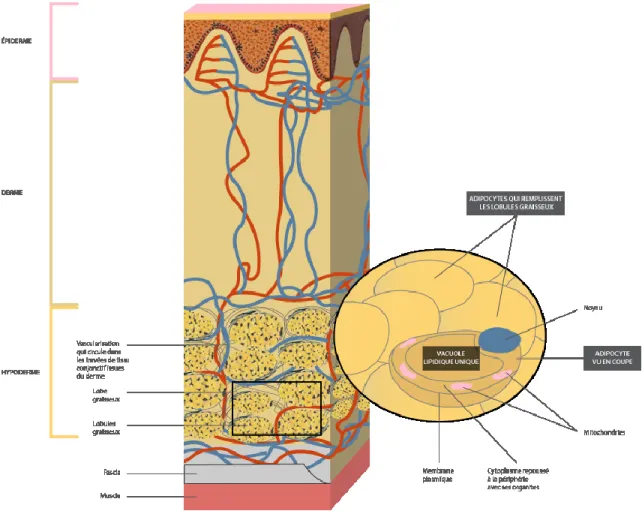
1.1.2.4 Hypoderme:
L'hypoderme se trouve sous le derme. Il fixe la peau aux muscles et à l'os sous-jacent et contient les vaisseaux sanguins et les nerfs qui aboutissent au derme. Il se compose de tissu conjonctif lâche entourant des Fb, des macrophages et surtout, des adipocytes. Il contient 50% de la graisse corporelle (Figure 5).[8, 20]
Figure 5: La structure de l'hypoderme
Dans cette figure, on voit les trois couches de la peau et, en gros plan, l'hypoderme qui est riche en adipocytes contenant des vacuoles lipidiques. Figure tirée du site web www.cosmeticofficine.com
8
1.2 La cicatrisation d'une plaie:
Lors d’une blessure de la peau, une série d'événements biochimiques complexes se déroule dans une cascade étroitement orchestrée pour réparer les dégâts. Quelques minutes après la lésion, les plaquettes (thrombocytes) s’agrègent au site de la lésion au niveau d’un caillot de fibrine formé dans les premières minutes du saignement. Ce caillot agit pour contrôler le saignement (hémostase)[15] La vitesse de cicatrisation peut être affectée par de nombreux facteurs, y compris les niveaux de circulation sanguine dans la plaie, plusieurs molécules sanguines, ou des hormones comme l'ocytocine. Pendant la phase inflammatoire, les bactéries et les débris sont phagocytés et éliminés, et des stimuli sont libérés, provoquant la migration et la division des cellules intervenant dans la phase proliférative.[16] Au niveau du derme au voisinage de la plaie, les Fb prolifèrent et migrent vers le centre de la plaie dans la matrice riche en fibrine et en fibronectine qui est un excellent substrat pour permettre la migration des cellules. Cette matrice est peu à peu remplacée par du collagène et d’autres molécules matricielles permettant de retrouver un tissu proche de celui d’origine.[21-24]
1.2.1 Les phases de la cicatrisation :
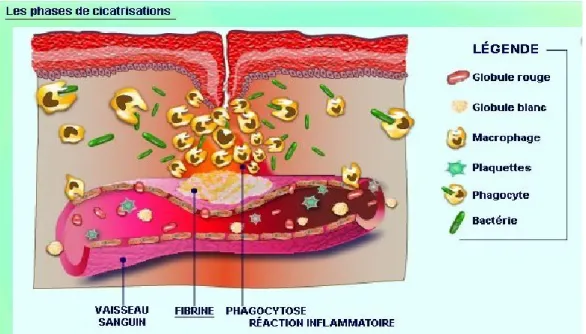
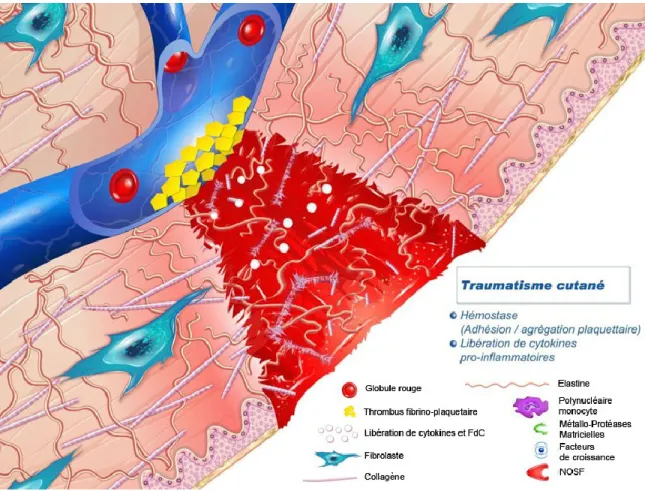
La cicatrisation est un processus complexe permettant la réparation de la peau après une blessure. Une fois que la barrière de protection est brisée, le processus physiologique de la guérison de la plaie est immédiatement mis en marche.[25] Le modèle classique de la cicatrisation est divisé en trois étapes qui se chevauchent (Figure 6):
9 Figure 6 : schéma présentant les différentes phases de la cicatrisation et les intervenants cellulaires et matriciels. [21]
1.2.1.1 – La phase inflammatoire:
L’inflammation est une réaction vasculaire et cellulaire qui permet d’éliminer les substances étrangères qui pourraient infecter la plaie. Cette première phase dure deux à quatre jours. Pendant cette étape, il y a formation d’un caillot de sang qui réunit de façon lâche les bords de la plaie. Ce caillot est formé lorsque des vaisseaux sanguins sont endommagés permettant le contact du contenu sanguin avec la matrice tissulaire et déclenchant la cascade de coagulation et l’activation des plaquettes.[15] (Figure 7)
Les plaquettes activées libèrent des facteurs de croissance et des médiateurs biochimiques qui sont les véritables médiateurs cellulaires de la cicatrisation, induisant entre autre une vasoconstriction afin de réduire la perte sanguine.[26]
Ces différents facteurs notamment le PDGF (platelet-derived growth factor), le bFGF (basic fibroblast growth factor) et les TGF (transforming growth factor α et β) vont moduler les différentes phases de la cicatrisation. (Figure 8)
10
Les différents produits provenant de la dégradation de la fibrine et de la lyse cellulaire, les peptides bactériens et les facteurs de croissance libérés par les plaquettes vont progressivement attirer les polynucléaires neutrophiles et les monocytes au niveau de la zone lésée. Ces cellules envahissent la plaie grâce à la vasodilatation et à la perméabilité accrue des vaisseaux sanguins.
Ce phénomène est contrôlé par la libération par les plaquettes d’une variété de cytokines et de facteurs de croissance qui sont hautement mitogènes pour les Fb et les cellules endothéliales et chimioattractants pour les cellules inflammatoires.
Ces macrophages comportent également un rôle de détersion locale par phagocytose des micro-organismes et des débris nécrotiques. Dès le cinquième jour, les cellules inflammatoires se font plus rares, les Fb deviennent le type cellulaire prédominant.[27]
Figure 7 : Schéma général des composant présents au cours des premier jours de la cicatrisation
11 Figure 8: la phase inflammatoire.
Figure pris du site web (http://www.urgostart.fr/index.php?page=cicatrisation-des-plaies)
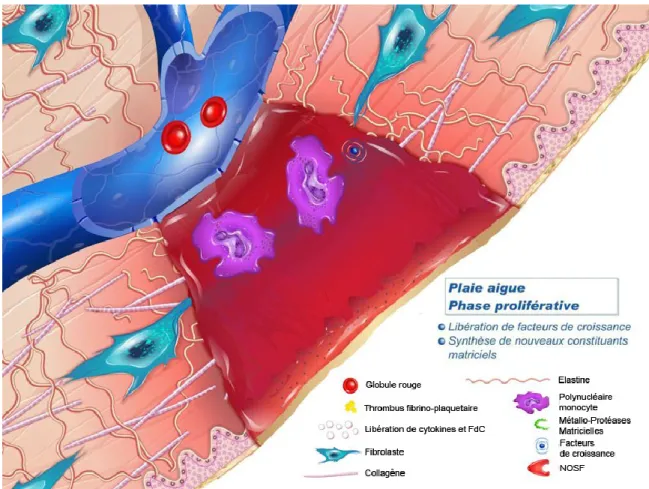
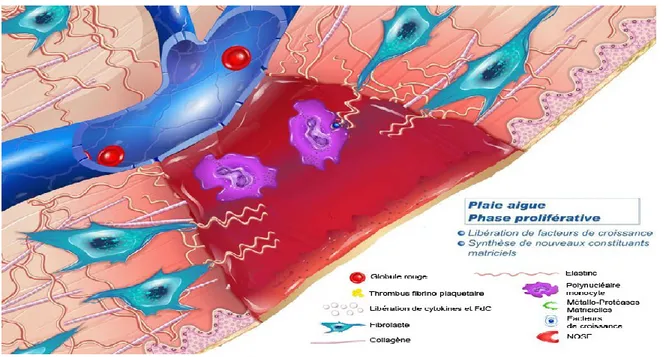
1.2.1.2 La phase proliférative:
C’est la phase de formation du tissu de granulation qui dure environ 10 à 15 jours. Environ deux ou trois jours après la blessure, les Fb et les CE (cellules endothéliales) commencent à migrer dans la plaie, marquant le début de la phase proliférative avant même que la phase inflammatoire ne soit terminée. Afin d’augmenter le nombre de cellules nécessaires à la formation du néo-tissu, les cellules recrutées au site endommagé entrent en mitose et forment le tissu de granulation.[23]
Le tissu de granulation est un tissu provisoire qui commence à apparaître dans la plaie lors de la phase inflammatoire et continue de se développer jusqu'à la fermeture de la plaie. Il se compose de nouveaux vaisseaux sanguins, de Fb, de cellules inflammatoires, de CE, de
12
Myofibroblastes (Wmyo), et des composants d'une nouvelle MEC provisoire. La MEC provisoire a une composition différente de la MEC présente dans les tissus normaux et ses composants proviennent des Fb et des Wmyo. Ces composants incluent la fibronectine, les collagènes, les glycosaminoglycanes (GAG), l'élastine, les glycoprotéines et des protéoglycanes. La présence de grande quantité de fibronectine et d’acide hyaluronique, crée une matrice très hydratée qui facilite la migration cellulaire. Avec le temps, cette matrice provisoire est remplacée par une MEC qui ressemble plus à celle trouvée dans les tissus non lésés.
La migration fibroblastique s’effectue via des récepteurs intégrines à la surface de leur membrane cellulaire. Les Fb synthétisent et remodèlent une nouvelle MEC qui se compose dans un premier temps de collagène de type III, puis progressivement de collagène de type I conférant des meilleures qualités mécaniques à la cicatrice.
Le processus d'angiogenèse se produit en même temps que la prolifération des Fb lorsque les CE migrent dans la zone de la plaie, attirées dans la plaie par la fibronectine présent dans le caillot de fibrine et par des facteurs angiogéniques libérés par d'autres cellules (bFGF, le VEGF, ainsi que différents composants de la MEC). La migration des CE est rendue possible grâce à la présence de collagénases et d’activateurs du plasminogène qui vont dégrader le caillot et une partie de la MEC. Lorsque le tissu est suffisamment vascularisé, la migration et la prolifération des CE diminuent et les CE des vaisseaux sanguins qui ne sont plus nécessaires meurent par apoptose (Figure 9).[23]
La contraction de la plaie va permettre le rapprochement des bords de la plaie diminuant ainsi la surface à réparer. La contraction commence lorsque les Fb stimulés par des facteurs de croissance se différencient en Wmyo.[28] Ces cellules sont capables d’initier une contraction et de transmettre cette activité au tissu avoisinant par l’intermédiaire d’interactions complexes entre les protéines de la MEC et leur cytosquelette.[23]
Les Wmyo sont attirés par la fibronectine et des facteurs de croissance et se déplacent le long de la fibronectine liée à la fibrine dans le MEC provisoire afin d'atteindre les bords de la plaie.[28] Ils forment des connexions à la MEC au niveau des bords de la plaie, et se fixent les uns aux autres par des desmosomes.[23] Les Wmyo contiennent beaucoup de ces
13 desmosomes qui leur permettent de tirer les protéines de la MEC quand ils se contractent, entrainant une réduction de la taille de la plaie.[29]
Figure 9 : la phase Proliférative 1.
Figure pris du site web (http://www.urgostart.fr/index.php?page=cicatrisation-des-plaies)
1.2.1.2.1 La réépithélialisation:
La formation de tissu de granulation dans une plaie ouverte permet à la réépithélialisation de prendre place. Les cellules épithéliales migrent alors à travers le nouveau tissu pour former une barrière entre la plaie et l'environnement. Les cellules épithéliales migrent progressivement à partir des berges de la plaie. Les facteurs de croissance qui contrôlent
14
cette phase sont l’EGF, le KGF (keratinocyte growth factor) et les TGF α et β produits par les Fb ou par les kératinocytes eux-mêmes. La migration des kératinocytes est également stimulée par le manque d'inhibition de contact et par des produits chimiques tels que l'oxyde nitrique.[24] Avant qu'ils ne commencent à migrer, les cellules doivent dissoudre leurs desmosomes et hémidesmosomes, qui ancrent normalement les cellules par des filaments intermédiaires dans leur cytosquelette aux autres cellules et à la MEC. (Figure 10)[25]
Lorsque la plaie est fermée par une monocouche de kératinocytes, la migration de ceux-ci s’arrête et ils se multiplient et se différencient. Une membrane basale se reconstitue progressivement. Secondairement, l’épiderme est colonisé par des mélanocytes.
Figure 10: la phase Proliférative 2.
Photo pris du site web (http://www.urgostart.fr/index.php?page=cicatrisation-des-plaies)
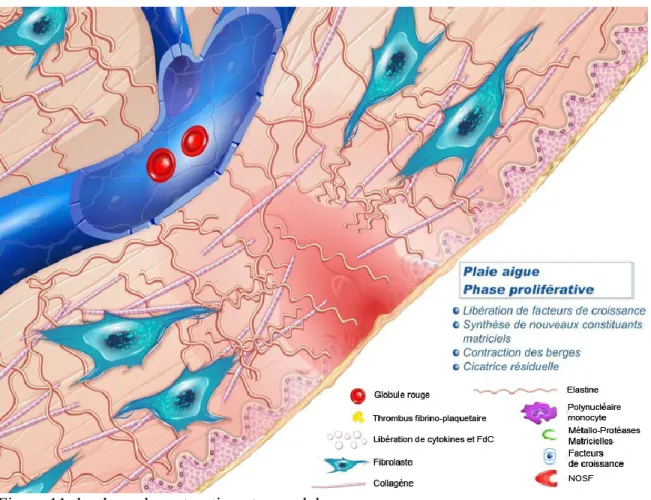
1.2.1.3 Phase de maturation et de remodelage:
Au début de cette phase, l’épiderme a retrouvé son épaisseur normale et la croûte formée à partir du caillot sanguin tombe. Les fibres de collagène commencent à être mieux organisées : initialement fines et désordonnées, elles deviennent plus épaisses et alignées avec les autres fibres des marges de la plaie. En plus des fibres de collagène, d’autres
15 composants comme des glycosaminoglycanes et des protéoglycanes viennent s’ajouter à la MEC.
Au cours de cette phase, la MEC va progressivement être remodelée, la quantité de Fb diminuée et les vaisseaux sanguins reprennent leur taille normale.
Différentes métallo-protéinases « MMP », des collagénases et plusieurs enzymes dégradant la MEC ainsi que leurs inhibiteurs interviennent dans les phénomènes de remodelage matriciel. L’apoptose des Fb et des CE marque la transition entre le tissu de granulation et la cicatrice proprement dite. (Figure 11)
Les phases de la cicatrisation progressent normalement d'une manière prévisible et selon un schéma bien précis. Une perturbation de ce schéma entraine la formation de plaie chronique ou de cicatrices pathologiques.[30]
Figure 11: la phase de maturation et remodelage.
16
1.2.2 Les myofibroblastes-description :
Dans de nombreux organes comme le foie, les poumons, les reins et la peau, les Wmyo sont principalement impliqués dans la production de MEC et la fibrose. (Figure 12)[31] Les Wmyo peuvent se différencier à partir de plusieurs types cellulaires (Figure 13).[23] Dans la peau, le consensus est qu’ils proviennent des Fb. La particularité des Wmyo est qu’ils contiennent de la vimentine, présente dans les filaments intermédiaires et marqueur mésenchymateux général mais également de l'alpha actine musculaire lisse. [27]
Figure 12: fibroblastes isolés du colon.
A et B Micrographies en contraste de phase, C et D microscopie électronique à balayage. http://ajpcell.physiology.org/content/277/1/C1 (Powel et al., 1999 Am J physiol)
17
1.2.3 Les myofibroblastes dans la cicatrisation des plaies:
Les Wmyo sont des cellules spécialisées apparaissant uniquement dans les plaies lors de la cicatrisation de la peau. Ils ont un fort potentiel contractile, synthétisent de la MEC[32] et stimulent une angiogenèse plus importante que les Fb.[33]
Les Wmyo peuvent contracter les bords de la plaie en utilisant un cytosquelette comportant le complexe actine-myosine qui est riche d'une forme d'actine appelée actine du muscle lisse alpha présente normalement dans les cellules musculaires lisses. Grâce à leur capacité de contraction des bords de la plaie,[30] les Wmyo peuvent accélérer la fermeture d’une plaie en diminuant la surface à réparer.[30]
Les premiers travaux sur la cicatrisation ont montré que le tissu de granulation prélevé d'une blessure pouvait se contracter in vitro d'une manière similaire au muscle lisse, lorsqu'ils étaient exposés à des substances induisant la contraction des muscles lisses, telles que l'adrénaline ou l'angiotensine.[23]
Lorsque la guérison est complète, ces cellules disparaissent par apoptose et il a été suggéré que, dans plusieurs maladies fibrotiques (par exemple une cirrhose du foie, la fibrose rénale etc...), ce mécanisme d’apoptose ne fonctionne pas, induisant la persistance des Wmyo, et par conséquent une augmentation trop importante de la MEC (fibrose) et de la contraction.[34] Dans la peau, ces cicatrices pathologiques sont appelées cicatrices hypertrophiques.[35]
18
Figure 13: Schéma montrant les mécanismes de différenciation des cellules en myofibroblastes. Les cellules à l’origines des myofibroblastes sont très variées en fonction des tissus.[26]
19
1.2.4 Définition des microvésicules
Théoriquement, tous les types cellulaires produisent des microvésicules (MV). (Figure 14) Deux principaux types de MV ont été identifiés, les exosomes provenant de l'endosome et les microparticules (MP) dérivées de la membrane plasmique.[36, 37] Les exosomes ont un diamètre de 30 à 150 nm, tandis que les MP ont un diamètre compris entre 100 et 1000 nm (Figure 15).[38] Bien que la biologie cellulaire de ces deux types de MV est très différente, ils circulent tous les deux dans l'espace extracellulaire et ont été détectés dans les fluides biologiques comme le sang ou les liquides synoviaux. Les deux types de vésicules contiennent des lipides, des protéines membranaires et des composants cytosoliques y compris des micros ARN, dont la présence commence à être exploitée en tant que bio-marqueurs. Leurs fonctions comprennent l'élimination des déchets et la communication intercellulaire. En outre, certaines MV jouent un rôle dans la coagulation grâce à la présence à leurs surfaces de composés permettant l’accrochage des constituants de la cascade de coagulation.[31]
Figure 14: Définition des MV (MVB: multivesicular bodies)[34]
20
Figure 15: tableau de comparaison entre les MP et les exosomes,
Tableau pris du site web http://www.frontiersin.org/Journal/10.3389/fimmu.2011.00067/full#h2 [33]
1.2.4.1 Les microparticules et la cicatrisation
Une des caractéristiques générales des cellules activées est qu'elles peuvent rejeter des fragments de leurs membranes plasmiques dans l'espace extracellulaire. Ces fragments, résultant d'un processus de bourgeonnement ou exocytose, sont également connus sous le nom de MP.[35] Ces MP comprennent des composants cytoplasmiques et des éléments membranaires tels que les phospholipides chargés négativement ou des récepteurs de surface cellulaire.
Les MP sont de nature hétérogène et sont caractérisées par une membrane externe composée d'une double couche de phospholipides et des protéines de surface cellulaire. Le mécanisme de la production des MP n'est pas entièrement compris. Les processus ne semblent pas différents de ceux observés dans l'apoptose impliquant le détachement de la membrane du cytosquelette d'ancrage et la perte de symétrie de la membrane, ce qui conduit à l'exposition de phospholipides chargés négativement.[35]
21 Des travaux ont montré une production de MP par des neutrophiles au cours de l'inflammation, suggérant que ces MP sont importantes dans l'orchestration de la résolution de l'inflammation.[36, 37] Il a été également montré que les MP jouent un rôle central dans plusieurs maladies cardiovasculaires.[32, 38] Les résultats indiquent que les effets inflammatoires et pro-coagulants des MP sur leurs cellules cibles sont provoqués par une composition lipidique spécifique ainsi que par le transfert des composants des MP vers les cellules inflammatoires.[36] De plus, il a également été montré que l'ARNm transporté par les MP affecte l'expression des protéines dans les cellules cibles.[31] En outre, des études ont apporté la preuve du rôle central des MP comme véhicules de transfert de miARN dans la circulation sanguine.[31] Ce profil peut également être utilisé comme marqueur spécifique pour certaines maladies (Let7-f, miR-27b et miR-130a) qui ont été identifiés comme miARN pro-angiogéniques. En revanche, miR-221 et miR-222 peuvent inhiber la migration des CE, la prolifération et l'angiogenèse in vitro par ciblage du récepteur du facteur de cellule souche de c-kit et peut réguler indirectement l'expression de l'oxyde nitrique par les endothéliale.[39] En outre, certains miARN sont impliqués dans l'angiogenèse tumorale comme l’ensemble miR-17-92 et miR-378. Des études indiquent également la contribution des miARN spécifiques (par exemple, 155, 21 et miR-126) à l'inflammation et aux maladies vasculaires).[31]
La P- sélectine est une des molécules d'adhésion trouvées dans les CE et les plaquettes qui peuvent être libérée de la membrane plasmique. Des études ont montré que la P-sélectine soluble induit la formation de MP pro-coagulantes à partir des monocytes in vivo lors de l'interaction avec son récepteur apparenté.[40, 41]
Les plaquettes activées libèrent de nombreuses protéines favorisant la cicatrisation des plaies et la promotion de l’angiogenèse. Il a été montré que les MP des plaquettes (PMP) peuvent exprimer et transférer des récepteurs fonctionnels, augmenter l'expression des molécules d'adhésion sur les cellules , stimuler la libération de cytokines, activer les voies de signalisation intracellulaires, modifier la réactivité vasculaire, favoriser l'angiogenèse in vitro et dans des modèles in vivo, et sont impliquées dans la régénération des tissus et les métastases du cancer.[42]
22
Enfin, notre laboratoire a montré que les Wmyo produisent des MP sous l'action du sérum humain ou bovin, et que cette production de MP est liée à une activation cellulaire et non à une induction de l'apoptose qui est le mécanisme le plus courant pour la production de ces MP. Ces MP ont une action promitotique sur les CE et fibroblastiques pouvant donc laissé penser qu’elles peuvent jouer un rôle très important au cours de la cicatrisation.[43]
1.2.4.2 Les molécules sériques responsables de la production de MP par les myofibroblastes :
Le sérum humain est l'un des fluides corporels le plus informatif, car il fournit un lien entre les organes, les tissus et les cellules.[44]
Il a été estimé que le protéome sérique est constitué de dizaines de milliers de protéines. Ce protéome comprend 22 protéines abondantes et bien caractérisées, qui représentent 99 % de la teneur en protéines dans le sérum humain et le 1% restant sont les protéines de faible abondance et de faible poids moléculaire (FPM) qui contiennent peut-être une riche source de biomarqueurs encore inconnus.[44] En fait, certaines protéines fonctionnelles connus, tels que l'insuline, les facteurs de croissance, et le glutathion, sont des protéines de faible poids moléculaire.[44]
Il a été montré que le sérum ou le plasma stimulent la production de MP par les Wmyo.[43] Afin de caractériser la nature biochimique des médiateur (s) présent (s) et responsable de la production accrue de MP, plusieurs analyses ont été effectuées permettant de conclure que ce stimulus était sensible à la chaleur et à la trypsine permettant de conclure sur la nature protéique de ce stimulus.[43]
De plus, le tamisage des molécules présentes dans le sérum, en utilisant des filtres qui permettent l'extraction des molécules de masse moléculaire inférieure à 10 et 30 kD, n'a pas affecté la production accrue de MP par les Wmyo.[43]
L'action de plusieurs protéines présentes dans le sérum a également été étudiée. Ces molécules ont été choisies en raison de leur importance quantitative dans le sérum (albumine , immunoglobulines )[45], de leur rôle dans le processus de cicatrisation des plaies (PDGF , TGFß )[21], ou dans l'induction de la production des MP (FGF2).[46]
23 Aucune des cinq protéines testées n’a pu moduler le nombre de MP produite par les Wmyo.[43]
24
1.3 Le génie tissulaire et la technique d'autoassemblage: 1.3.1 Qu’est-ce que le génie tissulaire ?
L’utilisation en médecine des méthodes par génie tissulaire est grandement reliée aux récents progrès réalisés en médecine, en biologie et en ingénierie. La possibilité que le corps humain puisse être réparé aussi facilement qu’une voiture en utilisant des cellules vivantes comme matériaux d'ingénierie est une possibilité qui semble de plus en plus réaliste.
Le génie tissulaire est basé sur la fabrication de tissus, ou d'organes, constitués de cellules et d'un échafaudage de MEC, ces tissus ou organes devant être pleinement fonctionnels afin de pouvoir les implanter chez les patients.[47]
Cette technique nécessite une source abondante de cellules saines qui peuvent être autologues (du même individu) ou allogénique. Ces cellules peuvent provenir de patients jeunes, adultes ou d’embryons (indifférenciées). Le point de départ de toute reconstruction d’un organe par génie tissulaire est la récolte de petites quantités de tissu provenant du futur bénéficiaire de l'organe ou d’un donneur sain.
Les cellules isolées de la biopsie sont ensuite cultivées à partir d'explants ou après digestion à la collagénase afin de créer une " banque de cellules ". Afin de recréer un tissu, ces cellules sont ensuite cultivées dans une matrice faite en général de collagène (la protéine matricielle majoritaire dans les tissus).[47] L’activité cellulaire peut être améliorée par l'addition de facteurs de croissance ou de cytokines ainsi que par l'utilisation de stimulation physique. Après une culture des tissus, les cellules peuvent être implantées chez le patient. Si les cellules utilisées proviennent du patient à greffer, cette méthode supprime la nécessité d’utiliser des médicaments anti-rejets puisque le tissu est alors accepté comme une partie du corps du patient.
L’ingénierie tissulaire est étroitement associée à des applications permettant de réparer ou remplacer des portions de tissus ou organes (os, cartilage, vaisseaux sanguins, vessie, peau, muscles, etc.). Le terme médecine régénératrice est souvent utilisé comme synonyme de génie tissulaire, bien que ceux qui sont impliqués dans la médecine régénératrice mettent
25 davantage l'accent sur l’injection directe de cellules souches pour remplacer les cellules défaillantes.
1.3.2 L’isolement cellulaire:
L’isolement des cellules provenant de liquides biologique tels que le sang est en général effectué grâce à des centrifugations différentielles. Lorsque les tissus d’origine sont solides, l'extraction est généralement effectuée par digestion de la matrice avec des enzymes comme la trypsine ou des collagénases suivie d’une centrifugation afin de séparer les cellules de la MEC.[48]
1.3.3 La matrice extracellulaire et son rôle important en génie tissulaire:
Les cellules sont souvent noyées dans un matériau fibreux appelé MEC qui régule de nombreux processus cellulaires.[49]
1.3.3.1 Rôle et importance :
La MEC fournit un soutien structurel et biochimique aux cellules environnantes. La composition de la MEC varie selon les tissus, cependant, l'adhérence cellulaire, la communication intercellulaire et la différenciation sont des fonctions communes à toutes les MEC. En outre, elle séquestre un large éventail de facteurs de croissance cellulaires et agit comme un magasin local pour les cellules environnantes.[49, 50]
La formation de la MEC est essentielle pour les processus tels que la croissance, la cicatrisation et la fibrose.
1.3.3.2 Composants moléculaires:
Les composants de la MEC sont produits in vivo par les cellules résidentes du tissu. La MEC est composé d'un maillage étroit de protéines fibreuses et de GAG.[51]
1.3.3.2.1 Les protéoglycanes:
Les GAG sont des polymères glucidiques et sont généralement fixés à des protéines de la MEC pour former des protéoglycanes (PG).[52-54]
Héparane sulfate : Héparane sulfate (HS) est un polysaccharide linéaire que l’on trouve dans tous les tissus animaux. Il est constitué d’un PG comprenant deux ou trois chaînes d’HS attachées à proximité de la surface cellulaire ou des protéines de la MEC.[55]
26
Le sulfate de chondroïtine : Les sulfates de chondroïtine contribuent à la résistance à la traction du cartilage, des tendons, des ligaments, et les parois de l’aorte. Ils ont été également connus pour affecter la neuroplasticité.[56]
Keratan sulfate : Les Keratan Sulfates ont une teneur en sulfate variable et, contrairement à beaucoup d'autres GAG, ne contiennent pas d'acide uronique. Elles sont présentes dans la cornée, le cartilage, les os et les cornes d'animaux.[55, 57]
1.3.3.2.2 Les polysaccharides non- protéoglycanes :
L'acide hyaluronique : L'acide hyaluronique est un polysaccharide constitué des résidus d'acide D- glucuronique et de N -acétyl alternatif. L'acide hyaluronique est produit au niveau de la surface interne de la membrane cellulaire et est transporté hors de la cellule au cours de sa biosynthèse. Il interagit avec un récepteur transmembranaire spécifique, CD44.[7, 58, 59]
Les fibres matricielles:
Une fibre très extensible présente dans la MEC au cours du développement et de la guérison des plaies qui affiche un certain nombre de sites de liaison pour des molécules d'adhésion cellulaire et des molécules de signalisation solubles.[60]
Le collagène : Les collagènes sont les protéines les plus abondantes dans la MEC. En fait, le collagène est la protéine la plus abondante dans le corps humain et représente 80 % de la teneur en protéines de la MEC. Les collagènes donnent un soutien structurel aux cellules résidentes. Le collagène, constitué de 3 chaines, est secrété sous forme de précurseur (procollagène) à l'extérieur des Fb qui est ensuite clivé par des protéases pour permettre l'assemblage extracellulaire. (Figure 16) Sous l'influence de l'acide ascorbique, ces fibres de collagènes, se renforcent et s'assemblent en faisceaux. Les fibres définitives et insolubles seront incorporées peu à peu dans la MEC permettant de répondre à des contraintes de traction très importantes.[61] Le collagène peut être divisé en plusieurs familles selon les types de structures qu'ils forment et plusieurs types de collagène peuvent être retrouvés dans le MEC d’un tissu.[52, 54, 58]
27 L’élastine : L’élastine, contrairement aux collagènes, donne l’élasticité aux tissus, ce qui leur permet de s'étirer lorsque nécessaire et de retourner à leur état d'origine sans dommage. Cette fonction est utile dans les vaisseaux sanguins, les poumons, la peau, et le nerf du cou, tous des tissus contenant des quantités élevées d’élastine. L’élastine est synthétisée par les Fb et les cellules musculaires lisses.[62]
Figure 16: Schéma de la synthèse du collagène
Photo montrant les étapes de l’assemblage des trois chaines de pro-collagène et de la formation des fibres de collagène. Photo pris du site web
http://www.addiactive.com/Comprendre/Zoomtechnique/Focussurlecollag%C3%A8ne/tabid/939/Default.asp x
28
1.3.3.2.3 Autre:
La fibronectine :
La fibronectine est une glycoprotéine qui relie les cellules avec des fibres de collagène dans la MEC, permettant aux cellules de se déplacer dans la MEC. La fibronectine relie les intégrines présentes à la surface des cellules avec les fibres de collagènes, ce qui provoque une réorganisation du cytosquelette de la cellule et facilite le mouvement des cellules. La fibronectine est sécrétée par les cellules sous forme inactive dépliée.[63-65]
Les laminines:
Les laminines sont des protéines détectées dans les membranes basales. Elles forment des réseaux structuraux qui résistent à d’importantes forces de traction. Elles aident également à l'adhésion cellulaire.
Les Fb en sécrétant les éléments de la MEC synthétisent, maintiennent et fournissent un cadre structurel aux tissus.[59]
1.3.4 Les échafaudages :
Lors de l’utilisation de la méthode de génie tissulaire, les cellules sont souvent ensemencées dans une structure matricielle artificielle capable de supporter la formation de tissu en trois dimensions. Ces structures, généralement appelées échafaudages, servent habituellement au moins un des objectifs suivants:
1- Permettre l’adhérence et la migration cellulaire. 2- Servir de support aux cellules
3- Permettre la diffusion des nutriments cellulaires essentiels et des produits secrétés 4- Exercer certaines influences mécaniques et biologiques pour modifier le comportement cellulaire.
29
1.3.4.1 Les matériaux utilisés comme échafaudages :
De nombreux matériaux différents ont été étudiés. Les plus courants sont des matériaux naturels et certains polyesters.
L’acide polylactique « PLA »est un polyester qui se dégrade dans le corps humain pour former de l'acide lactique, un produit chimique d'origine naturelle, qui est facilement éliminé par le corps.[66] D'autres exemples similaires sont l'acide polyglycolique (PGA)[66] et le polycaprolactone (PCL)[67] :le mécanisme de dégradation est comparable à celui du PLA, mais ils présentent respectivement une dégradation plus rapide et plus lente par rapport aux PLA.[68, 69]
Parmi les matériaux naturels, les différents dérivés de la MEC tels que le collagène ou la fibrine ou des matériaux de polysaccharidiques, comme le chitosane ou les GAG sont très étudiés.[66, 67]
Le LOEX a développé une méthode qui fait appel à la capacité des Fb à synthétiser une MEC in vivo. Les Fb sont cultivés dans des conditions leur permettant de fabriquer in vitro cette même MEC, entrainant la formation d’une matrice très similaire à celle retrouvée in vivo.[70]
1.3.4.2 Les applications médicales du génie tissulaire:
1.3.4.2.1 Historique de la thérapie cellulaire chez les grands brûlés:
Au début des années 80, la technique de culture des cellules de l’épiderme (kératinocytes) a été développée permettant une première application clinique du génie tissulaire à Boston en 1981.
Les recherches sur les greffes de la peau:
La culture des cellules de l’épiderme ne comporte cependant qu’un seul type de cellules cutanée et ne permet la reconstruction que d’une seule des trois couches principales de la peau.[71] Les travaux de recherche ont permis le développement d’autres types de substituts cutanés plus proche de la réalité en ajoutant un derme constitué d’une MEC et de Fb.[72, 73]
30
D’autres projets de recherche et de développement sont en cours, en particulier l’élaboration de nouveaux substituts cutanés comportant d’autres types de cellules, par exemple des cellules endothéliales, dans le but de reconstituer une peau ayant les mêmes caractéristiques et les mêmes fonctions que la peau normale.[71]
1.3.4.2.2 La technique d’autoassemblage du LOEX :
Depuis 1985, le centre LOEX de l’Université Laval utilise la capacité des Fb à produire une MEC importante en présence d’acide ascorbique.[74] Une méthode de fabrication du derme a été développée à partir de cellules humaines de peau afin de réparer des blessures de grandes surfaces grâce à la méthode du génie tissulaire. Cette technologie de génie tissulaire dite d’autoassemblage permet d’obtenir des tissus reconstruits (essentiellement de la peau mais d’autres tissus peuvent être produits par cette technique) élaborés uniquement à partir de cellules humaines.[70] Cette technique est basée sur la production de la MEC par les cellules fibroblastiques de façon similaire à ce qui se passe in vivo. En effet, in vivo, la MEC n'est pas constitué uniquement de collagène bien que celui-ci soit majoritaire. La technique d’autoassemblage est basée sur la possibilité que les cellules peuvent sécréter une MEC complexe, beaucoup plus complexe que la production in vitro d’un gel de collagène pur par exemple. Lors de la reconstruction d’un substitut cutané, des kératinocytes sont rajoutés au-dessus du derme afin de reconstituer un épiderme différencié.[75] Puisque les cellules nécessaires à la reconstruction du derme et de l'épiderme peuvent être isolées à partir d’une petite biopsie prélevée chez un patient, cette technologie permet la fabrication d’un substitut cutané autologue qui ne sera pas rejeté par le système immunitaire du patient après la greffe, permettant ainsi une intégration permanente. Le laboratoire utilise actuellement cette peau reconstruite pour traiter des patients brulés sur une grande partie de leur corps (plus de 60%) suite à une acceptation spéciale de Santé Canada. Par contre, le temps de fabrication de cette peau, environ 6 à 7 semaines, est un inconvénient majeur pour une utilisation large de ce traitement chez les patients (Figure 17).[47]
31 Figure 17: la technique d’autoassemblage développée au LOEX.
La thérapie tissulaire est une stratégie permettant de traiter les patients grands brûlés. Le traitement des brûlures varie en fonction de leur sévérité, et celle-ci dépend de la surface corporelle atteinte (exprimée en % de la surface corporelle) et de la profondeur de la brûlure.[76]
On parle de patient grand brûlé lorsque celui-ci est brulé à plus de 20 % de sa surface corporelle (10 % pour les enfants et les personnes âgées) et de brûlé grave à partir de 40 %. La chirurgie appliquée chez le grand brûlé consiste à éliminer le plus rapidement possible la peau nécrosée et à la remplacer par de la peau prélevée chez le patient lui-même.[71] Quand la surface brûlée dépasse les 50% chez l’adulte et 30% chez l’enfant, il est cependant difficile d’obtenir de la peau autologue en quantité suffisante pour recouvrir les surfaces brûlées, ce qui augmente le risque de décès.[47] De ce fait, les cultures de cellules cutanées jouent un rôle central dans le traitement des brûlures graves.[47]
32
1.4 Dépôt du collagène par les fibroblastes
1.4.1 La stimulation de la production de collagène par les Fb
humains :
Le collagène joue un rôle essentiel dans le maintien de la structure de la peau et représente jusqu'à 80 % du poids de la peau. La production de nouvelles fibres de collagène est donc essentielle pour la santé du tissu. Les collagènes de type I et III sont majoritaires dans le derme alors que le collagène de type IV et VII sont les composants principaux de la membrane basale. Le collagène de type V se retrouve de façon péricellulaire.[74] Au cours du vieillissement, la production de collagène par les Fb de la peau diminue. Il est généralement admis que le collagène de type III est plus fortement présent dans les dermes de personnes jeunes, et qu’il diminue considérablement avec l’âge.[74] Au cours du vieillissement, des niveaux de production de collagène sont réduits et les niveaux de réticulation du collagène sont augmentés, cela souvent sous l'action de facteurs externes tels que l'exposition au soleil (radiations ultra-violettes) entrainant une perte d’élasticité de la peau.[74]
Le collagène est formé dans la peau par les Fb. Il est possible de stimuler la prolifération de ces Fb et de les amener à produire plus de collagène en présence de vitamine C (acide ascorbique) qui agit sur les systèmes d'oxydo-réduction pour catalyser l'hydroxylation de la proline en l'hydroxy-proline, une modification caractéristique du collagène.[47]
1.4.2 Le dépôt de collagène :
Une des fonctions les plus importantes de Fb est la production de collagène. Une fois sécrétée, le collagène doit être déposé et intégré à la MEC afin de former un tissu résistant contrairement au caillot de fibrine - fibronectine, qui ne fournit pas beaucoup de résistance aux forces de traction.[77] Lors de la cicatrisation, les cellules impliquées dans l’inflammation, l'angiogenèse et la construction du tissu conjonctif migrent et se multiplient sur la matrice de collagène secrétée par les Fb.[78]
In vivo, le collagène de type III et la fibronectine sont produits en quantités appréciables dès les premiers jours après la blessure. Le maximum de dépôt est observé entre une et
33 trois semaines et restent les protéines matricielles prédominantes jusqu'à ce qu’à la phase de maturation pendant laquelle elles sont remplacées par le collagène de type I.[78]
Des études ont montres que la présence de PDGF conduit à une augmentation du dépôt de collagène dans les tissus fabriqués in vitro.[79] A l’inverse, une étude a montré que la présence de l'acide abscissique phytohormones (ABA) - identifié comme une hormone endogène chez l'homme- diminue de manière significative le dépôt de collagène par les fibroblastes provenant de biopsies de peaux de patients sclérodermiques.[80]
34
1.5 Le laminarane : 1.5.1 Définition
Saccharina longicruris est une algue brune (Figure 18) qui contient plusieurs composantes comme des laminaranes LM, des fucoidanes et des polyphénols qui peuvent influencer positivement la santé humaine.
Figure 18: Saccharina longicruris
Photo pris du site web https://seaweedindustry.com/seaweed/type/saccharina-longicruris
Parmi ceux-ci, il a été montré que les LM modulent la réponse immunitaire et ont des propriétés antis - tumorale et anti -apoptotiques.[81]
Les fucoidanes, par contre, affectent la sécrétion des protéines de la MEC, influencent la prolifération des cellules et peuvent activer l’apoptose. Ces activités biologiques sont dépendantes de la structure des polysaccharides, qui varient pour chaque espèce d’algue.[82]
35 Les LM sont des GAG composés d’un glucane de 5 kD avec un degré de polymérisation compris entre 20 et 25. Ils sont présents sous formes solubles et insolubles et sont constitués de D-glucose avec des liaisons beta (1,3), et beta(1,6) entre les chaînes de ramification. Les structures peuvent cependant varier selon les espèces d’algues, ainsi que facteurs environnementaux tels que les sels nutritifs et l'âge de l’algue. Ces facteurs sont également soupçonnés influencer l'activité biologique des LM sur les cellules.[82]
Saccharina longicruris, anciennement dénommée Laminaria longicruris, contient des LM, et un galactofucane qui est souvent inclus dans la famille des fucoidanes.[82]
1.5.2 Les actions des composants du Saccharina longicruris :
Une étape cruciale dans la cicatrisation est la migration et la prolifération des Fb, aboutissant à une augmentation de la sécrétion de collagène I et III.[83] Pendant cette phase, les Fb synthétisent également plusieurs GAG, dont le sulfate de chondroïtine, connus pour améliorer la cicatrisation des plaies.[84, 85] Des mimétiques de GAG se sont d’ailleurs avérés précieux pour stimuler la cicatrisation des plaies.[86] Dans la peau âgée, la sécrétion des GAG est modifiée et il y a une réduction de la prolifération des Fb et de la sécrétion de collagène[87]
En plus de son activité anticoagulante, l'héparine, un GAG de structure apparentée, propose une large gamme d'effets physiologiques, tels que la stimulation de la sécrétion des protéines de la MEC[57, 88] ou une activation de l'apoptose .[85] Les fucoidanes, les polysaccharides sulfatés extraits d'algues brunes, ont été montré comme ayant un mécanisme d'action similaire à celui de l’héparine. Certains auteurs ont montré que les fucoidanes affectent la sécrétion des protéines de la MEC[89], influencent la prolifération cellulaire[90] et peuvent induire l'apoptose .[91] Les galactofucanes, également isolés à partir d'algues brunes, ont des activités anti-thrombotiques et antivirales.[92]
La composition des monosaccharides, le nombre et les positions des groupes sulfates, le poids moléculaire et la conformation globale sont tous reconnus pour influencer la bioactivité d'un GAG [93, 94] En raison de leurs différentes structures, les galactofucanes
36
sont soupçonnés d’induire des activités métaboliques qui sont distinctes de celles induites par les fucoidan et l’héparine.
1.5.3 Effet des extraits de l’algue S. longicruris sur les fibroblastes:
Les galactofucanes extraits de l’algue brune S. longicruris, selon leur poids moléculaires peuvent influencer différentiellement la croissance cellulaire des Fb et la sécrétion de protéines. Des études menées sur deux extraits de galactofucanes ont montré une activité anti-proliférative avec une augmentation possible de la dégradation de la MEC par les Fb causée par une sécrétion accrue de MMP.[81] Ces mêmes études ont également montré que le LM augmente la production de collagène par les Fb[81]
37
Objectifs et hypothèses
Le génie tissulaire est une méthode de production de tissus in vitro à partir de cellules isolées. C’est une technique qui commence à être utilisée en clinique afin de traiter des patients ayant des déficiences dans un tissu mais la fabrication de ces tissus est longue et complexe, empêchant une utilisation plus large de ces tissus.
Ce mémoire présente les résultats obtenus afin d’améliorer la fabrication des tissus reconstruit par génie tissulaire selon deux voies de recherche :
Objectif 1- Déterminer la/les protéines sériques responsables de la production des MP par les Wmyo afin de pouvoir la/les utiliser pour stimuler la croissance des CE in vitro dans un modèle amélioré de peau contenant des capillaires sanguins ou in vivo, lors de la revascularisation des greffons.
- Fractionner les protéines du sérum bovin afin de trouver la ou les protéines responsables de la production des MP par les Wmyo. Chaque fraction obtenue est analysée quant à son contenu en protéines (dosage quantitatif et analyse qualitative par visualisation sur gel SDS) et à sa capacité de stimuler la production de MP par les Wmyo.
- Analyser par spectroscopie de masse les protéines présentes dans l’extrait purifié afin de déterminer les protéines à l`origine de la production des MP.
Objectif 2- Accroitre le dépôt de MEC afin de permettre une diminution du temps de production des dermes par autoassemblage
- Étudier le rôle du LM sur le dépôt de MEC produit par les Fb en mesurant l’épaisseur des dermes en présence ou absence de LM à différentes concentrations
- Analyser la quantité de collagène I par western-blot dans la matrice déposée ainsi que la quantité de MMP sécrétées par les Fb en présence ou absence de LM à différentes concentrations
38
Chapitre 2 : Matériel et méthodes:
2.1 La culture cellulaire: 2.1.1 Les fibroblastes:
Isolement des cellules: L’extraction des Fb humains a été effectuée à partir de morceaux de peau provenant de donneurs sains. Chaque biopsie a été incubée dans une solution de thermolysine (enzyme dégradant spécifiquement les protéines de la membrane basale, permettant une séparation nette du derme et de l'épiderme) à une concentration de 500 µg/ml dans un tampon HEPES. La séparation des deux couches (derme et épiderme) a été effectuée mécaniquement à l’aide de pinces. Le derme a été incubé dans de la collagénase H (0.125 U/ml) et les Fb mis en culture.
Culture des cellules: Les Fb ont été cultivés dans du milieu DME (Dulbecco's Modification of Eagle's) contenant 10% de sérum de veau fœtal (SVF), 100 U/ml de pénicilline et 25 µg/ml de gentamycine. Des Fb de passage inférieur à 5 ont été utilisés pendant toutes les expériences. Les cellules ont été incubées à 37°C dans 8% de CO2 et le milieu de culture a été changé tous les 2 jours.
2.1.2 Les myofibroblastes:
Isolement de cellules : Les Wmyo proviennent de plaies cutanées. Le chirurgien dépose une petite éponge de PVA (Polyvinyle Acétate) sous la peau de volontaires comme décrit précédemment par Germain et al.[48] Après 12 jours, au moment où les Wmyo sont en quantité maximale, l'éponge est récupérée et les Wmyo isolés grâce à un traitement avec une solution de collagénase H (0.125 U/ml).
Culture de cellules : les Wmyo ont été cultivés dans du milieu DME contenant 20% de SVF, 100 U/ml de pénicilline et 25 µg/ml de gentamycine. Les Wmyo de passage inférieur à 6 ont été utilisés pendant toutes les expériences. Les cellules ont été incubées à 37°C dans 8% de CO2 et le milieu de culture a été changé tous les 2 jours.
Tous les échantillons tissulaires ont été obtenus après le consentement éclairé du donneur et selon les principes exprimés dans la Déclaration d'Helsinki. Cette étude a été approuvée par le comité d'éthique de la recherche du Centre hospitalier affilié Universitaire de Québec.
39
2.2 Laminarane et traitement des cellules:
Le LM a été isolé d'algues S. longicruris qui ont été broyées puis traités selon les méthodes décrites dans [95]. Les algues ont été récoltées à Gaspé (Québec, Canada) et le travail a été effectué par Laurie-Ève Rioux et Sylvie Turgeon de l’Institut des neutraceutiques et aliment fonctionnel de l’Université Laval.[82]
Le LM reçu sous forme d'une poudre blanche (Figure 19), a été mis dans le milieu de culture DME 10% SVF à la concentration désirée avant d’être chauffé à 370C pendant une heure afin de permettre une meilleure dissolution des sucres.
40
2.3 Production de derme par la méthode d’autoassemblage:
Les Fb ont été cultivés dans le milieu décrit ci-dessus et complété par 50 µg/ ml d'acide ascorbique qui est un co-facteur important dans la production de la MEC. Après une semaine, un deuxième ensemencement de Fb a été effectué sur la première couche cellulaire. (Figure 20) Le milieu de culture a été changé tous les 2 jours pendant un total de 35 jours. Les feuillets dermiques obtenus ont été analysés par histologie et western blot (WB). Les surnageants de culture recueillis lors du dernière changement de milieux ont été utilisés pour effectuer le dosage des MMP.
Figure 20: Méthode de fabrication des feuillets dermiques par double ensemencement des Fb