En vue de l'obtention du
DOCTORAT DE L'UNIVERSITÉ DE TOULOUSE
Délivré par :
Institut National Polytechnique de Toulouse (Toulouse INP)
Discipline ou spécialité :
Surfaces Interfaces Continentales Hydrologie
Présentée et soutenue par :
M. VIVIEN PONNOU-DELAFFON le jeudi 2 juillet 2020
Titre :
Unité de recherche : Ecole doctorale :
Fonctionnement de la Zone Critique en milieu agricole: cas du Bassin
versant d'Auradé. Variations hydrochimiques spatio-temporelles et bilans
d'érosion
Sciences de l'Univers de l'Environnement et de l'Espace (SDU2E) Laboratoire Ecologie Fonctionnelle et Environnement ( ECOLAB)
Directeur(s) de Thèse :
MME ANNE PROBST M. JEAN-LUC PROBST
Rapporteurs :
M. PHILIPPE AMIOTTE SUCHET, UNIVERSITE DE BOURGOGNE M. STEPHANE BINET, UNIVERSITE D'ORLEANS
Membre(s) du jury :
Mme SABINE SAUVAGE, CNRS TOULOUSE, Président M. JEAN-LUC PROBST, CNRS TOULOUSE, Membre
Mme ANNE PROBST, CNRS TOULOUSE, Membre
M. WOLFGANG LUDWIG, UNIVERSITE DE PERPIGNAN, Membre
3
« Une mer calme n’a jamais fait un bon marin »
Proverbe
5
Remerciements
La thèse est un travail difficile mais il faut s’accrocher, ne jamais abandonner, ne jamais laisser tomber et ne jamais s’éparpiller ou délaisser sa thèse …
J’aimerais, tout d’abord, remercier grandement mes directeurs de thèse Anne et Jean-Luc Probst sans qui je n’aurais jamais pu finir, ni même commencer cette thèse. Un grand merci encore, à vous deux, qui m’avez tant appris au cours de cette thèse et soutenu dans les moments les plus difficiles.
Je souhaiterais exprimer toute ma gratitude aux membres du jury. Merci à Philippe Amiotte-Suchet, Stéphane Binet et Wolgang Ludwig d’avoir accepté d’évaluer mon travail. Merci à Olivier Ribolzi, Mathieu Sébilo et Issam Moussa de m’avoir accompagné lors des comités de thèse. Merci à Sabine Sauvage d’avoir accepté de faire partie de ce jury.
Je remercie également les membres du laboratoire d’écologie fonctionnelle et environnement (anciennement EcoLab), à commencer par son directeur Franck Gilbert, toujours disponible pour m’apporter son aide, mais aussi, sa secrétaire, Annick Corrège, sans qui la vie de chacune des personnes du laboratoire serait plus difficile.
Il y a aussi des personnes, sans qui cette thèse aurait été bien vide, sur le plan matériel, des data mais aussi sur le plan émotionnel. Merci donc à Virginie Payré-Suc et à Franck Granouillac, les femmes et hommes de terrain que je considère comme des amis. Merci à Corinne Pautot et Thierry Camboulive d’avoir apporté leurs soutiens techniques et moraux à cette thèse. Merci aussi à Robin qui avait pour mission de préparer mes analyses de 15N pendant son stage
de L3. Merci à Marie-José Tavella, qui aura su animer les journées et les soirées de travail au laboratoire ou avec qui j’ai attendu le dépanneur le soir. Merci aussi à tous ceux qui ont contribué indirectement à cette thèse par le travail qu’ils ont fourni sur Auradé avant moi. J’aimerais aussi remercier tous mes collègues de bureaux (et il y en a eu) qui ont su égayer mes journées. Donc merci, Franck Granouillac (encore lui, il est partout bien qu’à 20% au laboratoire par semaine), Marie, Amine B, Steve, Déonie, Oussama, Joggi, Sara, et Francesco (le petit chouchou).
6
Merci aussi à tous ceux qui ont pu me soutenir durant cette thèse : Thomas, Marilen, Ariane, Chuxian, Xi, Clément, Roxelane, Vanessa, Columba, Pankies, Théo, Théo, Huguette, Alpha, Amine Z, Juan, Simon, Jérémy, Pilar, Marine, Eva, Adrien, Betty, Clarisse, Quentin, Benjamin, Christophe, Camille, Stéphanie, Sylvain, Laure, Gaël, Julien, Yann, Dédé, Annie, Séverine, etc. Désolé pour les personnes que j’oublie et qui liront ces remerciements.
Je n’oublie pas non plus, les deux personnes, sans qui, je me serais senti bien seul la nuit à Auradé dans la cabane de Virginie (si on ne prend pas en compte les araignées), à savoir mes frères Algérien et Chinois, Amine et Xinda. Ces deux hommes qui ont accepté de braver le vent et la pluie pour récolter des échantillons de crues avec moi. Merci aussi à ceux qui m’ont accompagné sans pouvoir attraper de crue malgré la pluie, Anne-Sophie et Loïc.
Mes derniers remerciements vont à ma moitié, ma mie, Anne-Sophie, qui m’aura toujours soutenu et accompagné malgré les galères et les soucis et qui aura réussi à s’occuper de notre petit combattant, Gabriel (qui a déjà traversé plus que moi dans la vie), pour m’aider à finir ma thèse.
7
Sommaire
Liste des abréviations………..13
Introduction Générale………..……… 15
Chapitre I Synthèse Bibliographique………19
1. Introduction……….20
2. La Zone Critique……….20
2.1. Définition………..21
2.2. L’intérêt de l’étude de la zone critique……….23
3. Les Cycles du Carbone, de l’Azote et l’importance du cycle de l’eau………24
3.1. Le cycle du carbone………...25
3.1.1. La bimodalité temporelle du cycle du carbone……….25
3.1.2. L’impact anthropique………. 29
3.2. Le cycle de l’azote………...31
3.2.1. Le cycle naturel………32
3.2.2. L’impact de l’agriculture moderne dans le cycle de l’azote………..33
3.2.3. Les interactions entre les cycles du carbone et de l’azote dans un contexte agricole……….… 34
3.3. Le cycle de l’eau……….. 36
3.3.1. Le fonctionnement du Cycle de l’eau………...37
3.3.2. Un cycle porteur d’interactions……….…..38
8
Chapitre II Matériels et Méthodes………..……….44
1. Site d’étude : le bassin versant du Montoussé………..45
1.1. Contexte du site………45
1.2. Hydro-Climatologie du bassin versant………..46
1.3. Lithologie et sols………..48
1.4. Occupation des sols et pratiques agricoles………49
2. Méthodes de prélèvements et d’analyses………..51
2.1. Les différents sites de mesures, les dispositifs et les paramètres mesurés…………..51
2.2. Fréquences d’échantillonnage………..55
2.3. Méthodes de prélèvements………...55
2.4. Préparation et conditionnement des échantillons………..56
2.5. Analyses physico-chimiques et isotopiques………..57
2.5.1. Sur le terrain………..………..57
2.5.2. Au laboratoire………..……….. 57
3. Analyses et traitements de données………59
3.1. Méthodes de vérification et de correction des données……….………59
3.2. Méthodes de calibrations……….…….61
3.3. Méthodes statistiques……….64
3.3.1. Les tests paramétriques………...65
3.3.2. Les tests non- paramétriques………66
9
Chapitre III Hydrologie et géochimie des eaux du bassin versant du Montoussé……….70
1. Introduction……….71
2. Caractérisation hydrologique et climatique du bassin versant du Montoussé………72
2.1. Caractérisation climatologique du bassin versant du Montoussé……….72
2.2. Comparaison des données hydro-climatologiques du bassin versant du Montoussé avec des stations météorologiques de la région………..75
2.2.1. Comparaison des précipitations………..75
2.2.2. Caractérisation hydrologique du Montoussé dans un contexte régional ………..……….77
2.3. Influence des précipitations sur le débit du Montoussé………..….80
3. Tendances hydrologiques du bassin versant du Montoussé………..87
4. Caractérisation et tendances géochimiques du bassin versant du Montoussé……….90
4.1. Introduction………90
4.2. Principaux résultats et conclusion………91
4.3. Publication………..93
5. Traçage géochimique par les isotopes stables………109
5.1. Composition isotopique des pluies (δ2H et δ18O) et origine des précipitations…109 5.2. Composition isotopique (δ2H et δ18O) des eaux de surface du Montoussé et contribution de l’évapotranspiration………112
5.3. Composition isotopique δ13C du carbone inorganique dissous dans les eaux du Montoussé et contrainte isotopique sur la dissolution des carbonates………116
5.4. Evolution temporelle des compositions isotopiques de l’eau et du carbone des eaux de surface du bassin versant du Montoussé………121
5.4.1. Eaux de pluies………121
5.4.2. Eaux de ruisseau………..123
10
Chapitre IV Caractérisation spatiale ponctuelle des eaux de surface………..139
1. Introduction………..140
2. Contexte hydrologique du site d’étude………..140
3. Distribution spatiale des concentrations………..144
4. Evolution spatiale des flux des différents éléments………..150
5. Processus et facteurs explicatifs des variations spatiales de la composition chimique des eaux de surface ……….………..152
5.1. La dénitrification………..152
5.2. L’influence des fertilisants azotés sur la dissolution des carbonates………..155
6. Conclusion………..159
Chapitre V. Rôle des crues dans les transferts de matière……….161
1. Introduction………..162
2. Les mécanismes de la crue………..162
3. Le découpage hydrologique des crues……….167
4. Les relations concentration/débit (C/Q)………173
4.1. Les relations C/Q à long terme………173
4.2. Les relations C/Q à l’échelle d’une crue et le phénomène d’hystérésis……….176
5. Implication en termes de sources de matière et de mécanismes de transfert……….188
11
Chapitre VI Erosion physique et altération chimique……….205
1. Introduction………..206
2. Méthodes de calcul des flux………..206
2.1. Les flux entrant ………..207
2.1.1. Les apports atmosphériques………..207
2.1.2. Les intrants agricoles………….………..207
2.2. Les flux sortant……….208
2.2.1. Les exports agricoles……….208
2.2.2 Les flux de matière drainés à l’exutoire………..208
2.2.2.1. Les méthodes globales……….208
2.2.2.1.a. Méthode basée sur les moyennes arithmétique (Méthode 1)………209
2.2.2.1.b. Méthode basée sur la moyenne des concentrations pondérées par les débits (Méthode 2)……….209
2.2.2.2. Les méthodes de bilans partiels……….209
2.2.2.2.a. Méthode basée sur les moyennes arithmétiques des concentrations (Méthode 3)………210
2.2.2.2.b. Méthode basée sur les moyennes des concentrations pondérées par les débits (Méthode 4)……….210
2.2.3. Comparaison des résultats ……….211
3. Flux et bilans de matière……….………214
3.1. Entrées atmosphériques……….214
3.1.1. Origine des précipitations……….214
3.1.2. Flux d’éléments apportés par les précipitations………221
3.2. Flux d’éléments sortant dans le ruisseau du Montoussé……….225
12
4. Contribution des crues………..238
5. Bilans de l’érosion mécanique et de l’altération chimique………241
5.1. Erosion mécanique………. 239
5.2. Altération chimique………243
5.2.1. Dissolution des carbonates………..243
5.2.2. Taux de dénudation chimique………245
5.3. Consommation de CO2 par altération chimique et perte d’alcalinité………..250
5.3.1. Consommation de CO2………..250
5.3.2. Perte de CO2 due aux fertilisants………..………243
5.4. Comparaison érosion mécanique et altération chimique………255
6. Conclusion………..257
Conclusion Générale………..……….261
Perspectives ………. 271
Bibliographie..………..274
Liste des Figures………304
Liste des Tableaux………..314
Annexes……….317
13
Liste des Abréviations
CC : Changement Climatique CID : Carbone Inorganique Dissous
CZO : Critical Zone Observatory (Observatoire de la Zone Critique) CZEN : Critical Zone Exploration Network
DOC : Dissolve Organic Carbone (Carbone Organique Dissous) GES : Gaz à Effet de Serre
IGN : Institut national de l’information géographique et forestière
IPCC : International Pannel for Climate Change (Groupement International d’Expert Changement climatique)
MES : Matières en suspension
MERA : L’observatoire national de Mesure et d’Evaluation en zone Rurale de la pollution Atmosphérique à longue distance
NRC : National Research Council (Centre national de la recherche des Etats-Unis) OZCAR : Observatoire de la Zone Critique, Application, Recherche.
pH : potentiel hydrogène
RENECOFOR : Réseau National de suivi à long terme des ECOsystèmes FORestiers ZC : Zone Critique
15
16
De nos jours, la pression anthropique est devenue mondiale et aucun lieu sur Terre n’échappe à la présence de l’Homme, ne serait-ce que par la présence de plastique du sommet des plus hautes montagnes au plus profond des océans. L’un des domaines où cette pression est la plus forte est l’agriculture. Depuis son apparition, il y a 10000 ans, l’agriculture a permis de nourrir l’Homme mais elle a également profondément modifié la morphologie du paysage naturel. Depuis l’avènement de l’agriculture moderne, après la seconde guerre mondiale, les nouvelles pratiques agricoles ont contribué à appauvrir la qualité des sols par l’utilisation massive de fertilisants azotés, de produits phytosanitaires ou encore par l’utilisation de la monoculture intensive. L’étude de l’impact de ces pratiques agricoles a permis de mettre en évidence la diminution des quantités de carbone des sols (Lal et al., 2013 ; Nachimuthu and Hulugalle, 2016) et de la biodiversité des sols (Regina and Alakukku, 2010), ce qui a conduit à l’accélération de l’érosion des sols (Dotterl, 2013). L’utilisation massive de fertilisants azotés a conduit à des modifications dans des processus naturels, tel que la dissolution des carbonates, en perturbant les cycles naturels du carbone et de l’azote (Semhi et al., 2000 ; Perrin et al., 2008 ; Gandois et al., 2011).
En plus des perturbations anthropiques directes induites par ces pratiques agricoles, la révolution industrielle du XXème siècle a apporté une augmentation des concentrations en gaz
à effet de serre dans l’atmosphère. Ces apports de gaz à effet de serre n’ont fait que croitre et ont entrainé un réchauffement global de l’atmosphère, entrainant ce que l’on appelle aujourd’hui le changement climatique (IPCC, 2013). Ce changement climatique est responsable de perturbations dans les cycles naturels, notamment dans le cycle de l’eau, par l’augmentation de la température de l’hydrosphère. Ces perturbations entrainent une augmentation des évènements extrêmes tels que les sècheresses et les tempêtes (IPCC, 2018). Ce changement global peut provoquer de fortes perturbations régionales ou locales et intensifier les problèmes rencontrés dans le domaine agricole par l’accélération de la dégradation des sols.
Dans ce cadre de Zone Critique1 (ZC) agricole qui a été montré comme étant une zone fragile et qui est soumis à de fortes perturbations, les grands enjeux de cette thèse seront d’étudier les interactions entre les trois grands cycles : cycle du carbone, de l’azote et de l’eau au sein
1 Zone Critique : Zone de la planète Terre regroupant toute sa surface sur une fine couche allant de la
17
du domaine agricole, ainsi que l’évolution à long terme des pressions anthropiques et des changements climatiques sur ces cycles.
Pour répondre à ces enjeux, les problématiques du travail de cette thèse sont : Quel est le fonctionnement hydrobiogéochimique du bassin versant agricole du Montoussé ? Quelle est l’origine des éléments présents dans le ruisseau ? Comment les cycles du carbone, de l’azote et de l’eau interagissent ?
Cette étude a pour objectifs de :
-Caractériser les conditions hydroclimatiques et hydrochimiques du bassin versant du Montoussé
-Appréhender les variations hydrogéochimiques à différentes échelles de temps -Déterminer les variations dans l’espace des propriétés hydrologiques et hydrochimiques du ruisseau du Montoussé et de ses affluents
-Estimer l’influence des évènements hydrologiques extrêmes, les crues, sur le transfert des éléments chimiques
-Quantifier les flux hydrobiogéochimiques et réaliser les bilans d’érosion.
Le premier chapitre de cette thèse est dédié à la présentation du contexte général qui porte sur l’étude de la Zone Critique et celle des différents cycles globaux et de leurs interactions aux niveaux global et local. Ce chapitre permettra aussi de présenter les problématiques de l’impact anthropique sur ces différents cycles dans le contexte d’un bassin versant agricole. Le deuxième chapitre de cette thèse est consacré aux caractéristiques générales du bassin versant étudié. Il présentera également les différents outils et techniques d’échantillonnages et d’analyses physiques, chimiques, isotopiques et statistiques utilisés au cours de cette étude. Le troisième chapitre va permettre de définir l’hydroclimatologie du bassin versant du Montoussé et d’en analyser les évolutions temporelles. Ce chapitre va ensuite caractériser l’hydrochimie du ruisseau du Montoussé pour ultérieurement exposer les variations hydrochimiques temporelles à long et à court-terme et les processus associés à ces variations. La dernière partie de ce chapitre visera à améliorer la compréhension des processus de
18
contrôle de l’hydrochimie du ruisseau et à déterminer l’origine de certains éléments chimiques à l’aide des isotopes stables de l’hydrogène et de l’oxygène de l’eau, du carbone du carbone inorganique dissous, de l’oxygène et de l’azote des nitrates et du soufre des sulfates. Le quatrième chapitre est consacré à l’étude hydrochimique spatiale, réalisée le 9 avril 2018, sur le bassin versant du Montoussé et porte sur l’analyse des paramètres hydrologiques, hydrochimiques et isotopiques du cours d’eau du Montoussé et de ses affluents. L’objectif est de montrer les zones contributives du bassin versant et de mettre en évidence les différents processus de contrôle de la composition chimique et isotopique du Montoussé.
Le cinquième chapitre vise à caractériser les crues du Montoussé et à montrer l’intérêt de leur étude pour comprendre l’origine et le transport des éléments chimiques et des matières à l’exutoire du bassin versant.
Enfin, le but du sixième chapitre est de calculer, le plus précisément possible, les flux d’entrées et de sorties d’éléments et de matière sur le bassin versant du Montoussé, et d’étudier l’évolution de ces flux et des bilans entrées-sorties au cours du temps. Ce chapitre permettra de mettre en avant la contribution quantitative des crues au transport des flux dissous et particulaires à l’exutoire du bassin versant. La dernière partie permettra de déterminer l’état d’équilibre des sols du bassin versant agricole du Montoussé en établissant la balance entre les taux d’érosion mécanique des sols et d’altération chimique du substratum molassique. Une conclusion générale reprendra les principaux résultats de cette thèse et proposera des perspectives pour développer de futurs travaux scientifiques.
19
20
1. Introduction
La vie est cantonnée sur une fine couche de notre planète Terre : sa surface. L’Homme vivant au sein de cette couche s’est attaché à l’étudier pour sa survie. Il a ainsi découvert qu’à l’intérieur de cette zone, de grands cycles étaient en interaction. L’être humain et la vie sur Terre sont dépendants de ces cycles. Notamment les cycles du Carbone et de l’Azote qui constituent les briques de base de la vie, mais aussi le cycle de l’eau sans lequel la vie est impossible. Cependant, par sa présence, l’Homme a perturbé ces cycles et leurs interactions à large comme à faible échelle temporelle et spatiale. Le Changement Climatique en fait partie, tout comme l’artificialisation des terres et l’acidification des océans. Etant un lieu de vie et subissant de fortes perturbations, cette couche a été définie comme la Zone Critique (ZC).
Pour réussir à introduire ces différentes notions ainsi que leurs importances dans la vie sur Terre, ce chapitre va s’atteler à : (i) définir le terme de Zone Critique ; (ii) montrer les différents cycles globaux et leurs interactions aux niveaux global et local ; (iii) montrer les impacts anthropiques dans le contexte d’un bassin versant agricole.
2. La Zone Critique
L’être humain a toujours observé la ZC. Les peintures rupestres des animaux que l’on retrouve dans les grottes comme celle de Lascaux en est une première représentation. Le développement de la civilisation s’est effectué par des avancées scientifiques, comme le développement de l’agriculture il y a 10 000 ans, et n’a pu se faire que par l’étude de la ZC. Cependant, bien qu’il ait été toujours étudié, le concept de Zone Critique n’est introduit qu’en 1988 par Gail Ashley. Il n’a été mis en place que récemment, en 2001, par la National Science
Foundation (NSF) des Etats-Unis dans l’Etat de Virginie par la mise en place d’un réseau de
lieux d’observation de la ZC nommé « Critical Zone Observatory » (CZO) et l’ouverture de 10 observatoires (NRC, 2001). Ces observatoires se sont ensuite multipliés pour atteindre en 2015 le nombre de 64 (Giardino and Houser, 2015) et le regroupement des différents
21
organismes nationaux dans le « Critical Zone Exploration Network » (CZEN) porte aujourd’hui ce nombre à 247 sites répartis sur le Globe (Figure 1). Ces sites sont cependant cantonnés à quelques régions du monde, dont certaines avec de fortes concentrations d’observatoires comme l’Amérique du Nord, l’Europe de l’Ouest et l’Asie du Sud-Est comme on peut le voir sur la carte (Figure 1). Cette carte montre également les sites du réseau Français OZCAR (Observatoire de la Zone Critique-Application et Recherche) qui est une Infrastructure de Recherche nationale. Ce réseau fait partie depuis sa création en 2015 du CZO et compte plus de 100 sites d’observations (Gaillardet et al., 2018).
2.1. Définition
Ashley (1988) est le premier à définir la Zone Critique comme étant la zone entre la canopée des arbres et le sol. Le National Research Council (NRC) a ensuite défini la Zone Critique comme « the heterogeneous, near surface environment in which complex interactions
involving rock, soil, water, air and living organisms regulate the natural habitat and determine availability of life sustaining resources » (NRC, 2001). Cependant, la définition de Ashley (1988)
reste la plus utilisée avec une extension allant jusqu’à la couche la plus profonde des aquifères. La Figure 2 représente bien cette définition de la ZC qui sera le siège des interactions entre l’air, le vivant, le sol, l’eau et la lithosphère. La ZC représente une partie importante de la planète Terre regroupant toute sa surface sur une fine couche allant de la lithosphère à la basse atmosphère (Gaillardet et al., 2018). De ce fait, la ZC regroupe différentes disciplines telles que la géologie, la géophysique, la géochimie, la minéralogie, l’hydrologie, la biogéochimie, la pédologie, la géomorphologie, la microbiologie, l’écologie, la climatologie, … (Anderson et al., 2008 ; Brantley et al., 2016). A ces disciplines, il faudrait y rajouter toutes celles des sciences humaines et sociales puisque les êtres humains et les sociétés vivent également dans cette zone et l’influencent énormément par leurs activités.
22
Figure 1 : Carte Mondiale représentant les différents sites de la « Critical Zone Observatories » sur fond de GoogleMap et d’après les données de CZEN Site Seeker (www.czen.org) (A). Carte Mondiale et zoom sur la France des sites des observatoires du réseau OZCAR (B), d’après Gaillardet et al. (2018).
23
Figure 2 : Représentation de la Zone Critique. D’après Chorover et al., 2007 (Dessin de R. Indlimann).
2.2. L’intérêt de l’étude de la zone critique
L’enjeu principal de l’étude de la Zone Critique est d’améliorer la compréhension de la partie « habitable » de la Terre (Brantley et al., 2017). Pour améliorer nos connaissances sur cette interface de notre planète, une approche scientifique intégrée est nécessaire de par les différentes disciplines qui s’y rapportent. Pour résumé, l’objectif principal est de « mesurer, de comprendre et de simuler l’adaptation de la ZC d’une planète qui change dans un nouveau régime climatique » (Latour, 2018).
L’observation des phénomènes naturels permet également de définir l’impact anthropique sur la ZC. Cet impact peut se caractériser à des niveaux globaux comme la concentration de CO2 dans l’atmosphère ou encore le Changement Climatique, et doit être mis en relation avec
24
Perrin et al., 2008). D’un point de vue plus local, l’érosion des sols en contexte naturel vs. contexte anthropique, comme dans le cadre de l’activité agricole, a permis de montrer que, en fonction des pratiques agricoles, les taux d’érosion des sols peuvent augmenter plus ou moins fortement (Lal, 1994 ; Garcia-Ruiz, 2010 ; Sharma et al., 2011). De même, Il est important de montrer que la capacité de résilience de cette ZC permet aussi parfois de tamponner l’impact anthropique. Les rejets industriels de SO2 pendant les années 1970 ont
provoqué une hausse des concentrations de H2SO4 dans les précipitations et par conséquence,
une acidification des sols et des cours d’eau. Cependant, une large réduction de ces émissions a permis de diminuer ces concentrations en quelques décennies (Dambrine et al., 1995 ; Probst and Ambroise, 2019).
La Zone Critique est « l’habitat de la vie ». Elle constitue une source de nourriture pour les organismes en général (nutriments) et pour l’Homme en particulier (agriculture, pêche, etc.) et est une source d’eau potable. Elle rend aussi de nombreux services : elle régule la qualité et la quantité de ressources disponibles, nous protège et nous réchauffe (effet de serre et régulation des gaz à effet de serre) et enfin, elle est le siège de nombreuses activités de loisirs et de développement intellectuel. Elle participe également à l’amélioration de nos conditions de vie par la science bionique (exemple : invention du velcro). Enfin la ZC nous repose et nous apaise et permet de nous maintenir en bonne santé physique et mentale (Costanza et al., 1997 ; Haygarth and Ritz, 2009 ; Field et al., 2015 ; Bratman et al., 2019).
Au sein de la ZC, il existe de nombreux grands cycles biogéochimiques tels que ceux du carbone ou de l’azote qui vont interagir entre eux et contribuer au façonnement de cette fine pellicule de surface de la Terre.
3. Les cycles du carbone, de l’azote et l’importance du cycle de l’eau
Le carbone, l’azote et l’eau sont des éléments qui sont indispensables à la vie telle que nous la connaissons. Ils ont chacun leur propre cycle global qui peut se diviser en différents compartiments tels que l’atmosphère, la terre et les océans. Ces cycles ont varié au cours des temps géologiques et restent des composantes importantes de la Zone Critique.
25
3.1. Le cycle du carbone
Bien que le carbone ne soit pas l’élément le plus abondant sur Terre, il intervient dans les différents compartiments de la ZC, dans de nombreuses réactions du vivant et du non vivant. Il existe sous deux formes principales, une forme organique, généralement liée à d’autres éléments (hydrogène, etc.) produite par le réacteur biologique ; et une forme non-organique comme le CO2 ou le CaCO3. Le plus grand réservoir de carbone est la lithosphère (50.106 GtC)
puis les océans (38.103 GtC), la végétation (2,3.103 GtC) et l’atmosphère (590 GtC) (Figure 3).
3.1.1. La bimodalité temporelle du cycle du carbone
Le cycle du carbone peut être divisé en deux composantes temporelles : un cycle court qui va durer moins de 100 ans et un cycle long qui peut durer plusieurs millions d’années.
Le cycle court est constitué de deux processus biologiques : la photosynthèse, c’est-à-dire la transformation de CO2 (carbone inorganique) en carbone organique (matière organique) à
l’aide de l’énergie produite par le soleil ; la minéralisation, qui est le processus inverse, et dont la respiration fait partie, transforme le carbone organique (matière organique) en carbone inorganique (CO2). Sarmiento et Gruber (2002) ont montré que la respiration était de 59,6
GtC.a-1 pour les sols (Figure 3) , valeur très proche de celle (60,2 GtC.a-1 ) trouvée précédement
(Atjay et al., 1979 ; Roy et al., 2001). Cette valeur correspond à plus de 10% du stock de carbone pré-industriel de l’atmosphère, avec un temps de résidence du CO2 de 5 ans
(Schlesinger, 1997). Ce processus est également visible dans les échanges entre l’atmosphère et les océans avec une valeur de respiration légèrement plus importante de 70,6 GtC.a-1
26
Figure 3 : Le cycle global du carbone. Les chiffres en noir représentent les valeurs en carbone des différents réservoirs avant la révolution industrielle. Les chiffres en rouge correspondent aux évolutions des réservoirs de carbone depuis cette période. Les flèches noires représentent les flux de carbones naturels et les flèches rouges les flux de carbone anthropique. Les réservoirs sont exprimés en PgC (= GtC) tandis que les flux sont exprimés en PgC.a-1. D’après
Sarmiento and Gruber (2002)
Le cycle long du carbone concerne des processus géologiques qui vont participer à la création de ressources, au démantèlement et au façonnement des reliefs par érosion et altération. Dans le cadre de ce cycle long du carbone, la matière organique d’origine marine va être enfouie dans les sédiments, puis va subir des processus de dégradation (diagénèse) et de pyrolyse pour produire des huiles (pétrole), des gaz (CH4) et des résidus carbonés (graphite).
La matière organique terrestre composée essentiellement de débris végétaux va être enfouie par subsidence et subir des processus similaires pour former du charbon. Une partie du carbone organique va être érodée puis transportée par les fleuves sous forme dissoute et particulaire pour finir dans les mers et océans. Ce flux a été estimé à 0,38 GtC.a-1 (Ludwig et
27
Figure 4 : Le cycle long du carbone et les processus de ce cycle. D’après Gaillardet (2006).
Le carbone inorganique va pouvoir être précipité sous forme de carbonates mais surtout, existant principalement sous forme de silicates et de carbonates, il va subir les processus d’altération (Figure 4). Ce processus consiste à hydrolyser un minéral silicaté ou à dissoudre un minéral carbonaté avec l’acide carbonique qui est issu du CO2 atmosphérique. Ce processus
d’altération chimique des roches et de consommation de CO2 qui est étudié depuis le millieu
du 19ème siècle (Ebelmen, 1845), reste toujours au 21ème siècle (Golfier, 2001) un processus
très étudié. Les minéraux silicatés calciques et les minéraux carbonatés réagissent selon les équations suivantes :
CaAl2Si2O8 + 2H2O + 2CO2 → Al2Si2O5(OH)4 + Ca2+ + 2HCO3- Eq (I-1)
CaCO3 + H2O + CO2 → Ca2+ + 2HCO3- Eq (I-2)
Les ions hydrogénocarbonates qui sont ainsi obtenus sont ensuite transportés par les rivières et les fleuves pour finir dans les océans. Cette altération chimique des silicates et carbonates constitue donc un puit de CO2 atmosphérique. Cependant, l’altération des silicates consomme
deux fois plus de CO2 que l’atération des carbonates, car les 2 moles de HCO3 (pour une même
quantité de Ca2+ libéré) qui sont libérées dans l’équation I-1 sont toutes les deux issues du CO 2
28
atmosphérique alors que dans l’équation I-2, 1 seule mole de HCO3 est issue du CO2, l’autre
venant de la dissolution des carbonates (CO3).
De plus, la séquestration par précipitation de CaCO3 dans les océans (Figure 3 et 4) libère une
mole de CO2 (inverse de l’équation I-2). Ainsi la mole de CO2 nécessaire pour dissoudre des
carbonates sur les continents est compensée par la mole de CO2 libérée pour précipiter des
carbonates dans les océans. La boucle altération/précipitation des carbonates est donc fermée, ce qui entraine sur le long terme (356 Ma d’après Garrels et Perry 1974) un bilan nul en terme de puits/source de CO2. Dans le cadre de période de temps plus courte (10 000 ans),
l’altération des carbonates aura un impact immédiat sur la concentration de CO2 dans
l’atmosphère.
Ce processus d’altération des silicates et des carbonates dépend aussi de plusieurs facteurs : la nature de la roche mère avec un taux d’altération allant de la roche composée des minéraux les moins solubles (1 pour un granite), en passant par des carbonates (12), et en terminant par les roches composées des minéraux les plus solubles (80 pour les évaporites) (Meybeck, 1987) ; la température et le climat jouent un rôle important, notamment pour les carbonates, avec des concentrations moins élevées en HCO3- dans les rivières des climats chauds que dans
celles des climats froids (Ludwig et al., 1998) ; la lame d’eau écoulée, ou drainage, favorise l’altération et les exports des ions HCO3- ce qui limite la saturation du milieu lors de l’altération
des roches (Amiotte-Suchet et Probst, 1993) ; l’érosion mécanique joue aussi un rôle dans la mise au jour de la surface de roche et améliore l’altération chimique (Gaillardet et al., 1995). De plus, des valeurs d’érosion élevées entrainent une augmentation dans les taux d’altération des carbonates (Jacobson et al., 2003). Dans les milieux glaciaires et de très hautes montagnes, l’érosion par les flux d’eau des glaciers ainsi que l’éclatement dû à l’enchainement gel-dégel sont plus importants que les taux d’altérations (Anderson et al., 1997 ; Ruddiman, 1997) ; l’âge de la roche mère et des sols reste un facteur important, car une augmentation de l’âge d’un sol provoque une augmentation de sa profondeur et par conséquent un éloignement de la roche des processus d’érosion et d’altération (Hodson et al., 1998) ; le dernier facteur est la végétation et le microbiote du sol. La végétation entraîne un mécanisme de « pompe à proton » par la rhizosphère qui va favoriser l’altération (Hinsinger et al., 2003). De plus, la production des acides organiques va accelérer l’altération (Drever, 1994) et le développement de la rhizosphère va éroder mécaniquement le substrat (Lucas, 2001).
29
De nombreuses études ont rapporté des calculs de taux d’altération grâce aux estimations des concentrations de HCO3- dans les rivières (Amiotte-Suchet et Probst, 1993 ; Liu et Zhao, 2000).
Ces résultats ont permis la création de modèles (Amiotte-Suchet et al., 2003) pour estimer les quantités mondiales avec des flux annuels estimés à 0,14 et 0,29 Gt C-HCO3-/an pour les
silicates et les carbonates (Gaillardet et al., 1999).
Les différents réservoirs de carbones vont subir des variations de stock par des processus naturels qui vont entrainer des flux connus (Figure 3). Cependant, un facteur va venir perturber ce cycle naturel du carbone : les activités anthropiques.
3.1.2. L’impact anthropique
Les activités humaines vont entraîner la création de nouveaux flux de carbone entre les différents réservoirs (Figure 3). Cela va entrainer une hausse de la quantité de carbone présente dans l’atmosphère et contenue dans les océans. D’autres réservoirs vont quant à eux, diminuer leurs stocks de carbone comme les sols et les ressources sous-terraines (pétrole, charbon, etc.) (Figure 3). Les activités anthropiques telles que la déforestation, l’urbanisation, le transport, la combustion de combustibles fossiles pour produire de l’énergie et l’utilisation des terres par l’agriculture ont provoqué des émissions de CO2 et de CH4 dans l’atmosphère
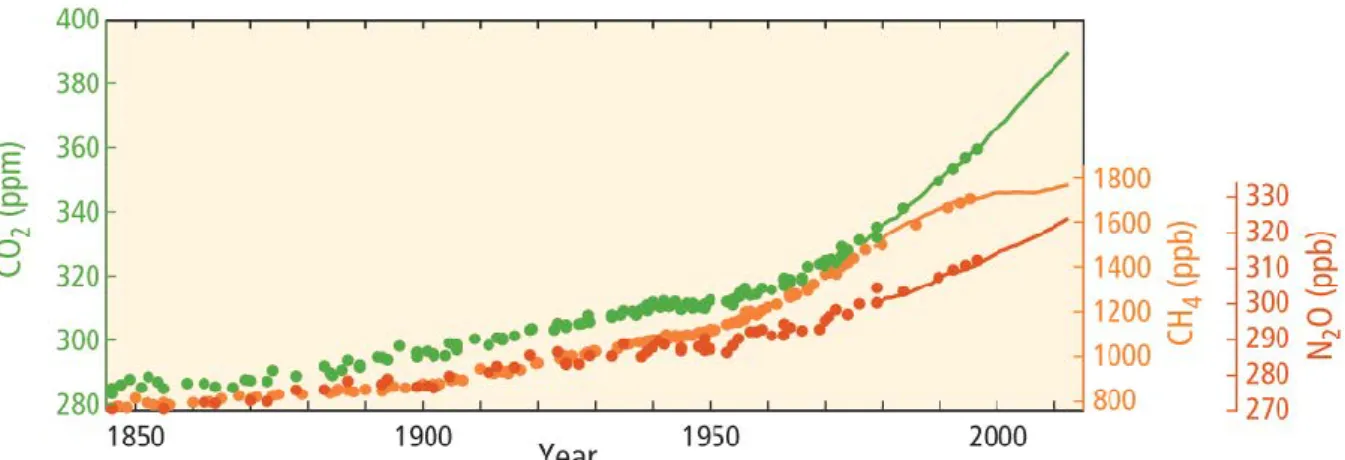
et sont la cause principale de l’augmentation de carbone dans ce réservoir (Figure 3 et 5). Alors que la concentration en CO2 dans l’atmosphère était de 280 ppm avant la révolution
industrielle, puis de 315 ppm lors du démarrage des mesures à Mauna Loa (Hawaï) en 1958 (Keeling, 1986), elle a ensuite dépassé les 400 ppm en 2015 et a atteint 410 ppm en 2019 (Figure 5). Les concentrations en CH4 ont doublé depuis la révolution industrielle. Le CO2 et le
CH4 étant des gaz à effet de serre, la hausse de leurs concentrations a entraîné une
augmentation des températures et est à l’origine du changement climatique (IPCC, 2014). La quantité de CO2 émise par les activités humaines a été estimée à 45 GtCO2-eq.an-12 en 2010.
Les pratiques agricoles ont été reconnues comme étant des facteurs d’augmentation des flux de bicarbonates dans le bassin versant du Mississippi (Raymond et al., 2018). Le changement d’occupation des terres, à savoir la déforestation pour la transformation en pâture ou en
2 CO
2 équivalence (CO2-eq) est une méthode de mesure des émissions de gaz à effet de serre qui prend en
30
champs libère le carbone stocké dans la végétation et dans les sols (Dotterl, 2013). De plus, l’érosion mécanique qui est provoquée par les pratiques agricoles comme le labour augmente la perte de sols et donc de carbone des sols qui va être transporté par les rivières (Lal, 1994). De plus, le changement d’occupation des sols par la déforestation pour la création de cultures entraine une érosion des sols plus importante (Sharma et al., 2011). A cela s’ajoute que les pratiques agricoles entraînent l’émission de CO2 par l’élevage de bétail (FAO, 2014) à hauteur
de 7,1 GtCO2.a-1 (FAO, 2013a) soit environ 14,5% des émissions de GES produites par l’homme.
Figure 5 : Concentrations atmosphériques des gaz à effet de serre : CO2 (en vert), CH4 (en
orange) et N2O (en rouge) déterminées par des carottes de glaces (points) et par des relevés
(lignes). D’après IPCC (2014).
Toutes les émissions humaines de CO2 ne restent pas dans l’atmosphère. Environ 30% d’entre
elles sont captées par les océans par la dissolution du CO2 dans l’eau. Cette augmentation a
provoqué une augmentation de l’alcalinité dans les lacs et rivières du Nord-Est de l’Europe et de l’Amérique du Nord (Stoddard et al., 1999). De plus, l’élévation des concentrations de CO2
a provoqué une acidification de la surface des océans qui a perdu 0,1 pH depuis la révolution industrielle (Hoegh-Guldberg et al., 2014). L’évolution du pH et des concentrations en CO2
dissous des océans provoque un changement dans les zones de saturation de la calcite et de l’aragonite, ce qui affecte de nombreux organismes marins comme les planctons ou les coraux (Dove et al., 2013). La compréhension du cycle du carbone et les perturbations anthropiques qui l’affectent ont permis de montrer l’importance de son existence et surtout le besoin de ne
31
pas le perturber d’avantage au risque d’affecter toute la biosphère terrestre et marine, y compris l’homme. Cependant, le cycle du carbone n’est pas le seul qu’il faille surveiller, car d’autres cycles sont importants et peuvent entrer en interaction avec ce dernier et entrainer de nouvelles perturbations.
3.2. Le cycle de l’azote
L’azote est l’un des éléments les plus abondants sur la Terre et des plus essentiels à la vie. On le retrouve dans les différents compartiments de la ZC notamment dans l’atmosphère où il est le composé majoritaire (Figure 6).
Figure 6 : Le Cycle global de l’azote. Les flèches bleues représentent les flux de carbone des océans et les marrons les flux des continents. La taille des réservoirs est exprimée en TgN (=1012g =MtC) tandis que les flux sont exprimés en PgC.a-1. D’après Hillis et al (2012).
32
3.2.1. Le cycle naturel
L’atmosphère est composée à 78% d’azote, principalement sous forme de diazote (N2). Il est
très peu réactif dû à la liaison triple entre ses deux atomes d’azote, mais de l’azote peut être fixé à partir de ce N2 grâce à des processus biologiques (bactéries, algues, légumineuses…) ou
encore anthropiques (méthode de Haber-Bosh de transformation du N2 en NH3 ou NO ou NO2
pour utilisation industrielle ou agricole) (Stumm et Morgan, 1996). De ce fait, la part disponible pour les organismes provient des formes plus accessibles comme les nitrates ou l’ammonium. Les interactions entre les compartiments se font essentiellement à partir des réactions chimiques de transformations de l’azote. Ce cycle part de la fixation de N2 en azote organique
(Norg) qui pourra subir une ammonification, une nitrification et une dénitrification pour redevenir du N2 (Figure 7). Les deux principales transformations en milieu naturel sont la
fixation de l’azote atmosphérique et la dénitrification des nitrates qui sont contenus dans les océans et les sols (Figure 6). Cependant, depuis la révolution industrielle, le flux de fixation de l’azote, qui représentait 89% (au début du XXème siècle) du flux total de transfert d’azote
depuis l’atmosphère, a diminué à moins de 50% (à la fin du XXème siècle) alors que le flux total
de transfert depuis l’atmosphère a doublé (Green et al., 2004). L’augmentation du flux total de transfert d’azote depuis l’atmosphère s’explique par l’arrivée des flux d’origine anthropique, avec la fixation industrielle et agricole par la technique de Haber-Bosh, mais aussi par l’augmentation des dépôts atmosphériques provenant des émissions de la combustion de ressources fossiles ou des pratiques agricoles (Figure 6).
Figure 7 : Processus de transformation de l’azote et ses différentes déclinaisons. Norg correspond à l’azote organique.
33
3.2.2. L’impact de l’agriculture moderne dans le cycle de l’azote
Depuis la révolution industrielle, les flux anthropiques d’azote sont devenus majoritaires (Figure 6) et la quantité de fertilisants azotés qui est utilisée dans l’agriculture ne fait qu’augmenter (Figure 8). Cette augmentation provient principalement des pays émergents fortement peuplés tel que la Chine et va continuer à augmenter dans le futur dans ces mêmes pays, mais également, dans les pays d’Afrique qui ne sont, pour le moment, pas de gros consommateurs de fertilisants azotés (FAO, 2014 ; IPCC, 2014 ; Lu et Tian, 2017).
Figure 8 : Evolution temporelle des flux d’azote (N) utilisés par an en TgN (=1012g =MtC). Nfer
tot correspond au flux total. Nfer avg correspond au flux par unité de surface cultivée. Le diagramme circulaire montre les proportions de fertilisant azotés utilisés dans les 5 plus grands pays consommateurs en 2013. D’après Lu et Tian, 2017.
Les apports de fertilisants azotés et le développement de l’élevage ont entrainé une augmentation des émissions de N2O (gaz à effet de serre) des sols vers l’atmosphère
(Breitenbeck et al., 1980). Ces émissions de N2O n’ont fait qu’augmenter depuis la révolution
industrielle (Figure 5). De plus, une libération de NH4+ et de NO3- des sols vers les eaux a
entrainé de nombreux développements d’algues dans les cours d’eau, les lacs et les océans. Ces efflorescences algales (algal bloom) provoquent une eutrophisation de l’eau (une diminution de l’oxygène dissous dans l’eau) et une anoxie qui fait mourir de nombreuses espèces aquatiques. De nombreuses études font état de cette eutrophisation des lacs Nord-Américains et Européens (Conley et al., 2008) et le développement de cyanobactéries, qui
34
peuvent être toxiques (Diaz et Rosenberg, 2008), ainsi que la création de zones mortes (Dead Zone) côtières qui sont réparties près des estuaires des grands fleuves mondiaux (Altieri et Gedan, 2015). Ce phénomène ne dépend pas uniquement de l’azote, il dépend également des quantités de phosphore qui sont présentes et qui vont contrôler l’eutrophisation de lacs (Schindler et al., 2008). L’interaction entre les cycles de ces deux éléments a permis de mieux comprendre les processus d’eutrophisation des lacs et des zones mortes.
3.2.3. Les interactions entre les cycles du carbone et de l’azote dans un contexte agricole
L’impact anthropique des pratiques agricoles sur chacun des cycles de C et de N a été démontré précédemment. Cependant, ces cycles interagissent déjà au niveau naturel du fait de leur importance dans le cycle naturel de la vie. Les rapports carbone-azote (C/N) dans les milieux marins et terrestres influencent les organismes et la production biologique (Sterner et Elser, 2002), ce qui va avoir des conséquences sur la production et l’absorption de CO2
atmosphérique (Gruber et Galloway, 2008). De plus, la maîtrise des interactions entre le carbone et l’azote dans les sols agricoles permet de réduire l’accumulation temporaire d’azote dans ces sols et donc de réduire les pertes dans l’environnement (Recous et al., 2017). Le contrôle de ces interactions dans le système sol-plante permet de mieux gérer la minéralisation et la stabilisation de la matière organique et donc les pertes en carbone des sols (Aita, 1996 ; Recous et al., 2017).
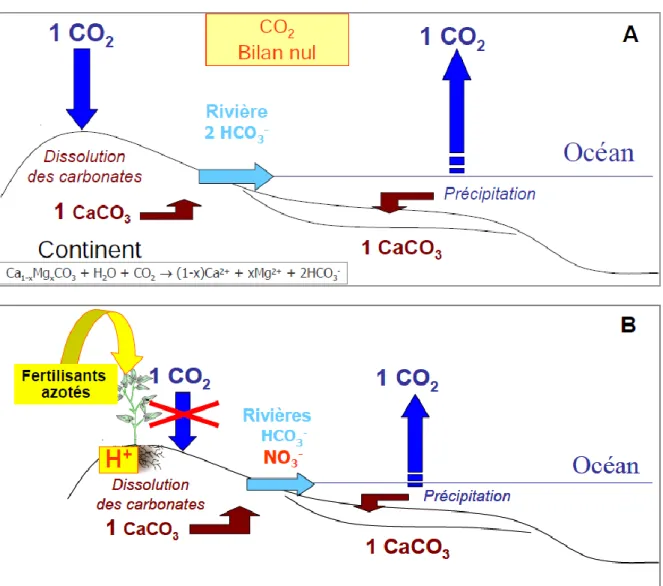
Depuis quelques années, des études ont commencé à s’intéresser à l’impact d’autres acides que l’acide carbonique sur la dissolution des carbonates (Faurie, 1977 ; Semhi et al, 2000). Perrin et al. (2008) a montré que l’apport de fertilisants azotés libérait des protons (H+)
(Gandois et al., 2011) selon l’équation Eq (I-3). Ces protons vont permettre la dissolution des carbonates selon l’équation Eq (I-4) et ils vont remplacer dans cette équation ceux de l’acide carbonique H2CO3 (équation Eq (I-2)).
NH4+ + 2O2 → NO3- + H2O + 2H+ Eq (I-3)
35
La Figure 9 permet de mieux comprendre le cycle de consommation de CO2 par la dissolution
des carbonates, puis la libération du CO2 par la précipitations des carbonates. Cependant,
l’apport de fertilisants azotés provoque une dissolution de carbonates sans consommation de CO2 tandis que la précipitation des carbonates libère, quant à elle, toujours du CO2. Cette
pertubation dans le cycle du carbone entraine un déséquilibre qui a été estimé entre 1,6 et 3,8% du CO2 mondial qui aurait pu être consommé à la place des protons relachés par les
fertilisants azotés (Perrin et al., 2008). De plus, la dissolution des carbonates par les fertilisants azotés pourrait représenter 30% de la dissolution totale pour le bassin versant du Girou (Probst, 1986), mais aussi jusqu’à 13% des flux d’export dans les océans de Ca2+ + Mg2+ pour
le bassin versant de la Garonne (Sehmi et al., 2000).
Ces flux de calcium, de magnésium, de bicarbonates ou encore de nitrates sont dépendants de la quantité d’eau drainée (Amiotte-Suchet et Probst, 1993) de même que l’eutrophisation des zones cotières puisque le transport de ces éléments s’effectue par les rivières. Il y a donc un cycle important qui n’a pas encore été évoqué et dont dépendent ces différentes interactions, c’est le cycle de l’eau.
36
Figure 9 : Schéma de la dissolution naturelle des carbonates dans le cycle du carbone (A) vs. la dissolution anthropique due aux fertilisants azotés (B). D’après Probst et Brunet (2005), Perrin et al. (2006) et repris par Perrin (2008).
3.3. Le cycle de l’eau
La planète Terre est connue sous le nom de planète bleue car elle est composée de 70% d’eau en surface. Cependant, seulement 2,5% de ce volume correspond à de l’eau douce qui est stockée dans des nappes profondes difficilement accessibles ou dans des glaciers. Une quantité infime d’eau est donc disponible pour l’Homme, pour qui l’eau est une ressource vitale puisqu’il en est composé à 65%. De plus, les besoins en eau de l’humanité ne se réduisent pas uniquement à la consommation directe d’eau. L’agriculture (production de
37
nourriture) et l’industrie (fabrication d’objets) en consomment également. Bien connaître et bien maîtriser le cycle de l’eau sont donc indispensables à l’être humain et à ses activités.
3.3.1. Le fonctionnement du cycle de l’eau
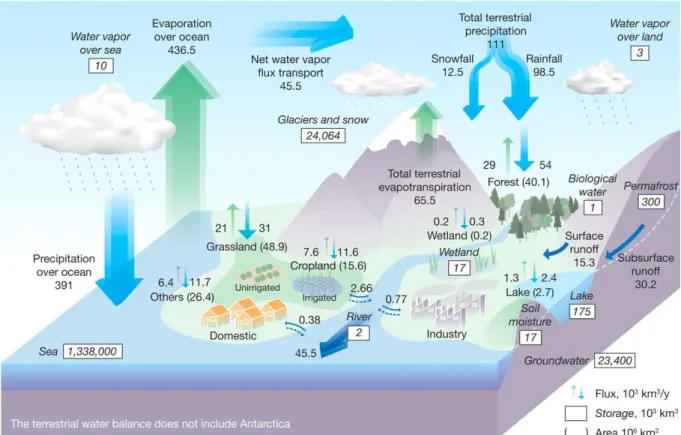
La Figure 10 permet de montrer les différents réservoirs d’eau et les différents flux entre ces réservoirs. L’océan est le réservoir le plus important et subit des processus d’évaporation dont les flux sont supérieurs aux précipitations, ce qui va permettre de transférer cet excédent (45500 km3.a-1) des océans vers les continents, en passant par l’atmosphère. Ce transport de
vapeur d’eau et l’eau évapotranspirée au-dessus des continents, vont permettre d’obtenir des précipitations. Sur les continents c’est donc l’inverse, on a un excédent de précipitations qui génère un écoulement vers les océans via les rivières (Oki et Kanae, 2006). Les précipitations ne sont pas réparties équitablement et varient géographiquement (selon les régions climatiques) mais aussi temporellement (années humides/sèches et saisons). La vapeur d’eau atmosphérique constitue une ressource non exploitable directement. Bien que son stock d’eau soit faible (13000 km3), elle permet de nombreux échanges de flux. La vapeur d’eau fait
partie des gaz à effet de serre mais elle possède un temps de résidence dans l’atmosphère faible (10 jours). Elle n’est donc pas considérée comme un paramètre de forçage contrairement au CO2 (Boé, 2007).
Cependant, le changement climatique (CC) risque d’impacter le cycle de l’eau au niveau des flux entre compartiments, mais aussi dans les réservoirs (fontes des glaciers). Les rapports successifs du GIEC (Groupement Inter-gouvernemental de l’Etude du Climat, IPCC en anglais), montrent que le CC va impacter les systèmes physiques (glacier, permafrost, lac, rivière, l’érosion des côtes ; les risques d’inondation, sécheresse, augmentation du niveau marin), les systèmes biologiques (écosystèmes terrestres et marins ; les risques d’incendies) ainsi que les systèmes humains (habitats, santé, économie et production de nourriture) (IPCC, 2014). Le cycle de l’eau est important pour toutes les raisons évoquées précédemment, mais l’eau constitue également le principal vecteur des échanges entre les différents compartiments de la Zone Critique et notamment au travers des rivières (Giardino et Houser, 2015). Avec le CC, les flux d’eau écoulés par les fleuves, des continents vers les océans, ont tendance à augmenter (Probst et Tardy, 1987 et 1989 ; Labat et al,2004) et la fréquence des évènements
38
de crue, qui sont responsables des transferts d’éléments dans les cours d’eau, a aussi tendance à augmenter (Kundzewicz et al., 2017).
Figure 10 : Cycle global de l’eau. Les rectangles représentent les réservoirs (103 km3), les flèches
représentent les flux (103 km3.a-1), les parenthèses représentent des surfaces (106 km²). Le flux
des nappes est inclus dans celui des rivières. D’après Oki et Kanae, 2006.
3.3.2. Un cycle porteur d’interactions
Les flux qui permettent le transfert le plus important d’eau sur les continents sont les précipitations (111000 km3.a-1) et les écoulements de surface (ruisseaux, rivières et fleuves)
(45500 km3.a-1 dont 30200 km3.a-1en sub-surface/souterrain et 15300 km3.a-1en surface)
(Figure 10). Ces flux d’eau sont les principaux modes de transport des éléments et ils régissent notamment les cycles du carbone et de l’azote qui ont été détaillés précédemment.
Les précipitations se forment à partir de noyaux de condensation (Triplet et Roche, 1986) qui peuvent être naturels (poussières, pollens) mais aussi anthropiques (particules provenant des émissions humaines) (Sicard, 2006). Les gouttes d’eau des précipitations contiennent des
39
particules et des gaz qui vont retomber vers le sol en récupérant d’autres éléments et d’autres molécules. Ce phénomène s’appelle le lessivage et il est le plus efficace pour le « nettoyage » de l’atmosphère. Ces précipitations sont considérées comme des dépôts humides et sont, par exemple, à l’origine de pluies acides issues des émissions anthropiques (Galloway et al., 1995 ; Probst et Ambroise, 2019). Il existe aussi des précipitations sèches ou dépôts secs qui consistent au dépôt par gravité de particules agrégées dans l’atmosphère. Ces dépôts peuvent être constitués d’espèces chimiques ou d’éléments issus d’une mobilisation ou émission locale, comme la remobilisation des fertilisants épandus dans un bassin versant agricole (Pascaud, 2013). Mais ils peuvent aussi avoir parcourus de longues distances, tel est le cas des poussières sahariennes qui peuvent être déposées en France (Loye-Pilot et al., 1986), ou des cendres volcaniques d’une éruption qui peuvent faire le tour de la planète (Shroder et Papale, 2015). L’eau issue des précipitations contenant ces éléments va au sol être évaporée, évapotranspirée, s’accumuler dans des réservoirs, mais elle va aussi interagir avec les différents compartiments de la ZC (organismes vivants, sols, sous-sols, roches…) et finalement s’écouler vers les océans.
40
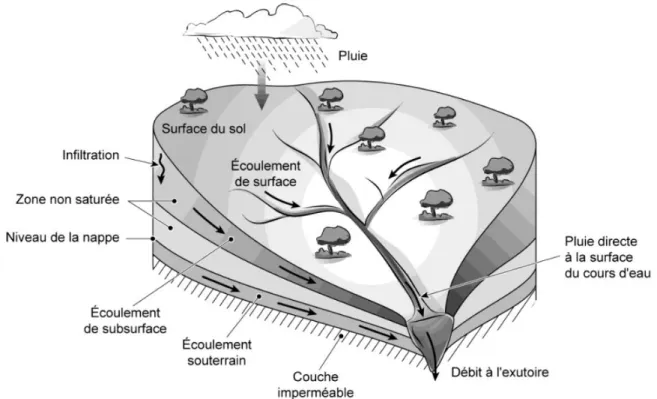
Dans un bassin versant (zone géographique drainée par un cours d’eau, ses affluents et sous-affluents et délimitée par la ligne de partage des eaux), les écoulements de l’eau au sol vont dépendre de paramètres tels que : la végétation, la topographie, les propriétés physiques et chimiques du sol (Jozef, 1998). Une fois au sol, l’eau va pouvoir ruisseler, s’infiltrer et créer un écoulement de sub-surface, ou s’infiltrer plus profondément pour créer un écoulement souterrain (Figure 11). Lors de ce trajet, l’eau va interagir avec les différents compartiments qui sont traversés et va se charger en ions provenant notamment de la végétation, et plus largement, des organismes vivants, des sols, et de la roche mère. Ces écoulements vont permettre de transporter le carbone organique des sols issu de la production biologique (Ludwig et al., 1996a), mais aussi du carbone inorganique issu de la dissolution des carbonates et de l’hydrolyse des silicates (ainsi que les ions associés) (Meybeck, 1987) hors du bassin versant vers les océans. De plus, Il a été montré que les taux de dénudation chimique des carbonates dépendaient directement de la lame d’eau écoulée (Liu et Zhao, 2000).
Le cycle de l’azote est, lui aussi, dépendant du cycle de l’eau et de ses écoulements. Les précipitations vont permettre de récupérer les molécules azotées qui sont présentes dans l’atmosphère, tandis que les écoulements vont permettre de contrôler les réactions de nitrification et de dénitrification qui sont dépendantes des quantités d’eau et d’oxygène présentent dans le sol (Weier et al., 1993).
Le cycle de l’eau permet la connexion entre les autres grands cycles, mais il permet aussi le transport de composés sous formes dissoutes et particulaires des continents vers les océans. Identiquement aux autres cycles, celui de l’eau est perturbé par les nombreuses activités anthropiques dont les modifications directes par les aménagements des cours d’eau (Giardino et Houser, 2015). Par exemple, la construction de barrages va entrainer des modifications dans les flux particulaires en créant un bassin de rétention des sédiments et des contaminants associés qui pourront être remobilisés lors des hautes eaux du cours d’eau (Benabdelkader et al., 2018). Le transport de nutriments va également affecter la production primaire des lacs et des fleuves in situ ainsi qu’à leurs embouchures, ce qui peut provoquer les phénomènes d’eutrophisation, d’efflorescence algale et de zones mortes.
Ce transport ne s’effectue pas de manière homogène au cours du temps. Le débit d’un cours d’eau, et donc le flux d’éléments exportés par celui-ci, varie temporellement suivant des cycles
41
saisonniers, annuels et interannuels. De plus, les transferts d’eau et d’éléments sont largement dominés par un évènement hydrologique majeur : la crue.
3.3.3. L’importance des crues
La crue est l’évènement pendant lequel le débit d’un cours d’eau est maximal. Une crue est généralement la conséquence d’importantes précipitations sur un bassin versant (Figure 12). Elle commence lorsque le débit augmente et se termine à la fin de la courbe de tarissement. La crue est dépendante de la géographie (pentes, surface), de la géologie, de la climatologie (notamment la durée et l’intensité de l’évènement pluvieux), du type d’utilisation des sols, de la végétation et de l’état de saturation en eau des différents réservoirs avant la crue (Anderson et Burt, 1978 ; Ambroise, 1999). En effet, la teneur en eau dans les réservoirs d’un bassin versant permet de contrôler l’intensité d’une crue (Hewlet, 1961 ; Linsley, 1967). Selon ces différents paramètres, une crue va avoir un impact plus ou moins important sur le transport de matière dissoutes ou particulaires.
Les crues de fortes intensités sont à l’origine d’une érosion importante des sols (Auzet, 1987 ; Dotterl, 2013). Lors de ces épisodes, le transport de matière dissoutes et particulaires atteint son maximum. Idir (1998) a pu montrer que sur le site du Strengbach, les crues représentaient 77% de la lame d’eau écoulée et entre 68 et 92% des flux dissous des éléments majeurs. Un bassin versant agricole peut exporter 57% de son flux de nitrates pendant les crues (Darwiche-Criado et al., 2015). Dans un grand bassin versant comme celui de la Garonne amont (9980 km²), une seule crue peut être à l’origine de 25% (69000 t en 9 jours soit 32 kg.km-2.h-1) des
exportations annuelles en MES. (Probst et Bazerbachi, 1986). Dans un bassin versant agricole de petite taille (3,28 km²) comme celui d’Auradé, une crue peut être à l’origine de 86% (94,5 t) de l’exportation annuelle de MES dans un temps très court (16h) soit 1,8 t.km-2.h-1 (Roussiez
et al., 2013).
Un cours d’eau, par sa composition chimique, permet de déterminer la géologie/lithologie d’un bassin versant et les pratiques anthropiques qui sont développées sur celui-ci (Stumm et Morgan, 1996). L’étude d’une crue, notamment de son transport de matière, permet aussi d’appréhender les réservoirs d’origine des éléments au sein d’un bassin versant (Probst, 1983). Certains éléments majeurs ont pour origine un compartiment spécifique du bassin
42
versant. Ainsi, le sodium et le chlore proviennent généralement des précipitations qui se sont formées à partir des eaux d’évaporation des océans (Meybeck, 1986). Le calcium et le magnésium sont généralement issus de l’altération des carbonates présents sur le bassin versant tandis que la silice provient de l’altération des silicates (Stumm et Morgan, 1996).
Figure 12 : Hydrogramme de crue et hyétogramme de précipitations
Le découpage d’un hydrogramme de crue en ses différentes composantes hydrologiques permet de mettre en évidence les contributions des différents compartiments dans les flux de matière qui sont exportées par un cours d’eau. Cette séparation des différentes composantes de l’écoulement fluvial s’effectue principalement selon deux méthodes : le découpage graphique, utilisant la loi de Maillet sur la courbe décrue (Maillet, 1905) ; le découpage chimique, utilisant comme traceur des éléments chimiques (Idir, 1998) ou isotopiques (Kendall et McDonnell, 1998). Ces découpages permettent généralement de mettre en évidence trois compartiments qui ont des écoulements bien spécifiques : l’écoulement de surface ;
43
l’écoulement hypodermique (qui provient des sols) et l’écoulement de nappe. Les contributions relatives de ces écoulements au débit total et aux flux du cours d’eau peuvent ainsi être calculées.
La relation entre la concentration chimique des éléments et le débit du cours d’eau pendant une crue (relation C-Q) va permettre de mettre en évidence différents processus hydrologiques au sein du bassin versant (Toler, 1965). Cette relation peut former graphiquement une boucle ou hystérésis. La forme et le sens de rotation de celle-ci, procure des informations sur les concentrations des écoulements provenant des réservoirs qui ont contribué au débit du cours d’eau lors de la crue (Evan et Davies, 1998). La comparaison des relations C-Q de plusieurs crues permet de classer ces dernières en différents groupes. Ces groupes montrent des relations avec les cycles saisonniers de la végétation et du climat ainsi qu’avec les conditions initiales du bassin versant (remplissage des réservoirs) (Johnson et East, 1982).
44
45
1. Site d’étude : le bassin versant du Montoussé
1.1. Contexte du site
Figure 13 : Carte de localisation du Bassin Versant d’Auradé dans le Gers, France. Cette carte représente l’utilisation des terres agricoles de l’année 2008-2009
Le bassin versant du Montoussé à Auradé, se situe dans le Gers à 30km à l’Ouest de Toulouse (Fig. 13). Le Montoussé est un affluent de la Boulouze qui se jette dans la Save, affluent rive gauche de la Garonne. La surface du bassin versant du Montoussé est de 328ha, pour une altitude maximale de 268m et minimale de 172m (à l’exutoire) avec une pente moyenne de 9% (pour une pente maximale de 29%). Il est caractérisé par des vallées et collines qui sont orientées NO/SE. Ce site a fait l’objet d’études depuis 1985 par le groupe AZF (AZote Fertilisant) Toulouse de la société Grande Paroisse (aujourd’hui GPN-TOTAL) pour le suivi de la concentration en nitrates dans la rivière en lien avec le débit afin d’évaluer les pertes d’intrants azotés liées aux ajouts de fertilisants par les agriculteurs. Depuis 2004, la surveillance et l’expertise scientifique du site ont été prises en charge par le laboratoire EcoLab en collaboration avec GPN-TOTAL jusqu’en 2011. Sur la période 1985-2004, la Direction Régionale de l’Environnement (DIREN) a effectué les mesures en continu des hauteurs d’eau du Montoussé. Le bassin versant a aussi fait l’objet de suivis par la Fédération Régionale de Défense contre les Ennemis des Cultures (FREDEC devenue FREDON) ainsi que
46
du Groupe Régional d’Action pour la réduction de la pollution de l’eau par les produits Phytosanitaires (GRAMIP) dans les années 1990.
En 1992, les agriculteurs du site ont créé l’Association des Agriculteurs du bassin versant d’Auradé (AAA) pour mettre en place une agriculture raisonnée basée sur de meilleures pratiques culturales avec un suivi des pratiques agricoles et la création de bandes enherbées. Cette mise en place des premières bandes enherbées (d’une largeur de 8m et composée de fétuque) en France le long du Montoussé, a été récompensée par le 1er prix de la fondation
Pierre Sarazin. En 1995, l’AAA a aussi implanté 3000m de haies et 1500 peupliers le long des cours d’eau. Depuis 2013, l’association s’est étendue à plus de 14 communes et a pris pour nom « le Groupement des Agriculteurs de la Gascogne Toulousaine (GAGT) ». En 2017, elle a reçu le 2ème prix de la fondation Pierre Sarrazin pour la mise en place de semis direct (qui limite
le travail du sol) et de cultures inter-rang (ou relay-cropping, qui permet de mettre en place une 2nd culture pour garder un couvert végétal toute l’année).
Ce site a fait partie du SOERE (Système d’Observation et d’Expérimentation au long terme pour la Recherche en Environnement) RBV (Réseau des Bassin Versants) depuis 2010, et est intégré aujourd’hui dans l’infrastructure de Recherche nationale OZCAR (Observatoire de la Zone Critique : Applications et Recherche) depuis sa mise en place en 2017. Il est l’un des sites de la zone atelier PYGAR (Pyrénées-Garonne) qui fait partie de l’infrastructure de Recherche nationale RZA (Réseau des Zones Ateliers). A l’échelle européenne, OZCAR et RZA sont inscrits sur la feuille de route de l’ESFRI eLTER (European Strategy Forum on Research Infrastructures, Europan Long Term Ecological Research).
1.2. Hydro-Climatologie du bassin versant
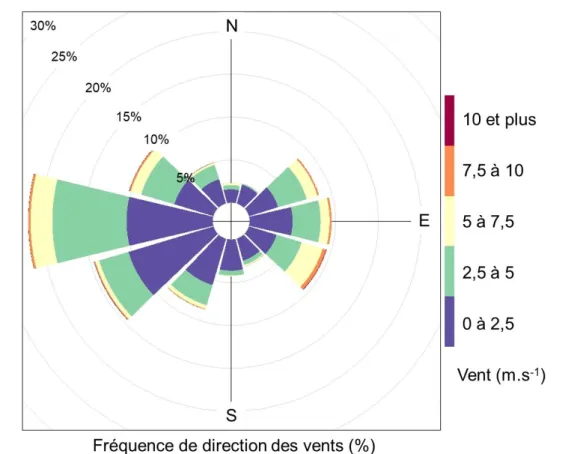
Le climat de la région des coteaux de Gascogne est tempéré et est soumis majoritairement aux influences océaniques. Les vents dominants sont des vents d’Ouest, Nord-Ouest qui proviennent de l’Océan Atlantique (pour 45% pour le quart Ouest pour les années de 2016-2018) et le vent d’Autant (Vent d’Est, Sud-Est) qui provient de la mer méditerranée (28% pour
47
le quart Est pour les années de 2016-2018) (Figure 14). Le capteur d’orientation du vent de la station météorologique du bassin versant étant défectueux, ces données proviennent de la Station météorologique du CESBIO (Centre d’Etudes Spatiales de la Biosphère) située à 1km du bassin versant du Montoussé.
Figure 14 : Rose des vents de la station météorologique du CESBIO à Auradé pour les années 2016-2018.
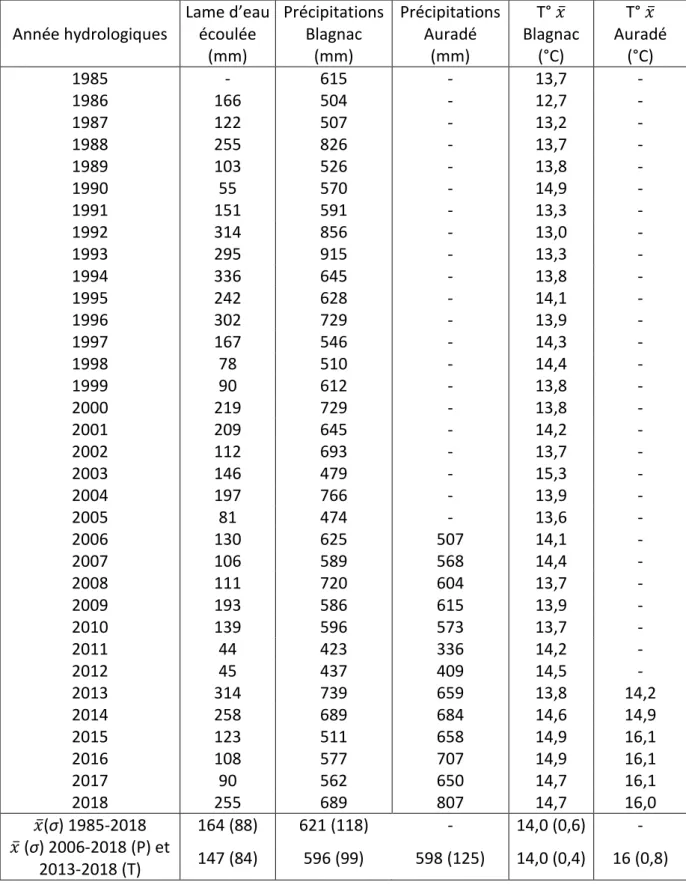
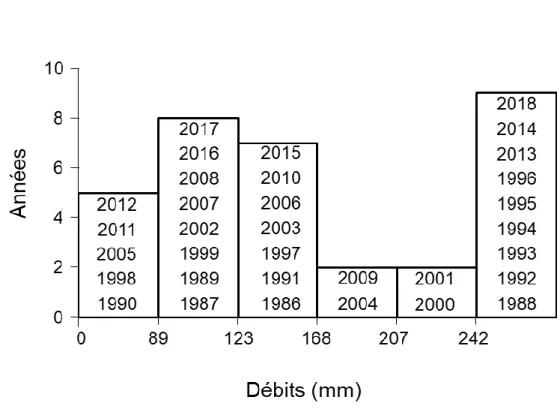
Les précipitations moyennes des années hydrologiques (période allant du 1er octobre au 30
septembre) sont de 621 ±118 mm et une température annuelle calendaire moyenne de 14,0 ±0,6 °C pour la période 1985-2018. Ces données de précipitations et de température pour la période 1985-2018 proviennent de la station météorologique de Blagnac, à 30km d’Auradé, administrée par Météo-France. Ces données remontent sur une plus grande période temporelle que celle de la station météorologique du bassin versant du Montoussé