ii ÉTUDE DE LA SYNERGIE ENTRE LA TOMATIDINE ET LES AMINOSIDES ENVERS
STAPHYLOCOCCUS AUREUS ET MÉCANISMES DE RÉSISTANCE
par
Jean-Philippe Langlois
mémoire présenté au Département de biologie en vue de l’obtention du grade de maître ès sciences (M.Sc.)
FACULTÉ DES SCIENCES UNIVERSITÉ DE SHERBROOKE
iii Le 22 juillet 2019
le jury a accepté le mémoire de Monsieur Jean-Philippe Langlois dans sa version finale.
Membres du jury
Professeur François Malouin Directeur de recherche Département de biologie
Professeure Viktor Steimle Évaluatrice interne Département de biologie
Professeur Pascale B. Beauregard Président-rapporteur Département de biologie
iv SOMMAIRE
Dans un contexte mondial de résistance aux antibiotiques, il est urgent de poursuivre la recherche et le développement de nouvelles classes d’antibiotiques. La tomatidine (TO), un alcaloïde stéroïdien issu de la tomate, est une molécule qui possède une activité antibiotique contre le phénotype small-colony variant (SCV) des Bacillales. Ces variants sont principalement caractérisés par la formation de colonies de petite taille, de leur croissance lente, de leur production de biofilm accrue et par une réduction de la production d’exoenzymes et de toxines. Toutefois, elle n’a pas d’activité contre les souches protoypes. Il a été montré précédemment que la TO cible la sous-unité c de l’ATP synthétase et inhibe la production d’ATP. Une synergie entre TO et la gentamicine (GEN), un aminoside, a également été démontrée. Il demeure toutefois à déterminer par quel mécanisme TO est en mesure de tuer les bactéries et la raison derrière la synergie observée.
Mon projet de maîtrise vise la compréhension des mécanismes d’action de ces antibiotiques afin de permettre la suite des études précliniques. Dans un premier temps, l’hydrophobicité de surface a révélé que les souches SCV résistantes à la TO sont moins hydrophobes. La TO étant une molécule hydrophobe avec son corps stéroïdien, il est probable qu’une surface moins hydrophobe limite les interactions et procure un certain niveau de résistance. Inversement, il a été observé qu’une augmentation de l’hydrophobicité de la surface accompagne une légère augmentation de la résistance à la combinaison TO-GEN chez les souches prototypes. Dans ce dernier cas, comme il s’agit de souches prototypiques, elles sont naturellement résistantes à la TO et posséder une haute hydrophobicité limiterait les interactions avec GEN qui est hydrophile. Puisque TO cible l’ATP synthétase, et donc la chaîne de transfert des électrons (CTE), elle a un impact sur le potentiel membranaire des souches cibles (SCV ou prototype), peu importe leur niveau de résistance. Toutefois, on observe une inhibition de la croissance lorsque le potentiel membranaire chute sous la barre des 2% du potentiel membranaire de la souche prototypique. La combinaison TO-GEN n’affecte pas plus le potentiel membranaire, lorsque comparé à GEN seulement. Par ailleurs, l’import d’aminoside est augmenté en présence de TO ce qui explique
v la synergie entre TO et GEN. Finalement, TO et la combinaison TO-GEN induisent la production d’espèces réactives de l’oxygène (ROS) à 4X la CMI pour les souches sensibles seulement. Fait intéressant, GEN seule engendre une production significative de plus de ROS qu’à partir de 8X la CMI. Ces observations ont permis de déterminer que TO agit sur les SCV en inhibant le potentiel membranaire et en induisant la production de ROS. De plus, il a aussi été possible d’établir la synergie observée entre TO et GEN est attribuable à une augmentation de l’import des aminosides et une production importante de ROS.
Mots clés : Tomatidine, SCV, antibiotiques, Chaîne de transport des électrons, S. aureus, aminoside, Espèces réactives de l’oxygène.
vi REMERCIEMENTS
Je voudrais tout d’abord remercier mon directeur de recherche, François Malouin pour son accueil dans son laboratoire lors de mes stages puis ma maîtrise. Il a toujours été de bon conseil et m’a permis de me développer professionnellement.
Je voudrais aussi remercier mes conseillers, Pascale Beauregard et Viktor Steimle pour leur implication dans le projet par leurs conseils et leur temps. Merci pour leurs protocoles et leur savoir-faire technique.
Je remercie aussi Maxime Lamontagne-Boulet qui a été mon mentor durant mes stages et qui m’a introduit au projet « tomatidine » au cours de sa maîtrise. Un gros merci aussi à tous les membres du laboratoire, autant passé que présent, avec qui j’ai pu discuter des problèmes et défis rencontrés. Ils m’ont été d’une grande aide autant technique que théorique. Je remercie aussi Isabelle Guay qui m’a fourni les souches nécessaires à mon projet.
Ce projet n’aurait pu se dérouler sans le support financier de Fibrose Kystique Canada et du CRSNG et l’implication de l’Université de Sherbrooke.
Finalement, je remercie ma famille qui a toujours cru en moi et pour leur support et encouragement. Un merci particulier à ma conjointe pour sa compréhension et pour qui j’aurais voulu être plus disponible.
vii TABLE DES MATIÈRES
Sommaire ... iv
Remerciements ... vi
Liste des abréviations ... x
Liste des tableaux ... xii
Liste des figures ... xiii
Chapitre 1 Introduction générale ... 1
1.1 Problématique de la résistance aux antibiotiques et l’importance de Staphylococcus aureus ... 1
1.1.1 Présentation de la problématique ... 1
1.1.2 Importance clinique de Staphylococcus aureus ... 1
1.2 Phénotypes de S. aureus et susceptibilité aux antibiotiques ... 2
1.2.1 Particularités des small-colony variant ... 2
1.2.2 Chaîne respiratoire ... 4
1.2.3 Structure de l’ATP synthétase ... 5
1.2.3.2 Potentiel membranaire et génération de celui-ci ... 8
1.2.4 Impacts de l’anaérobiose sur S. aureus ... 9
1.3 Antibiotiques ... 11
1.3.1 Les Aminosides ... 11
1.3.1.1 L’utilisation clinique des aminosides ... 11
1.3.1.2 Mécanismes d’entrée des aminosides ... 13
1.3.2 Inhibiteurs de l’ATP synthétase ... 16
1.3.3 La tomatidine... 17
viii
1.3.5 Hypothèses et objectifs de la recherche ... 23
Chapitre 2 ... 25
Mise en contexte ... 25
Bactericidal activity of the combination of tomatidine and aminoglycoside against virulent and persistent Staphylococcus aureus. ... 27
Abstract ... 28
Introduction ... 29
Methods ... 31
Strains and growth conditions ... 31
Generation of S. aureus WT mutants resistant to the TO-gentamicin (TO-GEN) combination ... 33
Whole-genome sequencing, assembly, and annotation. ... 33
Antibiotic susceptibility testing ... 34
Cell surface Hydrophobicity ... 34
Membrane potential measurement ... 35
Reactive oxygen species (ROS) quantification ... 35
GEN uptake assay ... 35
Time-kill kinetics ... 36
Statistical analyses ... 36
Results ... 36
Antibiotic susceptibility profiles ... 36
TO and TO-GEN combination resistant strains exhibit a modified cell surface hydrophobicity ... 37
ix
TO does not influence the membrane potential when combined with GEN ... 40
TO increases GEN uptake ... 44
TO and the TO-GEN combination are bacteriostatic under anaerobic conditions ... 45
Discussion ... 46 Conclusion ... 49 Funding... 50 Acknowledgements ... 50 Transparency declarations ... 50 References ... 51 Chapitre 3 ... 57 Chapitre 4 ... 61 Conclusion générale ... 61 Contributions supplémentaires ... 62
Annexe 1 : Article scientifique publié dans « Antimicrobiol Agents and Chemotherapy ».. 62
x LISTE DES ABRÉVIATIONS
GEN : gentamicine
TO : tomatidine
Cipro : ciprofloxacine
ROS : « reactive oxygen species », espèce réactive de l’oxygène
µg : microgramme
µl : microlitre
ml : millilitre
S. aureus : Staphylococcus aureus SCV : Small-colony variant
UFC : Unité formatrice de colonies
CMI : concentration minimale inhibitrice
SARM : Staphylococcus aureus résistant à la méthicilline
CTE : Chaîne de transport des électrons
Pi : Phosphate inorganique
xi ADP : Adénosine diphosphate
DCCD : N,N′-Dicyclohexylcarbodiimide
CCCP : Carbonyl cyanide 3-chlorophenylhydrazone
xii LISTE DES TABLEAUX
Chapitre 2
xiii LISTE DES FIGURES
Chapitre 1
Figure 1 Différences entre S. aureus prototypique et SCV p. 17
Figure 2 Cytochrome, voies alternatives et inhibiteurs de la chaîne de transport des électrons de S. aureus
p. 19
Figure 3 Structure et sous-unité de l’ATP synthétase bactérienne p. 21
Figure 4 La morphologie de S. aureus dépend entre autres de la disponibilité de l’oxygène
p. 24
Figure 5 Structure de la gentamicine p. 26
Figure 6 Structure de l’ATP synthétase et site de liaison des inhibiteurs p. 30
Figure 7 Structure de la tomatidine p. 32
Figure 8 Schématisation de la production de ROS induite par les antibiotiques et le mécanisme par lequel ils endommagent les bactéries
p. 34
Chapitre 2
Figure 9 Surface hydrophobicity of S. aureus grown under anaerobic conditions (C) in relation to TO or TO-GEN MICs
xiv Figure 10 Membrane potential of (A) S. aureus Newbould and non-target
species in presence of TO. (B) S. aureus in presence of TO under anaerobic conditions, (C) S. aureus ATCC 29213 and the combination-resistant mutant membrane potential and (D) S. aureus ATCC 29213 membrane potential in presence of GEN alone or in combination with TO 8µg/ml.
p.56
Figure 11 ROS production in S. aureus induced by (A) tomatidine or (B) the TO(8µg/ml)-GEN combination.
p.58
Figure 12 (A) GEN uptake by S. aureus ATCC 29213 and TO-GEN resistant mutants over a 2h-period and (B) relative GEN uptake in presence of TO 8µg/ml.
p.60
Figure 13 Kill kinetics of (A) S. aureus Newbould ΔhemB in presence of the TO, and of (B) S. aureus Newbould in presence of TO-GEN combination, under aerobic (colored lines) and anaerobic (black lines) conditions.
1 CHAPITRE 1
INTRODUCTION GÉNÉRALE
1.1 Problématique de la résistance aux antibiotiques et l’importance de Staphylococcus aureus
1.1.1 Présentation de la problématique
La résistance aux antibiotiques représentera une menace plus grande que le cancer d’ici 2050 et sera responsable de la mort de millions de personnes. L’Organisation Mondiale de la Santé a d’ailleurs identifié six pathogènes comme dangers immédiats, nommées ESKAPE, pour Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, et Enterobacter spp, sont les principaux agents causals des infections nosocomiales (Rice 2008; Santajit and Indrawattana 2016). Ces bactéries peuvent acquérir des résistances aux antibiotiques de diverses façons. La première est directement liée au traitement antibiotique. En effet, durant le traitement, il peut survenir des mutations spontanées qui modifient la cible de l’antibiotique utilisé et ainsi rendent la bactérie plus résistante. Cette bactérie est alors en mesure de croître dans un milieu autrement hostile et rend le traitement inefficace. La seconde méthode de développement de la résistance aux antibiotiques est par la transmission horizontale de gènes de résistance. Cette transmission peut se faire par l’entremise de plasmides contenant les gènes ou par l’incorporation dans le génome d’îlots de pathogénicité (Santajit and Indrawattana 2016; Lowy 2003).
1.1.2 Importance clinique de Staphylococcus aureus
S. aureus est un pathogène opportuniste qui affecte particulièrement les personnes avec une immunité compromise. Il est aussi responsable de nombreuses infections nosocomiales. S. aureus peut causer diverses pathologies dont des infections de la peau, des intoxications alimentaires, des syndromes de chocs toxiques ainsi que des infections pulmonaires pour ne
2 nommer que celles-là (Tong et al. 2015). Il est d’ailleurs devenu le pathogène le plus prévalent parmi les patients atteints de fibrose kystique, une maladie affectant la densité du mucus dans les poumons et conséquemment l’efficacité du système immunitaire (“Cystic Fibrosis - 2015 Registry Annual Report”). Toutefois, une forme résistante de S. aureus a émergé et est maintenant capable d’infecter des individus sains, S. aureus résistant à la méthicilline (SARM) (Liu 2009). Cette souche est résistante aux β-lactames grâce à une mutation dans le gène mecA qui est responsable de la synthèse de la penicillin binding protein 2a (Ubukata et al. 1989). De plus, cette souche de S. aureus peut posséder de multiple résistance et devient donc un pathogène très difficile à traiter et peut entraîner la mort des patients (David and Daum 2010; Kaur and Chate 2015).
1.2 Phénotypes de S. aureus et susceptibilité aux antibiotiques
1.2.1 Particularités des small-colony variant
S. aureus peut aussi adopter deux phénotypes distincts lors d’une infection. Le premier phénotype est dit prototypique et est associé avec la virulence normale de la bactérie. Le second est le phénotype petite colonie, ou SCV (small-colony variant), qui est un phénotype de persistance (Proctor et al. 2006). Ces SCV sont entre autres retrouvés chez les patients souffrant d’infection chronique à S. aureus, comme c’est le cas chez les personnes atteintes de fibrose kystique. Le premier phénotype est le prototype. C’est un phénotype standard au niveau de la croissance. Il produira normalement ses facteurs de virulence, telle l’hémolysine-α, et ne formera que peu de biofilm et n’aura pas tendance à vivre de façon intracellulaire (Novick 2003). Les SCV sont tout le contraire des prototypes au niveau de leur phénotype. En effet, ils ne produisent que peu d’exoenzymes et de toxines, ont une croissance plus lente, forment du biofilm et ont tendance à s’internaliser dans les cellules de l’hôte (Fig. 1) (Mitchell et al. 2010; Sendi and Proctor 2009; Proctor et al. 2006).
3 Figure 1. Différences entre S. aureus prototypique et SCV (modifié de Mitchell G. et Malouin F., 2012)
Ce qui cause ces différences majeures est généralement une mutation dans un gène responsable dans la biosynthèse de l’hémine ou de la ménadione. Ces gènes sont impliqués ultimement dans la formation du cytochrome c ou des ménaquinones respectivement (von Eiff et al. 1997; Clements et al. 1999). Certaines souches SCV récupérées sont aussi déficientes dans la synthèse de la thymidine (Proctor et al. 2006). Dans le cas présent, les mutations ayant un impact sur la CTE, sur la biosynthèse de l’hémine ou sur celle de la ménadione, sont les plus pertinentes. Comme l’intégrité de la CTE, les SCV verront aussi leur potentiel membranaire diminué grandement par rapport à la souche prototypique (Baumert et al. 2002; Miller et al. 1980). Il a aussi été montré que ces souches produisent moins d’ATP (Lamontagne Boulet et al. 2018). Pour ce qui est des impacts au niveau de la résistance aux antibiotiques, les SCV sont résistants aux aminosides (Mitchell et al. 2011a). Finalement, en clinique, ce phénotype est souvent retrouvé chez les patients fibrose kystique et est associé à la persistance de la bactérie dans les poumons, même après un traitement antibiotique. De plus, comme ces patients sont traités en
4 prophylaxie avec la tobramycine, un aminoside, il y a sélection des SCV et donc persistance de l’infection (Kahl et al. 2003; Cystic Fibrosis - 2015 Registry Annual Report).
1.2.2 Chaîne respiratoire
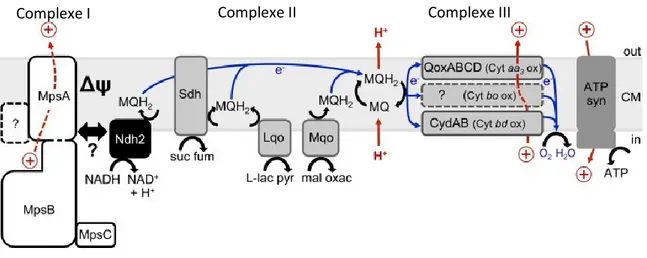
La CTE chez S. aureus est composée de complexes, variables selon les conditions environnementales, qui ont comme fonction de générer un potentiel membranaire par l’exclusion de cations ou de transférer des électrons (Hammer et al. 2013; Voggu et al. 2006). L’accepteur final d’électron sera l’oxygène, lorsqu’il est présent. La respiration aérobie sera préférée par S. aureus puisqu’elle est plus rentable énergétiquement que la fermentation, utilisée en anaérobiose (Hammer et al. 2013). Les premiers et deuxièmes complexes sont composés de déshydrogénases. Le premier est la NADH déshydrogénase de type II couplé avec la protéine MpsABC, qui est une pompe à proton. Chez S. aureus, la NADH déshydrogénase ne possède pas la partie transmembranaire qui permet normalement à la NADH déshydrogénase de type I d’oxyder le NADH et de pomper le proton résiduel à la fois (Sena et al. 2015). Le complexe II est une succinate déshydrogénase. Elle permet de transformer le succinate en fumarate et de léguer un électron à une ménaquinone (Cook et al. 2014). D’ailleurs, chez S. aureus, tout comme pour les autres bactéries à Gram positif, les seules quinones retrouvées sont des ménaquinones. Chez les bactéries à Gram négatif, on retrouve à la fois des ménaquinones et des ubiquinones (Somerville and Proctor 2009; Shibata and Kobayashi 2001). Les ménaquinones sont des transporteurs d’électrons mobiles qui permettent le transit entre les déshydrogénases, les cytochromes et finalement à l’oxygène lors de la synthèse de l’ATP (Zamboni and Sauer 2003). Le complexe III n’est pas le cytochrome oxydase c comme c’est le cas chez les bactéries n’ayant pas de chaîne de transport branché comme S. aureus. Le complexe III est plutôt composé d’autres cytochromes et transporteurs d’électrons qui sont parfois associés à des molécules plus grosses et moins mobiles. Il existerait un cytochrome o (à confirmer) qui constituerait le complexe IV dans la CTE. Toutefois, il y aurait deux voies de contournement. La première est constituée du cytochrome oxydase aa3 (QoxABCD). Cette voie contourne le cytochrome o et
permet d’oxyder l’oxygène directement. La seconde voie débute avec les ménaquinones et contourne le cytochrome c pour oxyder directement l’oxygène. Le cytochrome oxydase bd
5 (cydAB) est le principal constituant de cette voie. Finalement, la CTE se termine par l’ATP synthétase qui permet de faire entrer les protons précédemment expulsés pour former une molécule d’ATP et de réduire l’oxygène en eau (Fig. 2) (Voggu et al. 2006; Götz, Bannerman, and Schleifer 2006; Taber and Morrison 1964; Thöny-Meyer 1997).
Figure 2. Cytochrome, voies alternatives et inhibiteurs de la chaîne de transport des électrons de S. aureus (modifié de Mayer et al. 2015)
1.2.3 Structure de l’ATP synthétase
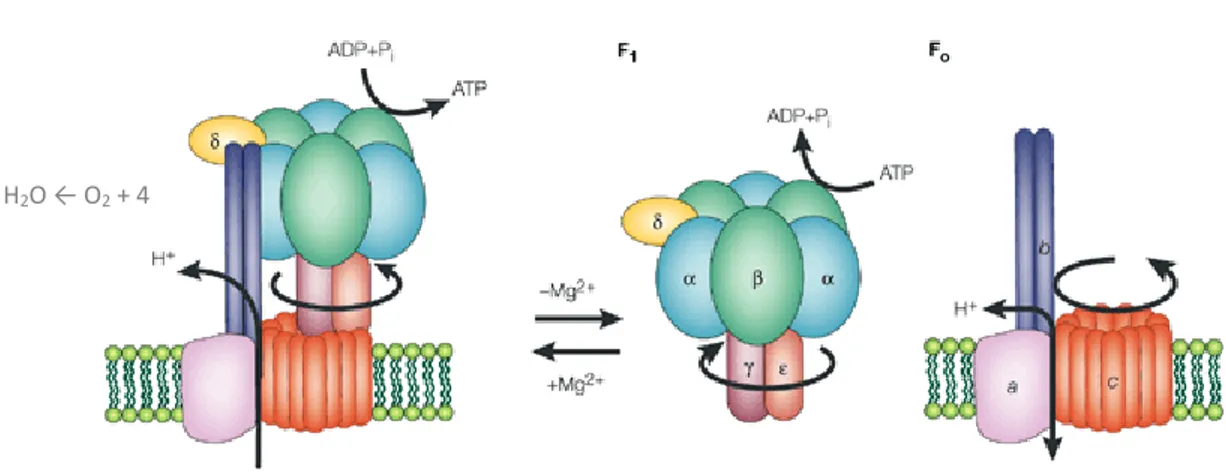
La structure de l’ATP synthétase bactérienne est composée de 2 fractions majeures. La fraction soluble dans l’eau, F1, et la fraction qui s’ancre dans la membrane, Fo. La partie F1 est composée
des sous-unités α3β3γδε et la partie Fo des sous-unités ab2c10 (Gupta et al. 2014). Une autre
distinction possible à faire dans l’ATP synthétase est la partie du stator et la partie du rotor. Le stator est responsable d’éviter la co-rotation du rotor et du site catalytique. Il est composé des sous-unités α3β3δab2 (Ahmad and Laughlin 2010; Weber 2006; Senior, Nadanaciva, and Weber
2002). Le rotor permet un changement conformationnel de la sous-unité F1 et du site catalytique
ce qui permet la formation d’ATP et est composé des autres sous-unités, soit γεc10 (Fig. 3)
(Yoshida, Muneyuki, and Hisabori 2001). De façon plus précise, dans le stator, la sous-unité α est une sous-unité de régulation en arrangement successif avec la sous-unité β. Cette structure hexagonale est composée de 3 sous-unités α et 3 β successives et forme 3 sites catalytiques de
6 liaison d’un nucléotide. Les trois sites sont nommés βTP, βDP, βE et sont responsables respectivement de la liaison à l’ATP, à l’ADP et au Pi (Leslie and Walker 2000). Les sous-unités δ et b2 s’assemblent pour former la tige périphérique et maintenir la structure formée par
les sous-unités α3β3 avec la sous-unité a (Weber 2006). La dernière partie du stator est composé
de la sous-unité a qui est la portion statique de la machinerie de translocation du proton au travers la membrane (Rastogi and Girvin 1999).
Le rotor est composé de la sous-unité γ. Cette partie mobile change de conformation lors du passage d’un proton et permet le changement dans l’angle de la sous-unité β (Ahmad and Laughlin 2010). Cela permet séquentiellement d’exposer le Pi, puis de mettre l’ADP et le Pi en contact. Finalement dans le la partie βTP l’ATP est relarguée. Chaque changement de conformation requiert un proton et un tour complet est fait à l’aide de 4 protons (Kustos et al. 2003)ku. La sous-unité ε est essentielle à l’assemblage de la partie Fo avec la partie F1 (Feniouk,
Suzuki, and Yoshida 2006). La sous-unité c est la partie formant le rotor de l’enzyme. La rotation commence par cette structure composée de 12 sous-unités c pour former un baril. Le résidu Asp 61 de la sous-unité c est en contact avec la sous-unité a et perd alors son proton. Cette forme déprotonée de l’Asp 61 subira un changement conformationnel qui permettra d’attacher un proton provenant de l’extérieur de la cellule. Le proton pourra entrer en contact avec l’Asp61 grâce au gradient de proton de part et d’autre de la membrane cytoplasmique. Une fois l’Asp 61 protoné, il y aura un autre changement conformationnel qui produira une rotation de cette sous-unité, et par conséquent l’assemblage du rotor. La nouvelle sous-unité c qui entrera en contact avec la sous-unité a sera déprotonée et ainsi de suite (Rastogi and Girvin 1999).
Pour récapituler, un proton entrera en contact avec le résidu déprotoné Asp 61 de la sous-unité c. Cela entraînera un changement de conformation et une rotation de celle-ci. Une nouvelle sous-unité c entrera en contact avec la sous-sous-unité a et le résidu Asp 61 de la première sous-sous-unité sera déprotonée. Ce proton sera ensuite transloqué vers la sous-unité γ. Cette dernière fera une rotation partielle et entraînera l’ouverture de la section βP de l’hexamère α3β3. Un second proton
fera encore tourner la sous-unité γ et refermera partiellement la section βP et ouvrira partiellement la section βDP. Cela permettra le contact entre le Pi et l’ADP. Un troisième proton
7 transloquera le Pi et l’ADP dans la troisième section βTP où l’ATP sera formée. Finalement un quatrième proton expulsera l’ATP et restaurera l’état initial de l’hexamère α3β3. Avec les
protons entrés dans la cellule, une molécule d’eau sera formée grâce à la molécule d’O2 oxydé
avec 2 électrons issus de la CTE (Fig. 3).
Figure 3. Structure et sous-unité de l’ATP synthétase bactérienne (modifié de Yoshida, Muneyuki, and Hisabori 2001)
Par contre, il reste beaucoup à apprendre sur la chaîne respiratoire particulière de S. aureus. L’ATP synthétase décrite est celle d’Escherichia coli et il est assumé qu’elle représente un bon modèle pour l’ATP synthétase bactérienne. Au moment d’écrire ce mémoire, il n’y avait pas encore de structure cristal disponible de l’ATP synthétase pour S. aureus. Il nous reste aussi à découvrir comment S. aureus est en mesure de générer et conserver l’activité de sa CTE, et par conséquent son potentiel membranaire, en condition anaérobie. La structure et l’organisation de la CTE restent aussi mystérieuses, en particulier en ce qui a trait aux cytochromes et à ses voies alternatives. Par exemple, il reste encore à déterminer s’il y a ou non un cytochrome oxydase o comme oxydase terminale.
8 1.2.3.2 Potentiel membranaire et génération de celui-ci
Afin de générer de l’ATP, la bactérie a besoin d’une force proton motrice qui permettra l’entrée de protons dans la cellule via l’ATP synthétase. La force proton motrice (Δp) peut être disséquée en deux parties, soit le gradient de proton (ΔpH) et le potentiel membranaire (ΔΨ). La force proton motrice peut être calculée selon la formule suivant : 𝛥𝑝 = 𝛥𝛹 + 2.3𝑅𝑇/𝐹𝛥𝑝𝐻; Où R est la constante des gaz, T la température absolue et F la constante de Faraday. Chez les bactéries, le pH intracellulaire est hautement contrôlé. Cela leur permet de prospérer sur une vaste gamme de pH environnementaux. Aussi, en l’absence d’un potentiel membranaire, il n’y a pas de génération d’ATP par l’ATP synthétase. C’est pourquoi, le gradient de proton est généralement ignoré lorsque l’on parle de la force proton motrice. Pour cette raison, la section suivante traitera du potentiel membranaire en assimilant la notion de force proton motrice (Dimroth, Kaim, and Matthey 2000).
Les rôles du potentiel membranaire sont multiples chez les bactéries. Par exemple, un groupe a démontré que le potentiel membranaire influe directement sur la division cellulaire en modulant la distribution cellulaire de protéines comme minD et ftsA (Strahl and Hamoen 2010). Comme S. aureus possède un NADH déshydrogénase de type II, il lui faut deux protéines distinctes pour oxyder le NADH, en provenance du cycle de Krebs, et exporter le proton produit de la bactérie. La protéine qui sert à l’exclusion du proton est le complexe MpsABC. La partie MpsA est la partie transmembranaire qui transloque le proton vers l’extérieur. MpsB est la partie cytoplasmique et possède un domaine de liaison aux métaux. La dernière partie MpsC est encore de fonction inconnue. Ce domaine protéique est aussi en mesure de transporter d’autres cations, tel Na+, vers l’extérieur de la cellule. Cela permet entre autres de maintenir et de contrôler à la
fois le potentiel membranaire et le gradient de proton de part et d’autre de la membrane cytoplasmique. Le groupe ayant décrit ce complexe a prouvé l’importance de ce domaine en faisant la mesure du potentiel membranaire de mutant de MpsABC. Ils ont découvert qu’en l’absence de celui-ci, le potentiel membranaire était réduit de plus de la moitié. Plus en aval de la CTE, ils ont constaté que la consommation d’oxygène était grandement diminuée, ce qui indiquerait un ralentissement de l’activité de l’ATP synthétase et que, par conséquent, l’absence
9 de ce complexe induit un phénotype ressemblant à celui d’un SCV (Mayer et al. 2015). S. aureus est aussi en mesure d’expulser des protons avec la réduction d’une ménaquinone en ménaquinol. Lors de la réoxydation du ménaquinol, les deux protons impliqués dans sa réduction seront envoyés vers l’extérieur de la cellule.
Finalement, les cytochromes jouent aussi un rôle dans la translocation de certains cations, aidant ainsi à conserver et générer un potentiel membranaire adéquat (Thöny-Meyer 1997). Bref, le potentiel membranaire est essentiel chez les bactéries afin de produire l’ATP étant donné que le gradient de proton est strictement contrôlé pour survivre à des variations de pH. C’est pourquoi S. aureus possède plusieurs voies pour réguler à la fois le gradient de proton et le potentiel membranaire via l’expulsion de proton ou de divers cations.
1.2.4 Impacts de l’anaérobiose sur S. aureus
Comme S. aureus est une bactérie anaérobie facultative, elle est en mesure d’adapter son métabolisme à l’absence d’oxygène. Cela vient au coût d’une certaine efficacité puisque la bactérie ne pourra plus se fier à son système le plus efficace pour régénérer de l’énergie, soit la CTE avec l’oxygène comme accepteur final d’électrons (Hammer et al. 2013). Cela aura donc pour effet qu’une souche au phénotype prototypique adoptera un phénotype semblable au SCV (Fig. 4).
10 Figure 4. La morphologie de S. aureus dépend entre autres de la disponibilité de l’oxygène.
Phénotypes de S. aureus NewbouldΔhemB (A) et S. aureus Newbould (B) en aérobie et de S. aureus NewbouldΔhemB (C) et S. aureus Newbould (D) en anaérobie
Un groupe a étudié la transcriptomique de S. aureus en absence d’oxygène (Fuchs et al. 2007). Ils se sont principalement intéressés aux gènes liés à la génération d’énergie. Les gènes du métabolisme en présence d’oxygène, comme la pyruvate déshydrogénase, ont été, sans surprise, moins exprimés puisque ces réactions sont dépendantes de la présence d’oxygène. Ils ont également observé la surexpression des gènes liés à la fermentation, comme la lactate déshydrogénase ou les importés d’acides aminés et de peptides (Nakano, Zuber, and Sonenshein 1998; Proctor et al. 2014).
11 1.3 Antibiotiques
1.3.1 Les Aminosides
1.3.1.1 L’utilisation clinique des aminosides
Les aminosides, que l'on appelle également des aminoglycosides, sont des antibiotiques à large spectre (“Aminoglycosides - Infectious Diseases - Merck Manuals Professional Edition”). Le premier antibiotique de cette classe à être découvert a été la streptomycine. En effet, suite à la découverte de la pénicilline et sa production de masse lors de la Seconde Guerre mondiale, il y a eu un grand intérêt pour le développement de nouveaux antibiotiques afin de répondre au besoin grandissant (Renneberg et al. 2008; Torok, Moran, and Cooke 2009). Les microorganismes du sol en furent la principale source. L'équipe de Waksman (Waksman and Woodruff 1941) qui étudiait les actinomycètes a isolé une souche ayant la capacité de produire un composé qui inhibait la croissance des bactéries en empêchant la synthèse protéique (Murray, Schraufnagel, and Hopewell 2015). De façon plus générale, les aminosides sont composés d’un sucre avec des groupements amines (-NH2) liés à un glycoside et sont chargés positivement (Fig.
12 Figure 5. Structure de la gentamicine (PubChem -https://pubchem.ncbi.nlm.nih.go )
Les aminoglycosides sont utilisés en clinique pour plusieurs types d’infections. Ils sont utilisés dans les cas de pneumonie, septicémie, infections urinaires graves et d’infections de la peau, par exemple. En bref, il est indiqué de les administrer dans les cas d’infections par des bactéries aérobies. Ils peuvent être appliqués de façon topique ou injecté intra musculairement ou par voie intraveineuse. De plus, comme ces antibiotiques ne sont pas absorbés par les intestins, ils peuvent être utilisés dans les cas d’infections du tractus digestif. Dans les cas d’infections plus sévères, ils peuvent être combinés à un antibiotique fragilisant la synthèse de la paroi cellulaire, comme les β-lactames, ces derniers facilitant l’accès à la membrane cytoplasmique pour les aminosides (Krause et al. 2016). Les aminosides ne sont toutefois pas sans effets secondaires. L’effet le plus fréquent est la néphrotoxicité qui découle directement de la charge positive de l’antibiotique. Il y a une liaison entre les membranes, chargées négativement, des cellules des tubules proximaux dans les reins. Les aminosides sont alors en mesure d’entrer dans les cellules et de s’accumuler dans le cytoplasme. Cela cause ultimement une production de radicaux libres et une dysfonction des mitochondries (Oliveira, Cipullo, and Burdmann 2006). Afin de suivre l’évolution de l’atteinte rénale, des échantillons de sang sont pris régulièrement au cours du traitement afin de vérifier le taux de filtration glomérulaire via le dosage de la créatine et l’urée.
13 La présence de plus de protéine dans les urines est un indicateur de la néphrotoxicité (Gerlach et al. 2011). Le deuxième effet secondaire d’importance est l’ototoxicité des aminosides. L’atteinte vestibulaire est réversible, mais l’atteinte auditive ne l’est pas. Les aminosides persistent dans le sérum pour 2 à 3 heures, mais dans les muscles, il peut y avoir persistance pour des semaines, voire des mois. Tout comme dans le cas de la néphrotoxicité, les cellules foliaires sont sujettes à la destruction par les aminosides et les radicaux libres qu’ils engendrent. La perte de l’audition permanente est causée par un dérangement de la liaison entre les poils cochléaires et les neurones afférents via une stimulation du récepteur NMDA. Ces récepteurs sont situés sur les poils cochléaires et sont responsables de la mémoire et de la plasticité synaptique (Leis, Rutka, and Gold 2015; Hiel et al. 1992). De façon plus rare, il peut y avoir un blocus musculaire. Toutefois, cet effet secondaire n’est fréquent que chez les patients atteints de myasthénie, une maladie auto-immunitaire neuromusculaire. Les premières manifestations sont une faiblesse musculaire et respiratoire. Les aminosides bloquent les canaux calciques voltage-dépendant des neurones moteurs. Cet effet peut être remédié avec des injections IV de calcium (Prayle et al. 2010; Paradelis et al. 1988; Parsons, Obaid, and Salzberg 1992).
1.3.1.2 Mécanismes d’entrée des aminosides
La cible des aminosides, le ribosome 30S, se situe à l’intérieur de la cellule bactérienne. Les aminosides causent des défauts dans la transcription des protéines, bloquent leur synthèse ou brisent les polysomes (Chang and Flaks 1972). De façon intéressante, les aminosides possèdent un fort effet post-antibiotique, c’est-à-dire qu’ils conservent leur action antibactérienne malgré des taux sériques sous les concentrations minimales inhibitrices grâce à leur fort lien avec le ribosome (Isaksson et al. 1993, 1988). Mais tout d’abord, il faut donc que l’antibiotique pénètre les défenses physiques qui protègent la bactérie de son environnement. La structure des couches de la surface de la bactérie est à l’origine de la résistance et susceptibilité naturelle aux aminosides. Chez les bactéries à Gram positif, il faudra donc passer le peptidoglycane, plus épais que chez les bactéries à Gram négatif, et la membrane interne. Pour les bactéries à Gram négatif, il y aura 2 membranes, externe et cytoplasmique, séparées par une couche de peptidoglycane, plus mince que chez les bactéries à Gram positif. Pour les bactéries à Gram
14 négatif, la membrane externe est poreuse face aux molécules chargées (Hancock et al. 1991). Les aminosides, molécules chargées positivement, sont alors en mesure de pénétrer cette première barrière à l’aide d’une voie dite hydrophile par l’intermédiaire de pores d’eau chargés (Taber et al. 1987). Ces porines laissent passer les molécules de petite taille. Par exemple, des molécules qui sont plus petites que 600-650g/mol pour les Entorobacteriacea (Nikaidos 1994; Hancock et al. 1991). La GEN fait 477g/mol et la streptomycine, 581g/mol. Il est donc possible, pour ces deux aminosides, de pénétrer la membrane externe grâce à ces porines. Elles font le lien et permettent le passage de molécules entre la membrane externe et le peptidoglycane en étant associé à des lipoprotéines de Braun, qui sont ancrés dans le peptidoglycane, ou des complexes protéiques liés au peptidoglycane. De plus, cette voie d’entrée de la première barrière est indépendante de la structure du LPS. Le peptidoglycane ne procure pas de défense efficace contre les aminosides, mais un affaiblissement de ce dernier par des β-lactames, par exemple, peut accroître l’efficacité des aminosides. Pour les bactéries à Gram positif, la charge positive des aminosides déplace les ions Mg2+ associés à l’acide téichoïque et permet un accès au
peptidoglycane. L’hypothèse selon laquelle le rôle moins prépondérant du peptidoglycane dans l’entrée des aminosides dans les bactéries est renforcé par le fait que les bactéries à Gram négatif ne sont généralement qu’un peu plus sensibles aux aminosides que les bactéries à Gram positif (“Practical Antimicrobial Therapeutics” 2017). Finalement, la dernière défense, commune aux bactéries à Gram négatif et positif, est la membrane cytoplasmique. L’antibiotique est en mesure de traverser cette membrane grâce au gradient de proton généré par la CTE (Dianne, And, and Epstein 1981).
L’entrée des aminosides dans les cellules bactériennes se fait en trois étapes. La première phase, décrite en partie dans la section précédente, est la phase ionique. C’est une phase qui est indépendante de l’énergie. Cette phase se produit presque instantanément suite à l’ajout de l’antibiotique. Chez les bactéries à Gram négatif, la liaison se fait grâce aux lipopolysaccharides, l’extrémité polaire des phospholipides et des protéines de la membrane externe. Par la suite, pour son entrée dans le périplasme l’antibiotique suivra la voie hydrophile, décrite dans la section précédente. Dans le cas des bactéries à Gram positif, c’est plutôt les extrémités polaires des phospholipides et l’acide téichoïque qui servent d’attache initiale aux aminosides. La liaison
15 à l’acide téichoïque se fait en déplaçant les ions magnésium (Davis 1987; Ramirez and Tolmasky 2010; Taber et al. 1987; Krause et al. 2016).
La deuxième partie de l’entrée des aminosides est dépendante de l’énergie, nommée « energy-dependant phase I, EDPI ». Cette phase nécessite une CTE fonctionnelle ainsi que les processus associés à la phosphorylation oxydative. Les bactéries deviennent résistantes à cette phase lorsqu’elles sont en présence d’un inhibiteur de ces voies (Krause et al. 2016). C’est d’ailleurs le cas chez les SCV de S. aureus. Comme celle-ci sera inhibée, cela causera une résistance aux aminosides. L’EDPI représente donc le passage initial des aminosides au travers de la membrane cytoplasmique. Cette entrée est en lien avec le potentiel membranaire et se fait par l’intermédiaire de canaux membranaires non spécifiques et possiblement grâce aux quinones membranaires. Une autre voie d’entrée serait via les imperfections membranaires créées lors de la division cellulaire. Par contre, cette voie ne permet qu’à une quantité limitée d’aminosides de franchir la membrane cytoplasmique (Taber et al. 1987; Davis 1987).
La dernière phase d’entrée des aminosides est la phase « energy-dependant phase II, EDPII ». C’est une phase où l’entrée des aminosides est accélérée par rapport à la phase I. Plus précisément, cette phase requiert l’hydrolyse de l’ATP, mais une certaine quantité d’aminosides est tout de même en mesure de franchir la membrane cytoplasmique en suivant un gradient de concentration. Plusieurs modèles ont été proposés pour expliquer la hausse d’entrée d’aminosides, mais un modèle est le plus probable. Selon ce modèle, lors de la phase I, les aminosides se lient aux ribosomes et causent des défauts dans la traduction des protéines. Parmi ces protéines mal traduites ou tronquées, certaines se retrouvent à la membrane. Cela causera une augmentation de la perméabilité membranaire progressive et facilitera l’import des aminosides. Les protéines mal traduites agiront à titre de canaux non spécifiques. Ainsi, l’importation d’aminosides sera augmentée au fur et à mesure que les défauts de traduction auront lieu. L’accumulation des défauts conduira ultimement à la perte de l’intégrité membranaire et à la mort de la bactérie (Taber et al. 1987).
16 1.3.2 Inhibiteurs de l’ATP synthétase
Comme l’ATP synthétase est la source d’énergie la plus commune parmi les organismes vivants, les inhibiteurs de cette enzyme seront donc très délétères pour ceux-ci. Les cinq principales cibles de ces inhibiteurs sont les sous-unité c, a, α et β (Fig. 6).
Figure 6. Structure de l’ATP synthétase et site de liaison des inhibiteurs. (Hong and Pedersen 2008)
La sous-unité β peut être inhibée par la citréoviridine. Cette molécule est produite par les moisissures du genre Penicillium et Aspergillus. La citréoviridine est un inhibiteur non compétitif pour la synthèse d’ATP et l’hydrolyse de l’ATP, dans le cas où l’organisme cherche à générer un potentiel membranaire plus grand (Gauses, Buck, and Douglas8 1981; Satre, Bof,
17 and Vignais 1980). Cependant, le mécanisme d’action exact n’est pas encore décrit. Tout près, à l’interface des sous-unité α et β se situe le site de liaison de l’efrapeptine. C’est un inhibiteur compétitif de la synthèse d’ATP qui se lie au site de liaison de l’ADP. La liaison entre l’ATP synthétase et l’inhibiteur est stabilisé avec la formation de deux ponts hydrogène. Cela empêche donc l’adhésion et la phosphorylation de l’ADP (Gene et al. 1984; W Leslie et al. 1999; Arakaki et al. 2003).
La sous-unité a, elle, est inhibée par les composés organostanniques. Ce sont des inhibiteurs compétitifs qui se lient au site de liaison des cations Na+ et H+ (von Ballmoos, Brunner, and
Dimroth 2004; Yagi and Hatefi 1984).
Finalement, la sous-unité c est inhibée par le DCCD, l’oligomycine et le nouvel antibiotique ciblant Mycobacterium tuberculosis, la bedaquiline. Le DCCD se lie de façon covalente au résidu carboxyle à la position 61 d’une des 10 sous-unités c assemblées qui forment le rotor. La molécule bloque le passage des protons en empêchant le mouvement rotatoire des sous-unités. Le rotor bloque après une rotation seulement. Le mouvement ainsi arrêté, inhibera le transfert des protons au travers le complexe et la synthèse d’ATP et augmentera le potentiel membranaire (Toei and Noji 2013; Miller et al. 1980). Un autre inhibiteur, l’oligomycine, est synthétisé par Nocardiopsis spp. et quelques espèces de Streptomyces. Il bloque le transit de proton en se liant à la partie Fo de l’ATP synthétase (Hong and Pedersen 2008). Finalement, un antibiotique
ciblant spécifiquement l’ATP synthétase de Mycobacterium tuberculosis a été développé (Hards and Cook 2018). Bref, cette liste n’est pas exhaustive, mais elle montre qu’il existe plusieurs sites pour l’inhibition de l’ATP synthétase et qu’il existe un potentiel pour le développement d’antibiotiques sélectifs pour cette cible.
1.3.3 La tomatidine
La TO est un alcaloïde stéroïdien (Fig. 7) dont l’activité antimicrobienne a été mise en lumière par les laboratoires des professeurs Malouin, Bouarab et Marsault à l’Université de Sherbrooke (Malouin et al. 2014).
18 Figure 7. Structure de la tomatidine (Lamontagne Boulet et al. 2018)
Cette molécule est le dérivé aglycone de l’α-tomatine, un antifongique produit naturellement par les tomates. Plusieurs espèces de champignons, dont Fusarium oxysporum f. sp. lycopersici, clivent l’α-tomatine en un tétrapeptide et en TO, inefficace contre les champignons. La TO est, quant à elle, seulement efficace contre la forme SCV des bactéries de l’ordre des Bacillales, dont fait partie S. aureus et Bacillus subtilis, sans avoir d’impact sur la croissance des bactéries possédant un phénotype prototypique. Plus spécifiquement, la TO se lie à la sous-unité c de l’ATP synthétase. Le gène codant pour la sous-unité c de l’ATP synthétase des Bacillales est très conservé parmi ceux-ci, mais des différences notables sont présentes lorsque l’on compare ce gène avec d’autres bactéries à Gram positif ou négatif. Les différences sont aussi très grandes lorsque l’on compare avec l’ATP synthétase mitochondriale. Une étude précédente a permis d’élucider une partie du mode d’action de la TO. Il a été démontré que la liaison à la sous-unité c de l’ATP synthétase réduisait la production d’ATP. Le manque d’énergie dans la bactérie pourrait expliquer la baisse observée dans la synthèse des protéines et autres macromolécules. Toutefois, S. aureus est en mesure de fermenter différentes sources de carbone et ne devrait pas dépendre de la production d’ATP par la CTE. De plus, une synergie a été observée entre la TO et les aminosides. Le mécanisme par lequel cette synergie opère demeure un mystère (Mitchell et al. 2011b; Lamontagne Boulet et al. 2018; Boulanger et al. 2015; Guay et al. 2018).
1.3.4 Mécanisme universel de bactéricidie
Les espèces réactives de l’oxygène (ROS) sont des métabolites normalement formés par l’activité de la CTE, autant chez les procaryotes que les eucaryotes (Devasagayam et al. 2004).
19 Les trois principales molécules considérées pour les dommages oxydatifs causés par un traitement antibiotique chez les bactéries sont le superoxyde (O2-), le peroxyde (H2O2) et les
radicaux hydroxyles (OH•) (Hayyan, Hashim, and AlNashef 2016). Ces molécules sont particulièrement importantes à gérer pour tous les organismes vivants exposés à l’oxygène puisqu’elles ont la capacité d’oxyder les structures cellulaires et les macromolécules essentielles à la survie de l’organisme (Devasagayam et al. 2004; Sosa Torres, Saucedo-Vázquez, and Kroneck 2015). Chez les bactéries aérobies utilisant leur CTE, les ROS sont principalement produits à deux endroits (Vinogradov and Grivennikova 2016). Le premier est l’ATP synthétase qui réduit l’oxygène en eau tout en formant une molécule d’ATP. Toutefois, il arrive qu’un électron seul passe la membrane et oxyde une molécule d’oxygène en doublet (O2) pour former
le superoxyde. La probabilité que cet évènement survienne n’est pas connue précisément, mais il est estimé qu’environ 0,2-2% des électrons traversent la membrane chez les mitochondries, dans un modèle in vitro. Le superoxyde est d’ailleurs le précurseur des autres ROS, et le moins réactif (McBee et al. 2017). Le deuxième complexe où les ROS sont produits est le complexe I. Plusieurs bactéries possèdent une NADH déshydrogénase de type I qui combine l’action d’oxydation du NADH en NAD + H+ et pompe le proton à l’extérieur de la cellule (Vinogradov
and Grivennikova 2016). D’autres bactéries, comme S. aureus, doivent utiliser deux protéines distinctes pour faire cette tâche. La première est une NADH déshydrogénase de type II et la seconde est une pompe à proton, MpsA (Mayer et al. 2015). Avec les protons libres et le superoxyde formé par la fuite d’électrons, il peut y avoir formation de peroxyde (2 O2- + 2H+
→ H2O2+ O2). Toutefois, en présence de fer, une troisième réaction peut se produire. Le
peroxyde nouvellement produit réagit avec un ion ferrique (Fe2+). La réaction produit alors un
ion hydroxyle, qui est particulièrement délétère pour les bactéries, avec les réactions suivantes : Fe2+ + H
2O2 →Fe3+ + OH• + OH- (Turrens 2003; Vinogradov and Grivennikova 2016; Van
Acker et al. 2016).
Les ROS sont dangereux pour les bactéries de par leur nature hautement réactive. Ils peuvent causer d’importants dommages aux lipides membranaires, à l’ADN et aux protéines (Belenky et al. 2015).
20 Figure 8 : Schématisation de la production de ROS induite par les antibiotiques et le mécanisme par lequel ils endommagent les bactéries (Van Acker and Coenye 2017)
Les lipides peuvent être endommagés par peroxydation, c’est-à-dire le remplacement d’un groupement méthyle par un groupement aldéhyde réactif. Ces dommages se font en trois étapes principales, soit l’initiation, la propagation et la terminaison. Tout d’abord, un radical hydroxyle donne son électron de surplus à un acide gras polyinsaturé de la membrane pour former un acide gras radical. Par la suite, l’acide gras radical réagit avec l’oxygène et peut propager son état aux
21 acides gras adjacent. Si ce n’est pas pris en charge par la cellule, toute la membrane sera à risque. Enfin, l’étape de terminaison a lieu lorsque deux lipides radicaux entrent en contact et se stabilisent en formant un aldéhyde réactif comme le malondialdéhyde ou l’hydroxynonenal. Ces aldéhydes réagissent avec la désoxyadénosine et la désoxyguanosine et causent des dommages potentiellement létaux à la bactérie. De plus, les lipides peroxydés ont tendance à diminuer l’étanchéité de la membrane (Ayala, Muñoz, and Argüelles 2014; Marnett 1999). Les dommages causés à l’ADN et à l’ARN par les ROS sont principalement dus à l’oxydation des guanines en 8-oxo-dGTP. Les dommages à l’ADN sont réparés rapidement par la cellule, mais si trop de guanines sont oxydées, des mutations peuvent alors se produire. Une autre conséquence possible de la présence de 8-oxo-dGTP dans l’ADN est la mauvaise transcription des gènes ce qui causera des défauts dans la traduction des protéines. L’ADN est composé de 2 brins et la réparation des lésions peut se faire en se basant sur le modèle du brin non endommagé. Cependant, lors de dommages oxydatifs sur l’ARN, il n’y a pas de modèle sur lequel la réparation peut se faire. De ce fait, les dommages à l’ARN sont plus délétères dans l’immédiat pour les cellules puisque les protéines sont à risque d’être mal traduites (Foti et al. 2012; Hofer et al. 2006; Z. Li, Wu, and DeLeo 2006; Burrows and Muller 1998). Les protéines peuvent aussi être affectées par les ROS. Elles peuvent être carbonylées ou elles peuvent tout simplement être inactivées par l’oxydation de certains cofacteurs. La carbonylation est une réaction où il y a formation de cétone ou aldéhyde réactifs sur les chaînes latérales des protéines avec des résidus de cystéines, lysine et histidine plus particulièrement. Ces modifications sont irréversibles et sont très nocives pour la cellule bactérienne qui ne pourra plus effectuer l’ensemble de ses fonctions métaboliques correctement, dont la réparation des autres dommages causés par les ROS. Le taux de carbonylation des protéines est aussi utilisé pour déterminer l’ampleur des dommages oxydatifs subis par une bactérie à la suite d’un stress ou d’un traitement antibiotique (Fedorova, Bollineni, and Hoffmann 2014).
Les bactéries aérobies, ou du moins habituées à la présence de l’oxygène, sont toutefois bien adaptées à gérer ces déchets toxiques, produits secondaires de la respiration. La première enzyme est la superoxyde dismutase qui sert à détoxifier le superoxyde. Le principe général de la réaction implique la réduction du superoxyde par un métal. Les trois métaux utilisés chez les
22 bactéries sont le fer, le cuivre et le manganèse. La réaction générale est la suivante : M(n+1)+
-SOD + O2- → Mn+-SOD + O2 où M représente un des métaux mentionnés plus haut, n le nombre
de charge positive que possède ce métal et SOD représente la superoxyde dismutase. Toutefois, en présence de proton et pour régénérer le nombre d’électron initial du métal, la réaction suivante pourrait avoir lieu : Mn+-SOD + O
2- + 2H+ →M(n+1)+-SOD +H2O2. Cela permettra de
régénérer le nombre d’électrons initial du métal, mais produira une molécule de peroxyde qui devra être détoxifiée à son tour (Steinman 1988; Tainer et al. 1983). Ici entre en jeux la deuxième enzyme de détoxification des ROS, la catalase. Cette enzyme transforme le peroxyde en eau et en oxygène (O2) (Chelikani, Fita, and Loewen 2004). Ces deux enzymes sont
primordiales pour la survie des bactéries qui sont en contact avec l’oxygène, mais s’il y a trop de ROS produits, la bactérie doit se tourner vers des mécanismes de secours pour réparer les dommages aux lipides, aux acides nucléiques et aux protéines. Pour la peroxydation des lipides, la bactérie peut se fier aux résidus d’histidine et au mannitol qui sont des piégeurs de radicaux libres (Agents Chemother Alexander Fridman et al. 2011). La protection contre les protéines carbonylées est l’action des protéases qui reconnaissent les protéines non spécifiques (Fedorova, Bollineni, and Hoffmann 2014). Finalement, les dommages à l’ADN sont réparables par excision de base endommagée (Cadet and Wagner 2013). Bien que le peroxyde et le superoxyde puissent être détoxifiés par des enzymes spécialisées, les radicaux hydroxyles ne le sont pas et causeront rapidement des dommages à la bactérie (Reiter et al. 1995).
Plus récemment, les ROS ont été associés à un mécanisme d’action secondaire pour tous les antibiotiques bactéricides (Fig. 8) (Kohanski et al. 2007). Le stress induit par la présence de ces antibiotiques sera perçu par le système de réponse au stress à deux composantes CpxA. Ce système activera le régulateur de transcription ArcA (Kohanski et al. 2008). Ce régulateur gère la transcription des enzymes impliquées dans le cycle de l’acide tricarboxylique (TCA) (Kottur and Nair 2016). Suite à la suractivation du TCA, la CTE sera fournie en excès de NADH et sera, par conséquent aussi suractivée. Comme expliqué précédemment, l’oxydation du NADH en NAD+ produira une certaine quantité de ROS (Dwyer et al. 2007; Kohanski et al. 2007). La
réaction du peroxyde avec le fer des protéines avec un complexe fer-souffre causera la réaction de Fenton qui sera la plus délétère pour les bactéries et pourra causer en partie leur mort
23 (Belenky et al. 2015). L’implication des ROS dans le cas d’un traitement des aminosides est assez claire dans le sens où la mauvaise traduction des protéines causera des protéines défectueuses qui pourront se retrouver dans la membrane et activer le système CpxA situé à cet endroit. Même chose avec les β-lactames qui ciblent la membrane. Cependant, il reste encore à trouver la raison pour laquelle les quinolones causent une perturbation de la membrane et ainsi la production de ROS (Kohanski et al. 2008). Dans le cas des antibiotiques bactériostatiques, il n’y a pas de production de ROS observée (Kohanski et al. 2007).
Ce mécanisme n’est toutefois pas sans avantages pour les bactéries. Si les concentrations d’antibiotiques demeurent sous la dose minimale inhibitrice, il y aura production de ROS sans toutefois avoir de mortalité cellulaire notable (i.e. lors d’une courbe de bactéricidie). Il pourra donc y avoir dommage à l’ADN et activation du système SOS. Ce système est plus prompt à faire des erreurs lors de la réparation et cela peut donc entraîner une mutation de résistance à l’antibiotique utilisé (G. Li et al. 2015). C’est d’autant plus important qu’en clinique, il arrive parfois que des patients n’adhèrent pas au traitement antibiotique et se retrouvent avec des concentrations sous-inhibitrices d’antibiotique dans leur sang.
Il est donc important de connaître les impacts des antibiotiques sur les bactéries au-delà de leur cible et de leur mode d’action principal. En effet, la production de ROS, quoique naturel, peut devenir un casse-tête de plus dans le traitement des infections en clinique et explique, du moins en partie, le mécanisme par lequel des mutants résistants, voire multirésistants, peuvent apparaître au cours du traitement.
1.3.5 Hypothèses et objectifs de la recherche
L’objectif de ma maîtrise était de déterminer le mode d’action de TO et d’élucider la synergie entre TO et les aminosides contre la forme SCV et prototypique de S. aureus. Ces connaissances sont essentielles au développement de cette nouvelle classe d’antibiotique et aidera à combattre efficacement les infections à S. aureus. Nos connaissances actuelles sur la tomatidine nous ont permis de poser trois hypothèses centrales à l’origine de ma recherche. La première étant que
24 l’effet bactéricide de la tomatidine et de la combinaison TO-aminoside est associé à l’inhibition de l’ATP synthétase, mais aussi à un changement dans le potentiel membranaire et/ou à la production de ROS. La seconde hypothèse est que l’étude des phénotypes associés à la résistance dévoilera l’ensemble des phénomènes cellulaires reliés au mode d’action des antibiotiques. Finalement, la troisième hypothèse est que les mutations conférant la résistance sont transférables à un autre Bacillales. Pour ce faire, il fallait dans un premier temps établir la méthodologie et les protocoles à suivre pour mesurer le potentiel membranaire, la production de ROS et dans un deuxième temps étudier des phénotypes tel que l’hydrophobicité de la surface, pouvant influencer l’action des antibiotiques. Ensuite, en utilisant ces protocoles, ces phénotypes pourront être mesurés en présence de TO et de la combinaison TO-aminoside afin d’y observer les impacts au niveau cellulaire. Enfin, certaines mutations de résistance à TO ont été transférées à Bacillus subtilis et pour les mutations de résistance à la combinaison, l’utilisation de la collection NEBRASKA qui contient déjà des mutants pour les gènes ndh2 et qoxC.
25 CHAPITRE 2
Bactericidal activity of the combination of tomatidine and aminoglycoside against virulent and persistent Staphylococcus aureus
Mise en contexte:
La cible cellulaire de la TO a été identifiée dans une étude précédente au laboratoire comme étant la sous-unité c de l’ATP synthétase et que la tomatidine inhibait la production d’ATP (Lamontagne Boulet et al. 2018). Cet article vise à déterminer le mécanisme d’action de la TO et de la combinaison TO-aminoside. La bedaquiline, un inhibiteur de la sous-unité c de l’ATP synthétase spécifique à Mycobacterium, est très étudié présentement et nous offre des avenues à vérifier pour découvrir le mécanisme d’action qui est spécifique à TO. D’autres études tendent à démontrer que les antibiotiques bactéricides induisent la production de ROS. Il serait aussi possible que TO facilite l’import d’aminoside dans la cellule, ce qui expliquerait l’effet synergique. Bref, dans ce contexte, il y a plusieurs opportunités de recherche qui permettront de découvrir le mécanisme d’action de TO et de la combinaison TO-aminoside et faciliteront le développement de cette nouvelle classe d’antibiotique.
Titre: Bactericidal activity of the combination of tomatidine and aminoglycoside against virulent and persistent Staphylococcus aureus.
Auteurs et contribution :
Jean-Philippe Langlois1 : Expériences biologiques avec la tomatidine et la combinaison de la
tomatidine avec la gentamicine pour déterminer leur mode d’action
Pierre-Étienne Jacques1 : Analyse du génome des souches résistantes aux antibiotiques
Sébastien Rodrigue1 : Préparation des ADN pour séquençage et analyse des souches résistantes
26 Kamal Bouarab1 : Initiateur du projet grâce à l’isolement du produit naturel tomatidine.
Éric Marsault2 : Collaborateur et codécouvreur de la tomatidine
François Malouin1# : Directeur de recherche de Jean-Philippe Langlois et d’Isabelle Guay et
auteur de correspondance.
1Département de Biologie, Faculté des Sciences, Université de Sherbrooke, Sherbrooke,
Québec, Canada, J1K 2R1
2Département de pharmacologie et physiologie, Faculté de médecine et des sciences de la santé;
Université de Sherbrooke, Sherbrooke (QC), Canada.
# Corresponding author. Mailing address: Université de Sherbrooke,Département de Biologie, Faculté des Sciences, 2500 Boul. Université, Sherbrooke, Quebec, Canada, J1K2R1. Phone: (819) 821-8000, ext. 61202. Fax: (819) 821-8049. E-mail: Francois.Malouin@USherbrooke.ca.
27 Bactericidal activity of the combination of tomatidine and aminoglycoside against virulent and persistent Staphylococcus aureus.
Langlois, J.-P.1, Jacques, P.-É.1, Rodrigue, S.1, Bouarab, K.1, Marsault, E.2, Malouin, F.1*
1Département de biologie, Faculté des sciences; Université de Sherbrooke, Sherbrooke (QC),
Canada.
2Département de pharmacologie et physiologie, Faculté de médecine et des sciences de la santé;
Université de Sherbrooke, Sherbrooke (QC), Canada.
* Corresponding author. Tel: +1-819-821-8000, ext. 61202; Fax: +1-819-821-8049; E-mail:
francois.malouin@usherbrooke.ca
28 Abstract
Objectives: Tomatidine (TO), a phytomolecule extracted from tomatoes, exerts a strong bactericidal activity on the infection-persistent phenotype of Staphylococcus aureus, the small-colony variant (SCV), with a minimal inhibitory concentration (MIC) of 0.06 μg/mL. Moreover, when TO is combined to an aminoglycoside (AMG), the combination shows a strong synergistic activity against prototypical (WT) S. aureus (MIC of 0.06 μg/mL), which are otherwise unaffected by TO alone (MIC of >128 μg/mL). We recently determined that the molecular target of TO was the ATP synthase subunit c (AtpE) and that TO reduced ATP production in S. aureus. The aim of this study was to uncover the mechanism of action of TO and that of the combination of TO-AMG against S. aureus WT and SCV.
Methods: The impact of TO and TO-AMG combination on the membrane potential and generation of reactive oxygen species (ROS) were determined using florescent probes. Gentamicin uptake was assessed in the presence of TO. Time-kill experiments were performed under aerobic and anaerobic conditions.
Results: TO is able to reduce membrane potential of both WT and SCV, but significant ROS are only produced in SCVs. Similarly, only the TO-AMG combination generated significant ROS production in the WT, which explains the strong synergy with AMG. Besides, there was no difference in membrane potential of WT when comparing the effect of AMG to that of TO-AMG. However, the combination TO-AMG generated 2.5 times more ROS and increased AMG uptake, compared to that caused by AMG alone. Both antibiotics and the combination became bacteriostatic under anaerobic conditions demonstrating the importance of ROS in the bactericidal activity.
Conclusions: These results shed light on the mechanism of action of TO and its synergy with AMGs against S. aureus WT. TO bactericidal activity against SCVs is attributable to both a critical drop in the membrane potential and is accompanied by an important ROS production.
29 Introduction
The World Health Organization identified antibiotic resistance as a threat to humanity (1, 2). Thus, developing new classes of antibiotics is an urgent need. Among the bacteria which represent the highest risk can be found Staphylococcus aureus. S. aureus is an opportunistic pathogen and recently became the most prevalent pathogen in cystic fibrosis patients (3). It chronically infects these patients, resists antibiotherapies, evades the immune system by forming biofilm and by living within nonphagocytic cells (4). The emergence of methicillin-resistant S. aureus (MRSA) that are often resistant to multiple classes of antibiotics, complicates antibiotherapy even more (5–7). The small-colony variant (SCV) is an alternative phenotype adopted by S. aureus which trades virulence for persistence traits. SCVs most often have an impaired electron transport chain, which reduces ATP production and growth rate. Therefore, they are more resistant to aminoglycosides that need the membrane potential generated by the electron transport chain to cross the cytoplasmic membrane. Both SCV and prototypical phenotypes are found in lungs of cystic fibrosis patients chronically infected with S. aureus (8– 11).
Tomatidine (TO) is the aglycone precursor of α-tomatine, an antifungal compound naturally synthesized by solonaceous plants (12). We previously demonstrated that TO is a potent and very selective ATP synthase subunit c inhibitor and displays a strong activity against SCV and targets very selectively the Bacillales (Staphylococcus, Listeria, Bacillus) (13). Also, the combination of TO and an aminoglycoside was shown to be synergistic and reduced the minimal inhibitory concentration of that class of antibiotics by 2-16 fold against prototypic S. aureus (WT), which are otherwise unaffected by TO alone (MIC of >128 μg/mL) (14, 15). Targeting the energy production or membrane potential has been considered for treatment of persistent infections (16). Recently, there has been a new antibiotic accessing the clinic, bedaquiline, also targeting ATP synthase subunit c. This antibiotic also has a specific target range and is specifically active against Mycobacterium tuberculosis and other mycobacterial species (17).
30 The stimulation of the production of reactive oxygen species (ROS) may be a secondary mechanism of action common to all bactericidal antibiotics (18). Indeed, antibiotics can stimulate the production of ROS, and more specifically, peroxide (H2O2), superoxide (O2-•), and
hydroxyl radicals (OH•). While the first two can be detoxified by bacteria with catalase and superoxide dismutase, respectively, bacteria are generally unable to detoxify the hydroxyl radical (18, 19). ROS are normal by-products of the aerobic respiration and are generated mainly by the oxidation of NADH by the electron transport chain (20). The overproduction of ROS under antibiotic pressure depletes NADH from the cells and creates a generalized oxidative stress on the bacteria. To confirm the hypothesis that TO bactericidal activity is linked to ROS production, it is essential to measure ROS production in presence of TO and also measure the activity of TO in the presence of an anti-oxidant or in the absence of oxygen. For instance, the bactericidal activity of ciprofloxacin, a fluoroquinolone targeting bacterial topoisomerases, is decreased in the absence of oxygen (21). Finally, to understand how TO increases aminoglycoside activity, the uptake of the latter by bacteria must be studied as aminoglycosides enter bacteria more easily if the membrane integrity is compromised (22).
We report here how TO, with or without AMG, exerts its bactericidal activity against both the WT and SCV phenotypes of S. aureus.
31 Methods
Strains and growth conditions
Strains used in this study were S. aureus Newbould (ATCC 29740) or S. aureus ATCC 29213. Strain NewbouldΔhemB (ΔhemB) was used as the SCV counterpart. This stable SCV strain ΔhemB was constructed by disrupting the hemB gene involved in the biosynthesis of heme in strain Newbould using the ermA cassette by homologous recombination (23). Also, TO-resistant strains previously described by Lamontange-Boulet et al (13) and obtained by serial passage on sub-MICs of TO are also used in this study (Table 1). All strains were grown in trypticase soy broth (TSB) or on trypticase soy agar (TSA) at 35oC. During anaerobic growth, oxygen did not
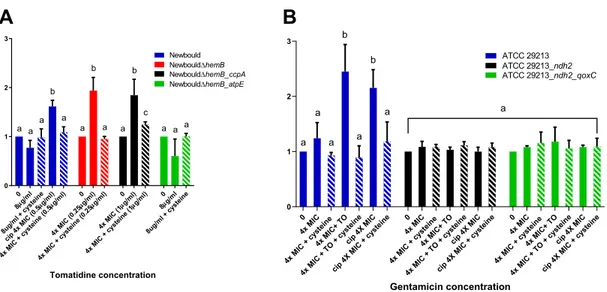
32 Table 1: Strains used in this study and their antibiotic susceptibility profiles
Strain S. aureus Newbould S. aureus Newbould ΔhemB S. aureus Newbould ΔhemB_ccpA S. aureus Newbould ΔhemB_atpE S. aureus ATCC 29213 S. aureus ATCC 29213_ndh2 S. aureus ATCC 29213_ndh2_qoxC Mutation
- ΔhemB G149V A17S - Del G36 H145N
Phenotypea WT SCV SCV SCV WT WT WT Microdilution MICb (µg/ml) TO >128 0.03-0.12 0.25 >128 >128 >128 >128 TO+cys >128 0.25 0.5 >128 >128 >128 >128 GEN 0.25-1 8 8 8 0.25-1 2 2-4 TO+GEN 0.06-0.12 - - - 0.06-0.12 0.5-1 2-4 Cip 0.12-0.25 0.12 0.12 0.12 0.25 0.12-0.25 0.25 Cip+cys 0.5 0.25 0.25 0.25 0.5 0.5 0.5 Disk diffusion Inhibition diameter (mm) TO anaerobic 0 25 - - - - - TO anaerobic 23 28 - - - - - Name in reference S. aureus Newbould S. aureus Newbould ΔhemB P07intR SaR1 - - - Reference
12 12 12 12 This study This study This study
b WT, wild type phenotype; SCV, small-colony variant