HAL Id: hal-02787482
https://hal.inrae.fr/hal-02787482
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
en santé animale : Test de résistance de souches
parasitaires et évaluation de l’activité de tanins
condensés
Malika Ariste-Zelize
To cite this version:
Malika Ariste-Zelize. Contribution à l’étude de ressources végétales utilisables en santé animale : Test de résistance de souches parasitaires et évaluation de l’activité de tanins condensés. [Stage] France. Université des Antilles - Site de Guadeloupe (UA), FRA. 2017, 28 p. �hal-02787482�
Faculté sciences exactes et naturelles Licence Biologie-Biochimie parcours BSS
Institut National de la Recherche Agronomique URZ Unité de Recherches Zootechniques
Domaines de Duclos
Contribution à l’étude de ressources végétales utilisables en
santé animale : Test de résistance de souches parasitaires et
évaluation de l’activité de tanins condensés.
Période : du 26/01/2017 au 22/02/2017
Réalisé par :
Ariste-Zelise Malika (Etudiantes en 3ème année de licence BB)
Maitre de stage : Mme Marie-Magdeleine Chevry Carine Référent de stage : Mr Philibert Lucien
Tutrice de stage UAG : Mme Gonzalez-Rizzo Silvina
2
Remerciements
Avant de commencer la présentation de ce rapport je tenais à remercier :
Monsieur Harry Ozier-Lafontaine, président de l’Institut National de Recherche Agronomique (INRA), ainsi que Mme Nathalie Mandonnet, directrice de l’Unité de Recherches Zootechnies.
Ma tutrice de stage Mme Carine Marie -Magdeleine Chevry, responsable de laboratoire de l’URZ, pour m’avoir permis d’effectuer mon stage au sein de son équipe, pour son accueil chaleureux ,sa disponibilité remarquable, sa confiance, et ses conseils avisées.
Mr Lucien Philibert, Mme Dalida Feuillet pour m’avoir encadré, et enseigné de nouvelles connaissances.
Mme Tatiana Silou-Etienne pour sa patience et m’avoir permis de me mieux maitriser les techniques de laboratoires.
Mme Suzzite Calif, Mr Yohan Felicittee, Steeve qui m’ont permis d’effectuer ce stage dans une bonne ambiance et qui ont facilité mon intégration au sein de l’institut.
Tous mes collègues stagiaires Malika, Wendy avec qui j’ai partagé d’agréables moments.
Toute l’équipe de l’Unité de Recherches Zootechniques, ainsi que les autres stagiaires pour leur accueil et leur conseil durant ce stage.
Enfin, je tiens à remercier ma famille, mes parents, mon frère Mathieu, un bon voisin, pour leur soutien et leur confiance qu’ils m’ont apporté tout au long de ce stage.
Je tiens à remercier toutes les personnes qui ont contribué au succès de mon stage et qui
3
Présentation de l’institut d’accueil
L’INRA (Institut National de la Recherches Agronomique) a été fondé en 1946.C’est le premier institut de recherche agronomique en Europe et deuxième en sciences agricoles dans le monde. C’est un établissement public à caractère scientifique et technologiques.Depuis 2016 il est présidé par Philippe Manguin. L’INRA est chargé :
- d’œuvrer au service de l’intérêt public afin de maintenir l’équilibre entre les exigences de la recherche et les demandes de la société. -de produire et diffuser des connaissances scientifiques et des innovations
principalement dans les domaines de l’ agriculture(pour une agriculture durable),de l’ alimentation(pour une alimentation saine et équilibrée )et de l’ environnement(pour
préserver et valoriser l’ environnement). -Contribuer à l’expertise, à la formation, à la promotion de la culture scientifique et
technique, et au débat de science-société.
INRA Antilles Guyane a été crée en 1949. Des 21 centres régionaux de l’INRA le centre de recherche Antilles Guyane est le seul à être situé en zone tropicale et couvre
les trois départements Français d’ Amérique (Guadeloupe, Martinique et Guyane). Le centre de recherche de la Guadeloupe est situé sur le domaine de l’INRA, le site
accueille l’unité mixte de recherche CIRAD-INRA. Son siège est en Guadeloupe. Il développe ses connaissances des milieux tropicaux, en
collaboration avec des laboratoires des centres de France Métropolitaine et ses partenaires régionaux et interrégionaux.
L’URZ (Unité de Recherche Zootechnique) est associé à deux unités expérimentales qui sont l’unité expérimentale en production et santé animale et la seconde qui accueille les expérimentations en production bovine et caprine sur le pâturage et en pathologie parasitaire. Trois thématiques de recherche sont développées au sein de l’URZ (Unité de Recherches Zootechniques) :
-Adaptation des animaux aux contraintes d’élevage tropicales -Evaluation multicritères des ressources végétales
4
Sommaire
I. Introduction ... 6
II. Etude bibliographique ... 7
A. Haemonchus contortus ... 7
B. Molécules anthelminthiques chimiques ... 8
C. Les tanins ... 10
D. Principaux tests anthelminthiques (in vitro). ... 11
III. Matériel et méthode ... 12
A. Matériels ... 12
1. Matériel biologique : larves L3 ... 12
2. Matériel végétal : Tanins condensés ... 12
B. Tests anthelminthiques ... 13
1. Test de migration larvaire (LMI) Larval Migration Inhibition... 13
a) But ... 13
b) Réactifs ... 13
c) Matériels ... 13
d) Mode opératoire... 13
e) Analyse ... 14
2. Test de dégainement (LEA) Larval Exsheatment assay ... 15
a) But ... 15 b) Réactifs ... 15 c) Equipements et matériels ... 15 d) Mode opératoire... 15 e) Analyse ... 17 C. Analyse statistique... 17
IV. Résultats et discussions ... 17
A. Caractérisation de la souche... 17
B. Evaluation de l’effet anthelminthique de tanins condensés sur la souche à caractériser. 20 1. Effet sur la migration ... 21
2. Effet sur le dégainement ... 21
C. Bilan ... 23
V. Conclusions et perspectives ... 23
VI. Bilan personnel ... 24
5
Résumé
Le parasitisme gastro-intestinal est un problème majeur qui atteint de nombreux
animaux tels que les caprins, ovins, et bovins. Pour lutter contre la strongylose gastro-intestinale causée par le parasite Haemonchus
Contortus et diminuer les pertes dans le cheptel, les éleveurs sont obligés d’avoir
recours à des traitements anthelminthiques chimiques. Cependant une mauvaise utilisation, un mauvais dosage des anthelminthiques entrainent l’apparition de résistance
des nématodes aux anthelminthiques chimiques. Des solutions alternatives sont recherchées. Différentes études montrent que les tanins
condensés qui sont des métabolites secondaires des plantes permettraient de lutter
contre le parasitisme gastro-intestinal. Plusieurs tests in vitro touchant une partie clé du cycle parasitaire sont réalisés.
L’objectif du stage est de caractériser une souche d’ Haemonchus contortus pour sa résistance aux principaux anthelminthiques de synthèse ; et d’évaluer l’effet d’extraits de tanins condensés sur cette souche via des essais in vitro sur la migration et le dégainement des larves L3 (infestantes).Les résultats obtenus montrent que la souche d’Haemonchus contortus est résistante les quatre tanins condensés testés n’ont pas d’effet sur la migration larvaire tandis qu’ils ont de l’effet sur le dégainement.
6
I.
Introduction
Dans les Antilles, la production des petits ruminants connait une phase de croissance
(Madassamy et al. 2007) qui entraine un impact positif sur l’économie. Cependant depuis quelques années un problème demeure : les petits ruminants sont
atteints de strongylose gastro-intestinale. C’est une pathologie que l’on retrouve chez les ruminants qui sont élevés à l’herbe et qui provoque une diminution de la production. Les conditions climatiques (chaleur et humidité) aux Antilles étant favorables au développement larvaire des strongles (Madassamy et al. 2007), cette
parasitose est un problème majeur que rencontrent les producteurs. Il existe plusieurs types de strongles responsables de parasitoses chez les ruminants,
notamment le nématode Haemonchus Contortus qui a un pouvoir pathogène important (Rozette L, 2009).
Pour lutter contre les infections parasitaires, les animaux sont traités avec des médicaments anthelminthiques. Mais l’utilisation répétée et déraisonnée des traitements anthelminthiques de synthèse provoque des résistances. L’utilisation combinée de différents produits anthelminthiques a conduit à l’apparition de monorésistances, voire de multirésistances aux familles anthelminthiques. A titre d’exemple, une étude en Guadeloupe a montré que tous les élevages caprins du territoire étaient résistants au moins aux benzimidazoles et que la majorité d’entre eux rencontraient des problèmes de résistance avec 2 à 3 familles d’anthelminthiques (Mathieu et al., 2014).
Des solutions alternatives sont recherchées afin de lutter contre l’apparition de résistances. Différentes stratégies sont mises en place afin d’optimiser l’utilisation d’anthelminthique comme la rotation des pâtures, l’utilisation de champignons et de bactéries nématophages (Sallé et al.2016), la phytothérapie. L’utilisation de molécules végétales issues de plantes contenant des tanins condensés est une autre alternative aux molécules anthelminthiques de synthèse, qui entrainent aussi des dégâts environnementaux par des rejets chimiques dans la nature. C’est dans ce cadre que se situent les travaux de lutte intégrée menés à l’INRA URZ.
L’objectif de cette étude est de caractériser la résistance d’une souche du parasite
Haemonchus Contortus aux anthelminthiques de synthèse couramment utilisés. Dans un
second temps, il s’agit d’évaluer l’effet de tanins condensés sur cette même souche de parasite. Cette étude est menée en prenant comme modèle le stade infestant L3 du
7 parasite et en utilisant les 2 biotests : le test de migration et le test de dégainement larvaires.
II. Etude bibliographique
A. Haemonchus contortus
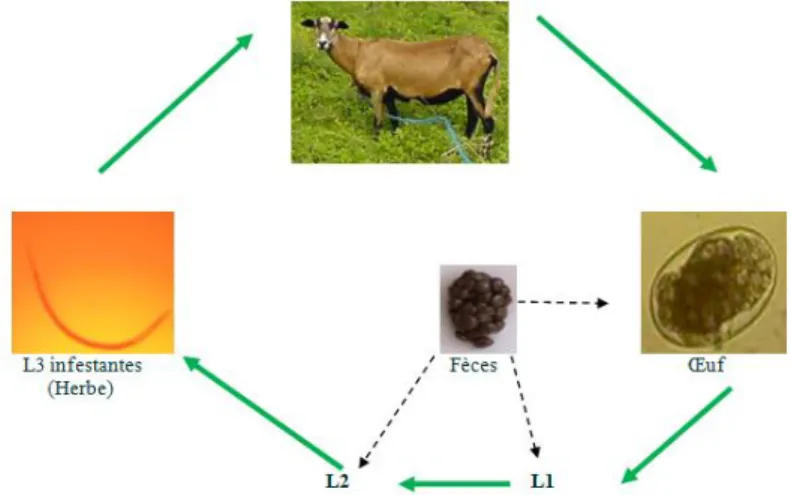
Le parasite nématode Haemonchus contortus est un strongle gastro-intestinal que l’on retrouve très fréquemment chez les petits ruminants et qui se loge dans la caillette. Il est l’un des plus pathogènes. C’est un parasite hématophage (qui se nourrit de sang) qui appartient à la famille des Trichostrongylidae. Il est à l’ origine de nombreuses pertes économiques. Son cycle parasitaire monoxème est constitué de deux phases (Figure 1) : Une phase libre ou exogène pendant laquelle l’animal préalablement infesté par des L3 (infestantes) ingérées va excréter des œufs de strongle qui seront éliminés par les fèces. Une fois éliminés, ils éclosent pour évoluer vers le stade L1 (dégainés) dans des conditions optimales du milieu (24 à 29°C). Ainsi au bout de 48H ces larves L1 vont se développer en larves L2 (gainées, en mue) qui évolueront à leur tour au bout de 96H en
larves L3 gainées. La gaine sert de protection. Lors de la phase parasitaire ou endogène les larves L3 très mobiles vont se déplacer et
migrer en hauteur sur l’herbe, puis seront ingérés par les ruminants : c’est le stade infestant. Post ingestion, elles perdent leur gaine pour pouvoir poursuivre leur développement et pénètrent dans le tractus digestif jusqu’ à la caillette de l’animal : Les larves continuent leur développement larvaire en L4 et L5 en ponctionnant les petits vaisseaux sanguins de la caillette pour se nourrir (Hue T, 2014).Une fois les larves L5 matures, elles atteignent le stade adultes auquel la reproduction devient possible.
8
B. Molécules anthelminthiques chimiques
Pour lutter contre les divers parasites, des anthelminthiques de synthèse (médicaments antiparasitaires) sont utilisés. Leur utilisation nécessite des précautions afin d’empêcher l’apparition de résistances. Les molécules anthelminthiques chimiques sont classées en différentes familles en fonction de leur mode d’action. Actuellement on compte quatre grands groupes qui sont :
Les benzimidazoles et les pro-benzimidazoles.
Les benzimidazoles regroupent une grande famille chimique qui possède une
importante activité anthelminthique. Les benzimidazoles agissent directement tandis que les pro-benzimidazoles doivent
être d’ abord transformées en benzimidazole actif, principalement dans le foie, une fois dans l’organisme de l’hôte (Narinderpal K et al., 1946 ).
Les benzimidazoles sont peu soluble dans l’eau tandis que les pro-benzimidazole sont plus soluble dans l’eau donc mieux assimilés par le corps de l’organisme hôte.
Ces composés agissent sur l’inhibition de la polymérisation de la tubuline et sur le métabolisme énergétique en provoquant un dysfonctionnement cellulaire ce qui entraine la mort du parasite.Ils agissent généralement sur la majorité des nématodes (strongles gastro-intestinaux et strongles respiratoires, cestodes). Les différents benzimidazoles et pro-benzimidazoles utilisés sont : Thiabendazole, mébendazole, oxfendazole, fébantel, fenbendazole, nétobimin, albendazole.
Figure 2: Exemple de structure chimique d’un anthelminthique de synthèse:albendazole
http://www.selleckchem.com/products/albendazole-oxide-ricobendazole.html Les imidazothiazoles et les tétrahydropyrimidines
Les imidazothiazoles sont constitués d’un cycle imidazole condensés à un noyau
thiazole, c’est un composé anthelminthique ayant un large spectre d’efficacité. Les tétrahydropyrimidines ont un spectre d’efficacité étroit. Ces deux composés n’ont
pas la même structure mais partage un même mode d’action. Ce sont des agonistes cholinergiques qui se fixent au récepteur nicotinique de l’acetylcholine. Ils agissent au niveau des ganglions nerveux du nématode et entrainent une paralysie spastique des
9 muscles et donc la mort du parasite, car ceux-ci ne peuvent plus restés attaché à la paroi de l’intestin et sont éliminés.
Les différents représentants de ce groupe sont le lévamisole, tétramisole, le pyrantel, le morantel, proziquantel.
Figure 3:Exemple de structure chimique d’un anthelminthique de synthèse: lévimasole
https://www.vetofish.com/sites/vetofish.com/files/definitions/levamisole.png
Les lactones macrocycliques Les lactones macrocycliques aussi appelés endectocides sont une famille
d’anthelminthique à large spectre d’efficacité. Cette famille est composée de deux groupes de lactones macrocyclique qui sont les avermectines et les milbémycines.La différence entre ces deux groupes est la présence d’un substituant disaccharide sur le C13 du cycle macrolide de l’avermectine. La première lactone macrocyclique
commercialisée est l’ivermectine. Les lactones macrocycliques sont des agonistes du récepteur GABA et du récepteur
glutamate .Elles ouvrent les canaux chlorures contrôlés par le glutamate dans les synapses entrainant une augmentation de la perméabilité aux ions chlore provoquant une entrée massive de chlore (hyperpolarisation de la cellule) et donc une paralysie flasque du parasite. Les représentants de ce groupe sont la doramectine, l’ivermectine, la monoxidectine ect…
Figure 4 : Exemple de structure chimique d’une lactone macrocyclique: ivermectine
http://pedagotech.inp-toulouse.fr/130919/res/ivermectine_structure.jpg
Les salicylanilides et les halogénophénols Les salicylanilides sont une famille d’anthelminthique ayant un spectre d’efficacité
étroit. Les salicylanilides inhibent la phosphorylation oxydative ce qui empêche la fabrication d’ATP. Les représentants de ce groupe sont le closantel, le nitroxynil, l’oxyclosanide, ect…
10
Figure 5 : Exemple de structure chimique d’un salicylanides : closantel
http://www.chemicalbook.com/ChemicalProductProperty_EN_CB5360606.htm
C. Les tanins
Le mot tanin signifie au sens étymologique tan. Tan est une poudre d’écorces de chêne
préparée à l’époque du Moyen-âge pour la préparation du cuir. Les tanins sont des substances naturelles organiques que l’on trouve dans pratiquement
toutes les parties des végétaux (racine, écorce, feuille). Ce sont des métabolites
secondaires des plantes supérieures. Ils jouent un rôle d’arme chimique défensive contre
certains parasites).
Il existe deux types de tanins chez les végétaux supérieurs : - les tanins hydrolysables et les tanins condensés.
Tanins hydrolysables
Les tanins hydrolysables sont des esters de phénol ou de glucide. Généralement l’ose est la molécule glucose. Ils peuvent entrainer une toxicité lors de la consommation de certaines plantes (Paolini V et al., 2003).
Tanins condensés
Les tanins condensés ou non hydrolysables, sont constitués de plusieurs monomères de flavanol et ont une toxicité moindre que les tanins hydrolysables. Un traitement chimique ou thermique (chaleur) peut entrainer leur dépolymérisation en anthocyanidol (anthocyanidines).
Figure 6:Structure des tanins.
11 Effets biologiques des tanins condensés chez les ruminants.
Une consommation de concentrations faibles ou modérées de TC (> 6%MS) peut montrer des effets positifs sur les herbivores par exemple sur l’augmentation de la croissance, de la production de lait et de laine (Hoste et al., 2006; Min et al., 2003). En général, les effets bénéfiques observés suite à la consommation de tanins condensés sont principalement dus à leur capacité de liaison aux protéines, ce qui protège les protéines alimentaires de la dégradation dans le rumen et donc augmente la disponibilité de ces protéines dans le tractus digestif inférieur (Hoste et al., 2006; Min et al., 2003).
La phytothérapie, en particulier avec des plantes riches en tanins condensés (TC), a été proposée comme une alternative durable pour le contrôle des nématodes gastro-intestinaux (Hoste et al., 2006). Le rôle des TC dans de nombreux processus biologiques liés à différents stades de nématodes a été confirmé par des études in vitro (Hounzangbe-Adote et al., 2005). Les mécanismes par lesquels les TC neutralisent les parasites peuvent varier, en fonction de la nature et de la composition des différentes espèces fourragères (Brunet et al., 2008b). De plus, des études expérimentales in vivo utilisant des plantes à tanins condensés (Athanasiadou et al., 2001, Min et al., 2005 ; Brunet et al., 2008a; Marie-Magdeleine et al., 2010), ont confirmé une activité anthelminthique.
D. Principaux tests anthelminthiques (in vitro).
Plusieurs tests anthelminthiques sont réalisés à l’INRA-URZ afin d’évaluer la bioactivité de substances sur les différents stades du parasite H. contortus. L’objectif principal est d’étudier le mode d’action de la substance en évaluant sa capacité à interrompre le cycle du parasite.
Stade Test Principe du test
Oeuf Test d’éclosion
Egg hatch assay(EHA)
Les œufs récoltés à partir des fèces d’un animal préalablement infestés sont incubés dans le produit à tester afin d’évaluer l’effet sur l’inhibition de l’éclosion des œufs.
L1/L2/L3 Test de
développement larvaire
Larval development
Des larves L1 sont mises en culture en présence du produit à tester afin d’observer l’effet sur le développement larvaire jusqu’au stade L3.
12 assay (LDA) L3 Test de migration larvaire Larval Migration Inhibition(LMI)
Les larves L3 sont incubées dans le produit testé puis soumises à migration afin d’observer l’effet sur la capacité de migration des larves infestantes.
Test de dégainement Larval Exsheatment assay(LEA)
Les larves L3 incubées dans le produit à tester sont ensite dégainées artificiellement afin d’évaluer l’effet sur le dégainement de la larve infestante.
Ver adulte
Test de motilité Les vers adultes sont récupérés après abattage et mis en contact avec le produit à tester afin d’observer l’effet dans le temps sur leur capacité à se mouvoir.
III. Matériel et méthode
A. Matériels
1. Matériel biologique : larves L3
Pour les 2 biotests, deux types de larves L3 (infestantes) de l’espèce Haemonchus
Contortus ont été utilisées : une supposée résistante et à caractériser et l’autre connue
sensible aux anthelminthiques. Ces deux souches sont préalablement obtenues par coproculture à partir de la méthode de Baermann (voir annexe 1). L’utilisation d’une souche sensible c’est à dire non résistante aux anthelminthiques permettra d’évaluer un effet thérapeutique en conditions classiques. Cette souche fera office de témoin expérimental pour la caractérisation de la souche suspectée résistante.
2. Matériel végétal : Tanins condensés
Quatre extraits de tanins condensés issus de plantes tropicales de différentes familles botaniques ont été utilisés. Pour cela les plantes ont été broyées et les tanins sont extraits avec de l’acétone à 70%. L’éther diethylique est ensuite utilisé afin de séparer les composés les plus lipophiles et les tanins. Les tanins sont ensuite purifiés avec de l’ethanol en utilisant un gel d’exclusion de sephadex qui permet de récupérer les tanins condensés par lavage à l’acétone. Pour chaque extrait de tanins condensés une solution à 5 mg/ml en PBS a été préparée.
13
B. Tests anthelminthiques
1. Test de migration larvaire (LMI) Larval Migration Inhibition
a) But
Le but du test de migration est de tester in vitro l’efficacité des tanins condensés sur la capacité de migration des larves L3 de l’espèce Haemonchus Contortus.
b) Réactifs
-Solution tampon PBS (phosphate buffer saline) reconstituée qsp 1L,0.01M,
Ph=7,4,25°C -Solution de Cydectine à 0.1 % -Solution de Lévamisole à 1% en PBS -Solution d’Albendazole à 1% en PBS -Solution d’Ivermectine à 1% en PBS c) Matériels -Béchers -Pipette jaugée -Poire à pipeter -Pipette pasteur -Micropipettes(P200,P1000,P5000) -Pince - Plaque quadrillée(comptage) - Vortex -Tube Falcon conique (50ml,15 ml)
- Agitateur magnétique -Barreau aimanté
-Microscope optique -Sonicateur
-Tamis d’une porosité de 20μm fixé à
l’insert -Centrifugeuse Thermo scientifique ST40 R
d) Mode opératoire
Préparation de la solution larvaire
Dans un premier temps, il s’agit de déterminer la concentration de larves présentes dans la solution larvaire obtenue par la méthode de Baermann, afin de pouvoir procéder au test. La solution larvaire est sortie du réfrigérateur afin d’être à température ambiante. Les larves sont mises dans un bécher en agitation. Sur une plaque de lecture seront déposés 10 gouttes de 20μl de solution larvaire. Chaque goutte sera observée au microscope afin d’être comptée afin connaitre le nombre de larves présentes dans les 10 gouttes et pouvoir ainsi faire une extrapolation pour 1 ml. On obtient donc pour chaque souche :
14
Souche à caractériser Souche sensible
94 L3/100μl 940/1ml
66L3/ 100μl 660/1ml
Mise en contact et lancement du test
La solution larvaire contenant les larves L3 est mise en contact avec les anthelminthiques et les tanins condensés pour la souche à caractériser et uniquement avec les anthelminthiques pour la souche sensible. Dans des tubes coniques de 15 ml identifiés ont été ajoutés 1 ml de solution larvaire et 1ml d’anthelminthique ou tanins condensés selon la souche puis agités au vortex. La cydectine disponible ayant une plus faible concentration donc deux volumes ont été mis en contact avec la solution larvaire. Cinq répétitions sont réalisées pour chaque réactif et extrait de tanins condensés. Le PBS seul est utilisé comme témoin négatif à raison de 5 répétitions. Une incubation
d’une durée de 3H se réalise ensuite à température ambiante (25°C). Suite à l’incubation, trois rinçages successifs sont réalisés : les tubes sont centrifugés à
4500rpm pendant 5 min à 15°C, le surnageant ne contenant pas de larves est prélevé et 2ml de PBS est ajouté puis on procède à une nouvelle centrifugation. Après 3
centrifugations, le dernier culot est repris avec 1ml de PBS. Les larves remises en suspension sont agitées au vortex avant d’être prélevées puis
posées délicatement dans l’insert préalablement posé dans des tubes coniques contenant
du PBS ajusté au niveau du tamis. Après 3h d’incubation à température ambiante dans un portoir, le contenu de l’insert est
prélevé des tubes. Le volume de l’ensemble des tubes est ajusté à 2 ml avec du PBS. Pour chaque tube, un échantillon de 10 gouttes de 20μl est prélevé après homogéisation et observé au microscope optique afin de déterminer le nombre de larves ayant migrées activement.
e) Analyse
Une fois le nombre de larves déterminé dans chaque goutte, le pourcentage brut de larves (L3) ayant migrées ainsi que le pourcentage de migration par rapport au témoin négatif (PBS) sont calculés selon la formule :
15
B : Pourcentage brut de L3 ayant migré N : Nombre de larves mises en contact avec les extraits Z : Nombre de larves comptées c’est à dire larves ayant effectivement migré
X : Facteur multiplicatif pour exprimer le nombre de larves comptées par ml T : Volume d’ajustement dans les tubes coniques
2. Test de dégainement (LEA) Larval Exsheatment assay
a) But
Le but du test de dégainement est de tester l’efficacité des anthelminthiques et tanins condensés sur le dégainage des larves L3 (infestantes) d’ Haemonchus Contortus.
b) Réactifs
-Solution tampon PBS (phosphate buffer saline ) reconstituée qsp 1L,0.01M,
Ph=7,4,25°C -NaCl à 16.6% -Eau de javel à 2.6% -Cydectine à 0.1% -Lévamisole à 1% -Albendazole à 1% -Ivermectine à 1% -Lugol c) Equipements et matériels -Béchers -Tube Falcon (50 ml) -Tube eppendorffs 1.5 ml,2ml -Tube cristal(5ml) -Fiole jaugée -Pipette jaugée -Poire à pipeter -Micropipettes(P20,P200,P1000) Plaque quadrillée(comptage) - Vortex - Agitateur magnétique -Agitateur pour maintenir une agitation
constante des tubes -Barreau aimanté
-Microscope optique -Centrifugeuse
d) Mode opératoire
16 Les larves de l’espèce Haemonchus Contortus obtenues préalablement par la méthode de Baermann sont comptées. La lecture au microscope optique de 10 gouttes de 10 μl est réalisée On obtient donc pour chaque souche :
Souche résistante Souche sensible
90 L3/100μl 900L3/1ml 45000L3/50ml 333000L3/370ml 111L3/100μl 1110L3/1ml 45000L3/40.54 ml 204240L3/184ml 70L3/ 10μl 700L3/1ml 45000L3/65 ml 115500L3 dans 165 ml
Une fois le nombre de larves connues, on peut calculer le nombre de PBS nécessaire qu’il faudra ajouter pour la dilution larvaire afin d’obtenir une solution à 2000L3/ml :
Souche résistante Souche sensible
40000/2000=20 ml de PBS 45000/2000=22.5 ml de PBS 45000/2000=22.5 ml de PBS La solution larvaire placée dans deux tubes Falcon de 50 ml est centrifugée deux fois à 2800tr/min pendant 15 min à 25°C. Le surnageant jeté et le culot récupéré est mis en suspension dans du PBS puis homogénéisé au vortex.
Test de la dilution de javel
Trouver la bonne dilution reste l’étape la plus importante pour réussir ce test. L’objectif étant d’obtenir 100% de dégainement à T60 (60 min) ou T70 (70min). Les souches sont soumises à plusieurs dilutions de NaCl (16.6%)/Javel (2.6%). Pour chaque dilution testée 1ml de celle-ci est ajoutée à 1 ml de solution larvaire à 2000L3/ml dans des tubes cristaux bien identifiés et homogénéisés .Pour le témoin PBS 1 ml de solution larvaire est ajoutée à 1 ml de PBS. Toutes les 10 min de T0 (0 min) à T70, 200μl de chaque tube (solution larvaire+dilution) est prélevée après homogénéisation puis transférée dans des tubes eppendorfs (2ml) dans lesquels 20μl de lugol sont préalablement distribués .Le contenu de chaque tube est lu.
Mise en contact des larves avec les anthelminthiques et tanins
condensés
La dilution de javel étant fixée à 1/180 pour la souche résistante et 1/100 pour la souche sensible, 0.5ml de solution larvaire à 2000L3/ml est prélevée sous agitation et y est placée avec 0.5 ml d’anthelminthique ou tanins condensés dans des tubes eppendorfs de 2 ml sous agitation constante pour une durée d’incubation de 3h. Au bout de 3h d’incubation, les larves sont centrifugées afin d’être lavées. Trois centrifugations successive à 5000tr/min, 21°C pendant 5 à 10 min sont réalisées. A chaque centrifugation le maximum de surnageant est retiré et le culot est repris avec 0.5 ml de PBS.
17 Ajustement du test de la dilution de javel
Dans des eppendorfs de 2 ml, 100μl de solution larvaire à 2000L3/ml et 100μl de la
dilution de javel retenue sont mis en agitation afin de confirmer la bonne dilution de javel qui permettra d’avoir 100% de dégainement au bout de 60 ou 70 min.
Test de dégainement
La solution précédemment obtenue (larves mises en contact avec anthelminthiques ou tanins condensés+PBS) est homogénéisée. Dans des tubes eppendorfs de 2 ml sont placées 100μl de solution larvaire (larve mise en contact avec anthelminthique ou tanins condensés) à 2000L3/ml et 100μl de la dilution de javel retenue. Pour chaque anthelminthique et tanins condensés ,5 répétitions ont été réalisé à T 60 et T 70 pour les larves résistantes et T 60 pour les larves sensibles. A l’issue des 3H, 20μl de lugol sont ajoutés afin de fixer les larves. Le nombre de larves dégainés est observé au microscope optique dans 10 gouttes de 20μl.
e) Analyse
Une lecture et un comptage du nombre de larves gainées et dégainées est réalisée afin de saisir les données sur un tableur Excel .Puis le pourcentage de larves dégainées par rapport aux larves gainées est déterminé selon la formule :.
%de larves dégainés= *100
C. Analyse statistique
Les données obtenues ont été soumises à une analyse de variance par le logiciel Minitab et les moyennes ont été comparées deux à deux. La Pr value du test statistique permettant de comparer les moyennes (traitement et témoin) fixée à 95% pour conclure à l’équivalence des moyennes. Quand les Pr value est inférieur à 5% nous pouvons dire qu’il y a une différence significative entre les moyennes comparées.
IV. Résultats et discussions
A. Caractérisation de la souche
1. Test de migration
Les résultats obtenus pour le test de migration sont présentés dans le tableau 1 et la figure 7.Les moyennes ne partageant aucune lettre sont sensiblement différentes.
18 Souche sensible
Le test de migration réalisé sur la souche sensible montre un pourcentage de migration brut proche des 100% pour le témoin négatif PBS, ce qui démontre le bon fonctionnement du test (tableau1).
Les résultats concernant le pourcentage d’efficacité par rapport au PBS (tableau 1 et figure 7) montrent que tous les anthelminthiques testés ont des effets significativement différents de celui du témoin négatif PBS et inhibent la migration larvaire. Le lévamisole et l’ivermectine ont des efficacités supérieures et non significativement différentes entre elles. L’albendazole a une efficacité modérée.
Les résultats montrent que la souche est donc sensible à la cydectine, au lévamisole, à l’albendazole et à l’ivermectine. On note cependant une plus faible efficacité pour la cydectine, qui pourrait s’expliquer par la faible concentration testée, ce résultat est donc à interpréter avec précaution.
Le test de migration larvaire peut donc permettre de mettre en évidence la résistance
à l’albendazole, au l vamisole, à l’ivermectine et potentiellement à la cydectine.
Souche à caractériser
Les résultats montrent que le test sur la souche à caractériser à bien fonctionné puisqu’ on obtient bien un pourcentage de migration brut proche de 100% pour le contrôle négatif PBS (tableau 1).
La différence significative d’efficacité par rapport au PBS montre bien la sensibilité de
la souche au lévamisole. D’autre part, les effets de l’albendazole et de la cydectine ne
sont pas significativement différents de celui du PBS, ce qui démontrerait une résistance significative de la souche à ces deux produits (tableau 1, groupement). Les résultats de l’ivermectine montrent une résistance modérée. Le résultat obtenu avec la cydectine reste cependant à interpréter avec précaution compte tenu de la faible concentration testée.
Souche sensible Souche à caractériser
Traitements % de migration brut Groupement % de migration brut Groupement PBS 94.4 a 90.54 a Lévamisole 0.30 d 2.77 c Albendazole 38.38 c 66.17 a b Ivermectine 9.09 d 38.03 b c
19
Cydectine 70.00 b 103.88 a
Tableau 1 : Pourcentage de migration brut des différents anthelminthique et du témoin négatif pour la souche sensible et la souche à caract riser d’Haemonchus contortus.
Figure 7 : Effet des anthelminthiques sur la migration des larves L3 d’Haemonchus Contortus de la souche sensible et la souche à caractériser par rapport au témoin PBS.
2. Test de dégainement
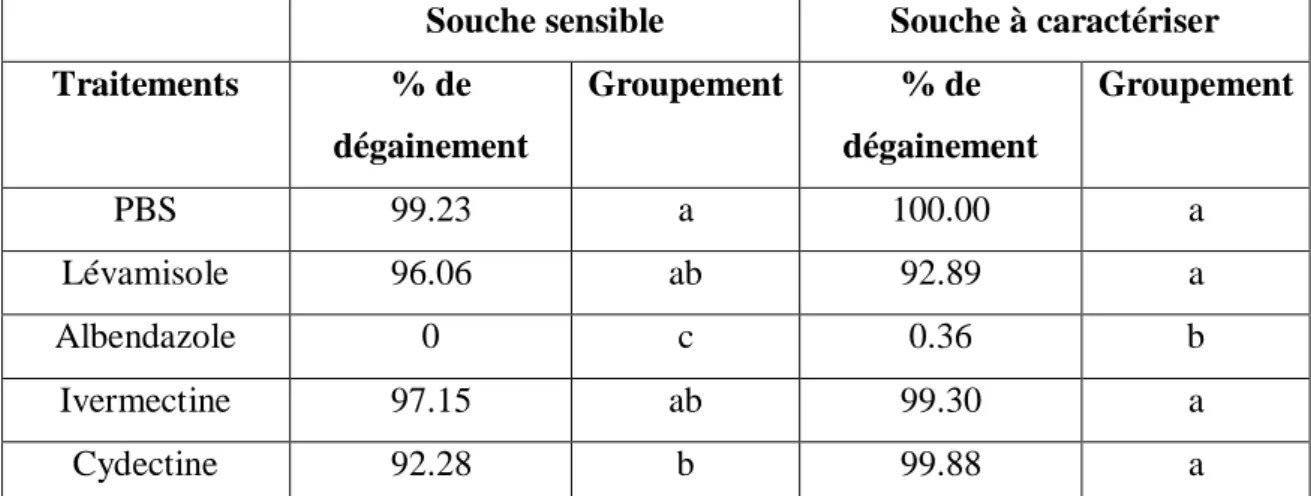
Les résultats obtenus pour le test de dégainement avec les produits anthelminthiques de synthèse sont présentés dans le tableau 2 et la figure 8. Les moyennes ne partageant aucune lettre sont sensiblement différentes.
Souche sensible
Le témoin négatif PBS a bien fonctionné pour ce test puisqu’ on a 100% de dégainement à 60 min (à la concentration 1/100 pour la souche sensible et à la concentration 1/180 pour la souche à caractériser), permettant la poursuite du cycle parasitaire d’ Haemonchus Contortus (tableau2).
La figure 8 montre que seul l’albendazole a un effet significatif sur le dégainement : il l’inhibe à 100%. Les autres anthelminthiques n’agissent pas sur le dégainement puisqu’ ils ont un effet non significativement différent de celui du PBS. De plus, on ne peut pas conclure avec certitude à la sensibilité ou non de la souche à la cydectine compte tenu de faible concentration testée.
Le test de dégainement peut donc permettre de mettre en évidence la résistance à l’albendazole. Souche à caractériser -50 0 50 100 150
Pourcentage d' efficacité des antheminthiques par rapport au PBS
Souche sensible Souche à carctériser
20 Le témoin négatif PBS de la souche à caractériser a montré un pourcentage de dégainement de 100%, ce qui démontre un bon fonctionnement du test (tableau2). Le lévamisole, l’ivermectine et la cydectine ont des effets non significativement différents de celui du PBS sur la souche (tableau 2, groupement). Conformément au résultat obtenu sur la souche sensible témoin, on ne peut conclure que la souche soit sensible ou non à ces 3 produits, ce test ne permettant pas de le faire. Cependant, il est possible d’affirmer que la souche est sensible à l’albendazole (effet significativement différent de celui du PBS) (figure 8).
Tableau 2 : Pourcentage de dégainement des différents anthelminthiques et du témoin négatif PBS
pour la souche sensible aux anthelminthiques et la souche à caractériser.
Figure 8 : Effet des anthelminthique sur le d gainement des larves L3 d’Haemonchus Contortus de la souche sensible et la souche à caractériser.
B. Evaluation de l’effet anthelminthique de tanins condensés sur la souche à caractériser. -20 0 20 40 60 80 100 120 Souche sensible Souche à caractériser
Souche sensible Souche à caractériser
Traitements % de dégainement Groupement % de dégainement Groupement PBS 99.23 a 100.00 a Lévamisole 96.06 ab 92.89 a Albendazole 0 c 0.36 b Ivermectine 97.15 ab 99.30 a Cydectine 92.28 b 99.88 a
21 Les résultats obtenus pour les tests de migration et de dégainement post-incubation avec les tanins condensés sont présentés dans le tableau 3 et les figures 9 et 10. Les moyennes ne partageant aucune lettre sont sensiblement différentes.
1. Effet sur la migration
Il n’y a pas d’effet significatif des tanins condensés (TC) observés sur la migration de la souche à caractériser : Il y a plus de 98% de migration et les effets de tous les TC sont non significativement différents du témoin PBS (tableau 3, groupement). Deux hypothèses : soit les TC n’ont pas d’effet sur ce stade parasitaire, soit la souche est résistante aux TC.
Traitements % de migration Groupement
PBS 100 a
TCM 98,59 a
TCI 136,85 a
TCP 123,24 a
TCA 107,04 a
Tableau 3 : Pourcentage de migration des différents tanins condensés et du témoin négatif pour la souche à caractériser.
Figure 9 : Effet des tanins condens s sur la migration des larves L3 d’Haemonchus Contortus de la souche à caractériser rapporté au témoin PBS.
2. Effet sur le dégainement
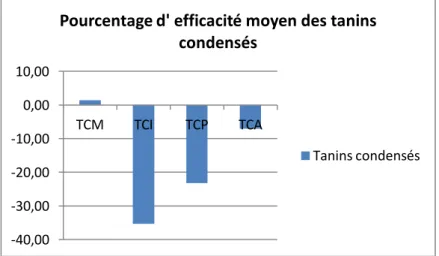
En comparant le pourcentage de dégainement des larves L3 avec celui du témoin négatif PBS (tableau 4) on observe que le pourcentage de dégainement des quatre tanins varie
-40,00 -30,00 -20,00 -10,00 0,00 10,00 TCM TCI TCP TCA
Pourcentage d' efficacité moyen des tanins condensés
22 entre 0 et 3.3% et est significativement différent du témoin PBS. Lorsque le pourcentage de dégainement est proche de zéro cela signifie que les tanins des plantes ont un effet inhibiteur sur le dégainement.
Traitements % de dégainement Groupement
PBS 100 a
TCM 0 b
TCI 1.34 b
TCP 1.32 b
TCA 3.29 b
Tableau 4 : Pourcentage de dégainement des différents tanins condensés et du témoin négatif pour la souche sensible et la souche à caractériser.
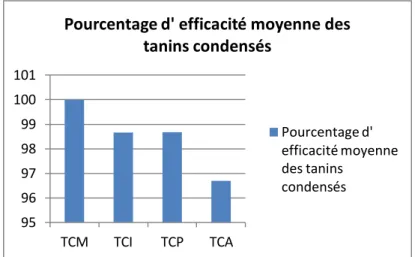
La figure 10 montre les efficacités moyennes des différents tanins testés sur le dégainement larvaire de la souche d’ Haemonchus Contortus à caractériser. Les résultats montrent une efficacité significative des 4 tanins condensés sur le dégainement larvaire (tableau 4, groupement). Les TC ont donc un effet anthelminthique puisqu’ ils inhibent le dégainement larvaire d’ Haemonchus Contortus à forte concentration (2.5mg/ml). Les larves restent gainées et ne peuvent pas poursuivre leur cycle.
Les différents TC montrent des efficacités significativement équivalentes sur le dégainement de la larve L3 (tableau 4, groupement). La souche testée est donc
sensible aux TC.
Figure 10 : Effet des tanins condens s sur le d gainement des larves L3 d’Haemonchus Contortus de la souche à caractériser, rapporté au PBS.
95 96 97 98 99 100 101 TCM TCI TCP TCA
Pourcentage d' efficacité moyenne des tanins condensés
Pourcentage d' efficacité moyenne des tanins
23 Les tanins utilisés pour ce test sont efficaces à forte concentration (2.5mg/ml) donc il faudra refaire le test en faisant varier les concentrations afin de déterminer l’effet dose et pourvoir calculer la CI50.
C. Bilan
Ces 2 tests avec les tanins condensés montrent qu’ils n’ont pas toujours d’effet sur tous les stades parasitaires et qu’ils ont un mode d’action différent de celui des anthelminthiques de synthèse. Cela montre la nécessité de procéder à plusieurs essais sur les différents stades afin de pouvoir conclure à un effet antiparasitaire lorsque l’on évalue une nouvelle substance ou un nouveau produit. D’après les résultats obtenus, il est possible de conclure que le test LMI n’est pas approprié à l’évaluation de l’effet antiparasitaire des TC et que c’est le test de dégainement qui est le plus adapté.
V. Conclusions et perspectives
L’objectif de cette étude était de caractériser une souche d’ Haemonchus contortus pour sa résistance aux principaux anthelminthiques de synthèse ; et d’évaluer l’effet d’extraits de tanins condensés sur cette souche via des essais in vitro sur la migration et le dégainement des larves L3 (infestantes) du parasite Haemonchus contortus.
Suite à cette étude il en ressort que :
-Pour mettre en évidence la résistance à l’albendazole, l’ivermectine et au lévamisole le test de migration serait le plus approprié. Le test de dégainement pourrait être utilisé afin de montrer une résistance à l’albendazole.
-Il faudra procéder à de nouveaux essais en utilisant de la cydectine pure afin de pourvoir confirmé le choix du test et la résistance de la souche. De plus, le test de dégainement devra être poursuivi pour déterminer la CI50 et ainsi pouvoir quantifier de manière plus fine la résistance aux anthelminthiques.
Globalement, la souche d’Haemonchus contortus a été caractérisée comme étant sensible au lévamisole et modérément résistante à l’ivermectine et à l’albendazole. Concernant les effets des tanins condensés : Le test de dégainement serait le plus approprié pour évaluer l’effet anthelminthique des tanins. Les tanins condensés testés présentent un effet anthelminthique sur la souche d’Haemonchus contortus caractérisée. L’utilisation de ressources naturelles locales aux propriétés anthelminthiques est une solution alternative positive à l’utilisation des médicaments anthelminthiques : elle peut permettre non seulement de préserver l’environnement en réduisant les intrants, mais aussi de diminuer les dépenses de l’éleveur en produits sanitaire. Les résultats de cette
24 étude confirment ces propriétés et encouragent à valoriser la flore guadeloupéenne en ce sens. L’analyse des structures chimiques des tanins condensés permettrait de comprendre les différences d’efficacités et de modes d’actions observés.
VI. Bilan personnel
Ce stage a été très enrichissant pour moi car il a été ma première expérience dans le domaine professionnel. J’ai pu acquérir de nombreuses connaissances et enrichir mon savoir. Dans le cadre du stage j’ai travaillé sur différent test comme le test de migration larvaire et le test de dégainement qui m’était inconnue jusqu’ à ce jours. Durant ce stage j’ai pu développer mon esprit critique sur les différents résultats obtenus, de participer aux activités et de me confronter aux problématiques scientifiques du laboratoire. Cette expérience m’a permis d’affiner mon projet professionnel et d’élargir ma vision sur celui-ci.
Avant de commencer ce stage j’avais quelques pensées négatives sur le travail en laboratoire de recherche et à l’issus de mon stage je n’en retiens que des point positif.
25
Annexe
METHODE DE BAERMANN
La méthode de Baermann est une technique d’enrichissement permettant de concentrer les larves. Ce procédé est basé su le fait que les larves de Nématodes coulent dans une grande quantité d’eau dans laquelle il n’existe pas de tension de surface. Enfin, notons que, pour que cette technique soit interprétable, il faut que les larves soient vivantes. On doit donc utiliser un prélèvement très frais.
Pr sentation de l’appareil de Baermann
L’appareil de Baerman est composé d’un entonnoir fixé à une potence. Cet entonnoir est prolongé par un tube clampé. Le prélèvement est disposé dans la de la gaze placée dans une passoire à thé, le tout étant posé sur l’entonnoir.
Mode opératoire
Réaliser l’inspection macroscopique du prélèvement.
Homogénéiser le prélèvement au moyen d’un mortier et d’un pilon (humidifier si les fèces sont trop sèches)
Peser 10 à15 grammes de l’échantillon et les placer dans le fond d’une passoire à thé Remplir l’appareil de Baerman d’une solution saline physiologique à 25°C
Poser la passoire remplie sur les rebords de l’entonnoir.
Compléter le niveau de saline de sorte que celui-ci affleure la partie inférieure du prélèvement
la gaze Entonnoir
les larves L3
tube clampé
Laisser reposer pendant au moins 6 à 8 heures
Déposer quelques gouttes prélevées au fond de la solution (ou du culot) sur une lame porte objet.
26 Observer directement au microscope sans recouvrir d'une lamelle.
Ouvrir le champ et recueillir10 à 15 ml du liquide dans un tube (centrifuger éventuellement 10 minutes à 1500 tours/min et récolter le culot avec une pipette
Avantages
La technique est facile et peu coûteuse.
Par ailleurs, l'enrichissement obtenu est bon et les débris sont limités dès lors que l'appareil n'a pas été secoué au cours de l'examen.
Cette méthode est la meilleure pour la récolte et l'identification des larves de Nématodes. Ces larves sont facilement isolées et non déformées contrairement à la technique de flottation.
Limites
La méthode de Baermann ne permet d'isoler que des larves.
L'analyse quantitative n'est pas possible ultérieurement car les larves sont difficilement
dénombrables en cellule de Mac Master et que leur répartition dans la solution récoltée n'est pas homogène.
Il faut impérativement que les matières fécales soient fraîches pour que les larves qu'elles contiennent soient vivantes.
27
Référence bibliographiques
Athanasiadou, S., Kyriazakis, I., Jackson, F., Coop, R.L., (2001), Direct anthelmintic effects of condensed tannins towards different gastrointestinal nematodes of sheep: in vitro and in vivo studies, Veterinary parasitology 99, 205-219.
Brunet, S., Jackson, F., Hoste, H., (2008a) Effects of sainfoin (Onobrychis viciifolia) extract and monomers of condensed tannins on the association of abomasal nematode larvae with fundic explants,International journal for parasitology 38, 783-790.
Brunet, S., Montellano, C.M.-O.d., Torres-Acosta, J.F.J., Sandoval-Castro, C.A., Aguilar Caballero, A.J., Capetillo-Leal, C., Hoste, H.,( 2008b), Effect of the
consumption of Lysiloma latisiliquum on the larval establishment of gastrointestinal nematodes in goats,Veterinary Parasitology,157, 81-88.
Hoste, H., Jackson, F., Athanasiadou, S., Thamsborg, S.M., Hoskin, S.O., (2006),The effects of tannin rich plants on parasitic nematodes in ruminants, Trends in parasitology 22, 253-261.
Hounzangbe-Adote, M.S., Paolini, V., Fouraste, I., Moutairou, K., Hoste, H.,( 2005). In vitro effects of four tropical plants on three life-cycle stages of the parasitic nematode, Haemonchus
Contortus,Research in veterinary science 78, 155-160.
Mahieu, M., Ferré, B., Madassamy, M., Mandonnet, N.,( 2014), Fifteen years later, anthelmintic resistances have dramatically spread over goat farms in Guadeloupe,Vet. Parasitol. 205, 379-384.
Marie-Magdeleine, C., Udino, L., Philibert, L., Bocage, B., Archimede, H., (2010), In vitro effects of Cassava (Manihot esculenta) leaf extracts on four development stages of Haemonchus
Contortus,Veterinary parasitology 173, 85-92.
Min, B.R., Barry, T.N., Attwood, G.T., McNabb, W.C., (2003), The effect of condensed tannins on the nutrition and health of ruminants fed fresh temperate forages: a review, Animal Feed Science and Technology 106, 3-19.
Min, B.R., Pinchak, W.E., Fulford, J.D., Puchala, R., (2005), Effect of feed additives on in vitro and in vivo rumen characteristics and frothy bloat dynamics in steers grazing wheat pasture,Animal Feed Science and Technology 123-124 PART 2, 615-629.
Paolini V, Dorchies P, Hoste H, (2003), Effets des tanins condensés et des plantes à tanins sur les strongyloses gastro-intestinales chez le mouton et la chèvre,Alter Agri, 61, 17-19.)
Kotze A, Prichard R, (2016), Chapter nine-anthelmintic resistance in Haemonchus contortus: history, mechanisms and diagnosis,Advances in parasitology, 93, 397-428.)
28 Hounzangbe-Adote M, Paolini V, Fouraste I , Moutairou K, Hoste H, (2005),In vitro effects of four tropical plants on three life-cycle stages of the parasitic nematode, Haemonchus contortus,Research in Veterinary Science, 78, 155-160.)
Rozette L, (2009), Strongles digestifs et pulmonaires chez les caprins, Bulletin de l’Alliance pastorale, 793, 2-8.
Euzéby J, (2008), Grand dictionnaire illustré de parasitologie médicale et vétérinaire, Lavoisier ,729-731.)
Várady M, Corba J, Letková V, Kovác G,(2008), Comparison of two versions of larval development test to detect anthelmintic resistance in Haemonchus contortus, Veterinary Parasitology 160,267-271.)