Contribution au développement d’un procédé de
conservation des haricots verts par la synergie de
l’acétate de potassium électro-activé et d’un traitement
thermique modéré
Mémoire
Alexandre Genois
Maîtrise en génie agroalimentaire
Maître ès sciences (M. Sc.)
Québec, Canada
© Alexandre Genois, 2014
Résumé
Dans le présent travail, l’efficacité d’une solution d’acétate de potassium électro-activée combinée à un traitement thermique modéré sur la conservation des haricots en conserve a été démontrée. L’électro-activation d’une solution d’acétate de potassium 0,0625M pendant 60 min à une intensité de 200 mA a permis d’obtenir un pH de 3,8 et un potentiel redox de +989 mV. Combinée à un traitement thermique de 95°C pendant 10 min, cette solution électro-activée, utilisée à titre de saumure des haricots verts en conserve, a détruit complètement les spores et les bactéries de Clostridium sporogenes. L’efficacité de l’effet barrière est donc prouvée. Comparativement au traitement standard, la texture des haricots est largement améliorée; il est jusqu’à six fois plus ferme et croustillant. L’absence de sodium et de chlore dans la solution électro-activée fait d’elle un produit de l’avenir. Ce nouveau procédé permet une importante économie de temps et d’argent.
Tables des matières
Résumé ... iii
Tables des matières ... v
Liste des tableaux ... ix
Liste des figures ... xi
Dédicaces ... xiii
Remerciements ... xv
Introduction ... 1
CHAPITRE 1 : REVUE DE LITTÉRATURE ... 5
1.1 Mise en contexte ... 5 1.2 La conservation... 5 1.3 Effet barrière ... 6 1.3.1 Acidification ... 6 1.3.2 Ultrahaute pression ... 7 1.3.3 Agents de conservation ... 8
1.3.4 Modulation du potentiel redox ... 9
1.3.5 Présence d’oxygène ... 10
1.3.6 Électro-poration ... 10
1.4 Bactéries sporulées présentes dans les aliments ... 12
1.5 Électro-activation ... 12
1.5.1 Concept d’électro-activation ... 12
1.5.2 Influence des électrodes ... 13
1.5.3 Milieu de réaction et phénomènes physico-chimiques associés ... 14
1.5.4 Facteurs influençant l’efficacité du procédé ... 16
1.6 Utilisations récentes de l’électro-activation ... 17
1.6.1 Domaine de l’agroalimentaire ... 17
1.6.2 Domaine de la santé ... 23
CHAPITRE 2 : HYPOTHÈSE ET OBJECTIFS ... 27
2.1 Formulation de l’hypothèse de recherche ... 27
2.2 Objectif principal ... 28
2.3 Objectifs spécifiques ... 28
vi
3.1 Électro-activation : Génération et étude des solutions ... 29
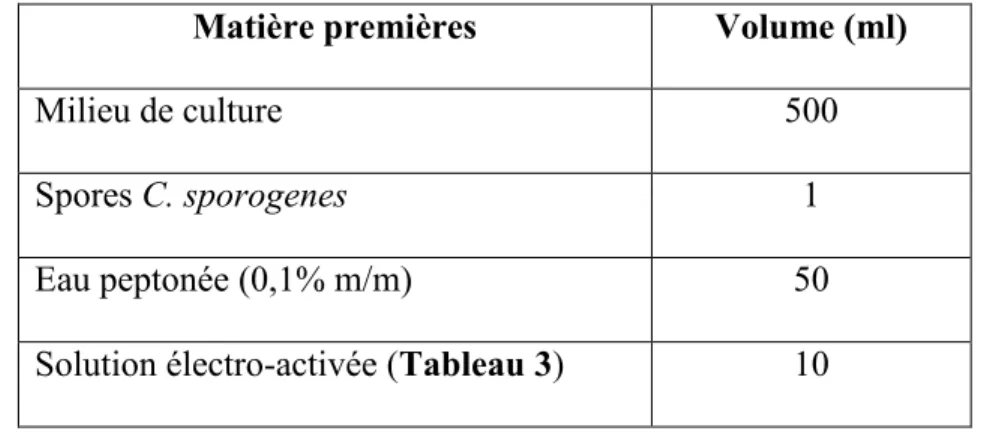
3.1.1 Matières premières ... 29
3.1.2 Le réacteur d’électro-activation ... 30
3.1.3 Protocole d’électro-activation ... 35
3.1.4 Mesures et prise de données... 35
3.1.5 Analyses statistiques ... 36
3.2 Microbiologie : Effet de la solution électro-activée sur les spores de Clostridium sporogenes ... 37
3.2.1 Matières premières ... 37
3.2.2 Préparatifs ... 39
3.2.3 Travail sous la hotte ... 40
3.2.4 Compte sur plaque ... 41
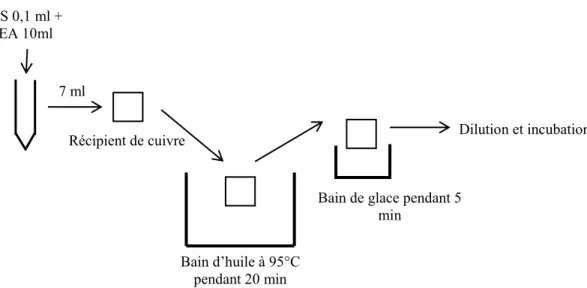
3.2.5 Combinaison de l’électro-activation avec un traitement thermique ... 42
3.3 Qualité : Comparaison de l’effet des traitements sur les caractéristiques nutritionnelles et organoleptiques du haricot ... 44
3.3.1 Matière première ... 44
3.3.2 Préparation des échantillons... 44
3.3.3 Texture ... 45
3.3.4 Perte de matière sèche dans la saumure ... 46
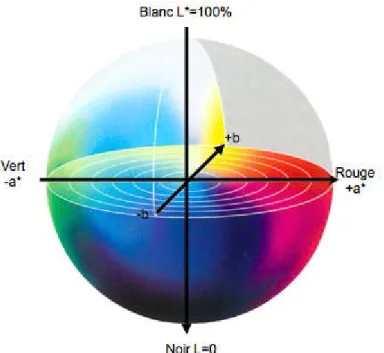
3.3.5 Couleur ... 46
3.3.6 Dosage de l’acide ascorbique (vitamine C) ... 48
3.3.7 Analyse au microscope électronique ... 50
CHAPITRE 4 : RÉSULTATS ET DISCUSSION ... 51
4.1 Électro-activation : Étude des solutions générées ... 51
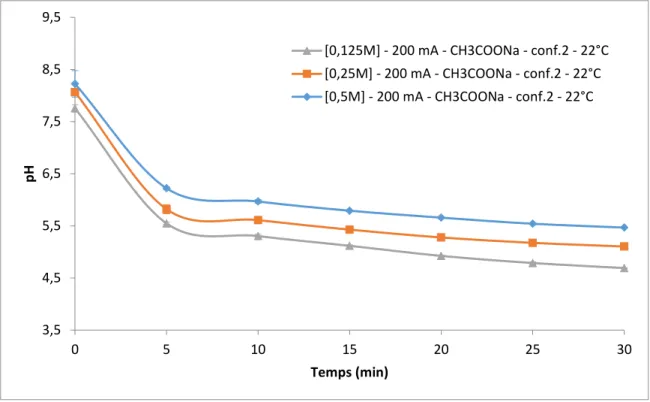
4.1.1 Effet de la concentration ... 52
4.1.2 Effet de l’intensité du courant électrique ... 59
4.1.3 Effet du temps ... 66
4.1.4 Optimisation du procédé ... 67
4.2 Microbiologie : Effet de la solution électro-activée sur les spores de C. sporogenes ... 72
4.2.1 Effet de la solution électro-activée sur les spores de C. sporogenes ... 72
4.2.2 Effet de la solution électro-activée et d’un traitement thermique sur les spores de C. sporogenes . 76 4.3 Qualité : Effet de la combinaison des traitements sur les haricots ... 78
4.3.1 Effet sur la texture ... 78
4.3.3 Effet sur la couleur ... 84
4.3.4 Effet sur la teneur en acide ascorbique (vitamine C) ... 86
4.3.5 Analyse au microscope électronique ... 88
Conclusion et perspectives ... 91
Liste des tableaux
Tableau 1: Caractéristiques des membranes échangeuses d’ions MK-40 ... 32
Tableau 2: Les facteurs et leurs niveaux du plan d'expérience 1 ... 34
Tableau 3: Conditions utilisées dans le bloc d'expérience 2 ... 35
Tableau 4: Conditions de traitement de la solution électro-activée ... 37
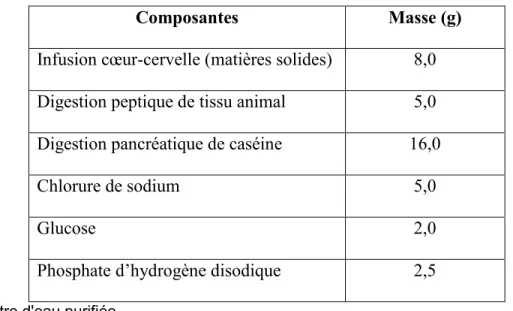
Tableau 5: Composition du milieu BHIS (BD) ... 38
Tableau 6: Éléments du milieu de culture ... 38
Tableau 7: Matériel requis pour un bloc ... 39
Tableau 8: Matière première pour un bloc ... 40
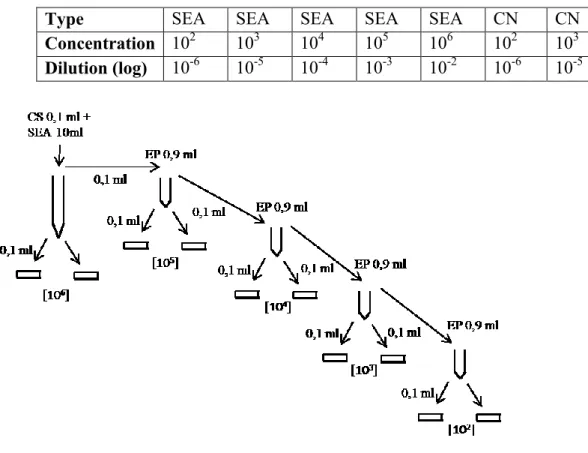
Tableau 9: Dilutions pour les tests microbiologiques ... 41
Tableau 10 : Paramètres pour l’analyse de la texture ... 46
Tableau 11 : Les facteurs et leurs niveaux ... 51
Tableau 12 : Résumé de l’analyse SAS ... 52
Tableau 13 : Objectif visé pour chaque paramètre ... 68
Tableau 14 : Caractéristiques de la solution électro-activée optimale obtenue ... 72
Liste des figures
Figure 1 : Mouvements des ions dans une cellule d’électro-activation à trois compartiments ... 16
Figure 2 : Conformation chimique des sels d’acétate ... 29
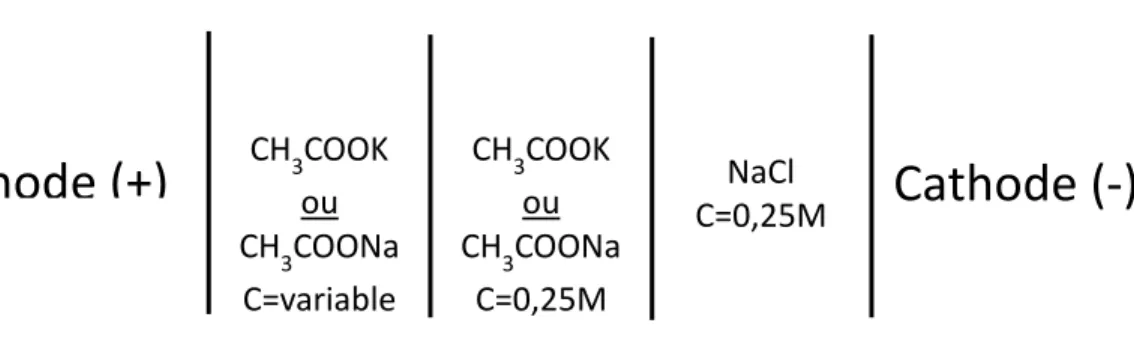
Figure 3: Emplacement des solutions et leur concentration ... 30
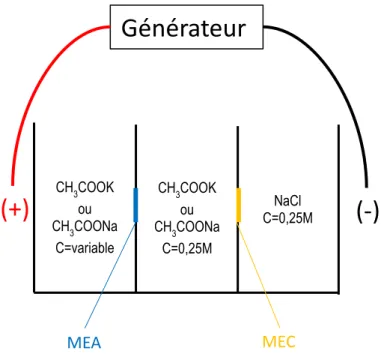
Figure 4: Représentation schématique du réacteur d'électro-activation (MEA: Membrane échangeuse d'anions) (MEC: Membrane échangeuse de cations)... 33
Figure 5: Schéma des dilutions pour la SEA ... 41
Figure 6: Graphique du traitement thermique à 95°C ... 43
Figure 7: Schéma du traitement thermique ... 43
Figure 8 : Photo de la cellule mini Kramer Shear ... 45
Figure 9 : Sphère de la chromaticité absolue L*a*b* ... 47
Figure 10 : Évolution du pH en fonction du temps pour la configuration #1, CH3COOK, à température ambiante pour les 3 niveaux de concentration étudiés. Dans tous les cas, la variation des moyennes ne dépassaient pas 5%. ... 53
Figure 11 : Évolution du pH en fonction du temps pour la configuration #2, CH3COONa, à température ambiante pour les 3 niveaux de concentration étudiés. Dans tous les cas, la variation des moyennes ne dépassaient pas 5%. ... 54
Figure 12 : Évolution du potentiel redox en fonction du temps pour la configuration #1, CH3COOK, à température ambiante pour les 3 niveaux de concentration étudiés. ... 55
Figure 13 : Évolution du pH en fonction du temps pour la configuration #2, CH3COONa, à température ambiante pour les 3 niveaux de concentration étudiés. ... 56
Figure 14 : Évolution de la résistance du système en fonction du temps pour la configuration #1, CH3COOK, à température ambiante pour les 3 niveaux de concentration étudiés. ... 57
Figure 15: Évolution de la température de la solution anodique en fonction du temps pour la configuration #1, du CH3COOK, à température ambiante pour les 3 niveaux de concentration étudiés. ... 59
Figure 16 : Évolution du pH en fonction du temps pour la configuration #1, CH3COOK [0,125M], à température ambiante pour 100 mA et 200 mA. ... 60
Figure 17 : Évolution du pH en fonction du temps pour la configuration #2, CH3COONa [0,125M], à température ambiante pour 100 mA et 200 mA. ... 61
Figure 18 : Évolution du potentiel redox en fonction du temps pour la configuration #1, CH3COOK [0,125M], à température ambiante pour 100 mA et 200 mA. ... 62
Figure 19 : Évolution de la température de la solution anodique en fonction du temps pour la configuration #1, CH3COOK [0,125M], à température ambiante pour 100 mA et 200 mA. ... 63
Figure 20 : Évolution du taux d’oxygène dissous dans la solution anodique en fonction du temps pour la configuration #1, CH3COOK [0,125M], à température ambiante pour 100 mA et 200 mA. 65 Figure 21 : Évolution du pH en fonction du temps pour la configuration #1, CH3COOK, 200 mA, à température ambiante pour [0,0625M] et [0,125M]. ... 69
Figure 22 : Évolution du potentiel redox en fonction du temps pour la configuration #1, CH3COOK, 200 mA, à température ambiante pour [0,0625M] et [0,125M]. ... 70
Figure 23 : Évolution de la température de la solution anodique en fonction du temps pour la configuration #1, CH3COOK, 200 mA, à température ambiante pour [0,0625M] et [0,125M]. ... 71
xii
Figure 24 : Le nombre de spores de C. sporogenes en fonction du temps d’électro-activation et de relaxation de la solution CH3COOK sur une échelle logarithmique. ... 74
Figure 25 : Le nombre des spores de C. sporogenes en fonction de la température de traitement sur une échelle logarithmique. ... 77 Figure 26 : La force de cisaillement en fonction du temps pour un haricot 6 jours après avoir subi le traitement standard. ... 79 Figure 27 : La force de cisaillement en fonction du temps pour un haricot 6 jours après avoir subi le traitement nouveau. ... 80 Figure 28 : Évolution de la fermeté en fonction du temps pour un haricot ayant subi le traitement standard et un haricot ayant subi le traitement nouveau. ... 81 Figure 29 : Évolution du travail de cisaillement en fonction du temps pour un haricot ayant subi le traitement standard et un haricot ayant subi le traitement nouveau. ... 82 Figure 30 : Évolution de la perte de matière sèche en fonction du temps pour un haricot ayant subi un traitement standard «STD» et un haricot ayant subi un traitement nouveau «NOU». ... 83 Figure 31: Évolution du chroma en fonction du temps pour un haricot ayant subi un traitement standard «STD» et un haricot ayant subi un traitement nouveau «NOU». ... 85 Figure 32 : Évolution de l’angle de nuance en fonction du temps pour un haricot ayant subi un traitement standard «STD» et un haricot ayant subi un traitement nouveau «NOU». ... 86 Figure 33 : Évolution de la teneur en acide ascorbique en fonction du temps pour un haricot ayant subi un traitement standard «STD» et un haricot ayant subi un traitement nouveau «NOU». ... 87 Figure 34: Paroi d’un haricot neuf jours après avoir subi un traitement standard. ... 89 Figure 35: Paroi d’un haricot neuf jours après avoir subi un traitement nouveau. ... 90
Dédicaces
À mes parents, proches et amis, Avec qui la vie prend réellement son sens. À Mohandas K. Gandhi (1869-1948), Qui a su guider l’Humanité vers un monde sain, juste et équilibré. À tous ceux pour qui donner signifie recevoir. À tous ceux qui agissent pour assurer la sécurité alimentaire, Afin de réaliser, un jour, le rêve où CHAQUE individu pourra manger librement.
Remerciements
Mes remerciements s’adressent tout d’abord à mon directeur de recherche, M. Mohammed Aider, qui m’a permis de repousser mes limites scientifiques. Son expertise et son désir d’innovation m’ont guidé tout au long de la maîtrise. Sa grande disponibilité, à tous moments, font de lui un directeur de recherche à l’écoute et un modèle pour ses collègues. Ensuite, je tiens à remercier toute l’équipe, soit Amara Aït Aissa, Viacheslav Liato et Alexey Kastyuchik, pour leurs généreux conseils et tous les bons moments partagés au laboratoire.
Au niveau technique, je dois remercier Marine Béguin, Diane Gagnon, Céline Paquin et Jocelyne Giasson pour leur précieux support à travers les différentes étapes de la maîtrise. Leur aide est d’une énorme importance et je tiens à les remercier doublement.
Je ne passe pas sous le silence la qualité de l’environnement d’étude et de recherche à l’Université Laval autant au niveau des professeurs que du personnel administratif. Un grand merci à tous ceux que j’ai eu la chance de croiser le chemin pendant cette maîtrise. Un mémoire n’est certainement pas la réalisation d’un seul individu; il s’agit d’une œuvre commune à laquelle chacun a contribué de près ou de loin.
Introduction
Le haricot est une source importante de vitamine C, de pyridoxine et de minéraux comme le fer, le magnésium et le zinc (Amiot, 2012). Plusieurs de ces éléments essentiels pour l’alimentation humaine qu’on retrouve dans le produit frais se dégradent rapidement si les haricots ne sont pas transformés. La saison de récolte des haricots est de courte durée dans les pays nordiques comme le Canada et ne dure que quelques semaines. La grande quantité obtenue en peu de temps oblige les industries à traiter les légumes afin de conserver leur valeur nutritionnelle et d’assurer une disponibilité jusqu’à la saison suivante. Depuis le milieu du IXe siècle, l’appertisation se révèle un moyen éprouvé pour la conservation des produits périssables. C’est un traitement basé sur la stabilisation du produit par un traitement thermique rigoureux visant à inactiver la flore pathogène et d’altération. Plus tard, cette technique est appelée «stérilisation». Selon l’Agence canadienne d’inspection des aliments, le respect des critères de stérilisation est essentiel pour la sécurité du consommateur (A.C.I.A, 2013). Le principal danger est la bactérie
Clostridium botulinum qui peut engendrer de sérieux troubles de santé (Marcotte et al.,
2008) car, cette bactérie produit la toxine botulique; une neurotoxine extrêmement mortelle. Cependant, différents inconvénients résultent de ce traitement. Sur le plan énergétique, les coûts de chauffage pour atteindre le seuil de 121°C nécessaires à la stérilisation sont très élevés. Aussi, la période de temps d’exposition des haricots à cette chaleur intense crée des effets indésirables au niveau nutritionnel et organoleptique. Les vitamines présentes en grande quantité dans le produit frais sont partiellement décomposées par oxydation thermique (Amiot, 2012). Ceci réduit leur biodisponibilité. La dégradation de la matrice sous l’effet de la chaleur conduit à un haricot mou et moins goûteux qu’un produit frais. Des changements de couleur sont également un inconvénient majeur de la stérilisation à très haute température.
De plus, le lessivage des nutriments vers la saumure, qui est généralement non-consommée, diminue également la concentration vitaminique et minérale. En effet, la mise en conserve des haricots implique l’ajout de saumure, une solution saline qui aide au pouvoir de conservation et au goût (Arul, 2009). Selon Santé Canada (2013), les canadiens consomment plus du double de l’apport de sodium recommandé. La réduction de
2
l’utilisation de ce composé est donc souhaitable; voiremême essentiel du point de vue de santé publique, car, les dépenses gouvernementales liées aux soins de santé des maladies cardiovasculaires sont très importantes. Dans le but de réaliser l’objectif multilatéral consistant à améliorer la valeur nutritionnelle des légumes en conserves tout en diminuant leur apport en sodium et en réalisant des économies d’énergies, il est important de revoir la technologie de production de cet aliment. La voie la plus prometteuse consiste à utiliser l’effet barrière qui est un concept scientifique permettant de contrôler les contaminants microbiens par une combinaison synergique de plusieurs barrières dont l’effet individuel serait inefficace. La longue durée de conservation des haricots en conserve est due à l’effet combiné de l’immersion en solution saline, du traitement thermique et de l’emballage. Dans le procédé classique de fabrication des haricots, le pH et le potentiel redox ne contribuent pas à l’effet barrière. Or, il pourrait s’avérer intéressant de les utiliser afin de réduire les autres effets et leurs impacts indésirables. En plus, par rapport à la question du sodium, le remplacement des molécules sodiques pourraient être effectué par des sels d’acides organiques qui ne contiennent pas de sodium. En effet, ces substances solides présentent très peu de risques à l’état pur comparativement aux acides liquides. Par conséquent, la manutention par les employés, dans un cadre industriel, est plus sécuritaire. L’acétate de potassium se dissocie en présence d’eau. Il se combine ensuite avec les ions de la solution électro-activée pour former un acide organique, in situ.
L’électro-activation de solutions aqueuses permet de modifier leurs propriétés physico-électro-chimiques de manière intrinsèque. Il est donc possible de moduler par cette technique le pH, la teneur en oxygène (oxydants) et la valeur du potentiel redox d’une solution (Aider et al., 2012). Par conséquent, l’acidification de la saumure par la génération d’ions H+ au niveau de l’anode, le potentiel redox positif et la saturation en oxygène de la solution saline, toujours du côté de l’anode, agiraient comme des barrières supplémentaires qui permettraient d’inhiber la croissance de C. botulinum dans les légumes (haricots) en conserves (Aider et al,. 2012).
L’objectif poursuivi dans ce projet de maîtrise consiste à étudier les propriétés de solutions d’acétate de potassium soumises à l’électro-activation dans un réacteur
tri-comportemental et leur impact en combinaison avec des traitements thermiques modérés sur l’innocuité des haricots en conserve dans le but d’améliorer la valeur nutritionnelle du produit de réduire les coûts de conservation et l’empreinte environnementale du procédé de conservation tout en contribuant de façon significative à réaliser l’objectif national par rapport à la réduction de l’apport en sodium des aliments transformés industriellement.
CHAPITRE 1 : REVUE DE LITTÉRATURE
1.1 Mise en contexte
L’utilisation de solutions électro-activées pour la conservation des haricots en conserve touche à plusieurs domaines scientifiques, de la microbiologie au génie des procédés, en passant par l’électrochimie et la qualité des aliments. L’importance de la conservation des aliments sera d’abord étudiée. Ensuite, l’effet barrière dû à la combinaison de traitements sera évalué. Différents travaux retrouvés dans la littérature à propos de l’utilisation de facteurs combinés seront analysés. L’impact des traitements sur les bactéries sporulées présentes dans les aliments sera revu en détails. Finalement, l’électro-activation, du concept jusqu’aux utilisations, sera mis en évidence dans le cadre de ce travail.
1.2 La conservation
La production annuelle de légumes sur de grandes surfaces, dans les pays sous un climat tempéré, engendre une importante récolte en peu de temps. La synchronisation entre le producteur et le transformateur doit être idéale afin de diminuer les pertes de légumes frais. Au fil des siècles, plusieurs procédés ont été développés afin de conserver ces aliments jusqu’à la prochaine récolte, qui est généralement un an après. Ainsi, l’étude approfondie des propriétés des légumes et de leur évolution au cours du temps est rapidement devenue un secteur clé dans le domaine de l’agroalimentaire. À la fin du 18e siècle, Nicolas Appert a mis au point un principe qui, encore aujourd’hui, est le fondement des techniques de conservation. L’appertisation, ou communément nommée stérilisation, consiste en un traitement thermique sévère pour détruire toute forme de vie qui nuirait à l’innocuité du produit à travers le temps. Néanmoins, les coûts engendrés par ce chauffage à haute température sont élevés. De plus, la qualité nutritionnelle et organoleptique de l’aliment diminue (Amiot, 2012). Étant donné que la stérilisation a fait ses preuves au niveau de la salubrité, elle représente actuellement le seul traitement conforme à la loi au Canada (A.C.I.A, 2013). Cependant, d’autres techniques peuvent être utilisées afin de moduler les caractéristiques de l’aliment sans atteindre le barème thermique légal. De récentes recherches ont montré un résultat équivalent à la stérilisation en combinant
6
plusieurs procédés, dont un traitement thermique modéré combiné à une acidification efficace avec des acides organiques autorisés comme additifs alimentaires (Marcotte et al., 2008; Santos et al., 1992).
1.3 Effet barrière
Une multitude de paramètres peuvent être utilisés pour la conservation des aliments. Ces derniers sont parfois utilisés sous forme de combinaison afin d’obtenir la salubrité visée sans soumettre les aliments à des traitements extrêmes. Cette technique de conservation se nomme l’effet barrière (en anglais, hurdles technology). Leister (2000) a montré que plus de soixante types de barrières sont présentement accessibles dans le domaine alimentaire. Ces traitements se traduisent principalement par des variations de température, de pression, d’agents de conservation, du potentiel Redox et de pH qui modulent l’activité de l’eau, l’acidité et la conformation des macronutriments. De plus, l’inoculation avec des micro-organismes compétitifs comme les bactéries lactiques est la barrière microbiologique la plus utilisée (Leister, 2000). Cette dernière permet d’installer une flore sécuritaire qui, parfois, peut même se révéler bénéfique pour le consommateur. L’environnement de l’aliment est finalement contrôlé par un emballage adéquat et une atmosphère adéquatement contrôlée. Dans la conserverie, les industries doivent se soumettre à un sévère barème thermique afin d’être conforme à la loi. Les critères d’innocuité sont établis en fonction de la destruction complète des spores de Clostridium
botulinum. Étant donné que la stérilisation affecte de façon significative la valeur
nutritionnelle et organoleptique des aliments et comporte un coût énergétique élevé, la recherche de traitements substituts ou complémentaires est en plein essor.
1.3.1 Acidification
L’abaissement du pH permet d’augmenter la durée de conservation des aliments (Angumeenal et al., 2013). Cette augmentation de la concentration d’ions H+ dans le milieu peut être obtenue à partir de plusieurs types de traitement: chimique ou biologique. L’ajout d’acides organiques liquides permet d’avoir un résultat rapide et un contrôle serré sur le pH désiré. Cependant, cette technique nécessite la manipulation de produits qui peuvent
s’avérer très nocifs. L’ajout d’acides forts dans des solutions faiblement acide ou neutre est très réactif et donc dangereux. Une acidification indirecte peut être réalisée avec l’aide de bactéries lactiques. Si les substrats nécessaires sont présents dans le milieu, les microorganismes produisent de l’acide et abaissent ainsi le pH du milieu. Ce procédé est plus lent mais beaucoup plus sécuritaire. Toutefois, il peut conduire à la production de gaz carbonique qui n’est pas toujours désirable dans un aliment, surtout, dans les conserves. De plus, l’instauration d’une nouvelle flore permet d’augmenter l’innocuité de l’aliment en entrant en compétition avec les potentiels microorganismes indésirables. L’effet de la combinaison de l’acidification et d’un traitement thermique sur des spores bactériennes a montré des résultats prometteurs (Marcotte et al., 2008). La réduction d’un log (1 D ou 90%) pour un traitement à une température de 90 °C prend 19.6 min. En combinant l’acidification au même traitement thermique, le temps pour réduire d’un log passe à 1.17 min. Cette diminution considérable du temps montre l’efficacité de l’effet barrière dans le domaine agroalimentaire. La sévérité du traitement nécessaire si l’acidification était utilisée seule serait très élevée. Ce type d’expérience a également été réalisé sur la purée d’asperges (Santos et al., 1992). Les résultats montrent que la baisse du pH combinée à un traitement thermique modéré conduit à l’inactivation des spores bactériennes. La courbe logarithmique de réduction des spores est accentuée par l’ajout d’acide citrique dans le milieu. Les recherches de Marcotte et al. (2008) et Santos et al. (1992) mettent en évidence le pouvoir synergique de l’acidification comme effet barrière combiné avec un traitement thermique inférieur à la valeur classique visant 121 C au centre du produit.
1.3.2 Ultrahaute pression
Le traitement à haute pression est une technique de pasteurisation à froid qui consiste en des aliments à soumettre, préalablement scellé dans un emballage souple et résistant à l'eau, à un niveau élevé de pression hydrostatique (pression transmise par l'eau) allant jusqu'à 600 MPa / 87000 psi pendant quelques secondes à une quelques minutes. C'est le même effet que de soumettre les aliments à une profondeur de 60 kilomètres de l'océan profond, si un océan profond de cette existence. L’utilisation de la pression élevée permet de stériliser les aliments sans atteindre le barème thermique de 121°C (Master et al.,
8
2004). L’exposition à une pression supérieure à 100 méga-pascals (MPa) pendant une durée et à une température comprise entre 60°C et 90°C permet d’inactiver les spores bactériennes. À température ambiante, il prend de cinq à huit jours à une pression de 175 MPa pour obtenir le même effet que la stérilisation (Wilson and Baker, 2000). L’ajout d’un traitement thermique à la hausse de pression permet de réduire considérablement le temps. À 70°C, avec un traitement de 70 MPa pendant 12h, les aliments respectent le standard de salubrité qui consiste en l’absence des spores bactériennes (Hirsch, 2000). Le principal avantage de l’utilisation de la haute-pression est la conservation de la qualité nutritionnelle des produits (Wilson and Baker, 2000). Aussi, il permet de réduire les coûts énergétiques engendrés par la stérilisation conventionnelle. Cependant, l’obtention d’une pression élevée nécessite des appareils de haute qualité à coût souvent très élevé. La combinaison d’un traitement thermique modéré et une haute pression illustre le potentiel de l’effet barrière dans l’industrie de la conserverie.
1.3.3 Agents de conservation
Depuis des siècles, des composés chimiques sont utilisés pour la conservation des aliments. Le sel est un des pionniers et, encore aujourd’hui, demeure un des plus utilisés dans le domaine agroalimentaire. Actuellement, plusieurs types d’agents de conservation chimiques existent sur le marché. Afin de contrôler l’usage et assurer la sécurité des consommateurs, le gouvernement du Canada décrit exhaustivement les composés chimiques permis et leurs concentrations maximales autorisées dans le Règlement sur les
produits transformés. Un agent de conservation est régulièrement utilisé en combinaison
avec d’autres agents ou traitements, car il n’affecte souvent qu’un seul paramètre à contrôler (Coote et Brul, 1999). Parfois, il possède plusieurs fonctions comme le chlorure de sodium dans les charcuteries qui sert à diminuer l’activité de l’eau, contrôler les microorganismes et rehausse le goût. Certains agents de conservation se retrouvent dans la nature comme le sel et le sucre tandis que d’autres doivent être synthétisés comme les parabènes et les propionates. L’effet des agents de conservation sur le contrôle microbien est très large et diversifié. Il débute par l’attaque de la membrane cellulaire et peut aller jusqu’à la perturbation des protéines en passant par la chélation d’éléments essentiels à la vie cellulaire (Coote et Brul, 1999). Les acides faibles, comme l’acide acétique ou citrique,
se montrent comme des agents de conservation économiques ayant une grande activité antimicrobienne (Noor et al., 2014). De plus, ils sont sécuritaires à manipuler et facile à produire. Coote et Brul (1999) ont affirmé au début du XXIe que l’utilisation des agents de conservation combinée à d’autres barrières, comme le potentiel redox ou l’électro-poration, permettrait de diminuer les traitements acides ou thermiques sévères pour la conservation des aliments.
1.3.4 Modulation du potentiel redox
Le potentiel redox est la tendance d’un composé à transférer ses électrons à un autre. Chacun des composés possède intrinsèquement un potentiel redox; le plus élevé des deux détermine qui sera le donneur d’électrons. Dans un système fermé, la perte d’électrons est obligatoirement accompagnée d’un gain d’électrons (Bai et al., 2013). Par exemple, le potentiel redox du couple oxygène/eau est de +820 mV, ce qui illustre une grande affinité des électrons de l’oxygène par l’eau. La formule de base pour une réaction de réduction est : Oxydant + n électrons ↔ Réducteur (Park et et al., 2007). Le potentiel redox est mesuré à l’aide d’un système composé d’une électrode inerte et d’une autre de potentiel connu (électrode de référence). Le standard, généralement utilisé, est celui de l’électrode à l’hydrogène. L’équation de Nernst permet de relier le potentiel redox avec les concentrations des composés réduits et oxydés comme suit:
où Eh : potentiel redox (V)
E0 : potentiel redox standard du système (V)
R : constante universelle des gaz (8.314 J/K/mol) T : température absolue (K)
n : nombre d’électrons transférés par molécule F : constante de Faraday (96.5 kJ/V/mol)
[Red] : concentration molaire de la forme réduite [Ox] : concentration molaire de la forme oxydée
La température et le ratio [réducteur]/[oxydant] sont les deux facteurs qui modulent principalement le potentiel redox d’une solution (Bai et al., 2013). Un contrôle rigoureux de ces paramètres est donc essentiel lors d’un traitement qui influence le potentiel redox, comme l’électro-activation de solutions aqueuses aux interfaces des électrodes. De plus, la cinétique de ces réactions met en jeu plusieurs facteurs, comme le niveau d’énergie
10
d’activation, qu’il est nécessaire de considérer. La modulation du potentiel redox est fréquente pour le contrôle des microorganismes et la qualité des produits dans l’industrie agroalimentaire (Prévost et Brillet-Viel, 2014).
1.3.5 Présence d’oxygène
L’oxygène est naturellement présent dans l’air à un taux de 21%. Dans le secteur de la conservation alimentaire, sa présence n’est pas souhaitable, car il participe à la détérioration de l’aliment comme dans le cas du rancissement du beurre ou du brunissement non enzymatique des fruits et légumes. Il existe d’ailleurs différents procédés, comme l’emballage sous vide ou en atmosphère contrôlée, qui permettent de ralentir considérablement l’oxydation (Arul, 2010). De plus, le blanchiment des légumes avant la mise en conserve sert en partie à retirer le surplus d’air afin d’éviter les réactions oxydatives (Bazinet, 2010). Néanmoins, la présence d’oxygène peut être désirée dans certaines situations comme étant souhaitable et peut agir comme une barrière efficace contre les microorganismes anaérobies pathogènes, comme C. botulinum, qui peuvent s’avérer toxiques pour l’être humain. Dans des conditions non-favorables, C. botulinum forme des spores très résistantes difficiles à détruire autrement que par un traitement thermique sévère. La présence d’oxygène réussit toutefois à réduire la viabilité de ces spores (Sims et al., 1984). Dans un milieu liquide, l’oxygène est dissous et retrouvé de manière plutôt uniforme. L’électro-activation d’une solution saline du côté de l’anode sature le milieu en oxygène (Shirahata et al., 2012). De plus, le taux d’oxygène est intimement relié au potentiel redox. Une grande concentration d’oxygène dissous fait augmenter le potentiel redox (Bazinet et al., 2008). Cette augmentation induite par le taux d’oxygène peut être contrôlée en remplaçant l’oxygène par d’autre gaz comme l’hydrogène ou le nitrogène (Cachon et al., 2003). Dans la situation où un potentiel redox élevé est désiré afin d’accentuer l’effet barrière, la présence d’oxygène est donc souhaitable.
1.3.6 Électro-poration
L’électro-poration est un phénomène physico-chimique ayant un effet sur les organismes vivants (Weaver et Chizmadzhev, 1996). Lorsque les cellules sont exposées à un puissant champ électrique, des micropores se créent au niveau de leur paroi cellulaire externe (Tsong, 1991). Dépendamment des conditions de traitement (la force du champ
électrique, le temps de pulsation, le nombre et la forme des pulsations, la température), l’effet peut être réversible, si la cellule survie, ou irréversible, si la cellule meurt. La recherche a démontré que la déstabilisation au niveau de la paroi cellulaire avait lieu du côté lipidique (Weaver et Chizmadzhev, 1996). En d’autres termes, l’agrandissement des pores rend la membrane plus perméable aux échanges avec le milieu, ce qui pourrait déstabiliser la cellule et engendrer sa mort. Certains chercheurs préfèrent donc le terme électro-perméabilisation au lieu d’électro-poration. L’utilisation d’un champ électrique comporte de nombreux avantages : les cellules ne sont pas soumises à un traitement thermique, le coût est faible et le contrôle des paramètres est précis. C’est d’ailleurs pour ces raisons que la recherche sur cette technique a largement progressé depuis la fin du XXe siècle (Golberg et al., 2012). La déstabilisation temporaire ou complète de la membrane cellulaire peut être utilisée dans plusieurs domaines du vivant comme la médecine, la biologie et l’agroalimentaire. Du côté médical, l’électro-poration réversible est une partie intégrante de plusieurs traitements comme celui d’électro-chimiothérapie pour lutter contre le cancer (Marty et al., 2006). Dans ce dernier cas, l’électro-poration des cellules cancéreuses permet d’y faire pénétrer des composés cytotoxiques qui autrement ne pourraient accéder aux cellules. De son côté, l’électro-poration irréversible permet de détruire les cellules en les rendant trop perméables au milieu et ainsi causer leur destruction. Ce procédé physico-chimique se révèle intéressant pour le contrôle des microorganismes dans le domaine alimentaire. Les bactéries et levures qui causent la majorité des intoxications chez l’homme peuvent être inactivées par l’exposition à un champ électrique. La conservation sur une longue période, comme dans l’industrie de la conserverie, nécessite un produit exempt de contaminants. L’effet significatif de l’électro-poration sur la réduction des microorganismes pathogènes a été démontré (Martin-Belloso et al., 2008). En effet, McDonald et al. (2001) ont réussi à réduire de six log la teneur en E.
coli dans du jus d’orange à l’aide d’un champ électrique pulsé de 30 kV/cm. Le même type
d’expérience, avec des microorganismes et des aliments différents, a fait l’objet de plusieurs publications depuis le début XXIe siècle. Malgré ces avancées importantes, la thermodynamique derrière l’électro-poration est encore mal connue (Golberg et al., 2012). La conductivité du milieu, l’activité de l’eau du produit et le pH semblent principalement faire varier l’effet du traitement électrique. L’électro-poration se révèle dans le secteur
12
agroalimentaire comme une barrière relativement récente et prometteuse (Mosqueda et al., 2008).
1.4 Bactéries sporulées présentes dans les aliments
L’inactivation des spores bactériennes est essentielle pour les produits alimentaires en conserve. Les bactéries Gram + du genre Bacillus et Clostridium se retrouvent naturellement dans les aliments provenant de la terre. Certaines ont la capacité de résister à des conditions difficiles sous forme de spores et se développer seulement lorsque le milieu devient favorable. L’étude de la croissance de Clostridium botulinum, utilisée comme bactérie de référence par rapport à l’innocuité en conserverie, nécessite une longue période de temps. En effet, la résistance élevée des spores engendre un risque sur plusieurs années. Il est néanmoins possible d’effectuer les tests microbiologiques de salubrité sur une courte période de temps en utilisant d’autres types de Clostridium ou Bacillus. À l’aide d’une combinaison de traitements favorables pour la germination des spores et de calculs de cinétiques de croissance, l’innocuité du produit en conserve peut être validée (Marcotte et al., 2008). Plusieurs études utilisent des spores de Clostridium perfringens (PA 3679), car, ces dernières présentent les mêmes caractéristiques biologiques que C. botulinum sans les conséquences graves du botulisme pour l’humain (Marcotte et al., 2008; Santos et al., 1992).
1.5 Électro-activation
1.5.1 Concept d’électro-activation
L’eau est une molécule présente en grande quantité sur terre. Elle est essentielle pour les systèmes biologiques et donc, à la vie. Elle est également présente dans plusieurs réactions organiques et inorganiques. Cette association de deux atomes d’hydrogène à un atome d’oxygène se retrouve, dans la majorité des milieux, sous une forme très stable thermodynamiquement. Dépendamment de différents facteurs, comme la température et la pression, les molécules forment un arrangement, soit solide, liquide ou gazeux. En dépit de cette stabilité naturelle, il est possible de déséquilibrer l’eau sur le plan énergétique en utilisant un traitement physique, chimique et/ou biologique. Plusieurs techniques sont maîtrisées par l’Homme depuis des siècles, comme le chauffage pour obtenir de la vapeur
d’eau ou bien l’utilisation d’agents hydrophiles pour capter l’eau. Plus récemment, un champ électrique a été appliqué sur un certain volume d’eau distillée afin de vérifier l’effet électrochimique sur les caractéristiques de l’eau (Bahkir, 1975). Ceci a conduit à sa déstabilisation au niveau ionique (Shaponoshnik & Kesore, 1977). Selon la position des molécules par rapport à l’électrode, ces dernières se dissocient en ions. Lorsqu’elle est soumise à un champ électrique, l’eau présente une grande activité physico-chimique (Kim et al., 2000). En effet, le changement de la conformation de l’eau en ions H+ et OH -modifient les caractéristiques de la solution. Dans la littérature, ce nouvel état est identifié par le qualificatif ‘’activé’’. La génération de solutions activées peut se faire par le procédé d’électro-activation; une technique dérivée de l’électrolyse de l’eau dans laquelle des membranes échangeuses d’ions sont utilisées pour orienter les flux ioniques et concentrer certaines propriétés dans des zones ciblées. Utilisé depuis la fin du XXe siècle dans l’industrie agroalimentaire, ce procédé est influencé par de nombreux paramètres dont il est difficile de cerner indépendamment leurs effets simples (Shirahata, 2012).
1.5.2 Influence des électrodes
Les réactions d’oxydoréduction, au cours desquelles l’activation a lieu, sont observées à l’interface des électrodes, soit à l’anode chargée positivement ou à la cathode chargée négativement. Ces dernières doivent présenter certaines propriétés afin d’être conformes pour la recherche et l’industrie, que ce soit dans le secteur médical ou alimentaire. Selon Yahagi et al. (2000), le matériel utilisé doit avoir une bonne conductivité électrique, une activité catalytique élevée et montrer une sélectivité pour la ou les réactions électrochimiques visées. De plus, il doit conserver ses caractéristiques tout au long du processus, qui peut s’étendre sur plusieurs heures, ce qui n’est pas toujours facile à réaliser. La position et la forme des électrodes doivent être optimales pour la cellule d’électro-activation utilisée en distribuant uniformément le courant électrique dans la solution. Pour le secteur alimentaire, le matériel doit être inerte et insoluble lorsqu’il est soumis à un champ électrique. Enfin, principalement pour l’aspect industriel, le matériel doit être le plus économique possible. Selon Aider et al. (2012), différents alliages de métaux inertes, comme le platine ou le titane, peuvent être agencés. De plus, une mince couche de rhodium peut être ajoutée afin d’augmenter la longévité de l’électrode. Le matériel utilisé pour l’anode et celui de la cathode peut être différent selon les besoins. De Battisti et al. (2012)
14
ont publié un article comparant l’alliage utilisé pour fabriquer des électrodes. Les deux types étaient le Ti/Ru O2 avec une couche de 2Sn O2, peu utilisé actuellement, et le Ti/Pt, très retrouvé en industrie et en recherche à cause de leur grande activité catalytique et leur longue durée de vie (Trasatti, 2000). Les facteurs contrôlés étaient le courant, la température et le temps d’électro-activation. Le traitement était sur des solutions ayant de faibles concentrations en chlorure de sodium. La génération de dérivés chloreux permet de quantifier l’activité catalytique à l’interface des électrodes. À une intensité de courant faible, utilisée généralement lors du procédé d’électro-activation à cause du coût plus faible et de la diminution de l’effet Joule, l’alliage Ti/Pt s’est révélé comme le plus efficace. Autrement dit, la plus grande activité catalytique, autant au niveau anodique que cathodique, a été observée avec l’alliage Ti/Pt. De Battisti et al. (2012) ont également montré, de facto, qu’il existe des différences importantes dans les résultats dépendamment du choix du matériel des électrodes.
1.5.3 Milieu de réaction et phénomènes physico-chimiques associés
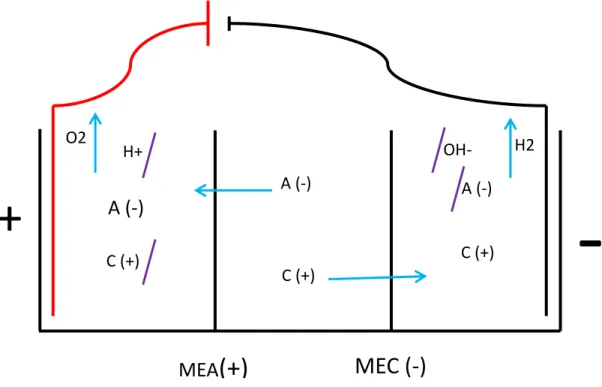
La cellule d’électro-activation est bâtie à l’aide de trois compartiments étanches et non-conducteurs ayant seulement une membrane sélective pour les séparer les uns des autres (Figure 1.1). Les caractéristiques des solutions présentes dans chaque compartiment sont différentes selon la disposition des membranes. Ces dernières permettent ou non le passage des ions, dépendamment de leur charge. Par exemple, la membrane échangeuse d’anions (MEA) laisse les anions la traverser et bloque les cations. Une membrane échangeuse de cations (MEC) produit l’effet inverse. Il existe également des membranes bipolaires, qui sont chargées à la fois positivement et négativement. Or, elles sont encore très peu utilisées pour les cellules d’électro-activation à trois compartiments, car, elles empêchent la concentration d’ions à cause de leur bipolarité. Selon Aider et al. (2012), les membranes doivent êtres très poreuses, hydrophiles et présenter une faible résistance électrique (R). Cette dernière caractéristique est très importante, car, une résistance électrique élevée diminue l’efficacité du procédé d’électro-activation à cause de l’effet Joule qui se traduit par une perte d’énergie électrique dans le milieu sous forme de chaleur. En plus de modifier les caractéristiques de la solution, ce chauffage non-désiré augmente le coût énergétique net. De plus, la variation de la résistance modifie l’intensité (I) ou le
voltage (U) fixé initialement. La loi de Ohm relie ces trois paramètres électriques sous l’équation : R(Ω) = U(V)/I(A). Une variation de la résistance illustre donc directement un changement au niveau du voltage ou de l’intensité. Ce paramètre est essentiel à contrôler lors du procédé.
Du côté de l’anode, la dissociation des molécules d’eau crée une saturation du milieu en oxygène dissous et en ions H+ selon l’équation globale suivante : 2H2O (l) → O2 (g) + 4H+ (aq) + 4e-. Une membrane échangeuse d’anions (MEA), chargée positivement, est installée entre les compartiments anodique et central, ce qui empêche les cations de migrer vers la cathode. Il en résulte une augmentation de la concentration d’ions H+ dans le milieu et par le fait même une acidification de ce milieu. De plus, l’oxygène sature la solution anodique et s’échappe par la suite sous forme d’O2. Ainsi, le pH diminue en fonction de l’augmentation des ions H+ et le potentiel d’oxydoréduction augmente à cause de l’oxygène qui sature la solution qui devient donc très oxydante. La solution à la cathode subit l’effet inverse selon la réaction suivante : 2H+ (aq) + 2e- → H2 (g). La présence d’une
membrane échangeuse de cations (MEC) entre les compartiments cathodique et central bloque la migration des anions. Ceci conduit à une solution très réductrice du côté de la cathode (Aider et al., 2012). La Figure 1, illustre les mouvements des ions soumis au champ électrique en fonction du positionnement des électrodes.
16
Figure 1 : Mouvements des ions dans une cellule d’électro-activation à trois
compartiments
Les modèles de la thermodynamique ayant lieu pendant le procédé d’électro-activation sont encore méconnus des scientifiques (Shirahata et al., 2012). Par conséquent, les expérimentations sont encore à l’étape fondamentale. Il est possible d’obtenir des résultats en fonction de certaines conditions; or, il est difficile d’établir quel facteur influence l’activité catalytique se produisant à l’interface de l’électrode. L’optimisation du procédé provient inévitablement de sa compréhension malgré sa complexité. En effet, plusieurs variables entrent en jeu lors de l’électro-activation.
1.5.4 Facteurs influençant l’efficacité du procédé
Le changement des propriétés physico-chimiques de la solution, comme la baisse de pH, modifie la conformation électrique des molécules présentes (Aider et al., 2012). La nature des produits contenus dans les compartiments jouent un rôle clé sur le traitement. Il s’agit normalement d’un mélange d’eau distillée et d’un sel, comme du NaCl ou du NaHCO3, dont la concentration est connue et habituellement très faible (<0,5M).
L’électro-activation de ces solutions dissocie les molécules partiellement ou entièrement. Ceci crée
+
-MEA
(+)
MEC (-)
A (-)
C (+) H2 A (-) C (+) O2 H+ A (-) C (+) OH-des ions sodiques et des dérivés chloreux non-désirables dans l’industrie alimentaire et médicale. Par conséquent, d’autres types de sel provenant de la famille des alcalins ou des alcalino-terreux peuvent être utilisés. De plus, afin de réduire les dérivés chlorés comme des chlorates et des perchlorates, il est intéressant d’utiliser des groupements chimiques organiques. Pour l’être humain, les dérivés chlorés peuvent s’avérer toxiques s’ils sont consommés en trop grande quantité (Kang et al., 2010). Cependant, il est important d’avoir une solution contenant suffisamment d’ions afin de conserver les propriétés conductrices. Une solution trop diluée nuirait au passage du courant, ce qui augmenterait la résistance électrique et l’effet Joule. Un autre point important à surveiller lors du traitement est le colmatage des membranes par certains composés peu solubles. Ce phénomène peut être observé, par exemple, lorsque l’intensité est trop élevée. Ceci est dû à la précipitation sur la membrane d’ions comme Mg2+, Mn2+, Fe+. Le colmatage est non-désiré étant donné que l’efficacité du procédé diminue grandement à cause de la montée de la résistance électrique. L’analyse des précipités retrouvés sur la membrane, à l’aide de microphotographies électroniques, permet de déterminer les ions responsables du colmatage. Un choix réfléchi des atomes composant le sel peut s’avérer intéressant afin de réduire ces accumulations solides sur à la surface des membranes.
1.6 Utilisations récentes de l’électro-activation
1.6.1 Domaine de l’agroalimentaire
Le secteur agroalimentaire est rempli de défis technologiques autant au niveau de la production que de la transformation et de la conservation des denrées. Ce secteur est en pleine expansion, suivant l’augmentation quasi-exponentielle de la population mondiale. Différentes stratégies sont mises en place afin de répondre à cette demande constamment grandissante. Or, ces dernières doivent également respecter d’autres aspects comme le coût du procédé et l’impact sur l’environnement. L’électro-activation à partir d’eau et de sel conduit à des solutions oxydantes (anolytes) ou réductrices (catholytes) présentant des propriétés physico-chimiques très intéressantes. Le contrôle microbiologique est le principal objectif de l’utilisation de ces solutions. Selon Aider et al.(2012), elles peuvent inactiver différents types de microorganismes comme des bactéries, des spores ou des levures. D’autres avancées récentes sont également en cours d’étude.
18
1.6.1.1 Inactivation des toxines de microorganismes
L’utilisation d’un champ électrique pour inactiver les microorganismes dans l’eau et les produits végétaux est un domaine qui est étudié depuis la fin du XXe siècle (Beuchat et al., 2001). Plusieurs cas sont répertoriés dans la littérature. Cependant, il est difficile d’établir des théories universelles par rapport à l’électro-activation à cause du grand nombre de facteurs. Primo, l’inactivation de Staphylocoque enterotoxine-A s’est révélée très prometteuse. La toxine de cette bactérie est souvent la cause d’intoxication alimentaire sévère chez l’Homme qui peut même conduire à la mort. Les enterotoxines-A produites par Staphylocoque possèdent une résistance élevée à la chaleur. Une concentration de 0,4 à 0,8 ng/ml est suffisante pour entraîner des complications trois à cinq heures après l’ingestion. Suzuki et al. (2002) ont utilisé des solutions électro-activées pour inactiver ce pathogène. Ils ont opté pour une solution de NaCl (0,1%) traitée pendant douze minutes, à température ambiante, à un voltage variant entre 9-11 volts. Ils ont testé une solution de NaCl produite à la cathode et une autre à l’anode sur la résistance de staphylocoque. Ils ont conclu que la solution électro-activée à l’anode, avec un potentiel d’oxydo-réduction très élevé (+1180mv) et un pH acide (2.5-3.8), permettait de neutraliser cette entérotoxine. Les caractéristiques physico-chimiques de l’anolyte obtenues intrinsèquement par le procédé d’électro-activation s’attaquent principalement à la paroi cellulaire des bactéries. Il a également un effet notoire au niveau de la structure de certains acides aminés comme la méthionine. Les mêmes analyses ont été réalisés avec le catholyte possédant les paramètres finaux suivants (potentiel Redox=-880mv et pH=11.6-12.0). Cette solution réductrice a également eu un effet souhaitable sur Staphylocoque enterotoxine-A. Or, elle s’est avérée légèrement moins efficace. Il est important de noter l’instabilité des solutions électro-activées. Cet équilibre ne dure que quelques minutes à quelques heures. Par conséquent, toutes les analyses par rapport à l’impact des solutions ont été réalisées juste après la fin du procédé d’électro-activation. Les bactéries ont été immergées immédiatement après l’arrêt du courant électrique. Le temps de trempage était fixe dans le cadre de cette étude. Ceci illustre donc le potentiel des solutions anodiques et cathodiques dans le domaine de la salubrité alimentaire.
1.6.1.2 Inactivation des spores de microorganismes
L’inactivation des spores bactériennes est essentielle pour les produits alimentaires en conserve. Des bactéries Gram + du genre Bacillus et Clostridium se retrouvent fréquemment dans différents aliments. Elles ont la capacité de résister à des conditions difficiles, comme un pH acide ou une température élevée, sous forme de spores et de se développer seulement lorsque le milieu devient favorable. Ces spores sont particulièrement dangereuses pour la santé humaine. En naissant de la spore, la bactérie végétative peut se remettre à produire des toxines mortelles. Il est donc essentiel d’éliminer ces bactéries sporulantes. La technique la plus utilisée est le traitement thermique appelé stérilisation. Or, ce procédé entraîne un grand coût énergétique et affecte la qualité du produit. L’électro-activation représente une alternative intéressante pour assurer l’innocuité du produit tout en gardant sa valeur nutritionnelle et organoleptique élevée.
L’utilisation des solutions oxydantes obtenues du côté de l’anode sur Bacillus
anthracis a démontré un grand potentiel d’inactivation de cette bactérie. Rogers et al.
(2006) ont généré cinq solutions électro-activées à partir d’hypo-chlorite de calcium à 5%. Ils ont utilisé des solutions contenant entre 305 ppm et 464 ppm de chlore libre et des potentiels d’oxydo-réduction se situant entre +400 mV et +1200 mV. En immergeant des spores de Bacillus pendant trente minutes dans les différentes solutions anodiques, ils ont obtenu une réduction de plus de 7 logs, ce qui est un effet très important de cette nouvelle approche. Toutefois, la présence d’une concentration élevée de chlore libre n’est pas désirable dans les produits alimentaires, car, elle cause des défauts sensoriels majeurs. En plus, le chlore qui est un agent oxydant fort peut facilement décolorer des pigments comme la chlorophylle ou certaines vitamines liposolubles. Kang et al. (2010) ont démontré que l’électro-activation de sels chlorés dissous conduisait à plusieurs sous-produits chloreux également indésirables. Ces derniers ont étudié l’effet du pH et de l’oxygène dissous sur les concentrations de chlorate et de perchlorate retrouvées. Dans certains domaines comme la désinfection, le chlore peut être souhaitable. Cependant, pour la conservation des aliments en conserve, une grande quantité de chlore et ses dérivés risquent de se retrouver dans le produit étant donné qu’ils sont en contact direct. La génération de solutions électro-activées
20
exemptes de chlore se révèle donc comme un défi nouveau dans le domaine de l’électrochimie appliquée à l’agroalimentaire.
Les mêmes caractéristiques physico-chimiques sont recherchées afin d’obtenir un effet similaire à Rogers et al. (2006) sur les spores. Les solutions anodiques peuvent également inactiver Staphylococcus aureus et, par conséquent, éliminer la production de sa toxine, l’endotoxine-A, par l’électro-activation d’une solution de NaCl (0,1%) pendant douze minutes à température ambiante à un voltage variant entre 9 et 11 V (Suzuki et al., 2002). Le pH de la solution activée se situait entre 2.5 et 2.8 avec un potentiel redox très oxydatif de +1180 mV. L’effet sur les spores de S. aureus est principalement au niveau de la structure de certains acides aminés comme la méthionine. L’inactivation des spores produisant ce composé toxique pour l’homme a été confirmée (Suzuki et al., 2002). Néanmoins, la problématique de la présence du chlore et du sodium, provenant de la décomposition anodique du NaCl, était toujours présente. Dans le contexte d’une saine alimentation qui contribue au bien-être, la réduction de l’apport en sodium par les aliments transformés est une des grandes tendances de l’industrie alimentaire du XXIe siècle.
Cependant, le sel commun qui constitue un agent de conservation des plus anciens et toujours utilisé et est difficile à substituer par d’autres sels. Dans le cadre de l’électro-activation, le sodium n’a pas un impact direct sur l’aliment et la quantité nécessaire est très faible. L’utilisation de sels de potassium s’inscrit comme une alternative intéressante. Dans ce contexte, on pourrait penser à substituer l’électro-activation du NaCl par celle d’un sel d’un acide organique autorisé comme additif alimentaire. L’acétate de potassium qui combine à la fois l’ion K+ et le radical acétyle (issu de l’acide acétique) serait un bon candidat. En effet, lors du procédé d’électro-activation, l’acétate de potassium sera dissocié et formera avec les ions H+ présents du côté anodique l’acide acétique qui est un agent de conservation puissant. Selon Berovic et al. (2007), l’acide acétique intervient comme un agent antimicrobien dans les aliments à cause de son pH faible. En activant cette solution d’acétate, il sera possible d’abaisser le pH et d’augmenter le potentiel redox. De plus, la manipulation de ce sel d’acide est plus sécuritaire que l’acide concentré, ce qui se révèle comme un important avantage pour la santé et la sécurité des travailleurs en industrie. L’utilisation de ce sel permettrait finalement de surpasser les effets indésirables concernant
le sodium et le chlore. En quelques mots, la combinaison des caractéristiques de la solution électro-activée, soit un pH acide et un potentiel redox élevée, à un traitement thermique modéré permettra d’inactiver les spores bactériennes.
1.6.1.3 Inactivation des microorganismes
Les solutions oxydantes ont un effet dévastateur sur les agents microbiens et se montrent ainsi très utiles pour la prévention de biofilms. Kim et al. (2011) a prouvé que les biofilms de Listeria monocytogenes pouvaient être inactivés par l’anolyte. Cette solution est économique car elle est seulement composée d’eau et de sel. Elle respecte aussi davantage l’environnement que les produits de nettoyage de synthèse. De plus, elle s’avère plus sécuritaire pour la manipulation par les employés. La solution cathodique peut aussi être utilisée après le traitement par l’anolyte. L’étude met en évidence une forme de synergie causée par l’utilisation consécutive de l’anolyte et du catholyte. Il est pertinent de mentionner que cette dernière est nécessairement produite pendant l’électro-activation. Il devient donc intéressant de l’utiliser pour le nettoyage au lieu de la mettre de côté. Les solutions oxydantes peuvent être aussi vaporisées sur des carcasses de poulet pour les désinfecter (Yang et al., 1999) et sur des légumes frais (Izumi, 1999). Ces derniers exemples illustrent la largeur du spectre antimicrobien des solutions électro-activées qui est en plein essor
1.6.1.4 Inactivation des levures
L’effet destructeur des solutions électro-activées sur les levures est similaire à celui retrouvé pour les microorganismes. El Murr et al. (1999) ont appliqué le procédé d’électro-activation pour la stabilisation du vin rouge. Ils ont obtenu des résultats similaires aux produits traités avec des sulfites. Des recherches plus poussées ont été menées sur
Saccharomyces cerevisiae afin d’étudier le mécanisme de dégradation et de réparation de la
cellule (Guillou et al., 2003). En effet, les levures ont la capacité de se réparer intrinsèquement suite à stress. Dans ce sens, les chercheurs ont conclu qu’il est très difficile pour l’instant de trouver des applications concrètes, mis à part le domaine vinicole, en lien avec l’inactivation complète des levures.
22
1.6.1.5 Isomérisation du lactose
La solution cathodique possède des caractéristiques intéressantes pour synthétiser différemment certaines molécules. Un article sur la synthèse du lactulose par l’électro-isomérisation du lactose met en évidence une nouvelle voie de synthèse de ce produit utilisé dans le domaine de la santé (Vidal & Aider, 2012). Au lieu d’utiliser un traitement chimique ou enzymatique, qui est actuellement utilisé en industrie, l’électro-activation de la solution de lactose dans le compartiment cathodique, qui est très réducteur, a permis de produire du lactulose. Ce composé est utilisé pour son mécanisme d’action au niveau de la flore intestinale et son activité pré-biotique. En excluant le lactose, la pureté du produit final était de 96,28% ±0,18% et quelques traces sporadiques d’autres sucres ont été retrouvées. Ce taux de pureté est relativement bon compte tenu du mécanisme de synthèse. La méthode enzymatique conduit à un meilleur taux, or, elle est beaucoup plus coûteuse. Le procédé d’électro-activation a pour avantage d’être relativement rapide, 60 minutes, simple et peu coûteux. La synthèse se réalise aussi à l’intérieur du même compartiment, sans ajout de réactifs, et est seulement influencée par le champ électrique et la conformation de la cellule de réaction. De plus, la résistance électrique diminuait pendant le traitement, indiquant une efficacité énergétique élevée du procédé (Vidal & Aider, 2012).
1.6.1.6 Extraction des protéines des graines de tournesol
La combinaison d’un traitement par la solution cathodique suivi de l’anolyte montre une utilisation doublement efficace de l’électro-activation. Nabok & Plutahin (2005) ont extrait les protéines des graines de tournesol à l’aide de cette combinaison de traitements. L’extraction intiale avait lieu dans la solution réductrice (pH 11) du côté de la cathode. Par la suite, la solution contenant les protéines solubilisées était transférée du côté de l’anode afin de faire descendre le pH au-dessous de leur point isoélectrique qui se situe à pH 4,5. Les protéines étaient ainsi précipitées. Cette approche a permis d’extraire 34% du total des protéines comparativement à 39% avec une extraction chimique (NaOH) (Nabok & Plutahin, 2005). L’avantage principal d’utiliser l’électro-activation se trouve au niveau des fibres. Le traitement chimique extrait, en même temps que les protéines, 15.4% de fibres. De son côté, la combinaison d’électro-activation permet d’extraire seulement les protéines.
Cette approche permet d’ouvrir les portes sur de nouveaux procédés d’extraction de macromolécules. Actuellement, c’est principalement par la voie chimique que ces extractions sont réalisées. En travaillant avec le point isoélectrique des protéines des aliments, il serait possible de les extraire ou de les modifier sans utiliser de réactifs externes.
1.6.2 Domaine de la santé
La recherche dans le domaine de l’alimentation et son lien avec la santé représente un secteur en forte croissance. Depuis le début des années 2000, la notion d’aliments fonctionnels et des nutraceutiques se développe, mettant au premier plan la prévention ou la guérison de certains maux à partir d’aliments ou ses dérivés. Que ce soit à l’aide de capsules digestibles ou sous forme de boissons aromatisées, les industries proposent aujourd’hui une vaste gamme de produits fonctionnels. Certains se fondent sur des études scientifiques tandis que d’autres laissent place à l’ambivalence face à la réelle fonctionnalité de l’aliment. Un nouveau type de marché est en plein développement au Japon, la consommation d’eau réduite dont le potentiel Redox est négatif (réducteur). Cette dernière possède les caractéristiques retrouvées dans la solution cathodique lors de l’électro-activation : le pH est basique, le potentiel d’oxydoréduction est négatif et la concentration en hydrogène moléculaire est élevée. L’eau réduite peut être obtenue à partir de plusieurs techniques comme le traitement à l’aide d’un champ magnétique, à l’aide d’une légère irradiation ou en la mélangeant avec certains types de minéraux (Shirahata et al., 2012). Le procédé d’électro-activation permet également d’obtenir la solution réduite et ce, de manière rapide, économique et sécuritaire. L’eau, une fois activée, est qualifiée fonctionnelle par rapport à l’être humain. Le corps est composé de 60-80% d’eau et cette dernière assure de nombreuses fonctions essentielles à la vie. Par exemple, elle agit à titre de transporteur dans les cellules et comme fournisseur principal des différentes formes de l’ion hydrogène (H+, H-, H2) et de molécules d’oxygène (O2) (Hove et al., 2003). L’activité
biologique de l’eau réduite est aussi due à des composés dérivés retrouvés dans la solution cathodique. Après le traitement d’électro-activation, cette dernière pourrait contenir de l’acide hypochloreux, du gaz chloreux et de l’ozone (Isshiki et al., 2003). L’eau fonctionnelle peut avoir un effet sur tous les troubles causés par un disfonctionnement
24
cellulaire dû à un stress oxydatif trop élevé comme le diabète, le cancer et l’hémodialyse. De plus, le catholyte peut agir comme un activateur de certaines enzymes anti-oxydantes. Cela représente une voie détournée pour capter le surplus de radicaux libres produit au niveau cellulaire (Podkolzin et al., 2001). Ces différentes utilisations sont étudiées en détails ci-dessous.
1.6.2.1 Activation d’enzymes anti-oxydantes
L’activation d’enzymes anti-oxydantes à l’aide de solutions électro-activées permet de réguler leur activité (Podkolzin et al., 2001). L’étude a démontré que la production de radicaux superoxydes en faible concentration, retrouvés dans la solution après le traitement, permettait d’activer la peroxydase, la catalase et la superoxyde dismutase. L’excès d’électron aurait donc une influence sur l’activité enzymatique. Lorsque l’activité maximale est atteinte, il y a une forme d’inhibition de l’effet de la solution électro-activée. Ce serait une forme d’autorégulation dont les chercheurs essaient de comprendre le mécanisme. L’utilisation du catholyte, à très long terme, pourrait permettre de diminuer le stress oxydatif intracellulaire qui est la cause de différents cancers et autres maux. Il est important de noter que les analyses effectuées par Podkolzin et al. (2001) étaient sur des enzymes de lapin et non humaines.
1.6.2.2 Effets de l’eau réduite sur le diabète
Le diabète est une maladie qui touche de plus en plus d’individus dans les pays développés. La sédentarité combinée à une alimentation riche en sucres simples et pauvre en nutriments provoque cette défaillance du métabolisme glucidique, lorsque ce n’est pas inné. Les personnes atteintes doivent assurer un contrôle rigoureux de leur taux de glucose afin d’éviter les troubles au niveau de leur état de conscience. Il existe deux types de diabète. Le type 1 est causé par un manque d’insuline provoqué par des dommages oxydatifs des cellules pancréatiques bêta attaquées par les cellules du système immunitaire. Le type 2 est principalement dû aux dommages oxydatifs des cellules adipocytes. Ce dernier type est favorisé par un stress chronique et le manque d’exercice chez l’individu. La consommation d’eau réduite permet de réduire ce stress oxydatif qui cause le diabète. Elle agit en tant que capteur des radicaux libres qui attaquent les cellules pancréatiques ou adipocytes. En consommant deux litres par jour de solution cathodique (pH 8-11 et