U
NIVERSITE DEG
ENEVEF
ACULTE DEM
EDECINESection de médecine clinique Département de psychiatrie Unité de neuro-imagerie psychiatrique
Thèse préparée sous la direction du Professeur Pandelis Giannakopoulos et du Dr Vicente Ibanez, PD
" Variations cérébrales morphologiques et
anatomiques observées au cours d’une dépression
majeure "
Thèse
présentée à la Faculté de Médecine de l'Université de Genève
pour obtenir le grade de Docteur en médecine par Christophe Graf de Genève Thèse n° 10431 Genève
Résumé
La dépression majeure est une pathologie fréquente, source d’une importante morbidité. Le cortex cingulaire étant impliqué dans la formation des émotions, l’hypothèse avancée et soutenue par la littérature, est qu’il existe une diminution significative du volume du cortex cingulaire subgénual préfrontal gauche chez les patients dépressifs et bipolaires. Cette région présente une variabilité anatomique importante nécessitant une définition claire des limites de la région d’intérêt. Ceci n’a pas été réalisé dans les études précédentes et engendre des conclusions controversées. Cette étude regroupe 77 patients répartis en quatre groupes : un groupe contrôle, un groupe de patients dépressifs majeurs, un groupe de patients bipolaires et un de schizophrènes (classés selon les critères DSM-IV). Le volume du cortex cingulaire subgénual a été mesuré par volumétrie en imagerie par résonance magnétique grâce à une méthodologie clairement définie. Le volume cérébral total, la substance grise et la substance blanche ont également été mesurés. Malgré une discrète diminution du volume du cortex subgénual préfrontal gauche chez les patients dépressifs chroniques, nous ne retrouvons pas de différence significative entre les quatre groupes. Le volume total et le volume de la substance blanche sont significativement moindres chez les patients bipolaires, ce qui pourrait refléter, en accord avec les données de la littérature, une atrophie sous-corticale plus importante dans cette pathologie. Enfin, les patients schizophrènes présentent des volumes conservés. La faible durée d’évolution de la maladie chez nos patients pourrait expliquer ce résultat qui va à l’encontre de plusieurs études. Ces résultats ne soutiennent donc pas l’hypothèse d’une diminution du volume du cortex subgénual chez les patients dépressifs et bipolaires, et par conséquent la présence d’une anomalie structurelle de cette région pouvant servir de marqueur biologique de cette affection. Ils permettent cependant de mettre en évidence les nombreux problèmes méthodologiques qui doivent être pris en considération de manière rigoureuse dans le cadre des études d’imagerie structurelle en psychiatrie.
I Introduction __________________________________________________________ 3
I.1 Généralités et épidémiologie ________________________________________________3
I.2 Neuroanatomie structurelle et fonctionnelle des troubles de l’humeur ______________4
A Régions incriminées dans la physio-pathologie des troubles de l’humeur _____________________4 B Les fonctions du cortex cingulaire du normal au pathologique _____________________________6 C Implication du cortex préfrontal subgénual dans la dépression ____________________________11
II Méthodologie et traitement des données ___________________________________ 13
II.1 But et hypothèse de l’étude _______________________________________________13
II.2 Présentation de cas et tableaux récapitulatifs_________________________________13
II.3 Méthodologie __________________________________________________________15
II.4 Aspects méthodologiques_________________________________________________21
II.5 Analyse statistique ______________________________________________________25
III Etude volumétrique cérébrale chez des patients dépressifs majeurs, des bipolaires et des schizophrènes________________________________________________________ 26
III.1 Résultats des volumes cérébraux totaux ____________________________________26
III.2 Résultats du volume du cortex cingulaire préfrontal subgénual _________________29
III.3 Etude des différentes morphologies observées _______________________________34
IV Discussion _________________________________________________________ 36
IV.1 Points forts et limitations de cette étude ____________________________________36
IV.2 Atteinte du volume cérébral total _________________________________________37
IV.3 Atteinte du cortex cingulaire subgénual ____________________________________39
V Bibliographie________________________________________________________ 41 VI Addendum _________________________________________________________ 48
I Introduction
I.1 Généralités et épidémiologie
La dépression majeure représente une des pathologies les plus fréquentes et ayant le plus de répercussions tant au point de vue personnel qu’économique. En effet, de par les coûts directs des hospitalisations et indirects engendrés par l’absentéisme, cette affection entraîne des dépenses en constante augmentation et participe grandement à l’élévation des coûts de la santé. Le diagnostic de dépression majeure est posé selon des critères cliniques définis par la classification du DSM IV [1]. Sa prévalence dans les pays industrialisés se situe entre 2,3 et 3,2 % des hommes, et de 4,5 à 9,3 % des femmes. Le risque de développer cette pathologie au cours de sa vie est de 7 à 12 % pour les hommes et 20 à 25 % pour les femmes. Elle touche 5 à 10 % des patients accueillis dans un service d’urgence et 10 à 14 % des patients hospitalisés. Chez les personnes âgées, elle est associée à une augmentation sévère des coûts et une détérioration de leur état de santé. Sa prévalence est estimée à 25% des personnes de plus de 70 ans. En Suisse, une récente enquête sur la santé a montré que la prévalence de la dépression traitée médicalement était de 3% pour les hommes et de 6% pour les femmes [2]. Ces chiffres représentent probablement une sous-estimation de la prévalence réelle, puisque certaines personnes déprimées ne recourent pas aux soins médicaux. Les principaux facteurs de risque comprennent le sexe féminin, une anamnèse familiale positive au premier degré et des antécédents personnels de dépression. Les autres facteurs de risque sont constitués par un manque de support social, un important stress quotidien, ainsi que l’abus d’alcool ou d’autres substances [3].
I.2 Neuroanatomie structurelle et fonctionnelle des troubles de l’humeur
De nombreuses études ont tenté d’identifier des altérations neuroanatomiques caractéristiques des troubles de l’humeur et en particulier de la dépression majeure et du trouble bipolaire. Ce chapitre résume les principales anomalies identifiées lors des études d’imagerie stucturelle et fonctionnelle.
A Régions incriminées dans la physio-pathologie des troubles de l’humeur
Bien que plusieurs études d’imagerie par résonance magnétique aient montré des signes neuroanatomiques d’atrophie cérébrale globale, tels qu’un élargissement des ventricules latéraux chez des patients dépressifs et bipolaires, ces observations restent très controversées [4-15]. En effet, seule une étude sur quatre montre un élargissement des sillons chez les dépressifs en résonance magnétique [6, 14, 16, 17]. De même, Rabins et al. a rapporté un élargissement du troisième ventricule chez les patients dépressifs qui n’a pas été retrouvé par Coffey et al. [14] [6]. De plus, le volume de la substance grise ainsi que le volume cérébral total calculés par résonance magnétique semblent conservés tant chez les patients dépressifs que chez les bipolaires [14, 15, 18-21]. Dans le même ordre d’idée, Soares et al. a décrit une augmentation relative de la substance blanche chez des patients bipolaires et les patients âgés dépressifs [22].
Cependant, des patterns d’atrophie focale ont été proposés, touchant essentiellement le système limbique, un ensemble de structures corticales et sous-corticales impliquées dans les phénomènes de mémorisation et de régulation de l’émotion (le cortex cingulaire, le cortex médial du lobe temporal contenant l’hippocampe, l’hypothalamus, les noyaux caudés, le
diminution serait dépendante de l’âge du patient et de la durée de sa maladie [26]. Ces observations sont renforcées par l’étude de Royall et al. qui a montré que des patients ayant subi des dommages cérébraux au niveau du lobe frontal présentent des symptômes négatifs comme l’apathie et l’inhibition, compatibles avec ceux observés dans le cadre d’un état dépressif [27]. Une réduction de la taille de l’hippocampe chez des patients souffrant d’épisodes dépressifs récurrents sévères en rémission depuis plus de six mois a été également observée [28] [29]. Une corrélation inverse entre la durée totale des épisodes et le volume hippocampal existe alors [30]. Enfin, deux méta-analyses récentes ont confirmé la diminution du volume hyppocampal chez les patients dépressifs chroniques, sans pour autant retrouver d’association avec la durée de la maladie [31] [32]. Dans des modèles animaux de dépression, une perte de volume hippocampal a été retrouvée chez des musaraignes soumises à un stress social chronique causé par un conflit de subordination ; un traitement de tricycliques a permis de prévenir cette diminution [33]. En effet, les antidépresseurs augmentent chez l’animal la neurogénèse hippocampale [34] [35]. Enfin, une diminution du volume du noyau caudé, du putamen et des amygdales, bien que fréquemment retrouvée, reste controversée [36] [21] [19] [18] [37] [31].
En imagerie fonctionnelle, les anomalies décrites au niveau du système limbique des patients dépressifs sont plus controversées. En effet, l’étude de Drevets et al. [38] a décrit une augmentation significative du débit sanguin dans une zone s’étendant depuis le cortex préfrontal ventro-latéral gauche jusqu’à la surface du cortex préfrontal médial ainsi que de l’amygdale gauche, chez des patients présentant une dépression familiale. D’autres études ont rapporté une diminution du métabolisme du cortex préfrontal, des ganglions de la base et du gyrus cingulaire antérieur chez des patients dépressifs majeurs [39] [40] [41] [42] [43] [44]. Cette diminution du métabolisme cérébral semble cependant représenter un marqueur d’état
dans la mesure où ces anomalies disparaissent chez les patients répondant aux traitements médicamenteux [45]. De même, Drevets et al. a décrit une augmentation du métabolisme cérébral de l’hippocampe [38]. Enfin, on a retrouvé une diminution du métabolisme des ganglions de la base [39] [46].
B Les fonctions du cortex cingulaire : du normal au pathologique
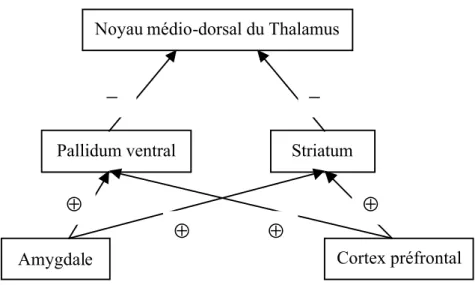
De ces études se dégage un modèle neuroanatomique des troubles de l’humeur, impliquant des atteintes du lobe frontal, des ganglions de la base, du thalamus, de l’hypothalamus et des amygdales [47] [48] [49]. Ces structures sont reliées par deux différents circuits. D’une part, le circuit limbo-thalamo-cortical, qui touche les amygdales, le thalamus médio-dorsal et une partie du cortex préfrontal médial et ventral. Les amygdales modulent l’activité neuronale entre le thalamus et les noyaux de la base d’un côté, le cortex préfrontal de l’autre [50]. D’autre part, le circuit limbique-striatal-pallidal-thalamique qui comprend le striatum, le pallidum ventral, le noyau médiodorsal du thalamus et les amygdales. Le cortex préfrontal et les amygdales jouent un rôle excitateur sur les ganglions de la base alors que ceux-ci inhibent le thalamus [50] [51].
Cortex préfrontal Noyau médio-dorsal du Thalamus
Amygdale
Pallidum ventral
−
⊕
⊕
Figure 1.2b : Circuit limbique-striatal-pallidal-thalamique.
⊕ : projections excitatrices. − : projections inhibitrices.
Figure 1.2c : Synthèse des deux circuits et modèle neuroanatomique des troubles de l’humeur.
⊕ : projections excitatrices. − : projections inhibitrices.
Amygdale Cortex préfrontal
Noyau médio-dorsal du Thalamus
Pallidum ventral Striatum
⊕
⊕
⊕
⊕
−
−
Amygdale Striatum⊕
Noyau médio-dorsal du Thalamus
⊕
−
Cortex préfrontal⊕
⊕
Pallidum ventral⊕
⊕
−
Les altérations neuroanatomiques et métaboliques observées chez les patients déprimés impliquent des régions bien connues pour jouer un rôle central dans les réactions émotionnelles, comportementales et cognitives : le système limbique [52]. Celui-ci représente une connexion et une zone de travail de l’information entre des stimuli viscéraux et le néocortex. Il permet à la « volonté » de contrôler les émotions ressenties. Des réponses plus complexes comme la peur, l’anxiété ou le plaisir ont été rapportées par des neurochirurgiens durant les opérations intéressant le système limbique. Pourtant, ces réactions se sont produites de manière inconstante et sont certainement plus le reflet d’une dysfonction complexe du système limbique que d’une atteinte isolée. Une ablation bilatérale du système limbique provoque chez des patients psychotiques une diminution des réactions émotionnelles [53] [54] et a été rapportée comme diminuant fortement la sensation de la douleur, ce qui atténue également les réflexes d’autoprotection. Ainsi, ces atteintes peuvent aboutir à une véritable apathie, compatible avec un syndrome frontal.
Un de ses composants, le cortex cingulaire, permet d’une part de ressentir une émotion provoquée par un stimulus, d’en relayer l’information vers le cortex cérébral et d’en renvoyer les effets, par exemple une stimulation sympathique. Posner et al. ont impliqué le cortex cingulaire dans le développement du self-control durant l’adolescence [55]. En effet, en cas de syndrome hyperactif, une hypoactivité de cette région est rapportée [56]. Une stimulation du cortex cingulaire permet de produire une activation du système autonome similaire aux réactions végétatives accompagnant une émotion (augmentation de la fréquence cardiaque et de la tension artérielle, pause respiratoire, dilatation des pupilles, etc.) [57].
Le cortex cingulaire antérieur reçoit une importante innervation dopaminergique du mésencéphale qui serait associée chez le singe avec le plaisir de recevoir une récompense [58] [59]. Ces neurones ne seraient pas activés si une récompense attendue ne se produisait pas. De même, chez l’homme, une étude a montré l’absence d’activation du cortex cingulaire antérieur chez des patients parkinsonniens (i.e. souffrant d’une destruction des neurones dopaminergiques du mésencéphale) suite à l’obtention d’une récompense par rapport à un groupe témoin [60]. Cette partie du gyrus cingulaire est également innervée par les amygdales qui relaieraient des sensations désagréables comme la peur [61]. Plusieurs études ont souligné le rôle du gyrus cingulaire antérieur dans l’anxiété et la résolution de problème [62] [63]. Son activation augmenterait avec la difficulté des problèmes à résoudre [64].
La partie ventrale du gyrus cingulaire antérieure serait impliquée dans la formation d’émotion alors que sa partie dorsale jouerait un rôle dans le processus de mémorisation via des connexions avec le noyau médio-dorsal du thalamus et les lobes temporaux [56]. Lorsque l’on demande à des sujets sains d’imaginer des situations désagréables la partie ventrale est
activée [65] [66]. De même, lorsque des patients obsessionnels-compulsifs ou souffrant d’un stress post-traumatique sont confrontés à leur phobie, la même région est activée [67] [68].
En conséquence, une atteinte du gyrus cingulaire, plus spécifiquement de sa partie antérieure, peut contribuer à désorganiser les processus émotionnels complexes et encore peu élucidés qui sont régulés par le système limbique.
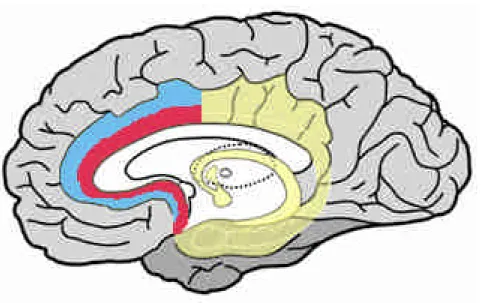
Figure 1.2e: Cortex cingulaire antérieur. La zone rouge délimite sa partie ventrale et la zone bleue sa partie dorsale.
C Implication du cortex préfrontal subgénual dans la dépression
Le cortex préfrontal subgénual représente une sous-division du gyrus cingulaire antérieur, qui se situe en dessous du genou du corps calleux, dans la partie la plus médiane des deux hémisphères. Il est formé par la partie distale des aires 24 et 32 selon Brodmann. L’aire 24 projette sur les amygdales, la substance grise péri-aqueducienne et les noyaux du système autonome du tronc cérébral [69]. L’aire 32 projette sur plusieurs noyaux du thalamus, le noyau caudé, le striatum et les amygdales [70]. Ces aires ont été plus spécifiquement impliquées dans la régulation de l’émotion et contribuent à l’élaboration de la pensée [71] [72] [73] [74] [75] [76]. Elles participent à l’initiation, la motivation et le comportement diriger vers un but. Une étude récente a montré qu’une stimulation de la substance blanche du cortex subgénual pouvait réduire les symptômes chez des patients dépressifs résistants au traitement [77].
Figure 1.3e : Le cortex cingulaire et sa partie préfrontale subgénuale. Gyrus cingulaire
Partie préfrontale subgénuale
En utilisant la tomographie par émission de positrons, Drevets et al. ont décrit pour la première fois en 1998 un hypométabolisme bilatéral du cortex subgénual lors d’une dépression majeure [78]. Deux autres études structurelles ont également montré une diminution significative du volume de la région du cortex subgénuale chez les dépressifs majeurs et les bipolaires par rapport à un groupe témoin [74] [79]. Cette altération sélective ne portait alors que sur le cortex cingulaire subgénual gauche, alors qu’à droite, il n’y avait pas de différence significative. Sur un plan morphologique, ce phénomène pourrait refléter une perte cellulaire focale (gliale ou neuronale) ou un défaut neurodéveloppemental. Cette découverte, si elle venait à être confirmée, pourrait alors être utilisée en clinique afin de faciliter le diagnostic voire de servir de critère de vulnérabilité neuroanatomique chez des patients ne présentant pas de symptômes mais étant dès lors à haut risque de développer la maladie. Cependant, trois problèmes méthodologiques majeurs n’ont pas été abordés dans ces études. En premier lieu, la définition des limites de la région d’intérêt selon le plan transversal (antéro-postérieur) n’est pas spécifiée. Pourtant, la région à étudier présente une variabilité anatomique importante, pouvant influencer de manière décisive les comparaisons dans les études de type cas/contrôle. De plus, Drevets et al. ne montrent qu’une morphologie du gyrus cingulaire alors qu’ils en existent plusieurs. Enfin, les critères de sélection des patients et leur incorporation dans les différents groupes ne sont pas clairs.
II Méthodologie et traitement des données
II.1 But et hypothèse de l’étude
La présente étude a pour but d’analyser le volume de la région préfrontale subgénuale du cortex cingulaire chez un groupe contrôle comparé à trois groupes de patients bien documentés sur le plan clinique (des patients dépressifs, bipolaires et schizophrènes). Les deux derniers groupes ont été choisis afin de tester la spécificité d’une éventuelle anomalie structurelle. En effet, tant pour la maladie bipolaire que pour la schizophrénie, des données récentes suggèrent la présence d’une atrophie du lobe frontal et du gyrus cingulaire antérieur [80] [46] [81] [82] [83] [84] [85]. Nous nous efforcerons de vérifier les résultats de l’étude de Drevets et al. et de voir si l’hypothèse d’une diminution du cortex subgénual préfrontal gauche se vérifie chez les patients dépressifs. Les limites de la région d’intérêt ont été définies de manière stricte et l’ensemble des variations anatomiques du cortex cingulaire subgénual ont été investiguées. Ces éléments méthodologiques nous permettent de tester de façon appropriée les résultats de Drevets et al. dans une série indépendante.
II.2 Présentation de cas et tableaux récapitulatifs
Le collectif incluait des patients hospitalisés ou suivis ambulatoirement dans le cadre du département de psychiatrie des hôpitaux universitaires de Genève. Les patients présentant une pathologie cérébrale pouvant influencer le volume étudié (encéphalopathie vasculaire, maladie dégénérative, maladie tumorale), ainsi que les malades dont les images obtenues étaient de mauvaise qualité ou présentaient des anomalies de signal ont été exclus. Tous les diagnostics psychiatriques ont été posés selon les critères du DSM-IV par un psychiatre expérimenté. En particulier, le groupe des patients schizophrènes inclut des diagnostics de
schizophrénie avérée, des personnalités schizoïdes, des troubles schizophréniformes et des patients schizophrènes présentant des troubles dépressifs concomitants. (cf Table 2.2)
Le groupe contrôle se composait de volontaires participant à une autre étude concernant les récepteurs des benzodiazépines au Pet-Scan et au SPECT-Scan [86]. Leurs images IRM étaient à l’origine utilisées afin d’aligner les différents plans. Le groupe ne se compose que de sujets masculins en raison de problèmes méthodologiques inhérents à l’étude de Millet et al, notamment des difficultés à la mise en place d’un cathéter artériel chez les femmes. Ces sujets ne recevaient aucun traitement psychotrope (antidépresseur, benzodiazépine ou neuroleptique). De plus, ils n’avaient pas d’antécédents d’abus de substance ou de maladie psychiatrique. (cf Table 2.2)
Tout patient a donné son consentement écrit à l’étude (cf. addendum). Celle-ci a été approuvée par le Comité d’éthique du département de psychiatrie.
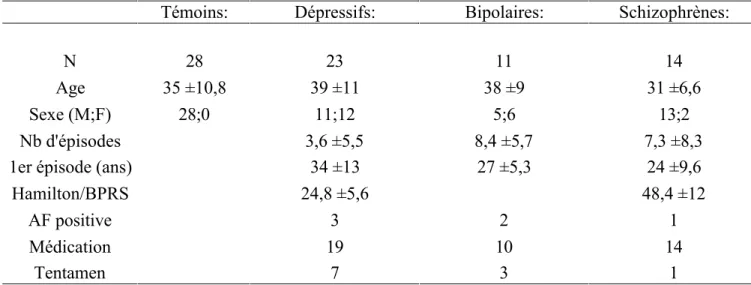
Témoins: Dépressifs: Bipolaires: Schizophrènes:
N 28 23 11 14
Age 35 ±10,8 39 ±11 38 ±9 31 ±6,6
Sexe (M;F) 28;0 11;12 5;6 13;2
Nb d'épisodes 3,6 ±5,5 8,4 ±5,7 7,3 ±8,3
1er épisode (ans) 34 ±13 27 ±5,3 24 ±9,6
Hamilton/BPRS 24,8 ±5,6 48,4 ±12
AF positive 3 2 1
Médication 19 10 14
Tentamen 7 3 1
L’âge du premier épisode est défini comme l’âge de la première hospitalisation pour trouble psychiatrique. Ce fait peut expliquer l’apparition relativement tardive du premier événement rapporté dans notre tableau pour chaque groupe. Nous pouvons voir que la première hospitalisation pour décompensation psychotique intervient logiquement bien avant le traitement en milieu spécialisé d’un état dépressif ou d’un virage maniaque. Le nombre d’épisodes représente le nombre de récidives de l’affection ayant nécessité une nouvelle hospitalisation. Afin de définir la gravité, nous avons relevé le score Hamilton lors de la réalisation de l’imagerie des patients dépressifs [87]. Nous avons fait de même avec le score BPRS (Brief Psychiatric Rating Scale) chez les patients schizophrènes [88]. Il a également été relevé si une médication psychotrope était en cours ou si le patient présentait une anamnèse familiale (existence d’un parent de premier degré souffrant de la même affection).
II.3 Méthodologie
Pour cette étude, nous avons étudié les 4 groupes pré-cités, afin de les comparer au niveau du volume total de leur cerveau et du cortex subgénual préfrontal du cortex cingulaire. L’IRM utilisée pour ce faire est une PICKER Elipse 1,5T. Le cerveau étant visualisé grâce à des images pondérées en T1, un TR de 15 millisecondes, un TE de 4 millisecondes et une grandeur de pixels de 0,98 x 0,98 x 1,10 mm3. 160 coupes de 3mm étaient nécessaires à la visualisation de l’image totale. Les coupes primaires étaient obtenues en axial. Tout le travail de traitement de ces données a été effectué sur un ordinateur SUN, sous environnement UNIX, grâce au programme Analyze [89]. Il convenait, dans un premier temps, d’éditer les cerveaux, afin d’éliminer toute région extra-axiale. Ceci fut effectué d’une manière manuelle, dans le but d’être le plus précis possible. Le technicien ne savait pas à quel groupe appartenait le cerveau examiné, un nom de code inconnu ayant été utilisé. Les coupes étaient ensuite
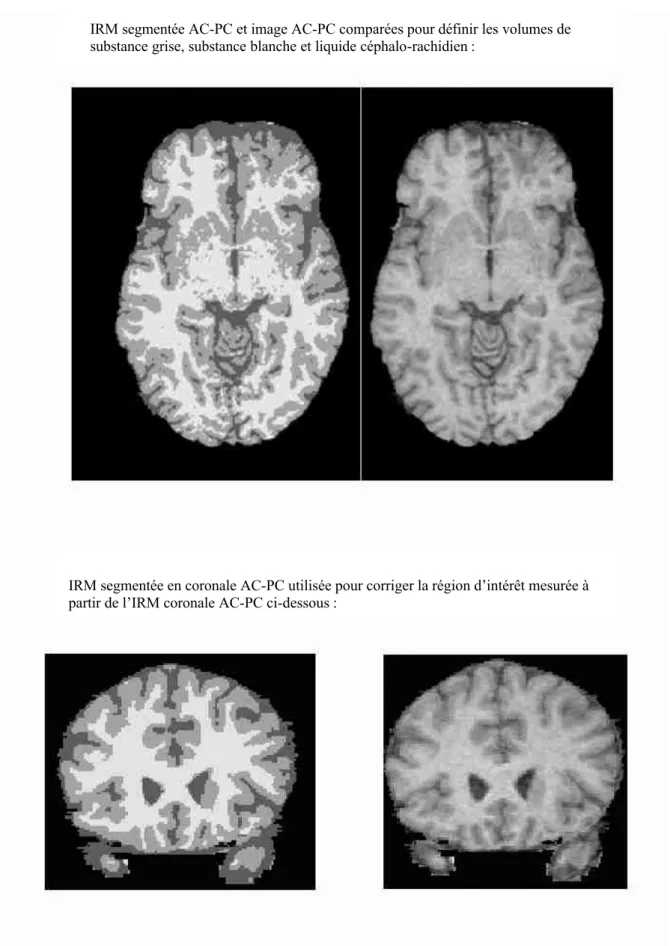
alignées selon la ligne AC-PC conventionnelle, ligne passant par la partie antéro-supérieure de la commissure antérieure et la partie antéro-inférieure de la commissure postérieure. Les images subissaient alors une interpolation dans les 3 dimensions, afin d’être alignées selon cet axe. Parallèlement, l’image AC-PC était segmentée grâce à un algorithme décrit dans la littérature qui prend en compte l’inhomogénéité du signal magnétique et le bruit de fond [90]. Cette opération s’effectuait sur Matlab v. 4.0 et permettait une séparation automatique selon l’intensité des différents pixels du cerveau en 3 groupes distincts et selon la méthode décrite dans l’étude de Rajapakse et al. [90]: la substance grise (haut signal T1), substance blanche et liquide céphalorachidien (LCR) (bas signal T1). Une comparaison automatique était ensuite effectuée, entre l’image IRM en AC-PC et l’image segmentée également en AC-PC. Cette méthode permettait de calculer le volume total cérébral, le volume total sans le LCR (volume communément utilisé comme référence), le volume de la substance grise totale, de la substance blanche totale et du LCR total. Les résultats étaient obtenus sous forme de tableaux en pixels et en centimètres cubes (cm3).
Pour étudier le cortex cingulaire, l’examinateur a traité les images non segmentées. Le repérage des points et des limites des structures a été effectué en utilisant les trois orientations visuo-spatiales (coronale, sagittale et transversale). Afin de délimiter la région d’intérêt en antéro-postérieur, nous avons choisi comme limite rostrale la première coupe où le corps calleux reliait les 2 hémisphères de manière uniforme comme décrit dans l’étude de Drevets et al. Nous avons éliminé toute coupe où l’effet de volume partiel empêchait de voir clairement le passage du corps calleux. En caudal, nous avons opté pour la dernière image sur laquelle le noyau caudé et le putamen étaient unis. Nous n’avons pas analysé les images où il était possible de discerner la séparation des 2 structures. Cette méthode nous a permis de fixer des
limites nettes en rostro-caudal, ce qui aboutissait à 12-15 coupes coronales devant être examinées par patient.
Le technicien a alors manuellement édité toutes les images une à une. Pour se faire, nous avons séparé la région d’intérêt composée de la substance grise des gyri cingulaires droit et gauche, vus en coronal, en quatre parties : respectivement le gyrus 24 gauche, 24 droit, 32 gauche et 32 droit. Il a été assigné une valeur de voxels à chaque région après que celle-ci ait été manuellement délimitée. Les valeurs étaient de 225 pour le 24 gauche, 150 pour le 24 droit, 75 pour le 32 gauche et 50 pour le 32 droit. Pour chaque patient, le côté par lequel l’examinateur commençait à éditer changeait, de façon à diminuer les erreurs de mesure dues à la surprojection des régions éditées. En effet, la résolution de l’image obligeait selon la morphologie du gyrus à déborder sur l’édition de la région adjacente. Une fois ce travail effectué, les résultats étaient comparés aux images segmentées afin de diminuer les erreurs de sur ou sous-estimation du volume. Les données étaient obtenues en centimètres-cube et en pixels.
Figure 2.3a : méthodologie utilisée pour calculer le volume cérébral total.
IRM native : IRM après édition :
Figure 2.3b : méthodologie pour calculer le volume cérébral total et la région d’intérêt.
IRM segmentée AC-PC et image AC-PC comparées pour définir les volumes de substance grise, substance blanche et liquide céphalo-rachidien :
IRM segmentée en coronale AC-PC utilisée pour corriger la région d’intérêt mesurée à partir de l’IRM coronale AC-PC ci-dessous :
Figure 2.3c : délimitation des régions d’intérêt en section coronale.
Figure 2.3d : régions d’intérêt après édition et attribution de valeur de voxels à chaque région utilisée pour le calcul final.
II.4 Aspects méthodologiques
Il n’a été tenu compte dans les résultats que du gyrus cingulaire dans son ensemble et non des valeurs séparées du gyrus 24 et 32. Du fait de la résolution de l’imagerie par résonance magnétique, ces structures ne pouvaient être définies de manière correcte. De plus, à cause des surprojections, en éditant la région supérieure (i.e. 24), la mesure débordait sur les régions controlatérales et inférieures (i.e. 32). Pour bien faire comprendre cette situation, la figure 2.4a montre une image « idéale » quoique rare dans notre étude (3%), réalisant le passage sous le corps calleux des deux gyri. Cette disposition anatomique correspond à celle décrite dans l’étude de Drevets et al.
Figure 2.4a : Situation « classique » où les deux gyri passent sous le corps calleux. Gyrus 24 Gyrus 32
Chez certains sujets, le gyrus 24 se collait au corps calleux à tel point qu’il disparaissait quasiment au niveau de la limite caudale de mesure fixée auparavant, ne restant en fait que le gyrus 32. Il arrivait également que le gyrus 32 s’arrête rostralement par rapport à la limite antérieure de mesure. Nous ne mesurions alors que la partie du gyrus cingulaire qui passait sous le corps calleux, à savoir le gyrus 24. Ainsi, par soucis de simplification, nous appellerons toutes nos mesures « gyrus 24 + 32 » droit ou gauche.
Figure 2.4b : Disparition du gyrus 24 droit sous le corps calleux.
Gyrus 24 Gyrus 32
Figure 2.4c : Arrêt du gyrus 32 gauche antérieurement avant son passage sous le corps calleux.
Enfin, les cerveaux ont été classés selon l’anatomie des sillons décrite dans l’atlas des sulci cérébraux. La morphologie du gyrus cingulaire a été étudiée, plus particulièrement la partie subgénuale, son anatomie et ses connexions. Les deux hémisphères ont été différenciés.
Figure 2.4d : Morphologies I du sulcus cingulaire. Les lignes colorées représentent le sulcus cingulaire entier. IA : Continu. IB : Interruption antérieure. IC : Interruption postérieure. ID : Interruption en 3 segments.
Gyrus 24 Gyrus 32
Figure 2.4e : Morphologie II du sulcus cingulaire. Les lignes colorées rouge et jaune représentent le sulcus cingulaire lorsqu’il est disposé en double parallèle. IIA-IIB-IIC-IID : selon sa longueur et sa disposition. La ligne bleue souligne le sulcus central. La morphologie 1 est constituée par un sulcus cingulaire qui
commence postérieurement au sulcus central et 2 lorsqu’il commence antérieurement.
Figure 2.4f : Morphologie de l’extrémité antérieure du sulcus cingulaire. La ligne rouge souligne le sulcus cingulaire et ses connexions. IA : pas de connexion. IB : connexion avec le sulcus paraolfactif antérieur. IC :
II.5 Analyse statistique
Les résultats ont été enregistrés dans un fichier "Excel". Ils ont été analysés par Statview 4.5 et Stata 8.2. Nous avons effectué un SK-test afin de définir la distribution des données. Des comparaisons de distribution inter-groupe grâce à une ANOVA pour les paramètres avec distribution normale, et grâce à une analyse de variance selon Kruskal-Wallis pour les autres ont été réalisées. Si la différence se révélait significative, une comparaison des groupes deux à deux au moyen du t-test pour les quatre premiers groupes et du U-test de Mann-Whitney pour le gyrus cingulaire gauche a été effectuée. Comme des comparaisons répétées étaient nécessaires, une correction selon Bonferroni qui consiste à diviser la valeur de p significatif par le nombre de groupes présents dans la comparaison originale a été appliquée.
Des régressions univariées et multivariées ont également été réalisées afin de définir le lien entre les variables indépendantes comme le volume total, le volume de la substance grise, le nombre d’épisodes et l’âge lors du premier épisode, et la variable dépendante, à savoir le volume du cortex préfrontal subgénual.
III Etude volumétrique cérébrale chez des patients dépressifs majeurs, des bipolaires et des schizophrènes
Le tableau 3 montre la distribution des données en fonction des variables. Les paramètres du volume total, substance grise, substance blanche, gyrus cingulaire droit suivent une loi gaussienne alors que le gyrus cingulaire gauche n’adopte pas une distribution normale.
Variable Pr(Skewness) Pr(Kurtosis) adj chi2(2) Prob>chi2
Volume total 0.817 0.623 0.29 0.8629
Subst grise 0.635 0.208 1.87 0.3921
Subst blanche 0.044 0.166 5.7 0.0578
Gyrus cing G 0.003 0.391 8.6 0.0136
Gyrus cing D 0.025 0.935 4.96 0.0838
Tableau 3: Test de Skewness/Kurtosis pour la normalité.
III.1 Résultats des volumes cérébraux totaux
Les volumes sont rapportés dans le tableau 3.1a.
Témoins (N=28) Dépressifs (N=22) Bipolaires (N=11) Schizophrènes (N=13) ANOVA Volume cérébral total (cm3) 1279 ±153,7 1194,1 ±112,8* 1147,18 ±129,7** 1211,5 ±163,2 P < 0,05
Substance grise (cm3) 760,37 ±107,4 697,71 ±79,6* 695,94 ±99,7 701,4 ±94
P > 0,05 Substance blanche (cm3) 519,11 ±73,5 491,51 ±62,1 451,24 ±43,5** 510,13 ±83,3
P < 0,05
* p < 0,05
Les figures 3.1b et 3.1c illustrent la distribution des volumes totaux et de la substance blanche dans les différents groupes diagnostiques.
Figure 3.1b : Comparaison des volumes cérébraux totaux sans le LCR. Chaque rectangle de couleur regroupe 50 % des valeurs obtenues. La partie supérieure et inférieure représentent chacune la limite de ± 25 % de la variation de la population étudiée. La ligne dans les rectangles représente la valeur médiane. Les lignes verticales symbolisent les valeurs minimales et maximales. Toute valeur en dehors de cette marge est appelée « hors ligne » et elle est représentée par un rond.
Figure 3.1c :Comparaisons des volumes de la substance grise.
Les volumes totaux des patients dépressifs et bipolaires sont significativement plus bas que ceux du groupe témoin (respectivement diminués de 85,34 cm3, p=0,03 et de 132,3 cm3, p=0,01). La même observation s’applique en ce qui concerne le volume de la substance grise pour les dépressifs (diminution de 62,8 cm3, p=0,02), mais pas en ce qui concerne les bipolaires (diminution de 64,4 cm3, p=0,09). Pour la substance blanche, seul le groupe des bipolaires reste significativement plus bas que les témoins (diminution de 67,87 cm3, p=0,001). Suite à la correction selon Bonferroni, seul le groupe des patients bipolaires reste significativement diminué quant au volume total et au volume de substance blanche (p<0,0125).
III.2 Résultats du volume du cortex cingulaire préfrontal subgénual
Les tableaux 3.2a et 3.2b résument les résultats du volume cingulaire subgénual droit et gauche des différents groupes. Les figures 3.2c, 3.2d et 3.2e montrent la distribution des volumes.
Témoins (N=28) Dépressifs (N=23) Bipolaires (N=11) Schizophrènes (N=15) ANOVA
CCPS droit (cm3) 0,54 ± 0,2 0,48 ± 0,1 0,53 ± 0,1 0,49 ± 0,2 P > 0,05
Tableau 3.2a: résultats des volumes du cortex cingulaire subgénual droit. Présentés en moyenne ± écart-type. CCPS : cortex cingulaire préfrontal subgénual
Témoins (N=28) Dépressifs (N=23) Bipolaires (N=11) Schizophrènes (N=15) Kruskal-Wallis CCPS gauche (cm3) 0,42 ± 0,2 0,31 ± 0,2* 0,54 ± 0,2 0,44 ± 0,4 P < 0,05 * p < 0,05
** p < 0,0125 (correction selon Bonferroni)
Tableau 3.2b: résultats des volumes du cortex cingulaire subgénual gauche. Présentés en médiane ± inter-quartile range. CCPS : cortex cingulaire préfrontal subgénual
0 0.2 0.4 0.6 0.8 1 1.2
Dépressifs Bipolaires Témoins Schizophrènes
Volume du gyrus cingulaire gauche
CC
Figure 3.2c : Volume du gyrus cingulaire subgénual gauche.
0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
Dépressifs Bipolaires Témoins Schizophrènes
Volume du gyrus cingulaire droit
Si l’on compare les différents groupes entre eux, nous voyons qu’il existe une diminution significative du volume du cortex cingulaire subgénual gauche chez les patients dépressifs par rapport au groupe témoin : -0,09 cm3 (p=0,05). Elle disparaît après correction selon Bonferroni. Cette différence n’est pas significative pour l’hémisphère droit : -0,05 cm3 (p=0,26) ni pour les autres diagnostics.
Pour chaque groupe, le volume de la région d’intérêt est inférieur pour l’hémisphère gauche par rapport à l’hémisphère controlatéral, mais cette différence n’est significative que pour le volume du cortex préfrontal subgénual gauche (diminué de 0,12 cm3, p<0,05). Cette différence disparaît après correction selon Bonferroni.
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
Hémisphère gauche Hémisphère droit
Volume du cortex préfrontal subgénual chez les patients dépressifs
CC
Nous avons également étudié comment évoluait le volume de la région d’intérêt des deux hémisphères en fonction du volume total, de la substance, du nombre d’épisodes et de l’âge du premier épisode.
Figure 3.2f : Volume du gyrus cingulaire gauche en fonction du volume total, de la substance grise, du nombre d’épisodes et de l’âge du premier épisode.
P> 0,05 P> 0,05 P> 0,05 ,1 ,2 ,3 ,4 ,5 ,6 ,7 ,8 Gyrus cing G 550 600 650 700 750 800 850 Subst grise Y = -,186 + ,001 * X; R^2 = ,18 ,1 ,2 ,3 ,4 ,5 ,6 ,7 ,8 Gyrus cing G 900 1000 1100 1200 1300 1400 1500 Volume total Y = -,112 + 4,045E-4 * X; R^2 = ,094 P> 0,05 ,1 ,2 ,3 ,4 ,5 ,6 ,7 ,8 Gyrus cing G 0 5 10 15 20 25 30 Nb d'épisodes Y = ,344 + ,006 * X; R^2 = ,052 ,1 ,2 ,3 ,4 ,5 ,6 ,7 ,8 Gyrus cing G 10 15 20 25 30 35 40 45 50 55 60 Age du 1er épisode
Figure 3.2e : Volume du gyrus cingulaire droit en fonction du volume total, de la substance grise, du nombre d’épisodes et de l’âge du premier épisode.
Le volume du gyrus cingulaire subgénual gauche et droite augmente de manière non proportionnelle au volume total et au volume de substance grise. Il n’y a pas de corrélation significative entre les différents paramètres étudiés. Dans un modèle de régression linéaire multivarié, aucun résultat significatif ne ressort. En comparant le volume moyen du cortex cingulaire subgénual préfrontal gauche et droit des patients dépressifs avec une anamnèse familiale positive (N=3), on ne voit pas de baisse significative par rapport au groupe témoin (G : -0,189, p=0,09; D : -0,084, p=0,49). P> 0,05 P> 0,05 P> 0,05 P> 0,05 ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 Gyrus cing D 900 1000 1100 1200 1300 1400 1500 Volume total Y = ,009 + 3,978E-4 * X; R^2 = ,096 ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 Gyrus cing D 550 600 650 700 750 800 850 Subst grise Y = -,014 + ,001 * X; R^2 = ,152 ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 Gyrus cing D 0 5 10 15 20 25 30 Nb d'épisodes Y = ,505 - ,006 * X; R^2 = ,057 ,2 ,3 ,4 ,5 ,6 ,7 ,8 ,9 Gyrus cing D 10 15 20 25 30 35 40 45 50 55 60 Age du 1er épisode
III.3 Etude des différentes morphologies observées
Morphologies Groupe total (N : 77) Témoins (N :28) Dépressifs (N : 23) Bipolaires (N : 11) Schizophrènes (N : 15) SCG SCD SCG SCD SCG SCD SCG SCD SCG SCD IA 36 (47%) 40 (52%) 13 (46%) 15 (54%) 10 (44%) 9 (39%) 4 (36%) 6 (55%) 9 (60%) 10 (67%) IB 3 (4%) 4 (5%) 2 (7%) 2 (7%) 1 (4%) 0 (0%) 0 (0%) 1 (9%) 0 (0%) 1 (7%) IC 16 (21%) 18 (23%) 5 (18%) 6 (21%) 5 (22%) 8 (35%) 4 (36%) 1 (9%) 2 13%) 3 (20%) ID 6 (8%) 6 (8%) 0 (0%) 2 (7%) 4 (17%) 2 (9%) 2 (18%) 2 (18%) 0 (0%) 0 (0%) IIA 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (=%) IIB 1 (1%) 0 (0%) 1 (4%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) IIC 8 (10%) 8 (10%) 3 (11%) 2 (7%) 2 (9%) 4 (17%) 0 (0%) 1 (9%) 3 (20%) 1 (7%) IID 7 (9%) 1 (1%) 4 (14%) 1 (4%) 1 (4%) 0 (0%) 1 (9%) 0 (0%) 1 (7%) 0 (0%)
Tableau 3.3a : Morphologies du sulcus cingulaire retrouvées pour chaque groupe de patients examinés et le groupe témoin, leur pourcentage respectif et les mêmes données concernant le groupe total. Ce tableau résume la morphologie du sulcus cingulaire, à savoir s’il est continu ou pas, simple ou double. Il se réfère à la description morphologique des tables 2.4d et 2.4e. SCG : sulcus cingulaire gauche. SCD : sulcus cingulaire droit.
La morphologie IA, à savoir un sulcus cingulaire simple continu est la plus fréquente tout groupe confondu, que ce soit concernant l’hémisphère droit ou gauche. Viennent ensuite les morphologies IC et IIC soit respectivement un sulcus simple discontinu avec une interruption postérieure et un sulcus double avec une partie antérieure frontale.Il n’y a pas de différence significative entre les patients dépressifs et les autres groupes.
Morphologies Groupe total (N : 77) Témoins (N :28) Dépressifs (N : 23) Bipolaires (N : 11) Schizophrènes (N : 15) SCG SCD SCG SCD SCG SCD SCG SCD SCG SCD IA-IIA 22 (29%) 10 (13%) 10 (36%) 3 (11%) 4 (17%) 5 (22%) 1 (9%) 1 (9%) 7 (47%) 1 (7%) IA-IIB 25 (32%) 29 (38%) 8 (29%) 11 (39%) 12 (52%) 8 (35%) 4 (36%) 5 (45%) 1 (7%) 5 (33%) IA-IIC 2 (3%) 8 (10%) 0 (0%) 2 (7%) 1 (4%) 3 (13%) 0 (0%) 2 (18%) 1 (7%) 1 (7%) IB-IIA 12 (16%) 7 (9%) 3 (11%) 2 (7%) 3 (13%) 3 (13%) 4 (36%) 0 (0%) 2 (13%) 2 (13%) IB-IIB 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) IB-IIC 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) IC-IIA 7 (9%) 6 (8%) 2 (7%) 2 (7%) 2 (9%) 2 (9%) 0 (0%) 0 (0%) 3 (20%) 2 (13%) IC-IIB 7 (9%) 11 (14%) 3 (11%) 7 (25%) 1 (4%) 2 (9%) 2 (18%) 0 (0%) 1 (7%) 2 (13%) IC-IIC 2 (3%) 6 (8%) 2 (7%) 1 (4%) 0 (0%) 0 (0%) 0 (0%) 3 (27%) 0 (0%) 2 (13%)
Tableau 3.3b: Morphologies et connexions del’extrêmité antérieure du sulcus cingulaire. Elles définissent ces connexions comme décrit dans la table 2.4f (I A-B-C) et sa limite, à savoir si celui-ci se termine plus ou moins rostralement du corps calleux (II A-B-C).
Les morphologies IA-IIA et IA-IIB sont prédominantes, tous groupes et hémisphères confondus. En comparant les morphologies caractérisées par un volume du cortex cingulaire moindre avec le volume du groupe témoin, nous ne trouvons pas de différence significative.
IV Discussion
IV.1 Points forts et limitations de cette étude
Les points forts de cette étude sont le nombre conséquent de patients dépressifs, l’exclusion de tout patient avec des anomalies de signal ou des masses intracérébrales. L’âge moyen des sujets rend peu probable l’action d’une maladie dégénérative sur l’étude du volume cérébral. L’utilisation d’une méthodologie précise permet de rendre crédibles les résultats, malgré une hétérogénéité anatomique importante. Cette diversité a pu être documentée par la classification des images grâce à un atlas de référence.
Les limitations de cette étude incluent en premier lieu l’absence de femmes dans le groupe témoin. Bien que la présence d’une médication psychotrope chez la plupart des patients pourrait influencer les différents volumes cérébraux, une étude récente a démontré qu’un traitement antidépresseur améliorerait les performances cognitives et les symptômes dépressifs des malades sans incidence sur la taille de l’hippocampe [91]. Enfin, la résolution de l’imagerie par résonance magnétique et l’absence de référence histologique pourraient induire des erreurs de mesure. De même, les mesures ont été effectuées par un seul technicien, ce qui pourrait influencer la définition de la région d’intérêt.
IV.2 Atteinte du volume cérébral total
La variabilité du volume cérébral total est importante dans le groupe témoin. En effet, sans tenir compte du LCR, il y a environ 600 cm3 d’écart en ce qui concerne le volume cérébral total, ce qui correspond à 50% de la valeur moyenne. Celui-ci se réduit a respectivement 450 et 300 pour le volume de la substance grise et blanche (environ 70% des valeurs moyennes). Cette disparité est certainement due à l’hétérogénéité interindividuelle du volume cérébral bien connu dans une population générale.
Le groupe des patients dépressifs majeurs et des bipolaires sont quasiment identiques, en ce qui concerne la valeur moyenne de leur volume total. Celle-ci est significativement d’environ 10% moindre que celle du groupe contrôle. Cependant le volume total chez les bipolaires est le seul à rester significativement diminué par rapport aux contrôles lors d’une correction pour les comparaisons multiples. Dans sa revue, Soares et al. fait référence à une diminution du volume du lobe frontal, du noyau caudé, du putamen et du cervelet chez les patients dépressifs alors que chez les bipolaires, un troisième ventricule élargi, une atrophie du cervelet et du lobe temporal, ainsi que des hyperintensités sous-corticales sont retrouvés [22]. Une méta-analyse regroupant 33 études montre un élargissement des ventricules et des sillons chez les patients dépressifs et bipolaires [92]. Elkis et al. a tenté d’augmenter le pouvoir statistique des études, isolément négatives, en les regroupant. Pourtant, du fait de leurs différences méthodologiques, ces études ne sont pas comparables. Lors d’une étude regroupant 36 patients bipolaires, 30 patients unipolaires et 26 contrôles, Dupont et al. ne décrit pas de différence du volume cérébral total entre les groupes diagnostics [93]. Ainsi, la littérature abonde dans le sens d’une diminution du volume du lobe frontal et des ganglions de la base tandis qu’une atrophie globale, un élargissement des sillons ou des ventricules ne sont pas systématiquement retrouvés. A contrario, et en accord avec les données de Soares et al, le
volume de la substance grise ne montre pas de diminution significative chez les patients avec troubles de l’humeur.
Pour la substance blanche, seul le groupe des patients bipolaires est significativement diminué par rapport au groupe contrôle. Starkowski et al. a montré une diminution du volume de la substance blanche accompagnée d’une augmentation relative de la substance grise chez 17 patients durant leur premier épisode maniaque comparés à 16 contrôles [94]. Cela pourrait refléter, via une atrophie sous-corticale, une perte axonale plus importante dans cette pathologie que dans les 2 autres. En effet, plusieurs études ont montré une augmentation des hyperdensités sous-corticales et périventriculaires chez les patients bipolaires qui pourrait refléter une atteinte des petites artères cérébrales entraînant des zones de démyélinisation [95] [7].
Les résultats du groupe des patients schizophrènes ne confirment pas l’étude de Koukolik et al qui montre une diminution du volume du cortex cérébral et de la substance grise par rapport à un groupe de référence [96]. Ceux-ci présentent également certaines atteintes localisées (une atrophie du gyrus parahippocampal, une diminution du nombre de neurones dans le noyau médiodorsal du thalamus, de l’amygdale, du cortex préfrontal et du gyrus cingulaire), et une dilatation des ventricules latéraux et du 3e ventricule. Dans notre travail par contre, nous ne trouvons pas de différence significative, par rapport au groupe témoin, ni du volume total ni de la substance grise des malades atteints de schizophrénie. Ainsi, malgré des cerveaux dans lesquels nous pouvons retrouver certaines des atteintes susmentionnées, entre autres la dilatation des ventricules, le groupe dans son ensemble ne diffère pas de celui de référence. Dans l’hypothèse d’une atteinte neurodégénérative, l’évolution de la maladie
maladie, ces anomalies structurelles ne sont possiblement pas encore détectables par les techniques d’imagerie par résonance magnétique.
IV.3 Atteinte du cortex cingulaire subgénual
L’étude du groupe des patients schizophrènes ne révèle pas de différence significative par rapport au groupe témoin. Ce résultat va à l’encontre de deux études récentes qui rapportent une diminution de volume notamment du cortex préfrontal et du cortex cingulaire antérieur chez des patients schizophrènes [84] [85]. Ces observations sont renforcées par l’étude de Bouras et al qui montre une diminution de l’épaisseur corticale du cortex préfrontal subgénual probablement due à une diminution de la taille des neurones plutôt qu’à une perte neuronale ou axonale, chez les patients schizophrènes [97]. Dans le même ordre d’idées, en analysant la partie préfrontale du cortex cingulaire subgénual droit, nous ne trouvons pas, que se soit pour les dépressifs ou les bipolaires de différence significative avec le groupe témoin. Cette observation confirme les données de la littérature [74] [79]. Si un processus neurodégénératif devait intervenir dans la pathogénèse de l’une ou l’autre de ces affections, la durée d’évolution relativement courte de nos groupes (5 ans pour les patients dépressifs, 11 ans pour les bipolaires et 7,5 ans pour les schizophrènes) pourrait expliquer l’absence d’atrophie en imagerie par résonance magnétique.
Concernant le groupe des patients bipolaires et le volume du cortex cingulaire subgénual gauche, nos résultats diffèrent de l’étude de Drevets et al. [74]. Celui-ci a décrit une diminution de 39% du volume de cette région alors que nos données ne révèlent pas de différences significatives avec le groupe contrôle. Les imprécisions méthodologiques décrites
précédemment pourraient expliquer cette discordance. En absence de nouvelles données apportées par la littérature, il est peu probable qu’une atteinte du gyrus cingulaire subgénual gauche visible par la résonance magnétique soit impliquée dans la pathogenèse de la maladie bipolaire.
Le volume du cortex subgénual préfrontal gauche est diminué d’environ 25% chez les dépressifs et de manière significative par rapport au groupe témoin. Ce résultat corrobore les observations de Drevets et al. qui ont trouvé une diminution de 48 % du volume du cortex subgénual gauche chez les patients dépressifs majeurs [78]. Pourtant, cette différence disparaît après correction des données pour les comparaisons multiples (Bonferroni), ce qui n’est pas spécifié dans l’article de Drevets et al. et qui relativise la valeur de la diminution que nous retrouvons ici. De plus, le pouvoir statistique des résultats concernant le volume cingulaire subgénual gauche n’est pas satisfaisant. Il faudrait, afin de le renforcer, soit un collectif de patient beaucoup plus important (N : 23 vs N : 28), soit une différence beaucoup plus importante entre les deux groupes que celle observée ici (-25%).
En conclusion, nos résultats ne soutiennent pas l’hypothèse d’une diminution du volume du cortex cingulaire préfrontal subgénual chez les patients dépressifs et par conséquent la présence d’une anomalie structurelle de cette région pouvant servir de marqueur biologique de cette affection. Ils permettent cependant de mettre en évidence les nombreux problèmes méthodologiques qui doivent être pris en considération de manière rigoureuse dans le cadre des études d’imagerie structurelle en psychiatrie. De plus, ils soulignent la variabilité morphologique inter-individuelle, impliquant la nécessité d’une analyse de collectifs très grands, documentés cliniquement de façon prospective.
V Bibliographie
1. American Psychiatric Association releases guideline on the psychiatric evaluation of adults. Am Fam Physician, 1996. 53(6): p. 2195-6.
2. statistique, O.f.d.l., Santé et comportement vis-à-vis de la santé en Suisse. 2000. 3. Andreasen, N.C. and B.D. W., Introductory textbook of psychiatry. 1995.
4. Andreasen, N.C., et al., Ventricular abnormalities in affective disorder: clinical and
demographic correlates. Am J Psychiatry, 1990. 147(7): p. 893-900.
5. Figiel, G.S., et al., Subcortical hyperintensities on brain magnetic resonance imaging:
a comparison of normal and bipolar subjects. J Neuropsychiatry Clin Neurosci, 1991.
3(1): p. 18-22.
6. Rabins, P.V., et al., Cortical magnetic resonance imaging changes in elderly
inpatients with major depression. Am J Psychiatry, 1991. 148(5): p. 617-20.
7. Dupont, R.M., et al., Subcortical signal hyperintensities in bipolar patients detected
by MRI. Psychiatry Res, 1987. 21(4): p. 357-8.
8. Johnstone, E.C., et al., Temporal lobe structure as determined by nuclear magnetic
resonance in schizophrenia and bipolar affective disorder. J Neurol Neurosurg
Psychiatry, 1989. 52(6): p. 736-41.
9. Swayze, V.W., 2nd, et al., Developmental abnormalities of the corpus callosum in
schizophrenia. Arch Neurol, 1990. 47(7): p. 805-8.
10. Lesser, I.M., et al., Brain injury and cognitive function in late-onset psychotic
depression. J Neuropsychiatry Clin Neurosci, 1991. 3(1): p. 33-40.
11. McDonald, W.M., et al., Occurrence of subcortical hyperintensities in elderly subjects
with mania. Psychiatry Res, 1991. 40(4): p. 211-20.
12. Risch, S.C., et al., Limbic-hypothalamic-pituitary-adrenal axis activity and
ventricular-to-brain ratio studies in affective illness and schizophrenia.
Neuropsychopharmacology, 1992. 6(2): p. 95-100.
13. Shah, S.A., et al., Posterior fossa abnormalities in major depression: a controlled
magnetic resonance imaging study. Acta Psychiatr Scand, 1992. 85(6): p. 474-9.
14. Coffey, C.E., et al., Quantitative cerebral anatomy in depression. A controlled
magnetic resonance imaging study. Arch Gen Psychiatry, 1993. 50(1): p. 7-16.
15. Harvey, I., et al., Volumetric MRI measurements in bipolars compared with
schizophrenics and healthy controls. Psychol Med, 1994. 24(3): p. 689-99.
16. Zubenko, G.S., et al., Brain imaging abnormalities in mental disorders of late life. Arch Neurol, 1990. 47(10): p. 1107-11.
17. Lammers GS, D.P., et al., MRJ of the corpus callosum and septum pellucidum in
depression. Biol Psychiatry, 1991. 29: p. 295-308.
18. Husain, M.M., et al., A magnetic resonance imaging study of putamen nuclei in major
depression. Psychiatry Res, 1991. 40(2): p. 95-9.
19. Krishnan, K.R., et al., Magnetic resonance imaging of the caudate nuclei in
depression. Preliminary observations. Arch Gen Psychiatry, 1992. 49(7): p. 553-7.
20. Aylward, E.H., et al., Magnetic resonance imaging measurement of posterior fossa
structures in schizophrenia. Am J Psychiatry, 1994. 151(10): p. 1448-52.
21. Dupont, R.M., et al., Magnetic resonance imaging and mood disorders. Localization
of white matter and other subcortical abnormalities. Arch Gen Psychiatry, 1995.
52(9): p. 747-55.
22. Soares, J.C. and J.J. Mann, The anatomy of mood disorders--review of structural
neuroimaging studies [see comments]. Biol Psychiatry, 1997. 41(1): p. 86-106.
23. Drevets, W.C., Neuroimaging studies of mood disorders. Biol Psychiatry, 2000. 48(8): p. 813-29.
24. Lai, T., et al., Reduction of orbital frontal cortex volume in geriatric depression. Biol Psychiatry, 2000. 48(10): p. 971-5.
25. Kumar, A., et al., Atrophy and high intensity lesions: complementary neurobiological
mechanisms in late-life major depression. Neuropsychopharmacology, 2000. 22(3): p.
264-74.
26. Elkis, H., et al., Increased prefrontal sulcal prominence in relatively young patients
with unipolar major depression. Psychiatry Res, 1996. 67(2): p. 123-34.
27. Royall, D.R., Frontal systems impairment in major depression. Semin Clin Neuropsychiatry, 1999. 4(1): p. 13-23.
28. Bremner JD, N.M., et al., Hippocampal volume reduction in major depression. Am J Psychiatry, 2000. 157: p. 115-8.
29. Yl, S., 3D MRI studies of neuroanatomic changes in unipolar major depression: The
role of stress and medical comorbidity. Biol Psychiatry, 2000. 48: p. 791-800.
30. MacQueen, G.M., et al., Course of illness, hippocampal function, and hippocampal
volume in major depression. Proc Natl Acad Sci U S A, 2003. 100(3): p. 1387-92.
31. Campbell, S., et al., Lower hippocampal volume in patients suffering from depression:
a meta-analysis. Am J Psychiatry, 2004. 161(4): p. 598-607.
32. Videbech, P. and B. Ravnkilde, Hippocampal volume and depression: a meta-analysis
33. Czeh B, M.T., et al., Stress-induced changes in cerebral metabolites, hippocampal
volume, and cell proliferation are prevented by antidepressant treatment with tianeptine. Proc Natl Acad Sci USA, 2001. 98: p. 12796-801.
34. Madsen TM, T.A., et al., Increased neurogenesis in a model of electroconvulsive
therapy. Biol Psychiatry, 2000. 47: p. 1043-9.
35. Malberg JE., et al., Chronic antidepressant treatment increases neurogenesis in adult
rat hippocampus. J Neurosci, 2000. 20: p. 9104-10.
36. Parashos, I.A., et al., Magnetic-resonance morphometry in patients with major
depression. Psychiatry Res, 1998. 84(1): p. 7-15.
37. Bremner, J.D., et al., Hippocampal volume reduction in major depression. Am J Psychiatry, 2000. 157(1): p. 115-8.
38. Drevets, W.C. and M.E. Raichle, Neuroanatomical circuits in depression:
implications for treatment mechanisms. Psychopharmacol Bull, 1992. 28(3): p.
261-74.
39. Videbech, P., PET measurements of brain glucose metabolism and blood flow in
major depressive disorder: a critical review. Acta Psychiatr Scand, 2000. 101(1): p.
11-20.
40. Ito, H., et al., Hypoperfusion in the limbic system and prefrontal cortex in depression:
SPECT with anatomic standardization technique [see comments]. J Nucl Med, 1996.
37(3): p. 410-4.
41. Vasile, R.G., et al., Focal cerebral perfusion defects demonstrated by
99mTc-hexamethylpropyleneamine oxime SPECT in elderly depressed patients. Psychiatry
Res, 1996. 67(1): p. 59-70.
42. Martinot, J.L., et al., Left prefrontal glucose hypometabolism in the depressed state: a
confirmation. Am J Psychiatry, 1990. 147(10): p. 1313-7.
43. Kumar, A., et al., Regional cerebral glucose metabolism in late-life depression and
Alzheimer disease: a preliminary positron emission tomography study. Proc Natl Acad
Sci U S A, 1993. 90(15): p. 7019-23.
44. Hurwitz, T.A., et al., Regional cerebral glucose metabolism in major depressive
disorder. Can J Psychiatry, 1990. 35(8): p. 684-8.
45. Brody, A.L., et al., Brain metabolic changes in major depressive disorder from pre- to
post- treatment with paroxetine. Psychiatry Res, 1999. 91(3): p. 127-39.
46. Hagman, J.O., et al., Comparison of regional brain metabolism in bulimia nervosa
and affective disorder assessed with positron emission tomography. J Affect Disord,
1990. 19(3): p. 153-62.
47. Drevets, W.C., Prefrontal cortical-amygdalar metabolism in major depression. Ann N Y Acad Sci, 1999. 877: p. 614-37.
48. Mayberg, H.S., Modulating dysfunctional limbic-cortical circuits in depression:
towards development of brain-based algorithms for diagnosis and optimised treatment. Br Med Bull, 2003. 65: p. 193-207.
49. Brody, A.L., et al., Prefrontal-subcortical and limbic circuit mediation of major
depressive disorder. Semin Clin Neuropsychiatry, 2001. 6(2): p. 102-12.
50. Kuroda, M. and J.L. Price, Synaptic organization of projections from basal forebrain
structures to the mediodorsal thalamic nucleus of the rat. J Comp Neurol, 1991.
303(4): p. 513-33.
51. Fuller, T.A., et al., Sources of presumptive glutamergic/aspartergic afferents to the rat
ventral striatopallidal region. J Comp Neurol, 1987. 258(3): p. 317-38.
52. Crawford, J.P., The anatomy of emotion. Med Hypotheses, 1978. 4(4): p. 311-23. 53. Ballantine HT, et al., Stereotaxic anterior cingulotomy for neuropsychiatric illness
and chronic pain. Journal of Neurosurgery, 1967. 26: p. 488.
54. Brown, Frontal lobe syndromes. Clinical Neuropsychology, Handbook of clinical Neurology, 1984. 45.
55. Posner, M.I. and M.K. Rothbart, Attention, self-regulation and consciousness. Philos Trans R Soc Lond B Biol Sci, 1998. 353(1377): p. 1915-27.
56. Bush, G., et al., Anterior cingulate cortex dysfunction in attention-deficit/hyperactivity
disorder revealed by fMRI and the Counting Stroop. Biol Psychiatry, 1999. 45(12): p.
1542-52.
57. Allman, J.M., et al., The anterior cingulate cortex. The evolution of an interface
between emotion and cognition. Ann N Y Acad Sci, 2001. 935: p. 107-17.
58. Gaspar, P., et al., Catecholamine innervation of the human cerebral cortex as revealed
by comparative immunohistochemistry of tyrosine hydroxylase and dopamine-beta-hydroxylase. J Comp Neurol, 1989. 279(2): p. 249-71.
59. Schultz, W., Predictive reward signal of dopamine neurons. J Neurophysiol, 1998.
80(1): p. 1-27.
60. Kunig, G., et al., Reduced reward processing in the brains of Parkinsonian patients. Neuroreport, 2000. 11(17): p. 3681-7.
61. Vogt, B.A. and D.N. Pandya, Cingulate cortex of the rhesus monkey: II. Cortical
afferents. J Comp Neurol, 1987. 262(2): p. 271-89.
62. Mizuki, Y., et al., A physiological marker for assessing anxiety level in humans:
frontal midline theta activity. Jpn J Psychiatry Neurol, 1989. 43(4): p. 619-26.
64. Paus, T., et al., Regional differences in the effects of task difficulty and motor output
on blood flow response in the human anterior cingulate cortex: a review of 107 PET activation studies. Neuroreport, 1998. 9(9): p. R37-47.
65. Pardo, J.V., et al., Neural correlates of self-induced dysphoria. Am J Psychiatry, 1993.
150(5): p. 713-9.
66. Dougherty, D.D., et al., Anger in healthy men: a PET study using script-driven
imagery. Biol Psychiatry, 1999. 46(4): p. 466-72.
67. Rauch, S.L., et al., A positron emission tomographic study of simple phobic symptom
provocation. Arch Gen Psychiatry, 1995. 52(1): p. 20-8.
68. Shin, L.M., et al., Regional cerebral blood flow during script-driven imagery in
childhood sexual abuse-related PTSD: A PET investigation. Am J Psychiatry, 1999.
156(4): p. 575-84.
69. Devinsky, O., et al., Contributions of anterior cingulate cortex to behaviour. Brain, 1995. 118 (Pt 1): p. 279-306.
70. Room, P., et al., Efferent connections of the prelimbic (area 32) and the infralimbic
(area 25) cortices: an anterograde tracing study in the cat. J Comp Neurol, 1985.
242(1): p. 40-55.
71. Barbas, H., et al., Serial pathways from primate prefrontal cortex to autonomic areas
may influence emotional expression. BMC Neurosci, 2003. 4(1): p. 25.
72. Freedman, L.J., et al., Subcortical projections of area 25 (subgenual cortex) of the
macaque monkey. J Comp Neurol, 2000. 421(2): p. 172-88.
73. Damasio, A.R., Descartes' error and the future of human life. Sci Am, 1994. 271(4): p. 144.
74. Drevets, W.C., et al., Subgenual prefrontal cortex abnormalities in mood disorders
[see comments]. Nature, 1997. 386(6627): p. 824-7.
75. Amaral, D.G. and J.L. Price, Amygdalo-cortical projections in the monkey (Macaca
fascicularis). J Comp Neurol, 1984. 230(4): p. 465-96.
76. Haber, S.N., The primate basal ganglia: parallel and integrative networks. J Chem Neuroanat, 2003. 26(4): p. 317-30.
77. Mayberg, H.S., et al., Deep brain stimulation for treatment-resistant depression. Neuron, 2005. 45(5): p. 651-60.
78. Drevets, W.C., et al., Reduced glucose metabolism in the subgenual prefrontal cortex
in unipolar depression. Mol Psychiatry, 1998. 3(3): p. 190-1.
79. Hirayasu, Y., et al., Subgenual cingulate cortex volume in first-episode psychosis. Am J Psychiatry, 1999. 156(7): p. 1091-3.
80. Coffman, J.A., et al., Cognitive impairment and cerebral structure by MRI in bipolar
disorder. Biol Psychiatry, 1990. 27(11): p. 1188-96.
81. Baxter, L.R., Jr., et al., Reduction of prefrontal cortex glucose metabolism common to
three types of depression. Arch Gen Psychiatry, 1989. 46(3): p. 243-50.
82. Cohen, R.M., et al., Evidence for common alterations in cerebral glucose metabolism
in major affective disorders and schizophrenia. Neuropsychopharmacology, 1989.
2(4): p. 241-54.
83. Buchsbaum, M.S., et al., Frontal cortex and basal ganglia metabolic rates assessed by
positron emission tomography with [18F]2-deoxyglucose in affective illness. J Affect
Disord, 1986. 10(2): p. 137-52.
84. Goldstein, J.M., et al., Cortical abnormalities in schizophrenia identified by structural
magnetic resonance imaging. Arch Gen Psychiatry, 1999. 56(6): p. 537-47.
85. Wright, I.C., et al., Supra-regional brain systems and the neuropathology of
schizophrenia. Cereb Cortex, 1999. 9(4): p. 366-78.
86. Millet, P., et al., Similarity and robustness of PET and SPECT binding parameters for
benzodiazepine receptors. J Cereb Blood Flow Metab, 2000. 20(11): p. 1587-603.
87. Hamilton, M., Development of a rating scale for primary depressive illness. British Journal of Social and Clinical Psychology, 1967. 6: p. 278-296.
88. Overall, J.E.e.G., D.R., The Brief Psychiatric Rating Scale. Psychological Report, 1962. 10: p. 799-812.
89. DeLisi, L.E., et al., Schizophrenia as a chronic active brain process: a study of
progressive brain structural change subsequent to the onset of schizophrenia.
Psychiatry Res, 1997. 74(3): p. 129-40.
90. Rajapakse, J.C., et al., Statistical approach to segmentation of single-channel cerebral
MR images. IEEE Trans Med Imaging, 1997. 16(2): p. 176-86.
91. Vythilingam, M., et al., Hippocampal volume, memory, and cortisol status in major
depressive disorder: effects of treatment. Biol Psychiatry, 2004. 56(2): p. 101-12.
92. Elkis, H., et al., Meta-analyses of studies of ventricular enlargement and cortical
sulcal prominence in mood disorders. Comparisons with controls or patients with schizophrenia. Arch Gen Psychiatry, 1995. 52(9): p. 735-46.
93. Dupont, R.M., et al., Diagnostic specificity of focal white matter abnormalities in
bipolar and unipolar mood disorder. Biol Psychiatry, 1995. 38(7): p. 482-6.
94. Strakowski, S.M., et al., Structural brain abnormalities in first-episode mania. Biol Psychiatry, 1993. 33(8-9): p. 602-9.
96. Koukolik, F., [Structural changes in the brain in schizophrenia and affective
psychoses]. Cesk Psychiatr, 1992. 88(6): p. 307-15.
97. Bouras, C., et al., Anterior cingulate cortex pathology in schizophrenia and bipolar
VI Addendum
Remerciements
Je désire remercier tout particulièrement le Dr Vincente Ibanez, médecin adjoint à l’unité de neuroimagerie de Belle-Idee (GE), pour son soutien, ses conseils et l’apport de sa précieuse expérience dans la réalisation et la rédaction de ce travail.
J’adresse toute ma gratitude au Prof. Giannakopoulos, médecin-chef du département de psychiatrie (GE), qui a patiemment relu et corrigé les différentes versions de cette thèse et sans qui celle-ci n’aurait pas vu le jour.
De même, un grand merci au Dr Philippe Millet (unité de neuroimagerie, Belle-Idee (GE)) qui m’a aidé quant à l’organisation du projet ainsi qu’à la mise au point de la méthodologie.
Je remercie également le Dr François Herrmann et Mr Raphaël Grandjean (unité de coordination des programmes transversaux, département de réhabilitation et gériatrie (GE)) pour leur aide bien venue quant à l’analyse statistique des données.
Enfin, merci à ma femme Laurence pour ses encouragements et son enthousiasme qui m’ont soutenu lors de la rédaction de ce travail.