HAL Id: dumas-02292917
https://dumas.ccsd.cnrs.fr/dumas-02292917
Submitted on 20 Sep 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
les patients immunodéprimés ou à risque accru suivant :
VIH+, BPCO, insuffisants cardiaques ou diabétiques
Aude Kopp Derouet
To cite this version:
Aude Kopp Derouet. Évaluation de l’application des recommandations vaccinales anti-pneumocoque en médecine de ville chez les patients immunodéprimés ou à risque accru suivant : VIH+, BPCO, insuffisants cardiaques ou diabétiques. Médecine humaine et pathologie. 2018. �dumas-02292917�
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
Année 2018
N° 155
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Évaluation de l’application des recommandations vaccinales
anti-pneumocoque en médecine de ville chez les patients
immunodéprimés ou à risque accru suivant :
VIH+, BPCO, insuffisants cardiaques ou diabétiques
Présentée et soutenue publiquement
le 19 septembre 2018
Par
Aude KOPP DEROUET
Née le 6 juillet 1990 à Palo Alto (États-Unis)
Dirigée par M. Le Docteur Pierre-Olivier Sellier, PH
Jury :M. Le Professeur Jean-François Bergmann, PU-PH ……….. Président M. Le Professeur Pierre-Jean Guillausseau, Professeur émérite
Abréviations ………6
Introduction ………7
Première Partie : Vaccination anti pneumococcique ……….. 9
I. Le Pneumocoque ………. 9
1. Streptococcus pneumoniae ………..9
2. Les infections à S. pneumoniae ………. 9
3. L’incidence des infections à Pneumocoque ………10
II. Vaccination ……….15
1. Vaccin 13 valences ………16
2. Vaccin 23 valences ………16
III. Recommandations et leur suivi ………16
1. Recommandations ………16
2. Couverture vaccinale ………..20
Deuxième partie : Matériel et Méthodes ………..….. 25
I. Principe de l’étude ……… 25
1. Objectif de l’étude ……….. 25
2. Description de la base de données ………. 27
3. Critères d’inclusion et d’exclusion ……… 29
Troisième Partie : Résultats ……….31 I. Population ………..31 1. BPCO ……….31 2.Diabète ……….32 3. Insuffisance Cardiaque ……….33 4. VIH 35 5. Caractéristiques des patients ………..35
II. Critère de jugement principal ………37
III. Critères de jugement secondaires ……….. 40
1. Par période ……… 40
2. Schéma vaccinal ………. 42
3. Caractéristiques des médecins ……….42
Quatrième Partie : Discussion ……….. 43
Conclusion ……….48
Annexes ………..49
Bibliographie ………. 50
Remerciements
A Monsieur le Professeur Jean-François Bergmann, qui m’a fait l’honneur de présider mon jury de thèse et qui m’a fait confiance pour rédiger ce travail et pour la suite. Merci pour votre aide et votre disponibilité. Merci pour tout le temps que vous accordez à vos équipes et à vos étudiants afin nous apporter une formation de qualité.
Au Docteur Pierre-Olivier Sellier, merci d’avoir accepté de diriger ce travail et de m’avoir fait confiance. Merci pour ta présence et ton aide si précieuse. Merci pour ce semestre au DMI4, ou j’ai énormément appris dans une ambiance de travail excellente.
A Monsieur le Professeur Pierre-Jean Guillausseau, je vous remercie d’avoir accepté d’être membre de mon jury de thèse.
A Monsieur le Professeur Stéphane Mouly, je vous remercie d’avoir accepté d’être membre de mon jury de thèse.
Au Docteur Olivier Mangin, merci pour tes conseils et ta présence tout au long de ce travail. A toute l’équipe de CEGEDIM, à Béranger Lekens, à Laurène Gantzer et à Manoro
Ravelomanantsoa, sans qui ce travail n’aurait pu exister. Merci pour votre investissement, votre aide et votre disponibilité.
Au Docteur Véronique Delcey et à toute l’équipe de Médecine Interne de Lariboisière, merci pour ce semestre exceptionnel passé avec vous.
Au Docteur Sylvain Diamantis, au Docteur Astrid de Pontfarcy, au Docteur Eka Chakvetadze au Docteur Clara Flateau, au Docteur Alessio Strazzula et à toute l’équipe de maladies infectieuses de Melun ainsi qu’à mes co internes : Anthony, Caroline et Céline, merci pour votre soutien lors de l’écriture de ma thèse et pour ce super semestre passé avec vous tous. A ma sœur, Apolline, mon Polo, avec qui je partage toutes mes joies et mes peines. Tu es mon rayon de soleil, merci de m’apporter autant de bonheur. Merci d’être toujours présente et si aimante, je suis fière de t’avoir à mes côtés.
A Tiphaine, ma Titi, avec qui j’ai parcouru tant de chemin, tellement de souvenirs depuis toutes ces années, plus de 15 ans à refaire le monde ensemble et tellement inséparables qu’on a choisi la même voie. C’est grâce à toi que j’en suis la aujourd’hui. Tellement d’étapes passées ensemble et encore tant d’autres qui nous attendent. Merci pour cette si belle histoire d’amitié et merci d’être toujours là pour moi.
A Elsa, ma Zazou, que je ne quitte plus depuis notre rencontre sur les bancs de la fac. Une si belle rencontre et une amitié si forte, qui nous rend inséparables depuis 10 ans. Merci de tout ce que tu as fait pour moi et de tout ce que tu m’apportes.
A mes amis d’enfance : Camille, Céline, Dana, Hermeline, Jenna, Jules, Laure, Matthieu, Maud, Pauline, Romain, Solène qui m’ont tant apporté depuis toutes ces années. Merci
d’avoir toujours été là et de m’avoir soutenue malgré les concours, les mois de révisions, l’écriture d’une certaine thèse… Vous êtes des amis en or.
A tous mes amis médecins : Alexandre, Anne L., Anne M., Antoine, Chakiba, Gabriel, Iyad, Justine, Manon, Ugo avec qui j’ai partagé toutes ces années d’études, dix ans déjà. Merci pour tous ces moments passés ensemble. Vous êtes des amis exceptionnels.
A Laurène, ma co-interne et amie avec laquelle j’ai partagé plus de la moitié de mon
internat, merci d’avoir été là dans les bons comme dans les mauvais moments et de m’avoir écouté parler de ma thèse matin midi et soir.
A Jeremy, Marie et William, merci pour ce semestre avec vous et pour tous les moments partagés après. Vive le SMIT 1.
A mes parents, qui m’ont toujours soutenue durant toutes ces années, merci d’avoir toujours cru en moi. Merci d’être toujours là dans les moments qui comptent pour moi. Une pensée pour leurs conjoints respectifs, Isabelle et Jean Paul, merci de rendre mes parents si heureux et d’être là pour moi dans ces étapes.
A mes frères : Antonin et Abel-Côme, merci pour tout le bonheur que vous m’apportez. A mes grands-parents, merci de m’avoir toujours soutenue, je suis fière de vous avoir à mes côtés.
A toute ma famille, merci d’être présents dans toutes les étapes de ma vie.
A Frédérique et Michel, Marion, Matthieu et Marianne, merci de m’avoir acceptée dans votre famille et pour votre soutien dans mes moments de rédaction intensive de thèse. A Martin, mon Chouki, mon mari, qui est à mes côtés depuis plus de 10 ans, merci de tout ce que tu as fait pour moi depuis toutes ces années. Merci pour ton soutien, ta patience, ta présence et ton amour.
APHP : Assistance Publique des Hôpitaux de Paris ATCD : Antécédent
B2LA : Beta 2 mimétique de Longue durée d’Action BPCO : Bonchopneumopathie Chronique Obstructive
Capita : Community-Acquired Pneumonia Immunization Trial in Adults CATI : Computer Assisted Telephone Interview
CHG : Centre Hospitalier Général CHU : Centre Hospitalo-Universitaire
CIM : Classification Internationale des Maladies
CLIN : Comité de Lutte contre les Infections Nosocomiales
CNAMTS : Caisse Nationale de l’Assurance Maladie des Travailleurs Salariés CNRP : Centre National de Référence des Pneumocoques
COMBAT : Cohorte des Méningites Bactériennes de l’Adulte CSI : Cortico-Stéroides Inhalés
dTP : Diphtérie-Tétanos-Poliomyélite
EARS-net : European Antimicrobial Resistance Surveillance Network ECDC : European Center for Disease Prevention and Control
FCU : Frottis Cervico Utérin
GHS : Groupe Homogène de Séjours
H.PR.IM : Harmonie et Promotion de l’Informatique Médicale HAS : Haute Autorité de Santé
HCSP : Haut Conseil de Santé Publique IBD : Invasive Bacterial Disease
IC : Intervalle de Confiance
IIP : Infection Invasive à Pneumocoque
INTI : Inhibiteur Nucléosidique de la Transcriptase Inverse INNTI : Inhibiteur Non Nucléosidique de la Transcriptase Inverse IP : Inhibiteur de Protéase
InVS : Institut de Veille Sanitaire MG : Médecin Généraliste
OMS : Organisation Mondial de la Santé
ORP : Observatoires Régionaux du Pneumocoque S. pneumoniae : Streptococcus pneumoniae SLD : Soins de Longue Durée
SPILF : Société de Pathologies Infectieuses de Langue Française VIH : Virus de l’Immunodéficience Humaine
Introduction
Les infections à pneumocoque sont fréquentes chez l’adulte. Les patients immunodéprimés ou ayant certaines pathologies chroniques sous-jacentes sont à risque accru de
pneumopathie à pneumocoque et d’infection invasive à pneumocoque. Les infections à pneumocoque constituent une cause majeure de morbidité et de mortalité partout dans le monde.
En France, le pneumocoque est la première cause de pneumopathie bactérienne communautaire et de méningite bactérienne chez l’adulte (1).
Deux vaccins sont actuellement disponibles : VPC13 (vaccin conjugué) et VPP23 (vaccin polyosidique). La stratégie de prévention des infections à pneumocoque chez l’adulte était précédemment basée sur la vaccination par le vaccin polyosidique des personnes à risque. Le VPC7 (vaccin conjugué) a été introduit dans le calendrier vaccinal des nourrissons en 2006. En 2010, il a été remplacé par le VPC13 chez l’enfant. L’efficacité de ces vaccins conjugués sur le portage des souches vaccinales et la couverture vaccinale des nourrissons par le VPC13 ont induit une immunité de groupe chez les adultes avec en 2016 une
diminution de l’incidence des infections invasives à Pneumocoque, par comparaison avec 2009 (2).
En 2013 : Actualisation des recommandations (3) avec définition de deux groupes distincts : le groupe des patients immunodéprimés et le groupe des patients à risque mais non
immunodéprimés. Les recommandations sont d’une dose de VPC13 puis à 8 semaines une dose de VPP23 chez les patients immunodéprimés ; et chez les patients à risque élevé non immunodéprimés, une dose de VPP23 est recommandée.
En 2017 : Actualisation des recommandations (4) avec schéma vaccinal identique entre les deux groupes constitués d’une dose de VPC13 puis à 8 semaines une dose de VPP23. Actualisation s’appuyant sur les résultats de l’étude Capita (Community-Acquired
Pneumonia Immunization Trial in Adults) (5) démontrant l’efficacité du vaccin VPC13 vis-à-vis des pneumopathies à pneumocoque et sur des méta analyses (6,7) confirmant l’efficacité du VPP23 vis-à-vis des infections invasives à pneumocoque et pneumopathies à
pneumocoque.
Le respect des recommandations permettrait une diminution de l’incidence de ces infections (8), de la mortalité (9) et un meilleur rapport coût-efficacité (8). Le médecin généraliste joue un rôle primordial dans le suivi de ces patients à risque et donc de leur vaccination. Les rares études menées sur des populations spécifiques suggèrent cependant une très faible
couverture vaccinale (10,11).
Quel est l’impact de ces recommandations en médecine de ville ? Nous utiliserons la base de données GERS Patient Data, CEGEDIM®, qui recueille les données des logiciels d’aide à la prescription de 2500 professionnels de santé en médecine ambulatoire, représentant 4 millions de patients actifs avec une antériorité pouvant aller jusqu’à quinze ans. Chaque prescription médicamenteuse est corrélée à un diagnostic. L’objectif de cette étude est de mesurer la couverture vaccinale anti pneumococcique par les spécialistes en médecine
générale des catégories de patients immunodéprimés ou à risque accru suivants : VIH, BPCO, insuffisants cardiaques chroniques, diabétiques et d’évaluer le changement des pratiques au fur et à mesure de l’évolution des recommandations.
Première Partie
I.
Le Pneumocoque
1. Le Streptococcus pneumoniae
Le S. pneumoniae est un diplocoque à Gram positif encapsulé. La capsule est de type polyosidique et permet de classer les pneumocoques en 91 sérotypes.
C’est un commensal des voies respiratoires supérieures, il colonise le rhinopharynx. La colonisation est précoce, en général avant 2 ans. La transmission est interhumaine, de type gouttelettes. L’incidence de l’infection varie en fonction des saisons, avec un pic hivernal, en relation avec les infections virales saisonnières (comme la grippe) qui favoriserait l’infection à Pneumocoque.
2. Les infections à S. pneumoniae
a. Facteurs prédisposant aux infections
• Déficits immunitaires congénitaux ou acquis :o Humoraux : hypogammaglobulinémie
o Cellulaires : infection par le VIH, corticothérapie prolongée, hémopathies lymphoïdes
o Inné : neutropénie, diabète
o Du complément : déficit en complément o hyposplénie ou asplénie
o Autres : alcoolisme chronique, dénutrition protidique, etc.
• Insuffisance respiratoire, cardiaque ou rénale chronique, cirrhose, BPCO, asthme • Âges extrêmes : < 2 ans, > 65 ans
• Promiscuité : Foyers, institutions, camps, …
• Infection virale lésant l’appareil respiratoire (grippe…)
Le risque de survenue d’une infection invasive à pneumocoque est multiplié par 4 si le patient a une pathologie chronique type diabète, insuffisance cardiaque ou BPCO et par 23 à 48 si le patient est immunodéprimé : VIH, hémopathie, … (1)
b. Physiopathologie et formes cliniques
A l’état normal, les défenses naturelles permettent à l’hôte de se débarrasser de S.
pneumoniae de la trompe d’Eustache, des sinus, des bronches et des alvéoles. A l’occasion
d’une baisse de l’immunité, il va provoquer :
• Des infections des voies respiratoires : pneumopathie, bronchite, otite, mastoïdite, sinusite, exacerbation de BPCO, abcès du poumon (compliquant une pneumopathie ou une bactériémie)
• Des infections neuroméningées : 1ère étiologie de méningite purulente chez l’adulte.
Résulte de l’extension d’un foyer (otite ou sinusite) ou d’une bactériémie • Des bactériémies : souvent secondaires à un foyer pulmonaire
• Des infections plus rares : péritonite, endocardite, arthrite, spondylodiscite, cellulite, endométrite
Les infections sont dites invasives lorsque les pneumocoques diffusent dans un site normalement stérile : c’est le cas des méningites, des bactériémies, des arthrites. Son pouvoir pathogène est lié :
• Aux adhésines qui lui permettent d’adhérer au niveau des récepteurs des cellules épithéliales du rhinopharynx
• A la structure de la capsule qui lui permet d’échapper à la phagocytose
• Aux facteurs de virulence non capsulaires : la pneumolysine qui est toxique pour les phagocytes et les cellules épithéliales respiratoires
• L’activation du complément et des cytokines inflammatoires
3. L’incidence des infections à S. pneumoniae
Les chiffres de l’incidence des infections à pneumocoque en France reposent sur la
surveillance de ces infections grâce à deux réseaux qui reposent sur des laboratoires de ville et hospitaliers :
• Le réseau Epibac, coordonné par Santé publique France
• Le réseau du Centre National de Référence des pneumocoques (CNRP) associé aux réseaux des Observatoires Régionaux du Pneumocoque (ORP). Le CNRP s’appuie sur 23 0RP, soit plus de 400 laboratoires et près de 500 établissements de santé (CHU, CHG, établissements privés, …).
Ces réseaux permettent de suivre l’évolution de l’incidence des infections invasives à pneumocoque mais aussi d’analyser l’impact de la vaccination sur celle-ci et de suivre l’évolution de la résistance des pneumocoques aux antibiotiques.
Le réseau Epibac :
C’est un réseau de microbiologistes hospitaliers créé en 1987 et coordonné par l’InVS depuis 1999 (devenu Santé publique France en 2016). Il est constitué de plus de 300 laboratoires de microbiologie hospitaliers français répartis sur l’ensemble du territoire et volontaires chaque
année pour participer à la surveillance des infections invasives bactériennes. Epibac collecte le nombre d’infections invasives dues à 6 bactéries dont le pneumocoque.
Pour chaque cas d’infection invasive à pneumocoque, la date de prélèvement, la date de naissance et le site de prélèvement sont recueillis. Ces données permettent d’estimer et de suivre le nombre de cas et l’incidence des infections invasives à pneumocoque pour l’ensemble de la population française par groupe d’âge.
Le Centre national de référence des pneumocoques (CNRP) et le réseau des Observatoires régionaux du pneumocoque (ORP) (fig1) :
Le CNRP a pour mission d’assurer l’expertise biologique et de contribuer à la surveillance des infections à pneumocoque et de leur résistance aux antibiotiques.
Pour la surveillance microbiologique des pneumocoques, le CNRP est associé depuis 2001 à un réseau de 23 ORP répartis sur l’ensemble du territoire métropolitain et incluant des laboratoires publics et privés (environ 400 laboratoires). Cette surveillance porte en particulier sur les souches isolées d’infections invasives à pneumocoque avec une
détermination de la sensibilité des souches de pneumocoques aux principaux antibiotiques utilisés ainsi que la détermination des sérotypes des souches de pneumocoques. Cette surveillance microbiologique est essentielle car elle permet de suivre l’évolution de la couverture sérotypique des différents vaccins et l’évolution de la résistance aux
antibiotiques (Annexe 1 : fiche clinique et biologique pour envoyer un prélèvement au CNR). Le réseau ORP-CNRP collecte et étudie chaque année depuis 2001 l’ensemble des souches isolées dans le liquide céphalo-rachidien ou dans le sang, chez les enfants âgés de 0 à 15 ans et, une année sur deux, sur un échantillon systématique d’une souche sur six parmi celles isolées dans le sang chez les adultes âgés de plus de 15 ans.
Fig1. Réseau de surveillance des pneumocoques : modalités de recueil centralisé des données sur les infections pneumococciques en France (souches et fiches de
renseignements cliniques et bactériologiques).
Grâce au partenariat ORP-CNRP- Santé Publique France, la surveillance de S. pneumoniae est de grande qualité et reconnue en France et à l’étranger.
Depuis 2001, le CNRP participe au réseau de surveillance européen EARS-net et fournit les données concernant la résistance aux antibiotiques des souches invasives de S. pneumoniae. Depuis 2011, le CNRP participe aussi à la surveillance des infections invasives à
pneumocoque sous l’égide de l’ECDC (IBD- labnet). Le CNRP a participé, en collaboration avec l’OMS (Department of immunization, vaccines and biologicals), Johns Hopkins Bloomberg School of Public Health (International Vaccine Access Center, Baltimore) et le Center for Disease Control and Prevention, à une étude multi-centrique d’impact du vaccin conjugué heptavalent (12). Le CNRP et les ORP contribuent activement aux côtés de la SPILF à une surveillance exhaustive des méningites de l’adulte à travers l’étude COMBAT.
Enfin, au niveau européen, le CNRP et les ORP contribuent activement avec ACTIV pour les enfants, la SPILF pour les adultes, et Santé Publique France, à une surveillance exhaustive des infections invasives, ce qui permet à la France d’être l’un des 13 pays d’Europe invités à participer au projet de mesure d’impact du vaccin 13-valent SpIDnet2 de l’ECDC/Epiconcept. En France, les pneumocoques sont la première cause de pneumopathie bactérienne
communautaire et de méningite bactérienne chez l’adulte. C’est une cause fréquente d’otite et de pneumonie chez le jeune enfant.
En 2016, l’incidence des pneumonies se situe entre 100 000 et 120 000 cas par an avec chez l’adulte jeune une incidence annuelle de 25/100 000 et chez le sujet âgé de 280/100 000. Pour ce qui est des infections invasives, l’incidence est de 7,7/100 000.
Depuis 2010, l’incidence des infections invasives (bactériémies, méningites) à pneumocoque a significativement diminué chez les enfants de moins de 2 ans, et dans le reste de la
population non vaccinée contre le pneumocoque.
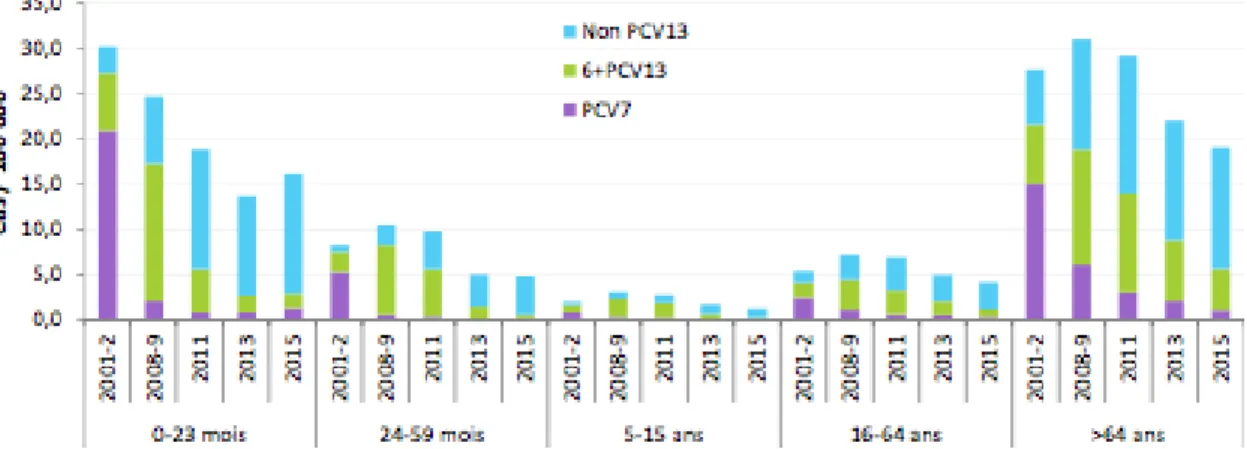
Les données du CNRP et du réseau Epibac mettent en évidence des modifications majeures de distribution des sérotypes, tant chez l’enfant que chez l’adulte, avec la quasi-disparition des sérotypes vaccinaux et l’émergence d’une grande diversité de sérotypes non vaccinaux (fig2).
Fig 2. Évolution de l’incidence des infections invasives à pneumocoque de sérotype vaccinal PCV7 (4, 6B, 9V, 14, 18C, 19F et 23F), 6+PCV13 (1, 3, 5, 6A, 7F et 19A,) ou non vaccinal (non PCV13) selon le groupe d’âge.
En comparaison avec la période pré-VPC13 (2008-2009), l’incidence des infections invasives à pneumocoque, tous sérotypes confondus, a diminué chez les enfants de moins de 2 ans et chez les enfants plus âgés et les adultes. Cette diminution concerne les infections
bactériémiques et les méningites à pneumocoque (figure 3, tableau 1). En 2016, l’incidence poursuit sa légère augmentation depuis 2015 chez les moins de 2 ans, les 15-64 ans et les personnes âgées de 65 ans et plus (figure 3).
Fig 3 Évolution du taux d’incidence des infections invasives à pneumocoque selon l’âge et de la couverture vaccinale à 24 mois, France métropolitaine, 1998-2016.
Tableau 1. Évolution de l’incidence des infections invasives à pneumocoques par âge en France métropolitaine, Epibac 1998-2016
II.
Vaccination
La stratégie de prévention des infections à pneumocoque chez l’adulte était précédemment basée sur la vaccination par le vaccin polyosidique des personnes à risque. Le VPC7 a été introduit dans le calendrier vaccinal des nourrissons en 2006. En 2010, il a été remplacé par le VPC13 chez l’enfant. Deux vaccins pneumococciques sont actuellement disponibles en France : le vaccin conjugué 13-valent Prevenar 13 qui contient 13 sérotypes du
pneumocoque, et le vaccin polyosidique non conjugué 23-valent Pneumo 23, qui contient 23 sérotypes du pneumocoque. Le vaccin Pneumovax (vaccin polyosidique 23-valent non conjugué) possède également une autorisation de mise sur la marché en France où il a déjà été commercialisé, notamment en période de rupture de stock du vaccin Pneumo 23.
1. Vaccin 13 valences
Le vaccin anti-pneumococcique conjugué 13-valent (VPC13) couvre 13 sérotypes (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F et 23F). Ce type de vaccin entraîne une immunité chez le jeune enfant, induit une réponse immunitaire mémoire et agit sur le portage des
pneumocoques au niveau pharyngé.
Ce vaccin est disponible pour la vaccination des enfants depuis 2010 et de l’adulte depuis 2013.
2. Vaccin 23 valences
Le vaccin anti-pneumococcique polysaccharidique 23-valent (VPP23) couvre 23 sérotypes (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F et 33F). Ce vaccin est très peu immunogène chez le jeune enfant et n’agit pas sur le portage. La répétition rapprochée des vaccinations induit un phénomène d’hyporéponse immunitaire. Ce vaccin est disponible depuis 1983.
III.
Recommandations et leur suivi
1. Recommandations
a. En 2010 (13)
Pour l’ensemble des enfants jusqu’à l’âge de 2 ans :
• Les enfants de 2 à 6 mois : une dose de vaccin conjugué 13- valent à 2 mois et à 4 mois avec une dose de rappel à 12 mois
• Les enfants âgés de 7 à 11 mois non vaccinés antérieurement : deux doses de vaccin conjugué 13-valent à 2 mois d’intervalle et un rappel un an plus tard
• Les enfants âgés de 12 à 23 mois non vaccinés antérieurement : deux doses de vaccin conjugué 13-valent à au moins 2 mois d’intervalle
Pour les prématurés et les nourrissons à risque élevé d’IIP : • Asplénie fonctionnelle ou splénectomie
• Drépanocytose homozygote • Infection à VIH
• Déficits immunitaires congénitaux ou secondaires à :
o une insuffisance rénale chronique ou un syndrome néphrotique
o un traitement immunosuppresseur ou une radiothérapie pour néoplasie, lymphome ou maladie de Hodgkin, leucémie, transplantation d’organe • Cardiopathie congénitale cyanogène, insuffisance cardiaque
• Pathologie pulmonaire chronique (à l’exception de l’asthme, sauf les asthmes sous corticothérapie prolongée)
• Brèche ostéoméningée • Diabète
• Candidats à l’implantation ou porteurs d’implants cochléaires
Une dose de vaccin conjugué 13-valent à 2, 3 et 4 mois avec un rappel entre 12 et 15 mois. Pour les enfants à risque élevé d’IIP âgés de 2 ans à moins de 5 ans (soit 59 mois au plus), non vaccinés :
Deux doses de vaccin conjugué 13-valent à 2 mois d’intervalle suivies d’une dose de vaccin polyosidique 23-valent au moins 2 mois après la deuxième dose de vaccin 13-valent. Pour les adultes et enfants de 5 ans et plus présentant une pathologie les exposant à un risque élevé d’IIP :
• Asplénie fonctionnelle ou splénectomie • Drépanocytose homozygote
• Infection à VIH, quel que soit leur statut immunovirologique • Syndrome néphrotique
• Insuffisance respiratoire • Insuffisance cardiaque
• Patients alcooliques avec hépatopathie chronique
• Personnes ayant des antécédents d’infection pulmonaire ou invasive à pneumocoque La vaccination est recommandée avec le vaccin polyosidique 23-valent.
Cette vaccination doit être proposée lors de leur admission dans des structures de soins ou d’hébergement aux personnes ci-dessus qui n’en auraient pas encore bénéficié.
b. En 2013 (3)
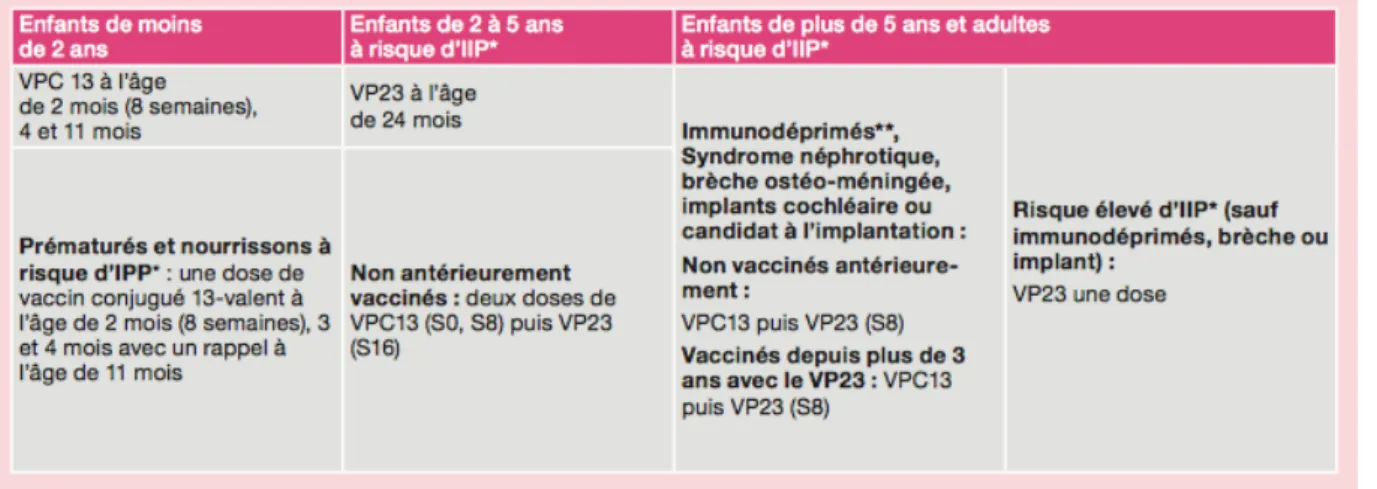
Recommandations générales :La vaccination par le VPC13 est recommandée pour l’ensemble des enfants âgés de moins de 2 ans selon un schéma vaccinal à deux injections à 2 mois d’intervalle à l’âge de 2 mois (8 semaines) et 4 mois suivies d’un rappel à l’âge de 11 mois.
Recommandations particulières :
Pour les prématurés et les nourrissons à risque élevé́ de contracter une IIP (cf. ci-dessous la liste des personnes à risques), le maintien d’un schéma vaccinal comprenant trois injections du vaccin pneumococcique conjugué 13-valent, suivies d’un rappel est recommandé́. À partir de l’âge de 2 ans, la vaccination est recommandée pour les patients à risque : a) Immunodéprimés (patients concernés par les recommandations de vaccination des immunodéprimés et patients atteints de syndrome néphrotique) :
• Aspléniques ou hypospléniques (incluant les drépanocytoses majeures) • Atteints de déficits immunitaires héréditaires
• Infectés par le VIH, quel que soit le statut immunologique
• Sous chimiothérapie pour tumeur solide ou hémopathie maligne • Transplantés ou en attente de transplantation d’organe solide • Greffés de cellules souches hématopoïétiques
• Traités par immunosuppresseur, biothérapie et/ou corticothérapie pour une maladie auto-immune ou inflammatoire chronique
• Atteints de syndrome néphrotique
avec une dose de VPC13 puis 8 semaines après une dose de VP23 si non antérieurement vaccinés.
b) Non immunodéprimés porteurs d’une maladie sous-jacente prédisposant à la survenue d’IIP :
• Cardiopathie congénitale cyanogène, insuffisance cardiaque
• Insuffisance respiratoire chronique, bronchopneumopathie obstructive, emphysème • Asthme sévère sous traitement continu
• Insuffisance rénale
• Hépatopathie chronique d’origine alcoolique ou non • Diabète non équilibré par le simple régime
• Patients présentant une brèche ostéo-méningée, un implant cochléaire ou candidats à une implantation cochléaire
avec une dose de VP23.
Pas de données existantes en 2013 pour permettre de recommander la pratique de revaccinations ultérieures.
c. En 2017 (4)
Actualisation des recommandations vaccinales en 2017 au vu des données d'une étude de grande ampleur portant sur l'efficacité du vaccin Prevenar 13 dans la prévention des pneumonies à pneumocoque chez les personnes de 65 ans et plus : l’étude CAPITA (5) est une étude randomisée en double aveugle, conduite aux Pays-Bas auprès de 85 000
personnes âgées de 65 ans et plus. Ces personnes étaient réparties en deux groupes de taille équivalente : le groupe des personnes vaccinées recevait une dose de Prevenar 13, tandis que le groupe témoin recevait un placebo. L'efficacité du vaccin Prevenar 13 a été
mesurée en comparant le nombre d’infections à pneumocoque dues à l'un des 13 sérotypes inclus dans le vaccin Prevenar 13 dans le groupe des personnes vaccinées et dans le groupe témoin. L'efficacité en terme de réduction du nombre de pneumopathies
communautaires dans le groupe des personnes vaccinées avec Prevenar 13 était de 46 %. Quand le critère d'efficacité comparait le nombre d'infections invasives à pneumocoque entre les deux groupes de personnes, l'efficacité était de 75 %.
L'efficacité du vaccin polyosidique non conjugué contre les infections invasives à pneumocoque est limitée dans le temps.
L'intérêt du vaccin polyosidique 23-valent est d'élargir la protection à d'autres sérotypes du pneumocoque que ceux qui sont inclus dans le vaccin Prevenar 13. En 2015, en analysant les sérotypes des souches de pneumocoques responsables d'infections invasives
(réseau Epibac), 58 % des pneumocoques non inclus dans le vaccin Prevenar 13 étaient couverts par le vaccin polyosidique 23-valent.
L'efficacité du vaccin polyosidique 23-valent a été montrée dans la prévention des infections invasives à pneumocoque. Cependant, l'efficacité vaccinale contre les pneumopathies dues à des pneumocoques de sérotype vaccinal, et contre les pneumopathies communautaires en général, est moins élevée.
L'immunogénicité du vaccin polyosidique non conjugué 23-valent est limitée dans le temps car les anticorps protecteurs ne sont plus détectables 2 à 6 ans après l'administration du vaccin. Ainsi, chez les personnes de 65 ans et plus, l'efficacité du vaccin sur le terrain est de 65 % deux ans après l'administration de la dose vaccinale. Au-delà de cinq ans, le vaccin ne semple plus conférer une protection. Mais les revaccinations successives avec un vaccin polyosidique non conjugué 23-valent, lorsqu'elles sont réalisées avec un intervalle court (moins de 6 mois), ne permettent pas d'augmenter la réponse immunitaire : ces
revaccinations itératives entrainent au contraire une hyporéactivité (c'est-à-dire une moindre réponse immunologique). Cette hyporéactivité disparaît avec le temps. De plus, la survenue d'effets indésirables est significativement plus fréquente en cas de revaccination dans un délai inférieur à 5 ans. Ainsi, un délai d'au moins 5 ans entre deux doses de vaccin polyosidique 23-valent est recommandé.
L'immunogénécité du vaccin Prevenar 13 est durable avec une efficacité du vaccin contre les pneumopathies à pneumocoque de sérotype vaccinal qui semble persister pendant au moins les quatre ans qui suivent la vaccination.
Mais chez les personnes vaccinées antérieurement avec le vaccin polyosidique non conjugué 23 valent, l'efficacité de Prevenar 13 est moindre si le délai entre les deux injections est court (moins d'un an). Il faut ainsi un délai d'au moins un an entre l'administration de la dose d'un vaccin 23-valent et celle du vaccin Prevenar 13 pour ne pas observer d'hyporéponse immunitaire.
Les données médico-économiques ont également été prises en compte pour choisir une stratégie coût-efficace d'utilisation des vaccins 13-valent et 23-valent chez les personnes à risque d'infection à pneumocoque.
A noter les nouvelles recommandations pour les personnes (adultes et enfants) âgées de 5 ans et plus, à risque d’une infection pneumococcique, quel que soit le niveau de risque :
• Les personnes non antérieurement vaccinées reçoivent la primo-vaccination pneumococcique par une dose de VPC13 suivie 8 semaines plus tard d’une dose de VPP23 ;
• Les personnes qui n’ont reçu antérieurement que le vaccin VPP23 pourront recevoir une injection du VPC13 si la vaccination antérieure remonte à plus de 1 an ;
l’injection ultérieure du VPP23 sera pratiquée avec un délai minimal de 5 ans par rapport à la date de l’injection du VPP23 ;
• Les personnes déjà vaccinées suivant la séquence VPC13 - VPP23 pourront recevoir une nouvelle injection du VPP23 en respectant un délai de 5 ans après la précédente injection de ce même vaccin ;
La nécessité de revaccinations ultérieures au-delà du premier rappel recommandé en 2017 devra être reconsidérée en fonction de la disponibilité des données d’efficacité de cette mesure.
2. Couverture vaccinale
La vaccination par le VPC7 a été suivie d’une baisse modérée de l’incidence des infections invasives à pneumocoque chez les enfants de moins de 2 ans ciblés par les
recommandations vaccinales, et d’une augmentation de l’incidence chez les enfants plus âgés et les adultes. La diminution, par effet indirect, des cas dus à des souches vaccinales chez les enfants de moins de 2 ans et chez les personnes de tous âges n’ayant pas été vaccinés, s’est accompagnée d’une augmentation des cas de souches non vaccinales. Ce remplacement par des souches non vaccinales a atteint tous les groupes d’âge, mais, chez les jeunes enfants, les souches vaccinales ont diminué de manière plus importante que les souches non vaccinales n’ont augmenté ; chez l’adulte, c’est l’inverse qui s’est produit. La nécessité d’une surveillance renforcée des infections à pneumocoque s’est imposée du fait de la mise à disposition du vaccin conjugué heptavalent anti-pneumococcique en 2001 en France, puis sa recommandation élargie à l’ensemble des enfants de moins de 2 ans en juin 2006, et enfin son remplacement par sa version à 13 valences en juin 2010. La
couverture vaccinale du vaccin heptavalent a augmenté progressivement. En 2008, si 75% des enfants de 6 à 12 mois avaient reçu une primo vaccination complète, seuls 60% des enfants de 16 à 24 mois avaient reçu un rappel (14). A ce jour, la couverture vaccinale chez
l’enfant du vaccin conjugué 13-valent est élevée. En 2014, 93,6% des enfants âgés de 9 mois ont reçu 2 doses de PCV13 et 89,3% des enfants de 24 mois ont reçu un schéma complet comportant deux doses et un rappel (15).
La couverture vaccinale élevée des nourrissons par le VPC13 a induit une immunité de groupe avec, en 2016, comparé à la période 2008-2009 (dernières années d’utilisation du VPC7), une réduction de l’incidence des IIP de 38% chez les personnes âgées de 15 à 64 ans et de 30% chez les personnes âgées de plus de 64 ans. L’incidence des cas dus aux souches des 7 sérotypes du VPC7 a poursuivi sa diminution entre 2008-2009 et 2016. L’incidence des cas dus aux 6 sérotypes additionnels du VPC13 a diminué dans tous les groupes d’âge (1). Chez les enfants de moins de 2 ans, l’incidence des cas dus aux 6 sérotypes additionnels du VPC13 a diminué de façon rapide et importante (15,5 cas/100 000 hab. en 2008-9 vs 1,8 cas/100 000 hab. en 2016, -88%, p < 10- 4). Chez les enfants de 2 à 14 ans, les adultes de 15 à 64 ans et ceux de plus de 65 ans, les incidences dues à ces 6 sérotypes ont diminué de 93%, 81% et 63% respectivement. L’incidence des cas dus à des souches non couvertes par le VPC13 a augmenté entre 2008-2009 et 2016 de 102% chez les enfants de moins de 2 ans, 84% chez les 2 à 4 ans, 36% chez les 5 à 14 ans, de 48% chez les adultes âgés de 15 à 64 ans et de 29% après 65 ans.
Cependant, malgré la modification observée de répartition des sérotypes au cours des IIP, du fait de l’immunité de groupe induite, l’efficacité du vaccin ne saurait être remise en cause : en 2016, comparé à la période 2008-2009 (dernières années du l’utilisation du VPC7), réduction de l’incidence des IIP de 38% chez les personnes âgées de 15 à 64 ans et de 30% chez les personnes âgées de plus de 64 ans.
Les dernières recommandations publiées par le HCSP estiment le taux de couverture vaccinale à 20%.
Les rares études menées suggèrent un taux de couverture vaccinale faible.
Une étude française rétrospective sur 6 ans, de janvier 2000 à Décembre 2005, a été menée chez les splénectomisés en reprenant les dossiers médicaux de 3 hôpitaux Parisiens (10). Leurs médecins traitants étaient contactés et devaient remplir un questionnaire. Sur les 154 patients éligibles, 70,8% avaient reçu un vaccin, 44% avaient reçu un vaccin anti
pneumococcique.
Une enquête nationale de couverture vaccinale a été menée en janvier 2011, en France afin d’évaluer la couverture vaccinale contre la grippe saisonnière dans les groupes cibles et mesurer l’efficacité vaccinale ; ainsi que la couverture vaccinale par les vaccins diphtérie-tétanos-poliomyélite (dTP) et antipneumococcique chez les personnes âgées de 65 ans et plus (16).
C’était une enquête téléphonique par sondage aléatoire simple à deux degrés, menée en population générale en janvier 2011. La base de sondage était constituée de 70 000 numéros téléphoniques potentiellement attribués à un utilisateur. Les interviews ont été réalisées en utilisant un système d’entretiens téléphoniques assistés par ordinateurs
(système CATI). Au total, 1 083 personnes ont été incluses. Parmi les personnes âgées de 65 ans et plus, 44 % étaient à jour de leur rappel décennal dTP et 4,8 % déclaraient être
vaccinales contre la grippe étaient de 71,0 % chez les personnes de 65 ans et plus avec pathologie sous-jacente, de 57,8 % chez les personnes de 65 ans et plus sans pathologie jacente, de 46,6 % chez les personnes âgées de moins de 65 ans avec pathologie sous-jacente et de 27,6 % chez les professionnels de santé.
Par ailleurs, l’APHP publie chaque année un rapport concernant la prévention des infections nosocomiales en recueillant et analysant ses indicateurs de prévention des infections nosocomiales.
Depuis 2008, l’APHP évalue la politique de vaccination des patients de SLD contre la grippe et le pneumocoque.
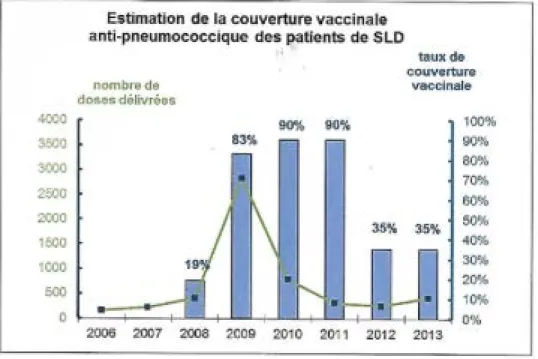
Concernant l’analyse de 2013 et la vaccination anti pneumococcique (17) :
La méthode d’estimation consistait à rapporter le nombre de vaccinations effectuées au cours des 3 dernières années au nombre de patients présents en 2013, en faisant l’hypothèse que les patients restent en moyenne 3 ans dans les services de SLD (dans la réalité, la durée moyenne de séjour en SLD est variable d’un site à l’autre : entre 1 an et demi et 5 ans).
Entre 200 et 400 patients de SLD étaient vaccinés chaque année de 2006 à 2008. En juin 2009, en prévision de l’épidémie de grippe, le CLIN central a recommandé de vacciner contre le pneumocoque l’ensemble des patients hospitalisés en SLD, en prévention de
complications de la grippe. 2833 patients ont été vaccinés en 2009 et 785 en 2010, dans les 18 hôpitaux concernés.
A partir de 2011, le nombre de vaccinations annuelles s’élèvent à 317 en 2011 et 257 en 2012. En 2013, le CLIN central a à nouveau recommandé de vacciner contre le pneumocoque l’ensemble des patients de SLD. 422 vaccinations ont été comptabilisées en 2013. Les
résultats sont présentés dans la figure 5.
Fig 5. Estimation de la couverture vaccinale anti pneumococcique des patients en SLD à l’APHP de 2006 à 2013
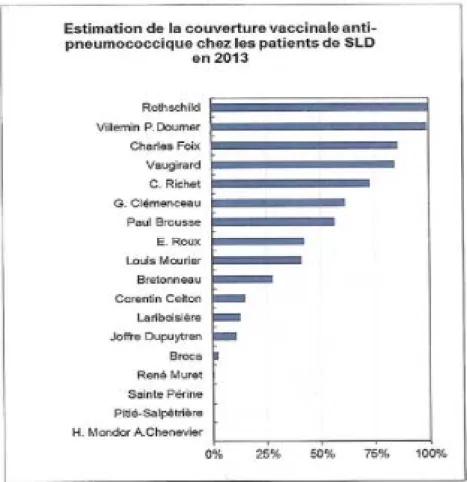
La couverture vaccinale des patients en SLD est estimée à 35% en 2013. Dans 7 hôpitaux sur 16, la couverture vaccinale des patients en SLD est estimée à plus de 50% (figure 6).
Fig 6 Estimation de la couverture vaccinale anti pneumococcique des patients en SLD à l’APHP en 2013, par hôpital
Concernant l’analyse de 2016 (18), le nombre de patients à jour de leur vaccination est connu dans 12 sur 16 hôpitaux : 81% de patients vaccinés soit 1413 patients (figure 7).
Fig 7. Taux de vaccinations des patients en SLD à l’APHP de 2014 à 2017
Le taux de vaccination des patients en SLD par hôpital est présenté dans la figure 8.
Deuxième partie : Matériel et Méthodes
I.
Principe de l’étude
1. Objectif de l’étude
Les infections à pneumocoque sont fréquentes avec une morbi mortalité importante dans les groupes à risque et pourtant il semblerait que la couverture vaccinale soit faible. L’objectif de cette étude est d’évaluer l’application des recommandations vaccinales anti pneumococcique chez l’adulte, par le taux vaccinal, chez les patients non immunodéprimés à risque et les patients VIH positif, en médecine de ville.
Il s’agit d’une étude épidémiologique, rétrospective avec un recrutement en France en médecine ambulatoire via la base de données GERS Patient Data, CEGEDIM®, via le codage CIM 10 et la prescription d’un vaccin anti pneumococcique.
Il était prévu initialement de comparer sur 2 périodes : après l’actualisation des
recommandations de 2013, période de 4 ans divisée en 4 tranches annuelles ; et après l’actualisation des recommandations de 2017, période d’un an. Mais concernant
l’actualisation des recommandations en 2017, nous n’avions pas assez de recul pour avoir des données sur cette période. Nous analyserons donc les données à partir des
recommandations de 2013 jusqu’à l’actualisation de 2017 avec une période contrôle : année précédant l’actualisation des recommandations de 2013.
Nous étudierons 4 populations de patients : • BPCO
• Diabète
• Insuffisance cardiaque • VIH
Critère de jugement principal :
Nous analyserons le pourcentage de patients vaccinés dans les différentes populations toute période confondue pendant la période d’analyse d’avril 2013 à avril 2017, en comparaison à la période contrôle de mars 2012 à mars 2013 :
Avec le pourcentage de patients avec une prescription et/ou remboursement d’un vaccin anti-pneumococcique après la date minimum de diagnostic enregistrée :
- Pneumo 23 : J07AL01 - Pneumovax : J07AL01 - Prevenar 13 : J07AL02
En considérant qu’un remboursement s’applique à une prescription si la différence entre la date de délivrance en pharmacie et la date de prescription était inférieure à 6 mois (afin d’éviter les doublons).
Et, nous regarderons s’il y a une différence du taux vaccinal entre population sur la période d’analyse.
Critères de jugement secondaires :
Nous analyserons également s’il y a une évolution année après année du pourcentage de patients vaccinés en comparant les périodes :
- Sur une période de 1 an : pour le groupe contrôle c’est-à-dire la population primo diagnostiquée de 2012 : 2012-2013 ; pour le groupe d’analyse : pour la population primo diagnostiquée en 2013 : 2013-2014, pour la population primo diagnostiquée en 2014 : 2014-2015, pour la population primo diagnostiquée en 2015 : 2015-2016, pour la population primo diagnostiquée en 2016 : 2016-2017
- Sur une période de 2 ans : pour le groupe contrôle c’est-à-dire la population primo diagnostiquée de 2012 : 2012-2014 ; pour le groupe d’analyse : pour la population primo diagnostiquée en 2013 : 2013-2015, pour la population primo diagnostiquée en 2014 : 2014-2016, pour la population primo diagnostiquée en 2015 : 2015-2017 - Sur une période de 3 ans : pour le groupe contrôle c’est-à-dire la population primo diagnostiquée de 2012 : 2012-2015 ; pour le groupe d’analyse : pour la population primo diagnostiquée en 2013 : 2013-2016, pour la population primo diagnostiquée en 2014 : 2014-2017.
- Sur une période de 4 ans : pour le groupe contrôle c’est-à-dire la population primo diagnostiquée de 2012 : 2012-2016 ; pour le groupe d’analyse : pour la population primo diagnostiquée en 2013 : 2013-2017
Ce qui nous permettra d’évaluer s’il y a une certaine latence chez les médecins pour
appliquer les recommandations, avec donc année après année un pourcentage de vaccinés probablement croissant par période.
Enfin, nous regarderons pour les patients vaccinés si le schéma vaccinal est respecté : - Pour les BPCO, insuffisants cardiaques et diabétiques : une dose de VPP23 - Pour les VIH : une dose de VP13 puis à 8 semaines VPP23
Pour les patients vaccinés : nous regarderons le % de patients vaccinés par médecin afin de savoir si ce sont toujours les mêmes médecins qui prescrivent, et l’âge du médecin.
2. Description de la base de données
Les données proviennent des dossiers patients informatisés des 2000 médecins généralistes et 1000 spécialistes libéraux équipés du logiciel de gestion de cabinet Crossway® (CEGEDIM) et participant à l’observatoire. La seule obligation est d’associer un diagnostic à toute prescription avec le code CIM-10. Les tables de données anonymisées (pour le patient et pour le médecin) recueillies par télétransmission automatique quotidienne sont présentées dans le tableau 2. Les données recueillies sont donc des données en vie réelle de la pratique de médecine de ville.
Les données de remboursement de la sécurité sociale ont été intégrées progressivement à partir de 2012 dans la base.
Tableau 2. Types de données disponibles dans la base Gers PatientData
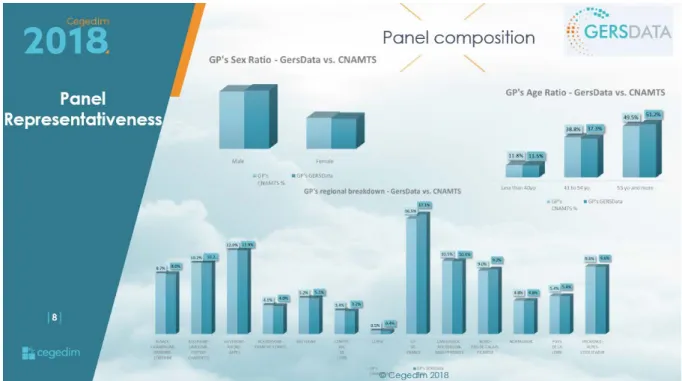
Les médecins généralistes de la base de données semblent équivalents en termes d’âge, de sexe et de répartition géographique aux médecins recensés par la CNAMTS (Fig 9)
1. Les données démographiques : date de naissance, sexe, département d’habitation, statut social et marital
2. Les antécédents et allergies 3. Le motif de consultation
4. Les symptômes/diagnostics avec leur code CIM 10 5. Les examens complémentaires prescrits
6. Les résultats de certains examens complémentaires (lorsque le laboratoire dispose d’un logiciel compatible avec la norme H.PR.IM et que le médecin décide d’importer les données, ou lorsque le médecin rentre les données manuellement)
7. Les traitements prescrits avec pour chaque médicament le motif de la prescription 8. Les examens complémentaires remboursés
9. Les traitements remboursés au patient 10. Les hospitalisations : GHS et dates
Fig 9. Caractéristiques Médecins Généralistes GERS Patient Data, CEGEDIM® vs CNAMTS
Chaque mois 1700 MG sont sélectionnés afin d’avoir une cohorte représentative de la population de MG française (en termes d’âge, de sexe et de localisation géographique). Ceci permet de s’assurer de la représentativité des échantillons.
3. Critères d’inclusion et d’exclusion
Notre étude se déroulera sur deux périodes :• Une période contrôle : de mars 2012 à mars 2013, avant l’actualisation des recommandations de 2013
• Une période d’analyse : d’avril 2013 à avril 2017 Critères d’inclusion :
On sélectionne les patients :
• Avec une date de diagnostic sur la période de contrôle ou d’analyse : cas incidents dans l’année
• Qui consultent chez le médecin généraliste • Avec un historique de remboursement
• Suivis au moins un an avant et un an après, afin de ne garder que les patients suivis de façon régulière et ainsi s’assurer au maximum d’une exhaustivité des données • Adultes (>= 18 ans)
• Identifiés dans la base de données par les diagnostics, les antécédents personnels et/ou la prescription de traitements des pathologies étudiées
Et les populations :
• Pour le groupe BPCO :
- via les codes CIM 10 : J41, J42 et J43,en ATCD et/ou diagnostic et/ou via les traitements suivants :
Beta 2 mimétiques longue durée (Formotérol : R03AC13, Salmétérol : R03AC12, Indacacétérol : R03AC18, Bambutérol : R03CC12, Olodatérol : R03AC19)
Anticholinergique longue durée (Tiotropium : R03BB04, Bromure d’umeclidinium : R03BB07, Glycopyrronium Bromure : R03BB06)
Association CSI avec B2LA ou Anti cholinergique (Formoterol + Budésonide : R03AK07/R03AK08 ou Fluticasone + Salmétérol : R03AK06/R03AK10 ou Vilantérol + Bromure d’umeclidinium : R03AL03 ou Indacaterol + Bromure de glycopyrronium : R03CC12 ou Vilantérol + Furoate de Fluticasone : R03AK10, Olodatérol + Bromure de Tiotropium : R03AL06)
Téophylline : R03DA04
Beta 2 mimétiques de courte durée (Terbutaline : R03CC03)
- avec exclusion des patients qui combinent les deux paramètres suivants : Prescription/ remboursement d’un des traitements du périmètre défini Diagnostic et ou antécédent d’asthme
Ce qui nous permet d’inclure les patients BPCO uniquement traités par Beta 2 de courte durée d’action et d’exclure les patients asthmatiques inclus par erreur dans cette population
• Pour les diabétiques : via les codes CIM 10 : E10 à E14 en ATCD et/ou en diagnostic, exclusion des patients non traités puisqu’il n’existe pas de recommandations vaccinales pour eux.
• Pour le groupe insuffisants cardiaques : via le code CIM 10 : I50 en ATCD et/ou en diagnostic, la notion de traitement étant non spécifique de la pathologie (identiques par exemple chez les patients hypertendus), elle n’est pas prise en compte pour inclure les patients
• Pour les patients VIH : via les codes CIM 10 : B20 à B24 en ATCD et/ou diagnostic et/ou via les traitements suivants :
INTI : J05C1 (en retirant les monothérapies de 3TC, lamivudine et de TDF qui correspondent aux traitements pour les patients porteurs de VHB)
IP : J05C2 INNTI : J05C3
Inhibiteur entrée VIH : J05C4
Antiviraux VIH anti intégrase : J05C5 Antiviraux VIH autres : J05C9
Critères d’exclusion :
• Un patient ne peut être que dans un seul groupe : s’il a plusieurs pathologies constituant une indication à une vaccination anti pneumoccocique, inclusion dans celui de la première pathologie diagnostiquée sur la période d’analyse sauf pour le VIH qui prime sur les autres pathologies
• Patients déjà vaccinés avant la date minimum de diagnostic
• Patients repérés uniquement par le traitement remboursé sont exclus de l’analyse car considérés comme n’ayant pas prévenu leur médecin traitant de leur pathologie La sélection des médecins se fait sur l’échantillon de médecins généralistes représentatifs et qui sont présents sur l’ensemble de la période.
II.
Analyse statistique
Pour le critère de jugement principal, les analyses statistiques réalisées comparent les pourcentages de patients vaccinés entre la période contrôle et la période d’analyse pour chaque population et entre les populations pour la période d’analyse.
Une autre analyse statistique sera réalisée pour le critère de jugement secondaire par périodes en réalisant une comparaison de la proportion de patients vaccinés entre les groupes toutes populations confondues par année de suivi après le diagnostic.
L’analyse statistique est réalisée par le test du Khi 2. Le niveau de significativité sera atteint avec un p ≤ 0,05.
Troisième partie : Résultats
I.
Populations
1. BPCO
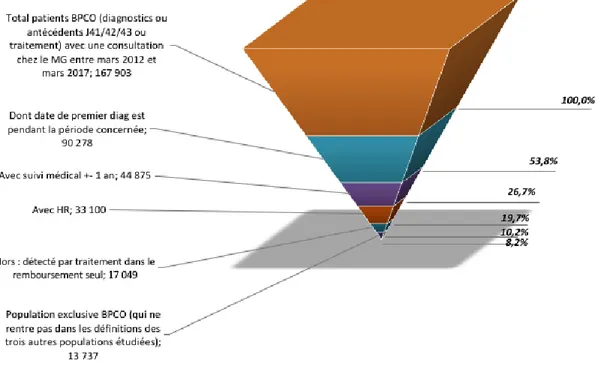
Pour la population des patients BPCO, 167903 patients sont identifiés via les codes CIM 10 : J41,J42,J43 en ATCD et/ou diagnostic et/ou via les traitements prédéfinis ayant consulté chez le médecin généraliste sur la période entre mars 2012 à avril 2017, dont 90278 sont des primo diagnostiqués sur la période concernée, dont 44875 ont bénéficié d’un suivi médical à plus ou moins 1 an, dont 33100 avec historique de remboursement dont 17049 après
exclusion des patients repérés via les historiques de remboursements seuls, dont 13737 en population exclusive. La sélection des patients est représentée dans la figure 10.
13737 (8,2%) patients BPCO sont inclus au total avec 2821 patients dans la période contrôle de mars 2012 à mars 2013 et 10916 dans la période d’analyse d’avril 2013 à avril 2017.
2. Diabète
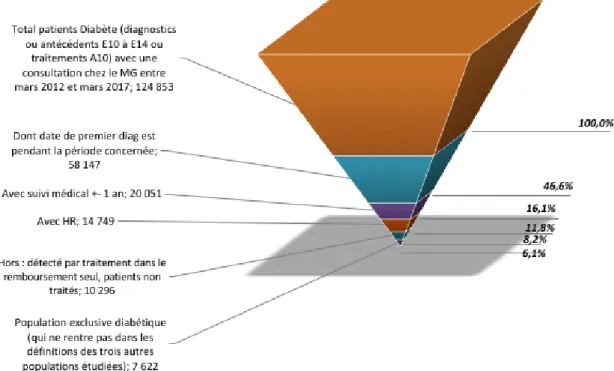
Pour la population des patients diabétiques, 124853 patients sont identifiés via les codes CIM 10 : E10 à E14 en ATCD et/ou diagnostic et/ou via les traitements antidiabétiques ayant consulté chez le médecin généraliste sur la période entre mars 2012 à avril 2017, dont 58147 sont des primo diagnostiqués sur la période concernée, dont 20051 ont bénéficié d’un suivi médical à plus ou moins 1 an, dont 14749 avec historique de remboursement dont 10296 après exclusion des patients repérés via les historiques de remboursements seuls ou non traités, dont 7622 en population exclusive. La sélection des patients est représentée dans la figure 11.
7622 (6,1%) patients diabétiques sont inclus au total avec 1628 patients dans la période contrôle de mars 2012 à mars 2013 et 5994 dans la période d’analyse d’avril 2013 à avril 2017.
3. Insuffisance cardiaque
Pour la population des patients insuffisants cardiaques, 17581 patients sont identifiés via les codes CIM 10 : I50 en ATCD et/ou diagnostic ayant consulté chez le médecin généraliste sur la période entre mars 2012 à avril 2017, dont 6666 sont des primo diagnostiqués sur la période concernée, dont 3269 ont bénéficié d’un suivi médical à plus ou moins 1 an, dont 2030 avec historique de remboursement, dont 816 en population exclusive. La sélection des patients est représentée dans la figure 12.
816 (4,6%) patients insuffisants cardiaques sont inclus au total avec 143 patients dans la période contrôle de mars 2012 à mars 2013 et 673 dans la période d’analyse d’avril 2013 à avril 2017.
4. VIH
Pour la population des patients VIH, 5264 patients sont identifiés via les codes CIM 10 : B20 à B24 en ATCD et/ou diagnostic et/ou via les traitements antirétroviraux prédéfinis ayant consulté chez le médecin généraliste sur la période entre mars 2012 à avril 2017, dont 3225 sont des primo diagnostiqués sur la période concernée, dont 883 ont bénéficié d’un suivi médical à plus ou moins 1 an, dont 733 avec historique de remboursement dont 380 après exclusion des patients repérés via les historiques de remboursements seuls. La sélection des patients est représentée dans la figure 13.
380 (7,2%) patients VIH sont inclus au total avec 98 patients dans la période contrôle de mars 2012 à mars 2013 et 282 dans la période d’analyse d’avril 2013 à avril 2017.
5. Caractéristiques des patients
Les caractéristiques démographiques des patients sont résumées dans les tableaux 3,4 et 5. Entre le groupe contrôle et le groupe d’analyse, il y a une majorité de femmes en terme de population générale : 51,1 % dans le groupe contrôle et 51,3 % dans le groupe d’analyse. Au sein de chaque population, il y avait dans le groupe contrôle : 55,9 % femmes BPCO, 43,4 % femmes diabétiques, 49 % femmes insuffisantes cardiaques et 42,9 % de femmes VIH et dans le groupe d’analyse : 56,7% femmes BPCO, 42,5 % femmes diabétiques, 50,7 % femmes insuffisantes cardiaques et 34,2 % de femmes VIH.
L’âge moyen dans le groupe contrôle : chez les BPCO est de 53,3 ans (écart type 15,7), chez les diabétiques 59,4 ans (écart type 12,7), chez les insuffisants cardiaques de 74,2 ans (écart type 11,9) et chez les VIH de 44,7 ans (écart type 12) et dans le groupe d’analyse : chez les BPCO est de 54,1 ans (écart type 16,1), chez les diabétiques 59 ans (écart type de 13,3), chez les insuffisants cardiaques de 75,7 ans (écart type 13,5) et chez les VIH de 44,7 ans (écart type 12,3). Toutes périodes confondues, la population la plus âgée en moyenne est la population « insuffisant cardiaque » et la plus jeune est la population « VIH ».
Tableau 4. Caractéristiques des patients sur la période d’analyse : âge et genre
La durée de suivi des patients en moyenne est supérieure à 10 ans sur la période contrôle ainsi que sur la période d’analyse quelle que soit la population.
II.
Critère de jugement principal
Le nombre de patients vaccinés après la date minimum de diagnostic dans les différentes populations pendant la période contrôle de mars 2012 à mars 2013 et la période d’analyse d’avril 2013 à avril 2017 toutes périodes confondues est représenté dans le tableau 6.
Tableau 6. Patients vaccinés par population après la date minimum de diagnostic pendant la période contrôle et la période d’analyse
Pour la population totale (fig 14) :
- Sur la période contrôle : 267 (6%) des 4690 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
- Sur la période d’analyse, 756 (4%) des 17865 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
Fig 14. Patients vaccinés dans la population totale pendant la période contrôle et la période d’analyse
La différence entre la période contrôle et la période d’analyse est significative avec p=2.229e-05 (IC 95% [0,007;0,022]).
Pour la population BPCO (fig 15) :
- Sur la période contrôle : 213 (7%) des 2821 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
- Sur la période d’analyse, 598 (5%) des 10916 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
Fig 15. Patients vaccinés dans la population BPCO pendant la période contrôle et la période d’analyse
La différence entre la période contrôle et la période d’analyse pour la population BPCO est significative avec p=3.821e-05 (IC 95% [0,010;0,031]).
Pour la population Diabète (fig 16) :
- Sur la période contrôle : 28 (2%) des 1628 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
- Sur la période d’analyse, 95 (2%) des 5994 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
Fig 16. Patients vaccinés dans la population Diabète pendant la période contrôle et la période d’analyse
La différence entre la période contrôle et la période d’analyse pour la population Diabète n’est pas significative avec p=0,7853 (IC 95% [-0,006;0,009]).
Pour la population Insuffisant Cardiaque (fig 17) :
- Sur la période contrôle : 10 (7%) des 143 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
- Sur la période d’analyse, 28 (4%) des 673 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
Fig 17. Patients vaccinés dans la population Insuffisance cardiaque pendant la période contrôle et la période d’analyse
La différence entre la période contrôle et la période d’analyse pour la population Insuffisance Cardiaque n’est pas significative avec p=0,2145 (IC 95% [-0,020;0,077]). Pour la population VIH (fig 18) :
- Sur la période contrôle : 16 (16%) des 98 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
- Sur la période d’analyse, 35 (12%) des 282 patients inclus ont eu au moins un évènement de vaccination après la date minimum de diagnostic.
Fig 18. Patients vaccinés dans la population VIH pendant la période contrôle et la période d’analyse
La différence entre la période contrôle et la période d’analyse pour la population VIH n’est pas significative avec p=0,4194 (IC 95% [-0,050;0,124]).
Sur la période d’analyse, 5% des patients BPCO, 2% des patients diabétiques, 4% des patients insuffisants cardiaques et 12% des patients VIH ont eu au moins un évènement de vaccination, p= 2.2e-16. La différence entre la population VIH et les autres est significative, p= 1.713e-11 (IC 95% [0,0427 ; 0,123]) ; ainsi que la différence entre la population Diabète et les autres p= < 2.2e-16 (IC 95% [-0,045; - 0,034]).
III.
Critères de jugement secondaires
1. Par période
La proportion de patients vaccinés en fonction des années suivant le diagnostic sur la population totale à vacciner en comparant par période de temps équivalente est représentée dans la figure 19.
Fig 19. Proportion de patients vaccinés en fonction des années suivant le diagnostic Les résultats sont en pourcentage de patients vaccinés sur la population totale à vacciner pour chaque groupe. Pour le groupe contrôle la population totale à vacciner toutes périodes confondues est de 4690 patients et pour le groupe d’analyse : pour les primo diagnostiqués de 2013/2014 : 4709, de 2014/2015 : 4660, de 2015/2016 : 4689 et 2016/2017 : 3807.
- Sur une période de 1 an après le diagnostic :
pour le groupe contrôle : 80 (1,7%) sont vaccinés dans l’année 1 pour le groupe d’analyse :
o 2013-2014 : 96 (2%) sont vaccinés dans l’année 1 o 2014-2015 : 80 (1,7%) sont vaccinés dans l’année 1 o 2015-2016 : 107 (2,3%) sont vaccinés dans l’année 1 o 2016-2017 : 89 (2,3%) sont vaccinés dans l’année 1
pour le groupe contrôle : 127 (2,7%) sont vaccinés dans l’année 1+2 avec 1% dans l’année 2
pour le groupe d’analyse :
o 2013-2015 : 142 (3%) sont vaccinés dans l’année 1+2 avec 1% dans l’année 2
o 2014-2016 : 136 (2,9%) sont vaccinés dans l’année 1+2 avec 1,2 % dans l’année 2
o 2015-2017 : 171 (3,6%) sont vaccinés dans l’année 1+2 avec 1,3 % dans l’année 2
La différence entre ces proportions n’est pas significative avec p=0,06827. - Sur une période de 3 ans après le diagnostic :
pour le groupe contrôle : 163 (3,5%) sont vaccinés dans l’année 1+2+3 avec 0,8 % dans l’année 3
pour le groupe d’analyse :
o 2013-2016 : 187 (4%) sont vaccinés dans l’année 1+2+3 avec 1% dans l’année 3
o 2014-2017 : 179 (3,8%) sont vaccinés dans l’année 1+2+3 avec 0,9% dans l’année 3
La différence entre ces proportions n’est pas significative avec p=0,4699. - Sur une période de 4 ans après le diagnostic :
pour le groupe contrôle : 221 (4,7%) sont vaccinés dans l’année 1+2+3+4 avec 1,2 % dans l’année 4
pour le groupe d’analyse :
o 2013-2017 : 228 (4,8%) sont vaccinés dans l’année 1+2+3+4 avec 0,8% dans l’année 4
2. Schéma vaccinal
Au sein de la population vaccinée, nous avons regardé dans chaque population pour le groupe contrôle et le groupe d’analyse quel schéma vaccinal a été fait.
Pour le groupe BPCO :
- Groupe contrôle : 152 (71,4%) patients vaccinés ont reçu une vaccination par Pneumo23 ou Pneumovax, 18 (8,5%) par Prevenar 13, 37 (17,3%) par Pneumo23 ou Pneumovax + Prevenar 13 et 6 (2,8%) patients ont reçu un autre schéma (c’est-à-dire plusieurs injections d’un même produit associées ou non avec un autre vaccin) - Groupe d’analyse : 339 (56,7%) patients vaccinés ont reçu une vaccination par
Pneumo23 ou Pneumovax, 92 (15,4%) par Prevenar 13, 141 (23,6%) par Pneumo23 ou Pneumovax + Prevenar 13 et 26 (4,3%) patients ont reçu un autre schéma. Pour le groupe Diabète :
- Groupe contrôle : 18 (64,2%) patients vaccinés ont reçu une vaccination par Pneumo23 ou Pneumovax, 3 (10,7%) par Prevenar 13, 6 (21,5%) par Pneumo23 ou Pneumovax + Prevenar 13 et 1 (3,6%) patients ont reçu un autre schéma.
- Groupe d’analyse : 53 (55,8%) patients vaccinés ont reçu une vaccination par
Pneumo23 ou Pneumovax, 15 (15,8%) par Prevenar 13, 26 (27,4%) par Pneumo23 ou Pneumovax + Prevenar 13 et 1 (1,1%) patients ont reçu un autre schéma.
Pour le groupe Insuffisance Cardiaque :
- Groupe contrôle : 8 (80%) patients vaccinés ont reçu une vaccination par Pneumo23 ou Pneumovax, 0 (0%) par Prevenar 13, 2 (20%) par Pneumo23 ou Pneumovax + Prevenar 13 et 0 (0%) patients ont reçu un autre schéma.
- Groupe d’analyse : 18 (64,3%) patients vaccinés ont reçu une vaccination par Pneumo23 ou Pneumovax, 4 (14,3%) par Prevenar 13, 3 (10,7%) par Pneumo23 ou Pneumovax + Prevenar 13 et 3 (10,7%) patients ont reçu un autre schéma.
Pour le groupe VIH :
- Groupe contrôle : 3 (18,8%) patients vaccinés ont reçu une vaccination par Pneumo23 ou Pneumovax, 4 (25%) par Prevenar 13, 9 (56,3%) par Pneumo23 ou Pneumovax + Prevenar 13 et 0 (0%) patients ont reçu un autre schéma.
- Groupe d’analyse : 8 (22,9%) patients vaccinés ont reçu une vaccination par
Pneumo23 ou Pneumovax, 10 (28,6%) par Prevenar 13, 16 (45,7%) par Pneumo23 ou Pneumovax + Prevenar 13 et 1 (2,9%) patients ont reçu un autre schéma.
3. Caractéristiques des médecins
71,1% des médecins qui vaccinent ont vacciné ≤ 2 patients. Leur moyenne d’âge est de 58,1 ans avec un écart type de 8,5 ans.
Quatrième Partie : Discussion
La couverture vaccinale anti pneumococcique toute population confondue (BPCO, Diabète, Insuffisance Cardiaque et VIH) dans notre étude semble faible avec 6% des patients vaccinés sur les primo diagnostiqués pendant la période contrôle et 4% des patients vaccinés sur les primo diagnostiqués pendant la période d’analyse.
Par population, le taux vaccinal n’est pas plus élevé avec
- pour les BPCO : sur les patients primo diagnostiqués pendant la période contrôle : 7% des patients ont été vaccinés contre 5% chez les primo diagnostiqués sur la période d’analyse
- pour les diabétiques : seulement 2% des patients ont été vaccinés quelque que soit leur période de primo diagnostic
- pour les insuffisants cardiaques : sur les patients primo diagnostiqués pendant la période contrôle : 7% des patients ont été vaccinés contre 4% chez les primo diagnostiqués sur la période d’analyse
- pour les VIH : sur les patients primo diagnostiqués pendant la période contrôle : 16% des patients ont été vaccinés contre 12% chez les primo diagnostiqués sur la période d’analyse
Les différences sont significatives seulement toute population confondue et pour les BPCO entre le groupe contrôle et le groupe d’analyse (respectivement p=2.229e-05 et p=3.821e-05), dans le sens d’une diminution du taux vaccinal après les recommandations. Mais, cette différence n’a finalement aucune pertinence clinique car ce sont des effectifs majeurs avec des micro variations qui créent des résultats significatifs.
Finalement, certaines populations sont plus ou moins sensibles aux recommandations. Les moins bien vaccinés de manière significative sur la période d’analyse par rapport aux autres populations (p= < 2.2e-16 (IC 95% [-0,045; - 0,034]), sont les patients diabétiques. En effet, peut-être est-ce parce qu’avant 2013 les patients diabétiques adultes n’avaient pas leur place au sein des recommandations.
Le meilleur taux vaccinal, avec une différence significative p= 1.713e-11 (IC 95% [0,0427 ; 0,123]), à l’inverse est retrouvé chez les patients VIH : est-ce parce qu’ils ont toujours été ciblés par les recommandations, reconnus comme patients plus fragiles et donc avec un meilleur suivi ? Mais, leur effectif est également le plus petit.
De nombreux pays recommandaient la vaccination par le VPP23 à partir de l’âge de 65 ans à l’instar des Etats-Unis (19) et du Royaume Uni (20) comme la Belgique (21), l’Espagne (22), la Grèce (23). L’Autriche (24) le recommande à partir de 50 ans, l’Italie (25) à des âges
différents suivant les provinces. Le Portugal (26) comme la France ne recommande pas la vaccination des personnes âgées.
La couverture vaccinale semble être dans d’autres pays également insuffisante :
- En Belgique (21) : Il est recommandé pour les personnes à risque accru d’infection pneumococcique de 19 à 75 ans : 1 dose de VPC13 puis à 8 semaines 1 dose de VPP23 avec une revaccination tous les 5 ans ; chez les patients âgés de 50 à 75 ans