ScienceDirect
www.sciencedirect.com
Nutritioncliniqueetmétabolismexxx(2014)xxx–xxx
Développement
professionnel
continu
Comment
gérer
la
nutrition
artificielle
chez
un
patient
diabétique
?
Management
of
artificial
nutrition
in
diabetic
patients
Nicolas
Paquot
a,∗,
Jenny
DeFlines
a,
Jean-Charles
Preiser
baServicedediabétologie,nutritionetmaladiesmétaboliques,CHUSart-Tilman,4000Liège1,Belgique bDépartementdesoinsintensifs,hôpitalErasme,808,routedeLennik,1070Bruxelles,Belgique
Résumé
Le développementd’unehyperglycémiechez despatientsqui bénéficientd’unenutrition entéraleou parentéralereprésente un problème importantenraisondesahauteprévalenceetdesesconséquencesentermesdemorbi-mortalité.Cependant,lapriseenchargedudiabèteoud’une hyperglycémiedestresslorsd’unenutritionartificielleconstitueundomainemalconnu,enparticulierchezlepatientnonagressé.Lesindications delanutritionartificielleetlesvoiesd’accèsnediffèrentpaschezlespatientsdiabétiquesouavechyperglycémiedestressparrapportàunpatient nondiabétique.L’utilisationd’uneformulationentéralespécifiqueaupatientdiabétiquenesejustifiepasactuellement.Lesobjectifsglycémiques doiventêtreindividualisés.Uneglycémiepréprandialeentre100et140mg/dL(5,5et7,8mmol/L)etpostprandialeentre140et180mg/dL(7,8et 10mmol/L)apparaissentcommedesobjectifsraisonnables.Uncontrôlerégulierdelaglycémiecapillaireestindispensable.L’insulineconstitue letraitementdechoixpourtraiterl’hyperglycémieetonrecommanded’adapterladuréed’actionthéoriquedel’insulineàlapréparationnutritive. Lapriseenchargedecespatientsnécessitelesupportd’uneéquipemultidisciplinaireexpérimentée.
©2014Publi´eparElsevierMassonSAS.
Motsclés:Diabète;Hyperglycémiedestress;Nutritionentérale;Nutritionparentérale;Patientnonagressé
Abstract
Hyperglycaemiainpatientsreceivingenteralorparenteralnutritionisamajorproblemduetoitshighprevalenceandpossibleconsequencesin termsofmorbidityandmortality.However,themanagementofdiabetes/stresshyperglycaemiaduringartificialnutritionremainslargelyunknown, especiallyinnon-criticallyillpatients.Theindicationsandaccessroutesforartificialnutritionarenotdifferentinpatientswithdiabetes/stress diabetesthaninnon-diabetics.Wedonotrecommendusingenteralformulasdesignedforpatientswithdiabetes.Theglycaemicobjectivemust beindividualized.Werecommendapreprandialbloodglucoselevelsbetween100and140mg/dL(5.5and7.8mmol/L)andpostprandiallevels between140and180mg/dL(7.8and10mmol/L).Afrequentmonitoringofcapillaryglycaemiasismandatory.Thebestdrugtreatmentfortreating hyperglycaemia/diabetesisinsulinandwerecommendtoadaptthetheoreticalinsulinactiontothenutritioninfusionregimen.Themanagement ofthesepatientsneedsthehelpofamultidisciplinaryexperimentedstaff.
©2014PublishedbyElsevierMassonSAS.
Keywords:Diabetes;Stresshyperglycaemia;Enteralnutrition;Parenteralnutrition;Non-criticallyillpatients
1. Introduction
La nutrition artificielle chez des patients diabétiques ou quiprésentent unehyperglycémie destress constitueunsujet
∗Auteurcorrespondant.
Adressee-mail:nicolas.paquot@ulg.ac.be(N.Paquot).
important en nutrition clinique pour différentesraisons. Tout d’abord, la prévalence de l’hyperglycémie chez des patients hospitalisésquibénéficientd’unsupportnutritionnelest extrê-mementélevéeetatteint,selonunrelevérécenteffectuédans 126hôpitauxauxÉtats-Unis(glycémiesupérieureà180mg/dL, 10mmol/L),46%danslesunitésdesoinsintensifset32%en dehorsdecesunités[1].Ensuite,l’hyperglycémieestassociéeà unpronosticpéjoratif,tantchezlespatientsdiabétiquesquenon http://dx.doi.org/10.1016/j.nupar.2014.05.003
diabétiques[2].Plusieursétudesontétémenéesauxsoins inten-sifsafindedéterminersiuncontrôleprécisetàdesvaleursbasses de la glycémie influenc¸aient le pronostic des patients, mais lesrésultatscontinuentàfairel’objetdecontroverses[3–5].Il semblequeleseffetsdélétèresassociésàl’hyperglycémiesoient atténuéschezlepatientdiabétique[6,7].Enfin,ledomainedela nutritionartificiellechezlepatientdiabétiqueouavec hypergly-cémiedestressresteengrandepartiemalconnuetnécessiterait laréalisationd’étudescomplémentaires,enparticulier chezle patientendehorsdessoinsintensifs.
Récemment, différentes sociétés scientifiques ont proposé desrecommandationspourlapriseenchargedel’hyperglycémie aucoursd’unenutritionartificiellechezdespatientsdiabétiques ounon[8–13].Ilestànoterd’embléequeleniveaudepreuvesde cesrecommandationsestdansl’ensembleassezfaible, témoi-gnantdu manquededonnées objectivesfaceàcettesituation cliniquepourtantfréquente.Deplus,laplupartdestravauxne font pas la distinction entre des patients diabétiques et ceux avecunehyperglycémie destress,demêmequ’entrepatients agresséshospitalisésauxsoinsintensifsetpatientsnonagressés séjournanten dehorsdecesunités. Danscette rubrique,nous nous proposons de synthétiser les recommandations les plus récentesconcernantlagestiondelanutritionartificielle(entérale etparentérale)chezlepatientdiabétiqueouavechyperglycémie destress,ensefocalisantprincipalementsurlepatient diabé-tique non agressé,hospitaliséen dehors duservice des soins intensifs.
2. Prévalencedudiabèteetdel’hyperglycémiechezdes patientshospitalisésrecevantunealimentation
artificielleetconséquences
Lenombredediabétiquesdanslemondeestestimé actuel-lement à près de 250millions et ce chiffre pourrait être de 380millions d’ici dix ans environ. Le vieillissement de la populationainsiquelemodedevieactuelle(sédentarité, modi-fications de l’apport alimentaire) et des facteurs génétiques expliquentcetteévolutionquasiépidémique[14,15].Onestime que15à25%despatientsadmisàl’hôpitalsontdiabétiques.La prévalencedudiabèteestencoreplusimportantechezlessujets âgésetquirésidenteninstitutionoùprèsd’untiersdespatients âgésde65–75ansprésentent undiabète,se chiffre atteignant 40%chezlesplusde80ans[16].
Chezdespatientshospitalisésdansuncontextedemaladie aiguë et dont lediabète n’est pas connu, unehyperglycémie de stress est définie par une glycémie à jeun≥126mg/dL (7mmol/L) ou≥200mg/dL (11,1mmol/L) à n’importe quel momentavecunevaleurd’hémoglobineglyquée(HBA1C)
infé-rieureà5,7%.Pardéfinition,cetteaugmentationdelaglycémie esttransitoireetsenormaliseralorsquelephénomèneaigu dis-paraîtra.Certainspatientsdemeurerontnéanmoinsdiabétiques. Comme le propose Olveira et al. [11], on pourrait identifier dèsleuradmissionlessujetsàrisquededévelopperundiabète parmiceuxquiprésententunehyperglycémieavecunevaleur d’ HBA1C entre5,7% et6,5%,ce qui indiqueuneanomalie
dans lemétabolismeduglucosepréalableàl’admission. Une mesuredelavaleurl’HBA1Cseraitdèslorssouhaitablecheztous
lespatientshospitalisésavecunehyperglycémie(≥126mg/dL, 7mmol/L),afindepouvoirpréciserlerisquedediabèteultérieur etdedéterminerlemieuxpossibleletraitementadéquat.
Larelationentrel’hyperglycémiechezlespatients hospita-lisés(diabétiquesounon) etlerisqueaccru decomplications etde mortalitéestbienétablie(infections,complications car-diaques,sepsis,insuffisancerénaleaiguë,décès)[17–20].Bien que la plupart des études randomisées visant à investiguer l’impact du contrôle de la glycémie sur l’évolution clinique aient été conduites chez des patients hospitalisés aux soins intensifs,denombreusesdonnéesobservationnellesdémontrent l’importancedutraitementdel’hyperglycémiechezdespatients admisdanslesservicesgénérauxd’unhôpital[18–21]. Néan-moins, l’objectifglycémiqueàatteindrefaitencorel’objetde nombreusespolémiques,enparticulierchezlepatient hospita-liséensoinsintensifs. Lesrecommandationslesplusrécentes sont au moins concordantes sur un point: le maintien de la glycémieen dessousde 180mg/dL(10mmol/L),mêmesiun seuil universel ne peut pas être défini [8,22]. Concernant le patientnonagressé,unconsensusactuelsedégagepour propo-serdemaintenirlaglycémiepréprandialeinférieureà140mg/dL (7,8mmol/L)etunevaleurinférieureà180mg/dL(10mmol/L) à tout moment.Ces objectifs peuventbien entendu varier en fonctiondessituationscliniquesrencontrées[11,12,23].
Chezlepatientdiabétiquenon agresséquibénéficied’une nutrition entérale (NE) ou parentérale (NP), l’objectif glycé-miquen’apasfaitl’objetd’étudesspécifiquesetestdonclaissé àl’appréciation duclinicien enfonctionde lasituation parti-culière dechaque patient [24]. L’objectif glycémiquene doit pasêtretropstrict,afind’éviterlasurvenued’hypoglycémies. Toutefois, comme mentionné ci-dessus, on observe une cor-rélation forte entre l’hyperglycémie induite par la nutrition parentéraletotale(NPT)etuneévolutioncliniquepéjorative.De plus,unehyperglycémiesupérieureà150mg/dL(8,3mmol/L) avantetaucours des24premièresheuresdel’initiationdela NPT est prédictiveà lafois de lasurvenuede complications àl’hôpitalet demortalité[2].Ces donnéessuggèrent qu’une interventionprécocepourpréveniretcorrigerl’hyperglycémie pourraitaméliorerl’évolutioncliniquedespatientsbénéficiant d’unenutritionartificielle[12].Ensituationchronique,plusieurs sociétés scientifiquesrecommandentdemaintenirlaglycémie entre140–180mg/dL(7,8–10mmol/L),mêmesiaucuneétude cliniquecontrôléerandomiséen’aétéjusqu’àprésentconduite endehorsdessoinsintensifs[11,13,23].
Onestimequ’environ5à8%despatientshospitalisés béné-ficientd’unsupportnutritionnelartificielentéralpourtraiterou prévenirladénutrition,sousformedesupplémentsoupour cou-vrirlatotalitédesapportsnutritionnels[11].Environ2–3%de patientssupplémentairesbénéficientd’uneNPTpourlesmêmes raisons.
L’hyperglycémie est une complication courante chez les patientshospitalisésquibénéficientd’uneNE,entre34et50% despatients,variantnotammentenfonctiondutypede popula-tionétudiée[25–27].EncequiconcernelaNPT,onarapporté entre 16et30% desujets préalablementdiabétiques chezles individus des unités de soins intensifs randomisés pour par-ticiper aux études d’intervention comparant le traitementpar
insulineconventionneletintensif[11].Enrevanche,la préva-lence d’une l’hyperglycémie ou d’un diabète préalable chez des patients bénéficiant d’une NPT en dehors des unités de soinsintensifsn’estpasconnue.Plevaetal.[28]rapportentdes épisodeshyperglycémiquesàplusde150mg/dL(8,3mmol/L) chezplusde90%depatientsbénéficiantd’uneNPT.D’autres travaux indiquent une prévalence de l’hyperglycémie supé-rieureà200mg/dL(11,1mmol/L)chez12à27%despatients quirec¸oiventuneNPT[29,30],tandisqu’uneétudeespagnole récente(nonpubliéeinextenso)rapporteque51%despatients nonagressésquiallaientbénéficierd’uneNPTprésentaientdes anomaliesdumétabolismeduglucose(baséessurlesvaleursde glycémiesetd’hémoglobinesglyquées)avantdedébuterlaNPT
[31].Deplus,desétudesàlafoisrétrospectivesetprospectives démontrentquelamiseenrouted’uneNEetd’uneNPestun facteurderisqueindépendantdel’apparitionoudel’aggravation d’unehyperglycémie,indépendammentd’unehistoirepréalable dediabèteetquececiestassociéàunaccroissementdurisquede morbi-mortalitéchezcespatients[12,20].Concernantles méca-nismesimpliqués,l’hyperglycémieperse,outrelefaitqu’elle révèlelagravitédelamaladiesous-jacente,entraînedes consé-quences défavorables majeures qui affectent le pronostic du patienthospitalisé,incluant l’augmentationde lamortalité,le tauxd’infectionetladuréedeséjouràl’hôpital.
Ilapparaît doncquel’hyperglycémiechez lespatients qui bénéficientd’unenutritionartificielle,ettoutspécialementchez lespatientsquiprésententundiabèteavantlamiseenplacedu supportnutritionnel,constitueunproblèmeimportantsuiteàsa prévalenceélevéeetlesconséquences possiblesentermesde morbi-mortalité.Ilimportedèslorsquecespatientssoientpris en chargepar deséquipes nutritionnelles expérimentées pos-sédantdescompétencesspécifiquesennutritioncliniqueeten diabétologieafin d’utiliserau mieux lestraitements hypogly-cémiants susceptibles de favoriser l’efficacité optimale de la nutritionartificielleutilisée.Lesindicationsetlesvoiesd’accès delanutritionartificiellenediffèrentpaschezlespatients diabé-tiques(oudéveloppantunehyperglycémiedestress)parrapport auxindividus nondiabétiques (saufdanslecas particulierde lagastroparésiediabétiquenécessitantuneadministrationdes nutrimentsauniveaupost-pylorique).
3. Traitementdel’hyperglycémiechezlespatientsnon agressésdiabétiques/avechyperglycémiedestresset nutritionentérale
L’obtentiondesobjectifs glycémiqueschez unpatient dia-bétiquerecevantuneNEconstitueleplussouventunvraidéfi. Différentescirconstances,tellesqu’undéplacementdelasonde, unarrêtimprévuounondel’administration(intolérance, exa-mensmédicaux,administrationdemédicaments,soins,kiné...) ouencoreuneadministrationcycliquedelaNEavecunapport oralvariableenfonctiondel’appétit,fontquelaprescription d’unschémad’insulinechezcespatientsdemeureleplus sou-ventproblématique etvanécessiter l’assistanced’uneéquipe expérimentée.
Le meilleur schéma d’administration d’insuline chez des patients diabétiques qui bénéficient d’une NE ne peut être
déterminé actuellement compte tenu du peu d’études dispo-nibles.Iln’existeenréalitéqu’uneseuleétuderandomiséequi comparedeuxstratégiesdifférentesd’administrationd’insuline chez des patients hyperglycémiques non agressés – insuline rapide injectée selonun algorithme préétabli en fonction du monitoring glycémique (avec si nécessaire insuline NPH en supplément) comparéeà de l’insuline rapide encombinaison avecdel’insulineglargine[27].Lesdeuxstratégiesdémontrent globalementuneefficacitécomparable.D’autresétudes rétros-pectivesimpliquantunpetitnombredesujetsontétépubliées, maisnepermettentpasdetirerdesconclusionsgénérales[11]. Lesrecommandationsactuelles,reprisespardifférentessociété scientifiques,sontdoncbaséessurdesavisd’experts[11–13].En nousinspirantdecesrecommandations,nouspouvonsproposer lasynthèseci-dessous.
Il est important tout d’abord de rappeler que les choix doiventêtrefaitaucasparcas,notammentenfonctiondumode d’administrationdelaNE(continue,cycliqueouenbolus).Afin d’éviterlesrisquesd’hypoglycémie,onconseilledefaire coïn-ciderladuréed’actiondel’insulineavecladuréedepassagedu mélangenutritif.Danscettemêmeoptique,certainsauteurs sug-gèrentquel’administrationdequantitésmodéréesetfréquentes d’insulineàactionintermédiaire(typeinsulineNPHou bipha-sique)seraientbénéfiquesauniveaudelaréductiondurisque d’hypoglycémie,encombinaisonsinécessaireavecdel’insuline àactionrapide(analogueounon).L’utilisationd’analoguesde l’insuline àactionprolongée(analogueslents)serait réservée auxpatientsavecdesbesoinsplusstablesouchezlespatients quirec¸oiventlaNEenbolusetchezlesquelsl’insulineglargine estcombinéeàdesanaloguesàactionrapide[11,12].
Les Fig.1–3 résumentle traitement par insuline qui peut être proposé pour contrôler l’hyperglycémie lors d’une NE chez unpatientdiabétique.Lorsque laNEestadministréeen bolus etsi le sujet diabétique était traitépréalablement avec desanti-diabétiques oraux,certainsauteurs recommandentde commencer l’insuline sous-cutanée àune dose de 0,3–0,5UI par kg de poids ajusté et par jour (en tenant compte égale-mentd’autresparamètres,telsquedespathologiesintercurrentes oud’autrestraitementscommel’administrationdecorticoïdes)
[11]. Si le patient était déjà traité par de l’insuline, la dose sera personnaliséeen sebasant sur lesdoses d’insuline préa-lablesetlasituationclinique.Lasurveillanceglycémiquedoit être trèsrégulière àl’instauration dela NE(au minimum un contrôle/3heures).Lerapportinsulinebasale/insulineprandiale estàdéterminerindividuellement,maisonconseille,audébut
au moins, de ne pas administrer plus de 40% de la dose
d’insuline totale sous formebasale, afin de réduire le risque d’hypoglycémie si lanutrition devaitêtre interrompue bruta-lement [11]. On recommande de plutôt privilégier au départ l’insulineNPHoudétemir,l’insulineglarginepouvantêtre uti-liséelorsquelepatienteststableouencorelorsquelaquantité souhaitée deNE estatteinte.Concernant l’insulineprandiale, lesanaloguesrapidesserontprivilégiésetadministrésjusteau démarragedelapochedeNE.LorsquelaNEestadministréede manièrecontinue,uneinsulinebasaleestrecommandée (glar-gineunefoisparjourouNPH,détémiroubiphasiquedeuxou troisfoisparjour)associéeàuneinsulinerapideordinairetrois
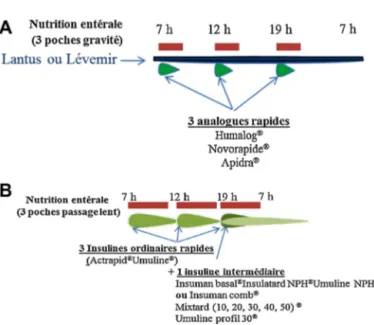
Fig.1.Schémasd’insulinothérapiepourunenutritionentéraleen3pochespar jour.A.Passagedelanutritionentéralerapideengravité(<2h).Schémaproposé «basalbolus»:Lantus®ouLevemir®enbasal,unefoisparjour+3injections
d’analoguesrapidesavantchaquepoche.Alternative:3injectionsd’Humalog®
mix30–50.B.Passagedelanutritionentéralesurplusde4heures.Deuxschémas proposés: 3injections d’insulinerapideordinaireetuneinjectiond’insuline intermédiaireNeutralProtaminHagedorn(NPH);3injectionsd’unmélange mixte(mix30–50).Lechoixdelaproportiond’analogue30ou50estfonction delaglycémiefaite1h30aprèslebranchementdelapoche.
D’aprèsD.Quilliotetal.[32].
fois parjour dontladose pourraêtre ajustée enfonction des contrôlesglycémiquesréguliers.Enfin,chezlespatients bénéfi-ciantd’uneadministrationdeNEcyclique(parexemplelanuit), onrecommandeuneinjectiond’insulineàactionintermédiaire (NPH,détémiroubiphasique)administrée30à60minutesavant ledébutdelaperfusion(avecd’éventuelsajustementsavecde l’insulinerapideordinaireouanalogueaudébutdelapoche).
Lespréparations«standard»deNEcontiennent habituelle-mentuneproportion élevéede glucides(environ 50%) et un apportassezmodéréenlipides(environ30%),cequi favorise-raituneréponseglycémiqueetinsulinémiqueélevéechezlesujet diabétiqueparcomparaisonàcequiestobservéaprèsunrepas mixte.Dèslors, différentespréparationsspécifiques destinées
Fig.2.Schémasd’insulinothérapiepourunenutritionentéraleen2pochespar jour.Schémaproposé:2injectionsd’uneinsulinemixte(associationd’une insu-linerapideoud’unanalogueetd’uneinsulineNPH).Lechoixdelaproportion d’analogueouderapide30ou50estfonctiondelaglycémieréalisée1h30après lebranchementdelapoche.
D’aprèsD.Quilliotetal.[32].
Fig. 3.Schémas d’insulinothérapie pour une nutrition entérale cyclique nocturne.Schémaproposé:uneinjectiond’unmélanged’insulinemixte (asso-ciationd’uneinsulinerapideoud’unanalogueetd’uneinsulineNPH).Lechoix delaproportiond’analogueouderapide30ou50estfonctiondelaglycémie réalisée1h30aprèslebranchementdelapoche.Ennutritionentéralecontinue, aulongcours:possibilitéd’utiliseruneinsulinedetypeLantus®(longuedurée
d’action).
D’aprèsD.Quilliotetal.[32].
auxpatientsdiabétiquesontétémisessurlemarchéaucoursde cesdernièresannées.Leurprincipeestdefournirdesglucidesà indexglycémiquebasavecunequantitéplusimportantedefibres solubles.Deplus,cespréparationscontiennentunpourcentage plusélevédelipides(principalementsouslaformed’acidesgras monoinsaturés).L’avantageprincipaldecetypedepréparations seraitderéduirel’hyperglycémiepostprandiale.Etdefait,des étudescliniquesmenéesàl’hôpitalontmontréunediminution des glycémiesetuneréduction desbesoins eninsuline, mais sansmodifierlesparamètresdéterminants,telsqueladuréedu séjourhospitalier,lasurvenuedesinfectionsetlamortalité[11]. Surdespériodespluslongues(jusqu’àtroismois),ces prépa-rationsspécifiques pourpatients diabétiquesamélioreraientle contrôlemétabolique(enparticulierlavaleurd’HBA1C),mais
sansmodifierlamorbidité[33].Cependant,mêmesiune méta-analyseestenfaveur del’usage decespréparationsentérales spécifiquespourlessujetsdiabétiques[34],ilmanque actuelle-ment d’études randomisées, de préférence menéesen double insu et incluant plus de patients sur une durée plus longue, quipermettraientd’obtenirdesrésultatsprobantsentermesde morbi-mortalité.Dèslors,danscesdernièresrecommandations, l’ASPENconclutqu’iln’existepasdedonnéessuffisantespour recommander l’usage de tellespréparations chez les patients adulteshospitalisésavechyperglycémie[13].
4. Traitementdel’hyperglycémiechezlepatient diabétiquenonagressérecevantunenutrition parentéraletotale(NPT)
En dehors des unités de soins intensifs, la gestion de l’hyperglycémieaucoursd’uneNPTn’apasfaitl’objetd’études randomisées,maisdeuxarticlesrécentsyontétéconsacrésdans cetterevueetlelecteurpeuts’yréférer[24,32].
Au niveau de la composition en macronutriments de la
poche de NPT, il n’existe pas d’étude qui permette d’établir la proportion idéale. Tant qu’à présent, on recommande un apport de calories non protéiques entre 60% de glucides et 40% de lipides.Letype de macro- oude micronutrimentsà
Fig.4.Schémasd’insulinothérapieennutritionparentéralecycliquenocturne. Uneinjectiond’unmélanged’insulinemixte(associationd’uneinsulinerapide oud’unanalogueetd’uneinsulineNPH).Lechoixdelaproportiond’analogue ouderapide30ou50estfonctiondelaglycémieréalisée1h30aprèsle bran-chementdelapoche.
D’aprèsD.Quilliotetal.[32].
administrer chez les sujets diabétiques en NPT n’a pas fait nonplusl’objetd’étudesspécifiques.Bienquel’utilisationde mélangesparticuliers d’acidesaminés (parexemplerichesen glutamine)oudelipidesspécifiques (basésurl’acideoléique ouenrichisenacidesgrasoméga-3)pourraitsemontrer béné-fiquedanslapriseenchargedel’hyperglycémie,iln’existepas actuellementdedonnéessuffisantesdanslalittératurepouren recommanderleurutilisation.
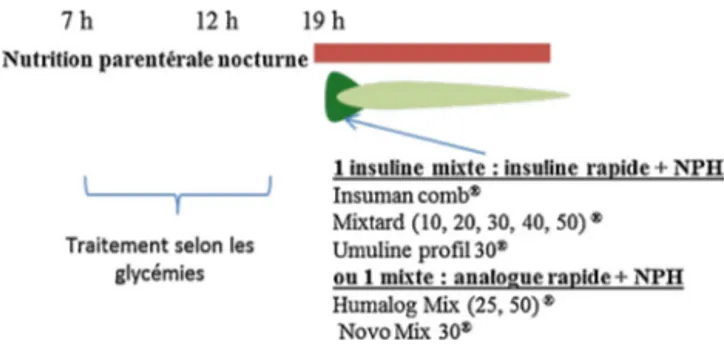
La Fig. 4 résume le traitement par insuline qui peut
être proposé pour contrôler l’hyperglycémie lors d’une NPT chez un patient diabétique. En situation chronique et stable, l’administration d’insuline rapide ordinaire directement dans la poche de NPT est une pratique courante et fait l’objet d’unlargeconsensus,bienquecettepratiquen’ait faitl’objet d’aucune évaluation précise et que labiodisponibilité exacte de l’insuline associée à la poche de NPT reste mal connue
[12,24,28]. Cette technique nécessite néanmoins des précau-tionsimportantes:elledoitêtreinitiéeenhospitalisationetles conditionsd’asepsiedoiventêtrestrictementcontrôléesdufait desrisquesinfectieux(Encadré1).L’avantageindéniabledece typed’administrationestdelimiterlerisqued’hypoglycémie encas d’arrêtinopiné delaNPT [32].Une pratiqueclinique assez courante est d’administrer l’insuline dans la poche et decorriger l’hyperglycémieéventuelle –uneautosurveillance glycémique régulière est indispensable– avec des injections d’insulinerapide ordinairesous-cutanéetoutesles6–8heures
[11,12].Sil’objectifglycémiquen’estpasatteint,l’équivalent desdeuxtiersdeladosedel’insulinesous-cutanéeinjectéeen correctionlejourprécédentseraajoutédanslaperfusion quo-tidienne[11].Encas dediabèteconnunon-traitéparinsuline préalablement,onpeutadministrer1à2UId’insulinepour10g deglucosecontenudanslapocheNPT.Silediabèteétaitdéjà traitéparinsuline,oncommencepar2UIpour10gdeglucose ou0,5UId’insuline par kgde poids. Comme alternative, on peutdébuteren administrantdanslapochede NPTlamoitié ou lesdeux tiers des besoins antérieurs du patient. Chez les patientsdiabétiquesdetype1,enplusdel’insulineadministrée danslapocheetducomplémentsous-cutané,onrecommande d’injecterentre0,05et0,1UI/kgd’insulinebasalesous-cutanée (glargine ou détémir) afin de prévenir une décompensation acido-cétosiqueencasd’arrêtimpromptudelaperfusion[11].
Encadré 1: Insuline injectée dans la poche de nutritionparentérale: les précautionset modalités
• Lanutritionparentéraledoitêtredébutéeet éva-luéeenhospitalisation;
• Ondoits’assurerd’unebonnehomogénéitédu
mélange: retournementdela pocheà de
mul-tiples reprises (le volume injecté, inférieur à
1mL doit êtrediluédans unvolume
générale-mentsupérieurà1L);
• La composition de la poche doit être
cons-tante: la biodisponibilité de l’insuline peut
varier de fac¸on considérable, selon la
compo-sitionenmicronutrimentsetenacidesaminés.
Parexemplesilesoligo-élémentssontajoutés
dansle mélange,ilfautquecettepratiquesoit
constante;
• Il faut utiliser une insuline de type rapide
(Umuline®,Actrapid®)(lacompatibilitéavecles
analoguesn’apasététestée);
• La stabilité de la biodisponibilité de l’insuline
n’est pas garantie, il est donc recommandé
decontrôlerlesglycémies,toutesles2heures,
durantlespremiersjours,defac¸onàadapterles dosesd’insuline;
• La dose initiale est généralement comprise
entre0,5à1UI/10gdeglucoseperfusé;
• Unrattrapagede2Uesteffectuéensous-cutané
silaglycémieestsupérieureauxobjectifsfixés.
Ontiendracomptedecesrattrapagespour
cal-culer la dosedu lendemain.L’adaptation dela
dosed’insulinesefera ensuitesurla glycémie
audébranchement.
Cen’estqu’encasd’hyperglycémieimportante,persistante et non contrôlée qu’une administration intraveineuse séparée d’insulinedevraêtreenvisagée.
Chez les patients diabétiques qui bénéficient d’une NP à domicile avec administrationcyclique (souvent nocturne), on peutenvisagerd’administreravantladébutdelaperfusionune insuline intermédiaire(NPH,détémir ouinsuline biphasique) parvoiesous-cutanée.
5. Conclusions
La prise en charge du diabète chez les sujets qui bénéfi-cientd’unenutritionartificielleresteundomainemalconnu,en particulierchezlepatientnonagressé.Actuellement,les recom-mandationssebasentessentiellementsurdesavisd’experts.De nouvelles étudesprospectives etincluantun nombresuffisant depatientssontindispensablesafinmieuxdéfinirlesobjectifs glycémiques, letypede préparationà utiliserouencorele(s) schéma(s)d’insulineàpréconiser,passeulemententermesde
contrôlemétabolique,maisaussipourleur(s)effet(s)auniveau delamorbi-mortalitéchezcespatients.
Déclarationd’intérêts
Lesauteursdéclarentnepasavoirde conflitsd’intérêtsen relationaveccetarticle.
Références
[1]CookCB,KongableGL,PotterDJ,AbadVJ,LeijaDE,AndersonM. Inpatientglucosecontrol:aglycemicsurveyof126UShospitals.JHosp Med2009;4:E7–14.
[2]PasquelFJ,SpiegelmanR,McCauleyM,SmileyD,UmpierrezD,Johnson R,etal.Hyperglycemiaduringtotalparenteralnutrition:animportant mar-kerofpooroutcomeandmortalityinhospitalizedpatient.DiabetesCare 2010;33:739–41.
[3]DunganKM,BraithwaiteSS,PreiserJC.Stresshyperglycaemia.Lancet 2009;373:1798–807.
[4]MarikPE,PreiserJC.Towardunderstandingtightglycemiccontrolinthe ICU:asystematicreviewandmeta-analysis.Chest2010;137:544–51. [5]LenaD,KalfonP,PreiserJC,IchaiC.Glycemiccontrolinthe
inten-sive care unit and during the postoperative period. Anesthesiology 2011;114:438–44.
[6]VincentJL,PreiserJC,SprungCL,MorenoR,SakrY.Insulin-treated diabetesisnotassociatedwithincreasedmortalityincriticallyillpatients. CritCare2010;14(1):R12,http://dx.doi.org/10.1186/cc8866.
[7]KrinsleyJS,EgiM,KissA,DevendraAN,SchuetzP,MaurerPM,etal. Diabeticstatusandtherelationofthethreedomainsofglycemiccontrolto mortalityincriticallyillpatients:aninternationalmulticentercohortstudy. CritCare2013;17(2):R37.
[8]IchaiC,PreiserJC,Sociétéfranc¸aised’anesthésie-réanimation,Sociétéde réanimationdelanguefranc¸aise,Expertsgroup.International recommen-dationsforglucosecontrolinadultnondiabeticcriticallyillpatients.Crit Care2010;14:R166,http://dx.doi.org/10.1186/cc9258.
[9]QaseemA,HumphreyLL,ChouR,SnowV,ShekelleP.Useofintensive insulintherapyforthemanagementofglycemiccontrolinhospitalized patients:aclinicalpracticeguidelinefromtheAmericanCollegeof Physi-cians.AnnInternMed2011;154:260–7.
[10]VaquerizoAlonsoC,GrauCarmonaT,JuanDíazM.Guidelinesfor specia-lizednutritionalandmetabolicsupportinthecriticallyillpatient.Update. Consensus SEMICYUC-SENPE:hyperglycemiaanddiabetes mellitus. NutrHosp2011;26(Suppl.2):37–40.
[11]OlveiraG,García-LunaPP,PereiraLJ,RebolloI,García-AlmeidaJM, SerranoP,etal.RecommendationsoftheGARINgroupformanaging non-criticallyillpatientswithdiabetesorstresshyperglycaemiaandartificial nutrition.NutrHosp2012;27:1837–49.
[12]UmpierrezGE,HellmanR,KorytkowskiMT,KosiborodM,MaynardGA, MontoriVM,etal.Managementofhyperglycemiainhospitalizedpatients innon-criticalcaresetting:anendocrinesocietyclinicalpracticeguideline. JClinEndocrinolMetab2012;97:16–38.
[13]McMahonMM,NystromE,BraunschweigC,MilesJ,CompherC.ASPEN clinicalguidelines:nutritionsupportofadultpatientswithhyperglycemia. JParenterEnteralNutr2013;37:23–36.
[14]HuFB.Globalizationofdiabetes:theroleofdiet,lifestyle,andgenes. DiabetesCare2011;34:1249–57.
[15]ScheenAJ,PaquotN.Lediabètedetype2:voyageaucœurd’unemaladie complexe.RevMedLiege2012;67(5–6):326–31.
[16]MorleyJE.Anoverviewofdiabetesmellitusinolderpersons.ClinGeriatr Med1999;15:211–24.
[17]CapesSE,HuntD,MalmbergK,GersteinHC.Stresshyperglycaemiaand increasedriskofdeathaftermyocardialinfarctioninpatientswithand withoutdiabetes:asystematicoverview.Lancet2000;355:773–8. [18]UmpierrezGE,IsaacsSD,BazarganN,YouX,ThalerLM,KitabchiAE.
Hyperglycemia:anindependentmarkerofin-hospitalmortalityinpatients withundiagnoseddiabetes.JClinEndocrinolMetab2002;87:978–82. [19]FalcigliaM,FreybergRW, AlmenoffPL, D’AlessioDA,RenderML.
Hyperglycemia-relatedmortalityincriticallyillpatientsvarieswith admis-siondiagnosis.CritCareMed2009;37:3001–9.
[20]OlveiraG,TapiaMJ,OcónJ,Cabrejas-GómezC,Ballesteros-PomarMD, Vidal-CasariegoA,etal.Parenteralnutrition-associatedhyperglycemia innon-criticallyillinpatientsincreasestheriskofin-hospitalmortality. DiabetesCare2013;36:1061–6.
[21]McAlisterFA,MajumdarSR,BlitzS,RoweBH,RomneyJ,MarrieTJ. Therelationbetweenhyperglycemiaandoutcomesin2471patients admit-tedtothehospitalwithcommunity-acquiredpneumonia.DiabetesCare 2005;28:810–5.
[22]JacobiJ,BircherN,KrinsleyJ,AgusM,BraithwaiteSS,Deutschman, etal. Guidelines for the use of an insulin infusion for the manage-mentofhyperglycemiaincriticallyillpatients.CritCareMed2012;40: 3251–76.
[23]MoghissiES,KorytkowskiMT,DiNardoM,EinhornD,HellmanR,Hirsch IB,etal.AmericanAssociationofClinicalEndocrinologistsandAmerican DiabetesAssociationconsensusstatementoninpatientglycemiccontrol. DiabetesCare2009;32:1119–31.
[24]DeFlinesJ,PaquotN,PreiserJC.Gestiondel’hyperglycémieaucours d’unenutritionparentérale.NutrClinMetab2012;26:143–7.
[25]Pancorbo-Hidalgo PL, Garcia-Fernandez FP, Ramirez-Perez C. Complicationsassociatedwithenteralnutritionbynasogastrictubeinan internalmedicineunit.JClinNurs2001;10:482–90.
[26]ArinzonZ,ShabatS,ShuvalI,PeisakhA,BernerY.Prevalenceofdiabetes mellitusinelderlypatientsreceivedenteralnutritionlong-termcareservice. ArchGerontolGeriatr2008;47:383–93.
[27]KorytkowskiMT,SalataRJ,KoerbelGL,SelzerF,KarsliogluE,Idriss AM,etal.Insulintherapyandglycemiccontrolinhospitalizedpatients withdiabetesduringenteralnutritiontherapy:arandomized controlled clinicaltrial.DiabetesCare2009;32:594–6.
[28]Pleva M,Mirtallo JM, Steinberg SM. Hyperglycemic events in non-intensivecareunitpatientsreceivingparenteralnutrition.NutrClinPract 2009;24:626–34.
[29]ValeroMA,AlegreE,GomisP,MorenoJM,MiguelezS,Leon-SanzM. Clinicalmanagementofhyperglycaemicpatientsreceivingtotalparenteral nutrition.ClinNutr1996;15:11–5.
[30]Marti-BonmatiE,Ortega-GarciaMP,Cervera-CasinoP,LacasaC,Llop JL,VillalobosJL,etal.Multicenterstudyontheprevalenceof hypergly-cemiaamonghospitalizedpatientswithparenteralnutrition.FarmHosp 2006;30:12–9.
[31]TapiaGuerreroMJ,OlveiraG,HyperglycaemiainParenteralNutrition StudyGroup.Hyperglycemiaanddiabetesduringtotalparenteral nutri-tioninnon-criticalhospitalisedpatientsinSpain.ClinNutr2011;6(Supp. 1):120.
[32]Quilliot D, Durain D, Malgras A. Principes de prise en charge de l’hyperglycémieau cours de lanutrition artificielle. NutrClinMetab 2012;26:40–4.
[33]Vaisman N, Lansink M, Rouws CH, van Laere KM, Segal R, Niv E, et al. Tube feeding with a diabetes-specific feed for 12 weeks improvesglycaemiccontrolintype2diabetespatients.ClinNutr2009;28: 549–55.
[34]EliaM,CerielloA,LaubeH,SinclairAJ,EngferM,StrattonRJ. Ente-ralnutritionalsupportanduseofdiabetes-specificformulasforpatients with diabetes: a systematic review and meta-analysis. Diabetes Care 2005;28:2267–79.