HAL Id: dumas-01756842
https://dumas.ccsd.cnrs.fr/dumas-01756842
Submitted on 6 Jun 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
aortique utilisant la prothèse hybride E-VITA Open
plus® : résultats du registre multicentrique français NOE
Réda Belhaj Soulami
To cite this version:
Réda Belhaj Soulami. Chirurgie élective des pathologies étendues de la crosse aortique utilisant la prothèse hybride E-VITA Open plus® : résultats du registre multicentrique français NOE. Sciences du Vivant [q-bio]. 2016. �dumas-01756842�
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
FACULTÉ DE MEDECINE
sous le sceau de l’Université Européenne de Bretagne
THÈSE EN VUE DU
DIPLÔME D'ÉTAT DE DOCTEUR EN MEDECINE
présentée par
Réda BELHAJ SOULAMI
né le 02 Février 1988 à RabatIntitulé de la thèse :
Chirurgie élective des pathologies
étendues de la crosse aortique
utilisant la prothèse hybride E-VITA
Open plus
®
: résultats du registre
multicentrique français NOE
Thèse soutenue à RENNES le 11/10/2016
devant le jury composé de : Jean-Philippe Verhoye
PU-PH – service de chirurgie thoracique et cardiovasculaire du CHU de Rennes / Président Alain Leguerrier
PU-PH – service de chirurgie cardiothoracique et vasculaire du CHU de Rennes / Juge
Hervé Corbineau
PU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Erwan Flecher
PU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Adrien Kaladji
MCU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Vito Giovanni Ruggieri
PU-PH – service de chirurgie cardiaque du CHU de Reims / Juge
Olivier Fouquet
PH – service de chirurgie cardiaque du CHU d’Angers / Membre invité
Amédéo Anselmi
MCU-PH - service de chirurgie thoracique et vasculaire CHU de Rennes / Directeur de thèse
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
FACULTÉ DE MEDECINE
sous le sceau de l’Université Européenne de Bretagne
THÈSE EN VUE DU
DIPLÔME D'ÉTAT DE DOCTEUR EN MEDECINE
présentée par
Réda BELHAJ SOULAMI
né le 02 Février 1988 à RabatIntitulé de la thèse :
Chirurgie élective des pathologies
étendues de la crosse aortique
utilisant la prothèse hybride E-VITA
Open plus
®
: résultats du registre
multicentrique français NOE
Thèse soutenue à RENNES le 11/10/2016
devant le jury composé de : Jean-Philippe Verhoye
PU-PH – service de chirurgie thoracique et cardiovasculaire du CHU de Rennes / Président Alain Leguerrier
PU-PH – service de chirurgie cardiothoracique et vasculaire du CHU de Rennes / Juge
Hervé Corbineau
PU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Erwan Flecher
PU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Adrien Kaladji
MCU-PH – service de chirurgie cardiothoracique et vasculaire CHU de Rennes / Juge
Vito Giovanni Ruggieri
PU-PH – service de chirurgie cardiaque du CHU de Reims / Juge
Olivier Fouquet
PH – service de chirurgie cardiaque du CHU d’Angers / Membre invité
Amédéo Anselmi
MCU-PH - service de chirurgie thoracique et vasculaire CHU de Rennes / Directeur de thèse
PROFESSEURS UNIVERSITAIRES – PRATICIENS HOSPITALIERS Nom Prénom Sous-section de CNU ANNE-GALIBERT Marie Dominique Biochimie et biologie moléculaire BELAUD-ROTUREAU Marc-Antoine Histologie; embryologie et cytogénétique BELLISSANT Eric Pharmacologie fondamentale; pharmacologie clinique; addictologie BELLOU Abdelouahab Thérapeutique; médecine d'urgence; addictologie BELOEIL Hélène Anesthésiologie-réanimation; médecine d'urgence BENDAVID Claude Biochimie et biologie moléculaire BENSALAH Karim Urologie BEUCHEE Alain Pédiatrie BONAN Isabelle Médecine physique et de réadaptation BONNET Fabrice Endocrinologie, diabète et maladies métaboliques; gynécologie médicale BOUDJEMA Karim Chirurgie générale BOUGET Jacques Thérapeutique; médecine d'urgence; addictologie BOURGUET Patrick Professeur des Universités en surnombre Biophysique et médecine nucléaire BRASSIER Gilles Neurochirurgie BRETAGNE Jean-François Gastroentérologie; hépatologie; addictologie BRISSOT Pierre Professeur des Universités en surnombre Gastroentérologie; hépatologie; addictologie CARRE François Physiologie CATROS Véronique Biologie cellulaire CHALES Gérard Professeur des Universités émérite Rhumatologie CORBINEAU Hervé Chirurgie thoracique et cardiovasculaire CUGGIA Marc Biostatistiques, informatique médicale et technologies de communication DARNAULT Pierre Anatomie
Nom Prénom Sous-section de CNU DAUBERT Jean-Claude Professeur des Universités émérite Cardiologie DAVID Véronique Biochimie et biologie moléculaire DAYAN Jacques Professeur des Universités associé Pédopsychiatrie; addictologie DE CREVOISIER Renaud Cancérologie; radiothérapie DECAUX Olivier Médecine interne; gériatrie et biologie du vieillissement; addictologie DELAVAL Philippe Pneumologie; addictologie DESRUES Benoît Pneumologie; addictologie DEUGNIER Yves Professeur des Universités en surnombre Gastroentérologie; hépatologie; addictologie DONAL Erwan Cardiologie DRAPIER Dominique Psychiatrie d'adultes; addictologie DUPUY Alain Dermato-vénéréologie ECOFFEY Claude Anesthésiologie-réanimation; médecine d'urgence EDAN Gilles Neurologie FERRE Jean Christophe Radiologie et imagerie Médecine FEST Thierry Hématologie; transfusion FLECHER Erwan Chirurgie thoracique et cardiovasculaire FREMOND Benjamin Chirurgie infantile GANDEMER Virginie Pédiatrie GANDON Yves Radiologie et imagerie Médecine GANGNEUX Jean-Pierre Parasitologie et mycologie GARIN Etienne Biophysique et médecine nucléaire GAUVRIT Jean-Yves Radiologie et imagerie Médecine GODEY Benoit Oto-rhino-laryngologie GUGGENBUHL Pascal Rhumatologie
Nom Prénom Sous-section de CNU GUIGUEN Claude Professeur des Universités émérite Parasitologie et mycologie GUILLÉ François Urologie GUYADER Dominique Gastroentérologie; hépatologie; addictologie GUYADER Dominique Hématologie; transfusion HUGÉ Sandrine Professeur des Universités associé Médecine générale HUSSON Jean-Louis Professeur des Universités en surnombre Chirurgie orthopédique et traumatologique JEGO Patrick Médecine interne; gériatrie et biologie du vieillissement; addictologie JEGOUX Franck Oto-rhino-laryngologie JOUNEAU Stéphane Pneumologie; addictologie KAYAL Samer Bactériologie-virologie; hygiène hospitalière KERBRAT Pierre Cancérologie; radiothérapie LAMY DE LA CHAPELLE Thierry Hématologie; transfusion LAVIOLLE Bruno Pharmacologie fondamentale; pharmacologie clinique; addictologie LAVOUE Vincent Gynécologie-obstétrique; gynécologie médicale LE BRETON Hervé Cardiologie LE GUEUT Maryannick Médecine légale et droit de la santé LE TULZO Yves Réanimation; médecine d'urgence LECLERCQ Christophe Cardiologie LEGUERRIER Alain Chirurgie thoracique et cardiovasculaire LEJEUNE Florence Biophysique et médecine nucléaire LEVEQUE Jean Gynécologie-obstétrique; gynécologie médicale LIEVRE Astrid Gastroentérologie; hépatologie; addictologie MABO Philippe Cardiologie MALLEDANT Yannick Anesthésiologie-réanimation; médecine d'urgence
Nom Prénom Sous-section de CNU MEUNIER Bernard Chirurgie digestive MICHELET Christian Maladies infectieuses; maladies tropicales MOIRAND Romain Gastroentérologie; hépatologie; addictologie MORANDI Xavier Anatomie MORTEMOUSQUE Bruno Ophtalmologie MOSSER Jean Biochimie et biologie moléculaire MOULINOUX Jacques Biologie cellulaire MOURIAUX Frédéric Ophtalmologie ODENT Sylvie Génétique OGER Emmanuel Pharmacologie fondamentale; pharmacologie clinique; addictologie PERDRIGER Aleth Rhumatologie PLADYS Patrick Pédiatrie POULAIN Patrice Gynécologie-obstétrique; gynécologie médicale RAVEL Célia Histologie; embryologie et cytogénétique RIFFAUD Laurent Neurochirurgie RIOUX-LECLERCQ Nathalie Anatomie et cytologie pathologiques ROBERT-GANGNEUX Florence Parasitologie et mycologie SAINT-JALMES Hervé Biophysique et médecine nucléaire SEGUIN Philippe Anesthésiologie-réanimation; médecine d'urgence SEMANA Gilbert Immunologie SIPROUDHIS Laurent Gastroentérologie; hépatologie; addictologie SOMME Dominique Médecine interne; gériatrie et biologie du vieillisement; addictologie SULPICE Laurent Chirurgie générale TARTE Karin Immunologie
Nom Prénom Sous-section de CNU TATTEVIN Pierre Maladies infectieuses; maladies tropicales THIBAULT Ronan Nutrition THIBAULT Vincent Bactériologie-virologie; hygiène hospitalière THOMAZEAU Hervé Chirurgie orthopédique et traumatologique TORDJMAN Sylvie Pédopsychiatrie; addictologie VERGER Christian Professeur des Universités émérite Médecine et santé au travail VERHOYE Jean-Philippe Chirurgie thoracique et cardiovasculaire VERIN Marc Neurologie VIEL Jean-François Epidémiologie, économie de la santé et prévention VIGNEAU Cécile Néphrologie VIOLAS Philippe Chirurgie infantile WATIER Eric Chirurgie plastique, reconstructrice et esthétique; brûlologie WODEY Eric Anesthésiologie-réanimation; médecine d'urgence
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS Nom Prénom Sous-section de CNU AME-THOMAS Patricia Immunologie AMIOT Laurence Hématologie; transfusion BARDOU-JACQUET Edouard Gastroentérologie; hépatologie; addictologie BEGUE Jean-Marc Physiologie BOUSSEMART Lise Dermato-vénéréologie CABILLIC Florian Biologie cellulaire CAUBET Alain Médecine et santé au travail DAMERON Olivier Informatique DE TAYRAC Marie Biochimie et biologie moléculaire DEGEILH Brigitte Parasitologie et mycologie DUBOURG Christèle Biochimie et biologie moléculaire DUGAY Frédéric Histologie; embryologie et cytogénétique EDELINE Julien Cancérologie; radiothérapie GALLAND Françoise Endocrinologie, diabète et maladies métaboliques; gynécologie médicale GARLANTEZEC Ronan Epidémiologie, économie de la santé et prévention GUILLET Benoit Hématologie; transfusion HAEGELEN Claire Anatomie JAILLARD Sylvie Histologie; embryologie et cytogénétique LAVENU Audrey Sciences physico-chimiques et technologies pharmaceutiques LE GALL François Anatomie et cytologie pathologiques LE RUMEUR Elisabeth Physiologie MAHÉ Guillaume Chirurgie vasculaire; médecine vasculaire
Nom Prénom Sous-section de CNU MARTINS Raphaël Cardiologie MASSART Catherine Biochimie et biologie moléculaire MATHIEU-SANQUER Romain Urologie MENARD Cédric Immunologie
REMERCIEMENTS
Je tiens à remercier le Professeur Jean-Philippe Verhoye, tout d’abord pour m’avoir confié ce travail autour de la chirurgie aortique, chirurgie que vous incarnez avec tant d’enthousiasme et d’excellence. Merci à vous, de m’avoir ouvert les portes de cette spécialité au sein de votre service. Merci pour vos conseils bienveillants, vos encouragements, et pour l’intérêt que vous portez à chacun des membres de votre équipe. Enfin, merci de me faire l’honneur de présider mon jury de thèse.
J’adresse aussi mes sincères remerciements au Professeur Alain Leguerrier, mon premier chef de service. Vous avez fait de notre service un centre de référence, reconnu non seulement pour son expertise, mais également pour la qualité de sa formation. Trouvez ici, cher Maître, l’expression de ma gratitude et mon dévouement.
Je tiens également à adresser mes remerciements les plus sincères au Professeur Hervé Corbineau, pour votre rigueur bienveillante qui nous pousse à donner le meilleur de nous-même. Votre excellence chirurgicale est un modèle pour vos élèves. Merci au Professeur Erwan Flecher. Trouve ici mon cher Erwan la marque de ma gratitude et mon respect, pour ton exemplarité humaine, ton dévouement incessant, et ta passion pour la discipline que tu nous apprends. Merci de tes encouragements et ton humour qui égayent les nuits parfois longues. Comme tu le dis si bien « c’est pas facile, la chirurgie ».
Mes pensées vont également envers le Professeur Vito Giovanni Ruggieri, du service de chirurgie cardiaque au CHU de Reims. Merci à toi mon cher Gianvito, pour ton encadrement scientifique, tes encouragements incessants, ta bonne humeur, et ton excellence chirurgicale.
J’adresse pareillement mes remerciements au Docteur Adrien Kaladji. Merci Adrien, pour ton excellence chirurgicale, humaine et ton humilité. Merci pour ta disponibilité et ton concours à ce travail. Enfin, merci de m’avoir fait découvrir la chirurgie vasculaire.
Mes remerciements vont également au Docteur Olivier Fouquet, du service de chirurgie cardiaque du CHU d’Angers. Merci Olivier pour ton aide, ta disponibilité, et pour l’amitié que tu me fais et siégeant dans mon jury de thèse.
Mes pensées vont également envers mon directeur de thèse, le Docteur Amedeo Anselmi. Trouve ici mon cher Amedeo l’expression de toute ma gratitude et mon amitié. D’abord pour ton encadrement, rigoureux, disponible et chaleureux, mais aussi pour ton exemplarité chirurgicale et humaine. Merci pour ton soutien, tes conseils, et ton humilité.
Un grand merci au Docteur Thierry Langanay. Pour votre amitié, votre dévouement, vos encouragements. Vous avez accompagné mes premiers pas dans cette discipline et continuez de me porter avec bienveillance. Trouvez ici l’expression de toute mon amitié et ma gratitude.
Je tiens à remercier également le Docteur Bertrand De Latour. Pour avoir porté à bout de bras l’activité de chirurgie thoracique, et pour votre dévouement incessant qui fait aujourd’hui de notre service une école de la discipline. Merci Bertrand pour votre disponibilité, votre humilité, votre bienveillance et l’excellence chirurgicale que vous transmettez avec passion à vos élèves.
Je ne saurais suffisamment remercier le Docteur Jacques Tomasi. Merci Jacques, pour ton amitié, ton soutien infaillible, et ta persévérance que je prends pour modèle.
Je n’oublie pas non plus le Docteur Simon Rouzé. Trouve ici mon cher Simon l’expression de toute mon amitié et ma gratitude pour tes encouragements, ta bienveillance et ton exemplarité.
J’adresse également mes remerciements les plus vifs aux équipes du bloc opératoire : IBODES, IADES, aides-soignantes, médecins anesthésistes et réanimateurs. Vous m’avez vu apprendre et progresser, et avez été mes premiers compagnons dans mes doutes et mes succès au bloc opératoire. Merci de votre gentillesse et votre professionnalisme.
Merci également aux Docteurs Céline Chabanne et Bernard Lelong, pour votre dévouement, votre disponibilité et votre professionnalisme.
Mes remerciements les plus sincères vont également à l’ensemble des équipes paramédicales du service, infirmiers et infirmières, aides-soignants, kinésithérapeutes, pour votre dévouement, votre bonne humeur et vos encouragements.
J’aimerais aussi adresser mes remerciements à mes co-internes tout au long long de ces années, les premiers à avoir partagé mes échecs et mes succès.
De l’autre côté de la Méditerranée, je souhaiterais adresser mes plus vives marques d’amitié et de sympathie au Docteur M’hamed Fares, mon premier maître au bloc opératoire, aux Docteurs Lazreq et Sekkat pour leur bienveillance, et à l’ensemble de l’équipe du bloc opératoire de la Clinique Agdal à Rabat. La transition est donc toute faite pour m’adresser à toi, mon cher Papa. Puisses-tu trouver dans ce travail une petite fraction de la passion que portes pour ces cœurs que tu tiens entre tes mains. Une petite fraction également de ma gratitude, mon admiration et mon amour pour celui qui m’a donné envie de choisir cette belle spécialité. Merci à toi Maman, pour ton amour et ton dévouement, ton soutien infaillible, et ta fierté que tu me rappelles si souvent. Merci à vous, Amine et Amira, pour votre amour et votre soutien.
Enfin, toutes mes pensées vont vers toi, Sara. Pour ta présence à mes côtés, pour ton soutien, ton amour, et notre bonheur à venir…
There is no disease more conducive to clinical humility than aneurysms of the aorta. Sir William Osler, 1905
TABLE DES MATIERES
LISTE DES DOCUMENTS ANNEXES ... 15 LISTE DES ILLUSTRATIONS ... 16 INTRODUCTION ... 17 PRESENTATION DU TRAVAIL DE THESE ... 17 CONTEXTE MEDICAL ... 21 1. Considérations anatomiques ... 21 2. Données épidémiologiques et physiopathologiques ... 23 3. Vascularisation et ischémie médullaires ... 28 4. Histoire de la chirurgie aortique ... 31 5. La trompe d’éléphant conventionnelle : l’œuvre de Hans Borst ... 37 6. L’avènement des thérapeutiques endovasculaires ... 39 7. La trompe d’éléphant hybride – The Frozen elephant trunk ... 40 a. Prothèses aortiques hybrides ... 40 b. La prothèse E-Vita Open plus® ... 42 8. Chirurgie de la crosse aortique en 2016 ... 44 a. Indications ... 44 b. Technique chirurgicale ... 45 c. Etat de l’art ... 48 ARTICLE ORIGINAL: Elective Frozen Elephant Trunk Using the E-Vita Open Prosthesis in 94 patients: Results of a Multicenter French Registry ... 52 Introduction ... 53 Materials and methods ... 54 Results ... 57 Discussion ... 60 Conclusion ... 64 CAS CLINIQUES ... 70 REFERENCES BIBLIOGRAPHIQUES ... 73
LISTE DES DOCUMENTS ANNEXES
Annexe 1 – Lise des centres participants au registre NOE
LISTE DES ILLUSTRATIONS
Figure 1. Campagne publicitaire pour l’hôpital Mount Sinaï, New York, 2004. Figure 2. Premier remplacement total de la crosse aortique décrit par Cooley en 1955. Figure 3. Couverture du magazine LIFE, 1970. Figure 4. Anatomie de la crosse aortique Figure 5. Variantes anatomiques de la crosse aortique Figure 6. Reconstruction 3D d’un scanner mettant en évidence une pathologie anévrysmale. Figure 7. Classifications de Stanford et De Bakey des dissections aortiques. Figure 8. Reconstruction 3D d’un scanner mettant en évidence une dissection aortique chronique. Figure 9. Collatéralité de la vascularisation médullaire. Figure 10. Passage du papyrus D’Ebers. Figure 11. Illustration de deux exemples de traitement des anévrysmes de la crosse aortique au 19e et début du 20e siècle. Figure 12. Cas clinique rapporté par DeBakey et Cooley en 1951. Figure 13. Vue opératoire d’un remplacement total de crosse aortique en 1959 par clamshell incision. Figure 14. Résultat du premier temps opératoire de la trompe d’éléphant conventionnelle. Figure 15. Technique chirurgicale de la trompe d’éléphant conventionnelle. Figure 16. Première description d’une endoprothèse aortique thoracique par Dake en 1994. Figure 17. Prothèse aortique hybride Chavan-Haverich. Figure 18. Prothèses aortiques hybrides Cronus, J Graft et Thoraflex. Figure 19. Caractéristiques techniques de la prothèse E-Vita Open plus. Figure 20. Système de déploiement de la prothèse E-Vita Open plus. Figure 21. Vue d’artiste du résultat d’une procédure de phrozen elephant trunk.Article original en anglais : Elective Frozen Elephant Trunk Using the E-vita Open Plus Prosthesis in 94 Patients: A multicenter National Registry
Figure I. Changes of aortic diameters after frozen elephant trunk treatment with E-Vita Open plus hybrid Graft Figure II. Behavior of Aortic False Lumen as assessed with Computed Tomography after elective frozen elephant trunk procedure using the E-Vita Open plus device.
INTRODUCTION
La chirurgie aortique moderne a connu son essor à la fin de la première moitié du siècle passé. En 1951, à Paris, Charles Dubost(1) décrivait le premier succès de mise à plat greffe d’un anévrysme de l’aorte abdominale. Les années qui suivent marqueront autant de jalons importants dans l’histoire de la chirurgie aortique, sous l’impulsion de Cooley et De Bakey à Houston, qui réaliseront en 1952 la première résection d’anévrysme de l’aorte thoracique(2), et en 1955 le premier remplacement total de crosse aortique(3) (figure 2).Les cinq décennies qui s’en suivront seront marquées par des avancées majeures dans les domaines de l’imagerie, de la réanimation, de la circulation extra-corporelle, de la protection cérébrale et médullaire, ainsi que des techniques chirurgicales et endovasculaires, offrant aux chirurgiens un arsenal thérapeutique considérable dans l’approche de la chirurgie aortique en général, et de la crosse aortique en particulier.
La prise en charge des pathologies de la crosse aortique demeure toutefois un l’un des défis majeurs en chirurgie cardiaque, tant par ses difficultés techniques que par la gestion péri-opératoire de patients souvent polypathologiques. L’évolution constante des thérapeutiques, aux confluents des techniques chirurgicales conventionnelles et endovasculaires, impose quant à elle au chirurgien la maitrise d’une discipline transversale.
La technique du « frozen elephant trunk », objet ce travail, est à l’image de cette évolution transversale et pluridisciplinaire. Cette étude en rapporte les résultats cliniques et radiologiques, dans le traitement des pathologies chroniques étendues de la crosse aortique, en utilisant la prothèse E-Vita Open plus®, dans le cadre d’un registre multicentrique français.
Figure 1. Campagne publicitaire pour l’hôpital Mount Sinaï, New York, 2004 – DEVITO/VERDI « Un anévrysme est une peine de mort. Nous avons le pouvoir de vous offrir une grâce ». Cette campagne publicitaire de 2004 souligne que même à l’ère moderne, les anévrysmes aortiques demeurent une pathologie grave et dont le traitement relève de la prouesse chirurgicale.
Figure 2. Premier remplacement total de la crosse aortique décrit par Cooley en 1955, sans Circulation extra-corporelle (CEC). Un shunt temporaire a été mis en place préalablement à la résection de l’anévrysme puis la reconstruction de la crosse aortique. Le patient décédera six jours plus tard. Extrait de Cooley DA, Mahaffey DE, De Bakey ME. Total excision of the aortic arch for aneurysm. Surg Gynecol Obstet. 1955 Dec;101(6):667–72. Figures 2, 3, 4, et 5.
Figure 3. Couverture du magazine Life. En avril 1970, le Magazine LIFE titre : « Une querelle amère. Deux grands chirurgiens en guerre pour le cœur humain ».
Après avoir tant contribué à l’essor de la chirurgie aortique moderne, Denton Cooley (Haut) et Michael DeBakey (Bas) auront une querelle qui durera plus de 40 ans.
Au début des années 60, Cooley quitte l’hôpital Méthodiste où il travaille avec DeBakey pour rejoindre l’hôpital Saint-Luc, où il fondera le Texas Heart Institute. En 1969, il fait fabriquer le premier cœur total artificiel au laboratoire de DeBakey, puis l’implante, sans l’accord de ce dernier.
DeBakey dira de cette première chirurgicale qu’il s’agit d’un vol, une trahison, un manque d’éthique, et un enfantillage permettant à Cooley de s’attribuer une première médicale.
Ce dernier se défendra en clamant qu’il s’agissait d’un acte désespéré pour sauver une vie. Extrait de http://www.nytimes.com/2007/11/27/health/27docs.html
PRESENTATION DU TRAVAIL DE THESE
Ce travail rapporte les résultats du registre national français N.O.E (Nouvelles Open des Evita), fruit d’une expérience multicentrique dans le traitement des pathologies chroniques étendues de la crosse aortique, à l’aide de la prothèse hybride E-Vita Open plus®.
Les pathologies chroniques de la crosse aortique, essentiellement représentées par les anévrysmes et les dissections aortiques chroniques, impliquent des stratégies opératoires complexes. La technique chirurgicale de référence(4) est la technique dite de la trompe d’éléphant conventionnelle en deux temps (elephant trunk). A la fin des années 1990(5), l’évolution des techniques chirurgicales conventionnelles et l’extension des thérapeutiques endovasculaires à l’aorte thoracique descendante aboutit à la mise au point de prothèses hybrides, permettant un traitement en un temps de ces pathologies étendues de la crosse aortique. Marquant l’évolution de la technique initiale telle que décrite par Hans Borst en 1983(6), c’est ce denier qui surnommera ces nouvelles procédures « frozen elephant trunk » (FET) (7).
La prothèse E-Vita open plus®, destinée à ces procédures, marque la seconde
génération de prothèses aortiques hybrides. Ce registre multicentrique en recense donc les résultats cliniques et radiologiques, à l’heure où la communauté chirurgicale cherche à définir plus finement la place de ces thérapeutiques(8,9).
Ce travail de thèse se présente comme suit : l’introduction comporte des rappels anatomiques, épidémiologiques et physiopathologiques, suivis d’un état de l’art de la chirurgie de la crosse aortique. Enfin, le corps de la thèse, est présenté sous la forme d’un article original en anglais soumis à une revue Européenne.
CONTEXTE MEDICAL
1. Considérations anatomiques
La prise en charge des pathologies de la crosse aortique implique, en plus des impératifs inhérents à toute chirurgie de l’aorte et des gros vaisseaux, 3 éléments spécifiques(10) :
• La position anatomique de la crosse, qui est d’abord verticale, antérieure droite, puis horizontale oblique avant d’avant en arrière et de droite à gauche, puis à nouveau verticale et postérieure gauche (figure 4). Cela a pour conséquences les variations et les difficultés d’abord chirurgicales selon que la lésion intéresse la partie proximale ou distale de la crosse et/ou qu’elle est associée à une lésion des segments adjacents.
• La naissance des troncs supra-aortiques (TSA) implique le plus souvent la mise en place de mesures de protection cérébrale.
• Les contraintes anatomiques et physiologiques de la crosse aortique impliquent la nécessité presque absolue de recourir à des techniques d’arrêt circulatoire total ou partiel pour la protection cérébrale, médullaire et viscérale.
Enfin, la crosse aortique peut présenter des variations anatomiques (figure 5), pouvant compliquer l’accès aux troncs supra-aortiques et à leur réimplantation.
Figure 4. (a) Anatomie de l’aorte thoracique. (b) Avec l’avènement des thérapeutiques endovasculaires, une définition alternative de l’anatomie de l’aorte thoracique en zones s’est répandue. La zone 0 correspond à l’aorte ascendante tubulaire englobant la naissance du TABC ; la zone 1 se situe entre le TABC et l’origine de la carotide commune gauche ; la zone 2 entre l’origine de la carotide commune gauche et l’artère sous clavière gauche. La zone 3 englobe les 2 centimètres distaux à l’origine de l’ASCG, et le segments d’aval représente la zone 4. Extrait de (11). Figure 5. Variantes anatomiques les plus fréquentes de la crosse aortique. La variante la plus courante (11%) est l’arche bovine, constituée d’un tronc commun englobant le TABC et la carotide commune gauche. Une origine séparée des quatre troncs supra-aortiques est plus rare (5%). Enfin, dans moins d’1% des cas, on note une naissance aberrante de l’artère sous-clavière gauche tandis que les autres troncs supra-aortiques ont une origine isolée. Extrait de (11).
2. Données épidémiologiques et physiopathologiques
En 2010, le « Global Burden Disease project »(12) a démontré que le taux de mortalité globale lié aux anévrysmes et dissections aortiques avait augmenté entre 1990 et 2010, passant de 2.49 par 100 000 à 2.78 per 100 000 habitants, avec un taux de mortalité plus important chez les hommes. Selon les statistiques du Center for Disease Control (CDC), les pathologies de l’aorte et ses branches sont responsables de 43 000 à 47 000 décès annuels aux Etats-Unis(13).
Notre étude s’intéresse aux pathologies chroniques de la crosse aortique, représentées majoritairement par les dissections aortiques chroniques et les anévrysmes aortiques. Ces deux entités représentent en effet 90% des patients pris en charge dans notre série.
Les anévrysmes aortiques
L’incidence des anévrysmes thoraciques est d’environ 400 cas pour 100 000 autopsies, et jusqu’à 670 pour 100 000 au-delà de 80 ans(14). Les anévrysmes de l’aorte thoracique sont classés selon le segment d’aorte qu’ils intéressent (figure 6). Cette distinction anatomique est importante car l’étiologie, l’histoire naturelle et le traitement de ces pathologies est variable selon le segment impliqué. Leur incidence est également différente : 60% des anévrysmes thoraciques impliquent l’aorte ascendante, 10% la crosse aortique, 40% l’aorte thoracique descendante et 10% l’aorte thoraco-abdominale(15).
Les anévrysmes de l’aorte thoracique peuvent être le résultat de multiples étiologies, qui ont en commun l’affaiblissement pariétal aortique :
• Les anévrysmes athéromateux ou dégénératifs
• Les anévrysmes dystrophiques, résultant de la dégénérescence médiale kystique(16)
• Les Maladies héréditaires du tissu élastique : Maladie de Marfan, Syndrome de Loeys-Dietz, Syndrome d’Ehler-Danlos, Syndrome de Turner. • Les aortites infectieuses : syphilis, tuberculose, pneumocoque… • Les aortites inflammatoires : Horton, Takayashu, Behçet… Enfin, les anévrysmes aortiques peuvent également compliquer l’évolution des dissections aortiques chroniques. Concernant l’histoire naturelle des anévrysmes de l’aorte thoracique, celle-ci est liée à leur taille ainsi qu’à leur localisation. Le groupe de Yale(17), qui a réalisé un suivi longitudinal de 304 patients présentant un anévrysme thoracique, a démontré que le taux de croissance annuel des anévrysmes thoraciques était de 0,1 cm par an. Cependant, la croissance était plus marquée dans les anévrysmes de l’aorte thoracique descendante (0,19 cm par an) que ceux impliquant l’aorte ascendante (0,07 cm par an). De surcroît, les anévrysmes disséqués évoluaient également plus rapidement (0,14 cm par an) que les anévrysmes non disséqués (0,09 cm par an). Enfin, la même étude a démontré que le risque relatif de dissection ou de rupture des anévrysmes thoraciques mesurant entre 5.0 et 5.9 cm est de 2.5, et de 5.2 quand leur diamètre dépasse 6 cm. En cas de maladie de Marfan associée, le risque relatif est de 3.7, tandis que le sexe féminin est associé à un risque relatif de rupture ou dissection évalué à 2.9.
Figure 6. Reconstruction tridimensionnelle d’un scanner préopératoire mettant en évidence une pathologie anévrysmale de la crosse aortique et de l’aorte thoracique descendante. Issu du registre NOE. Reconstruction réalisée sur le Logiciel Endosize(18).
Les Dissections aortiques chroniques
La survie aux dissections aortiques aiguës marque pour les patients l’entrée dans la dissection aortique chronique. La définition actuelle classifie les dissections aortiques comme étant aigües lorsqu’elles datent de moins de 14 jours, subaigües entre 15 et 90 jours, et chroniques au-delà de 90 jours(19). Elles incluent les patients présentant des dissections de type B chroniques, les patients opérés de dissections de type A avec la persistance d’une dissection en aval de la réparation aortique, et plus rarement, les patients porteurs de dissections de type A chroniques (figure 8).
L’incidence réelle des dissections aortiques est difficile à évaluer, car souvent sous-diagnostiquée. Aux Etats-Unis, elle est estimée à 2.9 nouveaux cas par 100 000 habitants par an, avec au moins 7000 cas de dissections aortiques par an(20). Dans une étude récente(21), englobant l’ensemble de la population islandaise entre 1992 et 2013, les auteurs démontrent que l’incidence des dissections aortiques aigües de l’aorte thoracique était de 2,53 nouveaux cas par 100 000 habitants par an. Dans ce même travail, les auteurs rapportent un âge moyen des nouveaux cas de 66.9 +/- 13.6 ans, et que 66% des dissections aortiques aigües de l’aorte thoracique recensées étaient de type A selon la classification de Stanford (figure 7). Enfin, 17,6% des patients sont décédés avant leur prise en charge hospitalière, 21.4 % des patients arrivés à l’hôpital sont décédés dans les 24 heures suivant leur admission, et 45.2 % des patients arrivés à l’hôpital sont décédés dans les 30 jours suivant leur prise en charge. Les décès liés aux dissections aigües de l’aorte thoracique sont liés à des facteurs bien élucidés(22): la rupture aortique, la tamponnade, l’insuffisance aortique aigüe ou la malperfusion cérébrale/viscérale.
D’après les données de l’IRAD(23) (International Registry of Acute Aortic Dissections), la survie à 3 ans des patients survivant à une dissection aortique de type B aigüe traités médicalement, chirurgicalement ou par voie endovasculaire est de 77.6%, 82.8% et 76.2%, respectivement. Concernant les dissections aortiques de type A(24), les données de l’IRAD suggèrent une survie à 3 ans de 90,3% des patients franchissant le cap aigu.
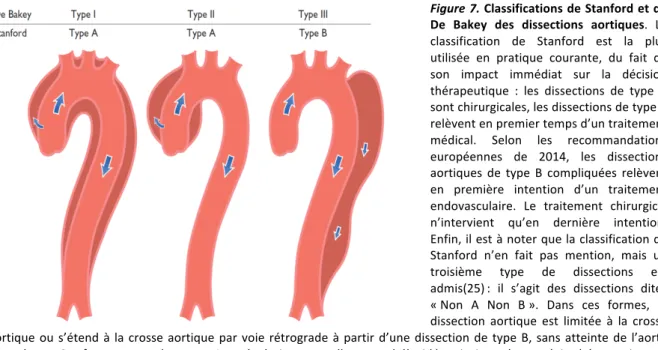
Figure 7. Classifications de Stanford et de
De Bakey des dissections aortiques. La classification de Stanford est la plus utilisée en pratique courante, du fait de son impact immédiat sur la décision thérapeutique : les dissections de type A sont chirurgicales, les dissections de type B relèvent en premier temps d’un traitement médical. Selon les recommandations européennes de 2014, les dissections aortiques de type B compliquées relèvent en première intention d’un traitement endovasculaire. Le traitement chirurgical n’intervient qu’en dernière intention. Enfin, il est à noter que la classification de Stanford n’en fait pas mention, mais un troisième type de dissections est admis(25) : il s’agit des dissections dites « Non A Non B ». Dans ces formes, la dissection aortique est limitée à la crosse aortique ou s’étend à la crosse aortique par voie rétrograde à partir d’une dissection de type B, sans atteinte de l’aorte ascendante. Ces formes sont plus rares. Leur évolution naturelle est mal élucidée, ainsi que la stratégie thérapeutique la plus adaptée(25). Extrait de (19).
Figure 8. Reconstruction tridimensionnelle d’un scanner préopératoire chez un patient porteur d’une dissection aortique chronique à la suite d’une dissection aortique de type A opérée. Patient du registre NOE. Reconstruction réalisée sur le logiciel Endosize(18).
3. Vascularisation et ischémie médullaires
L’ischémie médullaire est une complication redoutable survenant dans les suites des FET(26–28). L’étude de la vascularisation médullaire et des facteurs de risque associés à l’ischémie médullaire est donc primordiale.
La moelle épinière est vascularisée par deux artères spinales postérieures et une artère spinale antérieure, discontinues sur la longueur du rachis ; elles sont issues des artères vertébrales, mais, dès la région médiothoracique, elles ne reçoivent que des apports étagés par 2 à 3 artères intercostales, et 1 à 2 artères ilio-lombaires. Les artères spinales postérieures sont plexiformes et forment un réseau continu, alors que l’artère spinale antérieure est un long vaisseau unique et discontinu qui nourrit les cornes antérieures motrices de la moelle ; ces dernières sont donc plus à risque en cas d’interruption du flux sanguin. Au niveau médiothoracique (D4-D9), la vascularisation dépend étroitement d’un vaisseau nourricier majeur, l’artère d’Adamkiewicz (arteria radicularis magna), issue entre D9-D12 dans le 70% des cas, le plus souvent à gauche, mais dont l’origine peut s’étendre de D5 à L2(29,30). La vascularisation médullaire est néanmoins redondante : c’est la théorie du « collateral network ». Randall Griepp la résume en trois points dans une publication récente(31): d’une part, il existe un réseau axial de petites artères dans le canal rachidien, dans les tissus péri-vertébraux et les muscles périmédullaires qui s’anastomosent entre elles, ainsi qu’avec les artères nourricières de la moelle épinière. D’autre part, ces artères nourricières incluent non seulement les artères segmentaires mais également les artères sous-clavières ainsi que les artères hypogastriques et leurs branches respectives (figure 9). Enfin, Ce réseau peut augmenter le débit de l’une de ses sources en cas de réduction de débit d’une autre source, ou le réduire si une voie alternative opposant moins de résistances se développe. Conséquemment, des phénomènes de vol vasculaire ne sont pas exclus.
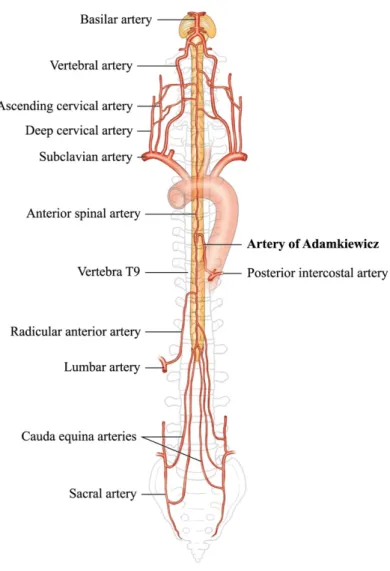
Figure 9. Collatéralité de la vascularisation
médullaire. En dehors des artères segmentaires, la vascularisation médullaire est également assurée par de multiples collatéralités, notamment sous-clavières et hypogastriques. Extrait de (32).
L’ischémie médullaire est une terrible complication, bien connue dans la chirurgie des anévrysmes thoraco-abdominaux, où elle peut affecter jusqu’à 22% des patients(33). Trois mécanismes principaux, isolés ou associés, sont mis en cause(33) :
• Le plus important est l’interruption permanente de la vascularisation médullaire par sacrifice d’une ou plusieurs artères intercostales ou lombaires, donnant naissance à une artère radiculomédullaire.
• Même en cas d’interruption temporaire de la vascularisation médullaire, une ischémie prolongée peut entraîner une paraplégie.
• Toute hypotension ou hypoxie per- ou postopératoire importante ou prolongée peut contribuer à l’ischémie médullaire.
Concernant la chirurgie de la crosse et de l’aorte thoracique descendante, les patients bénéficiant d’une trompe d’éléphant conventionnelle sont exposés à un faible risque d’ischémie médullaire, rapporté selon différentes séries entre 0 et 2.8%(34,35). Inversement, dans les premières séries de FET, cette complication tant redoutée était rapportée dans plus de 20% de cas(27). De multiples facteurs de risque ont été identifiés, notamment l’excès de couverture de l’aorte thoracique descendante, et donc l’occlusion des artères intercostales et segmentaires. Ce dernier facteur n’est pas exclusif ; en effet, dans les séries de réparation purement endovasculaire de l’aorte thoracique descendante, (TEVAR - thoracic endovascular aortic repair), l’ischémie médullaire n’est rapportée que dans 0 à 8,3% des cas, malgré le sacrifice souvent important d’artères intercostales(28).
Ces données sont corroborées par une étude autopsique sur 2 patients ayant présenté une paraplégie consécutive à une FET(26). Miyairi y démontre que dans les deux cas, l’artère d’Adamkiewicz n’était pas occluse par le stent de la prothèse. L’occlusion des artères segmentaires n’explique donc pas à elle seule l’ischémie médullaire. D’autres facteurs entrent donc en jeu, notamment lorsqu’ils compromettent la collatéralité médullaire. Ainsi, nous savons que par le biais du sacrifice des artères hypogastriques et/ou lombaires, les patients ayant pour antécédent une chirurgie de l’aorte abdominale sont exposés à un risque plus élevé d’ischémie médullaire lors des interventions intéressant l’aorte thoracique descendante(28) . Il en est de même pour les patients ayant eu un sacrifice de l’artère sous-clavière gauche, plus exposés au risque d’ischémie médullaire(36)..
Le drainage du liquide céphalo-rachidien reste quant à lui une mesure controversée(37) dans la prévention et le traitement de l’ischémie médullaire.
4. Histoire de la chirurgie aortique
Les défis liés à la chirurgie de la crosse aortique sont tels que cette discipline, comme nous la connaissons, est âgée d’à peine plus de 60 ans. Cependant, l'Histoire de ses fondations - notre compréhension de l’histoire naturelle des pathologies aortiques, notre connaissance de l'anatomie, et les fondements de nos pratiques chirurgicales actuelles – est millénaire.
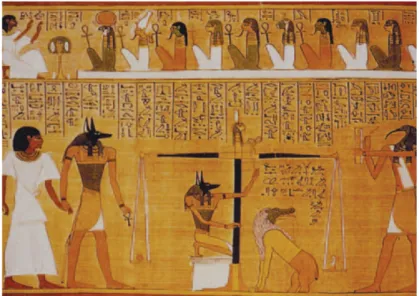
Nous savons aujourd’hui que dans l’antiquité, les Egyptiens souffraient de pathologies aortiques : des signes d’athérosclérose ont été mis en évidence sur des momies. Il est également démontré que les Egyptiens avaient conscience de l’existence des anévrysmes, au moins périphériques. Le papyrus d’Ebers (figure 10), datant de 1500 ans avant notre ère, les décrit comme étant des « tuméfactions des vaisseaux… hémisphériques… qui battent sous les doigts… ». Néanmoins, le manuscrit suggère que ces maladies devaient être traitées uniquement par des incantations, et exhorte le médecin à ne pas abandonner son patient.
Figure 10. Un passage du Papyrus d’Ebers, datant de 1500 ans avant JC, et vraisemblablement le premier document médical mentionnant la pathologie anévrysmale. Extrait de (11).
Au 2e siècle avant notre ère, Galien enrichit cette description des anévrysmes, tandis que son contemporain Antyllus réfléchissait à leurs étiologies : il distinguait les anévrysmes post-traumatiques, souvent sacciformes et asymétriques, des anévrysmes fusiformes ou cylindriques qu’il attribuait à la syphilis ou à d’autres pathologies chroniques(11).
Antyllus fut même le premier à suggérer le traitement des anévrysmes périphériques par ligature proximale et distale, puis évacuation du contenu du sac anévrysmal. Cette technique restera la référence jusqu’au 18e siècle(38).
Les premières descriptions détaillées des anévrysmes aortiques remontent à la renaissance, à l’ère où les dissections anatomiques devenaient des pratiques acceptables. En 1542, Jean François Fernel publiait son œuvre « De extremis corporis Affectibus », dans laquelle il distinguait les anévrysmes externes (périphériques) des anévrysmes internes (aortiques). Son contemporain, Antoine Saporta, à Montpelier, décrivait les symptômes d’une rupture d’anévrysme aortique fatal. A ce titre, l’une des premières descriptions précises de dissection aortique aigüe est celle qui emporta le roi George II d’Angleterre, en 1760, faite par son médecin personnel Nicholls.
Pendant des siècles, le repos, le jeûne, la restriction hydrique demeuraient le traitement par défaut des anévrysmes aortiques. Ambroise Paré, au 16e siècle, écrivait : « les anévrysmes survenant dans les parts internes du corps sont incurables ».
Entre les 16e et 19e siècles, de multiples théories ont cherché à décrire la genèse des anévrysmes aortiques. Les siècles suivants donneront d’ailleurs raison à certaines ; en 1876, Francis Welch présentait une série d’autopsies de 53 patients porteurs d’anévrysmes thoraciques et dont les deux tiers présentaient des signes patents de syphilis, tandis que parmi 106 patients indemnes de syphilis, il ne retrouvait à l’examen post-mortem qu’un seul anévrysme thoracique(39).
La causalité de la syphilis tertiaire dans la genèse des anévrysmes thoraciques devenait alors communément admise.
Au 19e siècle, Antonio Scarpa suggérait que la dégénérescence athéromateuse avait une implication dans la formation des anévrysmes aortiques. Mais jusqu’à cette époque, toutes les tentatives restèrent vaines, et l’espérance de vie des patients opérés d’anévrysmes aortiques se limitait au mieux à quelques jours.
En 1902, Théodore Tuffier obtenait un premier succès, éphémère, dans la prise en charge d’un anévrysme sacciforme de la crosse aortique, mais sa patiente décédera deux semaines plus tard.
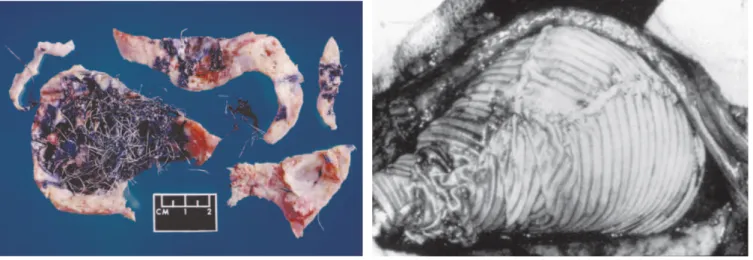
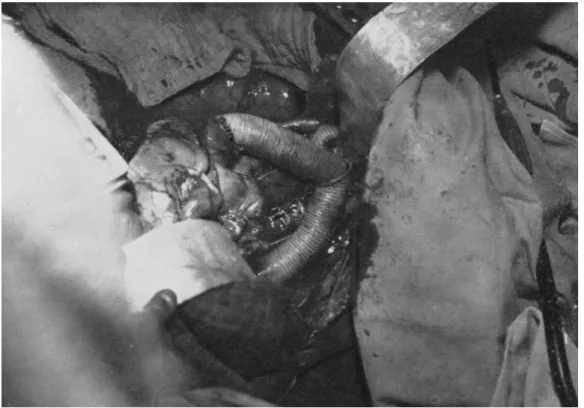
Jusqu’à la moitié du 20e siècle, la grande majorité des tentatives de réparation des anévrysmes aortiques demeurait sans franc succès, avec des techniques peu reproductibles et aux résultats aléatoires (Figure 11). Figure 11. Deux illustrations de techniques décrites dans la réparation des anévrysmes aortiques. A gauche, photographie post-mortem d’un anévrysme thoracique rompu, traité initialement par introduction de filaments d’acier pour en promouvoir la fibrose. A droite, photographie d’un anévrysme thoracique traité par wrapping dans du papier cellophane pour en limiter l’expansion et prévenir la rupture, selon la technique de Pope (1946). Extraits de (11).
En 1951, lors d’une conférence de la « Southern Surgical Society », Denton Cooley et Michael DeBakey devenaient les premiers chirurgiens à préconiser la résection chirurgicale des anévrysmes aortiques. Parmi les cas qu’ils présentent, figure celui d’une résection d’un anévrysme sacciforme de l’aorte ascendante et de la crosse aortique (2) (figure 12). Figure 12. Cas clinique rapporté par DeBakey et Cooley en 1951, présentant la résection d’un anévrysme sacciforme de l’aorte ascendante et de la crosse aortique. Radiographie préopératoire, schéma de l’intervention, et photographie de la cicatrice postopératoire. Extrait de (2)
Ce premier succès sera le moteur d’une décennie prolifique en chirurgie aortique. En 1952, Schafer décrit l’utilisation de shunts en polyéthylène pour permettre le clampage, la résection et le remplacement de segments artériels vitaux(40). Ses travaux permettront en 1955 à Cooley et DeBakey de réaliser le premier remplacement total de la
crosse aortique en utilisant des shunts provisoires entre les troncs supra-aortiques(3) (figure 2). Le patient décédera néanmoins six jours plus tard, vraisemblablement d’ischémie
cérébrale. Deux ans plus tard, l’adjonction de la circulation extra-corporelle (CEC), la machine de Gibbon(41), sera à l’origine du premier véritable succès de Cooley et DeBakey
dans le remplacement chirurgical d’une crosse aortique, en 1957(42).
Les années suivantes seront marquées par autant d’évolutions – et de révolutions – qui viendront améliorer la prise en charge des pathologies de la crosse aortique :
• En 1953, DeBakey introduisait l’utilisation des prothèses en Dacron pour le remplacement segmentaire aortique.
• En 1968, description de la technique de réimplantation en îlot des troncs supra
aortiques par Bloodwell(43).
• En 1975, Griepp introduisait l’utilisation de l’arrêt circulatoire en hypothermie
profonde en chirurgie aortique(44).
• Dans les années 1980, Frist redémontrait l’intérêt des techniques de perfusion
cérébrale dans la chirurgie de la crosse aortique(45).
Néanmoins, la complexité technique de la chirurgie de la crosse aortique en limitait encore les résultats. En outre, les voies d’abord restaient délabrantes. Bien que permettant une large exposition sur l’ensemble de la crosse aortique et l’aorte thoracique descendante proximale, ces voies d’abord faisaient peser à elles seules une morbidité supplémentaire – notamment pariétale et respiratoire – sur les patients. La thoracotomie bi-sous-costale (clamshell), voie d’abord de choix à cette époque, en est le parfait exemple (figure 13).
Figure 13. Photographie de 1959 : Vue en fin d’intervention d’un remplacement total de la crosse aortique, par bi-thoracotomie sous-costale. Cette voie d’abord offre effectivement une excellente exposition sur la crosse aortique, mais aux prix d’un délabrement pariétal important. Extrait de (46).
5. La trompe d’éléphant conventionnelle : l’œuvre de Hans Borst
En 1983, le Dr. Hans-Georg Borst décrit la trompe d’éléphant conventionnelle(6) à Hanovre, technique opératoire en deux étapes. Le premier temps, un abord par sternotomie médiane classique permet l’accès et la réparation de l’aorte ascendante et de la crosse aortique. Lors de cette première intervention, une prothèse en Dacron est utilisée pour le remplacement de la crosse aortique. La prothèse est invaginée, et introduite de manière antérograde dans l’aorte thoracique descendante. Elle est ensuite suturée au niveau de l’isthme aortique, puis désinvaginée, permettant de réaliser la réimplantation des TSA, tandis que l’autre portion de la prothèse flotte dans l’aorte thoracique descendante proximale. C’est d’ailleurs cet aspect qui lui vaudra son surnom de trompe d’éléphant (Figures 14 et 15). Figure 14. Résultat du premier temps chirurgical de la trompe d’éléphant conventionnelle telle que décrite par Borst en 1983. La portion de prothèse en Dacron flottant dans l’aorte thoracique descendante proximale rappelle en effet un aspect de trompe d’éléphant. Extrait de (6). Le deuxième temps opératoire, réalisé à quelques semaines du premier, est réalisé par thoracotomie postéro-latérale gauche. Cette voie permet un abord direct de l’aorte thoracique descendante, où la portion de Dacron flottante est récupérée, puis anastomosée avec la prothèse utilisée pour le remplacement de l’aorte thoracique descendante.
Figure 15. Technique chirurgicale de la trompe d’éléphant conventionnelle. A. La prothèse est invaginée. B. Elle est ensuite introduite de manière antérograde dans l’aorte thoracique descendant. C. Suture du moignon aortique distal. D. Désinvagination de la prothèse. E. Réimplantation des troncs supra-aortiques, ici en palette. Extrait de (10).
La trompe d’éléphant conventionnelle a donc grandement facilité la chirurgie de la crosse aortique, mais a soulevé deux problématiques(8) : d’une part, la mortalité cumulée liée à deux interventions majeures, atteignant 50% dans certaines séries, ainsi que le grand nombre de patients ne revenant pas pour le 2e temps opératoire. Ces limites à la technique soulèveront donc la nécessité d’une alternative chirurgicale en un temps.
6. L’avènement des thérapeutiques endovasculaires
La naissance des endoprothèses aortique remonte aux années 1970, en union soviétique. A Kharkov, Nicholas Volodos développait la première endoprothèse et en décrit la première implantation humaine en 1985 pour le traitement d’une sténose iliaque(47). La première implantation aortique abdominale suivit, en 1987. En 1990, Parodi transposait l’expérience de Volodos, réalisant le premier EVAR (Endovascular aortic repair) dans le monde occidental(48).
En 1994, à Stanford, Dake fut le premier à décrire l’utilisation des endoprothèses aortiques à l’étage thoracique, sur une série de 13 patients(49). Les endoprothèses qu’il décrit sont constituées d’un endosquelette en acier réparti en Z, recouvert d’un tube en Dacron. L’ensemble était déployé par voie transfémorale, sous contrôle fluoroscopique (figure 16).
Figure 16. Première description d’une endoprothèse aortique thoracique par Dake. A gauche, stent en acier utilisé comme endosquelette de la prothèse. En bas, image fluoroscopique avant et après implantation d’une endoprothèse pour le traitement d’un anévrysme de l’aorte thoracique descendante. Extrait de (49).
7. La trompe d’éléphant hybride – The Frozen elephant trunk a. Prothèses aortiques hybrides
Deux ans seulement après Dake, en 1996, Kato décrit pour la première fois l’utilisation d’une prothèse aortique hybride « homemade », destinée au traitement des pathologies de la crosse aortique. La prothèse qu’il décrit est composée d’un portion stentée couverte, identique à une endoprothèse aortique, mais ancrée dans une prothèse vasculaire en polyester(5), et implantée par sternotomie. D’autres prothèses hybrides « homemade » seront ensuite décrites par différents centres. Le principe chirurgical reste toutefois le même, et est décrit dans un chapitre ultérieur.
La prothèse Chavan-Haverich®(50) fut la première prothèse « homemade » utilisée par
le groupe de Hanovre avant l’invention de la prothèse E-Vita open®. Elle est composée d’une
portion proximale non stentée en dacron, associée à une portion distale stentée, avec un stent en acier réparti sous forme de Z (figure 17). Figure 17. A gauche, la prothèse aortique hybride Chavan-Haverich, du nom de ses deux inventeurs du groupe de Hanovre ; elle n’a jamais été commercialisée. A droite, son système de largage, introduit de manière antérograde dans l’aorte thoracique descendante. Extrait de (51).
En 2007, le groupe de Hanovre décrit la prothèse E-Vita Open®, qui sera la première
prothèse commercialisée en Europe et en Amérique du nord destinée aux procédures de FET. Son évolution, la prothèse E-Vita Open plus® a elle récemment reçu le marquage CE, en
juin 2014(51). Le chapitre suivant y est consacré. Nous citerons par ailleurs les autres prothèses hybrides les plus utilisées dans le monde(51):
• Cronus (MircoPort, Shanghai, Chine), utilisée majoritairement en Asie et Amérique du Sud, mise au point par Sun en 2003.
• Thoraflex (Vascutek, Inchinnan, Ecosse), mise au point en 2012 par Shrestha à Hanovre.
• J Graft Open (Japan Lifeline, Tokyo, Japon), mise au point en 2014 par Kato. Il s’agit en réalité de l’évolution de la première prothèse hybride qu’il avait lui-même décrit en 1996 (figure 18). • • Figure 18. Prothèses aortiques hybrides les plus utilisées dans le monde en dehors de la prothèse E-Vita Open plus®. En
haut, la prothèse Cronus®, en bas, la prothèse J Graft Open®, et à droite, la prothèse Thoraflex®. Extrait de (51)
b. La prothèse E-Vita Open plus® La prothèse hybride E-Vita Open plus® est composée d’une endoprothèse basée sur une structure métallique en nitinol recouverte de PET (Polyéthylène téréphtalique), et d’une prothèse vasculaire en polyester, tissée d’un seul tenant, et invaginée dans l’endoprothèse. L’endoprothèse et la prothèse vasculaire sont disponibles en diamètres entre 20 et 40mm. L’endoprothèse est disponible en 3 longueurs (130, 150 ou 160mm), tandis que la prothèse vasculaire existe en deux longueurs (50 ou 70mm). Les diamètres proximal et distal sont identiques. Outre la variété de tailles disponibles, la prothèse E-Vita Open Plus® se
distingue de sa version antérieure par un traitement imperméabilisant de la prothèse vasculaire, assurant une meilleure étanchéité. Plus récemment, la prothèse a bénéficié du rajout d’une collerette de suture située à la jonction entre les deux prothèses permet de simplifier la suture distale (figure 19). Figure 19. Caractéristiques techniques de la prothèse hybride E-Vita Open plus. Extrait de http://www.jotec.com/files/media/pdf/EN/Brochure%20E-vita%20OPEN%20PLUS%20%28EN%29.pdf
Concernant le système d’introduction, celui-ci présente à son extrémité un nez souple et court pour en faciliter le placement, tandis qu’un manchon textile de protection en assure la progression. Celle-ci est également favorisée par le cathéter armé, ainsi que les marqueurs radio-opaques sur l’endoprothèse qui permettent un déploiement précis, sous contrôle fluoroscopique. Le largage est quant à lui basé sur une technique « squeeze to release». Figure 20. Système de déploiement de la prothèse E-Vita Open plus. Extrait de http://www.jotec.com/files/media/pdf/EN/Brochure%20E-vita%20OPEN%20PLUS%20%28EN%29.pdf
8. Chirurgie de la crosse aortique en 2016 a. Indications
Du fait de la faible prévalence des pathologies isolées de la crosse aortique, leur histoire naturelle est moins bien connue que le reste des segments aortiques. Les données des recommandations européennes et américaines dans la prise en charge des pathologies chroniques de la crosse aortique sont donc calquées sur les indications liées aux segments adjacents.
Figure 21. Recommandations européennes et américaines concernant la prise en charge des anévrysmes de la crosse aortique. Dans les deux recommandations, la taille retenue portant l’indication chirurgicale est de 55mm. A noter, sur les recommandations américaines, datant de 2010, la trompe d’éléphant conventionnelle est toujours la technique de référence dans le remplacement total de la crosse aortique. Extrait de (13,19).
b. Technique chirurgicale
Ce chapitre décrit la technique chirurgicale d’implantation d’une prothèse E-Vita Open plus® dans une procédure de FET. La technique d’implantation est toutefois adaptée au
cas par cas. Dans notre série, aucun protocole n’a été imposé pour la réalisation de ces procédures au sein des différents centres.
La voie d’abord des FET est une sternotomie médiane verticale classique, pouvant s’étendre vers le haut pour faciliter la dissection des troncs supra-aortiques. A noter, l’exposition peut nécessiter la ligature et section du tronc veineux innominé, ce qui est sans conséquence clinique en dehors d’un œdème du membre supérieur gauche dans 5 à 10% des cas, et spontanément régressif en quelques jours. La cannulation axillaire droite est la cannulation de choix pour ces procédures. Elle présente en effet de nombreux avantages. L’artère peut être abordée dans le sillon delto-pectoral droit ou sous la clavicule droite, et cannulée soit directement soit par l’interposition termino-latérale d’une prothèse vasculaire de 10mm de diamètre. Elle permet une perfusion antérograde, ainsi que le maintien d’une perfusion carotidienne droite pendant l’arrêt circulatoire.
La cannulation fémorale est techniquement plus simple, mais présente plusieurs limitations. Contrairement à l’artère axillaire, l’artère fémorale est souvent intéressée par les processus athéromateux et disséquants. Le risque est alors double, la cannulation du faux chenal, potentiellement catastrophique en départ de CEC, ou l’embolisation athéromateuse liée à la perfusion rétrograde. Enfin, la méconnaissance d’une sténose iliaque sus-jacente peut empêcher l’obtention d’un débit artériel adéquat en cours de CEC.
Après le départ de la CEC, le refroidissement systémique est entrepris. Pendant ce temps, dissection de la crosse aortique et contrôle des TSA.
Ce temps permet également la réalisation d’un éventuel geste cardiaque associé (remplacement valvulaire, pontage, préparation de la racine aortique…). Une fois le refroidissement achevé, arrêt circulatoire, ouverture de la crosse aortique et mise en place d’une canule carotidienne gauche pour obtenir une perfusion cérébrale antérograde bilatérale. Départ de la cérébroplégie, à 10ml/kg/min. La sous-clavière gauche peut être également perfusée ou simplement clampée.
L’étape suivante est la découpe de l’ilot des troncs supra-aortiques, et la résection du reste de la crosse aortique. Crosse ouverte, l’endoprothèse est alors déployée de manière antérograde dans l’aorte thoracique descendante. En cas de cannulation fémorale, un guide peut être introduit par l’artère fémorale jusqu’à la crosse aortique, où il sera récupéré au moment du déploiement de l’endoprothèse. Cela permet, dans le cas des dissections aortiques, de s’assurer du déploiement de la prothèse dans le vrai chenal.
Ensuite, la prothèse est suturée au niveau de l’isthme aortique à l’aide de la collerette de suture. Une vigilance particulière à deux éléments est ici nécessaire : l’hémostase, du fait de la difficulté de retourner dans cette zone ultérieurement, ainsi que le risque de lésion du nerf récurrent gauche.
La prothèse vasculaire est ensuite désinvaginée de l’endoprothèse par le biais d’un fil tracteur.
L’étape suivante est donc la réimplantation des troncs supra-aortiques, après découpe de la prothèse vasculaire. Généralement faite en bloc, la réimplantation des TSA peut également se faire à l’aide de pontages séparés, notamment lorsqu’ils sont disséqués.
Enfin, la prothèse vasculaire est purgée puis clampée. La CEC est alors reprise à débit normal, et le réchauffement est entrepris. Il reste alors la réimplantation de la prothèse vasculaire sur l’aorte ascendante.
Contrairement à la procédure conventionnelle décrite par Borst, lors de des FET, en fin d’intervention, le stent dans l’aorte thoracique descendante ne flotte plus dans l’aorte thoracique descendante mais se fige, ressemblant à une trompe d’éléphant gelée, ce qui lui vaudra son surnom : the frozen elephant trunk (figure 22).
Figure 22. Représentation artistique d’une FET, utilisant une prothèse Thoraflex®. L’aspect du stent de l’endoprothèse
stentée dans l’aorte thoracique descendante évoque effectivement de trompe d’éléphant gelée. Extrait de http://www.annalscts.com/article/view/2713
c. Etat de l’art
Ce chapitre recense les techniques chirurgicales majeures dans la prise en charge des pathologies de la crosse aortique, en dehors de la trompe d’éléphant conventionnelle et de la FET, décrites plus haut. Il permet, en outre, de replacer la technique de FET dans un contexte plus large de thérapeutiques des pathologies de la crosse aortique.
Le remplacement de la crosse aortique par bi-thoracotomie antérieure (clamshell) C'est la première voie d'abord qui fut employée dans la chirurgie de la crosse de l'aorte. Elle a connu récemment un regain d'intérêt avec la technique dite « arch first technique »(52). Cette ouverture donne un jour extrêmement large sur l'ensemble de l'aorte thoracique et le cœur (figure 13), ainsi que sur l'origine des troncs supra-aortiques, permettant une multitude de gestes combinés. Toutefois, les artères mammaires internes sont sacrifiées du fait de la voie d’abord. Cette voie d’abord reste très lourde immédiatement et dans ses suites. En effet, l'ouverture des deux plèvres, le saignement associé à cette large ouverture, la déstabilisation de la statique thoracique et la douleur liée à la thoracotomie entraînent très souvent une ventilation prolongée avec son cortège de complications.
La bi-thoracotomie antérieure reste toutefois la technique de référence dans certains centres. Kouchoukos à Saint-Louis (Missouri, Etat-unis), rapportait en 2015 une série de 118 patients traités pour des pathologies chroniques de la crosse aortique par clamshell incision, avec une mortalité opératoire de 2,9%, un taux d’AVC de 1,5%, et surtout un taux d’ischémie médullaire de 0,8%(53). Ces résultats exceptionnels sont liés à une longue expertise de Kouchoukos dans cette technique, mais aussi à une hyper-sélection des patients, ainsi que l’exclusion des pathologies aortiques aigües, incompatibles avec cette voie d’abord.
La chirurgie hybride de la crosse aortique
La mortalité et la morbidité liées au remplacement de la crosse aortique chez les patients à haut risque opératoire a par ailleurs poussé à la mise au point de techniques de reconstruction hybrides. Ces thérapeutiques partent du concept que la crosse aortique représente, du fait de sa morphologie et de la naissance des troncs supra-aortiques, un milieu hostile au déploiement de procédures purement endovasculaires. En réalité, la problématique est surtout celle du collet proximal d’une part, et de la navigation dans les troncs supra-aortiques d’autre part.
Pour obtenir un collet proximal, l’approche hybride associe une transposition (debranching) d'un ou de plusieurs troncs supra-aortiques suivie par l'exclusion endovasculaire de la lésion. La transposition permet donc de créer une zone d'ancrage proximal adéquate pour l'implantation de l'endoprothèse tout en préservant la perfusion cérébrale et des membres supérieurs (figure 23).
Figure 23. Exemples de procédures hybrides de la crosse aortique. A gauche, transposition chirurgicale des trois troncs supra-aortiques sur l’aorte ascendante par une prothèse trifuquée, puis déploiement endovasculaire jusqu’en zone 0. A droite, pontage extra-anatomique carotido-sous-clavier gauche associé à une transposition prothétique de la carotide gauche, puis déploiement endovasculaire jusqu’en zone 1. Extrait de l’EMC – Chirurgie hybride de la crosse aortique.