ANNIE GAGNON
L'EFFET D'UN SUPPLEMENT COMBINE D'ACIDE
FOLIQUE ET DE VITAMINE B12 SUR LE
FOLLICULE DOMINANT OVARIEN CHEZ LA
VACHE LAITIÈRE EN PÉRIODE POSTPARTUM
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en sciences animales
pour l'obtention du grade de Maître es sciences (M.Sc.)
DEPARTEMENT DES SCIENCES ANIMALES
FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2012
Résumé court
L'objectif de ce projet était de déterminer l'effet d'un supplément combiné d'acide folique (320 mg) et de vitamine B12 (10 mg) sur le développement du follicule dominant ovarien chez la vache laitière en période postpartum. Des injections intramusculaires hebdomadaires de vitamines ont été données à partir de la troisième semaine prévêlage jusqu'à la neuvième semaine postvêlage. Suite à la ponction transvaginale d'un follicule
dominant, le volume de liqueur folliculaire récolté était plus grand chez les vaches ayant reçu des injections de vitamines. L'analyse de l'expression génique des cellules de la granulosa des follicules dominants (diamètre > 12 mm) menée sur la biopuce bovine d'EmbryoGENE indique que le traitement entraîne une faible expression des gènes associés au cycle cellulaire et une expression plus élevée des gènes associés à l'ovulation. Enfin, les résultats suggèrent que les cellules de la granulosa étaient plus différenciées en raison d'une probable amélioration du métabolisme énergétique au cours de la période postpartum chez les vaches traitées.
Ill
Abstract
The present experiment was undertaken to determine the effects of folic acid and vitamin B12 on the gene expression of granulosa cells from the dominant follicle of lactating dairy cows. Cows received weekly intramuscular injections of 320 mg folic acid and 10 mg of vitamin B12 or phosphate buffered saline 0.9%. Injections began three weeks before calving until 9 weeks after calving. The dominant follicle > 12 mm was punctured on day 57 postpartum. Follicular fluid quantities were higher in cows that received injections of vitamin B12 and folic acid. Hybridation of granulosa cells on EmbryoGENE microarray slides indicated that the treatment resulted in a lower expression of genes associated with cell cycle and a higher expression of genes associated with ovulation. Finally, results suggest that dominant follicles of cows given vitamin B12 and folic acid undergo an earlier cell differentiation compared to control cows, probably due to an improvement of energy metabolism during the postpartum period.
Avant-propos
Mon projet de maîtrise a demandé l'implication et la contribution de plusieurs personnes exceptionnelles. Je tiens à remercier tout d'abord mon directeur de maîtrise Jean-Paul Laforest et mon codirecteur François Richard qui ont élaboré le projet subventionné par l'Action concertée FQRNT-Novalait-MAPAQ. Je voudrais remercier Jean-Paul Laforest pour son enseignement et son expertise tout au long de mon projet de maîtrise. Je le remercie tout particulièrement pour son sens de la diplomatie et de son écoute. Je voudrais aussi remercier François Richard pour son enthousiasme, sa disponibilité et son expertise. Son optimisme dans les moments plus difficiles a été très précieux. Je voudrais aussi remercier toute son équipe pour leur accueil et leur soutien dans le laboratoire. De plus, le réseau EmbryoGENE a été omniprésent dans la réalisation de mon projet de maîtrise. J'aimerais remercier le codirecteur du réseau EmbryoGENE Marc-André Sirard pour sa collaboration et ses idées innovatrices. Je voudrais aussi remercier toute son équipe de professionnels et d'étudiants qui a été d'une aide exceptionnelle. Je remercie tout particulièrement les professionnelles Julie Nieminen, Isabelle Dufort, Isabelle Gilbert et les étudiantes Audrey Bunel et Anne-Laure Nivet.
Je tiens à remercier toute l'équipe du centre de recherche en sciences animales de Deschambault (CRSAD), en particulier son directeur Pierre Baril, Marie Vachon, Marie-Ève Tremblay et aussi les ouvriers Mathieu et Alain. Je voudrais aussi remercier Danny Pellerin, le conseiller en nutrition animale de l'Université Laval et le vétérinaire Louis Picard qui ont collaboré au projet. De plus, je voudrais remercier, celle que j'ai surnommée la maman de mon projet de maîtrise, Christiane Girard, d'Agriculture et Agroalimentaire Canada, pour sa collaboration au projet.
Personnellement, je remercie les étudiants et les professionnelles des laboratoires voisins pour leur enthousiasme et leur soutien. Je voudrais aussi remercier toute ma famille qui n'a cessé de s'élargir tout au long de ma maitrise pour son soutien et son amour. Pour conclure, je remercie tous mes amis pour leurs extravagances et leurs folies quotidiennes.
Table des matières
RÉSUMÉ COURT II ABSTRACT Ill AVANT-PROPOS IV TABLE DES MATIÈRES V
LISTE DES FIGURES IX LISTE DES ABRÉVIATIONS X
SECTION 1 : INTRODUCTION 1 SECTION 2 : REVUE DES TRAVAUX ANTÉRIEURS 2
SECTION 2.1 LA PHYSIOLOGIE OVARIENNE CHEZ LA VACHE 2
Section 2.1.1 Dynamique du follicule ovarien chez la vache 2
Section 2.1.2 Développement folliculaire ovarien 2 Section 2.1.3 Régulation de l'axe hypothalamo-hypophysaire-ovarien et la synthèse
des stéroïdes sexuels chez le bovin 5
2.1.3.1 L'axe hypothalamo-hypophysaire-ovarien 5 2.1.3.2 La synthèse des stéroïdes sexuels chez le bovin 6 Section 2.1.4 Recrutement, sélection et dominance d'un follicule ovarien 7
2.1.4.1 Le recrutement folliculaire 7 2.1.4.2 La sélection folliculaire 8 2.1.4.3 La dominance folliculaire 8
Section 2.1.5 Le processus de l'ovulation 9
2.1.5.1 Le déclenchement de la cascade signalétique 9 2.1.5.2 La vascularisation du follicule préovulatoire 10
2.1.5.3 Le système rénine-angiotensine 10
2.1.5.4 Expansion du cumulus 11
2.1.5.5 L'inflammation 11 2.1.5.6 Prostaglandines 11 2.1.5.7 La rupture du follicule 12
Section 2.1.6 Processus physiologiques et transcriptionnels dans les cellules de la
granulosa 12
2.1.6.1 Les processus physiologiques et transcriptionnels dans les cellules de la
granulosa au moment de la sélection d'un follicule ovarien 12 2.1.6.2 Les processus physiologiques et transcriptionnels dans les cellules de la
granulosa d'un follicule pré ovulatoire 13 SECTION 2.2 LE MÉTABOLISME ÉNERGÉTIQUE 14
Section 2.2.1 Etablir les principales sources d'énergie chez la vache laitière 75
2.2.2.1 L'état de chair 16 2.2.2.2 La mobilisation des lipides 17
2.2.2.3 Des protéines dégradables et des protéines non dégradables par le rumen... 17
2.2.2.4 Les hormones métaboliques 18
2.2.2.5 La leptine 18 2.2.2.6 Réponses inflammatoires 18
Section 2.2.3 Les effets du métabolisme énergétique sur la reproduction 19
2.2.3.1 Les vaches hautes productrices de lait 19 2.2.3.2 Mobilisation des réserves tissulaires 19
2.2.3.3 L'urée 20 2.2.3.4 La leptine 20 2.2.3.5 L'état de chair 21 2.2.3.6 Le facteur IGF-1 21 2.2.3.7 La progestérone 22 SECTION 2.3. INTERVENTION NUTRITIONNELLE CHEZ LES BOVINS LAITIERS 22
Section 2.3.1 Stratégie nutritionnelle pré et post-partum qui influencent l'efficacité
métabolique et la fertilité chez la vache laitière 22
2.3.1.1 L'effet d'une sous-alimentation 23
2.3.1.2 Nutrition glycogénique 23 2.3.1.3 Nutrition lipogénique 23 2.3.1.4 Nutrition glycogénique et lipogénique 24
2.3.1.5 Une carence en minéraux 24
2.3.1.6 Les protéines 25 SECTION 2.4 VITAMINE B12 ET DE L'ACIDE FOLIQUE 25
Section 2.4.1 La structure chimique de l'acide folique et de la vitamine B12 25 Section 2.4.2 Le rôle de la vitamine B12 et de l'acide folique sur le cycle de la
methionine 26 Section 2.4.3 Le rôle de la vitamine B12 et de l'acide folique sur le métabolisme
énergétique 29 Section 2.4.4 La régulation transcriptionnelle des gènes du cycle de la methionine et
du métabolisme énergétique 31 Section 2.4.5 Le rôle de la vitamine B12 et de l'acide folique sur la physiologie
ovarienne 32 Section 2.4.6 Les effets de l'acide folique et de la vitamine B12 sur le métabolisme
chez la vache laitière 33
SECTION 2.5 HYPOTHÈSE ET OBJECTIFS 34
SECTION 3 ARTICLE 35 SECTION 3.1 ABSTRACT 36 SECTION 3.2 INTRODUCTION 37 SECTION 3.3 MATERIALS AND METHODS 39
Vil
Section 3.3.1 Animals and treatment 39
Section 3.3.2 Blood sampling and dosage of progesterone, œstradiol, LH and FSH... 42 SECTION 3.3.3 BLOOD SAMPLING AND DOSAGE OF B12, UREA, NEFA, GLUCOSE AND
BHBA 42
Section 3.3.3 Oestrous cycle synchronization and aspiration of granulosa cells 43
Section 3.3.4 RNA extraction and microarray hybridization 45
Section 3.3.5 Analysis of microarray slides 45
Section 3.3.6 RT-QPCR 46 Section 3.3.7 Statistical Analysis 48
SECTION 3.4 RESULTS 49
Section 3.4.1 Microarray data analyses 53 Section 3.4.2 Validation by RT-QPCR 56
SECTION 3.5 DISCUSSION 59 SECTION 3.6 DECLARATION OF INTEREST 64
SECTION 3.7 FUNDING 64 SECTION 3.8 ACKNOWLEDGEMENT 64
SECTION 4 CONCLUSION GÉNÉRALE 65
Liste des tableaux
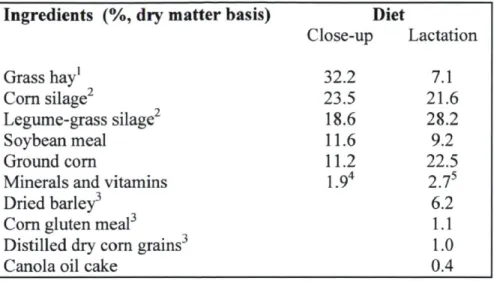
Table 3.1 Ingredients of the diets fed to dairy cows 40 Table 3.2 Composition of the diets fed to dairy cows 41 Table 3.3 Primer sequences used for RT-QPCR 47 Table 3.4 Plasma concentrations of vitamin B12, folates, glucose, NEF A, BHBA, urea and
dry matter intake 52 Table 3.5 Microarray data analyses 55
IX
Liste des figures
Figure 2.1 Présentation schématisée des diverses composantes histologiques du follicule
antral ovarien chez la vache 3 Figure 2.2 Représentation schématique du rôle de l'acide folique et de la vitamine B12
dans le métabolisme de la methionine et les principales fonctionnalités de cette voie dans la
cellule 27 Figure 2.3 Représentation de l'entrée du propionate dans le cycle de Krebs et l'implication
de la vitamine B12 en tant que cofacteur dans cette voie métabolique 30
Figure 3.1 Schematic representation of experiment 44 Figure 3.2 Volume of follicular fluid collected individually 50
Figure 3.3 Serum concentrations of progesterone, -estradiol-170, LH and FSH 51 Figure 3.4 Microarray data analyses were performed by limma (log fold change 1.25x and
adjusted p-value threshold 0.05) 54 Figure 3.5 Validation by RT-QPCR 57 Figure 3.6 Validation by RT-QPCR 58
ADAM 17 La disintégrine avec un domaine de métalloprotéase 17 (ADAM metallopeptidase domain 17)
ADAMTS-1 La disintégrine et un domaine de métalloprotéase à motif semblable à la thrombospomdine 1 (A disintegrin and metalloproteinase with thrombospondin motifs 1)
AMPc L ' adenosine monopho sphate cyclique Ang II L'angiotensine II
ATP L'adenosine-5'-triphosphate BHBA P-hydroxybutyrate
CYP11 Al Le cytochrome P450 coupant la chaîne latérale du cholestérol (Cytochrome P450, family 11, subfamily A, polypeptide 1)
CYP17 Le cytochrome P450 17a hydroxylase/C 17-20 lyase CYP19 Le cytochrome P450 aromatase
DAG Le diacylglycerol
DHEA La déhydroépiandrostérone
EGF Le facteur de croissance épidermique (Epidermal growth factor)
EGFRLs Les ligands du récepteur du facteur de croissance épidermique (Epidermal growth factor receptor ligands)
EGR1 Le facteur de croissance à la réponse hâtive 1 (Early growth response protein 1)
ERK Les kinases qui régulent le signal extracellulaire (Extracellular signal-regulated kinases)
FSH L'hormone folliculo-stimulante (Follicle-stimulating hormone)
GMPc La guanosine monophosphate cyclique
XI
GH L'hormone de croissance (Growth hormone)
3P-HSD Le 3P-hydroxystéroide déshydrogénase ID L'inhibiteur de differentiation
IGF-1 Le facteur de croissance semblable à l'insuline 1 (Insulin-like Growth Factor 1)
IGF-2 Le facteur de croissance semblable à l'insuline 2 (Insulin-like Growth Factor 2)
IGFBP La protéine liant le facteur de croissance semblable à l'insuline (Insulin-like growth factor-binding protein 1)
IP3 L'inositol triphosphate
LH L'hormone lutéinisante (Luteinizing hormone)
MAPK La protéine kinase activée par des mitogènes (Mitogen-activatedprotein (MAP) kinases)
NEFA Les acides gras non estérifiés (Non-esterifiedfatty acids)
PGE2 La prostaglandin E2 PGF2 a La prostaglandin F2a
PKA La protéine serine kinase A dépendante à l'AMPc (cAMP-dependent Protein Kinase)
PKC La protéine serine threonine kinase calcium dépendante (Protein kinase C) (Transforming growth factor R)
PTGS2 La prostaglandine-synthase endopéroxyde 2 (Prostaglandin-endoperoxide synthase 2)
PTX3 La pentraxine 3
SLC19A1 Le transporteur de folate 19A1 (Solute carrier family 19, member 1) SP La protéine spécifique (Specificity protein)
STAR La protéine qui régule la stéroïdogenèse aiguë (Steroidogenic acute regulatory)
THF Le tétrahydrofolate
TIMP1 L'inhibiteur de métalloprotéase tissulaire (Tissue inhibitor of metalloproteinase 1)
TNFAIP6 Le facteur de la nécrose tumorale alpha inducteur de la protéine 6 (Tumor necrosis factor alpha induced protein 6)
TGF(3 Le facteur de croissance transformant béta
VEGF Le facteur de croissance des cellules endothéliales vasculaires ( Vascular endothelial growth factor)
Section 1 : Introduction
Au Québec, les producteurs laitiers valorisent les vaches ayant une production laitière élevée. Le début de la lactation correspond au moment pour lequel la production de lait est la plus grande. Les besoins nutritionnels de la vache augmentent alors de façon spectaculaire pour la synthèse du lait. Particulièrement, durant la période postpartum, les vaches ayant une production de lait élevée auront un bilan énergétique négatif et prendront plusieurs semaines à récupérer suite au pic de lactation. La longueur et l'intensité du bilan énergétique négatif varient en fonction de la valeur génétique, la condition physique avant le vêlage, la production laitière, la prise alimentaire et le type de nutrition.
Plusieurs facteurs liés à un bilan énergétique négatif ont un impact sur la fertilité de la vache laitière. Il y a été montré qu'un déficit énergétique prolongé peut affecter le développement folliculaire, le développement du corps jaune et aussi la qualité de l'ovocyte chez la vache. Afin d'élaborer des stratégies permettant de diminuer la carence énergétique et ainsi améliorer la fertilité des vaches laitières, des récentes recherches ont fait ressortir qu'un supplément injectable d'acide folique et de vitamine B12 a un effet positif sur le métabolisme énergétique en début de lactation.
Ce mémoire de maîtrise s'amorce par une revue de la littérature sur de la physiologie ovarienne, le métabolisme énergétique, les effets d'un déficit énergétique sur la fertilité, les stratégies nutritionnelles utilisées afin d'améliorer la fertilité de la vache et un aperçu des fonctions de la vitamine B12 et de l'acide folique. Il se poursuivra par la présentation et la discussion de résultats d'un projet de recherche qui consistait à déterminer l'effet d'un supplément injectable d'acide folique et de vitamine B12 sur le fonctionnement du follicule dominant ovarien chez la vache laitière. Le tout se termine par une courte conclusion.
Section 2.1 La physiologie ovarienne chez la vache
Section 2.1.1 Dynamique du follicule ovarien chez la vache
L'ovaire a pour rôle d'assurer la production des cellules germinales et les sécrétions des œstrogènes et de la progestérone. La zone corticale de l'ovaire est gorgée de follicules tandis que la médulla centrale est principalement formée d'innervation et de vaisseaux sanguins et lymphatiques. Au moment de la puberté, le système reproducteur de la vache est régulé par des cycles œstraux ovariens réguliers (aucun anœstrus saisonnier). La puberté s'amorce autour de l'âge de 12 mois et la durée du cycle ovarien est de l'ordre de 21 jours chez la vache. Le cycle ovarien se divise en deux phases; une phase folliculaire et une phase lutéale. La phase folliculaire correspond à la période de fin de la croissance folliculaire jusqu'à l'ovulation (2 à 5 jours). La phase lutéale débute après l'ovulation et s'achève avec la régression du ou des corps jaunes (15 à 19 jours) (Driancourt & Levasseur 2001).
Section 2.1.2 Développement folliculaire ovarien
La formation d'un ovocyte débute au stade embryonnaire et se termine à la rupture de la vésicule germinale. Le développement ovocytaire ne peut se faire sans une étroite relation avec les cellules qui l'entourent. Le follicule ovarien subit plusieurs transformations morphologiques, physiologiques et biochimiques afin de permettre la maturation de l'ovocyte.
Le développement ovocytaire débute très tôt au stade embryonnaire. Les cellules germinales primordiales vont coloniser les gonades embryonnaires et se différentier en ovogonies. Les cellules germinales primordiales se divisent par plusieurs mitoses pendant toute la vie embryonnaire. Elles entrent en première division de la méiose au moment de la vie foetale. La première division de la méiose se déroule jusqu'au stade diplotène de la prophase 1. L'ovocyte s'entoure d'une couche de cellules aplaties et reste à ce stade de la méiose jusqu'au moment de sa sélection pour l'ovulation. L'ovocyte reste relativement quiescent alors que les cellules qui l'entourent sont en plein développement. Le premier
Cellules de la granulosa L'antre folliculaire Cellules du cumulus Ovocyte Zone pellucide Cellules de la thèque
MM
A W t t K
Figure 2.1 Présentation schématisée des diverses composantes histologiques du follicule antral ovarien chez la vache.
cubique monostratifié et puis un epithelium pluristratifié. Les cellules de la granulosa les plus proximales à l'ovocyte vont conserver leur morphologie épithéliale cubique et prendront le nom de corona radiata ou cellules du cumulus. La zone pellucide, une couche mucoprotéique, se forme entre les cellules du cumulus et l'ovocyte. Au cours de la croissance folliculaire bovine, le nombre de cellules de la granulosa va doubler 21 fois (24±2 jusqu'à 40 millions de cellules) (van Wezel & Rodgers 1996). Il a été observé qu'il y a des variations de l'indice mitotique et de la longueur de chaque division cellulaire au cours de la croissance folliculaire (Lussier et al. 1987). Une reprogrammation des cellules du stroma ovarien se produit autour du follicule qui se différencie en deux couches distinctes qui se nomment thèque interne et thèque externe. La thèque interne est constituée de cellules épithéliales et la thèque externe de cellules conjonctives et musculaires. Les vaisseaux sanguins du stroma ovarien migrent à travers les deux couches de la thèque jusqu'à la membrane basale qui sépare les cellules de la granulosa et de la thèque. Les cellules de la granulosa resteront avasculaires (Schams & Berisha 2002). Un antrum va se former grâce à une accumulation de liquide résultant des sécrétions de la granulosa, de la thèque et d'une exsudation plasmatique. L'ovocyte, entouré de sa zone pellucide et des cellules du cumulus, se localise dans un pôle de 1'antrum. Des jonctions communicantes assurent la communication entre les cellules de la granulosa, les cellules du cumulus et l'ovocyte. Les jonctions assurent le couplage ionique des cellules, mais également le passage de petites molécules (poids moléculaire inférieur à 1 kDa). Le syncytium électrophysiologique composé des connexines 37 et 43 permet une communication entre l'ovocyte et les cellules du cumulus (Nuttinck et al. 2000). Les facteurs inhibiteurs de la méiose sont synthétisés par l'ovocyte ou par les cellules somatiques et transférés à l'ovocyte (Tripathi et al. 2010). Le follicule prend alors le nom de follicule secondaire ou antral (Figure 2.1). Le volume de l'antre augmente considérablement au moment de la phase terminale du développement du follicule. À ce stade, le follicule se nomme le follicule préovulatoire. Chez la vache, son diamètre varie entre 15 et 20 mm. La croissance des follicules préantraux est très lente, par contre la croissance terminale des follicules s'effectue en quelques jours. La première indication de la reprise de la méiose de
l'ovocyte est la disparition de la membrane nucléaire et la condensation de la chromatine. Au moment de l'ovulation, la première division conduit à la maturation de l'ovocyte et à l'émission du premier globule polaire. La méiose est achevée pendant la fécondation et un ovule mature est obtenu après l'émission du deuxième globule polaire.
Section 2.1.3 Régulation de l'axe hypothalamo-hypophysaire-ovarien et la synthèse des stéroïdes sexuels chez le bovin
2.1.3.1 L'axe hypothalamo-hypophysaire-ovarien
L'hypothalamus est une région de l'encéphale localisée sous le thalamus dans le cerveau. Les hormones hypothalamiques exercent un contrôle sur l'activité adénohypophysaire. Les gonadolibérines (GnRH) induisent la libération des hormones adénohypophysaires. Les axones des neurones à GnRH se projettent dans la zone externe de l'éminence médiane. L'artère hypophysaire supérieure de l'éminence médiane forme un réseau de capillaires complexe constitué de deux plexus. Ces vaisseaux sont qualifiés de vaisseaux portes, car ils apportent à l'adénohypophyse du sang veineux en provenance de l'hypothalamus. Lors de son passage dans l'hypothalamus, le sang s'est appauvri en oxygène, en nutriments et enrichi en hormones hypothalamiques libérées dans l'éminence médiane. Le système porte hypothalamo-hypophysaire permet donc le passage direct des hormones hypothalamiques vers leurs cellules cibles adénohypophysaires à des concentrations bien plus élevées que dans la circulation systémique. La GnRH atteint l'adénohypophyse sous forme de « puises » via le système porte hypothalamo-hypophysaire. Un puise est une montée rapide des concentrations plasmatiques suivie d'une diminution exponentielle liée à la demi-vie de l'hormone. L'hypophyse est localisée dans la selle turcique, une dépression osseuse à la base du cerveau. Elle est divisée en deux zones anatomiquement distinctes : une zone glandulaire qui se nomme l'adénohypophyse et une zone constituée de fibres nerveuses qui se nomme la neurohypophyse. Les hormones neurohypophysaires sont des neuropeptides tels que l'ocytocine et la vasopressine. L'adénohyphyse a pour rôle de maintenir l'homéostasie, la croissance corporelle et la reproduction. Elle sécrète des substances telles que l'hormone de croissance (GH), l'hormone adrénocorticotrope, la prolactine, la
germinales et endocrines. Elles sont des molécules glycoprotéiques constituées de 2 unités différentes appelées a et p qui sont associées par des liens non covalents. Les sous-unités a de la LH et de la FSH sont identiques tandis que les sous-sous-unités P sont spécifiques à chacune de ces hormones gonadotropes. La FSH et la LH exercent un rôle sur la stéroïdogenèse. Elles mobilisent le cholestérol à partir des gouttelettes lipidiques et l'entrée du cholestérol dans les mitochondries. Elles stimulent aussi la transcription des gènes qui codent pour les enzymes de la stéroïdogenèse et stimulent la sécrétion des stéroïdes sexuels. Les stéroïdes sexuels exercent un rétrocontrôle négatif des sécrétions de la LH et la FSH par l'hypophyse et des sécrétions de la GnRH par hypothalamus. L'inhibine, la follistatine et l'activine sont des peptides sécrétés par les cellules de la granulosa. L'inhibine et la follistatine inhibent les sécrétions tandis que l'activine active les sécrétions de la FSH. La follistatine peut se fixer à l'activine et bloquer la stimulation des sécrétions de la FSH. De plus, le facteur de croissance semblable à l'insuline 1 (IGF-1), le facteur de croissance semblable à l'insuline 2 (IGF-2), la protéine liant le facteur de croissance semblable à l'insuline (IGFBP) et le facteur de croissance transformant bêta (TGFP) modulent l'effet des sécrétions de la FSH et de la LH (Lefèvre 2001).
2.1.3.2 La synthèse des stéroïdes sexuels chez le bovin
Les cellules de la thèque interne et les cellules de la granulosa sont responsables de la stéroïdogenèse dans le follicule ovarien. Ces deux types de cellules diffèrent par la nature de leurs récepteurs et de leurs activités enzymatiques. L'action de la FSH est restreinte aux cellules de la granulosa, car tous les autres types cellulaires n'ont pas de récepteur de FSH. La LH exerce son action sur les cellules de la thèque, les cellules de la granulosa et sur le corps jaune. Par contre, les récepteurs de la LH apparaissent seulement au stade folliculaire préovulatoire dans les cellules de la granulosa (Moon et al. 1978). Le pic de la FSH, qui est médié par l'élévation de l'adénosine monophosphate cyclique (AMPc), induit l'expression du récepteur de la LH dans les cellules de la granulosa (Sanders & Midgley 1983). Les enzymes tels que le cytochrome P450 17a hydroxylase/C 17-20 lyase (CYP17), le cytochrome P450 coupant la chaîne latérale du cholestérol (CYP11A1) et le 3p~ hydroxystéroide déshydrogène (3P-HSD) transforment le cholestérol plasmatique en
androgènes. Les androgènes sont les hormones sexuelles mâles produites par les testicules, mais également par les surrénales et les ovaires. La testosterone, la déhydroépiandrostérone (DHEA) et l'androstènedione sont les principaux androgènes connus. Les cellules de la granulosa du follicule dominant bovin expriment les enzymes du CYP11 A, le HSD3B2 et du cytochrome P450 aromatase (CYP19) et non le CYP17 (Bao & Garverick 1998). Les androgènes diffusent donc dans les cellules de la granulosa et sont transformés en
-estradiol-17P ou en progestérone (Moon et al. 1978). L'oestradiol-17p détermine l'apparition des caractères sexuels secondaires femelles et induit un rétrocontrôle en stimulant la production d'androgènes par les cellules de la thèque (Tsang et al. 1979, Roberts & Skinner 1990). Le pic de LH induit une augmentation significative de l'expression génique du récepteur de la progestérone dans les cellules de la granulosa et induit la lutéinisation (Cassar et al. 2002). La progestérone sécrétée par le corps jaune agit sur l'utérus et permet maintien de la gestation.
Section 2.1.4 Recrutement, sélection et dominance d'un follicule ovarien
Chez le bovin, deux ou trois vagues de croissance folliculaire ovarienne sont observées au cours d'un cycle œstral. Le développement folliculaire se fait en vagues de croissance coordonnée de plusieurs follicules antraux de 3 à 5 mm selon les fluctuations de sécrétions d'hormones (Evans et al. 2003). Une vague de croissance folliculaire se produit à tous les 7 à 10 jours au cours d'un cycle œstral chez le bovin. Il a été montré que les cycles de 3 vagues de croissance folliculaires ont une phase lutéale plus longue que les cycles à deux vagues de croissances folliculaires (Sirois & Fortune 1990). Chez les espèces monoovulantes comme le bovin, un seul follicule dominant sera sélectionné à partir de plusieurs follicules antraux. La LH et la FSH vont réguler les processus de recrutement, de sélection et de dominance en modulant l'action des hormones sexuelles2.1.4.1 Le recrutement folliculaire
Une augmentation de la fréquence des puises de la FSH a été répertoriée 1 à 2 jours avant le
début de la vague folliculaire et la fréquence des puises diminue au moment de la déviation du follicule dominant et des follicules subordonnés (follicules 6-7 mm) (Adams, Matteri et
al. 1992). La croissance des follicules recrutés entraine une augmentation de la production folliculaire de l'œstradiol-17p et de l'inhibine. L'œstradiol-17p et l'inhibine exercent alors une faible rétroinhibition de la FSH (Ginther et al. 2000, Mihm & Bleach 2003). Tous les follicules recrutés augmenteront de diamètre jusqu'au moment de la sélection folliculaire. 2.1.4.2 La sélection folliculaire
La sélection débute lorsque la concentration de la FSH est suffisamment faible qu'elle ne peut induire le recrutement (Adams et al. 1992). Le recrutement de nouveaux follicules va cesser, le follicule sélectionné va continuer à croitre. La mort des cellules de la granulosa est l'un des premiers indicateurs d'atrésie folliculaire. Une diminution de la taille du follicule et une accumulation de pycnoses (grains de chromatine condensée) dans les cellules de la granulosa sont les signes morphologiques d'un follicule en atrésie. Tous les follicules en santé produiront un ratio d'oestrogènes et d'androgènes plus élevé que les follicules atrétiques (Moor et al. 1978, Carson et al. 1981). Physiologiquement, il y aura une diminution de l'activité enzymatique de l'aromatase qui entraine une baisse de la production d'œstradiol-17p. La fin de la sélection coïncide avec la déviation folliculaire. La déviation est le moment à partir duquel le follicule dominant continue sa croissance et que les follicules subordonnés régressent par manque de la FSH chez le bovin (Ginther et al. 1996). Le follicule dominant continue sa croissance grâce à l'expression du récepteur de la LH et de la 3P-HSD dans les cellules granulosa (Bao & Garverick 1998). La LH périphérique va permettre le développement terminal du follicule.
2.1.4.3 La dominance folliculaire
Au moment où les follicules ont atteint un diamètre plus grand que 7,0 mm chez la vache, le follicule dominant va continuer à croitre tandis que les follicules subordonnés vont régresser (Ginther et al. 2001). Un follicule est considéré dominant lorsqu'il atteint un diamètre de plus de 8,5 mm. Durant la phase lutéale, la progestérone est sécrétée par le corps jaune. Une injection de prostaglandine F2a (PGF2a) induit une lutéolyse. La chute de la concentration de progestérone est associée à une augmentation des puises de LH et une persistance du follicule dominant bovin (Sirois & Fortune 1990). Une concentration élevée de progestérone induit une réduction de la fréquence des puises de la LH et une perte de dominance de follicule. La vague de croissance folliculaire se termine au moment de l'ovulation ou lors de l'atrésie du follicule dominant.
Section 2.1.5 Le processus de l'ovulation
L'ovulation consiste en la libération d'un ovocyte mature après la rupture du follicule dominant. L'élément déclencheur de la cascade signalétique ovulatoire est une libération massive de puises de la GnRH qui induit une libération massive de puises de la LH et de la FSH par l'hypophyse. Ceux-ci provoquent des changements structuraux et biochimiques qui conduisent à la rupture du follicule.
2.1.5.1 Le déclenchement de la cascade signalétique
Une élévation de la FSH et de la LH induit une élévation de la concentration d'AMP cyclique (AMPc). Le récepteur de la LH couplé à une protéine G stimule l'adénylyl cyclase qui produit de l'AMPc à partir de l'adenosine-5'-triphosphate (ATP). Chez le lapin, une élévation de la concentration sanguine de la LH induit une augmentation rapide de la concentration d'AMPc (Selstam et al. 1976) et une diminution de la concentration de la guanosine monophosphate cyclique (GMPc). L'AMPc, le principal second messager du récepteur de la LH, va induire les voies signalétiques de la protéine serine kinase A dépendante à l'AMPc (PKA) et les kinases qui régulent le signal extracellulaire (ERK) et les protéines kinases activées par des mitogènes (MAPK) dans les cellules du follicule. La phosphodiesterases 4D et la phosphodiesterase 8A régulent le taux d'AMPc dans les cellules de la granulosa bovine (Tsafriri et al. 1996, Sasseville et al. 2009). L'AMPc via la PKA induit l'expression génique de CYP11A et la synthèse de la progestérone (Oonk et al. 1990). L'angiotensine II peut aussi activer la voie de la PKC qui induit l'expression génique des facteurs de croissance épidermiques (EGF-like peptides) (l'épiréguline, la bêta-celluline et l'amphiréguline) qui sont essentiels au processus ovulatoire (Hsieh et al. 2007). Les facteurs EGF-like peptides sont des médiateurs paracrines qui propagent le signal de la LH dans le follicule ovarien (Park et al. 2004). L'activation des voies métaboliques de l'AMPc et de la PKC vont conduire à la reprise de la méiose et à la rupture folliculaire (Yoshimura et al. 1992a, Yoshimura et al. 1992b). La reprise de la méiose est permise par la fermeture des jonctions communicantes entre les cellules de la granulosa et l'ovocyte qui supprime l'action de facteurs inhibiteurs qui y transitent. La reprise de la méiose ou la maturation ovocytaire est une étape essentielle pour l'ovocyte en vue de la fécondation.
2.1.5.2 La vascularisation du follicule préovulatoire
Les couches de cellules de la thèque possèdent un fin réseau de capillaires jusqu'à la membrane basale sous les cellules de la granulosa. Une augmentation de la synthèse de l'oxyde nitrique par l'oxyde nitrique synthase induit une vasodilatation des vaisseaux sanguins. Le facteur activateur plaquettaire et le facteur de croissance des cellules endothéliales vasculaires (VEGF) induisent un accroissement de la perméabilité vasculaire. De plus, l'angiotensine II (Ang II), l'endothéline-1 et le peptide natriurétique auriculaire sont des peptides vasoactifs qui modulent le tonus vasculaire dans la circulation systémique. L'augmentation du flux sanguin induit une augmentation de la diffusion à travers les cellules. Les nutriments et les hormones se rendront plus rapidement par diffusion jusqu'aux cellules de la granulosa. Des changements locaux dans le flux sanguin dans l'ovaire sont étroitement liés à la biosynthèse des prostaglandines et des stéroïdes (Murdoch etal. 1986).
2.1.5.3 Le système rénine-angiotensine
Plusieurs études indiquent un rôle direct du système rénine-angiotensine et plus particulièrement de l'Ang II dans l'ovulation (Pellicer et al. 1988). Une inhibition de l'Ang II bloque le processus de l'ovulation. De plus, le taux d'ovulation est significativement plus faible lorsqu'un antagoniste des récepteurs à Ang II est injecté dans le follicule (Ferreira et al. 2007). La concentration Ang II augmente dans la liqueur folliculaire du follicule dominant pendant et après la déviation folliculaire chez le bovin (Ferreira et al. 2011b). Des études récentes ont montré que l'Ang II est impliquée dans la régulation des gènes ayant un rôle dans la sécrétion de l'œstradiol-17P et la différenciation des cellules de la granulosa chez le bovin. Elle induit une augmentation de l'expression des EGF-like peptides, de la disintégrine avec un domaine de métalloprotéase 17 (ADAM17) (Portela et al. 2011) et de la prostaglandine-synthase endopéroxyde 2 (PTGS2) chez le bovin. Une injection de la saralasine, un antagoniste compétitif de l'angiotensine II, fait diminuer la concentration de l'œstradiol-17P dans le liqueur folliculaire, l'expression génique de CYP19A1, de la 3fi-hydroxystéroïde déshydrogénase, du récepteur de la LH, et de la cycline D2 dans les cellules de la granulosa bovine (Ferreira et al. 2011a) Pour conclure, le système rénine-angiotensine via la PKC est impliqué dans la reprise de la méiose induite par un pic de la LH dans les ovocytes bovins (Barreta et al. 2008).
11
2.1.5.4 Expansion du cumulus
Les cellules du cumulus prendront de l'expansion en réponse au pic de LH grâce à la matrice extracellulaire. Les cellules du cumulus ont la capacité de synthétiser et de sécréter une matrice extracellulaire d'acide hyaluronique. L'acide hyaluronique induit un fort appel d'eau dans le follicule et accroit la pression hydrostatique à l'intérieur du follicule. La formation d'espace entre les cellules du cumulus permet au complexe ovocyte-cumulus de se détacher de la granulosa et d'être expulsé au moment de l'ovulation. Le facteur de la nécrose tumorale alpha inducteur de la protéine 6 (TNFAIP6) et la pentraxine 3 (PTX3) participent à la consolidation de l'acide hyaluronique entre les cellules du cumulus (Salustri et al. 2004, Russell & Robker 2007).
2.1.5.5 L'inflammation
La décharge préovulatoire de la FSH et de la LH provoque la rupture du follicule par l'intermédiaire d'une forte augmentation d'AMPc capable d'induire une réaction inflammatoire localisée. L'histamine, la bradykinine, la prostaglandin E2 (PGE2) et la PGF2a induisent une cascade de réactions protéolytiques. La progestérone dont la sécrétion est stimulée par la décharge gonadotrope limite l'importance de la réaction inflammatoire et permet la transformation du follicule en corps jaune (Rae et al. 2004).
2.1.5.6 Prostaglandines
Les prostaglandines sont synthétisées à partir de l'acide arachidonique des phospholipides membranaires. L'acide arachidonique est oxydé par la cyclooxygénase 2 dans l'ovaire afin de donner les endopéroxydes qui sont à l'origine des prostaglandines. Le processus ovulatoire est totalement bloqué après une injection intraovarienne d'un inhibiteur de la synthèse des prostaglandines (l'indométacine) (De Silva & Reeves 1985). Une augmentation de l'AMPc stimule la production de prostaglandines. De plus, les prostaglandines ont un rôle essentiel dans l'inhibition de la synthèse du collagène facilitant ainsi la rupture folliculaire. La PGE2 joue un rôle crucial dans le processus de l'ovulation en régulant le débit sanguin du réseau vasculaire des cellules de la thèque. Les cellules de la granulosa et du cumulus ont les récepteurs de PGE2 (2 et 4) capables d'induire la rupture de la paroi folliculaire et l'expansion du cumulus (Takahashi et al. 2006). De plus, la PGF2a facilite la libération d'hydrolases lysosomiales par les cellules de l'épithélium ovarien.
2.1.5.7 La rupture du follicule
La décharge de la FSH et de la LH préovulatoire induit aussi la dégradation de la matrice extracellulaire et plus particulièrement de la décomposition du maillage de fibres de collagène. La progestérone induit l'expression de la disintégrine et un domaine de métalloprotéase avec un motif qui aime la thrombospomdine (ADAMTS-1) et de la cathepsine L. Ce sont deux proteases qui participent activement à la rupture de la matrice extracellulaire. De plus, il a été monté que l'inactivation génétique du récepteur de la progestérone bloque l'ovulation (Robker et al. 2000). La désintégration de l'apex du follicule provoque sa rupture et ainsi sa rupture.
Section 2.1.6 Processus physiologiques et transcriptionnels dans les
cellules de la granulosa
L'expression génique est un processus biologique par lequel l'ADN est lu et transcrit en ARN afin de générer la fabrication de molécules qui auront un rôle actif dans le fonctionnement cellulaire. La transcription permet la synthèse de quatre types d'ARNs (ARN ribosomal, ARN messager, ARN de transfert et autre ARNs non codants). L'expression génique permet de connaître l'activité cellulaire de chaque type de cellules à un stade précis de son développement. Dans les cellules de la granulosa, l'expression génique est finement orchestrée. Les processus de sélection et de dominance folliculaire sont régulés par la LH et la FSH qui modulent l'action de l'œstradiol-17p, de la progestérone et de l'inhibine. Ils induisent des changements moléculaires et une réorganisation physiologique et morphologique. Ces fonctions vont permettre aux cellules de la granulosa de se différentier, d'induire la rupture folliculaire et de se transformer en corps jaune.
2.1.6.1 Les processus physiologiques et transcriptionnels dans les cellules de la granulosa au moment de la sélection d'un follicule ovarien
Avant la sélection folliculaire, les cellules de la granulosa sont indifférenciées. Les cellules de la granulosa sont pratiquement incapables de produire des stéroïdes, ne contenant qu'une très faible concentration de la progestérone (Tilly et al. 1991). Cette dernière constatation est due en grande partie à l'expression minimale de la protéine qui régule la stéroïdogenèse aiguë (STAR) (Johnson & Bridgham 2001). La sélection d'un follicule se produit à partir
13 d'une cohorte de follicules recrutés de 6 à 8 mm de diamètre chez le bovin. Les cellules de la granulosa expriment le récepteur de la FSH pouvant induire une faible production d'AMPc (Tilly et al. 1991). Le TGFp 1 et l'activine A agissent par l'intermédiaire de la protéine Smad2 qui induit un faible niveau d'expression du récepteur de la FSH dans les cellules de la granulosa. La FSH induit une augmentation de l'expression génique de l'inhibiteur de differentiation (ID) 2 et une diminution de l'expression génique d'IDl, ID3 et ID4. La transfection de ID 2 induit une augmentation significative de l'expression du récepteur de la FSH dans les cellules de la granulosa du follicule sélectionné. Donc, une surexpression de ID2 en présence de la FSH induit une augmentation de l'expression du récepteur de la FSH (Johnson et al. 2008). Une diminution de l'expression génique de la voie de signalisation MAPK/ERK dans les cellules de la granulosa conduit à une diminution de l'expression génique de ID1, ID3 et ID4 et une augmentation de l'expression génique de ID2. Donc, la voie de signalisation MAPK/ERK empêche la différenciation prématurée des cellules de la granulosa. La transition entre les cellules indifférenciées à un état différencié est associée à une augmentation accrue d'AMPc et à l'expression du récepteur de la LH dans les cellules de la granulosa (Woods & Johnson 2007). Lorsque la production d'AMPc induit par la FSH devient suffisante pour amorcer l'expression du récepteur de la LH et la production accrue de progestérone, le développement du follicule devient dépendant de la LH.
2.1.6.2 Les processus physiologiques et transcriptionnels dans les cellules de la granulosa d'un follicule pré ovulatoire
L'AMPc, le principal second messager du récepteur de la LH, va activer la voie signalétique de la PKA et indirectement les voies de la PKC et de la MAPK dans les cellules folliculaires. La LH induit l'expression du récepteur de la progestérone dans les cellules de la granulosa. Les facteurs de transcription, qui se nomment protéine spécifique 1 (SP1) et protéine spécifique 3 (SP3), se lient au promoteur du récepteur de la progestérone et recrutent plusieurs facteurs de transcription (Sriraman et al. 2003). Par exemple, les facteurs de transcription SP1 et SP3 modulent l'expression génique des EGF-like peptides chez la ratte (Sekiguchi et al. 2002). Bref, la LH stimule l'expression de récepteurs et de plusieurs voies signalétiques qui induisent l'expression des gènes tels que ADAMTS-1, cathepsine L, EGF-like peptides et de beaucoup d'autres. Le processus ovulatoire est
complexe et se produit en plusieurs étapes. L'expression génique varie spatiotemporel Iement dans les cellules de la granulosa. En réponse au pic de la LH, les cellules de la granulosa modifient leurs expressions afin de valoriser la réponse à un stimulus, la vascularisation et la synthèse de lipides. La réponse tardive des cellules de la granulosa au pic de la LH révèle une augmentation de l'expression génique des gènes associés à la localisation des protéines et aux transports intracellulaires chez le bovin (Gilbert et al. 2011). Par exemple, le facteur de croissance à la réponse hâtive 1 (EGR1) subit une augmentation d'expression génique 30 minutes après un pic de la LH, tandis que l'expression génique de la PTGS2, l'épiréguline, et le TNFA1P6 vont augmenter de façon spectaculaire 4 heures après un pic de la LH chez la souris (Espey & Richards 2002). Il existe plusieurs types de proteases telles que les métalloprotéases matricielles, les serines proteases et les ADAMTS. Ces proteases dégradent la matrice extracellulaire de l'apex folliculaire au moment de l'ovulation. Les gènes impliqués dans le remodelage de la matrice extracellulaire tels que ADAMTS1 et l'inhibiteur de métalloprotéase tissulaire (TIMP1) vont hausser leurs expressions géniques seulement quelques heures avant l'ovulation (Espey & Richards 2002). Ces proteases participent aussi à la différenciation des cellules de la granulosa en cellules lutéales chez la poule (Johnson & Woods 2009).
Section 2.2 Le métabolisme énergétique
Le métabolisme énergétique regroupe l'ensemble des réactions cellulaires qui induisent la production d'énergie chimique utilisable par la cellule. Les réactions d'oxydoréduction conduisent d'une part à la production de coenzymes réduits et d'autre part à la production d'ATP. Dans la cellule, l'ATP est formée à partir du glucose, de lipides, de certains acides aminés et triglycérides. Chez la vache laitière, ces composants vont provenir de la ration alimentaire ou seront synthétisés par la microflore ruminale.
15
r
Section 2.2.1 Etablir les principales sources d'énergie chez la vache
laitière
Chez la vache, les sources principales de glucides sont les fibres, l'amidon et les sucres solubles. Chez la vache, les sources de glucides de la ration alimentaire vont se transformer en acides gras volatils grâce à la fermentation ruminale. Les principaux acides gras volatils produits sont l'acétate, le propionate et le butyrate. Les composantes de la ration alimentaire qui ne sont pas dégradées par la flore microbienne dans le rumen sont digérées et absorbées par l'intestin afin de fournir des éléments nutritifs lipogéniques ou glycogéniques. L'acétate et le butyrate sont des composés à nombre pair de carbones et sont considérés comme des nutriments lipogéniques. Le propionate est un composé à trois carbones et est considéré comme un nutriment glycogénique (van Knegsel et al. 2007). Il est la principale source de glucose de la ration alimentaire. Le proprionate peut se transformer en oxaloacétate. L'acétylcoenzyme A, un composé lipogénique et l'oxaloacétate, un composé glycogénique vont se transformer en citrate. Le citrate va entrer dans le cycle de Kreb afin de donner de l'ATP à l'organisme. Le cycle de Krebs est la voie métabolique la plus efficace en production d'énergie. De plus, le cycle de Krebs donne le substrat nécessaire à la néoglucogenèse. En début de lactation, l'apport en énergie est plus faible que les besoins énergétiques. Le bilan énergétique négatif se traduit par une mobilisation des réserves corporelles. Les réserves corporelles sont principalement composées de lipides, une source de nutriments lipogéniques. La mobilisation des lipides se traduit par une augmentation de la concentration plasmatique d'acide gras non estérifié (NEF A). Les NEF As peuvent s'oxyder et se transformer en acétyle-coenzyme-A. La forte production de lait en début de lactation nécessite une forte production de lactose. Une augmentation de l'apport de nutriments glycogéniques et une concentration réduite d'insuline permettent la synthèse d'une grande quantité de lactose. Chez la vache ayant un déficit énergétique, les nutriments lipogéniques sont utilisés pour la production de l'acétylcoenzyme A et les nutriments glycogéniques sont utilisés pour la synthèse du lactose. Quand le ratio d'oxaloacétate et d'acétylcoenzyme A est déséquilibré. Il induit une baisse de la production d'ATP. L'acétylcoenzyme A en surplus va induire la synthèse de cétones, d'acétone, d'acétoacétate et de la P-hydroxybutyrate (BHBA). Une forte production de ces composés peut entraîner
une acetonemic L'excès de nutriments lipogéniques va être estérifié ou être entreposé dans le foie sous la forme d'acides gras tels que les triacylglycérides (van Knegsel et al. 2007).
Section 2.2.2 Les effets d'un bilan énergétique négatif
Un bilan énergétique négatif est défini par le fait que la prise d'aliments est inférieure aux besoins de l'animal. En fin de gestation et en début de lactation, les besoins en nutriments augmentent de façon spectaculaire pour la croissance fœtale et la synthèse du lait. La vache laitière est donc incapable de répondre à ses besoins énergétiques seulement par la ration alimentaire. La plupart des vaches vont se retrouver dans une période de bilan énergétique négatif durant la période périnatale et prendront plusieurs semaines pour en sortir. La longueur et l'intensité du bilan énergétique négatif varient en fonction de la génétique, de la condition physique avant le vêlage, de la production laitière et de la prise alimentaire. De plus, cette période est associée à une forte incidence de maladies métaboliques et autres, telles que la fièvre du lait, la rétention placentaire, la métrite, l'acétonémie, le déplacement de la caillette, les boiteries, et la mammite clinique (Kelton et al. 1998). Une carence énergétique a des répercussions sur l'organisme, dont les principaux éléments, qui suit. 2.2.2.1 L'état de chair
L'état nutritionnel ou l'état corporel d'un animal peut être évalués grâce à la cote d'état de chair. Une cote d'état de chair consiste à la notation des animaux sur une échelle de 1 (extrême minceur) à 5 points (obésité), avec parfois des quarts ou des demi-points. Il s'agit d'une palpation ou une inspection visuelle des os du dos et des processus lombaires. Elle reflète très bien les réserves corporelles disponibles pour le métabolisme de base, la croissance, la lactation et l'activité physique. Les vaches avec une cote d'état de chair peu élevée au moment de la parturition utilisent leurs réserves de tissus adipeux pour produire du lait ce qui entraine un bilan énergétique négatif (Garnsworthy & Topps 1982). Une cote d'état de chair élevée au moment du vêlage fait diminuer la prise alimentaire et prédispose les vaches à une diminution rapide de la masse corporelle (Pryce et al. 2001).
17
2.2.2.2 La mobilisation des lipides
Les vaches laitières peuvent s'adapter à une carenceénergétique par la mobilisation des réserves corporelles. La mobilisation des lipides est définie comme un déséquilibre entre la lipogenèse et la lipolyse dans le tissu adipeux. Une série de changements hormonaux de l'insuline plasmatique, des catecholamines, de l'hormone de croissance et des glucocorticoïdes favorise la lipolyse. Lors de la lipolyse, plusieurs lipases vont cataboliser les triglycérols en glycerols et en NEF As (Langin et al. 2005). Un pic de la concentration de triacylglycerols a été observé 7 à 13 jours après le vêlage et diminue progressivement par la suite (Bauman & Bruce Currie 1980). Les NEF As plasmatiques sont principalement composés d'acides gras saturés, dont le palmitate, le stéarate et de l'acide oléique. Les NEF As sont absorbés par le foie. Ils vont être transformés en énergie métabolisable ce qui permet au glucose d'être utilisé pour la croissance du fœtus et la synthèse du lactose. Les NEF As peuvent être oxydés en dioxyde de carbone afin de fournir de l'énergie ou être partiellement oxydés afin de produire des corps cétoniques ou de l'acétate. Le BHBA est la forme prédominante de corps cétoniques dans le sang et sa concentration est un indice de l'oxydation des acides gras. L'oxydation des acides gras permet de maintenir la glycémie en dépit de la concentration élevée de glucose circulante. Au moins 30 % des vaches laitières vont souffrir temporairement d'une acétonémie subclinique dans les premiers mois de lactation (Asl et al. 2011). Chez les vaches laitières, une stéatose hépatique est presque toujours liée à une mobilisation intense des lipides. Une stéatose hépatique est une accumulation de lipides dans le cytoplasme des cellules non adipeuses qui induit une lipotoxicité. L'excès de lipides est stocké sous forme de triglycérides dans le foie et est associé à une l'altération des fonctions métaboliques du foie (Grummer 2008). Elle est généralement précédée par des concentrations élevées des NEFAs dans le plasma.
2.2.2.3 Des protéines dégradables et des protéines non dégradables par le rumen En cas de manque de glucose, une augmentation du catabolisme des acides aminés stockés dans le muscle squelettique et les autres tissus peut créer une source de glucose. Le catabolisme des acides aminés induit la production d'urée. La production d'urée demande énormément d'énergie à l'organisme et accentue le déficit énergétique. De plus, un excès d'ammonium peut causer une hyperglycémie, une hyperkaliemic et une acidose métabolique (Kitamura et al. 2003).
2.2.2.4 Les hormones métaboliques
Les voies de signalisation impliquant la GnRH, l'insuline, le facteur IGF-1 et le glucose modulent la réponse de l'organisme au moment d'un bilan énergétique négatif (Lucy et al. 2001). Il a été montré que les hormones métaboliques et leurs récepteurs modifient leurs actions durant la période postpartum. La demande accrue de glucose après le vêlage conduit souvent à une baisse de l'insuline circulante en début de lactation. Une concentration peu élevée d'insuline favorise l'action directe de la GnRH sur la lipolyse et la néoglucogenèse en début de lactation. Ce n'est pas étonnant que les vaches ayant un haut mérite génétique pour la production laitière présentent une faible concentration d'insuline plasmatique (Bonczek et al. 1988). Le facteur d'IGF-I est considéré comme l'un des principaux médiateurs de la régulation de la synthèse du lait par la glande mammaire. De plus, les vaches ayant un bilan énergétique négatif présentent une diminution de l'expression génique hépatique pour les récepteurs IGF-1 et IGF-2, l'hormone GnRH et l'œstradiol-17p. Une diminution de l'expression génique des IGFBPs (3, 4, 5 et 6) et une augmentation de l'expression génique de IGFBP-2 ont aussi été montrées (Fenwick et al. 2008).
2.2.2.5 La leptine
La leptine est une hormone qui régule l'appétit et les réserves lipidiques dans l'organisme. Elle est une cytokine produite par les cellules lipidiques et sécrétée dans la circulation sanguine. Ses actions principales sont de contrôler la prise alimentaire grâce à son action sur l'hypothalamus et induire une mobilisation des lipides. Chez la vache laitière, sa concentration plasmatique chute en fin de gestation et augmente drastiquement les semaines suivant la parturition. Elle contrôle la prise alimentaire, la mobilisation des lipides et peut aussi contribuer à la résistance à l'insuline chez les ruminants en période péripartum (Ingvartsen & Boisclair 2001).
2.2.2.6 Réponses inflammatoires
Les changements de la composition en lipides plasmatiques associés à la mobilisation des lipides affectent directement l'activité des leucocytes. Au moment de la parturition et en début de lactation, la proportion d'acide palmitique augmente de façon significative dans le plasma. Les acides gras non saturés des phospholipides et les phospholipides à longue chaîne d'acides gras polyinsaturés leucocytaires diminuent. La composition de la membrane plasmique est modifiée et la fonctionnalité des leucocytes peut être diminuée. De plus, la
19 mobilisation des lipides induit directement une lipotoxicité et indirectement des modifications de la signalisation intracellulaire, de l'induction du stress oxydatif et de la biosynthèse des médiateurs lipidiques (Contreras & Sordillo 2011).
Section 2.2.3 Les effets du métabolisme énergétique sur la reproduction Chez les vaches en lactation, il y a arrêt du cycle ovarien après la parturition. Dans un contexte idéal, la vache ira sa première ovulation entre le jour 20 et 30 jours après la parturition. Les producteurs attendent de 1 à 2 cycles œstraux avant de procéder à la première insémination. L'ovule est de meilleure qualité, ce qui augmente les chances de procréation (Walters et al. 2002). Selon une régie de troupeau idéale, la première insémination devrait se faire autour du jour 60 postpartum. Il y a été montré qu'une carence énergétique prolongée peut affecter le développement folliculaire, le développement du corps jaune et aussi la qualité de l'ovocyte chez la vache (Wathes et al. 2003). Plusieurs facteurs métaboliques liés à un bilan énergétique négatif ont un impact sur la fertilité de la vache laitière (Staples et al. 1990). De plus, la production laitière et le nombre de parturitions ont une influence sur le système reproducteur (Stevenson et al. 1983, Walters et al. 2002).
2.2.3.1 Les vaches hautes productrices de lait
Les vaches hautes productrices de lait sont plus sujettes à un bilan énergétique négatif. Donc, elles sont plus sensibles à un problème de fertilité. Il a été montré que les ovocytes de ces vaches ont un taux de clivage plus faible et vont former moins de blastocystes (Snijders et al. 2000). De plus, il a été observé que plus de la moitié des vaches présentent des irrégularités dans leur cycle œstral.
2.2.3.2 Mobilisation des réserves tissulaires
Plusieurs chercheurs suspectent que les changements métaboliques liés à la mobilisation des réserves tissulaires en période post-partum seraient la cause des problèmes de fertilité. Un bilan énergétique négatif modifie les metabolites sanguins dans le liquide folliculaire et peut causer des dommages à l'ovocyte bovin (Leroy et al. 2004b). In vitro, des
concentrations élevées de NEF As entravent la maturation de l'ovocyte et la compétence au développement embryonnaire (Leroy et al. 2005). De plus, les problèmes métaboliques tels que la stéatose hépatique et l'acétonémie, même légère, sont associés à des problèmes de santé et une diminution des performances de reproduction chez les vaches laitières (Bobe et al. 2004). Chez les vaches multipares, une concentration élevée de NEF As, à moins d'une semaine avant le vêlage, a été associée à une probabilité accrue d'endométrite (Kaufmann et al. 2010). Les changements métaboliques semblent affecter la qualité de l'ovule et le lieu d'implantation de l'embryon.
2.2.3.3 L'urée
L'urée peut être directement incluse dans la ration alimentaire ou produite par l'organisme. La production d'urée exige énormément d'énergie de la part de l'organisme et accentue la carence énergétique. Un excès d'urée semble avoir un effet sur l'ovaire et l'utérus. Les vaches ayant une concentration élevée d'urée et de NEFA en période postpartum sont deux fois plus susceptibles de développer des kystes (Jackson et al. 2011). De plus, des concentrations élevées d'urée à une semaine postpartum ont été associés à une probabilité accrue d'endométrite chez les vaches primipares (Kaufmann et al. 2010). Des concentrations élevées d'azote uréique dans le lait en début de lactation ont une corrélation négative avec le taux de fertilité (Gustafsson & Carlsson 1993).
2.2.3.4 La leptine
Il existe plusieurs polymorphism.es du gène de la leptine. Les fonctions de la leptine peuvent varier selon le polymorphisme. Il existe une relation entre les polymorphismes de la leptine et les difficultés aux vêlages, la durée de la gestation et la mort du veau (Giblin et al. 2010). De plus, chez les vaches multipares, une concentration élevée de leptine avant le vêlage est un facteur prédictif d'une ovulation retardée et est associée à un intervalle plus long entre les vêlages. La leptine a une influence sur la prise alimentaire et la mobilisation des lipides. Il n'est donc pas étonnant qu'une concentration élevée de leptine induise les mêmes effets qu'un bilan énergétique négatif.
21 2.2.3.5 L'état de chair
La fréquence des puises de la LH est influencée par l'indice d'état chair d'un animal (Wright et al. 1987). La condition de chair idéale au tarissement et au vêlage varie entre 3,25 à 3,75. Une cote d'état de chair peu élevée diminue la probabilité d'une ovulation. Donc, les vaches ayant un état de chair bas en période post-partum prendront plus de temps à concevoir (Pryce et al. 2001). De plus, une perte élevée de la condition de chair en début de lactation modifie les paramètres physiologiques. Une cote d'état de chair élevée au moment de la parturition a un impact négatif sur la production de lait, les troubles de santé et de fertilité (Gearhart et al. 1990).
2.2.3.6 Le facteur IGF-1
Les facteurs IGF-I et IGF-II amplifient la réponse folliculaire aux effets de la LH et de la FSH et stimulent la croissance du follicule et de la stéroïdogenèse. Le facteur IGF-1 agit en tant que modulateur métabolique de l'activité ovarienne chez les vaches laitières. Une concentration élevée d'IGF-I pendant les 2 premières semaines de lactation est associée à une reprise rapide de l'activité ovarienne, un taux de conception élevé et un intervalle entre les vêlages plus court (Patton et al. 2007). Cependant, un bilan énergétique négatif réduit la concentration IGF-1 circulante et diminue la réponse à la LH et la FSH du follicule dominant. Chez le bovin, l'ovulation est retardée par l'inhibition de la fréquence des puises de la LH et par de faibles concentrations sanguines de glucose, d'insuline et d'IGF-1 qui réduisent la production d'œstrogènes par les follicules dominants (Butler 2000). L'expression génique de YIGFBP-2 est modifiée chez les vaches ayant un bilan énergétique négatif prononcé. Ceci peut modifier la biodisponibilité de l'IGF-I et affecter le recrutement des follicules ovariens (Llewellyn et al. 2007). De plus, le facteur IGF-1 et l'insuline ont un rôle physiologique dans l'utérus. Un taux faible dTGF-1 et d'insuline après le vêlage, altère les voies de signalisation dans l'endomètre et affecte la réparation des tissus de l'utérus (Contreras & Sordillo 2011). Enfin, l'intensité de la diminution de la concentration d'IGF-l influence à la fois la reprise ovarienne, l'intervalle de la première ovulation et la conception.
2.2.3.7 La progestérone
La progestérone sécrétée par les cellules de la granulosa et le corps jaune agit sur l'utérus et permet le maintien de la gestation. Une augmentation de la progestérone au début de la phase lutéale est un facteur déterminant pour la fertilité. Il y a été montré qu'une carence énergétique peut causer un retard du retour de l'activité lutéale (de Vries & Veerkamp 2000). De plus, une concentration diminuée de progestérone et du facteur IGF-1 peut créer un environnement sous-optimal dans l'utérus et nuire à l'implantation embryonnaire (Leroy et al. 2008a).
Section 2.3. Intervention nutritionnelle chez les bovins
laitiers
Un plan adéquat de nutrition et une bonne gestion des troupeaux entraînent une amélioration de la production laitière tout en maintenant la santé et les performances de reproduction. Une ration alimentaire qui créé une carence énergétique réduit la production de lait, induit une perte de poids, nuit à la reproduction et cause des troubles métaboliques. Inversement, une ration alimentaire fournissant un excédent d'énergie induit un excès de poids et des problèmes métaboliques. Plusieurs recherches en nutrition bovine se sont concentrées sur les problèmes de bilan énergétique négatif et de reproduction.
Section 2.3.1 Stratégie nutritionnelle pré et post-partum qui influencent l'efficacité métabolique et la fertilité chez la vache laitière
La composition alimentaire peut modifier des aspects physiologiques et causer des troubles de santé. L'hypocalcémie, la rétention placentaire, la métrite, l'endométrite, la mammite, l'acétonémie, la stéatose hépatique et l'acidose ruminale subaiguë peuvent être causés par une mauvaise nutrition. De plus, les performances de reproduction sont fortement perturbées si les besoins énergétiques et protéiques de l'organisme ne sont pas couverts.
23
Les nutriments glycogéniques, lipogéniques, les protéines et les minéraux ont des interactions spécifiques sur le métabolisme et le système reproducteur de la vache laitière. 2.3.1.1 L'effet d'une sous-alimentation
Une sous-alimentation induit une augmentation de l'hormone de croissance circulante et de l'urée qui est accompagnée d'une baisse de la concentration d'insuline circulante de la LH et d'IGF-1 (Cassady et al. 2009). Ces facteurs ont un effet sur le développement de l'ovocyte. Il a été montré qu'une sous-nutrition modérée des vaches laitières pendant la période péripartum a un effet sur la taille et l'atrésie du follicule dominant. De plus, une sévère sous-nutrition s'accompagne d'une absence de follicule de plus de 5 mm (Diskin et al. 2003). Une sous-alimentation retarde le moment de la première ovulation postpartum de 43 ±5 jours. Le retour à une ration comblant tous les besoins nutritionnels entraine une reprise de l'ovulation. Pour terminer, une sous-nutrition ne semble pas affecter directement le follicule. Les régulateurs métaboliques tels que l'insuline, la GH et les facteurs IGFs semblent moduler la réponse folliculaire à la LH (Diskin et al. 2003).
2.3.1.2 Nutrition glycogénique
Les nutriments glycogéniques améliorent le bilan énergétique en augmentant le flux de glucose dans le métabolisme. Les vaches multipares, recevant une ration riche en glucose, donnent un lait faible en matières grasses et présentent de faibles concentrations plasmatiques de NEF As et de corps cétoniques (van Knegsel et al. 2007). De plus, une meilleure disponibilité des éléments nutritifs glycogéniques réduit les risques de troubles métaboliques. Une alimentation riche en amidon stimule le développement des follicules et augmente le taux d'ovulation avant le jour 50 postpartums (Garnsworthy et al. 2008). De meilleurs résultats ont été observés avec l'utilisation de grains de maïs comme source d'amidon. Toutefois, les régimes alimentaires riches en amidon peuvent supprimer l'appétit en induisant trop rapidement la satiété.
2.3.1.3 Nutrition lipogénique
Un supplément de nutriments lipogéniques induit une augmentation de la mobilisation des lipides. Le supplément lipogénique a donc pour conséquence d'augmenter le taux plasmatique de NEF As, de BHBAs et de diminuer la quantité de matière sèche ingérée pendant les premières semaines de lactation (Moallem et al. 1997). Toutefois, les rations
alimentaires riches en graisses valorisent le développement de l'embryon contrairement à la mobilisation des lipides. Les acides gras polyinsaturés à longue chaine comme l'acide linoléique induisent une augmentation des sécrétions de prostaglandines par l'utérus et modifient la réponse immunitaire innée permettant ainsi d'améliorer le développement et la survie de l'embryon (Santos et al. 2008). Pour terminer, une nutrition lipogénique stimule la réapparition de l'activité lutéale.
2.3.1.4 Nutrition glycogénique et lipogénique
Il a été montré qu'une ration alimentaire stimulant la sécrétion d'insuline postpartum stimule le développement folliculaire, mais nuit à la compétence ovocytaire. Ces résultats ont conduit l'équipe de Dr R. Webb à l'hypothèse qu'une alimentation combinée de nutriments glycogéniques et lipogéniques pourrait avoir un effet bénéfique sur la reproduction. Le plan nutritionnel consiste à donner une alimentation glycogénique jusqu'à la première ovulation afin d'augmenter la glycémie et l'insuline favorisant ainsi le développement des follicules et la restauration de l'ovulation post-partum. Cette première phase est suivie d'une alimentation lipogénique durant la période d'insémination afin d'atténuer la sécrétion d'insuline et d'améliorer la compétence des ovocytes et la qualité des embryons. Cette double ration induit une augmentation du taux de conception jusqu'à 60 % (120 jours après la parturition) (Garnsworthy et al. 2009).
2.3.1.5 Une carence en minéraux
La parturition et le début de la lactation provoquent une baisse aiguë des concentrations de calcium dans le sang. La différence ionique entre les anions et les cations à des valeurs négatives avant le vêlage (100 à 150 mEq/kg de matière sèche) minimise le déclin rapide du calcium dans le sang (DeGaris et al. 2010). De plus, elle induit une augmentation de la quantité de matières sèches ingérées et améliore la production laitière des vaches multipares (DeGroot et al. 2010). Une carence en minéraux tels que le cobalt, le cuivre, le manganèse, le phosphore et le sélénium peuvent causer une baisse des performances de reproduction et de la production laitière. Stratégiquement, il est possible d'augmenter la biodisponibilité des oligo-éléments dans les tissus en les liants à des molécules organiques comme les acides aminés. Un supplément de sélénium organique induit une amélioration de la fonction des neutrophiles et une meilleure santé utérine (Ndiweni & Finch 1996, Cerri et al. 2009).
25
2.3.1.6 Les protéines
Les protéines métabolisables sont utilisées pour la production de lait, le développement du fœtus, les fonctions immunitaires et la reproduction. L'apport en protéines métabolisables des vaches laitières provient des protéines non dégradables par le rumen et de la synthèse de protéines par la flore microbienne. Une ration composée de sucres structuraux et de sucres non structuraux avec un supplément de niacine a un effet positif sur la production de protéine microbienne. De plus, la concentration de protéines non dégradables est plus élevée dans les ensilages d'herbes que dans l'herbe fraiche. Le ratio des concentrations de protéines dégradables et de protéines non dégradables par le rumen peut influencer l'apport énergétique à l'organisme chez la vache laitière (Weiss et al. 2009). Une ration riche en protéines métabolisables dans le rumen cause un excès d'ammoniac et une forte excrétion d'urée. Une forte excrétion d'urée nuit au métabolisme énergétique et à la fertilité. De plus, une augmentation de l'urée et de l'ammoniac peut être toxique pour les embryons (Butler
1998).
Section 2.4 Vitamine B12 et de l'acide folique
Section 2.4.1 La structure chimique de l'acide folique et de la vitamine B12
L'acide folique ou vitamine B9 est une vitamine hydrosoluble qui est constituée d'un anneau de ptéridine, de l'acide p-aminobenzoïque et de l'acide glutamique. L'acide folique est le précurseur métabolique d'un coenzyme, le tétrahydrofolate (THF), impliqué dans la synthèse des bases nucléiques (purines et pyrimidines). Le THF intervient également dans la synthèse d'acides aminés tels que la methionine, la glycine, l'histidine et la serine. Aujourd'hui, l'acide folique est connu plus particulièrement pour sa capacité à prévenir les risques d'anomalies du tube neural en cours de grossesse chez la femme (Smithells et al. 1983). Une carence en acide folique entraîne une anémie macrocytaire qui se caractérise par une taille augmentée des hématies (macrocytose) (Ramakrishnan et al. 2011).