University de Sherbrooke
Role du rScepteur NTS1 de la neurotensine dans un modele de douleur tonique
Par
Genevieve Roussy
Departement de Physiologie et Biophysique
M^moire presente a la Faculty de M^decine et des Sciences de la sante En vue de l'obtention du grade de
Maltre es sciences (M.Sc.) en physiologie
Sherbrooke 20 fevrier 2008
1*1
Library and Archives Canada Published Heritage Branch 395 Wellington Street Ottawa ON K1A0N4 Canada Bibliotheque et Archives Canada Direction du Patrimoine de I'edition 395, rue Wellington Ottawa ON K1A0N4 CanadaYour file Votre reference ISBN: 978-0-494-37935-6 Our file Notre reference ISBN: 978-0-494-37935-6
NOTICE:
The author has granted a non-exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecommunication or on the Internet, loan, distribute and sell theses
worldwide, for commercial or non-commercial purposes, in microform, paper, electronic and/or any other formats.
AVIS:
L'auteur a accorde une licence non exclusive permettant a la Bibliotheque et Archives Canada de reproduire, publier, archiver,
sauvegarder, conserver, transmettre au public par telecommunication ou par Plntemet, prefer, distribuer et vendre des theses partout dans le monde, a des fins commerciales ou autres, sur support microforme, papier, electronique et/ou autres formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
L'auteur conserve la propriete du droit d'auteur et des droits moraux qui protege cette these. Ni la these ni des extraits substantiels de celle-ci ne doivent etre imprimes ou autrement reproduits sans son autorisation.
In compliance with the Canadian Privacy Act some supporting forms may have been removed from this thesis.
Conformement a la loi canadienne sur la protection de la vie privee, quelques formulaires secondaires ont ete enleves de cette these. While these forms may be included
in the document page count, their removal does not represent any loss of content from the thesis.
Canada
Bien que ces formulaires
aient inclus dans la pagination, il n'y aura aucun contenu manquant.
TABLE DES MATIERES
Table des ma tier es I
Listedes figures Ill
Liste des tableaux .IV
Listedes abreviations V R6sum£ _ 1 Introduction 3 1. La douleur 3 1.1 Definition 3 1.2 Perception de la douleur 3 1.2.1 Peripherie 3
1.2.2 Systeme nerveux central 7
1.3 Mecanismes endogenes de contr61e de la douleur 10
1.3.1 Peripherie 10
1.3.2 Moelle epiniere 10
1.3.3 Tronc cerebral A 11
1.3.4 Centres superieurs 12
1.4 Modele animal: le test a la formaline 14
1.4.1 Description du test 14
1.4.2 Methodes d'analyse 18
1.4.3 Changements spinaux engendres par la formaline 21
1.5 Traitements actuels de la douleur 29
2 La neurotensine 29
2.1 Synthase, relSche et inactivation de la neurotensine 30
2.2 Localisation . 32
2.2.1 Peripherie 32
2.2.2 Systeme nerveux central . . 33
2.3 Colocalisation avec des neurotransmetteurs 35
2.3.1 Serotonine 35
2.3.2 Dopamine • 36
2.4 Roles 37
2.4.1 Peripherie 38
2.4.2 Systeme nerveux central 39
2.5 R^cepteurs de la neurotensine 41 2.5.1 NTS1 41 2.5.2 NTS2 ,....44 2.5.3 NTS3 46 Objectifs duprojet 49 Article _ 51 Discussion et conclusion 104 Remerciements 121 References 123 II
LISTE DES FIGURES
Figure 1 M£diateurs inflammatoires 5
Figure 2 Fibres afferentes primaires 7
Figure 3 Voies ascendantes de la douleur 9
Figure 4 Theorie du portillon 11
Figure 5 Contr61es inhibiteurs diffus nociceptifs impliquant la NA 12
Figure 6 Phases du test a la formaline 18
Figure 7 Expression de la proteine Fos au niveau spinal 24 Figure 8 Variabilite des comportements douloureux selon la
concentration de formaline .26
Figure 9 Structure primaire de la NT 30
Figure 10 Maturation du gene de la NT „ 31
Figure 11 Representation des voies neurotensinergiques dans un cerveau
derat 34
Figure 12 Localisation de la NT au niveau spinal 35
Figure 13 Projections spinales des fibres afferentes primaires ...106 Figure 14 Effet antinociceptif du PD149163 en douleur aigtie 118 Figure 15 Effet antinociceptif du JMV-431 en douleur tonique 119 Figure 16 Augmentation des MAPK suite a l'injection i.t. de
PD149163 120
LISTE DES TABLEAUX
Tableau 1 Événements induits par l'injection de formaline 5% dans la
patte arrière d'un rat 16
LISTE DES ABREVIATIONS
|am microns
5-HT sérotonine
ARNm ARN messager
CGRP calcitonine gene relatedpeptide
DRG ganglions de la racine dorsale de la moelle épinière
ERK extracellular related kinase
GABA acide gamma-amino butyrique
i.c.v. intracérébroventriculaire i.t. intrathécal
kDa kilo Daltons
MARK mitogen activatedprotein kinase
NGF nerve growth factor
NRM noyau du raphé magnus
NT neurotensine
NTSl récepteur de type 1 de la NT
NTS2 récepteur de type 2 de la NT NTS3 récepteur de type 3 de la NT
PC prohormone convertase
PAG substance grise périaqueducale
SNC système nerveux central
RESUME
La neurotensine (NT) est un neuropeptide de 13 acides aminés qui fut isolé au début
des années 70. Suite à sa découverte, il a été démontré qu'il était localisé autant au
niveau central que périphérique et que ses rôles étaient étroitement liés à sa
localisation. Pour exercer ses nombreux effets, incluant l'induction d'une analgésie
naloxone-indépendante, la NT interagit avec 3 sous-types de récepteurs soit NTSl, NTS2 et NTS3. Jusqu'à maintenant, l'implication du récepteur NTSl dans l'analgésie
induite par la NT a été démontrée uniquement dans des modèles de douleur aiguë. Nous avons donc décidé de caractériser le rôle du récepteur NTSl dans un modèle de douleur tonique, le test à la formaline. Ce test est composé de deux phases actives soit la phase I dite aiguë et la phase II dite inflammatoire. Ces deux phases sont entrecoupées par une interphase où il y a une inhibition active des comportements douloureux. Le test à la formaline permet une analyse rapide et efficace du potentiel analgésique de composés qui pourront être testés ultérieurement en douleur chronique. Lors des études comportementales, nous avons observé que la NT induit un effet analgésiant dose-indépendant. Les comportements douloureux ont diminué jusqu'à 23% dans la phase inflammatoire et ce avec les doses les plus élevées de NT. Pour déterminer plus précisément l'implication du récepteur NTSl dans l'analgésie induite par la NT, nous avons évalué l'effet de deux agonistes de ce récepteur soit le PD149163 et le NT69L. Ces deux agonistes ont démontré un effet analgésiant plus important que celui de la NT. Avec le PD149163 et le NT69L, l'intensité doulomeuse a diminué de façon dose-dépendante jusqu'à 61 et 48% respectivement dans la phase
inflammatoire et ce avec les doses les plus élevées utilisées. Pour confirmer les résultats obtenus avec les agonistes du récepteurs NTSl, nous avons co-administré chaque agoniste avec un antagoniste du récepteur NTSl, le SR48692. La combinaison du PD149163 et du SR48692 a induit un retour significatif de la douleur chez les animaux traités tandis que la combinaison du NT69L et du SR48692 a renversé
partiellement l'effet du NT69L seul. En sachant que le NT69L lie les récepteurs NTSl
et NTS2, ces résultats indiquent donc que les récepteurs NTSl et NTS2 sont à considérer dans l'analgésie observée lors du test à la formaline.
Afin de déterminer l'impact cellulaire des agonistes NTSl lors du test à la formaline,
nous avons révélé l'activité neuronale spinale via l'expression de la protéine Fos par la technique d'immunohistochimie. Du côté ipsilatéral à l'injection de formaline, une diminution significative de l'expression de la protéine Fos a été observée avec la NT, le PD149163 et le NT69L au niveau des lamina III-IV et V-VI. Les agonistes du récepteur NTSl ont aussi eu un effet diminutif dans les lamina I-II en plus d'être les seuls à avoir atténué l'expression de la protéine Fos au niveau des lamina III-IV et VI du côté controlatéral. L'activité neuronale spinale corrèle bien avec les résultats comportementaux obtenus avec les différents composés étudiés.
Cette étude nous suggère donc que les agonistes du récepteur NTSl pourraient
représenter une nouvelle voie de composés analgésiques.
mXRODUCTION
1. Douleur
La douleur est un phénomène subjectif et complexe, mais essentiel, nous permettant
de nous protéger contre les agressions extérieures. Une douleur peut être de type aiguë lorsqu'elle est localisée et apparaît rapidement suite à un stimulus périphérique; de type tonique lorsqu'elle est phasique et persistante; et de type chronique lorsqu'elle évolue depuis 3 à 6 mois consécutifs. Peu importe le type de douleur rencontré, des
mécanismes endogènes complexes sont enclenchés suite à un stimulus douloureux et ils seront décrits dans les prochaines sections.
1.1 Définition
Selon l'Association internationale pour l'étude de la douleur, la douleur est définie comme étant « une sensation désagréable et une expérience émotionnelle en réponse à une atteinte tissulaire réelle ou potentielle, ou décrite en ces termes » (MERSKEY et
al, 1979).
1.2 Perception de la douleur
1.2.1.1 Les nocicepteurs
Au niveau cutané, musculaire, articulaire et viscéral, nous retrouvons une variété de
nocicepteurs sous forme de terminaisons libres répondant à des stimuli douloureux qu'ils soient de type mécanique, thermique ou chimique (MCMAHON et
KOLTZENBURG, 2006). Ces derniers vont activer directement ou indirectement les
nocicepteurs par l'entremise de substances proinflammatoires libérées suite au dommage tissulaire causé par le stimulus (fig 1). Ces substances proviennent de trois sources principales soit les cellules lésées, les cellules inflammatoires et les nocicepteurs eux-mêmes (LE BARS et ADAM, 2002). Les cellules lésées libèrent des
protons ainsi que de l'adénosine triphosphate excitant davantage les nocicepteurs via l'ouverture de canaux cationiques. Les cellules inflammatoires, pour leur part, relâchent des substances telles que l'histamine, la sérotonine, la bradykinine, les prostaglandines, les leukotriènes, les cytokines pro-inflammatoires (TNFa, IL-ip...) et le NGF. Ces substances inflammatoires auront pour effet de sensibiliser les nocicepteurs à des stimuli éventuels et à d'autres substances inflammatoires en plus d'induire de l'hyperalgésie primaire. Pour ce qui est des nocicepteurs, ils libèrent des neuropeptides (substance F, CGRP...) provoquant ainsi leur propre excitation et
sensibilisation (LE BARS et ADAM, 2002, MCMAHON et KOLTZENBURG, 2006). Tous ces événements inflammatoires enclenchent im phénomène
d'amplification du stimulus douloureux. Cette amplification sera aussi modulée par l'activation ou la sensibilisation des fibres afférentes primaires avoisinantes au site
répondent à des stimuli de faible intensité. Elles ne sont donc pas considérées comme des nocicepteurs, mais plutôt comme des mécanorécepteurs. Ces fibres myélinisées de gros calibre transmettent très rapidement l'information non douloureuse, mais elles sont tout de même impliquées dans l'inhibition de l'information nociceptive (voir
section 2.3.2) (JULIUS et BASBAUM, 2001, PRICE, 1988). Pour ce qui est des deux autres catégories de fibres, elles se retrouvent en périphérie sous forme de terminaisons nerveuses libres où font principalement partie de la classe des nocicepteurs. Les fibres A6, faiblement myélinisées et de diamètre intermédiaire, sont principalement des récepteurs polymodaux (HUNT et MANTYH, 2001, LE BARS et ADAM, 2002). Elles peuvent être classées en deux types selon leur réponse à im stimulus thermique de haute intensité ou à un dommage tissulaire (MCMAHON et KOLTZENBURG, 2006). Lorsque stimulées, ces fibres induisent une douleur rapide et localisée que l'on nomme première douleur (RENN et DORSEY, 2005). Les fibres C, qui s'avèrent être les plus petites fibres afférentes primaires, sont constituées essentiellement de récepteurs polymodaux et sont non myélinisées (HUNT et MANTYH, 2001, MCMAHON et KOLTZENBURG, 2006). Elles sont responsables de l'apparition d'une douleur secondaire qui est plus tardive et diffuse (BELMONTE et CERVERO, 1996, KONIETZNY et al., 1981). Ces fibres peuvent aussi être divisées en deux types : les peptidergiques, contenant entre autres la substance P ou le
CGRP; et les non peptidergiques, exprimant entre autres IB4 et le récepteur P2X3 (AMANN et al., 1995, CAO et al., 1998, MCMAHON et KOLTZENBURG, 2006).
avec la même fréquence de décharge, seulement à des stimuli douloureux. Pour ce qui
est des neurones non spécifiques, ou à large gamme dynamique, ils transmettent l'information douloureuse ou non provenant des fibres AaP, Aô et C vers les centres
supérieurs en répondant de façon graduelle, donc avec une fréquence de décharge toujours croissante, à tous les types de stimuli (MARCHAND, 1998). Cette transmission d'information se fait par l'intermédiaire de neurotransmetteurs tels que le glutamate, qui est le neurotransmetteur excitateur prédominant dans tous les nocicepteurs, et de neuropeptides tels que la substance F (JULIUS et BASBAUM,
2001,RANDICetal., 1990).
1.2.2.2 Voies ascendantes
Pour parvenir aux centres supérieurs, l'information douloureuse emprunte différentes voies ascendantes (fig 2). La principale voie nociceptive est celle dite spinothalamique prenant naissance dans les lamina I, IV-V et VU-Vin de la moelle épinière, et se projetant jusqu'aux noyaux thalamiques puis vers le cortex. Cette voie est responsable de l'aspect sensori-discriminatif de la douleur, car elle permet de distinguer la localisation ainsi que le type de douleur ressenti (HUNT et MANTYH, 2001,
MCMAHON et KOLTZENBURG, 2006). D'autres voies ascendantes sont
impliquées comme celle dite spinoparabrachiale qui origine au niveau de la lamina I de la moelle épinière et qui se termme au niveau de l'aire parabrachiale ainsi que de la substance grise périaqueducale (PAG). Elle est impliquée dans l'aspect sensori-affectif de la douleur, car elle projette dans des régions corticales contrôlant
1.3 Mécanismes endogènes de contrôle de la douleur
1.3.1 Périphérie
Suite à une inflammation enclenchée par un stimulus douloureux, des substances inflammatoires comme l'IL-ip enclenchent la libération d'opioïdes endogènes par des cellules immunitaires telles que les lymphocytes, les macrophages et les monocytes. De plus, les fibres afférentes primaires, et particulièrement les fibres C, peuvent libérer de la met-enképhaline. Ces opiacés endogènes libérés au niveau du site endommagé induisent un effet anti-nociceptif via leur liaison à des récepteurs opioïdergiques de type ô, k ou p situés sur les fibres afférentes primaires (ANTUNES
et al., 2001, LE BARS et ADAM, 2002, MCMAHON et KOLTZENBURG, 2006).
1.3.2 Moelle épinière
Au niveau spinal, un contrôle de l'information douloureuse se fait via un « portillon de la douleur » situé dans les couches superficielles de la moelle épinière, où les fibres afférentes primaires font synapses avec les seconds neurones. Selon la théorie du portillon, lorsque les influx provenant des fibres Aô et C sont plus importants que ceux des fibres Ap, il y a transmission et perception des influx douloureux. Dans le cas contraire, c'est-à-dire quand les influx empruntent davantage les fibres AP que les fibres Aô et C, des intemeurones spinaux sont stimulés. Ces intemeurones inhibiteurs opioïdergiques ou non libèrent, entre autres, de l'enképhaline ou du GABA
Les principaux centres supérieurs impliqués dans l'intégration de la douleur sont le
thalamus et le cortex. Ces deux structures sont intimement liées permettant de distinguer autant l'intensité que le côté affectif de la doulem. En effet, les noyaux thalamiques se divisent en noyaux latéraux et médians qui relaient l'information douloureuse provenant de la périphérie au cortex. Les noyaux latéraux reçoivent principalement leurs afférences de la voie spinothalamique et projettent jusqu'aux cortex somatosensoriels primaire et secondaire impliqués dans l'aspect sensori-discriminatif de la douleur. Pour ce qui est des noyaux médians, ils reçoivent principalement leurs afférences de la voie spinoréticulothalamique et projettent vers les structures du système limbique soit le cortex cingulé antérieur et le cortex insulé
(MARCHAND, 2005).
Du côté de la modulation de la douleur, les mécanismes en place sont peu détaillés au niveau cortical. Il a été démontré que des techniques telles que l'hypnose et l'effet placebo influencent la perception de l'information douloureuse. En effet, la prise d'un placebo, une substance pharmacologiquement inactive, peut diminuer ou augmenter la douleur selon les croyances et les attentes du patient (MCMAHON et
KOLTZENBURG, 2006). Lorsqu'il y a diminution de la douleur suite à la prise d'un
placebo, cette analgésie peut être bloquée par le naloxone, un inhibiteur non-spécifique des récepteurs opioïdergiques, indiquant l'implication des voies opioïdergiques endogènes dans ce type de phénomène (LEVINE et al., 1978). Par contre, le placebo peut être de type opioïdergique ou non selon qu'il est comparé avec un analgésique opioïdergique ou non respectivement (AMANZIO et al., 1999).
1.4 Modèle animal : le test à la formaline
Afin d'approfondir les connaissances sur le phénomène de la douleur exposé dans les
sections précédentes, différents modèles animaux sont disponibles. Les rongeurs sont principalement retenus pour ce type d'étude, car leur réponse à la douleur peut être transposée à celle ressentie par les humains. De plus, leur manipulation est facilitée par leur taille et le contrôle de paramètres jouant sur la douleur, comme le stress, peut être réduit suite à leur acclimatation. Il existe plusieurs tests de comportement animal chez les rongeurs de douleur aiguë, tel le test du retrait de la queue, et de douleur chronique, telle la ligation du nerf sciatique, mais un seul permet le criblage de composés analgésiques avant la mise en place d'études animales fastidieuses soit le test à la formaline. Ce test est caractérisé par l'apparition d'une douleur tonique, ou persistante, suite à l'injection de formaline, rm stimulus chimique. Ce test est caractérisé par une réponse phasique de l'animal testé dont les phases du test, plus particulièrement les phases aiguë et inflammatoire, permettent de déterminer l'efficacité de plusieurs molécules à différentes doses en douleur aiguë et inflammatoire. Ce test intermédiaire permet donc une économie de temps et d'argent pour la recherche de molécules qui seront éventuellement étudiées en douleur
chronique en plus de déterminer le potentiel analgésique des composés à l'étude.
1.4.1 Description du test
Le test à la formaline est initié par l'injection de formaline au niveau de la lèvre supérieure, d'une patte avant ou, dans la quasi totalité des cas, d'une patte arrière d'un animal. La formaline est ime solution aqueuse de formaldéhyde 37% dont le volume injecté varie entre 20 et 150 pL à une concentration oscillant entre 0,2 et 5% chez le
rat (SAWYNOK et LIU, 2004, TJOLSEN et al., 1992). Cette concentration de la
solution de formaline peut représenter, selon l'étude, le pourcentage de formaldéhyde ou le pourcentage de formaline. Pour notre part, le pourcentage utilisé dans ce manuscrit est exprimé en pourcentage de formaline. H est à noter qu'une solution de formaline 10% équivaut à 3,7% de formaldéhyde (TJOLSEN et al., 1992). L'injection de formaline induit instantanément chez l'animal une douleur se manifestant par une gamme de comportements nociceptifs, d'oedème et d'extravasation plasmatique et ce
de façon concentration-dépendante (CODERRE et al., 1984, YASHPAL et
CODERRE, 1998). De plus, les différents effets physiologiques engendrés par la formaline se font ressentir jusqu'à 4 semaines suivant l'injection (tableau 1). Plusieurs factems peuvent faire varier ces effets, dont la température de la salle d'exprimentation et la dose, et ils seront décrits un peu plus loin.
Rapide 10 min
comportements de la ptiase 1 activation des afférences activatlon des neurones de la CD
augmentation FG et PA œdème
10-20 min aucun comportement
aucune activatlon des afférences aucune activatlon des neurones de aucune augmentation PC et PA oedème
20-90 min Comportements de la pfiase 2 activatlon des afférences la CD activatlon des neurones de la CD
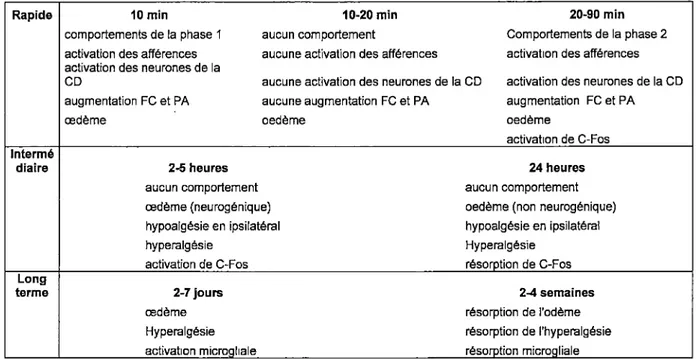
augmentation PC et PA oedème activatlon de C-Pos intermé diaire 2-5 fleures aucun comportement œdème (neurogènique) tiypoalgèsle en Ipsilatéral tiyperalgésle activatlon de C-Pos 24 heures aucun comportement oedème (non neurogènique) hypoalgèsie en Ipsilatéral Hyperalgèsie résorption de C-Pos Long terme 2-7 jours œdème Hyperalgèsie activatlon microgliale 2-4 semaines résorption de l'odème résorption de l'hypenalgésle résorption microgliale
Tableau 1. Événements induits par l'injection de fonnaline 5% dans la patte arrière d'un rat.
Suite à son injection, la formaline agit immédiatement et les comportements observés permettent d'effectuer le test à la formaline sur une période de moins de 2 heures. Les effets physiologiques de la formaline sont visualisés à l'aide de techniques biochimique ou immunohistochimique. CD : corne dorsale, FC : fréquence cardiaque, PA : pression artérielle. Tableau adapté de Sawynok J and Liu XJ 2004.
Lors du test, qui se déroule généralement sur une période de 60 minutes, 3 phases sont déclenchées et observées suite à l'injection de formaline. La phase I, aussi appelée phase aiguë, survient immédiatement suite à l'injection de formaline et se poursuit
jusqu'à la 9® minute du test. Cette phase est essentiellement induite par l'activation
indirecte des fibres C par la formaline via des médiateurs pro-inflammatoires dont la
bradykinine, la sérotonine, l'histamine et la substance P (DOAK et SAWYNOK,
1997, PARADA et al., 2001, SLUBATA et al., 1989). Elle permet de déterminer le potentiel analgésique des composés à l'étude en douleur aiguë, soit ime douleur apparaissant rapidement suite à im stimulus périphérique d'origine chimique.
L'interphase s'enclenche de la 9® à la 21® minute du test. Elle est caractérisée par une
atténuation et une stabilisation des comportements douloureux. L'interphase,
indépendante de la concentration de formaline, est causée par une inhibition active. Cette inhibition active, impliquant davantage les mécanismes GABAergiques ou opioïdergiques selon le sexe, a été démontrée par des injections subséquentes de
formaline à la 1^"^® et à la 20® minute du test produisant 2 interphases (FRANKLIN et
ABBOTT, 1993, GAUMOND et al., 2007, HENRY et al., 1999). Des composés peuvent moduler la durée de cette interphase démontrant leur action sm la composanteGABAergique. Enfin, la phase II, ou phase inflammatoire, débute à la 21® minute et se
poursuit au-delà de 4^0® minute du test. Elle est caractérisée par un retour et un
maintien des comportements douloureux chez l'animal à l'étude. C'est lors de cette
phase qu'un plateau de nociception peut être observé et ce entre la 20® et la 35® mmute
du test (YASHPAL et CODERRE, 1998). La phase II est une combinaison d'une réaction inflammatoire, impliquant des médiateurs pro-infiammatoires comme l'histamine, la sérotonine, les prostaglandines et la bradykinine; et d'une sensibilisation au niveau central découlant tous deux des phénomènes physiologiques activés lors de la phase I. Effectivement, il est possible d'inhiber les comportements nociceptifs de la phase II à l'aide, entre autres, d'opiacés injectés au niveau spinal avant et non après la phase I (DICKENSON et SULLIVAN, 1987, SHIBATA et al., 1989). Les comportements douloureux observés en phase II peuvent se voir diminuer par les composés à l'étude indiquant leur potentiel analgésique en condition
inflammatoire.
phase 1 Intensité de douleur phase 2 Interphase Temps
Figure 6. Phases du test à la formaline. Suite à l'injection de formaline au niveau de la patte
arrière d'un animal, une courbe de l'intensité de douleur en fonction du temps peut être obtenue permettant ainsi de distinguer trois phases soit la phase I dite aiguë, l'interphase, où il
y a une inhibition active de la douleur, et la phase n dite inflammatoire.
Comme mentionné précédemment, le test à la formaline permet donc d'identifier
rapidement les composés ainsi que les doses méritant d'être étudiés en douleur
chronique selon leur effet en phase II, car il a été démontré que les résultats obtenus dans cette phase corrèlent avec ceux obtenus en douleur chronique (VISSERS et al.,
2003, VISSERS et al., 2006).
1.4.2 Méthodes d'analyse
Différentes méthodes sont utilisées pour analyser et décortiquer les différents
comportements observés lors du test à la formaline.
1.4.2.1 Analyse numérique
Cette méthode a été décrite pour la toute première fois par Dubuisson et Dennis qui expérimentaient alors l'injection de formaline au niveau d'une des pattes avant de chats et de rats (DUBUISSON et DENNIS, 1977). Depuis, elle a été grandement
utilisée et souvent accompagnée de modifications techniques dont l'injection de formaline dans une des pattes arrières de l'animal à l'étude dans le but de pouvoir distinguer le léchage causé par la douleur de celui effectué lors du toilettage (CODERRE et al., 1993a, TJOLSEN et al., 1992). Le principe de l'analyse numérique est d'attribuer à chaque comportement douloureux une valeur numérique allant de 0 à 3, soit du comportement le moins douloureux à celui le plus douloureux. Les 4 stades de douleur pouvant être observés sont les suivants:
0 : le poids exercé sur la patte injectée ne diffère pas suite à l'injection de formaline comparativement à la pré-injection;
1 : le poids exercé sur la patte injectée est diminué, mais celle-ci demeure en
contact avec une surface;
2 : la patte injectée est complètement soulevée dans les airs;
3 : la patte injectée est mordillée, léchée ou secouée (DUBUISSON et DENNIS, 1977).
Suite à l'observation, la moyenne de l'intensité douloureuse est calculée en valeur numérique selon le temps passé dans chaque stade de douleur d'après la formule
suivante :
moyenne de l'intensité douloureuse = (T^x 1 )+("T7x2')+(Tqx3) Tt
où Ti = le temps passé en stade 1, T2 = le temps passé en stade 2, T3 = le temps passé
en stade 3 et Tt = le temps total de l'intervalle examiné (DUBUISSON et DENNIS, 1977, TJOLSEN et al., 1992). Nous avons décidé d'opter pour cette méthode d'analyse, car elle comporte certains avantages comparativement aux autres
méthodes. En effet, elle est fiable et valide, car elle consiste à utiliser une échelle
douloureuse objective et reproductible où la valeur numérique accordée à chaque
comportement concorde réellement avec l'intensité de douleur observée (CODERRE
et al., 1993a). De plus, elle permet une analyse complète de l'expérience douloureuse
observée chez l'animal injecté avec la formaline.
1.4.2.2 Analyse d'un seul paramètre
Cette méthode d'analyse simplifiée consiste à tenir compte d'un seul comportement douloureux chez l'animal à l'étude comme le léchage de la patte injectée ou l'élévation de cette patte dans les airs (ABBOTT et al., 1981, FANSELOW, 1984,
MCLAUGHLIN et al., 1990, SUGIMOTO et al., 1986). Ce dernier comportement est
le plus couramment choisi, car il est plus facile à observer et à quantifier.
1.4.2.3 Analyse multivariée
Cette méthode plus complexe consiste à considérer l'expérience douloureuse comme une combinaison de plusieurs variables telles que les différents états de la patte injectée (au repos, élevée dans les airs ou léchée, mordillée et secouée) et le niveau
d'activiti locomotrice (normal ou modifie pour proteger la parte injectee) (TJOLSEN et al., 1992). L'analyse statistique multivariee de ces variables permet done de determiner la relation existante entre chacune d'entre elles (TJOLSEN et al., 1991, TJOLSEN et al., 1991, TJOLSEN et al, 1992).
1.4.2.4 Analyse des comportements g^neraux
Cette analyse permet de determiner 1'influence d'un stimulus nociceptif sur les comportements gejieraux de l'animal a l'£tude. En effet, elle permet d'amasser des donn^es supplementaires sur le niveau et le type de nociception, le degre de sedation et la motricite de l'animal (FANSELOW, 1985, HOLLAND et GOLDSTEIN, 1990, PORRO et al., 1991). Elle s'avere etre davantage un complement aux autres m&hodes d'analyse qu'une m&hode d'analyse bien distincte.
1.4.3 Changements spinaux engendres par la formaline
La douleur induite par la formaline provoque des modifications des activity neuronales et gliales et ce particulierement au niveau de la moelle 6piniere. Ces changements spinaux surviennent a court et long terme suite a 1'injection de formaline ou les afferences primaires de la parte arriere injectee projettent pour transmettre 1'information douloureuse provenant de la peripheric vers les centres sup^rieurs. Des modifications du niveau d'expression de certains genes, comme le gene c-fos, ainsi que P activation de cellules gliales telles que les microglies peuvent etre observers.
1.4.3.1 Activation de genes a transcription rapide
Les genes a transcription rapide (« immediate-early gene ») sont des genes, comme le precise leur nom, dont la transcription est rapidement active^ au niveau neuronal suite a une stimulation. In vitro, leur expression peut etre active^ par des facteurs de croissance, des neurotransmetteurs, une d^polarisation membranaire ou une entree de calcium via les canaux voltage-dependants; et in vivo, par des stimuli douloureux qu'ils soient thermiques, mexaniques ou chimiques (CURRAN et al., 1984, HUNT et al., 1987, MORGAN et CURRAN, 1986, MULLER et al., 1984). II a &6 demontre" que ces genes sont de bons marqueurs de Pactivite" neuronale autant au niveau spinal que supraspinal. Des genes tels que fos et jun sont done classiquement induits rapidement. Le gene c-fos est couramment 6tudie en douleur, car 1'expression du gene peut 6tre activee par un stimulus nocif pour l'organisme tel que Pinjection intra-plantaire de formaline (HARRIS, 1998, HUNT et al, 1987, JINKS et al, 2002, LANTERI-MINET et al., 1993, LIMA et AVELINO, 1994, PORRO et CAVAZZUTI, 1993). Une fois exprim6e, la prot&ne nucleaire Fos s'het6rodim6rise avec une autre proteine nucleaire encodee par un des membres de la familley'KW et par la suite le complexe se fixe au niveau du site AP-1 de promoteurs de genes cibles pour moduler leur expression (HALAZONETIS et al., 1988, RAUSCHER et al, 1988). Jusqu'a maintenant, il a 6t6 demontre" que les genes cibles par Ph&6rodimere compost de Fos sont ceux du NGF, de la pr6proenk6phaline, de la prodynorphine, du neuropeptide Y, de la cholecystokinine et de la galanine (DRAISCI et IADAROLA,
1989, MUNGLANI et HUNT, 1995, MUNGLANI et al., 1996). Ces modulations pourraient expliquer les effets a long terme de la formaline. De plus, il a 6t6 demontre, par l'utilisation d'antagonistes ou d'inhibiteurs, que les neurones co-exprimant Fos et les recepteurs NMDA, les recepteurs neurokinine, la NO synthase ou la guanylyl cyclase semblent etre impliques dans la sensibilisation centrale (CHAPMAN et al., 1995a, CHAPMAN et al., 1995b, CHAPMAN et al, 1996, TAO et JOHNS, 2002). En effet, certains m^canismes de sensibilisation centrale impliquent des recepteurs NMDA et neurokinine ainsi que des mSdiateurs intracellulaires comme le NO, le calcium et la proteine kinase C (CODERRE et al., 1993b, DICKENSON et al, 1999, ZIEGLGANSBERGER et TOLLE, 1993).
Pour ce qui est de la distribution de la proteine Fos suite a l'injection de formaline, nous allons nous attarder a sa distribution au niveau de la moelle 6piniere, car cette structure nous a particulierement int6resse\ Suite a l'injection de formaline, 1'expression de la proteine Fos augmente de facon temps- et lamina- dependant et ce principalement du cdte" ipsilatfral. En effet, il a 6te note que lh apres l'injection de formaline, le marquage de la prot6ine Fos est diffus et maximal au niveau des lamina superficielles (I-II et III-IV) comparativement aux lamina plus profondes (V-VI et VII-X) dont le marquage augmente a 2 et 4h post-injection (fig 7) (ABBADIE et al., 1992, LEAH et al., 1992, PRESLEY et al., 1990). L'expression de la proline Fos augmente particulierement dans les lamina I, II et V et ce au niveau des lombaires L4 et L5 ou la majorite des afftrences primaires en provenance des partes arrieres font synapses avec les seconds neurones (fig 3). Du c6te" contralateral a Pinjection de formaline, une faible quantite de prolines Fos est exprim^e a partir de 2 et 4h
microglies au niveau des lamina superficielles de la corne dorsale et ce a partir du 3e
jour injection. L'activation microgliale atteint son apogee a 1 semaine post-injection et diminue a partir de la 2e et 4e semaine tout en demeurant eUevee (FU et al.,
2001). II a ete demontre" que la sensibilisation centrale induite par la formaline est observee a partir de la liK semaine post-injection correspondant au pic d'activation microgliale (FU et al., 2001, YEO et al., 2001).
1.4.4 Facteurs de variability
La douleur induite par la formaline est module par diffcrents facteurs tels que la concentration et le site d'injection de la formaline ainsi que des elements exteYieurs comme la temperature de la salle d'experimentation. II est important de tenir compte de ces elements, car la douleur observee lors du test a la formaline peut varier selon les criteres &ablis.
1.4.4.1 Concentration de formaline
La concentration de formaline injected influence grandement le type de comportements douloureux observes chez 1'animal a 1'etude. En effet, une concentration plus eUevee de formaline augmente la frequence des comportements les plus douloureux (fig 4) (ABBOTT et al., 1995, CODERRE et al., 1993a). Pour notre projet, nous avons done decide d'injecter une concentration de 5% formaline permettant ainsi de discriminer de facon claire les composes au niveau de la puissance
de leur effet antinociceptif, car les comportements les plus doulovireux sont majoritairement observes.
I
2 0 0 8 , taw WW J 400. .11... ..-l.tftfJP** B 1000 I MO « m.M
**>
J 1 mi jfh. 0X, 4- t
0 0.25 0.5 1.5 2.5Formalin Concentration 0,25 0. J 1.5 2.5 $ Formalin Concentration D I2(W J 800. 400. (1 • " ^
n
7" * rr MM) • f 400. 200J JESL,fl
0 0.25 0,5 1.5 2.5 5Konnaliii Concentration Formalin Concentration 04$ 0.5 1.5 2.5 5
Figure 8. Variabilite des comportements douloureux selon la concentration de formaline. L'injection de formaline a differentes concentrations au niveau de la patte arriere d'un animal indique que la concentration de formaline influence les comportements douloureux observ6s. En fait, plus la concentration de formaline est elevee, plus les comportements les plus douloureux sont frequents (* : difference significative comparativement a 0% formaline (P < 0.05); f : difference significative comparativement au groupe ayant passe le plus de temps
dans le stade considere (P < 0.05)).
Figure provenant de Coderre TJ et al, 1993b.
1.4.4.2 Site d'injection
Generalement, u n des comportements observes lors du test a la formaline est le lechage de la patte injectee. Dans la majorite des cas, une des pattes arrieres recoit l'injection de formaline. Ces pattes sont de meilleurs indicateurs de la douleur lorsqu'inject6es, car le lechage des pattes avants est un comportement couramment rencontre chez les animaux comparativement au lechage des pattes arrieres
(TJOLSEN et al., 1992). II a 6t6 d6montre que la formaline injected au niveau plantaire de la parte induit plus de douleur que lorsqu'elle est injectee au niveau de la surface dorsale de la patte et ce particulierement en phase I (ABBOTT et al., 1995, OKUDA et al., 2001). De plus, l'intensite douloureuse induite par la formaline est plus importante lorsque 1'injection plantaire est effective dans la region proximale relativement a la region distale de la patte (ABBOTT et al., 1995).
1.4.4.3 Temperature
La temperature ambiante de la salle ou a lieu 1'experimentation influence les comportements douloureux observes. Une augmentation de la temperature ambiante de seulement quelques degres provoque une amplification de la reponse douloureuse en phase II suite a l'injection de formaline (ABBOTT et al., 1995, ROSLAND, 1991). Ce phdnomene peut etre explique" par le fait que la reaction inflammatoire nexessaire a la phase II se d£veloppe plus lentement et de facon moins importante a plus basse temperature. Pour ce qui est de la phase I, il a 6t6 dtabli que les changements de temperature n'ont aucune influence sur la douleur induite par la formaline (ROSLAND, 1991).
1.4.4.4 Espece et race
Une variability au niveau de la reponse douloureuse peut survenir selon 1'espece et la race des animaux selectionnes pour le test. Chez la souris, il a 6te mentionne qu'il
existe une difference comportementale entre differentes races et ce phenomene demeure a etre verifte chez le rat (ABBOTT et al., 1995, MOGIL et al., 1998). Chez d'autres especes, comme le chat, il a et6 rapport6 que Pinjection de formaline induit une reponse monophasique comparativement a une reponse biphasique chez les rongeurs (DUBUISSON et DENNIS, 1977). Dans notre cas, nous avons opte" pour le rat, car il existe des similitudes entre ce dernier et Phumain au niveau des reactions suivant un stimulus douloureux. De plus, sa manipulation est facility par sa taille et le contr61e de parametres jouant sur la douleur, comme le stress, peut etre r£duit suite a son acclimatation.
1.4.4.5 Autres facteurs
D'autres facteurs peuvent jouer sur les comportements douloureux engendres par la formaline. L'Sge des animaux utilises pour P experimentation est a considered En effet, une reponse douloureuse plus importante survient chez les animaux jeunes comparativement aux animaux ages (WHEELER-ACETO et COWAN, 1991). Nous avons done decide de realiser nos experiences chez des rats jeunes, car ils permettent d'6tudier le potentiel analgesique des differents composes a P etude et de diminuer la variabilite. Un autre facteur de variabilite est le stress. II est done important de bien acclimater les animaux a la salle et au materiel d'experimentation avant d'entreprendre les tests dans le but d'abaisser la relache d'hormones du stress permettant d'obtenir une reponse nociceptive plus adequate (ABBOTT et al., 1986, ABBOTT et al., 1995). Des facteurs environnementaux comme Pactivite" humaine
dans la piece, les odeurs, la pression atmosph6rique et la luminosite peuvent aussi faire varier les r^sultats du test a la formaline (TJOLSEN et al, 1992). Un dernier facteur a ne pas oublier est l'heure a laquelle sont effectues les tests. En effet, le rythme circadien des rats est Pinverse de celui des 6tres humains et il faut s'assurer d'effectuer les tests lors de la m6me p6riode de la journ6e pour diminuer la variability entre les animaux, pour assurer un bon suivi du test et pour avoir une certaine reproductibilite.
1.5 Traitements actuels de la douleur
Plusieurs traitements sont presentement disponibles pour le soulagement de la douleur dont les anti-inflammatoires non-st6roi'diens et les opiaces (NERON, 2005). Ces derniers sont tres efficaces, mais leur prise quotidienne a long terme provoque l'apparition d'effets secondaires indesirables tels que la depression respiratoire, la constipation, les nausees, la confusion, la d6pendance et la tolerance (BALLANTYNE, 2007). La neurotensine (NT), un peptide retrouve autant au niveau central que pe^ipherique, pourrait s'averer 6tre une alternative a ces traitements, car ses effets analg^siques independants des voies opioi'dergiques ont ete demontres (CLINESCHMIDT et al., 1979).
2. Neurotensine
2.2 Localisation
La NT est exprim^e autant au niveau central que periphfrique. Dans le systeme nerveux central (SNC), sa distribution est tres Vendue tandis qu'en pdripherie, elle est principalement concentred dans le tractus gastro-intestinal. La localisation de la NT varie quelque peu selon les especes et, dans ce manuscrit, seule celle chez le rat sera considered.
2.2.1 Penpherie
Environ 85% du contenu en NT se retrouve en peripheric ou elle agit en tant qu'hormone (CARRAWAY et LEEMAN, 1976). La plus forte proportion du peptide est situee dans le tractus gasto-instestinal ou la NT est emmagasinee dans des granules denses au niveau des cellules endocrines de type N du jejunum et de l'il6um et de facon moins importante dans celles du colon et du duodenum (HELMSTAEDTER et al., 1977, POLAK et al., 1977, SUNDLER et al., 1977). La NT est localised plus faiblement au niveau du systeme cardiaque plus precisement dans le myocarde, le systeme de conduction du cceur, les cellules ganglionnaires intracardiaques et les vaisseaux coronariens (OSADCHII et POKROVSKII, 1998). Dans une moindre mesure, la NT est aussi situee dans les systemes pulmonaire, rSnal, pancreatique, splanchinique ainsi qu'au niveau de la peau (HARTSCHUH et al., 1983, REINECKE, 1985).
2.2.2 Systeme nerveux central
Dans le SNC, la NT agit en tant que neuromodulateur/neurotransmetteur et est retrouv^e exclusivement au niveau des neurones, stocked dans des v6sicules a corps dense (BAYER et al., 1991, BISSETTE et NEMEROFF, 1995). Les neurones neurotensinergiques et leurs projections sont localises dans plusieurs structures corticales incluant le striatum, l'hypothalamus, le cortex prefrontal, l'hyppocampe, le NRM et la PAG (BEITZ, 1982, CASTEL et al, 1993, GOEDERT et al., 1985, INAGAKI et al., 1983, ROBERTS et al., 1981). La NT est davantage exprim^e au niveau de l'amygdale, du septum lateral, du noyau du lit de la strie terminale, de la substance noire et de l'aire tegmentaire-ventrale (VTA) (JENNES et al, 1982, UHL, 1982). Ces structures sont etroitement ltees aux nombreux effets centraux qu'exerce la NT. Sa localisation dans la VTA et Phypothalamus lui confere respectivement un role dans le controle de la locomotion et de la thermoregulation (BENMOUSSA et al., 1996, REYNOLDS et al, 2006). La presence de la NT au niveau de la PAG et du NRM l'amene aussi a jouer un r61e dans le contrSle de la douleur (URBAN et SMITH, 1993 a). La NT peut aussi avoir des effets sur la memoire, car elle est retrouv6e dans l'hippocampe (SAKAMOTO et al., 1986). Tous ces roles neurotensinergiques et bien d'autres seront detailles a la section 2.4.
AGHAJANIAN, 1997). Pour ce qui est des recepteurs de la NT, particulierement le r£cepteur NTS1, ils sont exprim^s sur les neurones s^rotonergiques de tous les noyaux du raphe" (JOLAS et AGHAJANIAN, 1996, KITABGI et al., 1987, LI et al., 2001). Cette colocalisation NT/s6rotonine permet de supposer un role pour la NT dans la douleur via les voies sfrotonergiques, car le noyau dorsal et le NRM sont reconnus pour 6tre impliques dans le controle de 1'information douloureuse (MESSING et LYTLE, 1977). II a £te" d6montre que la NT a pour effet de moduler les neurones s£rotonergiques situes dans ces deux noyaux du raphe en augmentant leur degre d'excitabilite" (JOLAS et AGHAJANIAN, 1996, LI et al., 2001).
2.3.2 Dopamine
Les neurones dopaminergiques sont situes principalement dans 4 regions corticales soit le m£sencephale, le diencephale, le bulbe olfactif et la retine (BJORKLUND et LINDVALL, 1984, FALLON et LOUGHLIN, 1995). La majorite" de ces neurones dopaminergiques se concentrent dans le mesencephale qui comprend la substance , noire, la VTA et le «retrorubral field» (CACEDA et al., 2006). Les neurones
neurotensinergiques sont majoritairement detectes dans les memes structures que celles contenant de la dopamine (JENNES et al., 1982, UHL et al., 1977, UHL, 1982). La plupart des neurones dopaminergiques compris dans la VTA et la substance noire expriment les recepteurs de la NT, particulierement le r^cepteur de type 1 (NTS1). De plus, les recepteurs de la NT retrouves dans le mesencephale sont principalement presents sur des neurones dopaminergiques. Les neurones coexprimant la dopamine et
la NT sont observes, entre autres, dans le striatum, le diencephale et les projections prenant naissance dans la VTA (BINDER et al., 2001).
Cette colocalisation amene la NT a moduler le systeme dopaminergique et vice versa. En effet, la NT peut agir sur le systeme dopaminergique en augmentant le degre d'excitability des neurones dopaminergiques et en antagonisant les effets de la dopamine via le recepteur D2 (FARKAS et al., 1996, LEGAULT et al., 2002,
MERCURJ et al., 1993, PINNOCK, 1985). Pour sa part, la dopamine stimule principalement la relache de NT (HUANG et HANSON, 1997, RADKE et al., 1998, WAGSTAFF et al., 1996a, WAGSTAFF et al., 1996b). Ces interactions entre la NT et la dopamine peuvent se r6fl&er dans la modulation de la douleur en condition de stress. En effet, ces neurotransmetteurs interviennent dans certains etats, comme Panxi&e et le stress, qui influencent la perception de la douleur (GUI et al., 2004, JIMENEZ-VELAZQUEZ et al, 2006). De plus, il a ete demontre que Pinjection intrap£riton£ale repetee de SR48692, un antagoniste liant preTeYentiellement le recepteur NTS1 diminue la relache de dopamine survenant normalement suite a un stress permettant de croire a une interaction entre les deux neurotransmetteurs lors d'un stress induisant une antinociception (AZZI et al., 1998).
2.4 Roles
La NT exerce plusieurs effets autant au niveau central que periph6rique et ceux-ci sont etroitement lies a sa localisation. Dans cette section, le r61e de la NT au niveau du tractus gastro-intestinal, ou est retrouv6e la plus grande quantite de NT, sera demerit
ainsi que le role de la NT dans la nociception, car cet effet neurotensinergique nous interesse particulierement dans ce manuscrit.
2.4.1 Periph6rie
Lorsque la rel&che de NT peut etre stimulee par 1'ingestion d'acides gras et de nourriture, une serie d'6v6nements est enclenchee dans le tractus gastro-intestinal (MASHFORD et al, 1978, ROSELL et ROKAEUS, 1979). Selon sa localisation au niveau intestinal, la NT influence differemment la motilite. En effet, dans le jejunum et Pil6um, la NT inhibe la motilite" tandis que dans le cdlon, elle la stimule. D'autres effets opposes de la NT au niveau intestinal sont la stimulation des secretions pancreatiques et biliaires et 4'inhibition de la sexr&ion d'acide gastrique. Tous ces effets neurotensinergiques permettent de coordonner les fonctions gastro-intestinales pour optimiser la digestion (FERRIS, 1989). La NT participe aussi aux phenomenes inflammatoires ayant lieu dans les intestins en activant certaines cellules immunitaires et inflammatoires telles que les mastocytes, les macrophages, les cellules T et les neutrophiles. Cette activation favorise une vasodilatation, une d^granulation des mastocytes et une permeabilisation vasculaire caractdristique d'une inflammation (GOLDMAN et al., 1983, ZHAO et POTHOULAKIS, 2006).
Ailleurs en peripheric, la NT est impliqu£e dans quelques systemes physiologiques dont le systeme cardio-vasculaire ou elle induit l'augmentation du rythme cardiaque et de la contractilite du myocarde en plus de modifier l'h&nodynamie centrale, le flot sanguin et la circulation coronarienne (OSADCHII et POKROVSKII, 1998). La NT
influence aussi la croissance cellulaire, dont celle des tumeurs cancereuses, par Pentremise des r£cepteurs NTS1 et NTS3. En effet, il a ete demontre" que la NT agit comme un facteur de croissance en favorisant la proliferation des cellules cancereuses lors des cancers de la prostate, du pancreas, du poumon et du colon (DAL FARRA et al., 2001, MARTIN et al, 2002a, NAVARRO et al., 2006).
2.4.2 Systeme nerveux central
La NT induit divers effets centraux au niveau de la thermoregulation, de Pactivite locomotrice, de P appetence, du stress, de la presion arterielle et de la douleur. L'injection intracerebroventriculaire (i.c.v.) de NT influence la thermoregulation et la locomotion en provoquant une hypothermie et une hypolocomotion respectivement (MAENO et al., 2004). De plus, l'injection centrale de NT au niveau de la VTA ou de Phypothalamus induit des effets anorexigenes chez les animaux trait£s avec ce peptide (CADOR et al., 1986, HAWKINS et al., 1986). En effet, la NT reduit Pappetence des animaux qui est m€di6e, entre autres, par le recepteur Hi de Phistamine, impliquee dans la prise alimentaire (OHINATA et al, 2004). La NT peut aussi jouer un r61e dans le stress. Lorsqu'elle est injectee i.c.v., elle provoque la liberation d'hormones corticotropes par Phypophyse ant£rieure et de corticosterone par la glande surr^nale, peptides normalement liberes en reponse a un stress (FUXE et al., 1984, GUDELSKY et al., 1989, NICOT et al., 1994). De plus, l'injection i.c.v. d'un antagoniste du recepteurs NTS1, le SR48692, reduit P effet de la corticosterone liberie lors d'un stress aigue (AZZI et al., 1998, NICOT et al, 1997). L'injection centrale de NT
influence la pression arterielle en provoquant des effets diametralement opposes, hypotension ou hypertension, variant selon le site d'injection et Petat d'eveil de l'animal teste" (CARRAWAY et LEEMAN, 1973, CIRIELLO et ZHANG, 1997, RIOUX et al, 1981, SHIDO et NAGASAKA, 1985, SUMNERS et al., 1982).
L'implication de la NT dans la nociception est l'effet central neurotensinergique le plus documents. La NT module le controle descendant de la douleur en intervenant dans la transmission nociceptive (DOBNER, 2006). Suite a un stimulus douloureux, il a ete demontr6 que la liberation de la NT ainsi que 1'expression du gene de la NT sont augmented dans la PAG, structure hautement impliqu^e dans le contrdle descendant de la douleur (MAENO et al, 2004). De plus, plusieurs etudes font 6tat des effets analgesiques de la NT injectee dans de nombreuses structures du SNC comme la moelle epiniere, plus precisement au niveau de l'espace intrathecal (i.t), et les regions corticales neurotensinergiques (HYLDEN et WILCOX, 1983, SARRET et al., 2005, URBAN et SMITH, 1993b). Un fait particulier est que la NT induit des reponses opposees selon son site d'injection et la dose utilisee. En effet, des doses de Pordre du picomolaire favorisent Phyperalgesie comparativement a des doses beaucoup elevees produisant de Panalgesic Ces effets contraires ont &e observes suite a Pinjection de NT dans le NRM (SMITH et al, 1997, URBAN et SMITH, 1993a). La NT medie ces effets via deux de ses trois r^cepteurs, soit les recepteurs NTS1 et NTS2. L'implication de ces derniefs dans la nociception est d6crite a la section 1.5. II faut toutefois noter que les deux types de recepteurs interviennent dans le controle de ce ph&iomene. Le tout a &e illustre par Putilisation de Pantagoniste du r^cepteur NTS1,
le SR48692, renversant partiellement l'effet analgesique de la NT, liant pr^ftrentiellement le recepteur NTS 1 a faible dose (SARRET et al., 2005).
2.5 Recepteurs de la neurotensine
Comme d£crit pr6c6demment, la NT est presente dans differentes regions centrales et peYipheriques ou elle induit de nombreux effets. Ces effets sont medics via les trois sous-types de r£cepteurs, NTS1, NTS2 et NTS3. II a ete d^montre que les deux premiers sous-types de recepteur sont impliques dans les effets neurotensinergiques les plus importants comme le controle de la thermoregulation, de l'appetit et de la douleur. Les prochaines sections porteront done davantage sur les deux premiers sous-types de recepteurs.
2.5.1 NTS 1
Un premier recepteur neurotensinergique, le recepteur NTS1, a 6t6 clone" et caracterise chez le rat et l'humain au debut des annees 90 (TANAKA et al., 1990, VINCENT, 1992, VITA et al., 1993). La structure primaire du recepteur est composed de 424 acides amines chez le rat et de 418 acides amines chez Phumain et celle-ci s'avere gtre idehtique a 84% entre ces deux especes (TANAKA et al, 1990, TYLER-MCMAHON et al., 2000). Le poids mol^culaire de ce recepteur a 7 domaines transmembranaires de la famille des recepteurs couples aux prot&nes G (RCPG) est de 47 kDa (VINCENT et al, 1999).
Ce RCPG est principalement couple" a la proteine Gq/n menant a 1'activation de la
phospholipase C (KITABGI, 2002). Selon le type cellulaire &udi6, il peut aussi etre couple a la proteine Gy0, inhibant l'adenylate cyclase ou activant la phospholipase A2,
ou a la proteine Gs, activant l'adenylate cyclase (BOZOU et al., 1986, GAILLY et al.,
2000, ISHIZUKA et al., 1993, YAMADA et al., 1994). Certains segments du recepteur NTS1 sont importants pour le couplage des proteines Gq/n et Gy0 au
recepteur soit la troisieme boucle intracellulaire et la partie C-terminale respectivement. Cette section du recepteur serait aussi impliquee dans le couplage de la proteine Gs (NAJMI et al, 2002, SKRZYDELSKI et al., 2003, YAMADA et al.,
1994). Une autre particularity de la partie C-terminale est qu'elle contient des residus requis pour le decouplage de la proteine G associee, soit ser-415, thr-416 et ser-417, et l'internalisation du recepteur, soit thr-422 et tyr-424 (CHABRY et al., 1995, CLAING, 2004, OAKLEY et al, 2001). La liaison de la NT, au niveau de la troisieme boucle extracellulaire du recepteur NTS1, mene done a 1'activation de differentes voies de signalisation impliquant le GMPc, l'AMPc, l'inositol phosphate, le calcium et les MAPK tels que ERK1/2 (GENDRON et al., 2004). La voie de signalisation des ERK1/2, kinases transformant un stimulus extracellulaire en r^ponse intracellulaire, a
6t6 6tudi6e au cours de mon projet de maitrise, car elle est module en situation
douloureuse. En effet, il a et6 d6montr6 que la stimulation de RCPG, comme ceux des opiac6s, favorisent majoritairement la phosphorylation des ERK1/2 (GUTSTEIN et al., 1997, MA et al., 2001). L'implication du recepteur NTS1 dans cette voie de signalisation est jusqu'a present m^connue.
Le recepteur NTS1 est designe" comme etant le recepteur a haute affinite de la NT, car il possede une affinite elevee de 0,1-0,3 nM pour le peptide, affinite 10 fois superieure a celle du recepteur NTS2 pour la NT (VINCENT et al., 1999). La liaison de la NT au r6cepteur NTS1 implique deux regions du recepteur soit la troisieme boucle extracellulaire et la jonction extracellulaire des domaines transmembranaires 4 et 6 (RICHARD et al, 2001). Une fois li6e au recepteur, la NT forme avec lui un complexe qui sera internalise. Cette internalisation necessite la phosphorylation de residus sirups dans la partie C-terminale du recepteur soit la threonine en position 422 et la tyrosine en position 424 (CHABRY et al, 1995). Une fois au niveau intracellulaire, le complexe se dissocie. Le recepteur NTS1 est degrade dans les lysosomes tandis que la NT est transportee par les endosomes tardifs et/ou de recyclage vers l'appareil de Golgi (VANDENBULCKE et al., 2000).
L'ARN messager (ARNm) et la proteine du recepteur NTS1 sont exprimes dans certaines regions du SNC, mais davantage au niveau de la substance noire, de la VTA, du septum lateral, du noyau du lit de la strie terminale et des cortex prefrontal, cingule, insulaire et suprarhinal (ALEXANDER et LEEMAN, 1998, BOUDIN et al, 1996, ELDE et al, 1990, FASSIO et al, 2000). L'ARNm du recepteur NTS l a aussi 6t€ localise" au niveau des DRGs, mais non dans la moelle 6piniere, par hybridation in situ (ZHANG et al., 1995).
Le recepteur NTS1 est le principal recepteur implique" dans les effets neurotensinergiques incluant rhypothermie et Phypolocomotion (REMAURY et al., 2002). De plus, son r61e dans Panalgesie induite par la NT a ete" demontre et ce majoritairement dans des modeles de douleur aigue. Des Etudes effectuees chez des
souris deficientes pour le gene du recepteur NTS1 et des rats invalides pour le meme gene d&nontrent une absence de l'effet analgesique, observe prdcedemment chez des animaux de type sauvage, suite a rinjection i.c.v. de NT lors du test de la plaque chaude (PETTIBONE et al., 2002, TYLER et al., 1998). D'autres recherches ont indique qu'une microinjection supraspinale d'un antagoniste liant preT6rentiellement le recepteur NTS1 a faible dose, le SR48692, renverse l'effet antinociceptif de la NT lors du test de retrait de la queue (SMITH et al., 1997, URBAN et GEBHART, 1997). Cette observation a 6t6 d^crite par une autre etude ou l'analgesie induite par la NT ou un agoniste sp^cifique NTS1, le PD149163, injects dans la medulla rostro-ventrale 6tait bloqu<§e par le SR48692 lors du meme test (BUHLER et al., 2005).
2.5.2 NTS2
Suite a la decouverte du premier recepteur neurotensinergique, le recepteur NTS2 a 6te" clon6 par homologie avec le recepteur NTS1 de rat et de souris (CHALON et al.,
1996, MAZELLA et al., 1996). La structure primaire du recepteur NTS2 est constitute de 416 acides amines chez le rat et de 410 acides amines chez Phumain (VINCENT et al, 1999). Le poids moldculaire de cet autre recepteur a 7 domaines transmembranaires couple aux prolines G est d'environ 46 kDa (SARRET et al., 2005). Comparativement au recepteur NTS1, le recepteur NTS2 possede une troisieme boucle intracellulaire et une partie C-terminale plus longues et une partie N-terminale plus courte. Malgre ces differences structurales, les deux recepteurs sont identiques a 43% et sont homologues a 64% (VINCENT et al., 1999).
Hoist et ses collaborateurs avancent l'hypothese que ce RCPG pourrait 6tre coupte aux prolines Gq/n, Gy0 et Gn/u (HOLST et al., 2004). Toutefois, il a 6te" d6montr6
que la liaison de la NT ou d'agonistes au r^cepteur NTS2 influence diverses voies de signalisation incluant l'inositol phosphate, le calcium, Tacide arachidonique et les MAPK tels que ERK1/2 (VITA et al., 1998, YAMADA et al, 1998). L'activation de ces voies de signalisation est dependante du modele cellulaire etudie" et du niveau d'expression du r^cepteur.
Le r^cepteur NTS2 possede une affinity pour la NT de 1-5 nM, done 10 fois plus faible que celle du r<§cepteur NTS1 pour la NT (VINCENT et al., 1999). Lorsque la NT et le r^cepteur NTS2 forme un complexe, celui-ci est internalise" via des vesicules de clathrine (SARRET et al., 2002). A l'int&ieur de la cellule, la NT est transported par les endosomes tardifs et/ou de recyclage vers l'appareil de Golgi tandis que le r^cepteur est recycle a la surface membranaire. Ce recyclage est dependant de la phosphorylation d'une seule tyrosine, la tyrosine 237, situ6e dans la troisieme boucle intracellulaire (MARTIN et al., 2002b).
L'ARNm et la proteine du recepteur NTS2 sont fortement exprimes dans le bulbe olfactif, le noyau du lit de la strie terminale, le noyau preoptique, l'amygdale, le noyau thalamique anterieur, la substance noire, la VTA, le cortex cerebelleux, la PAG, le noyau dorsal du raph6, le noyau reticule et le NRM (MAZELLA et al, 1996, SARRET et al., 1998, SARRET et al., 2003b, WALKER et al., 1998).
L'implication du recepteur NTS2 dans les effets neurotensinergiques est r£pertori6e principalement au niveau de la modulation de la douleur aigug, ou il est impliqu6 dans l'effet antinociceptif induit par la NT. Cette implication a £te demontr6e, entre autres,
a l'aide du «writhing test» consistant a injecter intraperitonealement de l'acide ac&ique pour induire une douleur aigue, observed en crampes abdominales. Chez des souris deficientes pour le gene du r^cepteur NTS1, l'injection i.c.v. de NT a induit le mSme effet que chez des souris de type sauvage lors du « writhing test», ce qui sp£cifie que ce recepteur n'est pas implique dans l'analgesie induite par la NT (REMAURY et al., 2002). Lors de ce m§me test, une analgesie est observed suite a l'injection i.c.v. d'un agoniste du recepteur NTS2, la levocabastine (DUBUC et al, 1999a). Toujours lors du « writhing test», l'injection d'oligonucleotides antisens NTS2 chez des souris a d£montre une diminution de 1'analgesie normalement observed apres l'injection i.c.v. de NT (DUBUC et al, 1999b). De plus, une etude effectuee a l'aide du test du retrait de la queue indique que 1'analgesie observed suite a une injection i.t. de NT chez des rats est induite par 1'activation des r£cepteurs NTS2, car elle est toujours presente lors de l'injection d'agonistes NTS2, tels que le JMV-431 et la levocabastine, et elle est partiellement inhibee par le SR48692, un antagoniste liant preTerentiellement le recepteur NTS1 a faible dose, mais le r£cepteur NTS2 a plus forte dose (SARRET et al., 2005). II a ete demontre" lors du test de la plaque chaude qu'il n'y a aucune difference entre des souris de type sauvage et des souris deficientes pour le recepteur NTS1, contrairement a ce qui est observe" avec des souris deficientes pour le recepteur NTS2. Cette etude indique done que la NT medie son effet antinociceptif, en partie, via le recepteur NTS2, car il y a diminution de son effet lorsque le recepteur est absent (MAENO et al., 2004).
2.5.3 NTS3
Le recepteur NTS3 a ete purifie et clone au courant des annees 90 et il a la particularite d'etre identique a 100% a la proteine gp95/sortiline (MAZELLA et al., 1989, MAZELLA et al, 1998, ZSURGER et al., 1994). Ce recepteur de type I, contrairement aux recepteurs NTS1 et NTS2, est compose d'un seul domaine transmembranaire. Recemment, il a ete inclus dans une nouvelle famille de recepteurs soit celle des recepteurs de type VsplOp. Les recepteurs de cette famille possedent des caracteYistiques particulieres dont un domaine riche en cysteines, un seul domaine transmembranaire et au moins un site de clivage a la furine, une proline convertase (MAZELLA et VINCENT, 2006). Le r£cepteur NTS3 est constituS de 833 acides amines et son poids moleculaire est de 100 kiloDaltons (MAZELLA et al, 1998). M&ne s'il possede des proprietes de liaison semblables au recepteur NTS1, le recepteur NTS3 a une affinite" pour la NT variant selon sa composition. En effet, la partie N-terminale du recepteur est composed d'un site de clivage a la furine determinant 1'affinite" du recepteur pour la NT (sans clivage: 10-20 nM et apres clivage : 0,3 nM) (MAZELLA et al., 1998). En plus de la NT, le recepteur NTS3 a la capacity de Her, entre autres, la lipoproteine lipase, le pr6curseur du nerve growth
factor (NGF) et le propeptide NTS3 (inhibiteur derive du precurseur de NTS3)
(DICOU et al., 2004, MARTIN et al., 2005). Plusieurs regions centrales expriment fortement le recepteur NTS3 ou son ARNm tels que le cortex olfactif, le septum medial et la PAG ou le recepteur se retrouve dans les cellules gliales, les neurones et les adipocytes (SARRET et al., 2003a). Quelques etudes ont demontre 1'implication du recepteur dans la migration des microglies, 1'expression de genes, la rel&che de
cytokines/chimiokines par les microglies et la proliferation de cellules cancereuses (DICOU et al., 2004, MARTIN et al., 2005). Jusqu'a present, aucune &ude n'a fait mention d'un possible role pour le recepteur NTS3 dans la douleur.
OBJECTIFS DU PROJET
Les traitements analgesiques actuels pour soulager la douleur, tels que les opiaces, sont efficaces, mais leur utilisation presente toujours un risque d'effets secondaires indesirables. La NT repr^sente une alternative a considerer, car son potentiel analgesique a 6t6 maintes fois demontre. De plus, quelques Etudes font &at de P implication dans la douleur d'un des RCPG neurotensinergique, soit NTS1, et ce principalement dans la douleur de type aigue\ Aucune etude ne fait mention du r61e de ces r^cepteurs dans la douleur chronique. Un moyen efficace, rapide et economique est de determiner le potentiel analgesique de composes avant d'entreprendre des etudes en douleur chronique est le test a la formaline. Ce test permet d'obtenir une douleur phasique et persistante comportant une phase aigue et inflammatoire. II consiste a injecter de la formaline, un agent inflammatoire, et de noter les comportements qui s'en suivent. La formaline provoque la liberation de m^diateurs pro-inflammatoires au niveau du site injecte, stimule P expression de certains genes tel que la proline Fos et active des voies de signalisation comme celle des MAPK.
Les objectifs de ce projet sont done de :
1- Determiner le r61e du r^cepteur NTS1 dans Panalgesie induite par la NT dans un niodele animal de douleur tonique, le test a la formaline, par Pentremise d' agonistes et d' antagonistes du recepteur NTS 1.
2- Correler les resultats comportementaux avec Pactivite neuronale retrouvee au niveau de la moelle £piniere a Paide de Pexpression de la proline Fos.
3- Determiner la distribution ainsi que la localisation du r^cepteur NTS1 au niveau spinal et au niveau des DRG.
4- Observer 1'impact des agonistes du recepteur NTS1 sur 1'activation de la voie de signalisation des MAPK.
ARTICLE
SPINAL NTS1 RECEPTORS REGULATE NOCICEPTIVE SIGNALING IN A FORMALIN TONIC PAIN MODEL
Genevieve Roussy1, Marc-Andr6 Dansereau1, Louis Dore-Savard1, Karine
Belleville1, Nicolas Beaudet1, Elliott Richelson2, and Philippe Sarret1.
1 Department of Physiology and Biophysics, Faculty of Medicine and Health
Sciences, University of Sherbrooke, Sherbrooke, Quebec, Canada.
2 Department of Psychiatry and Psychology, Mayo Clinic College of Medicine,
Jacksonville, FL 32224, USA.
Article soumis le 17 septembre 2007 au Journal ofNeurochemistry, revise le 15 novembre 2007 et accepte le 17 d6cembre 2007.