THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées Ecologie et biologie des interactions - EBI (Poitiers)
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par : Emilie Portier
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms naturels
Directeur(s) de Thèse : Yann Héchard, Jérôme Labanowski Soutenue le 17 octobre 2014 devant le jury
Jury :
Président Pierre Grève Professeur des Universités, Université de Poitiers
Rapporteur Christine Roques Professeur des Universités, Université Paul Sabatier de Toulouse 3 Rapporteur Christophe Gilbert Maître de conférences, Université de Lyon 1
Membre Yann Héchard Professeur des Universités, Université de Poitiers Membre Jérôme Labanowski Chargé de recherche CNRS, Université de Poitiers Membre Carmen Buchrieser Directeur de recherche, Institut Pasteur de Paris
Pour citer cette thèse :
Emilie Portier. Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms naturels [En ligne]. Thèse Aspects moléculaires et cellulaires de la biologie. Poitiers : Université de Poitiers, 2014. Disponible sur Internet <http://theses.univ-poitiers.fr>
T
HESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(FACULTE DES SCIENCES FONDAMENTALES ET APPLIQUEES) (Diplôme National- Arrêté du 7 août 2006)
Ecole doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de Recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par :Emilie PORTIER
Rôle du fer sur
Legionella pneumophila
et
sur sa persistance dans les biofilms complexes
Directeur de thèse : M. Yann HéchardCo-directeur de thèse : M. Jérôme Labanowski
Soutenue le 17 octobre 2014, devant la commission d’examen :
Rapporteurs : Examinateurs : Mme Christine Roques M. Christophe Gilbert
Professeur, Université Paul Sabatier, Toulouse Maître de Conférences HDR, Université Lyon 1
Mme Carmen Buchrieser M. Pierre Grève M. Jérôme Labanowski M. Yann Héchard
Directeur de Recherche, Institut Pasteur, Paris Professeur, Université de Poitiers
Chargé de recherche CNRS, Université de Poitiers Professeur, Université de Poitiers
T
HESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(FACULTE DES SCIENCES FONDAMENTALES ET APPLIQUEES) (Diplôme National- Arrêté du 7 août 2006)
Ecole doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de Recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par :Emilie PORTIER
Rôle du fer sur
Legionella pneumophila
et
sur sa persistance dans les biofilms complexes
Directeur de thèse : M. Yann HéchardCo-directeur de thèse : M. Jérôme Labanowski
Soutenue le 17 octobre 2014, devant la commission d’examen : Rapporteurs : Examinateurs : Mme Christine Roques M. Christophe Gilbert
Professeur, Université Paul Sabatier, Toulouse Maître de Conférences HDR, Université Lyon 1
Mme Carmen Buchrieser M. Pierre Grève M. Jérôme Labanowski M. Yann Héchard
Directeur de Recherche, Institut Pasteur, Paris Professeur, Université de Poitiers
Chargé de recherche CNRS, Université de Poitiers Professeur, Université de Poitiers
Remerciements
Cette étude a été réalisée dans l’équipe de Microbiologie de l’Eau, du Laboratoire Ecologie et Biologie des Interactions, UMR CNRS 7267, dirigée par Monsieur Didier Bouchon. Je
tiens à lui adresser mes sincères remerciements pour m’avoir permis de réaliser ces travaux
au sein de son laboratoire.
J’adresse tous mes remerciements à Madame Christine Roques, Professeur à l’Université Paul Sabatier de Toulouse et à Monsieur Christophe Gilbert, Maître de Conférences à
l’Université de Lyon, de m’avoir fait l’honneur d’être rapporteurs de ce travail.
Je remercie également Madame Carmen Buchrieser, Directeur de Recherche à l’Institut Pasteur de Paris, et Monsieur Pierre Grève, Professeur à l’Université de Poitiers, d’avoir accepté participer à ce jury de thèse.
Je tiens à remercier tout particulièrement mes directeurs de thèse, Yann Héchard et Jérôme
Labanowski. Merci pour les discussions et les précieux conseils que vous m’avez apporté tout au long des ces quatre dernières années. Je vous présente également toute ma reconnaissance
pour votre confiance. Merci de m’avoir permis d’aller travailler chez nos collaborateurs. C’est une chance que je n’aurai jamais espéré.
Je remercie très sincèrement, Madame Carmen Buchrieser et Monsieur Nicholas Cianciotto,
Professeur à l’Université de Chicago, pour m’avoir accueillit dans leurs Laboratoires de Recherches. Et bien sûr, je souhaite dire un grand merci à toutes les personnes qui ont participé au projet, Tobias Sahr, Huaixin Zengh, Denise Burnside, Jessica Tyson et Celeste
Malama.C’est un honneur pour moi d’avoir travaillé avec vous, merci à tous pour votre aide très précieuse.
Un grand merci également à Jean-Marc Berjeaud et à Julien Verdon pour tout, les conseils,
les discussions scientifiques, leur soutient et le reste…
Un clin d’œil à toutes les personnes qui m’ont entouré pendant ces dernières années, Clém,
Marie-Claude, Didi, Laurence, Karine, Dada, Nawel, Renaud, Stéph, Christophe, Luce et
Ascel, ainsi que tous les membres du CHU. Chacun d’entre vous mériterait un paragraphe
mais je ne vais pas m’en sortir…
Anne, merci pour tous les conseils que tu m’as apporté et pour tes encouragements. Nono, ça
a été un grand plaisir de partager mon bureau avec toi, et n’oublies pas, c’est nous les
Warriors !
Petite dédicace, à Elo, Vincent, Jéjé et Lucille (et vos moitiés), on a passé de bon moment
tous ensemble… Bon courage pour la suite, et au plaisir de vous voir dans le grand nord…
Je garde les meilleurs pour la fin, mes parents et mon fréro, qui malgré toutes les épreuves
qu’on a pu traverser ces dernières années ont toujours été là pour moi, m’ont poussé, encouragé et soutenu. C’est aussi grâce à vous que j’en suis là aujourd’hui. Merci !
Sommaire
Liste des abréviations ... 1
Liste des figures ... 3
Liste des tableaux ... 5
Introduction Générale ... 7
Partie 1. Etude bibliographique ... 13
1. Legionella pneumophila ... 14
1.1. Le genre Legionella... 14
1.1.1. Généralités ... 14
1.1.2. Ecologie ... 17
1.1.3. La légionellose ... 20
1.2. Les facteurs de virulence ... 23
1.2.1. Internalisation de L. pneumophila et formation des vacuoles réplicatives ... 23
1.2.2. Rôle du système Dot/Icm ... 25
1.2.3. Différenciation de L. pneumophila ... 27
1.2.4. Réponse stringente ... 29
1.2.5. Régulation du passage en phase transmissive ... 31
1.2.6. Rôle du système de sécrétion de type II ... 34
2. Rôle du fer chez L. pneumophila ... 38
2.1. Rôle du fer chez les bactéries ... 38
2.2. Les sidérophores... 42
2.2.1. Découverte des sidérophores ... 42
2.2.2. Production de la légiobactine ... 43
2.2.3. Rôle des sidérophores dans l’infection ... 46
2.3. Transport du fer ferreux ... 46
2.4. Autres voies d’acquisition/assimilation du fer ... 48
2.4.1. Voie codée par les gènes iraA et iraB ... 48
2.4.2. Voie impliquant la maturation du cytochrome C ... 48
2.4.3. Rôle de la pyomélanine dans l’acquisition du fer ... 50
2.5. Relation entre le fer et la virulence ... 51
3.1. Généralités sur les biofilms ... 53
3.1.1. Définition ... 53
3.1.2. Structures ... 54
3.1.3. Formation d’un biofilm ... 56
3.1.4. Biofilms multi-espèces ... 59
3.1.5. Résistance aux traitements antibactériens ... 61
3.2. Interaction de L. pneumophila avec les biofilms ... 63
3.2.1. Les biofilms : niche écologique pour L. pneumophila ... 63
3.2.2. Prolifération de L. pneumophila dans les biofilms ... 66
3.2.2.1. Implantation du biofilm ... 66
3.2.2.2. Croissance du biofilm ... 67
3.2.3. Dernière étape : dissémination de L. pneumophila ... 68
3.3. Impact du fer ... 69
3.3.1. Sur les biofilms complexes multi-espèces naturels ... 69
3.3.2. Sur les biofilms mono-espèces de L. pneumophila ... 69
Partie 2. Matériel et méthodes ... 73
1. Méthodes de microbiologie ... 74
1.1. Souches bactériennes et cellulaires ... 74
1.2. Milieux de cultures ... 75
1.2.1. Culture de Legionella ... 75
1.2.2. Culture d’Escherichia coli ... 76
1.2.3. Culture des amibes ... 76
1.2.4. Culture des cellules U937 ... 76
1.3. Numération des microorganismes ... 77
1.3.1. Numération des légionelles ... 77
1.3.1.1. Par densité optique ... 77
1.3.1.2. Par numération des unités formant colonies (UFC) ... 77
1.3.2. Numération des cellules ... 77
1.4. Tests d’infection ... 78
1.4.1. Infection des macrophages ... 78
1.4.2. Infection des amibes ... 79
1.5. Internalisation de L. pneumophila dans les amibes ... 79
2.1. Extraction des acides nucléiques ... 81
2.1.1. Extraction ADN ... 81
2.1.2. Extraction ARN ... 81
2.2. Réaction de polymérisation en chaîne (PCR) ... 82
2.3. PCR en temps réel (PCRq) ... 83
2.3.1. Principe ... 83
2.3.2. Réalisation de la gamme étalon ... 84
2.4. Analyse quantitative de l’expression des gènes par RT-PCRq ... 84
2.5. Analyses t-RFLP ... 85
2.5.1. Principe ... 85
2.5.2. Conditions expérimentales ... 85
2.6. Analyse Microarray ... 87
2.7. Transformation naturelle ... 88
2.7.1. Construction d’un fragment d’ADN ... 88
2.7.2. Préparation des bactéries ... 89
2.8. Technique de clonage ... 90
2.8.1. Préparation des bactéries électrocompétentes ... 90
2.8.2. Constructions plasmidiques ... 91
2.8.3. Electroporation ... 92
3. Méthodes biochimiques ... 95
3.1. Test de la sensibilité à une carence en fer ... 95
3.2. Test NaCl ... 95
3.3. Test H2O2 ... 96
3.4. Activité des sidérophores ... 96
3.4.1. Production des sidérophores : Test Chrome Azurol S (CAS) ... 96
3.4.2. Test d’activité des sidérophores... 97
3.4.3. Utilisation des sidérophores ... 97
4. Formation des biofilms ... 98
4.1. Echantillonnage eau de rivière ... 98
4.2. Culture des biofilms complexes en condition semi-statique ... 98
4.3. Culture des biofilms complexes en condition de flux continu ... 99
5. Microscopie ... 101
5.1. Microscopie confocale ... 101
6. Spectrométrie par torche à plasma ... 102
6.1. Principe ... 102
6.2. Préparation des échantillons ... 102
Partie 3. Résultats ... 105
1. Rôle du fer sur l’implantation de L. pneumophila dans les biofilms complexes ... 106
1.1. Mise en place du modèle de biofilms complexes... 106
1.1.1. Mise en place des biofilms ... 106
1.1.2. Stratégie de dopage des biofilms ... 108
1.2. Publication 1: Role of iron in the persistence of L. pneumophila in complex biofilms ... 110
1.3. Résultats complémentaires ... 140
1.3.1. Détection des amibes dans les biofilms ... 140
1.3.2. Formation des biofilms à 20 °C ... 141
2. Rôle du fer sur l’expression des gènes de L. pneumophila ... 143
2.1. Publication 2: IroT/MavN, a new iron-regulated gene involved in L. pneumophila virulence against amoebae and macrophages ... 143
2.2. Résultats complémentaires ... 188
2.2.1. Analyse de l’expression des gènes de L. pneumophila cultivée en milieu BYE vs. BYE sans fer ... 188
2.2.2. Relation entre la carence en fer et le passage de L. pneumophila en phase transmissive... 189
2.2.2.1. Impact de la carence en fer sur l’expression des gènes induits lors du passage en phase transmissive ... 190
2.2.2.2. Test de résistance au NaCl ... 191
2.2.2.3. Test de résistance au H2O2 ... 193
2.2.2.4. Test d’entrée dans les amibes ... 194
2.2.2.5. Test de mobilité... 195
2.2.3. Implantation de lpw_30711 et lpp_2867 dans les biofilms complexes ... 196
Partie 4. Discussion ... 199
Conclusion générale et perspectives ... 211
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 1
Liste des abréviations
ACES: « N-2-acetamido-2-aminoethansulfonic acid »
BCYE: « Buffered Charcoal Yeast Extract »
BYE: « Buffered Yeast Extract »
CAS: « Chrome azurol assay »
Ccm: « Cytochrome c maturation »
CDM: « Chemical defined medium »
Cp: « Crossing point »
cy5, cy3: Cyanine 5/3
Da: Dalton
DFX: Deferoxamine mésylate
DIP: 2, 2’ dipyridyl
dNTP: Déoxynucléotides tri-phosphates
DO: Densité optique
EDTA: Acide éthylène diamine tétra-acétique
FAM: 6’ carboxyfluorescéine
GCAT: Glycerophospholipide cholesterol acyltransférases
HGA: « Homogentisic acid »
ICP: « Inductively coupled plasma »
InVs: Institut de Veille Sanitaire
LB: Luria Bertani
LCV: « Legionella containing vacuoles » MFS: « Major Facilitator superfamily »
MIF: « Mature intracellular form »
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 2
MOI: « Multiplicity of infection »
Mpb: Méga paire de base
pb: Paire de base
PBS: « Phosphate Buffered saline »
PCRq: Réaction quantitative de polymérisation en chaîne
Pht: « Phagosomal transporter »
PMA: Phorbol-12- Myristate
PPF: Pyrophosphate de fer
QS: Quorum Sensing
RNAP: « RNA polymerase »
ROS: « Reactiv oxygen species »
Rpm: Rotation par minute
RT-PCR: Reverse transcription couplée à la réaction de polymérisation en chaîne
SPE: Substance polymérique extracellulaire
SVF: Sérum de veau fœtal
TAR: Tours aéroréfrigérantes
TIISS: Système de sécrétion de type II
TIVSS: Système de sécrétion de type IV
t-RFLP: « Terminal restriction fragment length polymorphisme »
UFC: Unité formant colonie
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 3
Liste des figures
Figure 1 : Images de Legionella pneumophila prises en microscopie électronique ... 15
Figure 2 : Développement et libération de Legionella dans un système de distribution d’eau ... 18
Figure 3 : Evolution du nombre de cas et du taux annuel d’incidence des cas notifiés de légionellose en France, entre 1988 et 2012 ... 22
Figure 4 : Cycle de vie intracellulaire de L. pneumophila ... 24
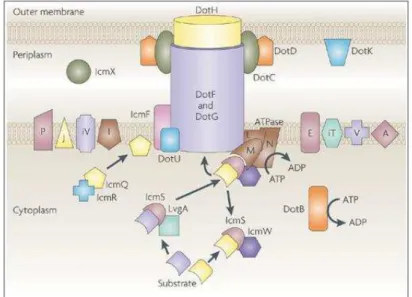
Figure 5 : Système Dot/Icm ... 26
Figure 6 : Cycle de vie de L. pneumophila ... 29
Figure 7 : Réponse stringente chez les bactéries ... 31
Figure 8 : Modèles de régulation des phases réplicatives et transmissives ... 32
Figure 9 : Modélisation du système de sécrétion de type II ... 35
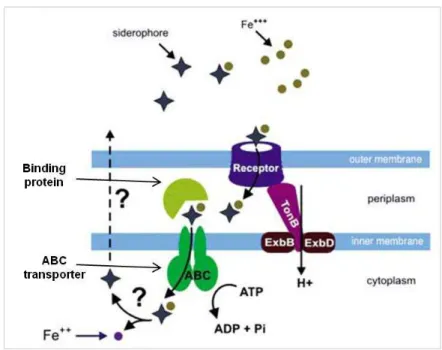
Figure 10 : Représentation schématique du transport du fer ferrique chez les bactéries Gram négatif, mettant en jeu des sidérophores ... 39
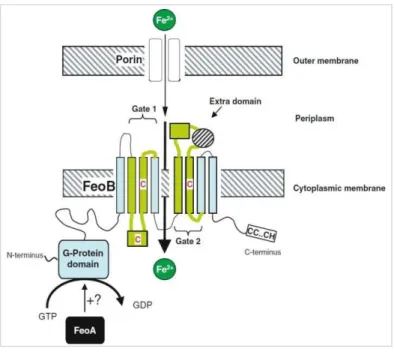
Figure 11 : Représentation schématique du transport du fer ferreux par les protéines Feo, chez E. coli ... 40
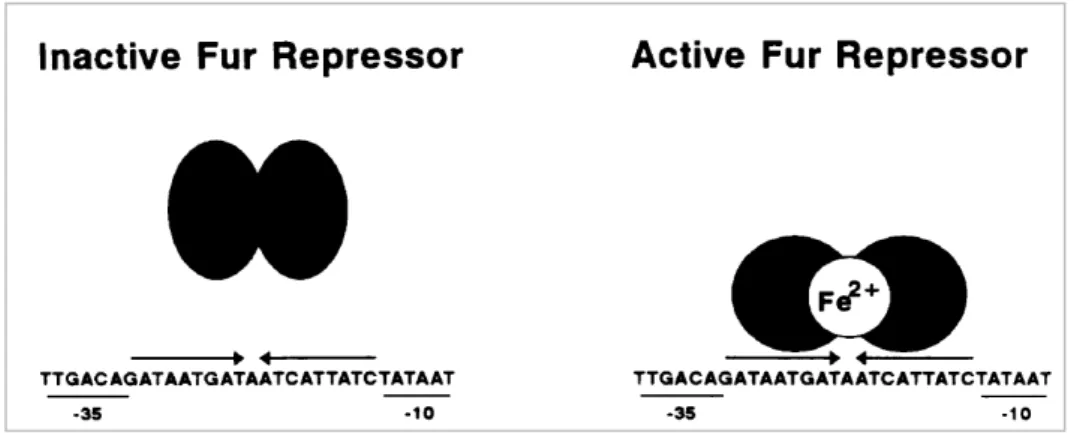
Figure 12 : Représentation schématique de la régulation du fer par la protéine Fur, chez E. coli. ... 41
Figure 13 : Structures chimiques de quelques chélateurs de fer ... 42
Figure 14 : Schéma récapitulatif des différentes voies métaboliques impliquées dans l’acquisition du fer chez L. pneumophila ... 44
Figure 15 : Représentation du système multiprotéique codé par l’opéron ccm et impliqué dans la maturation des cytochromes de type C ... 50
Figure 16 : Image de microscopie à contraste de L. pneumophila cultivée en présence ou non de fer ... 52
Figure 17 : Image de microscopie électronique de biofilms formés sur une surface en acier dans un système d’eau industrielle et sur un dispositif médical implanté ... 54
Figure 18 : Observation au microscope à épifluorescence d’un biofilm complexe développé sur une surface en acier dans un réacteur d’eau potable ... 55
Figure 19 : Développement d’un biofilm en cinq étapes ... 58
Figure 20 : Effets du PPF, à différentes concentrations, sur la formation des biofilms de L. pneumophila Lens ... 70
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 4
Figure 21 : Construction du fragment d’ADN, visant à inactiver le gène lpp_2867 ... 89 Figure 22 : Représentation schématique de la méthode utilisée pour cultiver les biofilms en condition semi-statique ... 99 Figure 23 : Représentation schématique du montage réalisé pour la croissance de biofilm en flux continu ... 100 Figure 24 : Structure des biofilms formés dans l’eau de rivière en flux continu et en condition semi-statique ... 108 Figure 25 : Comparaison d’un ou plusieurs dopages sur la persistance de L. pneumophila dans les biofilms complexes ... 109 Figure 26 : Quantification des amibes dans les biofilms formés en présence de DIP ... 140 Figure 27 : Comparaison de la persistance de L. pneumophila dans des biofilms formés à 37 °C ou à 20 °C ... 142 Figure 28 : Comparaison de la croissance de L. pneumophila dans du milieu BYE standard ou carencé en fer ... 189 Figure 29 : Effets de la carence en fer sur la résistance de L. pneumophila au NaCl (100 mM). ... 192 Figure 30 : Effets de la carence en fer sur la résistance de L. pneumophila au H2O2 (10 mM) ... 194 Figure 31 : Entrée de L. pneumophila dans les amibes après traitements aux chélateurs ... 195 Figure 32 : Effets du fer et des chélateurs, sur l’implantation des mutants lpw_30711 et
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 5
Liste des tableaux
Tableau 1 : Souches de bactéries utilisées au cours de l’étude ... 74
Tableau 2 : Séquences des amorces utilisées en PCRq et en t-RFLP ... 93
Tableau 3 : Séquences des amorces utilisées pour la construction des mutants ... 93
Tableau 4 : Séquences des amorces utilisées en RT-PCRq... 94
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 7
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 8
L’une des thématiques de recherche du laboratoire de Microbiologie de l’Eau est l’étude de la
maîtrise du développement de Legionella pneumophila, ainsi que ces interactions avec les biofilms et les amibes libres.
L. pneumophila est une bactérie pathogène de l’homme, présente dans les environnements aquatiques naturels ou artificiels. La contamination se fait par inhalation de particules d’eau
contaminées par la bactérie et est responsable de la légionellose. Cette infection constitue un
problème de santé publique car elle cause chaque année environ 1300 cas, avec 12% de
mortalité, malgré les thérapies mises en place pour la traiter.
En effet, la survie et la prolifération de ce pathogène sont essentiellement conditionnées par la
présence de protozoaires tels que les amibes, au sein des biofilms. Les biofilms, présents sur
des surfaces en contact avec l’eau, sont constitués par des agrégats de microorganismes enchâssés dans une matrice d’exopolymères. Ils procurent à L. pneumophila un environnement lui permettant de résister au stress environnemental et aux traitements
biocides. La présence d’autres microorganismes est indispensable à la prolifération de L. pneumophila, comme par exemple, les amibes, à l’intérieur desquelles elle se multiplie et acquière certaines propriétés phénotypiques. Après son passage dans les amibes, L. pneumophila développent un plus fort potentiel infectieux, elle est également plus résistante aux biocides, aux traitements thermiques et chimiques. Après multiplication, L. pneumophila est libérée dans le milieu extracellulaire, et peut ainsi se disséminer dans l’environnement
aquatique.
Dans cette étude, nous nous sommes intéressés aux interactions de L. pneumophila avec les biofilms. En 2008, notre équipe a mené une étude transcriptomique visant à comparer
l’expression des gènes chez L. pneumophila à l’état de biofilm mono-espèce, et sous sa forme
planctonique. Parmi les gènes modulés, les gènes pvcA et pvcB ont été induits. Ces deux gènes sont impliqués dans le métabolisme du fer. Leurs séquences présentent des similarités
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 9
avec les gènes codant la biosynthèse de sidérophores (pyoverdine) chez Pseudomonas aeruginosa. L’impact de fortes concentrations en fer, sur la formation de biofilms mono-espèce de L. pneumophila, a également montré que l’ajout de fer ralentissait la croissance du biofilm. Ces résultats ont permis de suggérer que le fer a un rôle dans la formation et le
développement des biofilms par L. pneumophila.
De plus, il est acquit que le fer est l’un des éléments indispensable à la croissance de L. pneumophila. Il présente également un rôle important dans la pathogénicité et la physiologie de la bactérie.
Au regard de ces résultats, il nous a semblé intéressant d’étudier l’impact du fer sur la formation des biofilms de L. pneumophila.
Ainsi, les deux principaux objectifs de notre étude sont, dans un premier temps, de voir
l’impact du fer ou au contraire les conséquences d’une carence en fer sur l’implantation et la
persistance de L. pneumophila dans les biofilms complexes. Dans un second temps nous
voulions avoir une vision plus globale de l’effet du fer au niveau de l’expression des gènes de L. pneumophila. Afin de réaliser ces objectifs, nous avons développé deux axes de recherche.
Le premier axe a été consacré à la mise en place d’un nouveau modèle de biofilms complexes, ainsi qu’à l’étude de l’impact du fer sur la persistance de L. pneumophila dans ces biofilms. Le second axe a été orienté sur la comparaison de l’expression des gènes de L. pneumophila,
cultivée dans un milieu de culture classique ou carencé en fer. Les résultats de l’analyse transcriptomique nous ont permis d’identifier un gène en particulier, induit par la carence en
fer : lpp_2867. La fin de l’étude a été consacrée à la caractérisation de ce gène, dans le but de comprendre son rôle dans le métabolisme du fer et dans la virulence de L. pneumophila. Les analyses transcriptomiques ont été réalisées dans le laboratoire de Carmen Buchrieser, à
l’Institut Pasteur, et dans lequel j’ai pu effectuer un stage de trois semaines. Les expériences
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 10
effectuées, en partie, dans le laboratoire de Nicholas Cianciotto, à l’Université de Médecine de Chicago. J’ai également eu l’opportunité d’y aller cinq semaines afin de réaliser une partie
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 13
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 14
1. Legionella pneumophila
En 1976, une épidémie de pneumonie a frappé plusieurs membres de la légion américaine, à
Philadelphie en Pennsylvanie (McDade et al., 1977). Ce n’est qu’en janvier 1977 que l’agent responsable de cette épidémie fût isolé par Joseph McDade et Charles Shepard. Le genre
Legionella fut ensuite établi en 1978 lors du premier symposium international sur la maladie des légionnaires et la bactérie isolée fut nommée Legionella pneumophila, pour souligner sa capacité à infecter les poumons (Brenner et al., 1979). La voie de transmission la plus communément admise est l’inhalation d’aérosols contaminés par les bactéries (Yu, 1993), pouvant atteindre les alvéoles pulmonaires (Muder & Yu, 2002; Newton et al., 2010). Le plus souvent, les sources de contamination sont les installations artificielles telles que les tours
aéroréfrigérantes (TAR) (Abu Kwaik et al., 1998) ou les systèmes de climatisation. Des niches naturelles existent également, comme les eaux des lacs et des rivières, dans lesquelles
se forment très souvent des biofilms susceptibles d’abriter L. pneumophila.
1.1. Le genre Legionella
1.1.1. Généralités
L. pneumophila appartient au genre Legionella et à la famille des Legionellaceae.
L’utilisation de la séquence du gène codant l’ARNr 16S a permis de confirmer que les Legionellaceae forment un sous-groupe de la subdivision gamma des protéobacteries. Le
nombre de sérogroupes et d’espèces ne cesse d’augmenter. Environ 59 espèces sont connues à
ce jour, comprenant 70 sérogroupes du genre Legionella, et 24 d’entre eux ont été associés à des pathologies humaines (Newton et al., 2006; Newton et al., 2010). L. pneumophila est
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 15
responsable de 90% des cas de légionellose et 84% sont causés par le sérogroupe 1 (Newton
et al., 2010). En France, L. pneumophila sérogroupe 1 est retrouvée dans 95% des isolats cliniques (Doleans et al., 2004). Son impact sur la santé publique oriente les recherches sur ce sérogroupe en particulier. En Australie et Nouvelle Zélande, une autre espèce prédomine. Il
s’agit de L. longbeachae, responsable de 30% des cas de légionellose (Yu et al., 2002). Au niveau mondial, les trois espèces L. longbeachae, L. bozomanae et L. micdadei causent 2 à 8% des cas de légionellose (Muder & Yu, 2002; Newton et al., 2010). Les espèces citées précédemment, sont celles les plus souvent impliquées dans les cas d’infection. Les autres espèces sont très rares, et très peu impliquées dans des cas de légionellose. Il existe aussi des
espèces proches, non cultivables en l’absence d’amibes, qui sont appelées « Legionella like amoebal pathogens » (Benson & Fields, 1998).
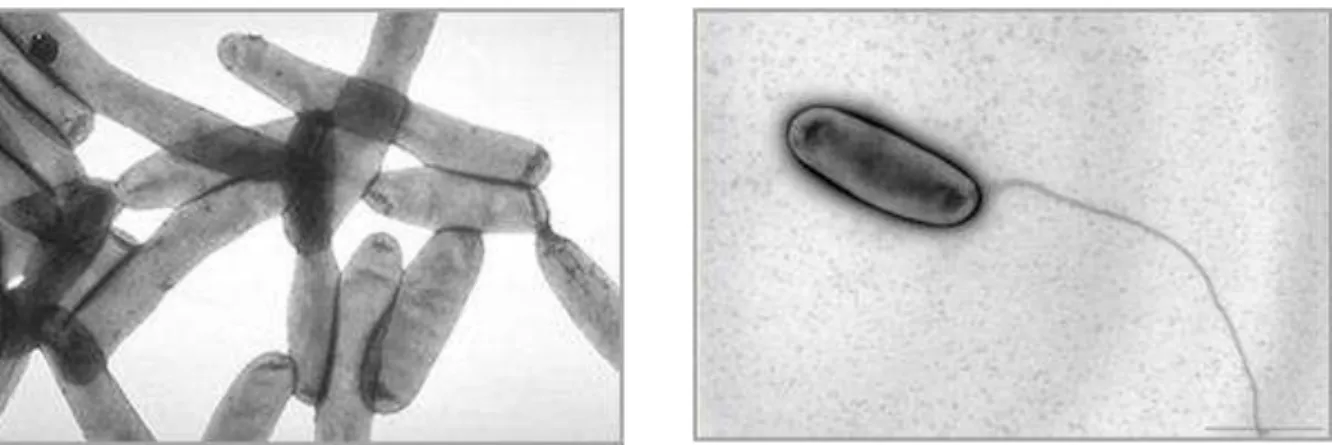
Figure 1 : Images de Legionella pneumophila prises en microscopie électronique (Brenner et al., 1979; Cazalet & Buchrieser, 2005).
L. pneumophila est un coccobacille Gram négatif (McDade et al., 1977), non sporulé et non capsulé (Fig. 1). Cette bactérie peut mesurer entre 0,3 et 0,5 µm de large et 1 à 3 µm de long
(Rodgers et al., 1980), et adopter une forme filamenteuse pouvant atteindre une longueur de 10 à 20 µm. En fonction des conditions environnementales et de son état physiologique, elle
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 16
peut être mobile grâce à la présence de flagelles (Byrne & Swanson, 1998), situé le plus
souvent en position monopolaire ou subpolaire (Rodgers et al., 1980).
L. pneumophila est aérobie stricte, catalase positive. Elle est aussi uréase négative et nitrate réductase négative. Son enveloppe bactérienne est très hydrophobe car riche en acides gras
ramifiés et en ubiquinones (Moss et al., 1977).
Le fer et la cystéine sont deux éléments indispensables à la croissance optimale de L. pneumophila. Elle se développe sur un milieu de culture qui lui est spécifique, le BCYE, composé de fer, de L-cystéine, de tampon ACES (N-2-acetamido-2-aminoethansulfonic acid),
d’extrait de levure et de charbon actif. Le pH optimal de ce milieu doit être fixé à 6,9 (Feeley et al., 1979; Pasculle et al., 1980). Elle utilise les acides aminés comme source de carbone et
d’énergie (Pine et al., 1979). Néanmoins, elle présente une auxotrophie pour deux d’entre eux, la sérine et la thréonine (George et al., 1980; Tesh et al., 1983). Le glutamate fait partie
de ces principales sources d’énergie (Weiss & Westfall, 1984) contrairement au glucose qui n’a aucun effet sur sa croissance (Pine et al., 1979). Legionella peut être isolée dans des environnements où la température peut varier entre 5 et 63 °C, et un pH compris entre 5,0 et
9,2 (Fliermans et al., 1981). Cependant, sa prolifération est favorisée lorsque les températures sont comprises entre 20 °C et 42 °C. Pour une croissance optimale, il est préférable de la
cultiver à 35 °C, à pH 6,9 (Diederen, 2008; Feeley et al., 1979; Fields et al., 2002). D’un point de vue génomique, en 2004, les génomes complets de trois souches de L. pneumophila
ont été décrits. Il s’agit des souches Paris, Lens et Philadelphia 1 (Cazalet et al., 2004; Chien
et al., 2004). Elles possèdent chacune un seul chromosome circulaire d’environ 3,5 Mpb, 3,3
Mpb et 3,4 Mpb respectivement. De l’ADN plasmidique est retrouvé chez les souches Paris et
Lens, contrairement à la souche Philadelphie où aucun plasmide n’a été identifié. Le génome
contient environ 3000 gènes et parmi eux, 88% codent des protéines d’intérêt. L’étude du
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 17
nombreux gènes semblent acquis par transfert horizontal et beaucoup d’éléments génétiques mobiles ont été identifiés. Il semblerait que beaucoup de ces gène soient d’origine eucaryote,
ainsi qu’un grand nombre de protéines contenant des motifs de protéines eucaryotes ou ayant
des similarités avec celles-ci (Cazalet et al., 2004; Chien et al., 2004). Plus récemment, les génomes complets de 5 autres souches de L. pneumophila ont été séquencés. Il s’agit des
souches Corby, Alcoy, 130b, Lorraine et HL0604 1035 (D'Auria et al., 2010; Ginevra et al., 2008; Gomez-Valero et al., 2011a; Schroeder et al., 2010; Steinert et al., 2007). Toutes ces souches de L. pneumophila, ont en commun un core-génome hautement conservé, comprenant beaucoup de protéines semblables à des protéines eucaryotes. Les recombinaisons et les
transferts de gènes sont fréquents. Des analyses de la distribution du polymorphisme des
nucléotides ont suggéré que de larges fragments de chromosomes (environ 200 kb) sont
échangés entre les différentes souches de L. pneumophila et contribuent à la dynamique du génome. Les plasmides jouent également un rôle dans la diversification du génome, par des
échanges entre les souches (Gomez-Valero et al., 2011b).
1.1.2. Ecologie
L. pneumophila est une bactérie ubiquiste, que l’on retrouve principalement dans des zones humides. Elle est retrouvée dans l’environnement aquatique naturel. En effet, elle colonise les eaux des lacs, des rivières et les eaux souterraines (Riffard et al., 2001). Néanmoins, peu de cas de légionellose ont été associés à des sources naturelles (Taylor et al., 2009). En revanche, des études ont permis d’identifier les installations hydriques artificielles comme étant les principales sources de contamination (Nguyen et al., 2006; Philippe et al., 2006). Parmi elles, nous pouvons citer les spas, les fontaines, les brumisateurs, les systèmes de douches, les
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 18
(Koide et al., 1993). Dans ces installations, la formation de biofilms est très courante (Lau & Ashbolt, 2009). Ces structures complexes représentent de véritables niches écologiques,
idéales pour la croissance et la multiplication de L. pneumophila. Finalement, ces installations favorisent la libération des pathogènes via la formation d’aérosols. Les infections bactériennes peuvent ainsi avoir lieu dans les habitations, les hôtels, mais également dans les hôpitaux
(Mermel et al., 1995).
La présence de L. pneumophila dans l’environnement est aussi conditionnée par la présence d’autres microorganismes tels que les amibes qui constituent un facteur clé dans le
développement de ces pathogènesdans les réseaux (Molmeret et al., 2005) (Fig. 2).
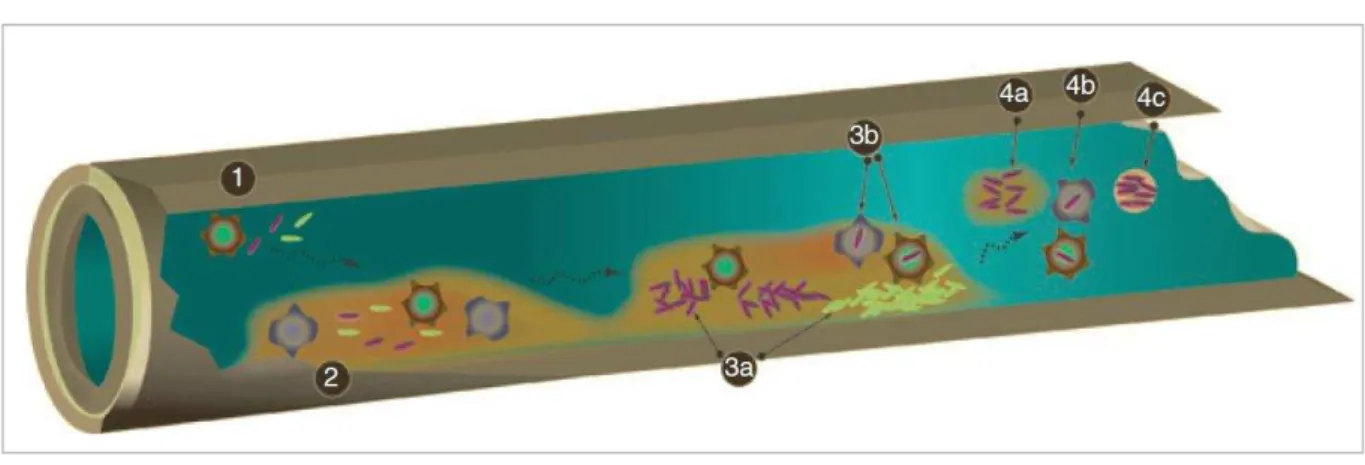
Figure 2 : Développement et libération de Legionella dans un système de distribution d’eau (Lau & Ashbolt, 2009; Mermel et al., 1995). Entrée de Legionella sp. et des protozoaires dans les systèmes de distribution d’eau (1) ; fixation des microorganismes sur la surface et développement de biofilms (2) ; prolifération de Legionella à l’intérieur des
biofilms (3a) ou à l’intérieur des protozoaires (3b) ; libération de Legionella lors du décrochage de fragments de biofilms dans lesquels sont piégées les bactéries (4a) ; libération de Legionella internalisée dans les protozoaires (4b), ou à l’intérieur de vacuoles relarguées
par les protozoaires (4c).
Ces protozoaires sont capables de se nourrir par phagocytose, de bactéries, d’algues ou de
levures, présentes en surface des biofilms. C’est en 1980 que Rowbotham à montrer la
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 19
Naegleria (Rowbotham, 1980). La présence du pathogène dans les eaux serait le résultat, dans
la majorité des cas, de leur prolifération à l’intérieur des amibes. Ce phénomène a pour conséquence d’augmenter les risques de transmission et d’infections potentielles (Fields et al., 2002). Les amibes jouent donc un rôle important dans la persistance de L. pneumophila dans
l’environnement et sur son pouvoir pathogène (Segal & Shuman, 1999).
La capacité de L. pneumophila à infecter les macrophages humains et à causer de graves infections, peut être la conséquence de son adaptation au sein des amibes (Molmeret et al., 2005). Lors de la co-évolution à l’intérieur des amibes, les bactéries sont capables d’acquérir des gènes eucaryotes, leur permettant ainsi une meilleure adaptation au mode de vie
intracellulaire (Buchrieser, 2011; Gomez-Valero et al., 2011a). Les amibes procurent à L. pneumophila, la capacité de persister dans l’environnement. Treize espèces d’amibes, comprenant principalement les genres Hartmannella et Acanthamoebae, sont connues à ce jour pour supporter la réplication intracellulaire de L. pneumophila (Molmeret et al., 2005). Une fois internalisée, L. pneumophila se multiplie, protégée des conditions environnementales par son hôte (Garcia et al., 2007). Après leur passage dans les amibes, les bactéries présentent des caractéristiques phénotypiques différentes. Elles deviennent plus résistantes aux fortes
températures, à l’acidité et aux variations de pressions osmotiques. Elles résistent donc à des conditions environnementales plus hostiles (Gao et al., 1998). Leur sensibilité aux antibiotiques et aux agents chimiques est nettement diminuée (Barker et al., 1995). Elles sont également plus virulentes, leur potentiel d’infection est plus important à l’encontre des amibes et des macrophages (Cirillo et al., 1994). A la sortie des amibes, L. pneumophila présente
également une plus grande capacité à s’implanter dans les biofilms (Bigot et al., 2013). Les amibes jouent donc un rôle essentiel dans la transmission de L. pneumophila (Molmeret et al., 2005; Rowbotham, 1980). Lors des épidémies de légionellose, la présence du pathogène est, dans la majorité des cas, corrélée à la présence d’amibes dans la source d’infection (Fields
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 20
et al., 1990). Les interactions avec les amibes sont considérées comme l’origine de la pathogénèse de L. pneumophila.
1.1.3. La légionellose
La contamination par L. pneumophila se manifeste par une pneumonie sévère, connue sous le nom de maladie du légionnaire ou légionellose. Elle peut entrainer le décès du malade dans 10
à 20% des cas (Diederen, 2008). L’homme contracte l’infection en inhalant des particules infectieuses, c'est-à-dire des micro-gouttelettes d’eau contenant le pathogène (Berk et al., 1998) capable d’atteindre les alvéoles pulmonaires (Yu, 1993). Il est admit que la principale
voie de contamination se fait par inhalation d’aérosols contaminés. Aucune contamination interhumaine n’a été démontrée à ce jour (Abu Kwaik et al., 1998).
Cette pathologie est une maladie émergente du XXème siècle. Ceci est essentiellement due au
développement et au vieillissement des systèmes de distribution de l’eau (McIntyre et al., 1991). Afin de prévenir au mieux les cas de légionellose, il est important de cibler les sources.
Les principales sources de contamination auxquelles l’Homme est susceptible d’être exposé,
sont les installations artificielles utilisant de l’eau à température moyenne et générant des aérosols, comme les douches, les climatiseurs et les spas (Breiman et al., 1990). La maladie se déclare dans un délai de 2 à 10 jours, et les symptômes peuvent persister jusqu’à 7 jours.
L’infection cause des troubles digestifs qui se traduisent par des douleurs abdominales, des
vomissements, des diarrhées, des effets au niveau neurologique, causant des maux de tête, des
troubles de conscience, des céphalées et des effets au niveau hépatique induisant des
insuffisances rénales, un syndrome glomérulaire, de l’hyponatrémie, ou encore de l’hypophosphorémie (Diederen, 2008).
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 21
Il est également important de connaitre les principaux facteurs de risques afin de prévenir ces
infections. Les facteurs individuels sont l’âge, le sexe, le tabagisme, l’alcoolisme, le diabète, la morbidité respiratoire et cardiovasculaire, l’immunodépression (Benhamou et al., 2005; Borella et al., 2005). Les facteurs collectifs comprennent les lieux où les réseaux d’eaux sont communs. Parmi les endroits les plus à risques nous pouvons citer les hôpitaux, les hôtels, les
campings, les stations thermales ou encore les TAR qui peuvent emmètre des nuages d’eau contaminée dans l’atmosphère, et ceci sur plusieurs kilomètres. En Novembre 2003, une épidémie localisée de légionellose est survenue à Harnes, dans le Pas-de-Calais, en France.
D’après le rapport d’investigation de l’institut de veille sanitaire (InVS), la souche
responsable de cette épidémie était la souche L. pneumophila Lens, sérogroupe 1. Au total, 86 cas ont été détectés, et parmi eux, 18 sont décédés. L’épidémie a été exceptionnelle de par son ampleur, mais aussi sa durée (plus de deux mois), et sa dispersion géographique (12 km
autour de la ville de Harnes). Les TAR d’une des usines de la ville ont été incriminées comme
étant à l’origine de cette épidémie. L. pneumophilac’est donc propagée dans l’environnement, piégée dans les gouttelettes d’eau contaminées, pendant le fonctionnement des installations de l’usine. La concentration en L. pneumophila sur ce site avait été estimée à 108 UFC/L
(Rapport d’investigation de l’InVs). Par la suite, plusieurs circulaires et arrêtés ont été mis en
place afin de prévenir au mieux les risques de contamination (Benhamou et al., 2005).
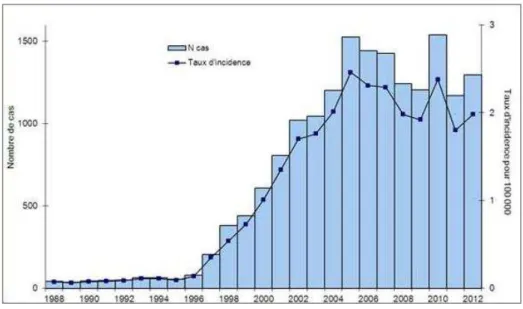
Depuis 1987, la légionellose fait partie des pathologies à déclaration obligatoire (Benhamou et al., 2005). L’InVS a présenté un bilan des cas de légionellose survenus en France en 2012 et 1298 cas ont été comptabilisés. Parmi eux, 98% étaient des cas confirmés, dont 95% dus à L. pneumophila sérogroupe 1. Le taux d’incidence des cas notifiés étaient de 1,98 pour 100 000.
Le nombre de cas a augmenté de 11% entre 2011 et 2012 (Fig. 3). Cependant, une baisse de la
mortalité est observée ces dernières années s’expliquant par une meilleure prévention des risques et des traitements plus efficaces (Carbonne & Astagneau, 2005).
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 22
Afin de pallier à cette infection, une thérapie optimale a été mise en place contre L. pneumophila, basée sur l’activité intrinsèque de certains agents, ainsi que sur leur profil pharmacocinétique et pharmacodynamique. Dans le cas de la légionellose, l’érythromycine, qui était l’antibiotique de référence depuis 1976, a été remplacé par les macroazalides et les
fluoroquinolones. Ils figurent en première ligne des traitements. Le choix de la thérapie et les
doses à appliquer, dépendent de la gravité de l’infection. La durée du traitement est également
variable. Chez un individu immunocompétent, le traitement dure en moyenne 14 à 21 jours,
tandis que chez un immunodéprimé ou dans le cas d’infection sévère, il peut durer jusqu’à 30
jours (Benhamou et al., 2005).
Figure 3: Evolution du nombre de cas et du taux annuel d’incidence des cas notifiés de légionellose en France, entre 1988 et 2012 (d’après l’InVS).
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 23
1.2. Les facteurs de virulence
L. pneumophila est le plus souvent associée à la flore bactérienne des biofilms (Newton et al., 2010), où elle sert de nourriture à certains protozoaires comme les amibes et les protozoaires
ciliés. Elles ont développé des moyens leur permettant d’échapper à la digestion par ces organismes (Greub & Raoult, 2004; Hilbi et al., 2007). La résistance aux amibes constitue un mécanisme basé sur la virulence de L. pneumophila (Hilbi et al., 2001). Elle est capable de résister à la phagocytose par les amibes ou les macrophages, grâce à des protéines sécrétées
par son système de sécrétion de type IV encore appelé, système Dot/Icm (Berger & Isberg,
1994; Brand et al., 1994). Une fois le pathogène phagocyté, il injecte une grande quantité de protéines dans la cellule hôte (effecteurs), détournant ainsi la phagocytose (Isberg et al., 2009; Zhu et al., 2011). Alors, plutôt que d’être dégradée par les lysosomes, L. pneumophila se
multiplie à l’intérieur de vacuoles connues sous le nom de « Legionella Containing Vacuoles » (LCV). Après leur réplication, les bactéries sont libérées en extracellulaire suite à
la lyse de leur cellule hôte (Horwitz & Silverstein, 1980). Elles possèdent un second système
de sécrétion, appelé système de sécrétion Lsp de type II, également impliqué dans les
interactions hôtes-pathogènes (Hales & Shuman, 1999; Liles et al., 1999). Ce système est indispensable à la croissance intra-amibes et intra-macrophages, et il sécrète un grand nombre
d’enzymes, telles que des protéases, des aminopeptidases et des phospholipases (Rossier &
Cianciotto, 2001; Rossier et al., 2008).
1.2.1. Internalisation de L. pneumophila et formation des vacuoles réplicatives
La fixation et l’internalisation de L. pneumophila sont les deux premières étapes du processus
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 24
grâce à des adhésines présentes à leur surface : RtxA, PilEL, EnhC et Hsp60. Des récepteurs,
capables de reconnaitre ces protéines ont été identifiés à la surface des cellules hôtes, A. castellanii ainsi que les cellules épithéliales (Cirillo et al., 2001; Garduno et al., 1998).
D’autres facteurs bactériens sont impliqués dans l’invasion, incluant, LpnE, LvhB2, LaiA, Lcl
et Htp, certains jouant un rôle direct dans la capture de L. pneumophila (Chang et al., 2005; Newton et al., 2006; Ridenour et al., 2003; Vandersmissen et al., 2010). L’internalisation de
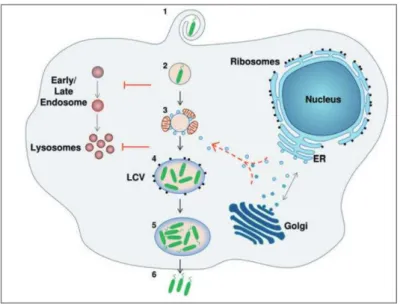
L. pneumophila par les amibes ou par les macrophages est initialement régulée par le système de sécrétion de type IV délivrant approximativement 300 effecteurs à l’intérieur de la cellule hôte (Gomez-Valero et al., 2011a). Une fois les bactéries attachées à leurs hôtes, elles sont internalisées par phagocytose (Horwitz, 1984), décrit pour les macrophages et Dictyostelium discoideum (Peracino et al., 2010; Watarai et al., 2001) (Fig. 4-2).
Figure 4: Cycle de vie intracellulaire de L. pneumophila (Franco et al., 2009).
(1) Internalisation de L. pneumophila par phagocytose, (2) inhibition de la voie endocytaire, (3) interaction de la LCV avec des mitochondries et inhibition de la fusion phagosome-lysosome, (4) recrutement du réticulum endoplasmique et des ribosomes sur la LCV pour former une vacuole réplicative, (5) réplication de L. pneumophila et formation du flagelle, (6) libération des bactéries dans le milieu extracellulaire et infection de nouvelles cellules hôtes.
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 25
Il y a ensuite un recrutement des mitochondries ainsi que des protéines du réticulum
endoplasmique de la cellule hôte (Fig. 4-3), puis formation de vacuoles contenant L. pneumophila (LCV) (Fig. 4-4). Ces vacuoles ont la capacité de résister à l’acidification et de
ce fait leur maturation en phagolysosome est rendue impossible (Horwitz, 1984). Enfin, la
réplication bactérienne est observée après la formation de ces compartiments, semblables à
des réticulums endoplasmiques rugueux.
1.2.2. Rôle du système Dot/Icm
Comme de nombreuses bactéries pathogènes, L. pneumophila possède un système de sécrétion qui lui est indispensable pour survivre et se répliquer à l’intérieur des protozoaires ou des cellules humaines qu’elle a infecté. Elle utilise ce système de sécrétion pour délivrer
des protéines effectrices à l’intérieur des cellules cibles ayant pour conséquence une
modulation des fonctions cellulaires chez l’hôte. Le système de sécrétion Dot/Icm (Defect in Organelle Trafficking ; Intracellular Multiplication), appartenant à la famille des systèmes de
sécrétion de type IV, est codé par 27 gènes. Il forme une aiguille moléculaire qui traverse les
membranes intracellulaire et extracellulaire (Fig. 5). Les protéines constituant cette structure
sont nombreuses. La protéine DotA est une protéine de la membrane interne qui sert de
protéine échafaud. DotB est une protéine cytoplasmique associée à la membrane interne,
possédant une activité ATPase. Son rôle est très important dans la formation du système car il
permet le transport des substrats via l’hydrolyse de l’ATP. Les protéines DotF-G-H-C-D
forment le core transmembranaire du système. DotU et IcmF, intramembranaires, permettent
le maintien du système sous sa forme active et jouent un rôle protecteur contre sa dégradation.
Certaines protéines sont responsables de la régulation du flux de substrat de part et d’autre de
la membrane. Il s’agit de la protéine IcmQ, responsable de la formation des pores dans la
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 26
du système est donc de délivrer des protéines à travers la membrane de la cellule hôte, pour
ainsi favoriser la prolifération de L. pneumophila.
Les protéines sécrétées par ce système sont nommées effecteurs. Ils modulent de nombreux
processus cellulaires chez l’hôte tels que la formation des LCV, le trafic vésiculaire, le
recrutement du réticulum endoplasmique. Ils sont également nécessaires dans différentes
étapes du processus infectieux et dans la réplication intracellulaire (Cianciotto, 2005; Isberg et al., 2009).
Figure 5 : Système Dot/Icm (Isberg et al., 2009). Représentation de la localisation
membranaire du système Dot/Icm et des relations entre les protéines qui le constituent. Cette
représentation est basée sur l’étude de la stabilité des protéines suite à des mutations par
délétion (Buscher et al., 2005). Les lettres individuelles correspondent aux noms des protéines Dot. Les lettres précédées de la lettre « i » indiquent le nom des protéines Icm.
Environ 300 effecteurs ont été identifiés à ce jour. Les pricipales protéines identifiées comme
étant impliquées dans le trafic vésiculaire sont VipA/D/E (Shohdy et al., 2005), mais aussi LegA8/AnkX/AnkN, LegC2/YlfB et Leg7/YlfA (de Felipe et al., 2005; de Felipe et al., 2008), SetA (Heidtman et al., 2009). D’autres protéines ont été désignées comme étant
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 27
responsables du recrutement des protéines du réticulum endoplasmique. Il s’agit des protéines
SidC et SidJ. L’effecteur Rab1 est un régulateur du transport membranaire impliqué dans la
biogénèse des LCV. Les fonctions de Rab1 sont modulées par d’autres effecteurs, tel que
l’inhibiteur LepB. LidA, en se liant à Rab1, stimule la formation de vacuoles réplicatives
(Conover et al., 2003; Derre & Isberg, 2005). La protéine RalF, induit le recrutement de Arf1 (GTPase impliquée dans la régulation du transport membranaire) aux LCV. De la même
façon, la protéine SidM/DrrA, permet le recrutement de la protéine Rab1 aux LCV. Des
effecteurs ont pour rôle d’affecter la synthèse protéique chez la cellule hôte, ils constituent
ainsi des facteurs de virulence et favorisent la dissémination de L. pneumophila : LegU2/LubX, Lgt1, LegC8/Lgt2, LegC5/Lgt3 (Kubori et al., 2008). D’autres ont aussi un rôle dans la survie de la cellule hôte. Nous pouvons citer SdhA, SidF et DimB. Une mutation
de l’un de ces gènes se traduit par un défaut de la réplication intracellulaire (Laguna et al., 2006; Losick & Isberg, 2006). Finalement nous pouvons aussi mentionner les protéines LepA
et LepB, impliquées dans la réplication intracellulaire et la protection de la cellule hôte contre
la lyse, lors de la libération des bactéries en extracellulaire (Chen et al., 2004).
1.2.3. Différenciation de L. pneumophila
Au cours de son développement intracellulaire, L. pneumophila passe par deux phases distinctes. Ces deux phases sont également observables lorsqu’elles sont cultivées en milieu liquide (Molofsky & Swanson, 2004). La première phase est la phase de réplication suivie par
la phase de transmission (Fig. 6).
Lorsque les conditions environnementales sont favorables L. pneumophila est capable de
proliférer, c’est la phase réplicative. Elle présente des caractéristiques phénotypiques
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 28
cytotoxiques et sont résistantes au sodium. Les caractères spécifiques de la phase transmissive
sont réprimés (Fig 6-2,3). Dès lors que le milieu s’appauvrit en nutriment, les carences induisent la différenciation de L. pneumophila qui passe en phase transmissive (Fig. 6-4). La
multiplication est réprimée, mais d’autres caractères sont exprimés. L. pneumophila devient plus virulente, mobile, cytotoxique et flagellée (Byrne & Swanson, 1998), ce qui facilite sa
sortie de la cellule hôte (Fig. 6-5). La libération se déroule en deux étapes. Il y a une première
étape durant laquelle la membrane du phagosome se rompt, libérant les bactéries dans le
cytoplasme (Molmeret et al., 2004; Molmeret et al., 2010), puis une étape de lyse de la membrane plasmique, probablement suite à la formation de pores (Molmeret & Abu Kwaik,
2002). Ainsi les bactéries sont libérées dans le milieu extracellulaire (Fig. 6-6). Une autre
proposition a été faite pour expliquer ce phénomène. La destruction de la cellule hôte aurait
lieu grâce à un processus d’apoptose (Santic et al., 2007).
En milieu de culture liquide, L. pneumophila se multiplie de manière exponentielle, tant que
les ressources nutritives sont suffisantes. Lorsque le milieu commence à s’appauvrir, elle se
différencie et entre en phase stationnaire, sa croissance est stoppée (Fig. 6-8). Pendant cette
phase, elle présente plusieurs caractéristiques. Elle est plus mobile, elle résiste aux UV, à la
chaleur, et aux changements de pressions osmotiques, elle possède aussi un potentiel
infectieux plus important (Molofsky & Swanson, 2004).
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 29
Figure 6 : Cycle de vie de L. pneumophila (Molofsky & Swanson, 2004). L. pneumophila
sous forme transmissive est phagocytée (1), lorsque les conditions sont favorables, la bactérie est en phase réplicative, elle se multiplie, les traits de transmission sont réprimés (2). L. pneumophila termine sa réplication, les traits de transmission sont de nouveau exprimés et une forme particulière, hautement résistante et infectieuse (Mature Intracellular Form : MIF) peut apparaître (4). La cellule hôte est lysée (5), la bactérie peut alors aller se loger dans un biofilm où elle peut rencontrer une nouvelle cellule hôte et démarrer un nouveau cycle (7). La bactérie en culture liquide peut également exprimer les facteurs de la phase réplicative et transmissive lors des phases exponentielle et stationnaire, respectivement (8).
1.2.4. Réponse stringente
Beaucoup de bactéries utilisent la réponse stringente pour activer des facteurs de virulence et
persister dans des environnements hostiles : Mycobacterium tuberculosis, Listeria monocytogenes, Staphilococcus aureus, Streptococcus typhimurium (Godfrey et al., 2002; Magnusson et al., 2005).
La réponse stringente est utilisée par L. pneumophila, pour s’adapter à une carence
nutritionnelle. Même si la composition exacte en nutriments, contenues dans les vacuoles
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 30
aminés dans l’environnement est indispensable à la croissance de L. pneumophila. Une variation de leur concentration peut affecter leur état physiologique. En effet, les acides
aminés constituent leur seule source de carbone et d’énergie (Tesh et al., 1983). Elles utilisent des transporteurs spécifiques, appelés Pht (Phagosomal transporters) qui leur permettent de
détecter la disponibilité de ces acides aminés dans leur environnement (Sauer et al., 2005). Une carence en acides aminés, induit certains changements chez L. pneumophila. Elle utilise la réponse stringente pour induire un ensemble de caractères lui permettant d’échapper à son
hôte, de survivre dans l’environnement ou encore de réinfecter d’autres cellules. L. pneumophila déclenche la réponse stringente lorsqu’elle subit un stress métabolique ou nutritif (carence en acides aminés, carbone, nitrogène ou phosphate) (Magnusson et al., 2005). De nombreux phénomènes physiologiques sont induits suite à ces carences comme
l’inhibition de la croissance, la répression de la synthèse nucléique et protéique, la production de protéines de dégradation, l’induction de la synthèse et du transport des acides aminés (Fig. 7). La réponse stringente résulte d’une accumulation d’ARNt non chargés, au niveau du site A
des ribosomes, due au manque d’acides aminés.
L’enzyme RelA associée aux ribosomes est activée pour synthétiser le ppGpp, ainsi que son précurseur le pppGpp, par phosphorylation du GDP et du GTP. Le ppGpp est capable de lier
directement les sous unités β et β’ de l’ARN polymérase (RNAP), modifiant l’expression de
certains gènes (Magnusson et al., 2005). Il agit donc comme un régulateur et module de nombreux processus cellulaires et physiologiques.
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 31
Figure 7 : Réponse stringente chez les bactéries (Magnusson et al., 2005). Deux voies
métaboliques permettent la formation du pppGpp (qui est par la suite converti en ppGpp) à
partir d’ATP et de GTP, en réponse à plusieurs signaux de stress. Bien que le ppGpp interagisse avec l’ARN polymerase (RNAP), il réprime de nombreuses voies métaboliques (-
indique une inhibition; + indique une stimulation).
1.2.5. Régulation du passage en phase transmissive
Afin de comprendre le changement de phase, le transcriptome de L. pneumophila a été étudié,
comparant l’expression des gènes entre la phase réplicative et la phase transmissive. L’expression de plus de la moitié du génome est modulée lors du passage en phase
transmissive. Ce résultat a été observé lors de la croissance intracellulaire mais aussi lors de la
croissance en milieu de culture (Bruggemann et al., 2006; Faucher et al., 2010).
Le gène relA est désigné comme étant le gène codant l’enzyme indispensable à la synthèse du
ppGpp (Zusman et al., 2002). Par analogie avec d’autres bactéries, le (p)ppGpp agit comme une alarmone qui coordonne certains mécanismes permettant à L. pneumophila d’échapper
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 32
l’environnement par l’infection d’autres phagosomes. Beaucoup de procaryotes possèdent une
seconde enzyme nommée SpoT, qui en fonction des conditions expérimentales, agit comme
une ppGpp synthase ou une ppGpp hydrolase (Chatterji & Ojha, 2001). Lorsque les
conditions de croissance sont favorables, SpoT et RelA agissent ensemble pour maintenir un
niveau basal de ppGpp dans le cytosol, grâce à leur activité hydrolase (Fig. 8-A). Puis lors
d’un stress induisant la réponse stringente, elles utilisent leur activité synthase, pour produire
le nucléotide (Magnusson et al., 2005) (Fig. 8-B).
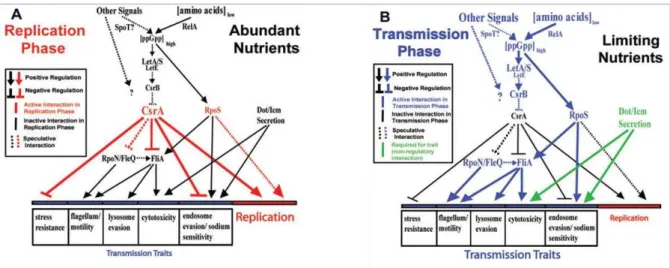
Figure 8 : Modèles de régulation des phases réplicatives et transmissives (Molofsky & Swanson, 2004). Le ppGpp et les facteurs sigma contrôlent l’expression des phénotypes des voies transmissive et réplicative. A partir des données génétiques obtenues, ce modèle d’étude
à pu être réalisé. Il présente les différentes voies de régulations, les interactions, directes et indirectes, entre les protéines. (A) Phase réplicative : CsrA réprime les caractères de la phase transmissive et induit la réplication. CsrA inhibe également la formation des flagelles, la résistance aux stress environnants ainsi que la sensibilité au sodium ; (B) Phase transmissive :
la carence en acides aminés induit la production de ppGpp, alarmone induisant l’expression de plusieurs protéines et menant à l’expression des caractéristiques de la phase transmissive telle que la production de flagelles, l’augmentation de la capacité à infecter les cellules hôtes,
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 33
Pour réguler l’expression des gènes impliqués dans la différenciation, l’activité de la RNAP
est modifiée par altération du facteur sigma (Nystrom, 2004). Il existe six facteurs sigma chez
L. pneumophila : RpoD, RpoE, RpoH, RpoN, RpoS et FliA. Ils sont impliqués dans la régulation du passage en phase transmissive (Bachman & Swanson, 2001; Molofsky et al., 2005). De récentes études ont permis de montrer que le ppGpp contrôle la capacité du facteur
sigma à lier la RNAP. Il contrôle aussi la production et l’activité de certains de ces facteurs (Magnusson et al., 2005). Lors d’une carence nutritive, la réponse stringente régule la compétition entre les différents facteurs sigma ainsi que d’autres aspects de la transcription,
modifiant ainsi le profil d’expression des gènes. Plus précisément, le facteur sigma, RpoS,
spécifique de la phase stationnaire, présente un rôle dans la sensibilité au sodium, l’expression
de la flagelline, l’évasion des lysosomes. Il est nécessaire pour la multiplication de L. pneumophila à l’intérieur des amibes (Hales & Shuman, 1999). Il coopère avec d’autres
facteurs pour induire les caractères de virulence qui permettent une multiplication importante
à l’intérieur des macrophages (Bachman & Swanson, 2001) et induit l’expression de gènes
impliqués dans la phase transmissive (Fig. 8-B). Lorsque le gène rpoS est présent en beaucoup de copies, il induit une répression des gènes csrA, letE, fliA et flaA, et inhibe la
mobilité, l’infectivité, mais aussi la cytotoxicité (Bachman & Swanson, 2004a). Ajouté aux
facteurs FliA et RpoS, le système à deux composants LetA/LetS, régule la mobilité de L. pneumophila, la cytotoxicité, l’infectivité et l’évasion des lysosomes dans les macrophages
(Bachman & Swanson, 2004a; Hammer et al., 2002) ainsi que dans les amibes (Lynch et al., 2003). Après leur entrée en phase stationnaire, LetA active des facteurs de la phase
transmissive en inhibant l’expression du facteur CsrA, répresseur des gènes codant pour ces facteurs (Fettes et al., 2001; Molofsky & Swanson, 2003). CsrA est une protéine indispensable qui régule le cycle de croissance biphasique de L. pneumophila. La protéine
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 34
dépendante du système LetA/LetS, mais induit aussi la cytotoxicité ainsi que l’infection des
macrophages (Bachman & Swanson, 2004b; Hammer et al., 2002). La fin de la phase réplicative est également caractérisée par une surexpression des gènes codant des effecteurs
du système de sécrétion Dot/Icm. Certains gènes sont induits lors de ce changement d’état, comme flaA, mip, dotH, dotO (Hammer & Swanson, 1999; Watarai et al., 2001). Ces caractéristiques ont été observées aussi bien en culture liquide qu’en culture intracellulaire (Byrne & Swanson, 1998).
1.2.6. Rôle du système de sécrétion de type II
Chez les bactéries Gram négatif, le système de sécrétion de type II, T2SS, constitue l’un des six systèmes permettant l’export de protéines du milieu intracellulaire vers le milieu extracellulaire ou vers une cellule cible. Des analyses génomiques ont révélé que les gènes
codant le T2SS sont communs à de nombreuses bactéries Gram négatif mais ne sont pas
universels (Cianciotto, 2005). Des études fonctionnelles ont indiqué que ce système est
promoteur de la virulence de pathogènes humains, de pathogènes ciblant les animaux mais
aussi ceux ayant pour cible les plantes (Cianciotto, 2005).
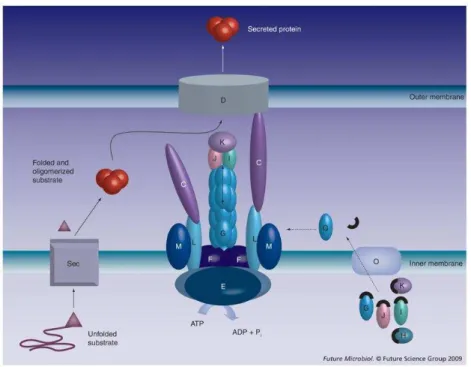
Il y a deux étapes dans le processus d’utilisation de ce système (Fig. 9) (Filloux, 2004). Lors
de la première étape, les protéines destinées à l’export sont transloquées à travers la
membrane interne via les protéines Sec et Tat et leurs extrémités N-ter sont clivées par des
peptidases. Dans la seconde étape, les protéines clivées sont transloquées du périplasme vers
le milieu extracellulaire grâce à l’action de complexes protéiques spécifiques, qui permettent
la formation de pores dans la membrane extracellulaire. Le complexe T2SS est constitué par
12 composants protéiques. Nous pouvons citer la sécrétine de la membrane externe (T2S D),
Rôle du fer sur Legionella pneumophila et sur sa persistance dans les biofilms complexes Page 35
pseudopilines (T2S G, H, I, J, K), des protéines facilitant la liaison d’ATPases à la membrane interne (Filloux, 2004; Peabody et al., 2003). Après translocation à travers la membrane
interne, une protéine destinée à l’export est clivée et son extrémité N-terminal est méthylée
par une pré-pseudopiline peptidase, aussi connue sous le nom de PilD. Le système de
reconnaissance des protéines qui transitent au travers de ce système n’est pas encore connu. Les protéines quittent la cellule au travers des pores (sécrétine). Ce processus nécessite la
formation de pseudopilines formant une structure semblable à celle d’un pilus qui agit comme
un piston pour éjecter les protéines à l’extérieur de la cellule par la sécrétine.
Figure 9 : Modélisation du système de sécrétion de type II (Cianciotto, 2005). Les
substrats sont transloqués à travers la membrane interne via la protéine Sec (ou Tat). Une fois
dans le périplasme, ils sont reconnus par l’appareil de sécrétion de type II. Ensuite, l’énergie
générée au niveau de la membrane interne est utilisée pour générer un pilus capable de
s’étendre et de se rétracter. Ce pilus est formé par les protéines T2S G, H, I, J et K qui
agissent comme un piston pour pousser les substrats vers la membrane externe. Les protéines
T2S I, J et K forment la pointe du pseudopilus, la protéine T2S G constitue l’arbre, mais les
interactions avec la protéine T2S H sont encore inconnues. La protéine O de la membrane interne clive et méthyle les pseudopilines avant leur intégration au système de sécrétion. C–M: Protéines core constituant le système; D: Sécrétine Dodécamérique; G: Pseudopiline majeure ; H–K: Pseudopilines mineures; O: Prépiline peptidase.