VARIABILITÉ INTRA-ARBRE DES PROPRIÉTÉS PHYSICO-MÉCANIQUES ET CHIMIQUES DU TESSMANIA AFRICANA EN
PROVENANCE DU GABON
Thèse
Jean Bosco Mbagou
Doctorat en sciences du bois
Philosophiae Doctor (Ph.D.)
Québec, Canada
VARIABILITÉ INTRA-ARBRE DES PROPRIÉTÉS PHYSICO-MÉCANIQUES ET CHIMIQUES DU TESSMANIA AFRICANA EN
PROVENANCE DU GABON
Thèse
Jean Bosco Mbagou
Sous la direction de :
Tatjana Stevanovic Janezic, directrice de recherche Yves Fortin, codirecteur de recherche
iii
Résumé
La présente recherche a pour objectif l’étude de la variabilité intra-arbre des propriétés physico-mécaniques et chimiques ainsi que celle de la durabilité naturelle du bois de Wamba (Tessmania africana) à partir d’échantillons prélevés de deux arbres, à trois niveaux de hauteur (DHP, mi-hauteur et sous la cime) et deux positions radiales (aubier et duramen). Les résultats ont montré des valeurs moyennes de retrait total dans le duramen de l’arbre 1 de 4,76, 7,40, et 12,51 % pour les retraits radial, tangentiel et volumique respectivement. Ces retraits se sont révélés très similaires dans le duramen des deux arbres avec une progression croissante de la base du tronc vers la cime. L’aubier a donné des moyennes légèrement inférieures. La masse volumique basale du bois de Wamba s’est avérée sensiblement la même dans les deux arbres avec respectivement pour l’aubier et le duramen de l’arbre 1 des valeurs de 677 kg/m3 et 712 kg/m3. Les valeurs correspondantes de la masse volumique anhydre furent de 762 et 812 kg/m3. À l’instar du retrait, la masse volumique augmente de la base du tronc vers la cime dans le duramen et atteint une valeur maximale à mi-hauteur dans l’aubier. Les résultats ont également permis d’observer une corrélation très significative entre la masse volumique basale et le retrait tangentiel total. Les valeurs moyennes du module d’élasticité en compression longitudinale furent de 15,6 GPa dans l’aubier et de 18,6 GPa dans le duramen. Celles de la contrainte maximale furent de 65,2 MPa dans l’aubier et 79,9 MPa dans le duramen. Les composés phénoliques ont montré des corrélations allant de significatives à très significatives avec les propriétés mécaniques. Hormis les pentosanes, le test de Student n’a signalé aucune différence significative de la concentration des constituants primaires dans les positions radiale et longitudinale. L’analyse des minéraux n’a détecté aucune présence de silice. La moyenne globale de teneur en extraits après sommation des rendements à l’éthanol-toluène et à l’eau chaude dans l’arbre 1 a donné 10,1 % dans le duramen et 7,5 % dans l’aubier, et des valeurs très similaires dans l’arbre 2. Les teneurs en polyphénols déterminées par spectroscopie UV sont plus importantes dans le duramen, particulièrement à mi-hauteur. L’analyse GC-MS des phytostérols a indiqué la présence de gamma-sitostérol, stigmastérol et de la bétuline, trois molécules intéressantes avec des activités anti-inflammatoires, antivirales, anti-VIH et hépato-protectrices. Les composés phénoliques expliqueraient en grande partie la résistance aux pourritures du duramen du bois de Wamba trouvé comme très durable.
iv
Summary
The aim of the present research is to study the intra-tree variability of the physico-mechanical and chemical properties as well as the natural durability of Wamba wood
(Tessmania africana) from specimens taken in two trees at three levels of height (DHP,
mid-height and under the crown) and two radial positions (sapwood and heartwood). The results showed mean values of total shrinkage in the heartwood of tree 1 of 4.76, 7.40, and 12.51% for radial, tangential and volumetric shrinkages respectively. The shrinkage values were very similar in the heartwood of the two trees with an increasing progression from the base of the trunk towards the crown. Sapwood gave slightly lower mean values. The basic density of Wamba proved to be about the same in both trees with respectively for the sapwood and heartwood of tree 1 mean values of 677 and 712 kg/m3. The corresponding mean values for the oven-dry density were 762 and 812 kg/m3. As for the shrinkage
variation, the density increases from the base of the trunk towards the crown in heartwood and reaches a maximum value at mid-height in sapwood. The results also made it possible to observe a very significant correlation between the basic density and the total tangential shrinkage. The mean values of the modulus of elasticity in longitudinal compression were 15.6 GPa in sapwood and 18.6 GPa in heartwood. Those of the maximum compressive stress were 65.2 MPa in sapwood and 79.9 MPa in heartwood. The phenolic compounds showed correlations going from significant to very significant with the mechanical properties. Except for pentosans, the Student test carried out on the primary components of the wood Wamba did not show any significant difference in their concentration in the radial and longitudinal positions. The analysis of minerals did not detect any presence of silica. The total average content of extractives after sequence extraction with ethanol-toluene and hot water in tree 1 gave 10.1% in heartwood and 7.5% in sapwood, and very similar values in tree 2. The polyphenol contents determined by UV spectroscopy are more important in heartwood, particularly at mid-height. GC-MS analysis of phytosterols indicated the presence of gamma-sitosterol, stigmasterol and of betulin, three interesting molecules for their anti-inflammatory, antiviral, anti-VIH, and hépato-protective activities. The phenolic compounds would mainly explain the decay resistance of the heartwood of Wamba, which was found as very durable.
v
Tables des matières
Résumé --- iii
Summary --- iv
Tables des matières --- v
Liste des figures --- viii
Liste des tableaux --- xi
Liste des abréviations et symboles --- xiii
Remerciements --- xvi
Introduction --- 1
Chapitre 1 : Revue de la littérature --- 5
1.1 Généralités sur le matériau bois --- 5
1.2 Anatomie du bois --- 7
1.3 Les principaux constituants du bois --- 8
1.3.1 La cellulose --- 9
1.3.2 Les hémicelluloses--- 10
1.3.3 Les lignines --- 12
1.3.4 Les extractibles --- 13
1.3.4.1 Les composés phénoliques --- 14
1.3.4.2 Les composés terpéniques des arbres --- 21
1.4.1 Propriétés physiques --- 22
1.4.1.1 La masse volumique --- 23
1.4.1.2 Le retrait --- 25
1.4.2 Propriétés mécaniques du bois --- 28
1.4.3 Propriétés chimiques --- 31
1.5 Facteurs de variation des propriétés du bois. --- 32
1.5.1 Définition de la qualité du bois --- 32
1.6 Durabilité des bois tropicaux --- 37
1.6.1 Définition de la durabilité naturelle --- 37
1.6.2 Champignons lignivores --- 38
1.6.3 Variation de la durabilité des bois tropicaux --- 39
1.7 État de connaissances sur le Tessmania africana --- 44
1.8 Hypothèses et objectifs de l’étude --- 46
1.8.1 Hypothèses --- 46
vi
1.8.3 Objectifs spécifiques --- 47
Chapitre 2 : Matériel et méthodes --- 49
2.1 Matériel --- 49 2.1.1 Échantillonnage --- 49 2.2 Méthodes --- 52 2.2.1 Structure anatomique --- 52 2.2.2 Propriétés physiques --- 53 2.2.3 Propriétés mécaniques --- 55
2.2.4 Dosage des constituants chimiques du bois --- 57
2.2.4.1 Méthode d’extraction à l’eau chaude --- 59
2.2.4.2 Dosages des composés phénoliques --- 61
2.2.4.3 Détermination des constituants chimiques macromoléculaires --- 64
2.2.4.4 Évaluation des minéraux dans le bois de Wamba --- 68
2.2.4.5 Analyse GC-MS des extraits éthanoliques dans le bois de Wamba --- 68
2.2.5 Évaluation de la durabilité naturelle du Wamba --- 70
2.2.5.1 Matériel et choix des champignons --- 70
2.2.5.2Procédure expérimentale --- 70
2.2.6 Analyse statistique des résultats--- 72
Chapitre 3 : Résultats et discussions --- 74
3.1 Caractéristiques anatomiques du Wamba --- 74
3.1.1 Aspects microscopiques --- 74
3.2 Propriétés physiques et mécaniques --- 79
3.2.1 Retraits linéaires et volumiques totaux --- 79
3.2.2 Retraits linéaires et volumique partiels --- 84
3.2.4 Anisotropie du retrait total --- 89
3.2.5 Masse volumique --- 90
3.3 Constituants chimiques du bois de Wamba --- 102
3.3.1 Rendements des principaux constituants du bois de Wamba --- 102
3.3.1.1 Teneur en cellulose --- 102
3.3.1.2 Teneur en hémicelluloses (pentosanes) --- 104
3.3.1.3 Teneur en lignine totale --- 105
3.3.2 Teneur en extraits totaux --- 107
3.3.2.1 Rendements en extraits solubles à l’éthanol-toluène et à l’eau chaude --- 107
3.3.3 Teneur en composés phénoliques --- 113
3.3.4 Analyse des sels minéraux --- 121
vii
3.4.1 Variation de la perte de masse du Wamba vis-à-vis de Polyporus versicolor --- 128
3.4.2 Variation de la perte de masse du Wamba en présence de Postia placenta --- 130
Conclusion générale --- 133
Perspectives --- 138
Bibliographie --- 140
Annexes --- 152
Annexe 1 : Incertitude (erreur systématique maximale) des retraits linéaires --- 152
Annexe 2 : Tableau des teneurs en humidité (%) d’équilibre des échantillons de mesure de retrait et de masse volumique conditionnés à 20oCet 65 % d’humidité relative. --- 152
Annexe 3 : Courbe d’étalonnage des phénols totaux. --- 153
Annexe 4 : Courbe d’étalonnage des flavonoïdes. --- 153
Annexe 5 : Courbe d’étalonnage des acides hydroxycinamiques. --- 154
Annexe 6 : Courbe d’étalonnage des proanthocyanidines. --- 154
Annexe7 : Chromatogramme des molécules identifiées dans l’aubier. --- 155
viii
Liste des figures
Figure 1.1 Différenciation de l'aubier et du duramen dans un tronc d'arbre (d'après
Cogliastro et al. 2006) ... 5
Figure 1.2: Coupe transversale dans un tronc d’arbre (d’après Langer et al. 1999) ... 6
Figure 1.3: Directions principales d'une d'une pièce de bois ((R : radiale; T : tangentielle; L : longitudinale) (adapté de Cloutier 2005a). ... 7
Figure 1.4: Structure de la cellulose (d’après Stevanovic 2014a). ... 9
Figure 1.5: Différents monosaccharides constituant les hémicelluloses du bois(d’après Stevanovic 2014a). ... 10
Figure 1.6: O-acétyl-glucuroxylana du bois de feuillus (d’après Stevanovic 2014a). ... 11
Figure 1.7: Monomères précurseurs des lignines (d’après Stevanovic 2014a). ... 12
Figure 1.8: Phénols simples du bois (C6-C1 et C6-C2) (d’après Traoré 2009). ... 16
Figure 1.9: Structure des différentes familles des flavonoïdes (d’après Traoré 2009)... 17
Figure 1.10: Stilbènes isolés de feuillus et de résineux (d’après Traoré 2009). ... 18
Figure 1.11: Quelques dérivés de l'acide hydroxycinnamique (d’après Stevanovic 2014a).19 Figure 1.12: Structure des différents tanins condensés (d’après St. Pierre 2012). ... 20
Figure 1.13: Structure des composés terpéniques(a)Ursolic acid; (b) Betulinic acid; (c) Stigmasterol; (d) Lupeol (d’après Kumar et Mishra 2015). ... 22
Figure 1.14: Variation du module d'élasticité longitudinale du bois d’épinette noire en fonction de la masse volumique basale (d’après Rycabel 2007). ... 23
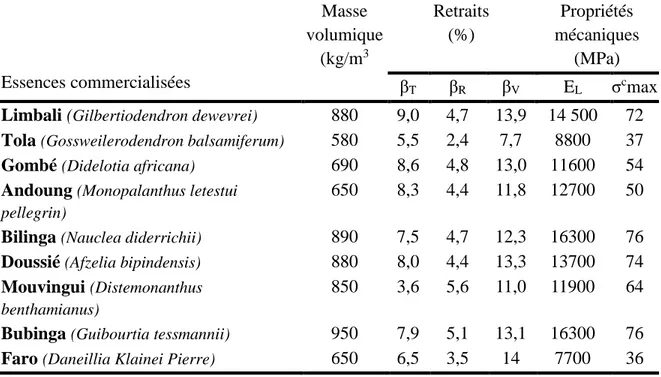
Figure 1.15: Relation entre la densité et le retrait volumique des principaux bois commerciaux africains (d’après Gérard et al. 1998). ... 27
Figure 1.16: Relation contrainte vs déformation (adapté de Panshin et de Zeeuw 1980). ... 29
Figure 1.17: Variation de la masse volumique basale vs hauteur dans l'arbre pour le bois d’épinette noire (d’après Rycabel 2007). ... 33
Figure 1.18: Variation de la masse volumique basale de six (6) espèces européennes en fonction de la hauteur (adapté de Trendelenburg et Mayer-Wegelin 1955). ... 35
Figure 1.19: Masse volumique basale du bois en fonction de la hauteur relative dans les tiges d'Abies balsamea, de Pinus contorta et de picea mariana (adapté de Heger 1974). ... 35
Figure 1.20: Kaemférol identifié dans le bois de Doussié(Afzelia spp)(d’après Deon et al. 1980). ... 41
Figure 1.21 : Naringénine identifié dans le bois de Doussié(Afzelia spp)(d’après Deon et al. 1980). ... 42
Figure 1.22: Pterostilibène identifié dans le bois de Padouk (Pterocarpus soyauxii) (d’après Edou 2006). ... 42
ix Figure 1.23 : Hydroxyuridine identifié dans le bois Moabi (Baillonella toxiperma) (d’après
Edou 2006). ... 43
Figure 2.1: (a) Aspect du bois sous écorce de Tessmania africana; (b) allure du tronc d’arbre en forêt. ... 49
Figure 2.2: (a) Prélèvement longitudinal des billons;(b) prélèvement des plateaux. ... 50
Figure 2.3: Schéma d’affectation des éprouvettes à partir d’un bloc de bois donné. ... 52
Figure 2.4 : (a) Conditionnement des échantillons à 13 % d'humidité; échantillon, micromètre et table de fixation. ... 55
Figure 2.5: (a) Machine d'essai mécanique; (b) système de maintien en équilibre de l'éprouvette et capteur de mesure de la déformation. ... 56
Figure 2.6: (a) Dispositif de tamisage; (b) poudre de bois. ... 57
Figure 2.7 : Extraction à l'éthanol-toluène au soxhlet. ... 58
Figure 2.8: Dispositif d'évaporation sous-vide. ... 58
Figure 2.9 : Acide gallique. ... 61
Figure 2.10 : Quercétine. ... 62
Figure 2.11 : Chlorure de cyanidine. ... 63
Figure 2.12 : Chlorure de chlorogénique. ... 63
Figure 3.1: Micrographies du bois de wamba dans les plans :(a) Transerversal; (b) Longitudianl-Radial; et (c) Longitudinal-Tangentiel(bois de duramen proche de la cime). ... 76
Figure 3.2: Quelques éléments de la structure anatomique du bois de Wamba (duramen à gauche et aubier à droite). ... 77
Figure 3.3: Variation des retraits totaux moyens dans le bois de Wamba(Tessmania africana). ... 81
Figure 3.4: Relation teneur en humidité-retrait tangentiel dans le duramen par niveau de hauteur de l'arbre 1. ... 87
Figure 3.5: Relation teneur en humidité-retrait tangentiel dans l'aubier par niveau de hauteur de l’arbre 1. ... 88
Figure 3.6: Variation des moyennes combinées de la masse volumique dans le bois de Wamba ... 91
Figure 3.7 : Relation masse volumique basale-retrait volumique dans la hauteur de l’arbre 1. ... 93
Figure 3.8: Variation des propriétés mécaniques dans la hauteur du bois de Wamba (aubier-duramen). ... 97
Figure 3.9: Relation masse volumique humide-module d'élasticité. ... 98
Figure 3.10: Relation module d'élasticité-contrainte maximale en compression longitudinale. ... 100
x Figure 3.11: Teneur en extraits totaux-retrait volumique dans le duramen de l’arbre 1. ... 110 Figure 3.12: Variation du rendement en flavonoïdes dans les troncs de bois de Wamba. . 116 Figure 3.13: Concentration en acides hydroxycinamiques dans le bois de Wamba. ... 118 Figure 3.14: Variation de la teneur en proanthocyanidines dans le bois de Wamba. ... 119 Figure 3.15: Structures des molécules identifiées dans le bois de Wamba (a) gamma sitostérol C29 H50 O; (b) stigmastérol C29H48O; (c) bétuline C30H50O2. ... 126
xi
Liste des tableaux
Tableau 1.1 : Composition chimique des résineux et feuillus de la zone tempérée(d’après
Sjörtröm 1993) ... 8
Tableau 1.2: Catégorisation de la masse volumique des bois tropicaux(d’après Gérard et al. 1998)... 25
Tableau 1.3: Classification des retraits directionnels des bois tropicaux africains(Gérard et al. 1998). ... 27
Tableau 1.4: Classification du module d'élasticité des bois tropicaux africains(d'après Gérard et al. 1998). ... 30
Tableau 1.5: Propriétés physico-mécaniques de quelques bois tropicaux africains des Césalpiniacées (d'après Gérard et al. 1998). ... 30
Tableau 1.6: Teneurs des principaux constituants chimiques des bois tropicaux africains (d'après Gérard et al. 1998). ... 31
Tableau 1.7: Classes de résistances aux champignons lignivores (NF-350-1 1994). ... 39
Tableau 1.8: Variation de la résistance aux champignons de quelques bois tropicaux africains (d'après Gérard et al. 1998). ... 43
Tableau 3.1:Variation de quelques éléments anatomiques dans le bois de Wamba... 75
Tableau 3.2: Test de Student de la variation de la proportion des vaisseaux dans le bois de Wamba. ... 76
Tableau 3.3: Coefficients des retraits linéaires et volumiques dans les deux arbres. ... 82
Tableau 3.4: Test de Student de la variation des retraits linéaires et volumiques totaux. .... 83
Tableau 3.5: Retraits linéaires et volumiques partiels dans les deux arbres... 85
Tableau 3.6: Test de Student de la variation des retraits partiels. ... 86
Tableau 3.7: Test de Student de l'anisotropie de retrait total. ... 90
Tableau 3.8: Variation de la masse volumique dans les deux arbres. ... 91
Tableau 3.9: Test de Student de la variation de la masse volumique dans les deux tiges de bois de Wamba. ... 92
Tableau 3.10: Analyse de la variance entre les propriétés anatomiques et propriétés physiques. ... 93
Tableau 3.11: Variation des propriétés mécaniques dans les tiges de bois de Wamba. ... 95
Tableau 3.12: Test de Student de la variation du module d'élasticité. ... 96
xii Tableau 3.14: Coefficients de corrélation entre les propriétés anatomiques et
physico-mécaniques. ... 101
Tableau 3.15: Variation de la proportion de la cellulose dans les deux arbres. ... 102
Tableau 3.16: Analyse statistique de la variation de la cellulose. ... 103
Tableau 3.17: Variation de la teneur en pentosanes dans les deux arbres. ... 105
Tableau 3.18: Test de Student de la variation en pentosanes dans le bois de Wamba. ... 105
Tableau 3.19: Variation du rendement en lignine dans le bois de Wamba. ... 106
Tableau 3.20: Test de Student de la variation de la lignine totale dans le bois de Wamba. ... 106
Tableau 3.21: Variation de la teneur en extraits totaux (%) dans le bois de Wamba ... 108
Tableau 3.22: Analyse statistique de teneur en extraits totaux dans le bois de Wamba. ... 109
Tableau 3.23: Variation du retrait volumique en fonction de la teneur en extraits ... 110
Tableau 3.24: Bilan des rendements des constituants chimiques à hauteur de poitrine. .... 111
Tableau 3.25: Bilan des rendements constituants chimiques à mi-hauteur. ... 112
Tableau 3.26: Bilan des constituants chimiques à proximité de la cime. ... 112
Tableau 3.27: Variation de la concentration en phénols totaux dans les deux arbres. ... 113
Tableau 3.28: Test de Student de la variation en phénols totaux. ... 114
Tableau 3.29: Variation de la teneur en flavonoïdes dans les deux arbres. ... 115
Tableau 3.30: Test de Student de la teneur en flavonoïdes ... 115
Tableau 3.31: Variation des acides hydroxycinnamiques dans les deux arbres. ... 117
Tableau 3. 32: Test de Student de la variation des acides hydroxycinnamiques... 117
Tableau 3.33: Variation en proanthocyanidines dans les deux arbres. ... 118
Tableau 3.34:Test de Student de la variation en proanthocyanidines. ... 119
Tableau 3.35: Concentration combinée des minéraux dans les deux arbres. ... 122
Tableau 3.36: Molécules identifiées dans les extraits éthanoliques du bois de Wamba. ... 124
Tableau 3.37: Variation de la perte de masse après attaque fongiquede Polyporus versicolor . ... 129
Tableau 3.38: Variation de la perte de masse après attaque fongique de Postia placenta 129 Tableau 3.39: Analyse statistique de la variation de la résistance aux champignons dans le bois de Wamba. ... 131
xiii
Liste des abréviations et symboles
Abréviation Signification
AlCl3 Trichlorure d’aluminium
ANOVA ANOVA : analysis of variance (analyse de la variance) ASTM American Society for Testing Material
βl Retrait longitudinal total
βr Retrait radial total
βt Retrait tangentiel total
βv Retrait volumique total COV Coefficient de variation Db Masse volumique basale
DH Masse volumique humide
DHP Diamètre à hauteur de poitrine D0 Masse volumique anhydre
DPNH Dinitro -2-4-phénylhydrazine DV Diamètre de vaisseaux
EL Module d’élasticité en compression longitudinale
ETOH Éthanol
Fht Fisher selon la position en hauteur dans l’arbre Frd Fisher selon la position radiale (aubier-duramen)
GC-MS Chromatographie en phase gazeuse couplée à la spectrométrie de masse. En anglais : Gas Chromatography-Mass Spectrometry
GPa Gigapascal
H Teneur en humidité du bois HNO3 Acide nitrique
HPA ou HPD Échantillon de bois situé à hauteur de poitrine avec A (Aubier) et D (Duramen) de l’arbre 1 ou de l’arbre 2
Ht Position de hauteur
Ht× Rd Variation selon les positions (hauteur∕ radiale) H2SO4 Acide sulfurique
xiv LWW Longueur de fibre moyenne pondérée (length-weight-weight mean)
MOE Module d’élasticité
MPa Mégapascal
MTA ou MTD Échantillon de bois pris à mi-hauteur avec A (Aubier) et D (Duramen) de l’arbre 1 ou de l’arbre 2
Pht Probabilité selon la position en hauteur dans l’arbre Prd Probabilité selon la position radiale (aubier-duramen) ppm Parties par million
PV Proportion de vaisseaux
Rd Position radiale (Aubier-duramen)
SCA ou SCD Échantillon de bois provenant sous la cime avec A Aubier) et D (Duramen) de l’arbre 1 ou de l’arbre 2
UV Ultraviolet
VIH Virus de l'immunodéficience humaine Déformation relative
σ Contrainte
σc
max Contrainte maximale de rupture en compression longitudinale
xv « L’avenir appartient à ceux qui croient à la beauté de leurs rêves ».
xvi
Remerciements
Je voudrais adresser mes sincères remerciements au Professeur Tatjana Stevanovic Janezic ma directrice de thèse pour son précieux encadrement. Professeur, votre confiance et vos sages conseils m’ont permis de donner le meilleur de moi tout au long de cette belle aventure dans votre laboratoire.
Ces sincères remerciements vont également à l’endroit de mon codirecteur, le Professeur Yves Fortin pour avoir accepté de travailler avec moi depuis le début de cette thèse. Votre patience et vos commentaires très pertinents ont été d’un apport considérable pour l’aboutissement de ce travail. Mes remerciements vont aussi à l’endroit du Professeur Edou Engonga pour votre implication depuis l’échantillonnage du matériel biologique en passant par les corrections du document.
J’adresse mes remerciements à toute l’équipe d’encadrement projet PEFOGRN-BC pour le soutien financier et matériel nécessaire à la réalisation de ce travail. Merci au Professeur Damas Khasa à Marie-France Gévry, Stephanie Dubés Desrosiers, Nathalie Carisey, Jacynthe Leblanc et à Gilles Cotteret.Une pensée pieuse pour le Docteur feu Ibrahim Sambo.
Je tiens également à remercier l’apport des techniciens Yves Bédard, Daniel Bourgault, David Lageux et Luc Germain pour l’aide dans la réalisation des essais aux laboratoires. Il en est de même pour l’ensemble du personnel du CRMR, en particulier pour Marthe Larouche et Guylaine Bélanger pour leur professionnalisme agrémenté par leur sourire qui illuminait mes moments les plus heureux et parfois les plus difficiles pendant ce parcours.
Enfin, je remercie toutes les personnes qui de près ou de loin m’ont apporté leur soutien moral ou financier. À mes aînés Émile Doumba, Marcellin Nziéngui, Antoine Ndongou et à mes amis Pierre, Géraud, Michel-Valérie pour votre amitié, votre affection et vos encouragements.
1
Introduction
Le concept de développement durable accepté par la communauté internationale depuis le sommet de Rio de 1992, se définit comme étant « la satisfaction des besoins des générations actuelles sans compromettre ceux des générations à venir ». À ce titre, les ressources naturelles et la forêt en particulier constituent un des piliers forts de ce concept. Le défi est donc de concilier le développement économique tout en assurant la protection de l’environnement. Car la forêt, à travers le bois, reste incontournable dans la lutte contre la pauvreté et les changements climatiques.
Dans ce contexte, il devient nécessaire pour les pays forestiers et principalement ceux du bassin du Congo à l’instar du Gabon de répondre aux demandes des utilisateurs des bois tropicaux par la promotion de nouvelles essences de bois de qualité tout en préservant au mieux la dynamique et la richesse des forêts naturelles.
En effet, la forêt gabonaise fait partie des forêts du bassin du Congo (deuxième massif forestier tropical après la forêt amazonienne). Elle couvre une superficie de plus de 80 % du territoire national, avec une biodiversité exceptionnelle tant pour les arbres que pour la flore renfermant 8 000 espèces de plantes et plus de 400 essences forestières potentiellement exploitables. Seulement, cet immense patrimoine naturel est véritablement menacé par un certain nombre de facteurs anthropiques, au premier rang desquels figure la coupe très sélective des essences des bois. Les prélèvements varient de 0,5 à 2 pieds d’arbres à l’hectare soit un volume de 3 à 12 m3 (Karsenty 2005). Les conséquences directes qui en découlent sont la raréfaction, voire la disparition à terme de certaines essences de bois notamment celles dites « phares ». Cette situation se justifie par des pratiques de marchés nationaux et internationaux des bois tropicaux, traditionnellement et durement ancrées dans le commerce des essences de « référence » (Lissouck et al. 2012). C’est le cas du Kévazingo (Guibourtia tessmannii) dont l’existence est actuellement très menacée du fait d’une exploitation accrue par une certaine catégorie d’exploitants forestiers présents au Gabon. Or, plusieurs essences de bois restent méconnues des industriels et des chercheurs en sciences du bois au Gabon. L’insuffisance de personnel qualifié et de laboratoires dans
2 le domaine expliquerait cette carence. Pourtant, les bois tropicaux sont considérés comme nobles pour plusieurs raisons : leur forte densité, leur dureté, leur durabilité naturelle, leur richesse en couleur, leur apparence variée et recherchée ainsi que leur facilité de mise en œuvre. De plus, un grand nombre d’essences tropicales produisent des bois de propriétés supérieures aux bois des essences de climat tempéré (Fouquet 2009), ce qui permet de les utiliser dans la construction pour des emplois soumis à de fortes sollicitations.
Dans le contexte forestier gabonais, l’Okoumé reste la principale essence. Elle a retenu l’attention des exploitants, industriels et des scientifiques. C’est un excellent bois de déroulage et très apprécié pour la production du placage et la fabrication du contreplaqué. La situation privilégiée de l’Okoumé a de facto scindé la possibilité forestière en deux principaux groupes. L’Okoumé et l’Ozigo d’une part, et d’autre part, les « bois divers » regroupant toutes les autres essences. Dans ce dernier groupe, seules quatre-vingts (80) d’entre elles sont connues et une vingtaine faisant l’objet d’une exploitation et d’un commerce intense (dont le Kévazingo, l’Azobé, le Padouk, le Bilinga, le Mouvingui, l’Iroko...). Toutes les autres espèces de bois font partie d’un autre grand ensemble dit des « essences secondaires ». C’est-à-dire des essences peu ou pas connues ou espèces ayant une valeur marchande marginale. C’est dans cette dernière catégorie que l’on trouve le Wamba (Tessmania africana), objet de la présente étude de thèse de doctorat.Le Wamba est une espèce qui fait partie de la famille botanique des Césalpiniacées, une sous-famille des Fabaceae ou (Leguminosae) (Dev, S.1989). Cette espèce est présente dans l’ensemble des six pays du bassin du Congo. Au Gabon, il est connu sous le nom de « Nkaga », au Cameroun par « Essingang » au Congo par « Pamiel » et en République Démocratique du Congo par « Wamba » (Faure et Vivien 2011). Ce bois comporte trois variétés, Tessmannia
lescrauwaetii, Tessmannia anormala et Tessamania africana (Maisonneuve et
Manfredini 1988, Faure et Vivien 2011). L’insuffisance de données scientifiques sur cette espèce, pourtant avec une morphologie attrayante et des diamètres moyens allant jusqu’à 1,20 m, nous a donc conduits à s’y intéresser de près.
Par ailleurs, en raison de son origine biologique, le bois est un matériau hétérogène dont la qualité est définie en fonction de son adéquation à l’usage donné. C’est le sens donné à
3 l’étude des propriétés physico-mécaniques et chimiques du Tessmania africana en provenance du Gabon. Ainsi, il s’agira d’étudier la variation de la masse volumique, celle du retrait et du module d’élasticité et de la contrainte maximale en compression longitudinale pour ce qui est des propriétés physiques et mécaniques. Le bois est composé principalement de cellulose, de lignine et des hémicelluloses. Ces constituants structuraux sont une source nutritive de premier choix des microorganismes. C’est pourquoi lors de la mise en œuvre du bois un des inconvénients majeurs est sa sensibilité aux attaques des agents biologiques, notamment les champignons lignivores. C’est pourquoi, après avoir analysé la variation de la teneur en constituants chimiques structuraux et en matières extractibles, nous étudierons la variabilité de la résistance aux pourritures de l’espèce
Tessmania africana. Ces analyses seront couplées à test statistique dans le but d’établir les
interrelations entre propriétés étudiées à travers une analyse de la variance (ANOVA).Mais il est assez connu que la qualité du bois reste également tributaire de nombreux facteurs, dont les conditions de croissance, le milieu (climat, sol...), l’âge, les agressions diverses, etc. Tout comme il est de notoriété que le bois est matériau variable rendant ainsi son utilisation complexe. Cette variabilité est une notion relativement connue au niveau interspécifique qu’elle l’est beaucoup moins au niveau intra spécifique (Jodin 1994). Dans le dernier cas, la variabilité intra-arbre est généralement plus importante que la variabilité inter-arbre (Koga et Zhang 2004).
Dans le but d’évaluer la variabilité des propriétés du bois de Wamba, notre étude s’appuie sur un échantillonnage stratifié réduit à deux arbres. Les difficultés techniques rencontrées sur le terrain et celles liées au coût de transport des plateaux de bois échantionnés vers le Québec ne nous ont pas permis d’avoir un nombre d’arbres plus élevé. Les diamètres des deux arbres coupés à hauteur poitrine étaient de 90 cm pour le premier et 60 cm pour le second. Même si on ne peut prétendre à la représentativité de l’espèce, ces diamètres nous ont semblé représentatifs des arbres commercialement exploitables au Gabon.
Le présent travail de recherche met donc en évidence la variabilité intra-arbre des propriétés physico-mécaniques et chimiques du bois de Wamba, une essence tropicale peu connue de la forêt sempervirente gabonaise. L’étude de la variabilité de ces différentes
4 propriétés prendra appui sur deux positions radiales (aubier vs duramen) et trois niveaux de hauteur (hauteur de poitrine, mi-hauteur et proche de la cime). Ainsi, la présente thèse se compose de trois chapitres. Le premier chapitre traite de la revue de la littérature, le deuxième est consacré au matériel d’essai et à la procédure expérimentale et le troisième chapitre présente les résultats et la discussion des résultats obtenus. Une conclusion générale ainsi qu’une ouverture sur les perspectives de futures recherches sont proposées à la fin du document.
5
Chapitre 1 : Revue de la littérature
1.1 Généralités sur le matériau bois
Le bois est le matériau constituant l’essentiel du tronc, des branches et des racines de l’arbre. Le tronc est constitué de bois et d’écorce. La qualité du bois est liée à sa structure macroscopique et microscopique, mais aussi à la structure des parois cellulaires déterminée par ses constituants chimiques. Cette qualité peut être mesurée dans l’aubier et dans le duramen. Une coupe transversale à la figure 1.1 permet de distinguer l’aubier et le duramen. Dans cette figure, la partie adjacente à l’écorce (aubier) a une couleur plus claire que la partie interne (duramen). Pour de nombreuses espèces de bois, cette distinction de couleur entre l’aubier et le duramen n’existe pas. Le bois exerce donc trois grandes fonctions dans l’arbre : la conduction de la sève brute des racines vers les branches, le soutien mécanique et la réserve des substances nutritives. Le bois d’aubier est le lieu de réserve en eau et en substances nutritives. C’est la partie physiologiquement active du xylème qui permet le transport de la sève brute des racines vers la cime (Taylor et al. 2002).
Figure 1.1 Différenciation de l'aubier et du duramen dans un tronc d'arbre (d'après Cogliastro et al. 2006).
6 Toujours selon (Taylor et al.2002), la proportion du duramen dans un arbre varie selon les espèces et selon les individus. Les différences en termes de génétique et de comportement écologique expliquent principalement les variations interspécifiques du duramen.Il est bon de noter que la duraminisation est le processus de formation du bois de cœur ou duramen. La conversion de l’aubier en duramen est provoquée par la mort des cellules de parenchyme. En s’approchant, le matériel de réserve contenu dans les cellules vivantes de parenchyme est progressivement dégradé et transformé en composés phénoliques ou extractibles. Lorsque les cellules de parenchyme meurent, les composés phénoliques accumulés dans le cytoplasme sont libérés. Ils imprègnent les parois de lumens des cellules avoisinantes pour former le duramen (Taylor et al. 2002).Le duramen est donc la partie formant un cône irrégulier au centre de la tige. Une fois sa formation initiée, le diamètre et la hauteur de ce cône continuent de croître pendant la vie de l’arbre (Giroud 2005). Toujours selon cet auteur, on ne distingue aucune différence majeure entre les propriétés mécaniques de ces deux parties du bois. La figure 1.2 permet de distinguer les différentes parties de l’arbre.
Figure 1.2: Coupe transversale dans un tronc d’arbre (d’après Langer et al. 1999).
Le bois est un matériau biodégradable principalement composé de carbone, d’hydrogène et d’oxygène. Ses propriétés dépendent non seulement de son anatomie, mais aussi de sa
7 composition chimique à travers la nature des trois bio-polymères qui le constituent (cellulose, lignine et hémicelluloses) ainsi que de la présence des extractibles en plus ou en moins grande quantité selon les essences considérées. Les études sur le matériau bois nécessitent donc des différents niveaux d’observation en fonction du type de recherche envisagée. On trouve ainsi des recherches menées à l’échelle macroscopique, microscopique et au niveau moléculaire.
1.2 Anatomie du bois
Le bois est un matériau poreux, hygroscopique et anisotrope, ses propriétés mécaniques, physiques et technologiques changeant suivant la direction choisie. Les éléments sont orientés parallèlement ou perpendiculairement à un axe de symétrie matérialisé par la moelle. La description de la structure anatomique du bois nécessite une observation suivant trois plans : le plan transversal (RT) perpendiculaire à l’axe de la tige où l’on peut observer les cernes annuels, le plan longitudinal-radial (LR) passant au centre de la tige et qui correspond au débit sur (quartier), le plan longitudinal-tangentiel (LT) tangent aux cernes annuels correspondant au débit sur (dosse), (Dirol et Xavier, 2001). La figure 1.3 présente les trois plans et les trois directions d’anisotropie du bois, axiale (L), radiale (R) et tangentielle (T).
Figure 1.3: Directions principales d'une pièce de bois (R : radiale; T : tangentielle; L : longitudinale) (adapté de Cloutier 2005a).
8 Selon Almeida (2006), la structure anatomique des bois tropicaux a une grande influence sur les propriétés physico-mécaniques. Cet auteur montre que le retrait du bois diminue significativement avec le diamètre des fibres. Leclercq (1981) rapporte aussi que pour le bois de hêtre, le retrait volumique total augmente avec la proportion des fibres à faible lumen et que ce même retrait diminue avec l’accroissement du diamètre des fibres à lumens plus étroits. Dans le même sens, Rao et al. (2002) rapportent que le diamètre des vaisseaux ainsi que leur longueur varient significativement dans l’arbre de la base vers le sommet alors que la proportion des tissus varie peu. Ces auteurs montrent une corrélation négative du retrait avec la proportion des vaisseaux.
1.3 Les principaux constituants du bois
Le bois est formé en majorité de trois différents composés macromoléculaires : la cellulose, les hémicelluloses et la lignine. À ces polymères se rajoutent les extractibles et les substances minérales. Les pourcentages de ces différents constituants peuvent varier selon l’espèce, les conditions climatiques, l’âge de l’arbre et les sites de croissance et même la partie de l’arbre étudiée. La nature et l’agencement des différents constituants du bois sont à l’origine de ses différentes propriétés. La séparation et la caractérisation des différents constituants chimiques du bois sont difficiles, du fait de leur étroite association au sein des parois cellulaires. Bien que relativement proche, la composition chimique du bois de conifère et de bois de feuillus est légèrement différente (tableau1.1).
Tableau 1.1 : Composition chimique des résineux et feuillus de la zone tempérée(d’après Sjöström 1993).
Constituants Résineux Feuillus
Cellulose 42 (± 2) 45 (± 2) Hémicelluloses 27 (± 2) 30 (± 2) Lignine 28 (± 2) 20 (± 2) Extractibles 3 (± 2) 5 (± 2)
9 Dans les bois des zones tempérées, les constituants macromoléculaires du bois représentent entre 95 à 99 % du matériau alors que, chez les bois tropicaux, cette valeur est souvent plus faible (environ 90 %) du fait des taux élevés d’extractibles (Fengel et Wengener 1984).
1.3.1 La cellulose
La cellulose étant le principal constituant chimique de la biomasse lignocellulosique, un très grand nombre d’études et d’ouvrages lui a été consacré (Kennedy et al. 1990). C’est un homopolymère linéaire dont la macromoléculaire est constituée d’une seule chaîne composée d’unités de β-D-glucose. Le motif répétitif de la chaîne est le dimère cellobiose (figure 1.4). On distingue ainsi, l’extrémité réductrice qui contient l’hydroxyle hémiacétal libre sur le carbone anomère du glucopyrannose, et l’extrémité non réductrice constituée par le résidu glucopyrannose qui ne contient pas l’hémiacétal. L’ensemble constitué de la cellulose et des hémicelluloses est appelé holocellulose. La cellulose est considérée comme plus stable thermiquement que les hémicelluloses. Elle joue un rôle principal dans le comportement mécanique des parois cellulaires du bois. Son taux de cristallinité est compris entre 40 et 50 % de la matière sèche du bois et varie selon les essences. Au moment de la cristallisation, les chaînes de cellulose s’assemblent pour former une fibrille de 1,2 à 4,8 nm de diamètre. Les fibrilles de cellulose s’agrègent pour former des microfibrilles d’une longueur de 2500 à 5000 nm et d’un diamètre 10 à 25 nm (Fengel et Wegener 1984). La structure cristalline de la cellulose est d’une grande importance pour les propriétés mécaniques du bois (Stevanovic 2014a).
10 1.3.2 Les hémicelluloses
Les hémicelluloses sont définies comme des hétéropolysaccharides présents dans les parois cellulaires des végétaux. Ces constituants chimiques du bois présentent une grande diversité de structure. Contrairement à la cellulose, ce sont des polymères totalement amorphes et ramifiés (Stevanovic et Perrin 2009). Les hémicelluloses sont composées de différents sucres incluant des hexoses tels que le glucose, le galactose,le mannose et les pentoses tels que le xylose, l’arabinose et les acides uroniques (figure 1.5).
Figure 1.5: Différents monosaccharides constituant les hémicelluloses du bois (d’après Stevanovic 2014a).
À l’instar de la lignine, les hémicelluloses sont intimement associées à la cellulose au niveau des parois. La chaîne principale des hémicelluloses peut être constituée par une succession de xylose comme les xylanes, ou de différents sucres comme le glucose et le mannose chez les glucomannanes. Sur les chaînes principales, viennent se greffer des chaînes latérales constituées de sucres comme le galactose, l’arabinose et des acides uroniques. Les résineux et les feuillus peuvent se différencier par les types d’hémicelluloses, mais aussi par des proportions relatives d’oses qui les constituent. Les
11 hémicelluloses présentent dans les bois de feuillus de zones tempérées sont principalement constituées de glucuronoxylanes (15 à 30 %) et de glucomannanes (2 à 5 %) (Fengel et Wegener 1984, Jodin 1994). La chaîne principale des glucuronoxylanes (figure 1.6) est constituée d’unités xylose partiellement acétylées liées par des liaisons β— (1-4), sur lesquelles viennent se greffer des résidus d’acide 4-O-méthylglucuronique liés par les liaisons α— (1-2).
Figure 1.6: O-acétyl-glucuroxylane du bois de feuillus (d’après Stevanovic 2014a).
Les glucomannanes sont formés de D-glucose liés à du D-mannose par une liaison β— (1-4) et ne sont pas acétylés. Les hémicelluloses de bois de résineux sont principalement constituées de galactoglucomannanes (20 à 25 %) et d’arabinoglucuronoxylanes (5 à 10 %). Les galactoglucomannanes sont partiellement acétylés. La chaîne principale est constituée de mannose et de glucose liés par des liaisons β— (1-4), auxquels sont liés du galactose par des liaisons α— (1-6).
La chaîne principale est formée de résidus de D-glucose liés par des liaisons β— (1-4), auxquels viennent se fixer des résidus de L-arabinose par des liaisons α— (1-6) et d’acide 4-O-méthylétherglucuronique liés par des liaisons α— (1-2) (Fengel et Wegner 1984, Sjöstrom 1993). Notons enfin que les hémicelluloses sont les principales responsables des phénomènes de retrait-gonflement dans la paroi avec des variations des teneurs en eau (Siau 1984).
12 Peu d’études parlent de la variabilité des composés chimiques du bois le long de l’arbre. Toutefois, en caractérisant l’holocellulose du cèdre de l’Ouest (Thuja plicata Donn), Barton et MacDonald (1971) rapportent que la teneur en l’hollocellulose dans le bois de cœur augmente de la base vers la cime avec respectivement 56,5 % à hauteur de poitrine, 59,0% à mi-hauteur et 62,2% proche de la cime.
1.3.3 Les lignines
La lignine est présente dans des proportions plus ou moins importantes dans toutes les plantes vasculaires. Elle assure la rigidité aux parois cellulaires végétales et diminue leur perméabilité lors du transport des matières nutritives et des métabolites. Elle représente également une barrière chimique aux attaques extérieures tout en assurant une toxicité vis-à-vis des attaques biologiques. C’est un polymère tridimensionnel synthétisé au niveau de la paroi cellulaire, résultant de la polymérisation oxydative des trois unités monomériques (figure 1.7).
Figure 1.7: Monomères précurseurs des lignines (d’après Stevanovic 2014a).
La lignine étant différente selon les espèces, il est juste de parler des lignines plutôt que de la lignine. La lignine des résineux comprend principalement des unités guaïacyles (dérivant de l’alcool coniférylique), alors que celle des feuillus comprend à la fois des unités guaïacyles et syringyles (dérivant respectivement des alcools coniférylique et sinapylique). L’étude de la structure des lignines est difficile du fait de leurs relations avec les autres constituants de la paroi cellulaire. Les lignines ne peuvent être séparées des hémicelluloses et de la cellulose, qu’après des traitements enzymiques ou chimiques, qui altèrent en partie son intégrité structurale (Fengel et Wegner 1984, Sjöström 1993). Les liaisons qui existent
13 entre la lignine et les polysaccharides au niveau des parois cellulaires peuvent être diverses telles que les liaisons éther, ester ou glycosidique. La lignine constitue le polymère le plus abondant sur la terre après la cellulose. En règle générale, l’allure rampante des mousses est en accord avec l’absence de lignification (Stevanovic 2014a).
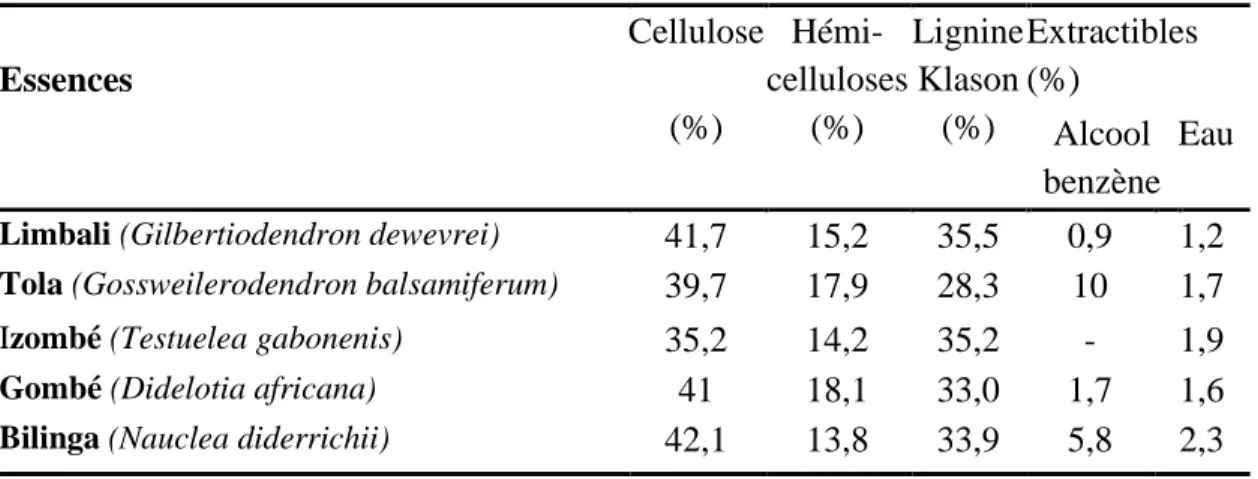
Nuopponen et al. (2006) montrent que la teneur en lignine des bois durs tropicaux peut excéder celle des bois tendres pour se situer entre (29 et 41 %). Selon Gérard et al. (1998) le Tola (Gossweilerodendron balsamiferum) a une teneur de 28,3 % alors que l’Izombé
(Testuela gabonesis), le Gombé (Didelotia africana) et le Bilinga (Nauclea diderricchii) ont respectivement des taux de lignines de 35,2 et 33,9 %. Minkué M’Ény (2000) indique que le pourcentage de lignine chez l’Okoumé (Aukouméa klaineana) se situe autour de 30,0 % dans le bois de cœur et de 28,0 % dans l’aubier. Barton et MacDonald (1971) rapportent que le taux de lignine est de 29,0 % au gros bout du tronc d’arbre, de 28,1 % à mi-hauteur et de 28,3 % au fin bout du cèdre de l’Ouest. Pour la même espèce, ils ont mesuré une teneur en lignine dans l’aubier de 32,3 % au gros bout, de 31,4 % à mi-hauteur et 29,4 % au fin bout.
1.3.4 Les extractibles
Mis à part les constituants structuraux du bois (cellulose, hémicelluloses et lignines), le bois contient une proportion importante de substances non ligno-cellulosiques, 2 à 10 %, voire 20 % chez certaines espèces (Rowe 1989). Il s’agit de substances protéiques et de matières de réserve (amidon, sucre, lipide) dites métabolites primaires dans les cellules vivantes, mais aussi une quantité parfois importante de métabolites secondaires appelés extractibles du bois et des composés minéraux. Toutefois, les métabolites primaires peuvent aussi se trouver parmi les extractibles. Les taux d’extractibles dans les bois de feuillus provenant des zones tempérées sont souvent inférieurs à ceux présents dans les bois de résineux (Fengel et Wegener 1984). Les bois tropicaux, quant à eux, présentent des taux d’extraits pouvant être beaucoup plus élevés comme dans le Teck (Tectona grandis), où ils représentent environ 13 % de la masse sèche (Bhat et Priya 2005, Thulasidas et Bhat 2001). Cloutier (2005b) indique que la teneur en extractibles chez certaines espèces tropicales peut
14 dépasser 30 % du poids anhydre du bois. La teneur des extraits est maximale au niveau de la zone de transition aubier-duramen. Dans le plan axial, plus la hauteur augmente, plus la teneur en extractibles diminue dans le duramen. Finalement, la portion d’extractibles est relativement constante dans l’aubier (Taylor et al. 2002). Ces composés chimiques ont de nombreuses interrelations avec les propriétés physiques, mécaniques du bois ainsi qu’avec la durabilité naturelle. Elles sont aussi responsables de certaines caractéristiques du bois telles que la couleur, l’odeur, les propriétés acoustiques et influencent certaines propriétés de transformation (collage, finition, mise en pâte) (Jodin 1994, Aloui et al.2004). D’autres chercheurs se sont intéressés à l’influence des extraits sur les propriétés mécaniques. Luxford (1931) a conclu que les extractibles contribuent à renforcer le bois; les contraintes maximales en compression longitudinale sont les plus affectées, les contraintes de rupture seraient également modifiées. Par contre, Badran et El-Osta (1977) sur Casuarina glauca et Arganbright (1971) sur le Sequoia sempervirens n’ont pas pu détecter d’effet significatif des extractibles sur la contrainte maximale en compression longitudinale.
El-Osta et al. (1981), dans une étude sur six (6) bois tropicaux à l’état sec à l’air, ont révélé que les extractibles et la densité expliquaient jusqu’à concurrence de 43,6 % de la variabilité des résultats de mesure de l’Acajou d’Afrique, l’effet des extractibles étant de signe positif. Ces auteurs aussi été démontré que, chez le Dabéma (Piptadeniastrum
africanum) et l’Angéline (Dicorynia paraensis), leur teneur en extraits avait une bonne
corrélation avec la durabilité naturelle (Deon et al.1980). Plusieurs auteurs ont aussi mis en évidence le rôle des substances extractibles sur la durabilité du bois et principalement les polyphénols. On retient que ces substances chimiques influencent les propriétés physico-mécaniques du bois. Chafe (1987) rapporte par ailleurs, une bonne corrélation entre la densité basale et la durabilité.
1.3.4.1 Les composés phénoliques
Les composés phénoliques ou polyphénols du bois sont définis comme des molécules organiques comprenant un noyau aromatique et au moins une fonction hydroxyle (OH) libre ou engagée avec d’autres molécules (Croteau et al. 2000). Boizot et Charpentier
15 (2006) indiquent que ces substances sont présentes dans toutes les parties des végétaux supérieurs (racines, tiges, feuillages, fleurs, pollens, fruits, graines et bois) et sont impliquées dans de nombreux processus physiologiques tels que la croissance cellulaire, la germination des graines ou la maturation des fruits. Les extractibles phénoliques peuvent être classés en différentes familles, se différenciant par la complexité de leur squelette de base.
1.3.4.1.1 Les phénols simples
Les phénols simples présentent généralement un squelette de type C6-C3, correspondant au motif phénylpropane présent dans les différents précurseurs de la lignine ou de type C6-C1, correspondant à la forme oxydée du motif précédant. La figure 1.8 indique les principaux composés de ce type d’extraits isolés à partir de bois de feuillus ou de résineux. Parmi les phénols simples à squelette de type C6-C1, il y a l’acide salicylique dont la forme acétylée est à la base de l’aspirine (Raven et al. 2000, Macheix et al. 2005). Dans certains cas, les composés phénoliques sont présents dans le bois sous forme combinée avec d’autres molécules, telles que des sucres comme le cas de la coniférine. Il est intéressant de noter que les poussières de bois de feuillus possèdent des propriétés cancérigènes liées notamment à la présence de quantités plus ou moins importantes d’acide gallique et de ses dérivés (Mammela 2001).
Les propriétés toxiques de ces composés sont dues à la présence des groupements hydroxyles successifs sur le même cycle aromatique (Kamaya et al.2005). Le p-hydroxybenzaldhéyde, p-anisaldhéyde et la vanilline ont été retrouvés respectivement dans plusieurs espèces de sorghum, dans l’huile essentielle de fenouille, de mimosa et dans la sève d’érable à sucre pour la vanilline (Stevanovic et Perrin 2009). La vanilline et le syringaldéhyde sont présents dans le bois de bouleau jaune (Lavoie et Stevanovic 2006). Les acides phénoliques correspondent à un squelette C6- C1. L’acide salicylique, l’acide gallique, l’acide syringique, l’acide p-hydroxybenzaldhéyde, l’acide vanillique et l’acide gentisique se retrouvent sous forme d’esters et glycosides dans le bois des angiospermes. Dans les squelettes C6-C2, les plus importants sont les dérivés de l’acide phénylacétique et
16 acétophénones. D’une manière générale, les phénols simples sont incolores, mais très sensibles à l’oxydation et deviennent bruns ou foncés à l’exposition de l’air. Ils sont solubles dans les solvants basiques, mais leur oxydation est facilitée en milieu alcalin.
Figure 1.8: phénols simples du bois (C6-C1 et C6-C2) (d’après Traoré 2009).
1.3.4.1.2 Les flavonoïdes
Les flavonoïdes sont parmi les composés les plus étudiés des métabolites secondaires et représentent le plus grand groupe de composés phénoliques présents dans les végétaux (Raven et al.2000). Les flavonoïdes de structure générale C6-C3-C6, se divisent en plusieurs familles présentant chacune un squelette bien différent. À l’intérieur de chaque famille, on observe des variations de structure portant principalement sur le degré d’hydroxylation, de méthoxylation et de glycosylation de chaque cycle. Ces fluctuations sont à l’origine des propriétés physico-chimiques et biologiques, attribuées à ces composés (Macheix et al.2005). Les principales familles des flavonoïdes sont : les flavanes, les flavones, les flavanones, les isoflavones, les chalcones et les aurones (Figure 1.9).
Les composés les plus impliqués dans la coloration des plantes sont les flavonoïdes. Ainsi, la couleur caractéristique de certains bois, comme Pterocarpus santallin, Pterocarpus
indicus ou Pterocarpus soyauxiiest due aux flavonoïdes. La santé humaine est l’un des
domaines dans lequel les flavonoïdes sont les plus utilisés à cause des propriétés antioxydantes que possèdent les végétaux (fruits, légumes, tubercules…). Les flavonoïdes sont également très utilisés en cosmétique et participent à la lutte contre le vieillissement cutané en tant que composés antioxydants. Ils limitent l’accumulation des formes actives de
17 l’oxygène très réactives et protègent les protéines de la peau (collagène et élastine) (Macheix et al. 2005).
Figure 1.9: Structure des différentes familles des flavonoïdes (d’après Traoré 2009).
1.3.4.1.3 Les stilbènes, les lignanes et les acides cinnamiques
L’abondance en stilbènes et en lignanes est fonction de l’espèce. Leur toxicité varie selon leur structure, mais également selon le type de souches bactériennes ou fongiques étudiées (Lee et al.2005). On attribue aux stilbènes (figure1.10) un rôle fongicide et de protection contre les insectes. Les stlilbènes sont également très importants pour la résistance aux champignons de pourriture du bois.Des recherches sur la biosynthèse des stilbènes par irrigation de jeunes plantes plants ont été réalisées pour conférer aux bois une meilleure résistance à la biodégradation avec des résultats très intéressants (Norin 1981). Certains stilbènes, comme la pinosylvine et ses formes mono ou diméthylées, isolés à partir de Picea
glauca, Pinus banksianat ou de Pinus resinosa inhibent fortement la croissance des
18 leurs effets sur des pourritures brunes comme Neolentinus lepideus, Gloeophyllum
trabeum, et Postia placenta seraient moins marqués (Celimene et al.1999).
Figure 1.10: Stilbènes isolés de feuillus et de résineux (d’après Traoré 2009).
Les stilbènes sont également très utilisés en pharmacologie. Le resvératrol par exemple, possède des propriétés anticancéreuses et cardioprotectrices. Contrairement aux lignines, les lignanes sont des composés ayant une activité optique. Les lignanes font partie du système de défense chimique de la plante et sont traditionnellement considérés principalement comme des métabolites secondaires du duramen (Stevanovic et Perrin 2009). On extrait facilement les lignanes du bois au méthanol. Comme la plupart des composés phénoliques du bois, les lignanes sont dotés des propriétés antioxydantes et antifongiques (Lee et al.2004).
Les acides cinnamiques possèdent une structure du type C6-C3. Les composés les plus fréquents sont l’acide p-coumarique, l’acide caféique, l’acide cinnamique, (figure1.11). Ils peuvent se définir en termes simples comme des molécules synthétisées par les végétaux et présentent des propriétés antifongiques antioxydantes et antiseptiques. Ils sont surtout utilisés en cosmétique et sous forme d’ester, dans la fabrication des parfums, mais en tant qu’exhausteur de goût. Durant la période précolombienne, l’acide cinnamique a servi dans le processus de momification.
19 Figure 1.11: Quelques dérivés de l'acide hydroxycinnamique
(d’après Stevanovic 2014a).
1.3.4.1.4 Les tanins hydrolysables et tanins condensés ou proanthocyannidines
Le terme tanin a été longtemps utilisé pour caractériser des extraits des végétaux riches en composés phénoliques. On définit les tanins comme des composés phénoliques solubles dans l’eau, dont la masse molaire se situe entre 500 et 3000. Les tanins présentent des réactions caractéristiques des phénols, et sont capables de précipiter les alcaloïdes, la gélatine et les autres protéines. Ces composés ont donc été caractérisés plus par leur action tannante vis-à-vis des protéines que par leur structure chimique (Ossipov et al. 2001). En fonction de leur structure chimique, les tanins peuvent être divisés en deux groupes : les tanins hydrolysables et tanins condensés (figure1.12). Les tanins hydrolysables sont des acides galliques et hexahydroxydiphénique et leurs dérivés. On les classe en deux catégories (Stevanovic et Perrin 2009) :
Les gallotanins qui libèrent par hydrolyse de l’acide gallique accompagné des dérivées galloylés ;
Les ellagitanins qui libèrent par hydrolyse de l’acide gallique accompagné de ses dérivés polycycliques : acide éllagique hexahydroxydiphénique, valonique. Etc.
20 Figure 1.12: Structure des différents tanins condensés (d’après St. Pierre 2012).
Alors que les tanins condensés sont présents dans la plupart des plantes vasculaires, les tanins hydrolysables sont limités aux dicotylédones. Le développement considérable de ces produits naturels avait atteint l’Afrique du Sud, principalement au Natal par la mise en place de plantations d’Acacias d’extraire le tanin de leurs écorces (Savard et Guinet 1954). C’est donc sous le nom écorces de wattles que l’on désigne les écorces de diverses variétés d’Acacias originaires d’Australie et introduites en Afrique du Sud et au Kenya. Ces écorces séchées à l’air renfermaient environ 30 à 40 % de tanins, principalement des catéchines (Savard et Guinet 1954). Dans une autre étude menée par Doat (1978), l’auteur indique que près de la moitié des échantillons de bois des espèces tropicales testées ne contiennent pratiquement pas de tanins. Le Bilinga (Nauclea diderrichii), le Limba (Gilbertiodendron
dewevrei), le Fraké (Terminalia superba), l’Eucalyptus (Eucalyptus globulus) et le
Parasolier (Musanga cecropioides) figuraient parmi les bois tropicaux testés par cet auteur.
En revanche, cet auteur rapporte que les écorces de ces espèces tropicales contenaient des teneurs en extraits à l’eau nettement plus élevées que celles de leur bois. Les teneurs des extraits totaux variaient entre 7 et 37 % et les quantités de tannins entre 5 et 10 % notamment pour le Dabéma (Piptadenia africana). Les tanins condensés sont des phénols
21 plus ou moins réticulés appelés aussi proanthocyanidines. Ils sont constitués principalement d’un assemblage complexe de catéchine et d’épicatéchine.
Le principe permettant la détermination des concentrations en proanthocyanidines est basé sur une conversion des tanins polymérisés en composés simples de cyanidine à une absorbance marquée dans le domaine visible du spectre électromagnétique permettant leur quantification par spectrophotométrie. Les tanins condensés sont des polymères d’unités flavane-3-ols, comme la catéchine. Elles sont liées entre elles par des liaisons C4-C8 ou C4-C6. Ces tanins, contrairement aux précédents sont assez résistants à l’hydrolyse. Les tanins condensés ou proanthocyanidines possèdent des effets anti-inflammatoires, antiallergiques et antiulcéreux (Scalbert et al. 2005). Ces composés sont aussi dans le vin et lui confèrent des effets cardioprotecteurs.
Les tanins condensés et les flavonoïdes ont la même origine biosynthétique basée sur le métabolisme des phénypropanoïdes et présentent une structure C6-C3. Ce métabolisme est un métabolisme secondaire, spécifique au règne végétal dont la nature varie en fonction des espèces végétales. Ces composés secondaires sont impliqués dans des fonctions diverses telles que la fertilité, la pigmentation et la protection contre les attaques des microorganismes (Macheix et al. 2005). Les composés phénoliques sont aussi importants dans divers domaines des sciences, pharmaceutiques, cosmétiques et nutraceutiques. De manière générale la valorisation de ces composés est bénéfique pour l’espèce humaine. Les extractibles sont utilisés comme anti-inflammatoires, antimicrobiens et comme compléments alimentaires ou antioxydants.
1.3.4.2 Les composés terpéniques des arbres
Les terpènes et les phytostérols (figure 1.13) sont largement répandus dans les arbres forestiers, mais les conifères constituent les sources les plus abondantes des composés terpéniques. Le rôle des terpènes dans la défense contre les microorganismes, ainsi que leur importance pour la résistance générale aux maladies est bien connue (Stevanovic et Perrin 2009). Parmi ces substances chimiques, on retrouve les triterpènes qui sont des composés se présentant le plus souvent sous forme polycyclique (pentacyclique).Mais on
22 trouve aussi des triterpènes non cyclique comme le squalène. Cette dernière molécule a été identifiée dans le bouleau jaune par Lavoie et Stevanovic (2006). Le bétuniol, responsable de la teinte blanche de l’écorce du bouleau blanc (Betula papyrifela) et le lupéol sont également des constituants majeurs de l’écorce du bouleau jaune. Les triterpènes sont aussi présents dans les bois tropicaux puisque les amyrines ont été identifiés dans la résine et dans le bois de l’Okoumé (Aucuméa klaineana), une espèce endogène du Gabon appartenant à la famille des Burseraceae (Minkué M’Eny 2000, Medzegue 2007).
Figure 1.13: Structures des composés terpéniques(a)Ursolic acid; (b) Betulinic acid; (c) Stigmasterol; (d) Lupeol (d’après Kumar et Mishra 2015).
Il est important de noter aussi que les constituants majeurs des extraits lipophiles de différents tissus de bouleau jaune sont tous des molécules bioactives avec des propriétés anti-flammatoires, anti-tumorales, anti-HIV rendant ainsi leur extraction très intéressante (Krasutsky 2006).
1.4 Étude des propriétés physico-mécaniques et chimiques du bois
1.4.1 Propriétés physiques
Les caractéristiques qui entrent dans cette catégorie sont nombreuses. La présente étude analyse la variabilité de la masse volumique et celle du retrait. Ces caractères sont essentiels pour juger de la qualité du bois et de son classement pour un usage donné.
23 1.4.1.1 La masse volumique
La masse volumique peut être définie comme la quantité massique de la matière ligneuse contenue dans le volume d’un bois donné. Cette propriété physique représente l’une des caractéristiques de base pour classer le matériau bois et son évaluation assez facile en fait un critère qualitatif de choix. Panshin et de Zeeuw (1980) soulignent que les propriétés mécaniques et physiques du bois sont étroitement liées à sa masse volumique. La figure 1.14 montre pour le bois d’épinette noire la relation entre le module d’élasticité en direction longitudinale (MOE) et la masse volumique.
Figure 1.14: Variation du module d'élasticité longitudinale du bois d’épinette noire en fonction de la masse volumique basale (d’après Rycabel 2007).
La masse volumique du bois varie considérablement d’une espèce à l’autre, au sein d’une même espèce et surtout à l’intérieur d’un même individu (de bas en haut et du centre vers la périphérie), d’une provenance à l’autre et même à l’intérieur de la même provenance (Singh 1987). Elle varie également selon les conditions de croissance, de la moelle vers l’écorce, en fonction de la hauteur dans l’arbre et selon le type de bois (état de maturité du bois) (Panshin et de Zeeuw 1980). Elle peut aussi varier entre l’aubier et le duramen.
24 Selon Woodcock et al. (2000), la masse volumique des espèces est faible dans les environnements humides tropicaux et est plus élevée là où les conditions sont plus sèches. En plus des effets de l’environnement, la masse volumique peut varier en fonction de la provenance et/ou de la famille dans la provenance (Zobel et Jett 1995). Une étude sur les feuillus tropicaux a démontré des différences significatives chez certaines espèces dont l’âge variait entre 6 et 10 ans. Ces différences établies à la suite d’une analyse de variance montraient que les caractères étudiés variaient en fonction de l’âge et des conditions de croissance. Concernant la variabilité intraspécifique de la masse volumique dans les espèces tropicales, Wiemann et Williamson (2002) indiquent que celle-ci est plus forte chez les feuillus tropicaux que chez les essences des climats tempérés.
Pour des besoins de clarté, rappelons que les corps poreux et hygroscopiques comme le bois et l’écorce présentent au moins trois définitions assez différentes de la masse volumique :
La masse volumique anhydre (D0) exprime le rapport de la masse au volume de
l’échantillon à l’état anhydre.
0 0 0 V M D (1) Où
M0 : Masse de l'échantillon anhydre (kg)
V0 : Volume de l’échantillon anhydre (m3).
La masse volumique à une teneur en humidité donnée (DH) donne le rapport de la
masse au volume de l’échantillon à cette teneur en humidité H.
H H H V M D (2) Où :
MH : Masse de l'échantillon humide (kg)
25 Par ailleurs certains auteurs tels que Kollmann et Côté (1968) donnent la masse volumique humide comme étant le rapport de la masse anhydre au volume l’échantillon à cette teneur en humidité H.
La masse volumique basale (Db) présente le rapport de la masse anhydre (M0) à son
volume de l’état de saturation (Vs) de l’échantillon.
S o b V M D (3) Où :
M0 : Masse anhydre de l’échantillon (kg)
Vs : Volume saturé de l’échantillon (m3).
En dehors des autres méthodes de classement des bois tropicaux, les utilisateurs se servent du tableau 1.2 établit par le centre de coopération internationale en recherche agronomique pour le développement (Cirad).
Tableau 1.2: Catégorisation de la masse volumique (kg/m3)
des bois tropicaux (d’après Gérard et al. 1998). Masse volumique (MV) Catégorie de bois
MV < 500 Bois très léger 500 < MV < 650 Bois léger 650 < MV < 800 Bois mi-lourd 800 < MV < 950 Bois lourd 950 > MV Bois très lourd 1.4.1.2 Le retrait
Le retrait est la propriété physique qui sert à évaluer la stabilité dimensionnelle et par le fait même, le comportement du bois au séchage (Skaar 1998). Le retrait est affecté par plusieurs facteurs incluant la teneur en humidité, la masse volumique, la structure anatomique, les extractibles, les constituants structuraux, l’effort mécanique et la proportion du bois juvénile (Tsoumis 1991, Jodin 1994). Le retrait apparaît dès que le bois vidé de toute l’eau