HAL Id: dumas-01131827
https://dumas.ccsd.cnrs.fr/dumas-01131827
Submitted on 16 Mar 2015
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Imagerie des tumeurs mixtes mésenchymateuses et
épithéliales du rein : à propos de 21 cas
Guillaume Bertrand
To cite this version:
Guillaume Bertrand. Imagerie des tumeurs mixtes mésenchymateuses et épithéliales du rein : à propos de 21 cas. Médecine humaine et pathologie. 2014. �dumas-01131827�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2014
N°135
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Imagerie des tumeurs mixtes mésenchymateuses et
épithéliales du rein. A propos de 21 cas
Présentée et soutenue publiquement
le 9 octobre 2014
Par
BERTRAND, Guillaume
Né le 3 septembre 1984 à Schiltigheim (67)
Dirigée par M. Le Docteur Eiss, David, PH
Jury :
M. Le Professeur Hélénon, Olivier, PU-PH ... Président Mme Le Docteur Verkarre, Virginie, MCU-PH ... Membre M. Le Professeur Timsit, Marc-Olivier, PU-PH ... Membre M. Le Professeur Brillet, Pierre-Yves, PU-PH ... Membre
2
REMERCIEMENTS
Au Professeur Hélénon,
Vous me faîtes l’honneur de présider cette thèse. Merci pour vos précieux conseils et le temps que vous m’avez consacré ainsi qu’aux différentes relectures, parfois au détriment de vos vacances.
Au Docteur Eiss,
Ta compétence alliée à ton humour ont contribué à rendre ce stage mémorable. Merci d’avoir accepté de diriger cette thèse et pour toutes ces gardes consacrées à la relecture. Et aussi merci pour tous ces demi-croissants.
A Monsieur Professeur Brillet,
Bientôt de retour à Avicenne et de l’autre côté du diaphragme. Merci de m’accueillir dans le service et d’avoir accepté de faire partie de mon jury.
Au Docteur Verkarre,
Merci pour votre disponibilité et vos explications claires et détaillées de l’histologie ainsi que d’avoir accepté sans hésitation de faire partie de mon jury de thèse.
Au Professeur Timsit,
Vos pertinentes remarques au staff d’urologie lui donnent du relief et de l’intérêt. Merci d’avoir accepté d’évaluer cette thèse.
A mes maîtres d’Internat,
Les Professeurs Bourgeois, Blétry, Brunel, Grenier, Lacombe, Vilgrain, Brauner, le Docteur Rodesch, les Professeurs Hélénon et Carlier.
Je vous remercie de m’avoir accueilli successivement dans vos services et d’avoir contribué activement à ma formation.
Au Professeur Fautrel,
Si je n’avais pas fait radio, j’aurais sans doute été bon pour la rhumato. Merci de ton enseignement et de ta sympathie. Ce fut un plaisir de participer à ces différents projets, bien après ma « trahison ».
Au Professeur Cluzel,
Votre rigueur, votre compétence et votre professionnalisme sont et resteront pour moi un exemple au cours de ma pratique future, qu’elle soit interventionnelle ou non. Je vous remercie de votre enseignement et d’avoir accepté de m’encadrer au cours de mon Master 2. A Diane et Damien,
3 A mes parents,
Tout vous dire serait plus long que ma thèse, et je ne veux pas que vous me voliez la vedette. Merci pour votre indéfectible soutien et votre amour.
A ma grand-mère,
Je sais que tu aurais voulu être là. Je pense fort à toi et je sais que toi également depuis Pontarlier.
A Frédéric et Myriam,
Parce que je ne supportais pas que vous soyez Docteurs et pas moi ! A Anaëlle et David,
Ces chers petits trésors. A Valérie,
Fidèle amie, sous-colleuse à qui mon classement aux ECN doit beaucoup et mère de ma filleule.
A ma famille et à mes proches, trop nombreux pour tous les nommer ici. A Marie,
Mon amour chéri, qui m’a supporté – dans les deux sens du terme mais surtout dans un – tout au long de cette thèse. Merci d’être à mes côtés chaque jour. Merci pour ton soutien, ta bonne humeur, ta générosité, ton sourire, (tes gâteaux), enfin tout ce qui fait que je t’aime plus que tout. Ce travail t’est en grande partie dédié.
5
TABLE DES MATIERES
I. INTRODUCTION ... 7
II. GENERALITES ... 10
A. Clinique ... 10
1. Néphrome kystique ... 10
2. Tumeur mixte épithéliale et stromale ... 11
B. Anatomie pathologique ... 11
1. Classification des tumeurs rénales primitives ... 11
2. Néphrome kystique ... 14
3. Tumeur mixte épithéliale et stromale ... 16
4. Transformation maligne ... 20
5. Diagnostics différentiels ... 21
C. Ethiopathogénie ... 21
1. Néphrome kystique ... 21
2. MEST ... 21
3. L’expression variable d’une même néoplasie ... 22
D. Imagerie ... 22
1. Classification scanographique des tumeurs kystiques... 22
2. Néphrome kystique ... 33
3. MEST ... 35
III. MATERIEL ET METHODES ... 38
A. Données cliniques et anatomo-pathologiques ... 38
B. Technique d’imagerie ... 38
C. Population étudiée ... 40
D. Relecture des examens ... 41
E. Critères évalués en imagerie ... 41
IV. RESULTATS ... 43 A. Clinique et anatomo-pathologie ... 43 B. Imagerie ... 45 1. TDM et IRM ... 45 2. Comparaison TDM/IRM ... 50 3. Echographie de contraste ... 50 4. Suivi ... 52 5. MEST ... 54 V. DISCUSSION ... 55 VI. CONCLUSION ... 60 VII. BIBLIOGRAPHIE ... 61
6
ABREVIATIONS
BHD : syndrome de Birt Hogg Dubé CCR : carcinome à cellules rénales
IRM : imagerie par résonance magnétique MEST : tumeur mixte épithéliale et stromale NK : néphrome kystique
TDM : tomodensitométrie
TMME : tumeur mixte mésenchymateuse et épithéliale du rein UH : unité Hounsfield
UIV : urographie intra-veineuse
7
I.
INTRODUCTION
La classification OMS 2004 des tumeurs de l’appareil urinaire distingue la famille des tumeurs mixtes mésenchymateuses et épithéliales du rein (TMME), qui regroupe trois tumeurs : le néphrome kystique (NK), la tumeur mixte épithéliale et stromale (MEST) et le sarcome synovial.
Le NK est une tumeur bénigne à composante épithéliale et stromale (1). C’est une lésion entièrement kystique multiloculaire, sans portion charnue ou nécrose (1). Le premier cas a été décrit en 1892 par Walter Edmunds alors dénommé adénome kystique du rein et supposé d’origine wolffienne (2). Certains l’ont par la suite appelé kyste rénal multiloculaire et supposé être une forme de dysplasie rénale (3,4). En 1989, l’hypothèse néoplasique est mise en avant, avec de possibles similitudes avec le néphroblastome (5). En 1994, un cas de NK avec importante composante mullérienne a été rapporté, soulevant l’hypothèse d’une dysontogenèse (6). En 1998, Eble et Bonsib ont proposé de nouveaux critères diagnostiques pour le diagnostic de NK, toujours utilisés aujourd’hui, le distinguant notamment du néphrome kystique partiellement différencié (7). Le terme de néphrome kystique a été proposé en 1951 et plusieurs dénominations ont pu être employées, comme néphrome kystique multiloculaire, kyste multiloculaire, néphrome multikystique (8). Plus de 200 cas ont été rapportés dans la littérature (9).
8
La MEST est une tumeur à composante double épithéliale et stromale (1). C’est une lésion d’architecture plus complexe, avec une proportion variable des composantes kystique et solide. Elle a pour la première fois été rapportée en 1973 par Block et al. sous le nom de néphrome mésoblastique congénital de l’adulte. Dans les années qui suivirent, des cas similaires de néphromes mésoblastiques de l’adulte ou d’hamartomes kystiques du pyélon rénal ont été rapportés (10–15). Différents noms ont été proposés pour la décrire : hamartome kystique du pyélon rénal, néphrome mésoblastique de l’adulte, hamartome léiomyomateux, tumeur solide et kystique biphasique (16). Le terme de MEST, qui reflète le mieux la nature de la lésion, a été proposé en 1998 par Michal et Syrucek (17). Environ 90 cas ont été rapportés depuis 1997 (16).
La MEST et le NK présentent des données épidémiologiques communes, touchant majoritairement les femmes après 30 ans (1). Ces dernières années, plusieurs observations ont rapporté des similitudes histologiques et génétiques entre ces deux tumeurs, tant et si bien que certains auteurs ont proposé d’englober ces deux entités sous le terme de tumeur rénale épithéliale et stromale (18). Une hypothèse récente est qu’elles constituent l’expression variable d’une même néoplasie (19).
Le sarcome synovial présente des caractéristiques démographiques différentes et la composante épithéliale de la tumeur correspond en fait à des tubules rénaux piégés au sein de la portion stromale. En 2013, l’International Society of
9
Urological Pathology a publié des recommandations de modification de la classification OMS, excluant le sarcome synovial des tumeurs mixtes mésenchymateuses et épithéliales, ce groupe ne comportant plus que les NK et MEST (20).
Le NK et la MEST sont des tumeurs bénignes. Leur découverte est le plus souvent fortuite. Ils peuvent se révéler par une pesanteur lombaire ou une hématurie. En imagerie, ils se présentent classiquement comme des tumeurs kystiques complexes, appartenant généralement aux catégories chirurgicales de la classification de Bosniak (21). Leur principal diagnostic différentiel est alors le carcinome kystique multiloculaire à cellules claires. Aucune caractéristique morphologique ne permet de les en différencier et leur exérèse chirurgicale est le plus souvent nécessaire. De rares cas de dégénérescence maligne ont été rapportés dans les deux cas (22).
Après un rappel des caractéristiques cliniques et pathologiques des TMME et du système de classification des tumeurs kystiques de Bosniak, nous rapportons les résultats d’une étude rétrospective monocentrique ayant porté sur 21 TMME prouvées histologiquement opérées sur une période de 6 ans, parmi lesquelles 20 NK et 1 MEST. L’objectif de ce travail a été d’étudier rétrospectivement l’aspect en imagerie d’un type rare de tumeur du rein, la TMME, au travers d’une série de 21 lésions opérées entre 2008 et 2013 dans un centre spécialisé.
10
II.
GENERALITES
A.
Clinique
1. Néphrome kystique
Les données de la littérature consistent surtout en des cas ou séries de cas et la prévalence n’est pas précisément connue. Ils représentaient 2,4% des tumeurs d’une série de 165 lésions rénales primitives (23) et 0,5% parmi 4532 tumeurs rénales étudiées sur une période de 18 ans (24).
Il existe une distribution biphasique des lésions, pédiatrique et adulte. On l’observe entre 2 et 4 ans avec un ratio garçons/filles à 3/1. On l’observe par ailleurs entre la 4ème et la 6ème décade avec un ratio homme/femme à 1/8 (25–28). Dans une série plus récente, le sex ratio était de 91% en faveur des femmes et l’âge médian au moment de la découverte de 55 ans (39 à 79 ans) (24). Ils sont dans la plupart des cas uniques. Plusieurs cas de lésions bilatérales ont été rapportés, touchant surtout les enfants (7,24).
La présentation clinique diffère selon la population. Chez l’enfant, Il s’agit typiquement d’une masse indolore de l’abdomen ou du flanc de croissance plus ou moins rapide et de découverte fortuite. Chez l’adulte, la découverte peut être fortuite au cours d’un examen systématique ou bien consécutive à des signes non spécifiques comme une masse palpable, une douleur lombaire, une hématurie, une anémie, une infection urinaire ou une hypertension artérielle, symptômes rapportés dans environ trois quarts des cas selon les séries (24,29).
11
2. Tumeur mixte épithéliale et stromale
Les données de prévalence montrent qu’il s’agit d’une entité rare (<1%). Elles représentaient 0,20% d’une série de 4532 tumeurs rénales et 0,28% d’une série d’environ 8000 tumeurs rénales (24,30).
Elles touchent surtout les femmes entre la 4ème et la 6ème décades avec un âge moyen au moment du diagnostic entre 38 et 56 ans. Le sexe ratio est nettement en faveur des femmes de 6/1 à 15/1 (14,18,22,30–32). Elles sont dans la plupart des cas uniques. Un cas de MEST bilatérale et un cas de localisation controlatérale après exérèse d’une première MEST ont été rapportés (24,33). Elles peuvent ne pas être symptomatiques dans 19 à 33% des cas. Lorsqu’elles le sont, elles s’expriment le plus fréquemment par une masse palpable, une douleur lombaire ou une hématurie (16,24)
B.
Anatomie pathologique
1. Classification des tumeurs rénales primitives
Les cancers du rein sont des proliférations tumorales malignes primitives du parenchyme rénal dominées par le carcinome à cellules rénales.
Certaines tumeurs malignes (carcinome à cellules rénales : carcinome à cellules conventionnelles, carcinomes papillaires, carcinomes à cellules chromophobes) et bénignes (adénomes oncocytaires et angiomyolipomes) représentent plus de 90% des tumeurs du rein.
12
La dernière classification histopathologique des tumeurs rénales de l’adulte de l’OMS est celle de 2004 (1) (Tableau 1). Elle classe les différents types tumoraux selon leur type histologique et distingue :
Les tumeurs à cellules rénales Les tumeurs métanéphriques Les tumeurs néphroblastiques Les tumeurs mésenchymateuses
Les tumeurs mixtes mésenchymateuses et épithéliales Les tumeurs neuroendocrines
Les tumeurs hématopoïétiques et lymphoïdes Les tumeurs des cellules germinales
Les tumeurs métastatiques
Les NK et les MEST appartiennent au groupe des tumeurs mixtes épithéliales et mésenchymateuses au même titre que le sarcome synovial primitif.
En réalité, la composante épithéliale du sarcome synovial primitif correspond à des tubules rénaux natifs piégés au sein de la tumeur. Une conférence de consensus de 2012 de l’International Society of Urological Pathology propose de reclasser cette tumeur dans le groupe des tumeurs mésenchymateuses, ce qui laisserait comme seuls représentants des tumeurs mixtes le NK et la MEST (20).
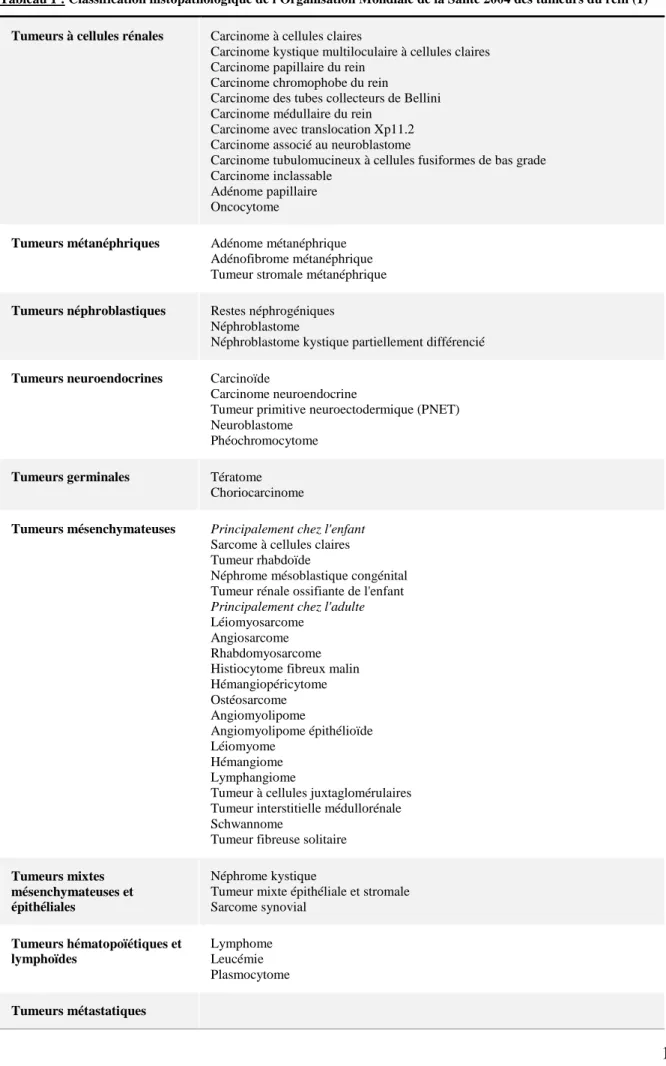
13 Tableau 1 : Classification histopathologique de l'Organisation Mondiale de la Santé 2004 des tumeurs du rein (1)
Tumeurs à cellules rénales Carcinome à cellules claires
Carcinome kystique multiloculaire à cellules claires Carcinome papillaire du rein
Carcinome chromophobe du rein
Carcinome des tubes collecteurs de Bellini Carcinome médullaire du rein
Carcinome avec translocation Xp11.2 Carcinome associé au neuroblastome
Carcinome tubulomucineux à cellules fusiformes de bas grade Carcinome inclassable
Adénome papillaire Oncocytome
Tumeurs métanéphriques Adénome métanéphrique Adénofibrome métanéphrique Tumeur stromale métanéphrique
Tumeurs néphroblastiques Restes néphrogéniques Néphroblastome
Néphroblastome kystique partiellement différencié
Tumeurs neuroendocrines Carcinoïde
Carcinome neuroendocrine
Tumeur primitive neuroectodermique (PNET) Neuroblastome
Phéochromocytome
Tumeurs germinales Tératome Choriocarcinome
Tumeurs mésenchymateuses Principalement chez l'enfant Sarcome à cellules claires Tumeur rhabdoïde
Néphrome mésoblastique congénital Tumeur rénale ossifiante de l'enfant Principalement chez l'adulte Léiomyosarcome
Angiosarcome Rhabdomyosarcome Histiocytome fibreux malin Hémangiopéricytome Ostéosarcome Angiomyolipome Angiomyolipome épithélioïde Léiomyome Hémangiome Lymphangiome
Tumeur à cellules juxtaglomérulaires Tumeur interstitielle médullorénale Schwannome
Tumeur fibreuse solitaire
Tumeurs mixtes mésenchymateuses et épithéliales
Néphrome kystique
Tumeur mixte épithéliale et stromale Sarcome synovial Tumeurs hématopoïétiques et lymphoïdes Lymphome Leucémie Plasmocytome Tumeurs métastatiques
14
2. Néphrome kystique
a) Macroscopie
Le NK est une tumeur encapsulée bien limitée, purement kystique multiloculaire. Il ne comporte pas de portion solide. Les kystes ont un contenu séro-hématique qui peut parfois paraître hémorragique. La lésion peut être focale ou occuper l’ensemble du rein. Un développement sinusal ou exorénal est fréquemment observé. Rarement, elle est de situation intra pyélique prédominante. Les calcifications sont rares. Les plages de nécrose ou d’hémorragie sont rares, habituellement retrouvées en cas de hernie de la tumeur dans le pyélon ou l’uretère, responsable d’une atteinte de la fine couche d’épithélium de transition (26). La taille peut varier grandement au moment du diagnostic, souvent de grande taille aux alentours de 7 à 9 cm (22,24).
L’aspect macroscopique est illustré par la figure 1a.
a) Microscopie
Les kystes sont bordés d’un épithélium simple couche de cellules aplaties, cubiques ou en clous de tapissier, avec de possibles territoires stratifiés voire des atypies (Figures 1b et 1c). Leur cytoplasme peut être éosinophile ou clair.
Les septa fibreux peuvent être pauci cellulaires ou cellulaires, avec une densité ressemblant à du stroma ovarien. On peut voir quelques faisceaux de muscle lisse ou strié voire du cartilage.
15
Figure 1 : Aspect anatomo-pathologique d’un néphrome kystique
a : pièce macroscopique retrouvant une lésion encapsulée contenant des cloisons fines délimitant des logettes de taille variable allant jusqu’à 2 cm ; b : coloration HES à grossissement x16 : cavités kystiques multiples séparées par de fines cloisons plus ou moins cellulaires ; c : coloration HES à grossissement x100 : cloisons bordées d’un épithélium simple couche aplati.
c a
16
Les septa peuvent contenir des agrégats de tubules matures (1)
Il n’y a pas d’atypie cellulaire stromale ou épithéliale. On ne retrouve pas de blastème ou d’élément immature comme dans le néphroblastome cystique partiellement différencié (26).
b) Immunohistochimie
Le NK est négatif pour le Renal Cell Carcinoma Marker (RCC Ma) (34). Il est positif pour les récepteurs aux oestrogènes dans 19% des cas, récepteurs à la progestérone dans 40% des cas, au CD10 dans 50% des cas, à la calrétinine dans 41% des cas et à l’inhibine dans 36% des cas (18).
c) Cytogénétique
Des cas familiaux de néphromes kystiques ont été rapportés (35). Une association avec le blastome pleuropulmonaire est décrite, compatible avec un facteur génétique prédisposant (36).
3. Tumeur mixte épithéliale et stromale
a) Macroscopie
C’est une tumeur d’architecture plus complexe, à développement souvent central au sein du rein. La taille est variable entre 2 et 25 cm. Elle présente une double composante faite de multiples kystes et de portions solides (37,38). La composante kystique peut prédominer et être associée à des nodules muraux ou ressembler au carcinome kystique multiloculaire à cellules claires (12,39). Elle n’est pas encapsulée mais bien limitée (37). Elle peut avoir un développement
17
expansif faisant hernie au sein du pyélon, sans envahissement ou destruction des parois pyéliques (14). La portion solide est typiquement blanchâtre, ferme présentant parfois une texture d’aspect spiralé (22). Des zones d’hétérogénéité contenant de la nécrose ou des calcifications peuvent être observées (10).
L’aspect macroscopique est illustré par la figure 2a.
b) Histologie
La tumeur présente deux composantes : épithéliale et mésenchymateuse.
La composante épithéliale fait partie intégrante de la tumeur et ne se contente pas de la border : elle s’immisce au sein de la composante stromale. Elle est faite de tubules ou structures tubulo-papillaires plus complexes avec ou sans dilatation kystique. Ceux-ci sont bordés par un épithélium aplati ou cubo-cylindrique qui peut présenter un cytoplasme clair et ont un aspect caractéristique en clous de tapissier (40). L’épithélium forme parfois de petites touffes papillaires. Un urothélium, parfois hyperplasique, peut également border certaines parties des kystes (22).
La composante mésenchymateuse est caractérisée par des faisceaux de cellules fusiformes montrant différents degrés de différentiation musculaire lisse, fibroblastique ou myofibroblastique entremêlés de faisceaux de collagène (40). Le stroma est dit pseudo ovarien et des cellules stromales d’allure lutéinisées ont été décrites (18,39). Il y a une proportion variable de cellules fusiformes à noyau dodus et au cytoplasme abondant et de collagène dense. De la graisse peut être
18
présente (41–43). L’extension de la tumeur au-delà de la capsule rénale n’a pas été décrite.
Il existe une variante dite cellulaire, atypique (16). La cellularité est faible pour dans la variante classique et élevée dans la variante cellulaire. Il n’y a pas de différence au sein de la composante épithéliale entre les deux variantes. Des remaniements hémorragiques, nécrotiques et un index mitotique élevé peuvent être retrouvés dans la variante cellulaire (14).
L’aspect histologique est illustré par les figures 2b à 2e.
c) Immunohistochimie
Habituellement, la MEST est positive pour le CD10 dans 77% des cas, la calrétinine dans 69% des cas, l’inhibine dans 42% des cas, les récepteurs aux œstrogènes dans 62% des cas et à la progestérone dans 85% des cas (18). L’expression des récepteurs à la progestérone est plus étendue et intense que celle des récepteurs aux œstrogènes (18,44). Les cellules stromales peuvent être positives aux anticorps dirigés contre la vimentine, l’actine des muscles lisses, la caldesmine, la desmine et les récepteurs hormonaux aux œstrogènes et à la progestérone (16,18). La composante épithéliale réagit à la cytokératine, notamment la cytokératine 7 (16).
19
Figure 2 : Aspect anatomo-pathologique d’une MEST
a : pièce macroscopique : plusieurs kystes à paroi lisse séparés par des secteurs solides plus ou moins abondants, blanchâtres ; b, c, d et e : coloration HES en grossissement x16 (b et d) et x100 (c et e). b et c : cloisons bordées d’un revêtement épithélial en clous de tapissier et contenant un stroma de type pseudo ovarien fusiforme ; d et e : territoire solide d’une MEST constitué de quelques kystes avec au fort grossissement (e) une illustration du stroma pseudo ovarien.
b c
d e
20
d) Cytogénétique
Il a été mis en évidence dans un cas une translocation t(1 :19) (45). Une série de 21 cas étudiant l’inactivation du chromosome X montre une inactivation non au hasard au sein des composantes épithéliale et mésenchymateuse de la tumeur dans 60% des cas, suggérant une origine cellulaire commune (46). Une étude n’a pas mis en évidence au sein des MEST les mutations habituellement retrouvées au sein des néphromes mésoblastiques congénitaux, ce qui va contre une relation entre ces deux tumeurs.
4. Transformation maligne
Le néphrome kystique et la MEST se comportent majoritairement comme des lésions bénignes. Plusieurs cas de transformation maligne ont été rapportés dans les deux cas.
Dans leur revue, Moslemi et al. ont retrouvé 10% (9/90) de MEST malignes, sous la forme d’une transformation sarcomateuse ou carcinomateuse ou sous la forme d’une récidive loco-régionale agressive rapidement fatale dans le cas de 4 patients (16,47–52).
Les néphromes kystiques malins se manifestent le plus souvent sous la forme de sarcomes, qui peuvent être un sarcome indifférencié, un léiomyosarcome, un sarcome pléiomorphe ou un mésenchymome malin (7). Des cas de dégénérescence maligne épithéliale à cellules claires ont également récemment été rapportés (52–54).
21
Ce risque potentiel de transformation maligne, même s’il est remis en doute par certains auteurs, doit être gardé à l’esprit et intégré dans la décision de prise en charge (16,22).
5. Diagnostics différentiels
Les principaux diagnostics différentiels des TMME sont les tumeurs rénales kystiques, comme le néphroblastome kystique partiellement différencié, le carcinome à cellules rénales kystique multiloculaire, le carcinome kystique multiloculaire à cellules claires.
C.
Ethiopathogénie
1. Néphrome kystique
L’origine de cette lésion est mal déterminée. On a initialement supposé qu’il se développait à partir de reliquats wolffiens (2). Par la suite, on l’a pris pour une forme de dysplasie rénale puis à nouveau considéré comme une tumeur, possiblement similaire au néphroblastome (3–5). En 1994, un cas de NK avec importante composante mullérienne a fait soulever l’hypothèse d’une dysontogenèse (6). En 1998, on propose de nouveaux critères diagnostiques, le distinguant du néphroblastome kystique partiellement différencié (7).
2. MEST
L’origine de la MEST reste débattue. Certains l’ont considérée comme un hamartome, d’autres originaire du blastème rénal. L’hypothèse d’une tumeur des tubes collecteurs a un temps été proposée avant d’être abandonnée (16).
22
Certains ont suggéré que la MEST est le représentant rénal des tumeurs kystiques à stroma ovarian-like des voies biliaires et du pancréas (37).
3. L’expression variable d’une même néoplasie
Ces dernières années, plusieurs études ont rapporté des points communs entre le NK et la MEST (20). Ces deux lésions atteignent préférentiellement les femmes autour de la ménopause, présentent des caractéristiques morphologiques se chevauchant et expriment dans les deux cas des récepteurs hormonaux aux œstrogènes ou à la progestérone. Une étude de faible effectif a retrouvé un profil d’expression génique similaire entre le NK et la MEST, comparativement aux carcinomes rénaux (55).
Devant ces particularités, les experts de l’International Society of Urological Pathology ont estimé, dans les recommandations issues de leur conférence de consensus de 2012, que le NK et la MEST devraient être considérés comme des variantes de la même néoplasie (19).
D.
Imagerie
1. Classification scanographique des tumeurs kystiques a) La classification de Bosniak
Les lésions kystiques du rein sont fréquentes, et leur découverte fortuite très banale avec le développement des explorations abdominales échographiques et de l’imagerie en coupes. Les kystes sont rares chez l’enfant (0,1 à 0,45%) et communs chez l’adulte, avec environ 50% des patients porteurs d’un ou de
23
plusieurs kystes après l’âge de 50 ans (56,57). Leur taille, leur nombre et leur complexité augmente avec l’âge (58,59). Ils sont dans la plupart des cas simples, bénins et asymptomatiques.
Si les kystes simples sont facilement identifiables, les kystes complexes représentent un enjeu diagnostic et il est nécessaire de savoir différencier les kystes complexes typiquement bénins des plus suspects, afin d’orienter la prise en charge.
La classification des tumeurs du rein la plus utilisée en imagerie est celle de Bosniak. C’est une classification initialement tomodensitométrique. Elle a été introduite pour la première en 1986 et a depuis lors été à plusieurs reprises mise à jour, la dernière fois en 2005 (21,60).
Elle est basée sur différentes caractéristiques morphologiques des kystes : Epaisseur de la paroi
Présence de cloison
Présence de portion charnue Présence de nodule tissulaire Calcification de la paroi Calcification des cloisons Densité spontanée des kystes
24
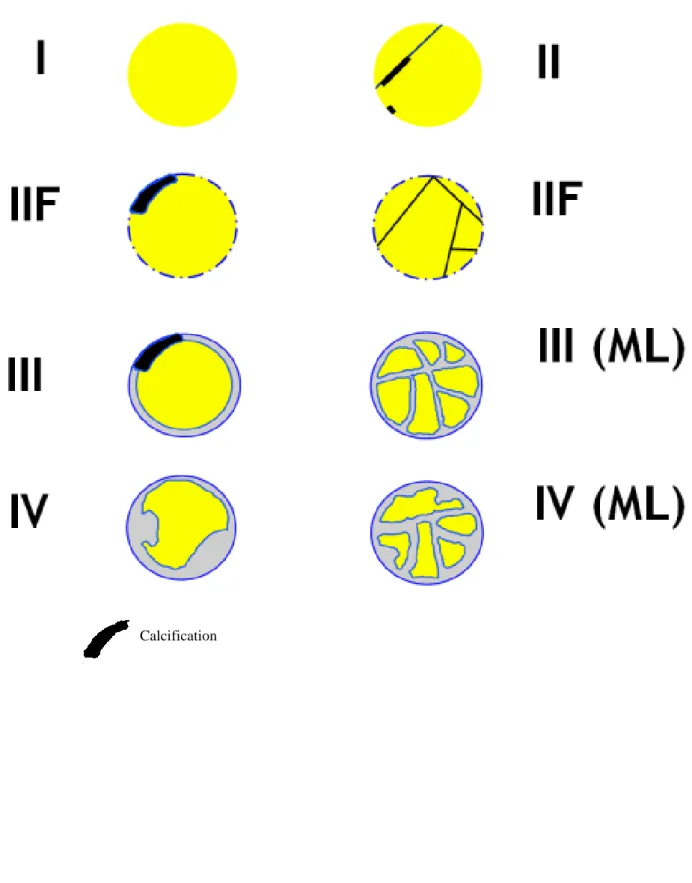
Initialement, elle utilisait quatre catégories, les types 1 et 2 correspondant à des kystes simples, le type 3 à des lésions kystiques indéterminées et le type 4 à des tumeurs kystiques typiquement malignes. En 1993, Bosniak a rapporté la difficulté de classer des lésions indéterminées, plus complexes que le type II, sans pour autant justifier d’être classées en type III (61). Une cinquième catégorie a été introduite en 1997, le type IIF – F pour follow-up (suivi) (62). C’est une catégorie intermédiaire entre les types II et III, intéressant des kystes discrètement plus complexes que le type II mais pas assez pour rentrer dans le type III.
Le but de la classification est de séparer les kystes chirurgicaux (types III et IV) des non chirurgicaux (types I, II et IIF).
Le tableau 2 reprend la dernière classification de Bosniak et les figures 3 à 5 illustrent les différents types de Bosniak.
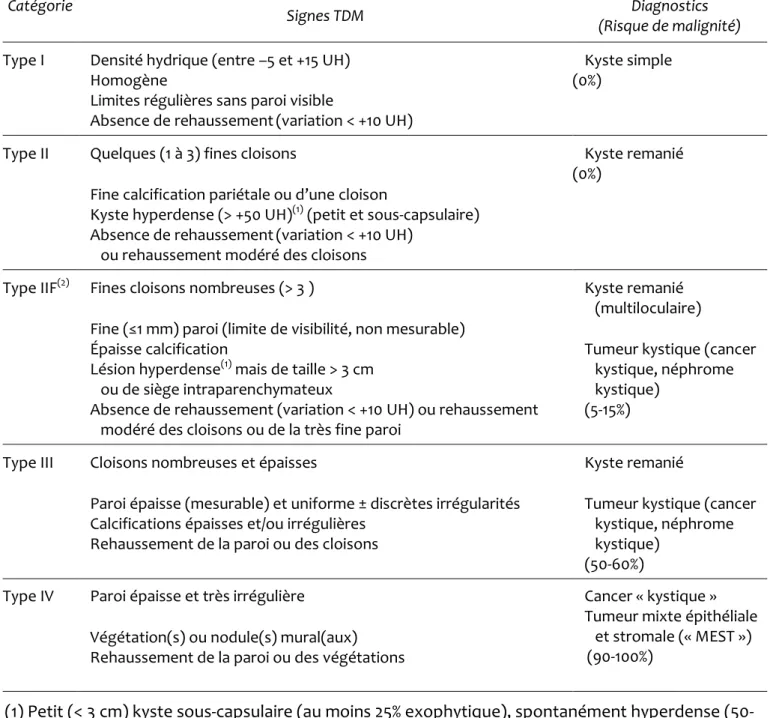
25 Tableau 1 : Classification TDM des tumeurs rénales kystiques d’après Bosniak (60)
Catégorie
Signes TDM Diagnostics
(Risque de malignité)
Type I Densité hydrique (entre –5 et +15 UH) Homogène
Limites régulières sans paroi visible
Absence de rehaussement(variation < +10 UH)
Kyste simple (0%)
Type II Quelques (1 à 3) fines cloisons
Fine calcification pariétale ou d’une cloison
Kyste hyperdense (> +50 UH)(1) (petit et sous-capsulaire) Absence de rehaussement(variation < +10 UH)
ou rehaussement modéré des cloisons
Kyste remanié (0%)
Type IIF(2) Fines cloisons nombreuses (> 3 )
Fine (≤1 mm) paroi (limite de visibilité, non mesurable) Épaisse calcification
Lésion hyperdense(1) mais de taille > 3 cm ou de siège intraparenchymateux
Absence de rehaussement (variation < +10 UH) ou rehaussement modéré des cloisons ou de la très fine paroi
Kyste remanié (multiloculaire)
Tumeur kystique (cancer kystique, néphrome kystique)
(5-15%)
Type III Cloisons nombreuses et épaisses
Paroi épaisse (mesurable) et uniforme ± discrètes irrégularités Calcifications épaisses et/ou irrégulières
Rehaussement de la paroi ou des cloisons
Kyste remanié
Tumeur kystique (cancer kystique, néphrome kystique)
(50-60%) Type IV Paroi épaisse et très irrégulière
Végétation(s) ou nodule(s) mural(aux) Rehaussement de la paroi ou des végétations
Cancer « kystique » Tumeur mixte épithéliale
et stromale (« MEST ») (90-100%)
(1) Petit (< 3 cm) kyste sous-capsulaire (au moins 25% exophytique), spontanément hyperdense (50-90 UH), homogène, aux limites régulières, non modifié après injection de contraste.
26 Figure 3 : Illustration de la classification de Bosniak
27
Figure 4 : Illustration de la classification de Bosniak des lésions kystiques rénales
a à h : coupes TDM axiales sans injection (a, e et g) et injectées au temps néphrographique (b, c, d, f et h). a et b : kyste simple, Bosniak I ; c : kyste Bosniak II, présentant trois fines cloisons, d : kyste Bosniak II, présentant une cloison fine finement calcifiée ; e et f : kyste Bosniak II, dense ; g et h : kyste Bosniak IIF, présentant une macro calcification sans rehaussement.
a b
c d
e f
28
Figure 5 : Illustration de la classification de Bosniak des lésions kystiques rénales
a, c, d, e et f : coupes TDM axiales injectées au temps néphrographique. a : kyste Bosniak IIF, présentant une paroi visible non mesurable, infra-millimétrique (flèches) ;b : coupe IRM axiale T1 injectée au temps néphrographique : kyste Bosniak IIF, présentant de multiples cloisons fines, c : kyste Bosniak III uniloculaire, présentant une paroi épaisse supra-millimétrique ; d : kyste Bosniak III multiloculaire, présentant une paroi et des cloisons épaisses supra-millimétriques ; e : kyste Bosniak IV, présentant une paroi épaisse et irrégulière ; f : kyste Bosniak IV, présentant un nodule mural tissulaire (flèche).
a b
c d
29
b) Malignité des lésions selon le type de Bosniak
Les lésions de type I sont des lésions typiquement bénignes et ne requièrent aucun suivi ou prise en charge. Hormis une lésion de type I maligne, possiblement en rapport avec une technique scanographique suboptimale, tous les kystes de type I rapportés étaient bénins (63). Les lésions de type II sont des lésions bénignes très peu complexes et ne requièrent aucun suivi et aucune prise en charge. Le risque de malignité pour les IIF varie entre 5 et 15% (64–67). Ce sont des lésions probablement bénignes mais nécessitant un suivi par imagerie. En cas de type III, le risque de malignité est plus élevé, entre 50 et 60% et le traitement recommandé est chirurgical (66–69). Le taux de malignité de la catégorie IV est proche de 100% et le traitement recommandé chirurgical.
Les deux séries les plus importantes ayant étudié la validité du système de Bosniak ont porté sur 70 et 82 lésions opérées (68,70). Elles ont obtenu des résultats globalement concordant, même si des divergences dans le pourcentage de lésions malignes existaient au sein des catégories II et IV. Siegel et al. en ont dénombré 1 parmi 8 lésions de type II (12%) et 26 parmi 29 de type IV (90%) contre 0 et 100% respectivement dans le cas de Curry et al. Cependant, environ la moitié des examens de l’étude de Siegel n’étaient pas techniquement adéquats, ce qui peut majorer le risque de mauvais classement, alors que l’étude de Curry avait suivi un protocole scanner rigoureux. Le taux de malignité parmi les types III était de 59% (68). Il a plus récemment été montré que l’introduction
30
de la catégorie IIF avait permis l’augmentation du taux de malignité dans la catégorie III (de 50 à plus de 80%) (65).
c) Difficultés de la classification de Bosniak (1) Technique rigoureuse
Outre la connaissance des différents critères, la justesse de classification nécessite un examen de bonne qualité, comportant au moins une phase sans injection et une phase néphrographique (68,71).
(2) Lésions infra-centimétriques
Elles sont exclues du système de Bosniak. La densité mesurée est peu fiable compte tenu de la petite taille, du bruit de fond, des phénomènes de durcissement de faisceau et des effets de volume partiel.
Dans la population générale à partir de 40 à 50 ans, un microkyste est hautement probable, surtout si la densité spontanée est plus faible que celle du cortex rénal adjacent (72,73). Aucune surveillance particulière n’est préconisée.
L’attitude est différente concernant l’adulte jeune ou au sein d’une population à risque de carcinome à cellules rénales (CCR traité ou synchrone ou facteur de susceptibilité génétique type VHL, BHD, forme familiale de cancer papillaire). On préconise une surveillance active ou un complément par IRM.
31
(3) Densité spontanée indéterminée
Le système de Bosniak considère les lésions de type I ou II de densité hydrique jusqu’à 15 UH et les kystes denses, de densité spontanée supérieure à 50 UH. Les lésions simples de densité intermédiaire entre 15 et 50 UH sont exclues de cette classification. Ces lésions peuvent correspondre à des kystes simples atypiques, à des kystes denses atypiques voire à des CCR solides particulièrement de type papillaire (74). On peut proposer une échographie ciblée avec au besoin l’injection de produit de contraste ultrasonore ou bien une IRM.
(4) Rehaussement indéterminé
L’absence de rehaussement correspond à une variation de densité inférieure à 10 UH. Un rehaussement positif correspond à une variation de densité d’au moins + 20 UH. Entre 10 et 20 UH, le rehaussement est indéterminé et la lésion inclassable. Il peut s’agir dans ce cadre d’un kyste simple avec phénomène de durcissement de faisceau, responsable d’une majoration artéfactuelle de la densité au sein du kyste, ou bien d’une tumeur solide hypovasculaire comme les CCR papillaires (74). On peut proposer une échographie ciblée avec au besoin l’injection de produit de contraste ultrasonore et en seconde intention une IRM.
32
(5) Type III avec rehaussement négatif
Devant l’absence de rehaussement de la paroi ou des cloisons, la lésion est inclassable. On peut proposer une IRM injectée ou une échographie avec injection de produit de contraste ultrasonore, plus sensible que le scanner dans la détection de cloisons ou d’un rehaussement par les microbulles.
(6) Les masses kystiques mal classées Masses de type IIF sous-classées
Devant une masse de type IIF, on peut réaliser une IRM en complément, qui la reclasse parfois en type III (75).
Masses sous-classées en IRM
Les tumeurs kystiques hémorragiques présentent un hypersignal T1 spontané lié aux produits de dégradation de l’hémoglobine, responsables d’artefacts de susceptibilité magnétique. Dans ces cas, le rehaussement d’une portion tissulaire peut être masqué. L’IRM est alors à confronter à la TDM. Les séquences T2, de diffusion ou d’injection dynamique de chélates de gadolinium avec soustraction peuvent alors présenter un intérêt (76).
Surveillance active d’une masse de type III
Une masse de type III peut dans certains contextes être surveillée, comme en cas d’âge avancé ou de risque chirurgical élevé. Dans cette situation, une évaluation par IRM peut être réalisée car elle est susceptible de reclasser une lésion de type III en type IV, ce qui pourrait modifier la prise en charge (75–78).
33
2. Néphrome kystique
C’est une tumeur kystique, correspondant classiquement à un type III de Bosniak. L’aspect du NK n’est pas spécifique et ne permet pas de le distinguer des autres tumeurs kystiques, notamment malignes.
Les séries les plus importantes s’intéressant aux résultats de l’imagerie des NK remontent aux années 1980 et décrivent surtout l’aspect en UIV et en échographie. Des études plus récentes d’effectif moindre ont étudié l’aspect tomodensitométrique. L’aspect en IRM se base sur des séries de quelques cas.
a) Echographie
L’aspect n’est pas spécifique. Elle est souvent réalisée en première intention chez l’enfant. Elle peut permettre d’affirmer l’origine rénale de la lésion. Typiquement, il s’agit d’une masse kystique comportant de multiples logettes anéchogènes séparées par de fines cloisons échogènes sans nodule tissulaire. Le NK peut apparaître échogène et tissulaire en cas composante microkystique responsable de nombreuses interfaces acoustiques (28,79). Une série de 18 cas a retrouvé un aspect kystique multiloculaire dans 17/18 (94%) des cas et une masse hypoéchogène dans 1/18 (6%) des cas. Un signal Doppler a été mis en évidence au sein d’une cloison dans un cas parmi les cinq tumeurs explorées par cette technique (80).
34
b) Tomodensitométrie
C’est la technique de choix dans l’exploration des masses kystiques.
Le NK se présente habituellement comme une lésion kystique complexe à limites nettes contenant de nombreuses logettes de taille variable et non communicantes séparées par des cloisons d’épaisseur variable. Une paroi épaisse et régulière est fréquente. Des calcifications de la paroi ou des cloisons peuvent être présentes.
La densité des logettes est le plus souvent liquidienne, pouvant varier selon le contenu plus ou moins protidique ou hémorragique. Le rehaussement des cloisons est faible ou absent (24,81).
Une série de 22 cas de NK retrouve 100% de lésions kystiques. Un type III de Bosniak est décrit dans 77% (17/22) des cas, un type IV dans 19% (4/22) des cas et un type II dans 4,5% (1/22) des cas (24). Une série de 18 cas de NK retrouve 100% de type III de Bosniak (80).
L’extension au système collecteur est habituelle et a été décrite dans 86% (19/22) des cas, au sein desquels une extension au pyélon a été décrite dans 22% (5/22 des cas (68).
c) IRM
35
On retrouve une lésion kystique multiloculaire encapsulée faite de logettes de signal liquidien en hypersignal T2. Le signal est plus variable en T1, selon le contenu liquidien, protidique ou hémorragique. La capsule et les cloisons apparaissent en hyposignal T2, se rehaussant modérément après administration intraveineuse d’un agent de contraste gadoliné (79,80,82–85).
d) La hernie pyélique
L’extension au pyélon est une caractéristique classique du néphrome kystique. Dans la série de Madewell et al., elle a été documentée par l’UIV, la pyélographie rétrograde ou sur la pièce opératoire chez 49% (25/51) des patients présentant un retard d’excrétion à l’UIV (26). Dans la série de Banner et al., un défaut de remplissage pyélique en faveur d’une protrusion pyélique a été mis en évidence sur l’UIV chez 3 des 13 patients (23%), et sur la pyélographie rétrograde chez 1 des 13 patients (8%), présentant un rein muet (25). Plusieurs cas de hernie pyélique ont par ailleurs été rapportés (28,79,86–94)
3. MEST
Les différents articles de la littérature s’intéressent surtout au versant anatomopathologique de la MEST. Il y a peu de données concernant l’aspect en imagerie. Un article de 1999 a étudié 22 cas rapportés de néphromes mésoblastiques de l’adulte et plusieurs cas et séries de cas de MEST sont disponibles (24,31,95–99). La modalité la mieux connue est le scanner. La
36
MEST peut revêtir différents aspects en fonction de la proportion de tissu solide qui la compose. Ainsi, on peut observer un spectre allant de lésions majoritairement kystiques, de type III de Bosniak à des lésions complètement solides, en passant par le type IV de Bosniak.
a) Echographie
Compte tenu de la rareté de la tumeur, l’aspect échographique est peu décrit. Park et al. ont rapporté un cas de MEST apparaissant comme une masse hétérogène hyperéchogène (97). Sahni et al. ont rapporté le cas d’une masse partiellement kystique bien limitée avec un nodule central.
b) Tomodensitométrie
C’est souvent l’examen de première intention de l’exploration d’une masse rénale. L’aspect habituel est celui d’une masse multiloculaire complexe bien limitée ayant une proportion variable de ses composantes kystique et tissulaire et présentant un rehaussement hétérogène et tardif après injection (96,97,99,100). Des séries de cas plus récentes retrouvent une tumeur majoritairement kystique dans 68% (23/34) des cas, majoritairement solide dans 32% (11/34) des cas avec parmi les tumeurs kystiques, 74% (17/23) de type III de Bosniak et 26% (6/23) de type IV (24,95–100). Une présentation majoritairement graisseuse est possible (99). Comme pour le NK, des cas de hernie à développement endo-pyélique ou endo-urétéral sont rapportés (96,99,101,102).
37
c) IRM
Les cas rapportés sont rares. On retrouve comme au scanner une tumeur mixte et complexe de rehaussement hétérogène et modéré après injection pour sa portion tissulaire. La composante kystique est de signal élevé en T2, variable en T1 selon le contenu. Un cas de néphrome mésoblastique de l’adulte a retrouvé une masse tissulaire en hyposignal T1 et T2 hétérogène, avec une petite portion kystique de signal liquidien (103). La portion tissulaire a été rapportée en hyposignal T2 dans deux autres cas, possiblement en rapport avec la composante stromale (96,97).
38
III. MATERIEL ET METHODES
A.
Données cliniques et anatomo-pathologiques
Nous avons recherché rétrospectivement au sein de la base de données du laboratoire d’anatomo-pathologie de notre institution l’ensemble des lésions pour lesquelles le diagnostic de néphrome kystique ou de MEST avait été porté entre le 01 janvier 2008 et le 31 décembre 2013. Cette recherche a permis d’identifier 20 patients opérés au sein des services d’urologie et de chirurgie pédiatrique de notre institution. Les données d’état civil et cliniques ont été obtenues à partir des comptes rendus radiologiques, anatomo-pathologiques et du dossier patient. Le type de chirurgie, l’aspect macroscopique et microscopique, le diagnostic de certitude et la présence d’éventuels critères de malignité ont été étudiés à partir du résultat d’anatomo-pathologie revu par un praticien uro-pathologiste (VV).
B.
Technique d’imagerie
Les différents examens ont été revus à partir du serveur d’imagerie de notre institution (PACS Carestream, Carestream Health, Rochester, New-York).
Les scanners ont été réalisés sur différents appareils, comportant 4 à 64 barrettes, principalement un 64 barrettes Lightspeed VCT (General Electric Systems, Milwaukee, Wisconsin) et un 4 barrettes Philips Mx8000 (Philips Medical Systems, Best, Pays-Bas). L’exploration a été faite en mode hélicoïdal, en coupes fines chevauchées avec reconstruction en coupes de 1,5 à 3 mm
39
d’épaisseur, en filtre mou. Il a dans un premier temps été réalisé un passage sans injection de produit de contraste dans la totalité des cas. Un passage portal ou néphrographique (entre 70 et 120 secondes) après injection d’un produit de contraste iodé à 300 ou 350 mg d’iode par mL (100 à 150 mL à un débit de 1,5 à 3 mL par seconde) a été réalisé chez tous les patients à l’exception d’un seul, chez qui seul un temps cortico-médullaire (40 secondes) était disponible. Des passages cortico-médullaire et tardif excrétoire ont le plus souvent été réalisés chez les autres.
Les IRM ont toutes été réalisées avec un aimant de 1,5 Tesla. La plupart l’ont été avec un aimant 1,5 Tesla Signa ou Discovery MR450 (General Electric Systems, Milwaukee, Wisconsin) à l’aide d’une antenne de surface multiéléments. L’exploration des reins était faite dans les plans axial et coronal en T1 et T2. Des séquences T1 avec saturation de la graisse, multiphasiques, en écho de gradient après injection de chélates de gadolinium (acide gadotérique à 0,5 mmol/ml à la dose de 0,2 mmol/kg) ont été réalisées chez tous les patients à l’exception d’un qui avait été exploré au préalable par un scanner multiphasique injecté.
Six patients (7 lésions) ont été explorés par échographie avec injection de produit de contraste ultrasonore (ECUS). Elles ont été réalisées avec un appareil Toshiba Aplio XG ou 500 (Toshiba, Otawa, Japon), utilisant une sonde de fréquence intermédiaire curvilinéaire (PVT-375BT) en mode B, composite et
40
composite non linéaire, à bas index mécanique (0,07), après injection de 2,4 mL de SonoVue (Bracco, Constance, Allemagne). Des boucles vidéo ont été enregistrées et stockées sur PACS pour analyse différée.
C.
Population étudiée
Vingt patients (15 femmes (75%) et 5 hommes (25%), soit un ratio F/H à 3/1) comportant 21 lésions (20 NK et 1 MEST) ont été analysés. L’âge des patients était compris entre 11 mois et 80 ans, soit une moyenne de 43,8 ans. Deux patients étaient d’âge pédiatrique, un garçon de 4 ans et une fille de 11 mois. La population adulte était composée de 18 patients (14 femmes (78%) et 4 hommes (22%), soit un ratio F/H à 3,5/1). L’âge de cette population allait de 21 à 80 ans, soit une moyenne de 48,4 ans.
Parmi les 21 tumeurs, 18 ont été explorées par TDM, dont 10 par TDM seule. 11 lésions l’ont été par IRM, dont 3 par IRM seule. Huit lésions ont été explorées à la fois par TDM et IRM. Sept lésions ont été explorées par ECUS, 4 en complément de l’IRM et de la TDM, 2 en complément de la TDM seule et 1 en complément de l’IRM seule.
Les données ont été recueillies sur une période de 6 ans (2008-2013). Les différents examens radiologiques ont été réalisés dans différents centres mais principalement au CHU Necker - Enfants Malades (Paris).
41
D.
Relecture des examens
Chaque examen a bénéficié d’une double lecture par un radiologue junior (GB) et un radiologue sénior spécialisé en imagerie urologique (DE). En cas de discordance, un consensus était atteint après avis d’un second radiologue expert en imagerie urologique (OH).
E.
Critères évalués en imagerie
Que ce soit en IRM ou en TDM, les critères suivants ont été recherchés : le nombre de lésions, le siège de la tumeur, sa taille, sa nature kystique ou tissulaire, le nombre, l’épaisseur et la régularité des parois et/ou cloisons, la densité sans et après injection (ou l’intensité aux différentes pondérations sans et après injection), la présence de graisse, de nécrose, de calcification, les rapports avec le système collecteur et les signes évocateurs de malignité (envahissement vasculaire ou de la graisse péri-rénale ou adénopathie).
En échographie de contraste, ont été analysés la nature kystique ou tissulaire, l’échogénicité, le nombre, l’épaisseur et la régularité des parois et/ou cloisons et le rehaussement après injection.
Dans les trois modalités, le type de Bosniak était déterminé selon la classification éponyme (21,60).
En cas de lésion kystique complexe, celle-ci était classée en type II si elle présentait une paroi non visible et jusqu’à trois fines cloisons perceptibles et
42
régulières d’épaisseur non mesurable. Elle était classée en type IIF si elle présentait soit une paroi visible non mesurable (infra-millimétrique), soit un minimum de 4 fines cloisons perceptibles, soit une combinaison de ces deux différents critères. Elle était classée en type III si elle présentait soit une paroi épaisse mesurable (supra-millimétrique) mais régulière, soit des cloisons épaisses mesurables (supra-millimétriques) mais régulières, soit une combinaison de ces deux critères. Elle était classée en type IV en cas de paroi ou cloison épaisse et irrégulière ou en cas de végétation intra-kystique ou de nodule mural.
Concernant l’imagerie en coupes, en cas d’exploration par TDM et par IRM, le type de Bosniak le plus élevé était retenu.
43
IV. RESULTATS
A.
Clinique et anatomo-pathologie
La découverte de ces tumeurs rénales a été fortuite dans la majorité des cas, parfois devant une douleur lombaire ou une hématurie.
Quatorze patients ont été opérés d’une tumorectomie, un d’une néphrectomie partielle, quatre d’une néphrectomie totale dont une néphrectomie d’hémostase, un d’une néphrectomie élargie pour carcinome à cellules claires ipsilatéral et un d’une urétéro-néphrectomie devant la suspicion d’une tumeur urothéliale.
Vingt-et-une TMME ont été évaluées chez 20 patients. Treize lésions (62%) étaient situés à gauche, 8 (38%) à droite. Un homme présentait deux lésions du rein gauche. Sept lésions étaient développées au pôle supérieur du rein, 11 à son tiers moyen et 3 à son pôle inférieur. Toutes les lésions avaient des limites nettes. Leur grand axe variait de 19 à 153 mm de grand axe, pour une moyenne à 72 mm et une médiane à 76 mm. Dans deux cas, la tumeur prenait l’aspect d’une volumineuse hernie à développement endo-pyélique (Figure 6).
Les NK prenaient l’aspect de lésions kystiques multiloculaires encapsulées à paroi et cloisons plus ou moins fines, présentant un épithélium plat, cubo-cylindrique ou en clous de tapissier et un stroma plus ou moins cellulaire dans certains cas pseudo ovarien (Figure 1).
44
Figure 6 : NK avec hernie endo-pyélique
a, b, c : coupes TDM coronales et axiale injectées au temps tardif : masse kystique polaire supérieure faisant hernie dans le pyélon (flèches blanches) ; d : pièce de néphrectomie correspondante : masse kystique multiloculaire à paroi interne lisse de la jonction des tiers moyen et supérieur, faisant hernie dans le pyélon (flèche noire).
b a
c
45
La MEST présentait plusieurs kystes de taille variable bordés d’un revêtement aplati, cubo-cylindrique ou en clous de tapissier, avec entre les kystes un abondant stroma plus ou moins cellulaire prenant un aspect pseudo ovarien, dans lequel étaient présents des tubules ou microkystes (Figure 2).
Aucune atypie cytonucléaire ou mitose n’était présente.
B.
Imagerie
1. TDM et IRM
Toutes les lésions, y compris la MEST, étaient encapsulées avec des limites nettes et étaient de nature kystique. Quatorze des 21 lésions (67%) correspondaient à des lésions multiloculaires de type III de Bosniak (Figure 7), 6/21 (29%) à des types IIF de Bosniak et 1/21 (5%) à un type II de Bosniak. Aucune lésion ne correspondait à un type IV de Bosniak. Cinq lésions (3 Bosniak IIF et 2 Bosniak III) présentaient des calcifications de leur paroi ou de cloisons, de morphologie variable. Toutes les lésions kystiques présentaient un rehaussement visible et modéré de leur paroi et/ou de leurs cloisons, hormis la lésion kystique Bosniak II. En cas de paroi ou cloisons épaisses, celles-ci apparaissaient hypointenses en T2. Cinq lésions parmi les 21 (24%) présentaient des logettes hyperdenses ou hyperintenses en T1. Aucune lésion ne comportait de graisse ou de nécrose.
46
Figure 7 : NK classé Bosniak III
Tumeur kystique multiloculaire à paroi épaisse et régulière (flèches blanches) contenant de multiples fines cloisons régulières se rehaussant. a : coupe TDM axiale au temps néphrographique ; b : coupe IRM axiale T1 fat sat injectée au temps néphrographique ; c et d : coupes IRM axiale et coronale T2 fat sat ; e : pièce macroscopique correspondante : tumeur multiloculaire encapsulée contenant des cloisons fines délimitant des logettes de taille variable allant jusqu’à 2 cm.
a
b
c e
47
Dix-huit lésions parmi les 21 (86%) venaient au contact ou se développaient dans le sinus du rein. Dans trois cas, la tumeur faisait hernie dans le système collecteur, prenant dans deux cas l’aspect d’une volumineuse hernie à développement endo-pyélique (Figure 6).
Les caractéristiques détaillées de l’aspect en imagerie en coupes sont résumées dans le tableau 3. La MEST est la lésion 21 (Figure 8).
Dans aucun cas n’a été constaté d’envahissement du pédicule vasculaire ou de la graisse ou d’adénomégalie loco-régionale.
48
Tableau 2 : Caractéristiques morphologiques et aspect en imagerie en coupes détaillés pour chaque TMME
P ati ent L és ions Age ( anné es ) Gr and axe ( mm ) C ôté E pa is se ur pa roi (mm ) P rot rus ion sinus ale Nombr e de c loi sons E pa is se ur c loi sons C alcif ica ti ons de la pa roi ou de s cloi sons De ns it é ou signal de s logettes ( UH ) De ns it é ou signal kys ti que unique 2nde c ompos ante : de ns it é (UH ) ou signal T ype de B os niak 1 1 38 75 G 3 N 4 à 10 F N Hyd O 3 2 2 41 92 G <1 N 4 à 10 F F+G Hyd O 2F 3 3 19 85 G 3 N >10 F N Hyd O 3 4 4 56 28 D 0 N 4 à 10 F F/L 20 O 2F 5 5 59 79 G 0 N >10 E M N Hyd O 3 6 6 4 90 D 2 N >10 E M P Hyd O 3 7 7 28 44 G 0 N 4 F N Hyd N HT1, HT2 2F 8 28 49 G <1 N 4 à 10 F N Hyd O 2F 8 9 39 77 G 2 N >10 F N Hyd O 3 9 10 57 89 G <1 N >10 E N M G Hyd N 44 2F 10 11 56 46 D <1 O 4 à 10 E N M N Hyd O 3 11 12 0 ,7 111 G 2 O >10 E M N Hyd O 3 12 13 79 57 G <1 N >10 E N M P Hyd N 57 3 13 14 19 24 G 0 N 2 F N Hyd O 2 14 15 45 74 G 2 N 4 à 10 F N Hyd O 3 15 16 59 107 D <1 O >10 F N Hyd O 3 16 17 50 19 D 0 N 4 à 10 F N Hyd O 2F 17 18 61 53 D 2 N >10 F N Hyd N HT2, HT1 3 18 19 60 85 G 4 N >10 E M N Hyd O 3 19 20 47 153 D 3 N >10 E M N Hyd O 3 20 21 46 30 D 2 N >10 E M N Hyd O 3
49
Figure 8 : Cas de MEST
a : coupe TDM axiale au temps portal : masse kystique à paroi infra millimétrique et multiples cloisons fines et régulières se rehaussant, classée Bosniak IIF ; b, c, d : coupes IRM axiale T1 fat sat injectée au temps néphrographique, axiale T2 fat sat et coronale T1 fat sat injectée au temps néphrographique : lésion kystique multiloculaire à paroi et cloisons épaisses et régulières se rehaussant, classée Bosniak III ; e : pièce macroscopique correspondante : tumeur faite de plusieurs logettes kystiques à paroi lisse comportant des secteurs solides plus ou moins abondants, blanchâtres.
c
b a
d
50
2. Comparaison TDM/IRM
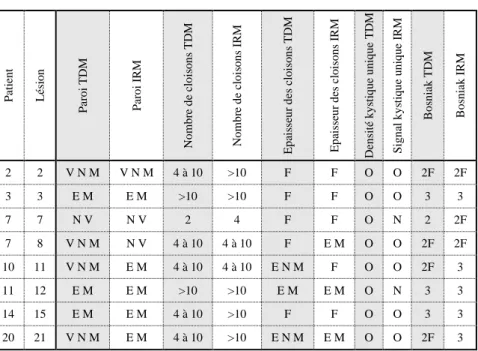
Huit lésions ont été explorées à la fois par IRM et par TDM (Tableau 4). Dans 3 cas sur 8, elles ont été reclassées dans une catégorie supérieure en IRM. Une lésion est passée de II à IIF du fait de cloisons plus nombreuses en IRM. Deux lésions sont passées de IIF à III en raison d’une paroi épaisse et mesurable dans un cas et de cloisons épaisses et mesurables dans l’autre (Figures 8 et 9).
Tableau 3 : Comparaison du type de Bosniak entre IRM et TDM
P at ie n t Lé si o n P ar o i TD M P ar o i IR M N o mb re d e cl o is o n s T D M N o mb re d e cl o is o n s IR M Ep ai sse u r d es c lo iso n s TD M Ep ai sse u r d es c lo iso n s I R M D en si té k y st iq u e u n iq u e TD M S ig n al k y st iq u e u n iq u e IR M B o sn ia k TD M B o sn ia k I R M 2 2 V N M V N M 4 à 10 >10 F F O O 2F 2F 3 3 E M E M >10 >10 F F O O 3 3 7 7 N V N V 2 4 F F O N 2 2F 7 8 V N M N V 4 à 10 4 à 10 F E M O O 2F 2F 10 11 V N M E M 4 à 10 4 à 10 E N M F O O 2F 3 11 12 E M E M >10 >10 E M E M O N 3 3 14 15 E M E M 4 à 10 >10 F F O O 3 3 20 21 V N M E M 4 à 10 >10 E N M E M O O 2F 3
N V : non visible, V N M : visible non mesurable, E M : épaisse et mesurable, F : fine, E N M : épaisse non mesurable, O : oui, N : non.
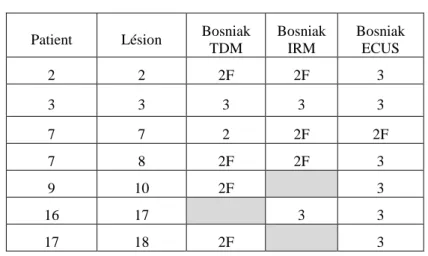
3. Echographie de contraste
Sept lésions ont été explorées par ECUS (Tableau 5). Dans 4 cas sur 7, l’ECUS suggérait un reclassement dans une catégorie supérieure de Bosniak, passant de Bosniak IIF à Bosniak III.
51
Figure 9 : NK reclassé par l’IRM
a : coupe TDM axiale injectée au temps néphrographique : masse kystique multiloculaire à paroi et cloisons visibles infra millimétriques se rehaussant, classée Bosniak IIF ; b, c, d : coupes IRM axiales T1 fat sat injectée au temps néphrographique et axiale et coronale T2 : masse kystique multiloculaire à paroi et cloisons épaisses se rehaussant, reclassée Bosniak III.
c a
52
Une lésion kystique à paroi fine contenant plusieurs fines cloisons sans prise de contraste objectivable orientait vers un type IIF de Bosniak alors qu’une lésion kystique à paroi et multiples cloisons régulières se rehaussant orientait vers un type III. Dans 3 cas sur 7, elle était en accord avec l’imagerie en coupes (en comparant avec la catégorie la plus élevée dans le système de Bosniak).
Tableau 4 : Comparaison de l’ECUS à l’imagerie en coupes
Patient Lésion Bosniak TDM Bosniak IRM Bosniak ECUS 2 2 2F 2F 3 3 3 3 3 3 7 7 2 2F 2F 7 8 2F 2F 3 9 10 2F 3 16 17 3 3 17 18 2F 3 4. Suivi
Deux patients ont été suivis pendant 3 et 6 ans avant d’être opérés. Dans un cas, la lésion initialement IIF a été perdue de vue pendant 6 ans et a vu sa taille et son type de Bosniak se majorer passant de 45 à 79 mm et de IIF à III (Figure 10). L’autre lésion avait été surveillée pendant trois ans avant d’être adressée à notre institution. Elle est restée stable en catégorie III mais sa taille avait progressé de 97 à 153 mm après 3 ans.
53
Figure 10 : Majoration de la taille et de la complexité d’un NK au cours du suivi
a, b : coupes TDM axiale et sagittale injectées au temps néphrographique et tardif : masse kystique multiloculaire à paroi et cloisons visibles infra millimétriques se rehaussant, classée Bosniak IIF ; c, d : TDM réalisée 6 ans plus tard, coupes axiale et coronale injectées au temps tardif : masse kystique plus volumineuse, multiloculaire à paroi épaisse et cloisons fines et régulières, plus nombreuses, classée Bosniak III ; e : pièce macroscopique correspondante : lésion kystique multiloculaire à parois fines.
d b
c a
54
5. MEST
Il s’agissait d’une lésion kystique à limites nettes de 3 cm. En TDM, elle présentait une paroi visible non mesurable et des cloisons fines modérément rehaussées la faisant classer en type IIF. Elle a été reclassée suite à l’IRM en type III, devant une paroi et des cloisons épaisses et régulières (Figure 8). Il n’y avait pas de graisse ou de calcification.
55
V.
DISCUSSION
Les TMME représentent moins de 1% des tumeurs rénales opérées dans notre institution sur cette période, fréquence en accord avec les données de la littérature (23,24).
Notre série reflète l’activité d’un centre spécialisé dans la chirurgie rénale, à forte orientation onco-urologique, et dans la chirurgie pédiatrique à forte orientation urologique. Nous avons retrouvé une distribution biphasique du NK, avec deux populations pédiatrique et adulte. Deux cas sont survenus chez des enfants avant 4 ans, âge habituellement rapporté (25,26). La population adulte avait une moyenne d’âge de 48 ans. Nous retrouvions une prédominance féminine avec un ratio femme/homme à 3,25/1, plus faible que le chiffre habituellement rapporté aux alentours de 8/1 (1,24). Un patient présentait deux NK, ce qui a déjà été rapporté pour les deux types de tumeur, dans notre cas sur le même rein (7,24). Nous rapportons un seul cas de MEST, représentant 5% des TMME, ce qui confirme la rareté ce cette tumeur.
Les NK étaient tous kystiques et majoritairement (65%) de type III de Bosniak (Figure 7), ce qui concorde avec l’aspect le plus fréquent (24,80). Nous avons retrouvé un type II et une proportion élevée (30%) de type IIF. La série de Lane et al. rapporte un cas de type II et aucun IIF (24). Un NK se présentant sous la forme d’un type IIF n’est pas à notre connaissance rapporté dans la littérature. Aucune lésion n’était de type IV, ce qui a été décrit précédemment (9,80).
56
Cependant, une série clinique récente retrouve jusqu’à 18% (4/22) de type IV parmi les NK (24). L’objectif principal de ce travail ne portait pas sur les résultats de l’imagerie des tumeurs, et les examens n’ont pas à notre connaissance fait l’objet d’une relecture avec utilisation rigoureuse du système de Bosniak, dont on connaît la variabilité inter opérateur (70).
La MEST prenait l’aspect d’un type IIF en scanner, reclassé ici en type III par l’IRM (Figure 8). Aucune MEST de type IIF en TDM n’a à notre connaissance été rapportée dans la littérature. L’aspect habituellement rapporté varie de la tumeur kystique de type III de Bosniak à la tumeur solide en passant par différentes proportions des tissus kystique et solide (24,99).
Dans 3 cas parmi les 8 lésions explorées à la fois par IRM et par TDM, l’IRM retrouvait une lésion plus complexe, la faisant reclasser en un type plus élevé dans le système de Bosniak, avec un impact sur la prise en charge (Figures 8 et 9). Le reclassement dans la catégorie supérieure (type III chirurgical d’emblée) était observé dans 2 cas parmi les lésions classées IIF en scanner. Ce résultat souligne l’intérêt de l’IRM dans le bilan initial des masses kystiques de complexité intermédiaire (75).
Dans 4 cas sur 7 explorés par ECUS, elle a amené à reclasser la lésion en un type plus élevé. Dans chaque cas, il s’agissait d’un type IIF en TDM ou en IRM, reclassé en type III. Aucune lésion reclassée ne correspondait à un type III en IRM. Si l’ECUS peut être utilisée efficacement dans la caractérisation de