ÉTUDES PROTÉOMIQUES DE L’INTERACTION ENTRE STREPTOMYCES
SCABIES ET LES TUBERCULES DE POMME DE TERRE OU LA SUBÉRINE
par
Lauriane Giroux
Thèse présentée au Département de biologie en vue de l’obtention du grade de docteur ès sciences (Ph.D.)
FACULTÉ DES SCIENCES UNIVERSITÉ DE SHERBROOKE
Le 4 février 2021
Le jury a accepté la thèse de Madame Lauriane Giroux dans sa version finale.
Membres du jury
Professeure Carole Beaulieu Directrice de recherche Département de biologie Université de Sherbrooke
Professeure Nathalie Beaudoin Codirectrice de recherche
Département de biologie Université de Sherbrooke
Docteure Claudia Goyer Évaluatrice externe
Agriculture et Agroalimentaire Canada
Professeur Peter Moffett Évaluateur interne Département de biologie Université de Sherbrooke
Professeur Sébastien Roy Président-rapporteur
REMERCIEMENTS
Je voudrais remercier ma directrice de recherche Pre Carole Beaulieu pour m’avoir accueillie dans son laboratoire pour la durée de mes études doctorales. Je tiens aussi à remercier ma codirectrice Pre Nathalie Beaudoin ainsi que mes conseillers Pr Peter Moffett et Pr Sébastien Roy pour leurs conseils durant mon doctorat. Je voudrais aussi remercier notre professionnel de recherche Sylvain Lerat pour son aide et ses conseils. Je tiens aussi à remercier mes collègues au laboratoire plus particulièrement Julien F-Guertin sans qui je me serais ennuyée grandement.
Je voudrais aussi remercier ma famille pour m’avoir soutenue tout au long de mes études universitaires. Merci Papa et Maman pour vos conseils et m’avoir écoutée me plaindre quand je trouvais que tout allait tout croche. Noémie, Renelle et Zacharie pour toutes vos stupides jokes sur le fait que j’étais étudiante et pauvre. Merci à mes deux petites amours Estelle et Bérangère pour toutes vos questions qui m’ont changé les idées quand je me sentais triste.
Merci à Gabriel St-Pierre-Lemieux pour tous les relectures et commentaires sur mes choses! Je voudrais remercier mes collègues au bureau, Fred, Dave, Martin, JS, Vincent et Charles. Merci d’avoir mangé tous les cupcakes et brownies que j’ai faits pour me détresser ou me défâcher!
Merci à Chantal et Mina au Centre Sève pour toutes les discussions et conseils que vous m’avez donnés. Merci à Yaseen pour toutes nos pauses thé/café durant son postdoc. Et plus particulièrement merci à Fatima, Iauhenia et Mina pour votre amitié durant ce doctorat. Jamais, je n’aurais pensé trouver d’aussi bonnes amies en commençant mon doctorat.
SOMMAIRE
La gale commune de la pomme de terre, une maladie esthétique qui se caractérise par la présence de lésions liégeuses au niveau du périderme, est causée par Streptomyces scabies. Le pouvoir pathogène de S. scabies est lié à la production d’une toxine, la thaxtomine A. Cette production de thaxtomine A est induite par la subérine et le cellobiose. La subérine est un biopolymère complexe constituée d’un domaine polyaromatique et d’un domaine polyaliphatique retrouvé dans le périderme de la pomme de terre. Il est connu que la subérine induit la production de glycosyl hydrolases et d’estérases ainsi que divers changements physiologiques et morphologiques chez S. scabies. L’objectif de cette thèse est de caractériser le protéome de S.
scabies durant ses interactions avec de la subérine de pomme de terre ou avec des tubercules de
pomme de terre.
Afin de déterminer si la présence de subérine est profitable à S. scabies dans une communauté bactérienne, une étude du sécrétome d’une communauté bactérienne du sol cultivée pendant 60 jours dans un milieu ayant comme seule source de carbone de la subérine a été effectuée. Cette étude nous a permis de confirmer la nature récalcitrante de ce substrat pour la communauté bactérienne. Cette étude a aussi permis détecter la présence d’une xylanase produite par S.
scabies ainsi que deux lipases appartenant à Myxococcus xanthus et Rhodanobacter thiooxydans
suggérant que ces bactéries peuvent croître en présence de subérine.
Dans une seconde partie, une étude du sécrétome de S. scabies, M. xanthus et R. thiooxydans en présence de subérine ou dans un milieu de culture riche a été effectuée afin d’évaluer si la présence de bactéries affectait la croissance et le sécrétome de S. scabies. Cette étude nous a permis de confirmer que S. scabies est très bien adapté à la subérine et qu’il résiste mieux à la prédation par M. xanthus en présence du substrat récalcitrant qu’en milieu riche, et ce à l’opposé de R. thiooxydans.
Dans une troisième partie, une étude du protéome intracellulaire de S. scabies souche 87-22 en présence et absence de subérine a été effectuée afin d’identifier les protéines de régulation qui sont produites par S. scabies en présence de subérine. Parmi les protéines produites figurait C9Z6I6, une protéine liant la gamma-butyrolactone. Une mutation du gène SCAB_12091 a été effectuée ainsi qu’une comparaison des protéomes entre ce mutant et la souche sauvage. Cette étude a permis de mettre en lumière le rôle de C9Z6I6 dans l’expression de différentes enzymes du métabolisme central tel que les enzymes impliquées dans la glycolyse, le métabolisme des lipides et la synthèse du NAD.
La quatrième et dernière partie avait pour but de faire parallèle entre les protéines produites par
S. scabies en présence de subérine et en présence de tubercules. Pour ce faire, une étude du
protéome intracellulaire de S. scabies en présence ou absence de microtubercules de pomme de terre produits in vitro a été effectuée. Cette étude a démontré que durant l’interaction entre
S. scabies et les microtubercules, les mécanismes liés à l’acquisition du fer étaient induits chez
la bactérie. Une compétition pour cet élément semble donc se faire entre la bactérie et la plante. Plusieurs protéines liées au stress oxydatif sont surproduites en présence de la plante ce qui suggère que la plante se défend de la colonisation de l’agent pathogène par la production de ROS. Des métabolites secondaires connus pour influencer le pouvoir pathogène, mais aussi d’autres de fonction inconnue apparaissent aussi jouer un rôle dans les interactions S. scabies-tubercules.
Les résultats présentés dans cette thèse démontrent que S. scabies est très bien adapté à la vie en présence de subérine. S. scabies fait partie des rares bactéries de la communauté bactérienne du sol à survivre lors d’une incubation prolongée en présence de subérine. Cet agent pathogène résiste mieux à la prédation dans un milieu contenant la subérine qu’en milieu riche au contraire d’une autre bactérie du sol. Cette adaptation de S. scabies est attribuable à des mécanismes divers dont la production de la protéine C9Z6I6, une protéine liant la gamma-butyrolactone. Parmi les protéines produites en présence de subérine, certaines le sont aussi en présence de
la biosynthèse de métabolites secondaires suggérant que les mécanismes d’adaptation à la subérine ont une importance durant la pathogenèse. Cette thèse a permis d’élucider plusieurs mécanismes d’adaptation bactérienne à la subérine, mécanismes qui semblent avoir une importance dans les interactions entre S. scabies et les autres bactéries du sol, mais aussi dans la vie saprophytique et parasitique de cet agent phytopathogène.
Mots clés : analyse protéomique, fer, gale commune, lipides, métabolites secondaires, microtubercule, Myxococcus xanthus, NADH, périderme, prédation, Rhodanobacter
TABLE DES MATIÈRES
CHAPITRE 1 INTRODUCTION ... 2
1.1 La pomme de terre ... 2
1.1.1. Importance et culture... 2
1.1.2. Plant de pommes de terre ... 3
1.2 Le tubercule ... 3
1.2.1. Structure générale et formation ... 3
1.2.2. Périderme ... 4 1.3 La subérine ... 6 1.3.1. Rôle et structure ... 6 1.3.1.1 Rôle ... 7 1.3.1.2 Structure ... 8 1.3.2. Biosynthèse ... 9 1.3.3. Dégradation ... 13 1.4 Streptomyces scabies ... 13
1.4.1. Facteurs de virulence de S. scabies ... 17
1.4.2. Phytotoxines ... 17 1.4.2.1 Thaxtomines ... 17 1.4.2.2 Concanamycine ... 20 1.4.2.3 Phytotoxines coronafacoyles ... 21 1.4.3. Enzymes de dégradation ... 22 1.4.4. Sidérophores ... 23
1.5 Importance de la subérine dans l’interaction entre S. scabies et la pomme de terre 24 1.5.1. Protection physicochimique ... 24
1.5.2. La subérine, source de carbone et d’énergie pour S. scabies ... 25
CHAPITRE 2 Analyses protéomiques de bactéries du sol cultivées en présence de subérine de
pomme de terre, un biopolymère récalcitrant ... 32
2.1 Sommaire ... 32
2.2 Manuscrit de l’article ... 34
2.2.1. Abstract ... 35
2.2.2. Introduction ... 36
2.2.3. Materials and Methods ... 37
2.2.3.1 Culture conditions ... 37 2.2.3.2 Proteomics analysis ... 39 2.2.3.3 Secretome analysis ... 39 2.2.3.4 Protein diversity ... 40 2.2.4. Results ... 40 2.2.5. Discussion ... 55 2.2.6. Acknowledgements... 59 2.2.7. References ... 60
CHAPITRE 3 Comparaison de la croissance et du sécrétome de Streptomyces scabies, Myxococcus xanthus et Rhodanobacter thiooxydans cultivés en culture pure ou coculture dans un milieu contenant de la subérine ... 115
3.1 Sommaire ... 115
3.2 Manuscrit de l’article ... 117
3.2.1. Abstract ... 117
3.2.2. Introduction ... 118
3.2.3. Materials and methods ... 120
3.2.3.1 Culture conditions ... 120
3.2.3.2 Bacterial growth estimation ... 120
3.2.3.3 Protein quantification ... 121
3.2.3.4 Secretome analysis ... 122
3.2.3.5 Scanning electron microscopy ... 123
3.2.4.2 Suberin colonization by S. scabies, M. xanthus and R. thiooxydans in a pure or a coculture ... 126 3.2.4.3 Secretome analysis ... 128 3.2.5. Discussion ... 139 3.2.6. Acknowledgements... 142 3.2.7. References ... 143
CHAPITRE 4 Rôle de la protéine putative de Liaison à la gamma-butyrolactone C9Z6I6 dans l’adaptation de streptomyces scabies 87-22 à la subérine de pomme de terre ... 221
4.1 Sommaire ... 221
4.2 Manuscrit de l’article ... 223
4.2.1. Abstract ... 223
4.2.2. Introduction ... 224
4.2.3. Materials and methods ... 226
4.2.3.1 Culture conditions ... 226
4.2.3.2 Deletion of SCAB_12091 from Streptomyces scabies 87-22 ... 227
4.2.3.3 qRT-PCR analysis ... 228
4.2.3.4 Intracellular soluble proteins extraction ... 229
4.2.3.5 Proteome analysis ... 229
4.2.3.6 NAD/NADH ratio determination ... 231
4.2.4. Results ... 231
4.2.4.1 Construction of a deletion mutant for the gene SCAB_12091 ... 231
4.2.4.2 Gamma-butyrolactone binding protein gene expression ... 233
4.2.4.3 Growth comparison between S. scabies 87-22 and ∆12091 in absence or presence of suberin ... 233
4.2.4.4 Analysis of S. scabies strains 87-22 and ∆12091 proteomes grown in presence or absence of suberin ... 234
4.2.4.5 NAD/NADH ratio ... 253
4.2.5. Discussion ... 253
CHAPITRE 5 Analyses protéomiques pour étudier le comportement de l’agent
phytopathogène Streptomyces scabies à son hôte, Solanum tuberosum ... 338
5.1 Sommaire ... 338
5.2 Manuscrit de l’article ... 340
5.2.1. Abstract ... 340
5.2.2. Introduction ... 341
5.2.3. Materials and methods ... 342
5.2.3.1 Bacterial growth conditions ... 342
5.2.3.2 Plant material and growth conditions ... 342
5.2.3.3 Intracellular soluble proteins extraction ... 343
5.2.3.4 Proteomic analysis ... 343
5.2.3.5 Determination of supernatant nitrite concentration ... 345
5.2.3.6 Iron and thaxtomin A quantification in culture supernatant ... 345
5.2.3.7 Gene expression ... 345
5.2.4. Results ... 347
5.2.4.1 Proteome analysis of S. scabies in presence of potato tubers ... 347
5.2.4.2 Nitrite production by S. scabies in the presence of tubers ... 359
5.2.4.3 ICP-MS analysis of iron content ... 359
5.2.4.4 Quantification of thaxtomin A production in presence of tubers ... 360
5.2.4.5 S. scabies gene expression in the presence of potato microtubers ... 361
5.2.5. Discussion ... 362
5.2.6. Acknowledgments ... 367
5.2.7. References ... 368
CHAPITRE 6 DISCUSSION ET CONCLUSION ... 450
LISTE DES TABLEAUX
Chapitre 2
Table 2.1. Abundance of predicted extracellular proteins (NSpC) within the diverse bacterial genera identified in suberin medium inoculated with potato field soil ... 42 Table 2.2. Rhodanobacter thiooxydans proteins involved in lipid metabolism
and ketogenesis found after 5 or 30 days of incubation ... 47 Table 2.3. Myxococcus xanthus proteins involved in lipid metabolism and
ketogenesis found after 5 or 25 days of incubation ... 50 Table 2.4. Putative suberin degradation and utilization pathways in
Rhodanobacter thiooxydans and Myxococcus xanthus ... 53 Table S2.1. Proteins with predicted extracellular localization produced by soil
bacterial community during growth in minimal medium supplemented with suberin, from 5 to 60 days ... 64 Table S2.2. Proteins produced by Rhodanobacter thiooxydans LCS2 during
growth in minimal medium supplemented with suberin at day 5 and day 30 ... 73 Table S2.3. Proteins produced by Myxococcus xanthus DK 1622 during growth
in minimal medium supplemented with suberin at day 5 and day 25 . 98 Chapitre 3
Table 3.1. List of the primers used in this study ... 121 Table 3.2. Number of proteins detected in suberin medium (day 10) and
tryptone medium (day 3) ... 130 Table 3.3. Total normalized spectral abundance factor (NSAF) percentage of
each function group in SM for either the pure or coculture for each bacterium ... 132
Table 3.4. Total NSAF percentage for each function group in CTT medium for either the pure or coculture for each bacterial species... 134 Table S3.1. All proteins found in suberin medium (day 10) and CTT medium
(day 3) for S. scabies EF-35 ... 147 Table S3.2. All proteins found in suberin medium (day 10) and CTT medium
(day 3) for M. xanthus ... 169 Table S3.3. All proteins found in suberin medium (day 10) and CTT medium
(day 3) for R. thiooxydans ... 189 Chapitre 4
Table 4.1. Primers used in this study ... 228 Table 4.2. Relative expression of genes SCAB_12081 and SCAB_12101 in S.
scabies strain ∆12091 compared to S. scabies strain 87-22 ... 233
Table 4.3. Distribution of S. scabies strains 87-22 and ∆12091 proteins within functional groups ... 237 Table 4.4. Proteins of S. scabies 87-22 negatively regulated by the putative
gamma-butyrolactone binding protein C9Z6I6 when the bacterium is grown in presence of suberin ... 243 Table 4.5. Proteins of S. scabies 87-22 positively regulated by the putative
gamma-butyrolactone binding protein C9Z6I6 when the bacterium is grown in presence of suberin ... 248 Table S4.1. Distribution of the proteins in control (CM) or suberin (SM) medium
for S. scabies strain 87-22 and ∆12091 ... 263 Chapitre 5
Table 5.1. List of primers used in this study ... 346 Table 5.2. Distribution of S. scabies strain EF-35 proteins within functional
groups depending on culture conditions. S. scabies were grown in MS-S medium supplemented or not with potato microtubers cv. Russet Burbank (RB) or Yukon Gold (YG) ... 349
Table 5.3. Proteins with an NSAF value twice higher in the presence of both potato cultivars than in a pure culture of S. scabies EF-35 ... 351 Table 5.4. Proteins with an NSAF value twice lower in the presence of both
potato cultivars than in a pure culture of S. scabies EF-35 ... 356 Table S5.1. S. scabies strain EF-35 proteins grown in MS-S medium as a pure
culture or supplemented with potato microtubers cv. Russet Burbank (RB) or Yukon Gold (YG) ... 372
LISTE DES FIGURES
Chapitre 1
Figure 1.1. Coupe transversale de pomme de terre transversale de pomme de
terre (adapté de Faridnia et al., 2015) ... 4 Figure 1.2. Représentation schématique du périderme de pomme de terre
adapté de Tyner et al. (1997) ... 5 Figure 1.3. Représentation de la subérine (Bernards, 2002) ... 6 Figure 1.4. Microscopie électronique à transmission du périderme de pomme
de terre ... 7 Figure 1.5. Vue d’ensemble représentant la biosynthèse de la subérine
(Vishwanath et al., 2015) ... 11 Figure 1.6. Vue d’ensemble de la synthèse du domaine polyaromatique de la
subérine à partir de la voie des phénylpropanoïdes (Valiñas et al.,
2015) ... 12 Figure 1.7. Tubercules de pomme de terre avec différents niveaux d’infection
à la gale commune (photo prise par Iauhenia Isayenka) ... 15 Figure 1.8. Cycle de vie et d’infection de S. scabies (Agrios, 2005) ... 16 Figure 1.9. Structure de la thaxtomine avec ses différents groupements (King
et Calhoun, 2009) ... 18 Figure 1.10. Disque de subérine après 1 an d’incubation sans (A) et avec
S. scabies (B) (Beaulieu et al., 2016) ... 26 Figure 11.1. Microscopie électronique à transmission de la subérine incubée
avec S. scabies entre 0 et 60 jours. ... 27 Chapitre 2
Figure 2.1. Functional diversity index and distribution into functional groups of predicted extracellular proteins produced by a soil bacterial
Figure 2.2. Growth curve of Rhodanobacter thiooxydans LCS2 (A) and
Myxococcus xanthus DK 1622 (B) in minimal medium
supplemented with suberin as sole source of carbon (squares) or not
supplemented (circles). ... 44 Figure 2.3. Functional diversity index and distribution into functional groups
of proteins produced by Rhodanobacter thiooxydans LCS2 (A) and
Myxococcus xanthus DK 1622 (B) grown in minimal medium
supplemented with suberin ... 46 Chapitre 3
Figure 3.1. Bacterial population estimated by quantifying the abundance of one specific gene for each bacterial species in SM (A) or CTT medium
(B). ... 125 Figure 3.2. Scanning electron microscopy of suberin exposed for 60 days to
either pure cultures of R. thiooxydans (A), M. xanthus (B), S.
scabies (C), or these three species in coculture (D). Non-inoculated
suberin control is shown (E). ... 127 Figure 3.3. Proteins production in supernatant for SM and CTT medium at 10-
and 3- days ... 128 Chapitre 4
Figure 4.1. Construction and verification of SCAB_12091 deletion mutant. .... 232 Figure 4.2. Growth comparison between S. scabies strains 87-22 and ∆12091
in both control (CM) and suberin (SM) media ... 234 Figure 4.3. Numbers of proteins produced in control (CM) or suberin (SM)
medium in S. scabies strains 87-22 and ∆12091. ... 235 Figure 4.4. Selection criteria used to determine proteins whose production
might be directly or indirectly regulated by C9Z6I6 in presence of
suberin ... 239 Figure 4.5. Main metabolic pathways regulated by C9Z6I6 when S. scabies is
Figure 4.6. NAD/NADH ratio in control (CM) and suberin (SM) medium after
3-day growth ... 253 Chapitre 5.
Figure 5.1. Numbers of S. scabies proteins detected in pure culture or when cultivated in the presence of Russet Burbank (RB) or Yukon Gold
(YG) microtubers ... 348 Figure 5.2. Iron content of culture supernatants. ... 360 Figure 5.3. Relative gene expression (+ standard deviation) S. scabies EF-35
genes in a culture medium containing potato microtubers cv. Russet Burbank (RB) or Yukon Gold (YG) compared to a medium without
LISTE DES ABRÉVIATIONS ET DES SIGLES % Pourcentage °C Degré Celsius Alpha Beta Gamma µg Microgramme µL Microlitre µM Micromolaire Oméga
CFA Acide coronafacique
CFU Colony-forming units (Unité formant des colonies)
CM Control medium Cm Centimètre
D Day (Jour)
Da Dalton
Df Function diversity (Diversité de fonction)
Dt Taxonomic diversity (Diversité taxonomique)
DNA Acide désoxyribonucléique DTT Dithiothréitol
EDTA Ethylenediaminetetraacetic acid EtOH Éthanol
FeSO4 Sulfate ferreux
G Gramme
GBL Gamma-butyrolactone
H2O2 Peroxyde d’hydrogène
HPCL High Performance Liquid Chromatography (Chromatographie en phase liquide à haute performance)
ICP-MS Inductively coupled plasma mass spectrometry (spectrométrie de masse à plasma à
couplage inductif)
K2HPO4 Phosphate dipotassique
kV Kilovolt
L Litre
m/z Mass-to-charge ratio (Rapport masse/charge)
Mg Milligramme
MgSO4 Sulfate de magnésium
mL Millilitre
Min Minute
Mm Millimètre mM Millimolaire
MS Mass spectrometry (Spectrométrie de masse)
MS-S Murashige-Skoog supplemented with starch (Murashige-Skoog supplémenté avec de
l’amidon)
MW Molecular weight (Poids moléculaire)
NaCl Chlorure de sodium
NAD Nicotinamide adenine dinucleotide
NADH Nicotinamide adenine dinucleotide forme réduite
nM Nanomolaire
NSAF Normalized spectral abundance factor (Facteur d’abondance spectral normalisé)
NSpC Normalized spectral count (Nombre de spectres normalisé)
Nt Nucleotide
O
-2 Ion superoxyde
PBS Phosphate buffered saline (Tampon phosphate)
pH Potentiel hydrogène
Ppm Partie par million
qPCR Quantitative polymerase chain reaction (Réaction en chaîne par polymérase
quantitative) RB Russet Burbank RPM Rotation par minute
RT-qPCR Real time quantitative polymerase chain reaction (Réaction en chaîne par
polymérase quantitative en temps réel)
S Seconde
SDS-PAGE Sodium dodecyl sulfate polyacrylamide gel electrophoresis
SM Suberin medium (Milieu subérine)
SpC Spectral count (Nombre de spectres)
V Volt
w/v Weight per volume (Poids par volume)
YG Yukon Gold
CHAPITRE 1 INTRODUCTION
1.1 La pomme de terre
La pomme de terre (Solanum tuberosum) est une plante appartenant à la famille des Solanacées, une famille qui comprend en autre la tomate, l’aubergine et le tabac. La pomme de terre est une vivace, mais en agriculture elle est utilisée comme une culture annuelle. Le terme fait aussi référence au tubercule de la plante qui est consommée un peu partout dans le monde.
1.1.1. Importance et culture
La pomme de terre représente une très bonne source de nutriments. En effet, il s’agit d’une bonne source de fer, de potassium, de phosphore, de glucides ainsi que de vitamines. De plus, la pomme de terre n’est pas seulement utilisée en alimentation, mais également dans la fabrication d’alcool, dans des préparations pharmaceutiques, de produits biodégradables ainsi que pour la production d’amidon.
En 2016, la production mondiale de pomme de terre se retrouvait au 5e rang après la canne à sucre, le maïs, le blé et le riz avec une production de 376 827 milliers de tonnes (FAO, 2018).
Au Canada, la culture de pomme de terre représente la culture légumière la plus importante représentant 1,28 milliard de dollars en 2018 (Agriculture et Agroalimentaire Canada, 2019). Elle est cultivée principalement pour le marché de la transformation (69 % de la culture), le marché frais (19 %) et pour la semence (12 %) (Agriculture et Agroalimentaire Canada, 2019).
1.1.2. Plant de pommes de terre
Le développement du plant de pommes de terre se fait à partir d’un tubercule. Le tubercule germe à partir de ses yeux. À partir de ces germes et des pousses, les tiges, le foliage, les stolons, les racines, l’inflorescence et la nouvelle génération de tubercule se développeront (Struik, 2007).
La partie aérienne du plant de pommes de terre comprend les tiges aériennes, les feuilles, les fleurs et les fruits. Les fleurs de pomme de terre varient en couleur allant de blanc jusqu’au mauve selon le cultivar. De plus, les fruits ressemblent à des cerises et contiennent plusieurs centaines de graines.
La partie souterraine du plant, quant à elle, est composée de racines, de stolons et de tubercules. Les tubercules sont des organes de réserves formées à partir des stolons et représentent la partie comestible du plant.
1.2 Le tubercule
1.2.1. Structure générale et formation
Le tubercule joue un rôle à la fois d’organe de réserve pour la plante, tel que mentionné précédemment, mais également d’un rôle pour la propagation de la plante.
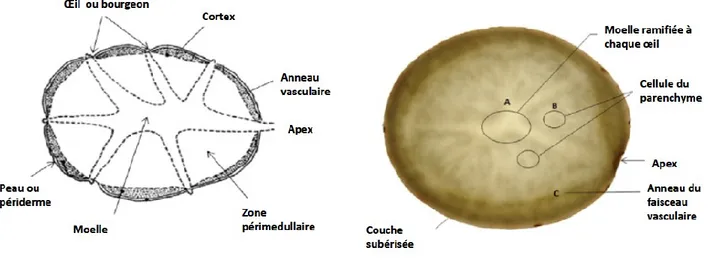
La figure 1 ci-dessous représente la coupe transversale d’un tubercule de pomme de terre (Faridnia et al., 2015). On retrouve sur celle-ci les différentes structures du tubercule soit les yeux, le cortex, l’anneau vasculaire, les cellules du parenchyme et le périderme.
Figure 1.1 Coupe transversale de pomme de terre (adapté de Faridnia et al., 2015) Le tubercule est formé à partir de l’élargissement du bout d’un stolon. La formation du tubercule peut être divisée en trois étapes soit l’initiation, l’élargissement et la maturation du tubercule (Hannapel, 2007).
L’initiation de la tubérisation correspond au premier gonflement du bout des stolons pour former les tubercules. Il est bien de mentionner que la photopériode joue un rôle important dans l’initiation de la tubérisation (Struik, 2007) et que la transition stolon-tubercule correspond à la régulation à la hausse des gènes liée à la biosynthèse d’amidon (Xu et al., 2011). L’expansion du tubercule représente sa croissance afin d’obtenir des tubercules de grosseur commercialisable tandis que la maturation correspond à la subérisation et à la diminution de son métabolisme afin d’entrer en phase de dormance (Struik, 2007).
1.2.2. Périderme
Le tubercule est recouvert par le périderme. Celui-ci est appelé peau ou pelure dans le langage courant. Le périderme, comme la cuticule, sert de couche de protection contre les différents stress abiotiques et biotiques auxquels la plante fait face.
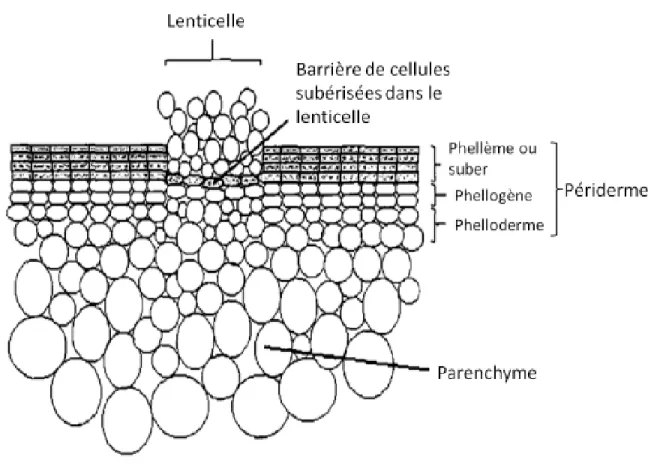
Le périderme est composé de trois types de tissus soit le phellème, le phellogène et le phelloderme (Reeve et al., 1969). Le phellème représente la couche extérieure du périderme et est formé à partir de la division des cellules du phellogène. Le phellogène donne aussi naissance au phelloderme qui se retrouve vers l’intérieur du tubercule. On retrouve aussi des lenticelles dans le périderme qui sont des ouvertures naturelles qui permettent des échanges avec l’environnement. À mesure que les cellules du phellème se développent, les parois vont se subériser formant ainsi la couche protectrice (Sabba and Lulai, 2002). Les cellules subérisées vont mourir, car le dépôt de subérine empêchera les échanges cellulaires. La figure 2 représente une schématisation du périderme.
Figure 1.2 Représentation schématique du périderme de pomme de terre adaptée de Tyner et al. (1997).
1.3 La subérine 1.3.1. Rôle et structure
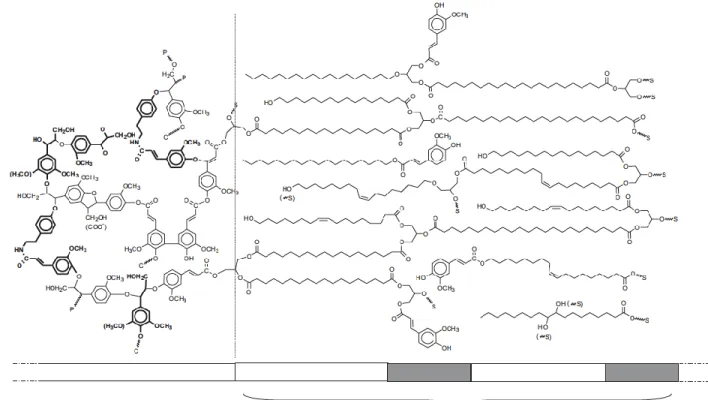
La subérine est un biopolymère composé d’un domaine polyaliphatique associé à un domaine polyaromatique lié de façon covalente (Figure 3). Les deux domaines sont distincts, mais coexistent dans les cellules subérisées (Bernards, 2002).
Figure 1.3 Représentation de la subérine (Bernards, 2002).
La subérine lorsque déposée dans les parois des cellules du phellème forme des lamelles. La figure suivante représente l’organisation en lamelle de la subérine dans le périderme de pomme de terre (Solanum tuberosum) (Figure 4).
Figure 1.4 Microscopie électronique à transmission du périderme de pomme de terre. PW : paroi cellulaire primaire SW : paroi cellulaire secondaire subérisée TW: paroi cellulaire tertiaire (Beaulieu et al., 2016)
1.3.1.1 Rôle
La subérine représente une barrière entre la plante et son environnement (Graça, 2015). Elle est retrouvée principalement dans le périderme des plantes (écorce d’arbre, pelure de tubercules), dans l’épiderme et l’hypoderme des racines ainsi que dans les cellules de la gaine du faisceau (Bernards, 2002; Graça and Santos, 2007). La subérine apparaît aussi suite à des blessures tant mécaniques que dues à des pathogènes (Schreiber et al., 2005).
La subérine joue un rôle dans la rétention d’eau, mais aussi pour la protection contre les attaques d’agents pathogènes. Son rôle pour la rétention d’eau est basé sur le fait que la subérisation des
l’eau du périderme (Bernards, 2002). Serra et al., (2010) ont aussi démontré que les tubercules de pomme de terre déficients pour l’enzyme FHT (enzyme codant pour une feruloyl transférase) avaient un périderme plus perméable.
Le rôle de protection contre les agents phytopathogènes est appuyé par les travaux de Lulai et Corsini (1998). Il a été démontré que la subérisation permettait la résistance à Erwina
caratovara subsp. carotova ainsi qu’à Fusarium sambucinum. Pour ce faire, Lulai et Corsini
ont suivi la déposition des domaines aliphatiques et aromatiques lors d’essai de cicatrisation sur du périderme de blessure. Ils ont donc pu démontrer que le domaine polyaromatique était responsable de la résistance à E. carotovara tandis que le domaine polyaliphatique permettait, quant à lui, la résistance à F. sambucinum (Lulai and Corsini, 1998).
1.3.1.2 Structure
La dépolymérisation de la subérine via des réactions telles que l’hydrolyse, l’alcoolyse ou l’hydrogénolyse a permis d’obtenir la composition des monomères aliphatiques composant la subérine (Graça and Santos, 2007). On retrouve principalement le glycérol, les alpha-oméga diacides à chaîne longue et les oméga-hydroxyacides à chaîne longue. Les alkanols et 1-alkanoic acide ont aussi été retrouvés en petite quantité (Graça and Santos, 2007). Ces composés seraient liés entre eux avec des liens esters soit des liens esters linéaires, des liens glycéryl ester et des liens féruloyl esters (Graça and Santos, 2007). Le domaine polyaliphatique de la subérine peut être comparé à la cutine. Ce domaine est composé principalement d’acide gras -hydroxy, d’acide ,-dicarboxylique, d’acide gras oxygéné en milieu de chaîne, d’acide gras non substitué ainsi que d’alcools gras primaires (Vishwanath et al., 2015).
Pour ce qui est du domaine polyaromatique, celui-ci se compare à la lignine. On retrouve des monolignols comme dans la lignine, mais aussi des acides hydroxycinnamiques tels que l’acide férulique ou ses conjugués (Ranathunge et al., 2011).
1.3.2. Biosynthèse
La biosynthèse de subérine n’est toujours pas totalement élucidée. Cependant, certaines étapes ont été établies à l’aide de méthodes biochimiques et moléculaires en plus des études faites sur la lignine et la cutine dues à la similarité de leur structure avec la subérine.
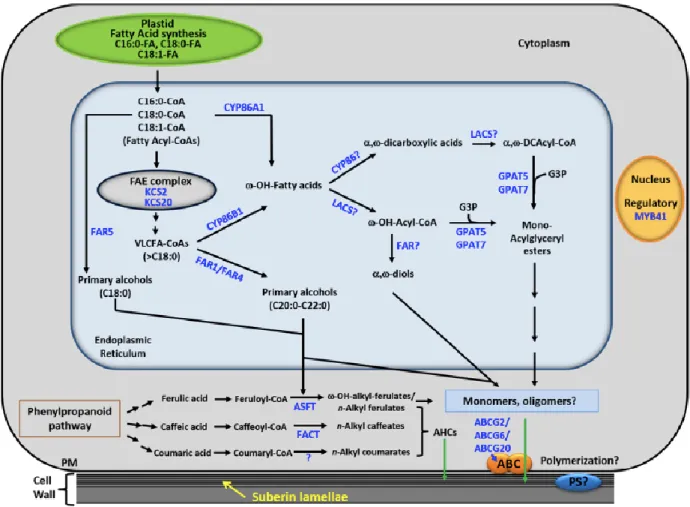
La biosynthèse de la subérine implique l’-hydroxylation d’acide gras ainsi que l’oxydation subséquente en ,-dicarboxylique acide, l’élongation des longues chaînes d’acide gras, l’activation des acides gras en acyl-CoA thioester gras, la réduction des chaînes acyles gras en alcools gras primaires, diverses acylations impliquant l’incorporation de glycérol et de composés phénoliques, et la polymérisation des monomères (Vishwanath et al., 2015). L’ordre dans lequel les réactions se font reste à déterminer.
La figure 5 représente une vue d’ensemble de la synthèse des monomères de subérine. La synthèse des acides gras a lieu dans les plastes, ce qui produit principalement des chaînes acyles 16 : 0 et 18 : 1 pouvant être par la suite exportées et modifiées dans le réticulum endoplasmique par différentes enzymes. L’élongation des chaînes acyles gras a lieu via le complexe FAE (fatty acyl elongation) ce qui permet de produire des acides gras à très longues chaînes à l’aide d’enzymes tels que les -ketoacyl-CoA synthases (KCS). Chez la pomme de terre, l’implication de StKCS6 (une - ketoacyl-CoA synthase qui est une enzyme de condensation du FAE) dans l’élongation des précurseurs de la subérine pour des chaînes de C28 ou plus longues a été démontrée (Serra et al., 2009).
La réduction des acyles se fait par les fatty acyle réductases (FAR) qui vont produire les alcools primaires ainsi que les ,-diols. L’oxydation des acyles gras se fait par des cytochromes P450 qui produisent les acides gras -hydroxy (-OH) et les ,-dicarboxyliques. Chez la pomme de terre, StCYP86A33, une -hydroxylase d’acide gras, est important pour la production de monomère -fonctionnel. En effet, lors d’essais pour l’extinction du gène (RNA silencing)
StCYP86A33, l’équipe de Serra et al (2009) obtenait une réduction significative des 18 : 1 acides
-hydroxy et d’acides ,- dicarboxylique chez le périderme du tubercule.
L’estérification des -OH et des acides ,-dicarboxyliques acide se fait par les glycérol-3-phosphate acyltransférases (GDAT) qui produiraient des sn-2 monoacylglycérol (Vishwanath et al., 2015). Les cytochromes P450 pourraient poursuivre l’oxydation des acides gras -hydroxy en acides ,- dicarboxyliques. L’activation des acides gras en acyl-CoA gras est faite par LACS (long-chain acyl-CoA synthetase). Les étapes de transport et de polymérisation des monomères de subérine sont encore à élucider. Cependant, des transporteurs ABC pourraient être impliqués dans le transport des monomères aliphatiques à travers la membrane plasmique. Des polyesters synthases pourraient jouer un rôle dans la production de polyester à poids moléculaire élevé en liant les sn-2 monoacylglycérols avec d’autres monomères.
Figure 1.5 Vue d’ensemble représentant la biosynthèse de la subérine (Vishwanath et al., 2015)
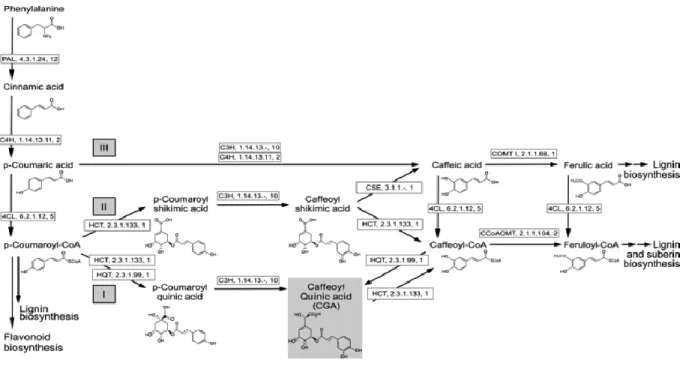
Les précurseurs de la partie aromatique de la subérine sont synthétisés à partir de la voie des phénylpropanoïdes qui a bien été étudiée dans le cadre de la biosynthèse de la lignine, mais qui est peu connue pour son rôle dans la synthèse de la subérine.
Le point d’entrée dans le métabolisme des phénylpropanoïdes est catalysé par la phénylalanine amonia-lyase (PAL) qui transforme la phénylalanine en p-coumaroyl-CoA, le précurseur de la voie des flavonoïdes donc de la synthèse de lignine (Valiñas et al., 2015). Le p-coumaroyl-CoA
différents précurseurs de la synthèse de subérine telle que l’acide caféique et l’acide férulique (Valiñas et al., 2015). La figure 6 représente les différentes étapes et enzymes impliqués dans le métabolisme des phénylpropanoïdes qui mènent à la biosynthèse de la partie polyphénolique de la subérine.
Figure 1.6 Vue d’ensemble de la synthèse du domaine polyaromatique de la subérine à partir de la voie des phénylpropanoïdes (Valiñas et al., 2015).
Les composés phénoliques produits sont par la suite transportés à la membrane plasmique (mécanisme inconnu à ce jour) et vont stimuler l’activité d’une NAD(P)H oxydase dépendante de la membrane plasmique (Bernards et al., 2004). Lorsque la quantité de composés phénoliques sera assez élevée, celle-ci induira la production de O
-2 et de H2O2, ce qui permettra la polymérisation des phénoliques grâce aux différentes peroxydases présentes (Bernards et al., 2004).
Les deux domaines de la subérine sont liés par trois types de liaisons, soit les liaisons au glycérol des acides gras à longues chaînes, l’estérification tête-à-queue de deux acides gras à longues chaînes et les liaisons hydroxy acide (Graça et al., 2015). Les liaisons férulate--hydroxy acide joueraient un rôle dans la liaison des deux domaines de la subérine. L’extinction du gène FHT codant pour une acyltranférase de la famille BAHD qui catalyse la formation de --hydroxy acide férulée, apporte des changements au niveau de la structure de la subérine (Serra et al., 2010).
1.3.3. Dégradation
La subérine représente un biopolymère récalcitrant. Malgré tout, sa dégradation a été répertoriée chez certains champignons tels que Fusarium, Apergillus nidulans, Coprinopsis cinerea et
Rosellinia desmazieresii (García-Lepe et al., 1997; Kontkanen et al., 2009; Ofong and Pearce,
1994). Par ailleurs, Beaulieu et al. (2016) ont démontré la capacité de dégradation de la subérine de Streptomyces scabies (discuté dans la section 1.5.2).
1.4 Streptomyces scabies
Les espèces du genre Streptomyces possèdent un cycle de vie complexe qui commence par la germination d’une spore. La spore forme un ou deux tubes germinatifs. Les tubes germinatifs poussent par croissance apicale afin de former le mycélium végétatif. Suite à différents stress, une différenciation morphologique se produit puis la production d’hyphes aériens est enclenchée et s’accompagne généralement de la production de métabolites secondaires. Les hyphes aériens doivent briser la tension de surface afin de croître dans l’air et éventuellement, les hyphes se fragmentent pour former les spores. Le métabolisme secondaire chez les Streptomyces correspond donc au développement des hyphes aériens (sur milieu solide) ou à la phase stationnaire (en milieu liquide) (Bibb, 2005). Plusieurs régulateurs pléiotropiques sont retrouvés chez les différentes espèces de Streptomyces ainsi que des régulateurs spécifiques à certains
métabolites tels que les antibiotiques étant donné que leur métabolisme secondaire est complexe et diversifié.
Parmi les régulateurs du métabolisme secondaire, on retrouve en autres les gènes bld, whi, et les gamma-butyrolactones. Les gènes bld sont des gènes impliqués dans la formation du mycélium aérien et sont nommés ainsi, car les mutants sont d’apparence chauve (bald) due à leur incapacité à former un mycélium aérien. Il a été démontré que les gènes bld ne sont pas seulement impliqués dans la formation du mycélium aérien, mais aussi dans la production d’antibiotiques et certains mutants semblent aussi influencer l’utilisation du carbone (Pope et al., 1996).
Les gènes whi sont impliqués dans la sporulation. Ils sont nommés ainsi dû à la couleur blanche des spores chez les mutants cependant les mutants whi sont capables d’ériger un mycélium aérien. Plusieurs gènes whi sont retrouvés et ils peuvent être divisés en 2 groupes selon le moment où ils sont retrouvés lors de la sporulation. Les gènes whiA, whiB, whiG, whiH, whiI et whiJ sont classés dans la phase précoce tandis que whiD, whiE, whiL, whiM et whiO sont impliqués dans la phase tardive de la sporulation (Chater, 2001).
En plus des gènes bld et whi, les gamma-butyrolactones ont été démontrées comme des régulateurs de la production d’antibiotiques et de la différenciation morphologique chez les
Streptomyces. Les gamma-butyrolactones sont des molécules de signalisation qui ressemblent
aux acylhomosérine lactones (AHL) des bactéries à Gram négatif à l’exception de la chaîne latérale de carbone (Takano, 2006).
Les systèmes de régulation par les gamma-butyrolactones sont retrouvés chez plusieurs espèces de Streptomyces. Il est possible de diviser les gamma-butyrolactones en trois groupes soit les virgina butanolide (possède un groupe - hydroxyle, identifié chez S. virginiae), les composés IM-2 like (-hydroxyle en position 6, identifié chez S. lavendulae) et les substances A-factor like (possède un 6-keto group, identifié chez S. griseus et S. coelicolor) (Rabyk et al.,
lié au métabolisme secondaire et à la différenciation morphologique chez S. griseus. Il est produit de façon dépendante de la croissance et il a été démontré qu’une concentration aussi faible que 10-9 M permettait au facteur A de déclencher la différenciation morphologique (Horinouchi and Beppu, 1992).
Très peu d’espèces pathogènes sont retrouvées chez les Streptomyces. Parmi celles-ci, on retrouve Streptomyces scabies, l’agent causal de la gale commune de la pomme de terre.
S. scabies est un agent phytopathogène retrouvé un peu partout dans le monde. En plus
d’infecter la pomme de terre, S. scabies peut aussi causer des symptômes de gale commune chez les plantes ayant des racines pivotantes telles que le radis, la betterave, les arachides (Bignell et al., 2010a). La gale commune est une maladie esthétique du tubercule de la pomme de terre qui n’affecte pas la santé humaine. La maladie est caractérisée par la présence de lésions plus ou moins subérisées à la surface du tubercule (Figure 7). Ses lésions peuvent être superficielles, surélevées ou profondes.
Figure 1.7 Tubercules de pomme de terre avec différents niveaux d’infection à la gale commune (photo prise par Iauhenia Isayenka)
Cette maladie engendre de lourdes pertes économiques au Canada qui étaient estimées en 2003 aux environs de 15 et 18 millions de dollars par an (Hill and Lazarovits, 2005).
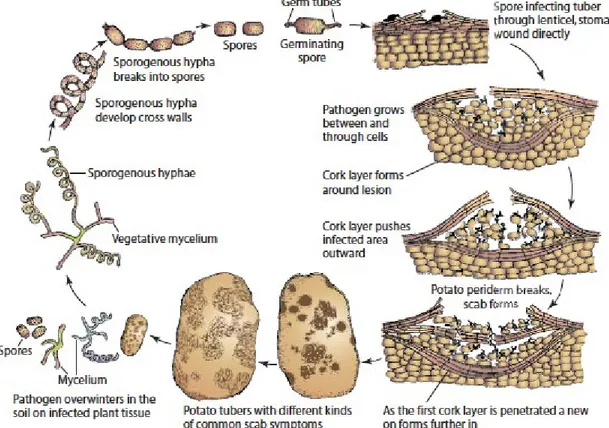
Figure 1.8 Cycle de vie et d’infection de S. scabies (Agrios, 2005)
S. scabies pénètre les tubercules en croissance via les lenticelles ou des blessures. La pénétration
directe du périderme a aussi été suggérée (Loria et al., 2003). Après la pénétration du tubercule,
S. scabies pousse dans les tissus du périderme. En réponse à l’infection, la plante va produire
rapidement plusieurs couches de cellules subérisées ce qui a pour effet de repousser les bactéries vers l’extérieur (Agrios, 2005). Les symptômes peuvent par la suite s’aggraver si les bactéries parviennent à pénétrer les nouvelles couches de cellules subérisées jusqu’à la récolte des tubercules. Grâce à sa capacité à sporuler, S. scabies peut donc survivre (automne et hiver) jusqu’à ce que les conditions soient favorables (printemps et été) pour infecter de nouveau les tubercules.
1.4.1. Facteurs de virulence de S. scabies
Le pouvoir pathogène de S. scabies est dû principalement à la production de toxines nommées thaxtomines. Cependant, S. scabies produit d’autres métabolites secondaires tels que la concanamycine et les phytotoxines coronafacoyles. Des protéines sont aussi probablement impliquées dans le pouvoir pathogène de S. scabies dont la protéine Nec1 (protéine avec activité nécrotique), une tomatinase TomA et la toxine scabin. Les protéines Nec1 et TomA jouent vraisemblablement un rôle dans le processus d’infection en inhibant les défenses de la plante (Joshi et al., 2007a; Seipke and Loria, 2008). La toxine scabin fait partie des mono-ADP-ribosyltransférases, mais son rôle dans la virulence de S. scabies reste à être élucidé. En plus de ses toxines, S. scabies possède différentes protéines de dégradation pouvant être impliquées dans sa virulence.
1.4.2. Phytotoxines 1.4.2.1 Thaxtomines
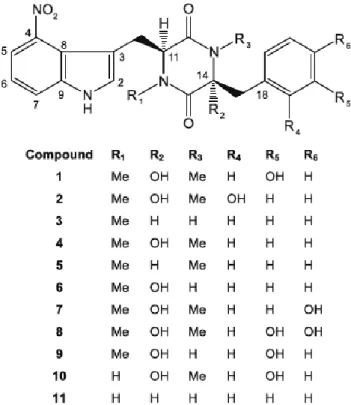
Les thaxtomines sont des dipeptides cycliques (2,5-diketopiperazines) dérivés d’acide aminé, soit le L-phénylalanine et le L-tryptophane qui contient un résidu nitroindole. Elles ont été isolées pour la première fois de tranches de pomme de terre infectées par S. scabies (King et al., 1989). Il existe plusieurs formes de thaxtomine. Parmi celles-ci, la thaxtomine A représente la forme principale (King and Calhoun, 2009). Les différentes formes diffèrent dans les groupements retrouvés sur le squelette principal (Fig. 9).
Figure 1.9 Structure de la thaxtomine avec ses différents groupements (King et Calhoun, 2009)
La production de thaxtomine a été démontrée comme étant essentielle à la virulence des
Streptomyces causant la gale commune. Des mutations dans les gènes responsables de la voie
de biosynthèse de thaxtomine rendent les souches portant ces mutations non pathogènes (Healy et al., 2000 ; Joshi et al., 2007b ; Kers et al., 2004).
La biosynthèse de thaxtomine débute par la synthèse d’oxyde nitrique (NO) à partir d’arginine par la protéine TxtD qui est un oxyde nitrique synthase (Kers et al., 2004). Par la suite TxtE, un cytochrome 450 monooxygenase, va ajouter le NO au tryptophane pour former le L-nitrotryptophane (Barry et al., 2012). TxtA et TxtB, des peptides synthétases non ribosomales (NRPS), vont utiliser la phénylalanine ainsi que le L-nitrotryptophane pour former le précurseur de la thaxtomine A, la thaxtomine D (Healy et al., 2002 ; Johnson et al., 2009). La thaxtomine
retrouvé dans TxtA et TxtB (Bignell et al., 2014a). TxtC, un cytochrome 450 monooxygenase, a pour rôle d’ajouter un groupement hydroxyle à la phénylalanine (Healy et al., 2002) ce qui formera la thaxtomine A.
Le rôle de TxtH, une protéine de la famille MbtH-like, n’est pas encore clairement défini, mais celle-ci pourrait avoir un rôle de chaperonine responsable du repliement adéquat des NRPS TxtA et TxtB (Li et al., 2019a).
La régulation de la biosynthèse de thaxtomine se fait par TxtR, un régulateur de transcription de la famille AraC/XylS. L’activation de TxtR se fait par le cellobiose qui une fois lié au régulateur permet de lever la répression qu’il exerce sur les gènes de biosynthèse de la thaxtomine (Johnson et al., 2007 ; Joshi et al., 2007b). L’expression de txtR est aussi régulée par CebR, un répresseur pour l’utilisation de la cellulose, du cellobiose et des cello-oligosaccharides (Francis et al., 2015). CebR lie l’ADN en amont et dans les gènes de synthèse de la thaxtomine. L’interaction de CebR et du cellobiose permet de relâcher la répression de CebR au site de liaison permettant ainsi la transcription des gènes de synthèse de thaxtomine (Francis et al., 2015). Ainsi, le système de transport CebEFG-MsiK qui transporte le cellobiose et le cellotriose dans la cellule est aussi requis pour la production de thaxtomine (Jourdan et al., 2016). Il a été démontré que la délétion de CebE (protéine liant le cellobiose et cellotriose) et MsiK (ATPase liée au transport des carbohydrates) causait une atténuation de la virulence sur des pousses de radis ce qui démontre que le transport du cellobiose vers la cellule est important pour la virulence de S. scabies.
Outre le cellobiose, la subérine est aussi une inductrice de la production de thaxtomine. En effet, lorsque la subérine était combinée au cellobiose, une meilleure production de thaxtomine était observée comparativement à la subérine ou au cellobiose seul (Lerat et al., 2010).
1993 ; Loria et al., 1997) et la présence d’acides aminés aromatiques (Babcock et al., 1993 ; Lauzier et al., 2002 ; Legault et al., 2011) affectaient la production de thaxtomine. Plus récemment, les gènes bld ont été démontré comme ayant un rôle dans la régulation de la production de thaxtomine A. En effet, lorsque les gènes bldA, bldC bldD, bldG et bldH étaient délétés une diminution ou l’abolition de la production de thaxtomine en milieu liquide était noté et la virulence de S. scabies était affectée lors des essais avec des plantes (Bignell et al., 2014b).
La thaxtomine a plusieurs effets chez les plantes. Il a été démontré que l’ajout de thaxtomine causait des lésions ressemblant à la gale sur des mini-tubercules cultivés stérilement (Lawrence et al., 1990), pouvait aussi causer de la nécrose sur des tranches de pomme de terre (Loria et al., 2006) et d’autres tissus (Jourdan et al., 2017). Un traitement à la thaxtomine de semis entraînait en un retard de croissance, de l’enflure chez les hypocotyles et racines, une hypertrophie cellulaire ainsi que la nécrose des tissus (Leiner et al., 1996 ; Loria et al., 1997).
En plus de tous ces symptômes, la thaxtomine cause l’inhibition de synthèse de la cellulose, mais son mode d’action n’est pas connu à ce jour (Bischoff et al., 2009; Duval and Beaudoin, 2009; Fry and Loria, 2002; Scheible et al., 2003).
1.4.2.2 Concanamycine
Les concanamycines sont des polycétides macrolides caractérisés par un cycle macrolide tétraénique à 18 membres avec un éther méthylénolique et une chaîne B-hydroxyhemiacetyl (Bignell et al., 2014a). Les concanamycines ont été isolées pour la première fois chez
Streptomyces diastatochromogenes S45 (Kinashi et al., 1984). Elles ont été isolées pour la
première fois chez S. scabies de souches provenant du Japon (Natsume et al., 1998).
Les concanamycines fonctionnent comme des inhibiteurs de type vacuolaire ATPase et possèdent un large spectre d’activités biologiques incluant des activités antivirale,
anti-Le rôle exact des concanamycines dans la gale commune n’est pas encore élucidé, cependant le groupe de Natsume et al. ont démontré que la concanamycine A avait un effet synergique sur la toxicité de la thaxtomine et que sa co-production avec la thaxtomine accentuait les symptômes de la gale commune (Natsume et al., 2017).
1.4.2.3 Phytotoxines coronafacoyles
Les phytotoxines coronafacoyles sont des toxines composées d’un polycétides à base d’hydrinance bicyclique, l’acide coronafacique (CFA) et d’un acide aminé ou un dérivé lié par un lien amide (Li et al., 2019b). La principale phytotoxine coronafacoyle produite par S. scabies est la Cfa-Ile (Fyans et al., 2015).
Il a été démontré que S. scabies possédait un groupement de 15 gènes pour la biosynthèse de l’acide coronafacique (CFA). Parmi ces gènes, 9 sont homologues aux gènes de Pseudomonas
syringae pv. tomato et Pectobacterium astrosepticum, deux agents phytopathogènes causant la
moucheture de la tomate et la jambe noire de la pomme de terre, tandis que les 6 autres n’ont pas d’homologues connus (Bignell et al., 2010b).
Les gènes cfa 1-5 de S. scabies codent pour les enzymes responsables de la synthèse de l’intermédiaire de CFA soit le 2-carboxy-2-cyclopentenone à partir de l’alpha-ketoglutarate et du manoyl-CoA. Les gènes cfa6 et 7 codent pour des polycétides synthases I (PKS) multifonctionnelles requises pour la synthèse du squelette de CFA. Le gène Cfal code pour une coronafacate ligase. Le gène SCAB_79711 code pour une 3-hydroxybutyryl-CoA déhydrogénase qui réduit l’acétoacétyl-CoA en 3-hydroxybutyryl-CoA, un intermédiaire dans la biosynthèse du crotonyl-CoA. Le crotonyl-CoA sert de substrat pour la crotonyl-CoA carboxylase/réductase codée par le gène cfa8 qui permet la conversion du crotonyl-CoA en ethylmanoyl-CoA. Le gène SCAB_79691 code pour une monooxygenase de type P450 pouvant jouer un rôle dans l’ajustement du polycétide produit. Les gènes SCAB_79681
un rôle dans la modification du polycétide. Le gène SCAB_79591 code pour un régulateur de la famille PAS-LuxR tandis que le gène SCAB_79581 n’a pas de fonction connue.
Ces gènes de biosynthèse sont transcrits comme un seul ARNm de cfa1 au gène SCAB_79721 et les gènes SCAB_79581 et SCAB_79591 représentent une autre unité de transcription. La protéine SCAB_79591 (CfaR) active directement l’expression des gènes codant pour Cfa-Ile en se liant à un site dans la région du promoteur de cfa1 (Cheng et al., 2015).
Les phytotoxines coranofacoyles ont des effets variés sur les plantes dont l’hypertrophie des tissus, la chlorose des feuilles, la stimulation de la production d’éthylène, l’accumulation d’anthocyanine, l’inhibition de l’élongation des racines, des changements dans la structure des chloroplastes et l’accumulation d’inhibiteurs de protéinases (Li et al., 2019b).
Le rôle de la CFA-Ile dans la gale commune reste indéterminé. Cependant, une corrélation positive entre la production de CFA-Ile et la sévérité des symptômes développés sur les tissus de tubercules a été suggérée (Cheng et al., 2019).
1.4.3. Enzymes de dégradation
Chez les bactéries phytopathogènes, la capacité de produire des enzymes dégradant les parois cellulaires des plantes représente un atout. Il a été démontré que la production de ces enzymes tels que les pectates lyases, cellulases, lipases et estérases représentaient des facteurs de virulence. Plus récemment, une étude phylogénétique suggérait que les espèces phytopathogènes de Streptomyces peuvent également utiliser un ensemble de protéines dégradant les polymères de plantes (Huguet-Tapia et al., 2016).
Plusieurs enzymes de dégradation ont été identifiées dans les surnageants de culture de
(Komeil et al., 2014a; Padilla-Reynaud et al., 2015a) et une subérinase (Beaulieu et al., 2016), mais leur rôle dans la pathogénicité de S. scabies n’a pas été démontré.
1.4.4. Sidérophores
Le fer est important pour de nombreux processus métaboliques microbiens tels que la réduction d’oxygène pour la synthèse d’ATP, la réduction des précurseurs ribotides de l’ADN, la formation d’hème et autres fonctions essentielles (Neilands, 1995). Le fer est présent en grande quantité, mais celui-ci est généralement peu biodisponible dans les sols. Ceci est dû au peu de solubilité du fer inorganique qui se dissout à des niveaux beaucoup plus faibles que ceux requis pour la croissance des plantes et des bactéries (Crowley, 2006). Pour contrer ce manque de fer, les bactéries produisent des sidérophores afin de chélater celui-ci.
La production de sidérophores joue un rôle important pour la virulence de plusieurs bactéries. Par exemple, il a été démontré chez Pseudomonas syringae pv. tabaci que la production du sidérophore pyoverdine était essentielle pour sa virulence chez le tabac (Taguchi et al., 2010).
S. scabies est connu pour la production des sidérophores pyocheline et scabicheline (Seipke et
al., 2011 ; Kodani et al., 2013).
La production de pyocheline par S. scabies ne semble pas être requise pour le pouvoir pathogène de la bactérie contrairement à Pseudomonas aeruginosa. En effet, des mutants ne produisant pas la protéine SCAB1471 codant pour un peptide synthase non ribosomal (pyocheline synthase) étaient toujours virulents sur des tranches de tubercules ainsi que sur des pousses de radis (Seipke et al., 2011).
Il a été établi que la scabicheline est le produit métabolique d’un groupe de gènes biosynthétiques de peptides nonribosomaux cryptiques identifiés chez S. scabies (Kodani et al., 2013). Le rôle de la scabicheline dans la pathogénicité de S. scabies reste à être élucidé.
1.5 Importance de la subérine dans l’interaction entre S. scabies et la pomme de terre
1.5.1. Protection physicochimique
La subérine agit comme protection contre les agents pathogènes. Cette protection vient de la fraction polyphénolique de la subérine, mais aussi de l’épaisseur de la couche de cellules subérisées.
Par exemple, l’acide férulique, l’acide chlorogénique ainsi que l’acide protocatéchique ont déjà été signalés comme étant des composés antimicrobiens (Joshi et al., 2015; Sarma and Singh, 2003). Dans le cas de la gale commune, la tolérance de différents cultivars de pomme de terre semble liée à la présence d’acides phénoliques. En effet, les cultivars tolérants ont une quantité plus élevée d’acide gallique, d’acide hydroxycinnamique, d’acide férulique, d’acide chlorogénique, d’acide coumarique ainsi que d’acide cinnamique que les cultivars sensibles (Singhai et al., 2011).
De plus, les cultivars de pommes de terre possédant une peau lisse et mince sont plus susceptibles aux dommages causés par S. scabies que les variétés possédant une peau de type russet qui elles, ont un périderme protecteur contenant un plus grand nombres de couches de cellules subérisées (Lulai, 2007). L’équipe de Khatri et al (2011), a démontré que la présence de S. scabies avait un effet stimulant sur le développement du périderme. Cet effet a été mesuré par l’augmentation du nombre de couches de cellules ainsi que l’épaisseur du périderme (Khatri et al., 2011).
De plus, il a été démontré que la présence de S. scabies ou sa phytotoxine causait une augmentation du nombre de couches de cellules du phellème ainsi qu’une plus grande accumulation du domaine polyphénolique dans ces tissus (Thangavel et al., 2016).
1.5.2. La subérine, source de carbone et d’énergie pour S. scabies
Puisque la subérine est ancrée dans la paroi cellulaire de la plante et que celle-ci est associée à d’autres composantes telles que les polysaccharides (Graça and Santos, 2007), la présence de subérine lors de la croissance de S. scabies va induire la production de différentes enzymes hydrolytiques. Ainsi une étude du sécrétome de S. scabies en présence de subérine a démontré qu’une grande variété de glycosyl hydrolases, par exemple des cellulases, xylanases, arabinofuranosidases et endoglucanases étaient produites (Komeil et al., 2014a). De plus, il a été établi que la subérine stimulait l’activité glucanase or xylanase aussi bien sinon mieux que la cellulose, le cellobiose ou le xylane (Padilla-Reynaud et al., 2015a).
Outre sa capacité de produire divers glycosyl hydrolase en présence de subérine, S. scabies semble aussi posséder la capacité de dégrader la subérine, un composé pourtant très récalcitrant à la dégradation bactérienne. En effet, lors d’une étude sur la dégradation de la subérine par
S. scabies, il a été démontré l’incubation de disques de subérine avec l’agent phytopathogène
entraînait une fragmentation de ceux-ci (Beaulieu et al., 2016). Cette fragmentation était observée seulement si les disques étaient incubés avec S. scabies (Figure 10).
Figure 1.10 Disque de subérine après 1 an d’incubation sans (A) et avec S. scabies (B) (Beaulieu et al., 2016).
En plus de la fragmentation des disques de subérine, les travaux de Beaulieu et al ont mis en évidence le détachement des lamelles de subérine par S. scabies (Figure 11).
Figure 1.11 Microscopie électronique à transmission de la subérine incubée avec
S. scabies entre 0 et 60 jours.
PW : paroi cellulaire primaire ; SW: paroi cellulaire subérisée ; TW : paroi cellulaire tertiaire. * montre les zones de détachements de la paroi secondaire. Les flèches blanches montrent le détachement des lamelles de subérine et les
Le détachement des lamelles de subérine a été observé en microscopie électronique à transmission après 60 jours d’incubation avec S. scabies. En plus des changements au niveau de la subérine, leurs travaux ont démontré qu’il y avait une modification de la composition de la subérine au cours du temps. En effet, des modifications dans la proportion des composés aliphatiques étaient observées dans le temps.
Quand on se penche sur la dégradation de la subérine, on remarque qu’il existe très peu de documentation sur la dégradation de subérine, mais généralement celle-ci est attribuée aux champignons produisant un type particulier d’estérases, les cutinases. Il a été démontré que certaines cutinases agissent aussi sur la subérine.
La dégradation de la subérine par les champignons a été démontrée par plusieurs études. Par exemple, une étude sur la production des lipases par les champignons a mis en évidence la capacité d’espèces de Fusarium et d’Apergillus nidulans à dégrader la subérine (García-Lepe et al., 1997).
Il a été démontré que la cutinase CcCUT1 de Coprinopsis cinerea était capable de dégrader la subérine (Kontkanen et al., 2009). Afin de mettre en évidence la capacité de CcCUT1 à dégrader la subérine, l’équipe de Kontkanen et al (2009) a produit de façon recombinante la cutinase, a ensuite testé son activité sur le p-nitrophénol estérifié avec des acides gras de différentes longueurs (C2 à C18) et traité de la subérine avec l’enzyme afin de mesurer la quantité d’acides gras relâchés. De plus, ils ont aussi comparé en microscopie de la subérine non traitée avec de la subérine traitée avec CcCUT1 et la dépolymérisation de la subérine était observée.
L’analyse du transcriptome et sécrétome de A. nidulans ayant crû en présence de subérine a révélé la production d’enzymes qui pourraient être liées à la dégradation de subérine. En plus des cutinase-subérinases, des enzymes tels que des lipases, des enzymes modifiant les alcools gras à longues chaînes ainsi que des enzymes liées à l’utilisation de la partie phénolique de la
Du côté bactérien, la dégradation de la subérine n’est pas bien documentée. L’équipe de Fett et al., (2000) a démontré que la subérine induisait l’activité estérase cutinolytique de
Thermomonospora vulgaris sans toutefois démontrer que ces estérases avaient la capacité de
dégrader la subérine. La capacité de dégrader la subérine, du moins partiellement, a cependant été démontrée chez S. scabies (Beaulieu et al., 2016).
Plus récemment, des travaux portant sur la protéine Sub1 ont mis en évidence la capacité de Sub1 à dégrader entre autres la subérine et la cutine (Jabloune et al., 2020). Il avait été suggéré par l’équipe de Komeil et al., que la protéine Sub1 était une subérinase. Leurs travaux démontraient que le gène sub1 était semblable à CcCUT1 de Coprinopsis cinerea en plus de voir son expression induite spécifiquement par la subérine (Komeil et al., 2013).
L’équipe de Jabloune et al. (2020) a purifié Sub1 et ont testé son activité estérase sur différents p-nitrophenyl ester. Ils ont observé que Sub1 était plus actif sur le p-nitrophényle butyrate (C4) et le p-nitrophényle octanoate (C8). De plus, ils ont observé le relâchement d’acides gras de la subérine et de la cutine suite à leur incubation avec Sub1.
Outre la dégradation des composés aliphatiques, la dégradation des composés aromatiques a aussi été étudiée. L’équipe de Khalil et al. (2019) a démontré que S. scabies dégrade l’acide férulique et l’acide coumarique. De plus, S. scabies aurait aussi la capacité de détacher la fraction aliphatique de la fraction aromatique. En effet, l’équipe de Komeil et al. (2014) a identifié deux feruloyl estérases qui pourraient jouer un rôle dans la dégradation de la subérine.
1.5.3. La subérine inductrice de la biosynthèse de thaxtomine
Comme il a été précédemment mentionné, il est connu que le cellobiose permet de lever la répression de TxtR afin de permettre la transcription des gènes de biosynthèse de la thaxtomine (Francis et al., 2015 ; Johnson et al., 2008). Lerat et al. (2010) ont démontré que la combinaison
l’expression des gènes de biosynthèse. Ils ont aussi démontré que les gènes nos et txtA impliqués dans la biosynthèse n’étaient pas ou légèrement induit en présence de cellobiose ou de subérine, mais qu’en présence des deux composés ces gènes étaient fortement exprimés. L’augmentation de l’expression de ces gènes permettait de dire que la subérine apporte un signal complémentaire au cellobiose pour stimuler la production de thaxtomine (Lerat et al., 2010).
1.6 Objectifs de recherche
Les travaux de recherche du laboratoire s’intéressent à la subérine, principalement à ses effets sur S. scabies et donc son rôle dans la gale commune de la pomme de terre. Dans cette optique de recherche, la protéomique est beaucoup utilisée, car cela permet d’avoir une vue d’ensemble de ce qui arrive dans les conditions étudiées. La protéomique a été utilisée dans le cadre de l’analyse dans le temps du sécrétome de S. scabies en présence de subérine (Komeil et al., 2014a), ou encore à l’aide de gel 2D pour identifier protéines produites en subérine (Lauzier et al., 2008). Dans le cadre de mon projet de recherche, j’ai utilisé la protéomique afin de complémenter les études précédentes du laboratoire.
La première partie de mon travail consistait à déterminer quelles bactéries pourraient être impliquées dans la dégradation de la subérine. L’objectif de cette partie est de déterminer à l’aide d’une analyse du sécrétome d’un sol provenant d’un champ de pommes de terre en présence de subérine comme seule source de carbone quelles sont les bactéries du sol pouvant être impliqué dans la dégradation de la subérine.
La deuxième partie de mon travail consistait à comparer le comportement de S. scabies en culture pure ou en coculture avec Myxococcus xanthus et Rhodanobacter thiooxydans dans un milieu contenant de la subérine. M. xanthus et R. thiooxydans ont été identifiés comme des bactéries produisant des lipases en présence de subérine dans la première partie de la thèse. L’objectif de cette partie est de déterminer comment la présence de deux bactéries du sol qui
peuvent se développer en présence de subérine affecte la croissance et le sécrétome de
S. scabies.
La troisième partie de mon travail consistait à regarder et comparer l’effet de la subérine sur le protéome intracellulaire de S. scabies ainsi que chez le mutant ∆ 12091. L’objectif de cette partie est de déterminer quelles protéines sont produites spécifiquement et abondamment en présence de subérine, en plus de déterminer quelles protéines sont affectées positivement ou négativement par le gène SCAB_12091.
La quatrième et dernière partie de mon projet consistait en l’analyse du protéome de
S. scabies en présence de tubercules de pomme de terre. L’objectif de cette partie est de faire un
parallèle entre les protéines produites par S. scabies en présence de subérine et celles produites en présence de tubercules. Ainsi que d’identifier les protéines qui requièrent la présence de tubercules vivants pour être produites ou qui sont plus abondantes en présence de tubercules.