HAL Id: tel-01127065
https://tel.archives-ouvertes.fr/tel-01127065
Submitted on 6 Mar 2015
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
surfaces métalliques à base d’assemblage de
nanoparticules d’Au : application superhydrophobe
Yanpeng Xue
To cite this version:
Yanpeng Xue. Voie innovante pour la nano micro texturation de surfaces métalliques à base d’assemblage de nanoparticules d’Au : application superhydrophobe. Matériaux. Université Pierre et Marie Curie - Paris VI, 2014. Français. �NNT : 2014PA066184�. �tel-01127065�
THÈSE
PRÉSENTÉE AL’UNIVERSITÉ PIERRE ET MARIE CURIE
ÉCOLE DOCTORALE :
Chimie physique et analytique de Paris VI (ED388)
Par Xue Yanpeng
POUR OBTENIR LE GRADE DE DOCTEUR
SPÉCIALITÉ : Chimie des matériaux
Voie innovante pour la nano micro texturation de surfaces
métalliques à base d’assemblage de nanoparticules d’Au :
Application superhydrophobe
Directeur de recherche : Abdelhafed TALEB Soutenue le : 26 juin 2014Devant la commission d’examen formée de :
M. Ahmed HAMRAOUI Maitre de conférences – Université Paris Descartes Rapporteur M. Kouakou KOKOH Professeur – Université de Poitiers Rapporteur M. Didier DEVILLIERS Professeur – Université Pierre et Marie Curie Examinateur M. Mohamed CHEHIMI Directeur de Recherche– Université René Diderot Examinateur Mme Christine VAUTRIN-UL Professeur – Université d’Orleans Examinateur
Sommaire
INTRODUCTION………..7
CHAPITRE I : Synthèse bibliographique………11
1. Les nanomatériaux structurés en surface………... 13
1.1 Définitions et familles………...13
1.1.1 Les nano-objets………....13
1.1.2 Les matériaux structurés………....13
1.2 Méthodes de texturation de la surface : Approches habituelles...14
1.2.1 Approches de préparation descendantes « Top-down »…...14
1.2.1.1 La lithographie………...14
1.2.1.2 L’usinage par laser………...16
1.2.1.3 La gravure chimique et physique………...16
1.2.2 Approches de préparation ascendantes « Bottom-up »…...17
1.2.2.1 Le processus sol-gel………....17
1.2.2.2 Le procédé électrochimique d’électrodépot………..17
1.2.2.3 L’autoassemblage de nanoparticules………....23
1.2.3 Morphologies des motifs en surface………..…27
1.3 Propriétés spécifiques et applications………....27
1.4 Conclusion……… ………...29
2. Propriétés de mouillage………..….30
2.1 Introduction……….….…30
2.2 Rappels sur la mouillabilité………..….32
2.2.1 La tension de surface d’un liquide pur………..…..32
2.2.2 La loi de Laplace………..…..33
2.2.3 La longueur capillaire……….….…..34
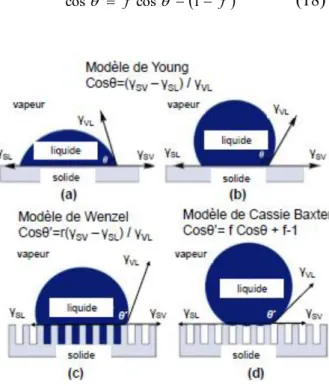
2.3 Mouillabilité des surfaces homogènes : Modèle de Young…..…...34
2.4 Mouillabilité des surfaces hétérogènes et rugueuses………..…….35
2.4.1 Modèles de Wenzel………..…..36
2.4.2 Modèle de Cassie-Baxter……….…….36
2.5 La transition entre le modèle de Wenzel et Cassie Baxter et les surfaces à propriétés de mouillage ajustables……….……..37
2.6 L’intérêt des mouillabilités extrêmes : les surfaces superhydrophobes et superhydrophiles……….…….38
CHAPITRE II: Self organized gold nanoparticles as new nanoelectrocatalyst templates for surface nanostructuring. ……….51 Journal of Electroanalytical Chemistry 693 (2013) 60–66
CHAPITRE III: Self-assembled thiolate functionalized gold nanoparticles
Template toward tailoring the morphology of electrochemically deposited silver nanostructure………71 Electrochimica Acta 88 (2013) 621– 631
CHAPITRE IV: Electrodeposition of Self Organized Superstructure of Copper Dendrites or Polyhedral Particles on Gold Nanoparticle
Modified Highly Oriented Pyrolytic Graphite Electrode…… ..97 Electrochimica Acta 112 (2013) 838– 844
CHAPITRE V: Electrodeposition of Oriented Cobalt Fir Tree-like Morphology with Adjustable Wetting Properties Using Self Assembled Gold Nanoparticle Modified HOPG Electrode……….115 J. Mater. Chem. A, 2013, 1, 11580–11588
CONCLUSION GENERALE………..137 ANNEXES……….141 1. Microscopie électronique à balayage à effet de champs (FEGSEM).
2. Appareillage et méthodes de mesure d’angle de contact.
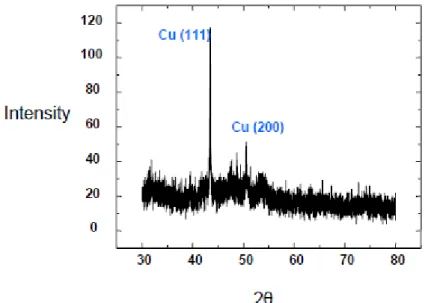
3. Microscopie électrochimique (Scanning Electrochemical Microscopy - SECM). 4. Diffraction des rayons X (DRX).
5. Spectrométrie de photoélectrons induits par rayons X (en anglais, X-Ray
photoelectron spectrometry : XPS ou Electron spectroscopy for chemical analysis : ESCA).
6. Principes, théories et méthodes de base d’électrochimie.
6.1 Rappels sur l’électrochimie 6.1.1 Le potentiel de Nernst 6.1.2 Cinétique électrochimique 6.1.3 Electrocristallisation 6.2 Méthodes de base de l’électrochimie
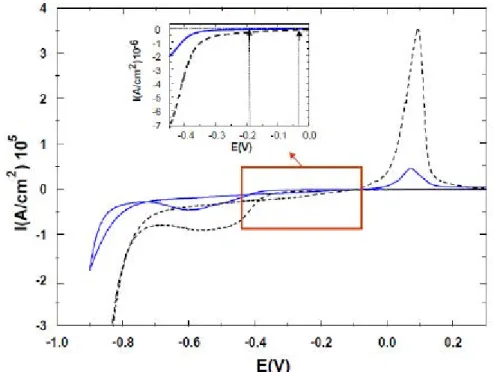
6.2.1 Montage électrochimique 6.2.2 Voltammétrie cyclique 6.2.3 Chronoampérométrie
INTRODUCTION
Depuis bien très longtemps, il est bien établi que la science des matériaux repose sur la relation entre les propriétés, la morphologie structurale et la mise en forme des matériaux qui constituent les objets (métaux, polymères, semi-conducteurs, céramiques, composites, etc.). Jusqu'au XIXe siècle l'utilisation des matériaux était essentiellement empirique. Une évolution majeure a eu lieu quand Josiah Willard Gibbs (1839-1903), physico-chimiste américain, réussit à démontrer que les propriétés thermodynamiques reliées à la structure atomique avaient un lien direct avec les propriétés physiques d'un matériau. À la suite de cela, la science des matériaux ne s'est plus limitée aux métaux ou aux céramiques et s'est considérablement diversifiée, notamment avec le développement des plastiques, des semi-conducteurs après la Seconde Guerre mondiale.
Depuis quelques années, la science des matériaux a vu l’émergence d’une nouvelle discipline avec la fabrication d’objets à l’échelle du nanomètre. Il s’agit là d’explorer un domaine où les effets quantiques bousculent la physique des solides. A cette échelle, on peut noter que les atomes volumiques sont en proportion négligeables par rapport à ceux de la surface. Cette nouvelle configuration confère aux nanoparticules des propriétés imposées par les atomes de surface et non pas par ceux du volume. Ainsi, les nanomatériaux ont des propriétés qui diffèrent de celles des matériaux de même composition à l’état massif et leur taille devient comparable à un certain nombre de grandeurs physiques telles que le libre parcours moyen [1,2] ou les parois de Bloch [1,3]. De ce fait, la taille, la forme et l’assemblage des nanoparticules deviennent des paramètres de même importance que la composition chimique pour contrôler leurs propriétés spécifiques [1].
Aujourd'hui, le principal moteur de l'innovation de la science des matériaux est le développement de domaines de pointe tels que les nanotechnologies ou l'aérospatial demandeur de nouveaux concepts et ruptures technologiques. La science des matériaux est au cœur de beaucoup des grandes révolutions techniques. Particulièrement depuis un siècle1 : électronique (ordinateurs, lecteurs de CD et DVD…), automobile (moteurs, carrosserie, phares, etc.), aéronautique, énergies renouvelables (panneaux solaires…), nanosciences, nanotechnologies, etc… . Dans le monde actuel, les industriels se livrent une course sans merci à la miniaturisation des objets. On nous promet des produits plus petits, plus légers, moins chers, une clé USB n’est guère plus grosse qu’une cigarette, un PC entier peut être contenu dans une boite à chaussure. Par conséquent à ces progrès une technologie est née qu’on appellera par la suite nanotechnologie. Cette nouvelle technologie vise à élaborer de nouveaux matériaux (nanomatériaux) et des composants toujours plus petits, à construire « atome par atome » de nouvelles molécules et à les assembler sous différentes architectures pour réaliser de nouvelles fonctions, et à exploiter des phénomènes nouveaux qui n’apparaissent qu’à l’échelle du nanomètre. Cette connaissance, confèrent aux scientifiques et aux industriels la possibilité d'élaborer de nouveaux édifices atomiques pour obtenir les propriétés désirées et découvrir de nouvelles possibilités d'applications.
Dans cet élan, les matériaux nanostructurés en surface représentent un grand intérêt. En effet, l’organisation des motifs en surface, leur taille nanométrique, leur morphologie, mais aussi les couplages physiques dus au pas de réseau de quelques nanomètres de ces motifs
confèrent à ces matériaux de nouvelles propriétés. Cela fait de ces matériaux des candidats potentiels pour divers applications de capteurs, de surfaces auto nettoyantes etc …
On devine l'intérêt pratique qu'il peut y avoir à élaborer des surfaces nanostructurées pour les applications de surfaces autonettoyantes. En effet, les gouttes les fuient, et ells restent secs après une exposition à l'eau. Il s’agit d’un phénomène purement physico-chimique qui est bien établi actuellement et qui est attribué à une coexistence de deux propriétés : une propriété chimique traduite par une faible tension de surface et une propriété physique traduite par la création d’une rugosité hiérarchique. Stimulés par les applications potentielles de ce phénomène (lunette autonettoyante et antibuée, pare-brise anti-pluie, revêtement antigivre, vêtement intâchable, peinture anti-humidité) les chimistes et les physiciens ont multiplié depuis les années 1990 les procédés pour fabriquer de telles surfaces. Avec l’émergence des nanotechnologies et le développement des outils de fabrication, de nouveaux procédés ont vu le jour.
Parmi les techniques physiques et chimiques utilisées pour la nanostructuration de surface, celle d’auto-assemblage de nanoparticules est la plus simple à mettre en œuvre et la moins coûteuse. Cette technique d’auto assemblage couplée ou non à l’électrodépôt sera utilisée pour l’élaboration des différentes surfaces nano structurées que nous avons étudié.
Ce mémoire de thèse est structuré en différents chapitres bibliographiques et expérimentaux. Le premier chapitre est consacré à une recherche bibliographique sur les nanomatériaux et les propriétés de mouillage. Nous présentons les défis potentiels pour la nanofabrication de surfaces superhydrophobes. Nous discutons les méthodes générales de fabrication ascendante «bottom-up» et descendante « top-down », afin de créer une rugosité hiérarchique. Une attention particulière sera apportée au positionnement du sujet par rapport au progrès dans le domaine. Nous proposons dans une deuxième partie de ce rapport bibliographique une description des phénomènes de mouillage et une révision des modèles de la superhydrophobicité. Nous présentons dans une seconde partie les défis potentiels pour la nanofabrication de surfaces superhydrophobes.
Par la suite seront exposés les résultats obtenus sous forme d’articles, précédés par un résumé qui décrit d’une manière succincte les résultats dont ils font l’objet. Dans les différents articles, des résultats sur les propriétés électro catalytiques des nanoparticules d’Au seront reportés et une nouvelle approche de structuration de la surface d’électrode sera décrite. Par ailleurs, le rôle des molécules fonctionnalisant les nanoparticules dans le contrôle de la morphologie du film électrodéposé ainsi que ces propriétés de mouillage sera illustré.
A la fin des chapitres, la conclusion générale récapitule et dresse la synthèse des différents résultats importants et s’attache à souligner l’apport des résultats dans les domaines scientifiques de la thèse. Par ailleurs, un constat est dressé sous forme de questions dans la conclusion à propos des phénomènes non élucidés et qui pourront être l’objet de perspectives à ce travail.
Références
[1] Les nanosciences 2. Nanomatériaux et nanochimie, M. Lahmani, C. Bréchignac, Ph. Houdy, Edit Belin 2006.
[2] U. Kreibig, M. Vollmer:Optical properties of metal cluster, Springer Series in material science 25, Springer – Verlag Berlin Heidelberg (1995).
[3] C. Kittel: Rev. Mod. Phys. 21, 541 (1949).
Chapitre I : Synthèse Bibliographique
1. Les matériaux nanostructurés en surface
1.1 Définitions et familles
L’unité de référence du nanomonde est le nanomètre (noté en abrégé nm). Le préfixe « nano » vient du grec nannos qui signifie « nain ». Un nanomètre équivaut à un milliardième de mètre (1nm=10-9 m) soit approximativement 1/50000 de l’épaisseur d’un cheveu humain. Cette échelle est celle de l’atome, la brique élémentaire de toute matière. Il existe ainsi la même différence de taille entre un atome et une balle de tennis qu’entre une balle de tennis et la planète Terre.
Les nanomatériaux sont les matériaux purs (ou les alliages), formés accidentellement ou manufacturés, contenant des particules libres, sous forme d’agrégat ou sous forme d’agglomérat, dont l’une des dimensions physiques au moins est à l’échelle nanométrique c’est-à-dire comprise entre 1 et 100 nm ou qui possède une structure interne ou de surface à l’échelle nanométrique. Par conséquent à cette définition les nanomatériaux sont classés en deux grandes familles.
1.1.1 Les nano-objets
Cette famille englobe les matériaux dont au moins une dimension externe se situe à l’échelle nanométrique (entre 1 et 100 nm). Parmi les composantes de cette famille on peut distinguer :
Les nanoparticules : ce sont les nano-objets dont les trois dimensions externes se situent entre 1 et 100 nm.
Les nanofibres, nanotubes, nanofilaments ou nanobatonnets : Ce sont des nanoobjets dont deux dimensions externes sont comprises entre 1 et 100 nm.
Les nanofeuillets, nanoplats ou nanoplaquettes : Ce sont des nanoobjets dont une dimension externe est comprise entre 1 et 100 nm.
1.1.2 Les matériaux nanostructurés
C’est la famille des matériaux qui possèdent une structure interne ou de surface à l’échelle du nanomètre. Par ailleurs, elle peut être scindée en plusieurs sous familles
Les agrégats et agglomérats de nanoobjets : Ce sont des assemblages de nanoobjets dont la taille est sensiblement supérieur à 100 nm.
Les matériaux nanoporeux : Ce sont des matériaux poreux avec des tailles de pores à l’échelle du nanométrique.
Les nanocomposites : Ce sont des matériaux composés en tout ou en partie de nanoobjets, soit incorporés dans une matrice soit présents en surface (nanostructurés en surface). Ces nanostructures en surface permettent d’apporter une nouvelle fonctionnalité ou de modifier certaines propriétés existantes. Pour la suite de ce travail on s’intéressera plus particulièrement aux matériaux nanostructurés en surface.
1.2 Méthode de texturation de la surface : approches
habituelles.
Pour la réalisation des matériaux nanostructurés en surface, différentes techniques ont été utilisées. Ces techniques de fabrication ont largement été développées ces dernières années et ont été motivées par la course à la miniaturisation des dispositifs que se livrent les industriels. Il existe de nombreux procédés, plus ou moins complexes, permettant de créer des micro ou nano structures sur des surfaces de divers matériaux. Il existe de nos jours trois approches pour l’élaboration de matériaux texturés en surface :
- Approches descendantes « Top-down ». - Approches ascendantes « Bottom-up ». - Combinaison de ces deux approches.
Ci-dessous est un aperçu des principales techniques.
1.2.1 Approches de préparation descendantes
« Top-down ».
Dans l’approche descendante, les nanostructures sont réalisées par une succession d’étapes technologiques qui relèvent de la microélectronique. Cette approche consiste en partant de matériaux micrométriques de fabriquer des nanomatériaux. Nous allons présenter dans ce qui suit quelques exemples de ces méthodes.
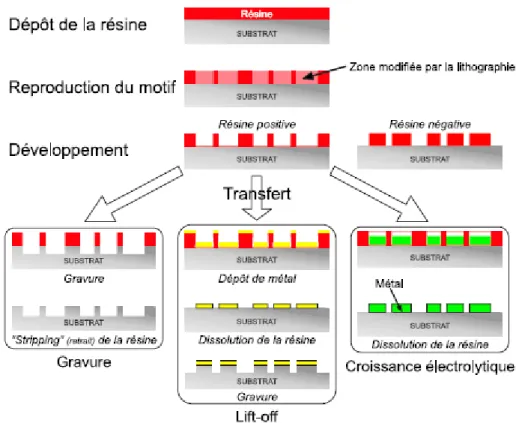
1.2.1.1 La lithographie :
Sous ces différentes formes, la lithographie est réalisée en plusieurs étapes : dans un premier temps une résine photosensible est appliquée sur la surface à structurer (Fig. 1). Par la suite un masque est déposé sur la résine avant son irradiation avec une longueur d’onde donnée. Un développement souvent par chimie douce permet de révéler les motifs dans la résine. La gravure du substrat ou le dépôt de métal dans les zones de la surface, laissées libres permet d’obtenir les motifs désirés en surface et la résine restante est éliminée.
Figure 1: Schématisation des différentes étapes de l’approche top-down : lithographie suivie de
différentes méthodes de transfert.
Figure 2: Images MEB montrant des structures obtenues par l’approche top-down. (a) Réseau de
structures de Ni obtenu, par lithographie [1]. (b) Réseau de nanostructures d’Au réalisées par lithographie électronique et lift-off. (c) Réseau de structures métalliques ayant un diamètre minimum de 10 nm et une période de 40 nm obtenu par nanoimpression dans une couche de PMMA suivi d’un lift-off. [2]
Les différents procédés de lithographie se différencient par la technique utilisée pour créer la texture en négatif ou en positif dans la résine (Fig. 1, 2) (rayonnement UV, faisceaux de rayon X, d’ion, d’électron) [1-2]. Les différentes résolutions de la texture préparée dépendent de la longueur d’onde utilisée et plus cette longueur d’onde est faible, plus la résolution est meilleure. A titre d’exemple la photolithographie permet d’atteindre des résolutions d’une centaine de nanomètres, tandis que la lithographie électronique offre des résolutions à l’échelle du nanomètre.
1.2.1.2 Usinage par Laser :
Cette technique consiste en l’utilisation d’un faisceau d’énergie concentré en un spot très fin qui permet la texturation de la surface par ablation de matière (Fig. 3) [3-5]. Ce procédé permet un contrôle de la morphologie à des échelles micrométriques sur large variété de matériaux tels que les métaux, les céramiques, les plastiques, les polymères ou le bois. Par l’utilisation d’un laser femtoseconde cette technique permet de s’affranchir de l’effet thermique et de générer des motifs de quelques microns d’une manière industrielle. Par cet avantage, cette technique est mieux adaptée aux matériaux sensibles à la chaleur.
Figure 3: Schéma montrant le procédé d’usinage laser, Il s'agit de focaliser le faisceau laser dans une
surface précisément définie (quelques 1/10 mm²) pour vaporiser le matériau à usiner. Un contrôle précis de tous les paramètres du laser permettra de limiter son action à une profondeur définie. Un déplacement du faisceau d'énergie par balayage entraîne l'enlèvement de la matière par couches successives. Une assistance gazeuse sous pression favorise l'éjection de la matière vaporisée tout en limitant l'échauffement de la pièce. Cette technique est similaire à l'électroérosion.
1.2.1.3 La gravure chimique et physique :
Cette technique consiste à graver la surface mise à nue par un masque en utilisant une attaque en phase liquide, gazeuse ou plasma. On distingue deux classes de méthodes :
- Les méthodes basées sur la gravure humide en utilisant une réaction chimique, consistent à plonger le matériau dans une solution agressive qui va attaquer les régions non protégées de ce dernier (Fig. 4). Cette technique a le mérite d’être facile à mettre en œuvre et peut être facilement transposable à une échelle industrielle. Par ailleurs, elle présente une bonne sélectivité des matériaux. En revanche, elle a l’inconvénient de se produire de manière isotrope dans toutes les directions et s’accompagne d’une sous gravure qui handicape fortement son application. Les réseaux de tubes d’Aluminium ou d’oxyde de Titane obtenus respectivement par anodisation d’un film d’Al et de Titane en sont des bons exemples illustratifs [6-10].
- Les méthodes de gravure sèche utilisent plutôt des procédés physiques de gravure tels que le bombardement par un faisceau ionique ou électronique (Fig. 4) [11-12]. Ces méthodes permettent d’atteindre la résolution submicronique. Ces techniques présentent l’avantage d’une forte anisotropie de la gravure (la frontière entre les
zones gravies et non gravées sera la plupart du temps rectiligne et verticale), mais ont l’inconvénient d’être beaucoup plus difficile à mettre en œuvre.
-
Figure 4: Schéma montrant le gravure chimique et physique avec un masquage identique. La largeur
du motif gravé sera différente selon la méthode de gravure utilisée isotrope ou anisotrope.
1.2.2 Approches de préparation ascendantes
« Bottom-up ».
Ces approches reposent sur la formation spontanée, par regroupement d’atomes pour réaliser des assemblages dans une grande échelle. Ces approches sont simples et permettent d’obtenir des meilleures résolutions à l’échelle du nanomètre. Nous allons présenter dans ce qui suit les principales techniques.
1.2.2.1 Le processus sol – gel
La réalisation de ce processus se déroule en plusieurs étapes. Un réseau d’oxyde est formé d’abord par hydrolyse du précurseur ou d’une dispersion colloïdale dans un solvant, qui va subir par la suite des réactions de polycondensation. La rugosité et la taille des pores du réseau sol – gel sont déterminées par la cinétique de la réaction sol-gel, le pH, le type de catalyseur, la nature du précurseur, la masse moléculaire des additifs et la température de durcissement [13-15].
1.2.2.2 Le Procédé électrochimique d’électrodépôt.
Parmi les approches ascendantes, le procédé électrochimique d’électrodépôt a pris une place importante et a montré une grande efficacité pour l’élaboration des surfaces texturées
[16-18]. Cette technique permet de réduire des espèces en solution afin de réaliser un dépôt sur un substrat conducteur positionné au niveau de la cathode. Le montage pour réaliser un dépôt électrochimique est présenté sur la figure 5 :
Figure 5 : Schéma du montage d’une cellule électrochimique à trois électrodes permettant de
réaliser un dépôt électrochimique.
La réaction électrochimique mise en jeu lors d’un dépôt électrochimique est la réduction de l’ion métallique au niveau de la cathode selon le schéma suivant :
M z+ + ze- → M(s) (1)
Pour réaliser cette réaction, il faut appliquer un potentiel à la cathode inférieur à sa valeur d’équilibre en présence du couple rédox (Mz+/ M). La différence entre le potentiel appliqué, E, et sa valeur à l’équilibre, Eeq, est appelé la surtension et notée :
η= E-Eeq (2)
Cette surtension dépend de plusieurs paramètres liés au processus d’électrodépôt, tels que la nature de l’électrolyte, la densité de courant cathodique et la nature du métal déposé. Par ailleurs, la vitesse d’électrodépot est directement dépendante de la densité de courant qui traverse la cellule électrochimique qui est fonction de la surtension.
La masse du métal déposée durant un temps, t, en négligeant les réactions parasites, est calculée par la loi de Faraday exprimée par la relation suivante :
Q= ne . F = I . t (3)
n(M) = ne / z = Q / z.F=I.t / z.F (4)
avec Q la quantité d’électricité, F la constante de Faraday (96485 C.mol-1), ne le nombre de mole d’électrons échangés, I le courant imposé, t le temps du dépôt et z le nombre d’électrons échangé lors de la réaction redox.
L’électrodéposition d’un métal est souvent accompagnée de réactions parasites, qui consomment le courant appliqué et réduit la masse déposée à la cathode. La réduction des protons au niveau de la cathode en est un exemple. Les conséquences de cette réaction sur le dépôt métallique peuvent être plus désastreuses, elles peuvent engendrer la fragilisation du dépôt, un changement de ses propriétés, la formation de piqûres … [19-20].
Pour limiter les nuisances de cette réaction, il est préférable de se placer à des surtensions suffisamment faibles. Il faut que le dégagement hydrogène se trouve à un potentiel plus bas que le potentiel de réduction d’électrode du métal à la fois sur la cathode mais aussi sur le métal lui-même.
Les caractéristiques de l’électrodépôt métallique sont gouvernées par différents paramètres, qu’on peut scinder en deux classes :
- Les paramètres imposés par les conditions initiales, tels que la nature et la préparation des électrodes, la composition de l’électrolyte, la configuration du montage, les paramètres électriques, la température …
- Les paramètres imposés par l’évolution temporelle du système, souvent leur rôle est complexe.
Il est couramment admis que les différents mécanismes impliqués dans l’électrodépôt d’un métal sont les suivants :
- Transport de l’ion métallique hydraté du cœur de la solution vers la cathode à travers la couche de diffusion et la couche d’Helmholtz.
- Diminution de la couche hydratée autour de l’ion métallique, lorsque celui-ci se rapproche de la surface de la cathode.
- Formation d’adatome (ou adion) avec transfert de charge à la surface de la cathode pour former des atomes métalliques à la surface de la cathode.
- Nucléation de germes à la surface de la cathode par diffusion et assemblage des adatomes au niveau des sites stables de la surface de la cathode (défauts, marches et coins)
- Croissance par rassemblement de plusieurs germes afin de minimiser l’énergie de surface et de former des entités plus stables.
Figure 6 : Schéma des différentes étapes impliquées aux stades initiaux de l’électrodépôt [20].
La formation de dépôt, résulte d’une compétition entre la croissance de germes existants et la germination de nouveaux germes. Lorsque la surface de la cathode présente des défauts, des marches et des coins, la nucléation de germe s’effectue au niveau de ces derniers.
La morphologie et la structure du dépôt électrochimique dépendent fortement de la compétition entre les processus de germination et de croissance, ainsi que les phénomènes de coalescence. L’assemblage d’adatomes à la surface de la cathode va former des clusters qui vont croitre dans différents directions parallèlement ainsi que perpendiculairement au substrat pour former des grains. Pour les stades initiaux de la croissance sur une surface idéale sans défauts, trois mécanismes principaux permettent d’illustrer l’influence du substrat [20].
- Modèle de Volmer – Weber propose la croissance tridimensionnelle (3D) de petits germes isolés à la surface de la cathode (Fig. 7a). Ces derniers s’organisent en îlots qui coalescent par la suite pour former un film continu. Ce mécanisme de croissance est favorisé par de faibles interactions entre les atomes du métal formant les germes et ceux formant la surface de la cathode (ψM-S < ψM-M).
- Modèle de Frank – Van Der Merwe propose une croissance bidimensionnelle (2D) couche par couche (Fig. 7b). Ce mode de croissance prend place lorsque le paramètre de maille des atomes déposés, dM, est proche de celui des atomes formant le substrat dS. Les conditions de ce type de croissance correspondent à ceux d’une croissance épitaxique. En présence d’une différence notable de paramètre de maille, l’apparition de défauts permet de relaxer les contraintes et par conséquent la formation du dépôt.
- Modèle de Stranski – Krastanov combine les deux modes précédents. Au stade initial, la croissance s’effectue selon le mécanisme de Frank – Van Der Merwe (Fig. 7c). Au cours du dépôt, lorsque le désaccord de paramètre de maille entre les atomes électrodéposées et ceux de la surface de la cathode devient non négligeable, la croissance s’effectue selon le mécanisme de Volmer – Weber. Cette transition est observée aussi lorsque l’influence du substrat diminue.
Figure 7 : Schéma représentant les trois modèles de croissance (a) Volmer Weber, (b)Frank – Van Der Merwe et (c) Stranski – Krastanov [21]. Avec ψM-S l’interaction métal-substrat et ψM-M
l’interaction métal-métal.
(a)
(b)
Dans tous ces mécanismes, les conditions du dépôt sont supposées être proches de l’équilibre, sans influence de la cinétique et avec une formation d’alliage négligeable [22]. Ces mécanismes permettent d’expliquer les stades initiaux de croissance sur une surface idéale. La présence d’espèces adsorbées à la surface de la cathode peut fortement perturber ces mécanismes. Dans le cas où l’adsorption de ces espèces bloque la croissance perpendiculaire à la surface de l’électrode, une croissance couche par couche est plus favorisée [23-24].
La structure du dépôt peut être évaluée à différents niveau du processus d’électrodépôt. Au-delà d’une certaine épaisseur du dépôt, l’influence de l’électrode devient négligeable et le dépôt est souvent polycristallin [25]. Cependant les propriétés de l’électrodépôt (rugosité et morphologie de surface, taille et orientation des grains) dépendent de la nature du matériau déposé et des conditions d’élaboration [25].
Lors de la croissance des germes pour former des grains plusieurs situations se présentent selon les conditions d’élaboration (mécanismes de Fischer) [26] :
- Soit les germes grossissent séparément et sont fortement influencés par la direction du champ électrique, E, entre l’anode et la cathode. Ce type de dépôt est noté FI (Field-oriented isolated cristals).
- Soit les germes grossissent selon une nucléation 2D fortement influencée par la surface de la cathode. Le premier germe formé joue le rôle de marche pour les adatomes suivants. Ainsi une première couche couvrant la surface de la cathode est formée. Cette dernière ferra état de surface pour la couche suivante. Ce type de dépôt est noté BR (Basis oriented reproduction).
- Soit les germes croient sous forme de cristallite en forme de fibre, parallèle aux lignes de champ électrique et forment une structure compacte. Ce type de dépôt est noté FT (Field-oriented texture).
- Soit les germes croient sous forme de petits grains orientés aléatoirement. Souvent ce type de dépôt est stabilisé par l’incorporation d’éléments étrangers [27]. Ce type de dépôt est noté UD (Unoriented dispersion type).
Si la croissance des grains s’effectue sans coalescence, la structure colonnaire (grains allongés) est la plus fréquemment observée. La croissance des grains s’effectue perpendiculairement à la surface de la cathode [28] avec des vitesses différentes le long de la direction du champ électrique. Ces différences de croissance peuvent s’expliquer par des considérations thermodynamiques, les plus denses plans cristallographiques ont de faible énergie de surface et ont une vitesse de croissance plus rapide [29- 31].
Dans la littérature, Il est bien établi que la taille des grains est contrôlée par les processus de germination/croissance et par conséquent par la surtension appliquée et par le degré d’inhibition des espèces adsorbées en surface [26].
En l’absence de l’influence de transport de masse vers la surface de la cathode et d’inhibition, l’application d’une forte surtension permet d’augmenter la concentration des
adatomes en surface. Ces conditions permettent de réaliser des dépôts plus lisses en favorisant la germination et la formation de grains plus fins. En revanche l’application de faible surtension favorise la formation de gros grains [26].
En présence d’espèces adsorbées à la surface des grains, leur taille et leur morphologie se retrouvent affectées. En effet, l’adsorption d’espèces telles que les anions de l’électrolyte, les additifs organiques à la surface de la cathode influencent les processus de germination et de croissance. Selon l’affinité d’adsorption des espèces à la surface, l’intensité d’inhibition est plus au moins intense. Cette affinité dépend des plans cristallographiques à la surface de l’électrode et de la surtension appliquée [19, 32-34].
La température peut aussi influencer la taille des grains [35]. En effet l’exaltation des phénomènes de diffusion superficielle va conduire à une augmentation de la taille des grains.
Les travaux de Wind et al. [26] ont montré la dépendance de la morphologie des films à deux paramètres qui sont la surtension appliquée et l’intensité d’inhibition (Fig.8).
Figure 8 : Diagramme montrant la morphologie du dépôt en fonction de l’intensité de la surtension et
d’inhibition.jdl densité de courant limite de diffusion, 2D et 3D respectivement la nucléation bidimensionnelle et tridimensionnelle, FI dépôt dendritique ou poudreux, BR dépôt cohérent avec croissance de la rugosité avec l’épaisseur, FT dépôt cohérent avec une épaisseur constante et des grains de petites tailles et UD dépôt cohérent avec des grains de petites tailles [26,36].
D’après ce digramme on peut noter différentes situations :
- Pour de faibles intensités d’inhibition, les mécanismes de croissance (2D, 3D ou 2D/3D) mentionnés précédemment sont valides.
- Pour de faibles surtensions, on peut avoir l’absence de dépôt ou la formation des dépôts de type FI.
- Lorsque la surtension augmente, la germination a lieu et la croissance s’effectue selon un mécanisme couche par couche de type 2D pour former un dépôt de type BR ou FT. Par la suite des mécanismes de nucléation 2D ont lieu conduisant à la formation de dépôt de type UD.
- Pour les surtensions élevées, des dépôts poudreux ou dendritiques sont formés. - Lorsque l’intensité d’inhibition augmente à surtension constante, la croissance
s’effectue selon les mécanismes de Fischer. La croissance est initiée par un mécanisme de nucléation 2D avec formation d’empilement de couche. La croissance latérale de ces couches est limitée par les adsorbats en surface. Ce mécanisme conduit à une croissance de dépôt de type BR qui évolue vers un dépôt de type FT quand l’intensité d’inhibition augmente.
- Pour les fortes surtensions et/ou intensités d’inhibition, le processus de germination 3D a lieu.
En résumé la morphologie du dépôt électrochimique est influencée par différents facteurs dont les principaux selon les travaux de Bergstressser [23] sont :
- La rugosité de surface et l’orientation cristallographique à la surface de la cathode. - Le nombre de sites de nucléation.
- La compétition entre la germination et la croissance. - L’adsorption d’espèces à la surface de la cathode.
- Les conditions de dépôt (courant, tension, température etc …).
- Les défauts de la surface de la cathode (taille des grains, dislocations etc …).
L’intervention des phénomènes de transport de masse au cours du processus d’électrodépôt, accentue l’influence de certains paramètres mentionnés ci-dessus. Au cours du dépôt électrochimique, l’épaisseur de la couche diffuse varie en fonction des aspérités de surface formées pendant le dépôt. Cela à pour conséquence de favoriser le dépôt sur les pointes plutôt que sur les vallées, ce qui favorise la formation d’une surface plus rugueuse pour de long temps de dépôt [20].
La surtension a aussi une influence importante sur la rugosité finale des dépôts. L’application d’une faible surtension favorise la formation d’une rugosité importante. Cela est la conséquence du dépôt préférentiel des ions métalliques sur les aspérités de surface et donc l’augmentation de la rugosité de surface [20]. En revanche lorsque la surtension augmente, les ions métalliques se déposent plus rapidement en recouvrant toute la surface de la cathode, ce qui a comme effet de diminuer la rugosité.
Au cours du processus d’électrodépôt, la morphologie du dépôt peut varier en fonction des conditions d’élaborations ayant une forte influence sur le couplage des différents phénomènes impliqués ce qui rend très difficile de prévoir la morphologie finale de la surface.
1.2.2.3 L’auto - assemblage de nanoparticules
Parallèlement aux autoassemblages de nanostructures obtenues par croissance directement sur le substrat (électrodépôt) présenté ci–dessus, la chimie permet de synthétiser des nanoparticules aux propriétés contrôlées (taille, forme, dispersion et fonctionnalisation). Leur mise en forme sur un substrat permet d’obtenir des assemblages de nanoparticules avec un ordre à courte et à longue distance et une rugosité de surface contrôlée. Différents types de nanoparticules ont été utilisés pour fabriquer des films poreux à rugosité contrôlée. Parmi ces nanoparticules, celles à base de silice ou de métaux nobles, tels que l’Au ou l’Ag, ont été
abondamment utilisées pour la texturation de la surface. Par ailleurs, différentes techniques de dépôt ont été utilisées pour la mise en forme de ces nanoparticules telles que le dépôt de goutte (drop coating) [37], immersion retrait (dip coating) [38-39] etc …
Les structures formées spontanément par les auto assemblages de nanoparticules sont à l'équilibre thermodynamique ou proche de celui-ci. Les avantages de ces techniques d’auto-assemblage résident dans la possibilité de préparer des structures avec peu de défaut et des pas de réseau de l’ordre du nanomètre, bien inférieur aux limites de définition latérale atteignables par les différentes types de lithographie. Par ailleurs, l'auto-assemblage permet de former des structures à plus haut degré d'ordre que ce qui peut être atteint avec les autres techniques mentionnées précédemment. Cet ordre sera d'autant plus important que les nanoparticules formant la structure présentent une distribution en taille assez étroite et que les interactions substrat – nanoparticules sont favorables.
Ces interactions entre les nanoparticules et le substrat ainsi qu'entre les nanoparticules elles-mêmes ont été utilisées comme forces motrices à la formation de structures auto-assemblées. Les assemblages moléculaires, par exemple, impliquent souvent des interactions non covalentes telles que les forces de Van der Walls, interactions électrostatiques ou hydrophobes, liaisons hydrogène ou de coordination. L'assemblage de mesostructures ou macrostructures formées de nanoparticules peuvent de plus impliquer d'autres forces telles que la gravité [40,41], les champs électromagnétiques [42,43] les forces de cisaillement [44], la capillarité [45,46] et l'entropie [47].
La force la plus fréquemment utilisée pour les auto-assemblages bidimensionnels (2D) de nanoparticules en solution est la force de capillarité latérale. Cette force est née de la déformation de la surface d'un liquide, qui serait considérée comme plane en l’absence de nanoparticules ou de substrat. L’intensité de la force capillaire entre deux nanoparticules est directement proportionnelle à la déformation interfaciale créée par les nanoparticules et peut atteindre 26 MPa [48].
La déformation de l’interface air - liquide dépend des propriétés de mouillage des nanoparticules. Cependant, un mouillage très faible des nanoparticules ou du substrat par le liquide ou des répulsions électrostatiques entre le substrat et les nanoparticules sont des obstacles à la formation d'un film uniforme. Ces problèmes de mouillage peuvent être contournés, soit en fonctionnalisant le substrat avant dépôt des nanoparticules, soit en fonctionnalisant les nanoparticules [49].
Les forces capillaires peuvent être les forces dominantes selon la chimie de surface des nanoparticules et peuvent être de natures différentes, on peut notamment mentionner les interactions médiées par la gravité, par le mouillage, ou encore les interactions dues aux irrégularités de la ligne de contact (Fig. 9).
Figure 9: Schéma montrant les interactions capillaires entre nanoparticules sur une interface (a)
attraction entre deux nanoparticules flottantes de même taille (b) attraction entre deux nanoparticules immergées de même taille (c) répulsion entre deux particules flottantes de même taille, une lourde et une léger (d) répulsion entre deux particules une hydrophile et l’autre hydrophobe.(e) Pont capillaire entre deux particules sphériques présentant une bonne mouillabilité [50].
Lorsque deux particules sont de taille égale et ne sont pas en contact, les forces capillaires peuvent être simplifiées sous les équations suivantes [50-51] pour les forces flottantes (Eq. 5) et d’immersion (Eq. 6) : L Kl 6 R F (5) L Kl 2 R F (6)
où σ est la tension interfaciale entre le liquide et l'air, R est le rayon des nanoparticules, K1(L) est la fonction de Bessel modifiée au premier ordre et L est la distance inter-particules. Ces deux forces ont la même dépendance vis-à-vis de la distance, L, mais des dépendances très différentes vis-à-vis du rayon, R, des particules et de la tension interfaciale, σ. En pratique, la force de flottaison devient négligeable pour des particules d'un diamètre inférieur à 10 nm.
Dans tous ces cas de figure, les interactions capillaires sont la conséquence d’une déformation de l’interface. Lorsque les particules sont de grande taille (R>5 µm) ou très denses, elles déforment l’interface sous l’effet de la gravité. Les interactions attractives associées sont dites de flottaison et varient en R6 [50-51]. Pour des particules de taille inférieure au micron, ces forces deviennent négligeables car le poids des particules n’est pas suffisant pour déformer l’interface. Si les particules sont situées sur un substrat solide ou dans un film liquide mince, l’interface est déformée par le mouillage. Les interactions attractives associées sont alors dites d’immersion et subsistent même pour des particules de rayon inférieur au micron. Ces interactions varient en R2[50-51].
La force des ponts capillaires (Fig 9e) dépend de la géométrie des particules et des propriétés des matériaux en contact, telles que l'énergie de surface, la mouillabilité et la rugosité de surface. Par exemple, un liquide qui mouille bien une surface (angle de contact faible) forme un ménisque concave et un état de tension (Fig. 9). La force capillaire entre deux nanoparticules adjacentes à une interface air-liquide tend à attirer d’autres nanoparticules aux propriétés de mouillage identiques et à former un assemblage de nanoparticules à cette l'interface (Fig. 10).
Figure 10: (a) Schéma de l’étalement/séchage d’une suspension colloïdale sur tournette
(spin-coating)[39], (b) Schéma de l’étalement/séchage d’une suspension colloïdale sur substrat immergé (dip-coating). Le schéma montre aussi la dynamique de l’ensemble, avec vw la vitesse de retrait du
substrat, vc la vitesse de croissance du cristal, jw le flux d’eau, jp le flux de particule, je le flux d’évaporation (h est l’épaisseur du cristal qui peut être en mono ou multicouches) [45]
La déformation de l’interface air - liquide dépend des propriétés de mouillage des nanoparticules. Cependant, un mouillage très faible des nanoparticules ou du substrat par le liquide ou des répulsions électrostatiques entre le substrat et les nanoparticules sont des obstacles à la formation d'un film uniforme. Ces problèmes de mouillage peuvent être contournés soit en fonctionnalisant le substrat avant dépôt des nanoparticules [49], soit en fonctionnalisant les nanoparticules.
La qualité des films flottants peut être contrôlée par la taille des nanoparticules, leur nombre, leurs propriétés de surface et leur charge ainsi que les propriétés du substrat sous-jacent [46,52]. Le transfert de ces films flottants vers un substrat solide est possible via différentes techniques, telles que celles de Langmuir-Blodgett ou d’immersion-retrait (dip coating). Ces techniques permettent d'élaborer des structures denses soit bidimensionnelles
[50–53-54] soit tridimensionnelles [55-56].
D'après la théorie de Hamaker, la force électrostatique d'attraction entre deux sphères est fonction de la distance les séparant [57]. A de grande distance de séparation, d, le potentiel d'attraction, ɸ, est proportionnel à d-6, alors qu'à de faibles distances ɸ est proportionnel à d-1.
Pour que l'autoassemblage soit possible, il faut que ɸ soit comparable à l'agitation thermique kT. Si ɸ <<kT alors l'assemblage n'est pas plus stable que l'état dispersé, il ne peut donc pas avoir lieu. Si ɸ >>kT alors les particules s'agrègent rapidement et n'ont pas la possibilité de s'auto-organiser. Une auto-organisation lente et une faible distribution des tailles de nanoparticules favorisent un ordre à longue distance [58,59]. La chimie de surface, la charge des particules, la présence de surfactants et la nature des nanoparticules jouent aussi des rôles importants [60]. Par exemple, les semi-conducteurs sont caractérisés par une attraction interparticulaire moindre que celle des métaux. Une distribution de tailles très étroite est nécessaire pour obtenir un réseau ordonné de nanoparticules semi-conductrices [61]. Collier et col [60] ont inventorié de nombreuses nanostructures formées à partir de solutions colloïdales de nanoparticules. Ces structures peuvent présenter des arrangements cubiques centrés, cubique à faces centrées [62] ou encore hexagonaux compacts [63].
1.3 Morphologies des motifs en surface.
Les différentes techniques de texturation de la surface, donnent lieu à la formation d’une variété de motifs en surface du substrat. Les propriétés des motifs en termes de taille et de morphologie dépendent de la technique utilisée pour le dépôt. Pour les techniques de texturation utilisant un masque, la morphologie des motifs reproduit le moule du masque et la taille dépend des paramètres de la technique tels que la taille et l’intensité du faisceau de graveur, le temps de texturation, la cinétique des réactions mises en jeu etc. Cependant, pour les techniques n’utilisant pas de masque la morphologie des motifs est gouvernée par les processus physico chimiques impliqués dans le procédé de texturation, tels que les processus de diffusion, d’adsorption, de cinétique des réactions mises en jeu. Parallèlement, les propriétés du substrat sont aussi à prendre en compte dans le procédé d’élaboration d’une morphologie donnée.
En solution aqueuse et en l’absence de masque, la technique électrochimique d’électrodépôt permet de préparer des surfaces texturées avec des motifs de morphologie variée. Dans ces conditions, la morphologie des motifs en surface est imposée soit par différents paramètres de la technique, tels que le potentiel, le temps d’électrodépôt, soit par les propriétés de l’électrode utilisée.
1.4 Propriétés spécifiques et applications
Lorsque les dimensions des nanomatériaux deviennent comparables à une grandeur physique caractéristique du système, par exemple le libre parcours moyen des électrons ou les parois de Blochs dans les matériaux magnétiques, leurs propriétés physico-chimiques individuelles sont radicalement différentes de celles du matériau massif [64]. Les champs d’applications des nanomatériaux sont très importants dans divers domaines, tels que celui de l’opto-électronique (polariseurs, interrupteurs tout optique), des verres fonctionnalisés, du stockage haute densité de l’information etc … [64].
De par la dimension des nanomatériaux, une nouvelle configuration apparaît qui leur confère des propriétés originales (physiques, thermiques, mécaniques etc…) imposées par les atomes de surface et non pas par ceux du volume. Par exemple, l’or est totalement inactif à l’échelle micrométrique alors qu’il devient un excellent catalyseur aux dimensions nanométriques [65]. La dimension d’assemblage des nanomatériaux est un autre paramètre qui détermine leurs propriétés. En effet, l’organisation des motifs en surface, leur taille et leur morphologie offrent à ces matériaux de nouvelles propriétés. Ces dernières résultent à la fois
de la taille des motifs, de leur organisation et des couplages physiques entre les motifs. Ceux-ci, les rendent de potentiels candidats à des applications dans différents domaines comme l’optique (matériaux photoniques) [64], la biologie (capteur) [66-67], la conversion de l’énergie (cellule photovoltaïque) [68], etc…
Les nanotechnologies et en particulier, les nanostructurations de surface ont toute leur place dans cet élan de développement de nouveaux matériaux exploitant les propriétés des nanomatériaux et apportant des avancées technologiques importantes dans divers domaines. Les matériaux nanostructurés en surface présentent un intérêt considérable tant d’un point de vue fondamental que technologique. En effet, à ce niveau, la matière présente des propriétés différentes et souvent étonnantes, et apporte des solutions à toute une série de problématiques actuelles par le biais de matériaux, composants et systèmes plus petits, plus légers et plus efficaces. De plus, en réalisant des matériaux et des processus destinés à un usage plus spécifique, la nanotechnologie permet l’économie des ressources et la réduction du volume des déchets et des émissions, ce qui entraîne un impact moindre sur la santé et l’environnement.
Dans divers domaines la réalisation de revêtements à partir de nanostructures permet de doter la surface de nouvelles fonctionnalités en termes d’aspect, de dureté, d’adhérence, de résistance à la corrosion, de mouillabilité et permet d’accroître leurs performances, de conductivité thermique ou électrique, de résistance mécanique, chimique ou thermique etc … tout en limitant les coûts de revient. Par ailleurs, ces matériaux sont souvent multifonctionnels, permettant de coupler diverses fonctions à la fois. Des exemples d’application dans divers domaines de la nanostructuration de la surface sont ci dessous :
Dans le domaine de l’optique, la structuration de la surface apporte plusieurs fonctionnalités à la surface. Elle permet de diminuer la réflexion et d’augmenter la capacité d’absorption de la lumière incidente [69-70]. Par ailleurs, elle permet aussi d’apporter une coloration à un matériau sans l’utilisation de colorant [71]. Au-delà de ses effets, la structuration de la surface peut présenter des caractéristiques très sélectives en longueur d’onde ou/et en polarisation. Cette propriété apporte à ces dispositifs la capacité de se comporter comme un filtre optique [64] que l’on peut ajuster par le contrôle des paramètres géométriques des motifs en surface.
Dans le domaine de la tribologie, la structuration de la surface est un paramètre important qui définit les performances d’un contact mécanique. Elle influence la qualité de la séparation des surfaces mais également le transport de lubrifiant et par conséquent le frottement et l’usure [72].
Dans le domaine des applications médicales, la micro et la nanostructuration de surface des implants est un paramètre à prendre en compte dans la réponse cellulaire. Des réactions osseuses positives ont été observées sur les implants dentaires, liées à leur nanostructuration
[73-75].
Dans le domaine des applications des revêtements anticorrosion, la nanostructuration de surface peut apporter d’autres propriétés intéressantes au matériau vis-à-vis de la protection contre la corrosion : propriétés mécaniques telles que la flexibilité et la solidité, et donc la résistance aux chocs. Tel est le cas du revêtement élaboré par Greer et al. avec Caltech présentant en surface des nanopiliers de 100 nm de diamètre de verre métallique riche en zirconium (Zr35Ti30Co6Be29) [76].
Dans le domaine des revêtements autonettoyants la nanostruturation de la surface est primordiale [77-79]. De nombreux travaux ont essayé de reproduire de façon artificielle la surface de la feuille de lotus qui est couverte de micro/nano textures. Par conséquent à cette topographie de surface l’eau ne remplit pas l’espace entre les textures de surface et repose sur de l’air. Cette configuration permet à la goutte d’eau de rouler sans adhérer à la surface, ce qui lui apporte la capacité d’emporter les poussières présentes sur la surface d’où la désignation de surface autonettoyantes. Ce phénomène est appelé effet lotus est sera exploré dans le cadre de ce travail de thèse pour différents films préparés par voie électrochimique. Par ailleurs, les propriétés de mouillage seront développées dans le chapitre suivant.
1.5 Conclusion
Les matériaux nanostructurés en surface constituent une classe de nanométariaux qui permet de combiner à la fois les propriétés à l’échelle du nanomètre ainsi que leur synergie pour soit amplifier celles excitantes soit en créer de nouvelles. La synergie entre les propriétés des motifs en surface résulte à la fois de la taille des motifs, de leur organisation et des couplages physiques entre les motifs. Selon les méthodes de préparation mentionnées dans ce chapitre, un contrôle de la taille, de la morphologie et de l’espacement entre les motifs est possible et ceci via les paramètres techniques de chacune des méthodes. Dans le cas des techniques utilisant un masque, les propriétés (la taille, de la morphologie et de l’espacement entre les motifs) des textures préparées dépendent de celles du masque. En revanche, pour les techniques n’utilisant pas de masque, les propriétés des textures sont imposées par les paramètres de la technique et les conditions d’élaboration.
Dans ce travail de thèse nous allons proposer une stratégie de texturation de la surface basée sur l’utilisation d’assemblage de nanoparticules métalliques comme sites préférentiels pour le dépôt électrochimique. Des performances spécifiques à notre approche seront mises en évidence.
2
Propriétés de mouillage
2.1 Introduction
La nature a été depuis toujours une source d’inspiration pour les scientifiques et les chercheurs, la superhydrophobie en est un exemple. Une surface est dite superhydrophobe lorsque sa surface est très difficile à mouiller, c'est le cas de la feuille de lotus (Fig. 1a-c), de la capucine ou de chou, il en est de même pour les plumes de canard qui restent sèches à la sortie de l’eau.
Bien que le phénomène de l’auto-nettoyage associé aux feuilles de lotus soit connu en Asie depuis au moins 2000 ans, son étude est assez récente. Ce n’est que depuis le début des années 70 avec l’introduction du microscope électronique que le phénomène lotus a été exploré par le botaniste Wilhelm Barthlott [81-83].
L'effet lotus est un phénomène de superhydrophobie causé par une rugosité hiérarchique de la surface à la fois microscopique et nanoscopique. Dans le cas de la feuille de lotus, la double structure est formée d'un épiderme. La couche extérieure s'appelle la cuticule où il y a une couche de cire. L'épiderme de la feuille est formé de papilles de quelques microns (Fig. 1d) sur lesquelles reposent les cires (Fig.1e et 1f). Cette couche de cire est hydrophobe et forme la deuxième composante de la double structure. Cette dernière confère à la surface de la feuille de lotus des capacités autonettoyantes : en s'écoulant, les gouttes d'eau emportent avec elles les poussières et les particules (Fig. 1g-1i).
Les phénomènes décrivant la propriété d’auto-nettoyage des surfaces superhydrophobes ont été identifiés dans les années 1970. Cette propriété est une conséquence de la formation d’une double structure à la surface superhydrophobe. Par ailleurs, la surface de contact, et avec elle la force d’adhérence entre surface et eau ou particules de saleté, est si réduite (Fig. 1g-1i) que cela aboutit à un auto-nettoyage (F.g. 2). La première analyse scientifique fondamentale eut lieu sur les feuilles de lotus par Barthlott et Neinhuis dans le milieu des années 90. Ces deux auteurs réussirent également la première transposition sur des prototypes techniques et les premières coopérations industrielles virent le jour. Depuis la fin des années 90 ce sont avant tout des scientifiques en physique et science des matériaux qui ont exploré ce phénomène de façon intensive et il existe entre-temps une littérature extrêmement importante ainsi que des douzaines de brevets qui découlent du brevet Lotus-Effekt®.
On devine l'intérêt pratique qu'il peut y avoir à élaborer de telles surfaces superhydrophobes : les gouttes les fuient, et elles restent sèches après une exposition à l'eau. Il s’agit d’un phénomène purement physico-chimique que l’on peut appliquer de façon biomimétique à des surfaces techniques. Stimulés par les applications potentielles (lunette autonettoyante et antibuée, pare-brise anti-pluie, revêtement antigivre, vêtement intâchable, peintures anti-humidité) les chimistes et les physiciens ont multiplié depuis les années 1990 les procédés pour fabriquer de telles surfaces. Avec l’émergence des nanotechnologies et le développement des outils de fabrication, de nouveaux procédés ont vu le jour. Actuellement il est bien établi que pour élaborer des surfaces superhydrophobes, il est nécessaire de réaliser des surfaces avec la coexistence de deux propriétés : une propriété chimique traduite par une faible tension de surface et une propriété physique traduite par la création d’une rugosité hiérarchique.
Figure 1: Images montrant la surface superhydrophobe et autonettoyante du Lotus. (a)une plante à
fleurs de lotus, (b) une feuille de lotus contaminée avec de l'argile et (c) diparition des particules adhérentes par l'eau. (d-f) des clichés en MEB montrant la surface des feuilles de lotus avec différents
grossissements. (g) une goutte d'eau sphérique sur une feuille superhydrophobe. (h) des particules lipophiles adhèrent à la surface d'une goutte d'eau, en roulant sur la feuille de lotus. (i)un cliché en
MEB d'une goutte illustre la faible mouillabilité, sur la surface des feuilles micro-structurées superhydrophobes
Le premier produit commercial qui mimique l’effet lotus a vu le jour en 1999 et consiste en une peinture auto-nettoyante pour façades (Lotusan®). Il existe avec ce seul produit environ 50 000 bâtiments dans le monde qui ont été enduits de “revêtements-Lotus”. D’autres secteurs de l’industrie ont adopté cette technologie. Les verres auto-nettoyants de la société Ferro GmbH constituent un autre domaine d’utilisation : ils ont été installés dans les capteurs optiques situés aux péages des autoroutes allemandes. La Société EVONIK AG a, quant à elle, développé des prototypes de laques et de matières plastiques. Dans le domaine du textile une entreprise italienne a appliqué le principe de l'effet lotus à des tissus [84].
( a)
( b)
Figure 2: Schéma montrant le principe de l’auto nettoyage sur une surface superhydrophobe: une
goutte roule sur la surface en ramassant la saleté et l'emporte avec elle
Cette propriété superhydrophobe est explorée dans le cadre de cette thèse, pour des systèmes artificiels que nous préparons avec notre approche.
2.2
Rappels sur la mouillabilité
Le mouillage est l’étude du comportement d’une goutte ou d’un film liquide en contact avec un solide ou un autre liquide dans un environnement donné (gaz, liquide). Le système tri phasique (substrat, liquide déposé/ fluide environnant) peut évoluer plus ou moins rapidement vers un état d’équilibre thermodynamique. Pour une goutte liquide, cet état est caractérisé par une valeur finie de l’angle de raccordement entre les interfaces solide/liquide et liquide/fluide environnant. Si le liquide s’étale sur le substrat pour former un film, il est alors caractérisé par un angle de contact nul. La compréhension des phénomènes de mouillage, d’hydrophilie et d’hydrophobie est indispensable au développement d’applications dans des domaines aussi variés que l’optique, l’aéronautique, le bâtiment etc.
Les films sont qualifiés « hydrophiles » quand l’angle de contact est plus faible que 90° et « hydrophobes » quand l’angle de contact dépasse les 90°. Les films superhydrophobes présentent un angle de contact très élevé (angle de contact > 150°) et un hystérésis d’angle de contact très faible [85]. Les films superhydrophiles sont carcatérisées par des angles de contact très faible (angle de contact < 10°).
Pour décrire le phénomène de mouillage il est nécessaire dans un premier temps, de rappeler la notion de tension de surface à l’origine de ce phénomène. Nous décrivons alors dans la suite le mouillage des surfaces homogènes et hétérogènes.
2.2.1 La tension de surface d’un liquide pur
Les forces de cohésion entre les molécules d’un liquide sont responsables de la tension de surface. Les molécules au sein du liquide sont en effet soumises à des forces attractives égales (en moyenne) dans toutes les directions, alors que celles situées à la surface du liquide échangent moins d’interactions (Fig. 3). Ce déficit de liaisons est à l’origine de la tension de surface d’un liquide et l’augmentation de l’énergie sa surface [86-88].
Figure 3: Shéma montrant la modélisation des forces de cohésion entre les molécules à la surface et
au sein d’un liquide.
Une expression de la tension de surface peut être obtenue par un modèle énergétique simple. Lorsque l’on augmente la surface libre d’une quantité élémentaire, il faut transférer des molécules vers la surface. Le travail élémentaire dW qu’il faut fournir pour augmenter la surface de dA s’écrit alors :
dA
dW L. (7)
Avec γL la tension de surface du liquide. L’ordre de grandeur de cette quantité γL s’obtient en divisant une énergie d’interaction de Van der Waals typique par une surface moléculaire:
γ
L= kT/a2 (8)Les liquides usuels ont en effet une tension de surface comprise entre 16 mN/m pour l'éther et 72 mN/m pour l'eau. Les métaux et les produits minéraux (le verre en particulier) sont plus cohésifs et leur tension est en général de quelques centaines de mN/m. Un liquide minimise spontanément son énergie de surface, c'est pourquoi une goutte de pluie est sphérique.
2.2.2 La loi de Laplace
Un liquide qui présente une courbure est caractérisé par un saut de pression lorsque l’on traverse cette interface courbée. Cette différence de pression, P, entre la pression extérieure (pression atmosphérique par exemple) et l’intérieur du liquide en un point de l’interface est donnée par la formule de Laplace :
2 1 1 1 r r P (9) x x x A ir Vo lume Inter face
avec r1 et r2 les rayons de courbures principaux. Il est possible d’appliquer cette relation dans le cas du remplissage d’un capillaire de rayon R. Si l’on assimile le ménisque à une calotte sphérique, les deux rayons de courbures sont égaux, avec r1 = r2 =R/cosθ, où θ est l’angle de contact du ménisque sur la paroi du tube. L’équation 8 peut alors se reécrire de la façon suivante :
R P 2 cos /
(10)
2.2.3 La longueur capillaire
En pesanteur et en dehors de toute autre champ externe, deux forces agissent sur une goutte posée : les forces de tension superficielle (les forces capillaires) et les forces gravitationnelles (pesanteur). Afin de s’assurer que les forces gravitationnelles jouent un rôle négligeable à la fois dans le profil de la goutte et dans le mouillage, le rayon R0 de l’aire de contact de la goutte doit obéir à une des deux équations 11 et 12 ci-dessous:
R0 < g lc (11)
avec lc est la longueur capillaire caractéristique de chaque liquide, γ et ρ représentant respectivement la tension de surface et la masse volumique du liquide et g est l’accélération de la pesanteur. Cette longueur caractérise le rapport des forces de tension superficielle et de pesanteur s'exerçant sur une interface. Elle est de l'ordre de 2,7 mm pour une solution aqueuse sur terre. Cette longueur est bien caractéristique de la taille d’une goutte lorsqu’elle commence à s’étaler pour devenir une flaque. Sur cette dernière, les effets capillaires ne jouent plus que sur les bords (ils déterminent également la hauteur de la flaque).
De façon équivalente : 2 0 0 gR B < 1 (12)
où Bo est le nombre de Bond [88] caractérisant la balance entre les effets gravitationnelles et capillaires de la goutte. Le nombre de Bond caractérise entre autres la déformation d'une goutte d'un liquide. Lorsque le nombre, Bo, de la goutte est plus petit que 1 la goutte reste
sphérique car la tension superficielle l'emporte sur la gravité. À l'inverse si Bo est grand la
goutte s'aplatit sous l'effet de la gravité.
2.3 Mouillabilité des surfaces homogènes
Une goutte de liquide déposée sur une surface solide parfaitement lisse et horizontale, homogène du point de vue chimique, adopte à l’équilibre une conformation fonction des interactions entre le liquide et le solide, et des interactions entre le solide et le milieu environnant. En l’absence de toute réaction chimique d’interface, les interactions échangées sont de types Van der Waals et éventuellement des interactions acide-base. A l’équilibre le système minimise son énergie et dans le cas d’un mouillage partiel, la goutte prend la forme particulière d’une calotte sphérique si le volume déposé est petit (la force de gravité étant négligeable). Dans ce cas, l’équation de Young relie l’angle de contact formé par le raccordement du liquide avec le solide et les énergies interfaciales du système :

![Figure 6 : Schéma des différentes étapes impliquées aux stades initiaux de l’électrodépôt [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/14536157.724118/20.892.292.660.731.1014/figure-schéma-étapes-impliquées-stades-initiaux-l-électrodépôt.webp)

![Figure 10: (a) Schéma de l’étalement/séchage d’une suspension colloïdale sur tournette (spin- (spin-coating)[39], (b) Schéma de l’étalement/séchage d’une suspension colloïdale sur substrat immergé](https://thumb-eu.123doks.com/thumbv2/123doknet/14536157.724118/27.892.179.763.294.552/schéma-étalement-suspension-colloïdale-tournette-étalement-suspension-colloïdale.webp)