FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DES SCIENCES AGRONOMIQUES
Réf : ……./UAMOB/F.SNV.ST/DEP.AGR/2018
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Agronomiques
Spécialité : Protection des végétaux
Présenté par :
IDRIGUENE Lydia & ABERKANE Farida
Thème
Etude du pouvoir insecticide et fongicide de
l’extrait éthanolique de Pistacia lentiscus
Soutenu le :
01 / 07 / 2018Devant le jury composé de :
Mme SAYAH Siham MAB Univ Bouira présidente Mme BOUBEKKA Nabila MCB Univ Bouira promotrice Mme MAHDI Khadidja MCB Univ Bouira Examinatrice
Avant tout nous remercie Dieu tout puissant qui nous a donné le courage, la
patience, la volonté et la force pour réaliser ce travail ;
Nous tenons s à exprimer nos sincères remerciements à Mme BOUBEKKA
Nabila qui nous
A accordé sa totale confiance, sa grande expérience, ses précieux conseils qui
ont permis le bon déroulement et l’aboutissement de ce travail.
Nous adressons d’immenses remerciements aux membres du jury réunis autour
de mon mémoire, notamment, pour leur lecture certainement attentive et
enrichissante.
A Mme SAYAH Siham .pour l’honneur qu’elle nous a fait en présidant
notre membre jury.
A Mme MAHDI Khadidja pour nous avoir fait l’honneur d’examiner ce
travail.
Nous somme également reconnaissante à tous les responsables pour leur
accueil chaleureux et leur gentillesse.
Nous tenons aussi à exprimer notre gratitude à tous les professeurs et
enseignants qui ont collaboré à notre formation depuis notre premier cycle
d’étude jusqu’à
la fin de notre cycle universitaire.
Merci à tous.
Dédicaces
Je dédie ce travail :A mes très chers parents à qui je dois ma réussite et ma joie
A mes adorables sœurs et cher frères
A mon cher époux
A ma belle famille
A tous mes ami(e)s
A tous ceux de ma promotion 2013, mes collègues du département
D’Agronomie ainsi qu’à tous ceux qui m’ont apporté
Leur aide de près ou de loin pour la réalisation de ce modeste travail.
Dédicaces
Je dédie ce travail :A mes très chers parents à qui je dois ma réussite et ma joie,
A mes adorables sœurs et mes chers frères ;
A toute ma famille
A tous mes ami(e)s
A tous ceux de ma promotion 2013, mes collègues du département
D’agronomie ainsi qu’à tous ceux qui m’ont apporté
Leur aide de près ou de loin pour la réalisation de ce modeste travail.
Marina
Pistacia lentiscus subsp. emarginata. Vert= Pistacia lentiscus subsp. Lentiscus……….2
Figure 2 : Arbrisseau de Pistacia lentiscus………..4
Figure 3 : Feuilles et fruits de pistachier lentisque………..4
Figure 4: (A) Brunissement diffus des tiges, (B) Nœud brun violacé, (C) Attaque superficielle de la tige, (D) Tache brune sous forme de trait de plume, (E) Brunissement diffus de la gaine……….9
Figure 5 : Cycle parasitaire des fusarioses des céréales……….10
Figure 6 : Morphologie d’un puceron ailé………..14
Figure 7 : Représentation schématique du cycle de vie des pucerons en régions tempérées………...15
Figure 8 : Carte limites administratives de la wilaya de Bouira………..21
Figure 9 : Puceron Aphis nasturtii observé sous microscope optique (original)……….24
Figure 10 : Schéma résumant les différentes étapes du travail expérimental………..26
Figure 11 : Séchage et broyage des feuilles de pistachier………27
Figure 12 : Etapes de préparation de l’infusé………..28
Figure13 : Extraction par soxhlet de l’extrait éthanolique du pistachier lentisque…………..29
Figure 14 : Test de l’activité insecticide de l’extrait éthanolique de pistachier lentisque…..30
Figure 15: Isolement à partir des tiges de blé………..32
Figure 16: Apparition des champignons………..32
Figure 17 : Evolution de la mortalité des adultes d’A.nasturtii en fonction du temps et des doses de l’extrait éthanolique de Pistacia lentiscus………..39
Figure 18 : Evolution de la mortalité des larves d’A.nasturtii en fonction du temps et des doses de l’extrait éthanolique de Pistacia lentiscus……….40
Figure 19 : Variation de la mortalité corrigée des différentes doses de l’extrait éthanolique du Pistacia lentiscus sur les adultes d’Aphis nasturtii………..41
Figure 20 : Variation de la mortalité corrigée des différentes doses de l’extrait éthanolique du Pistacia lentiscus sur les larves d’Aphis nasturtii………41
Figure 21 : Figure 20 : Croissance mycélienne après 216h………43
Figure 22 : Vitesse de la croissance mycélienne du Fusarium sp sous l’effet de l’augmentation de la concentration d’extrait éthanolique des feuilles de Pistacia lentiscus par rapport aux témoins……….44
Tableau 1 : Valeurs de dilutions utilisées………34
Tableau 2 : Résultats du screening chimique de Pistacia lentiscus………37
Tableau 3 : Croissance mycélienne (mm) de Fusarium sp en fonction du temps et de la concentration (C) d’extrait éthanolique de Pistacia lentiscus et de l’éthanol……….42
Introduction ……… ………..1
CHAPITRE I : Synthèse bibliographique I.1- Synthèse bibliographique sur le Pistachier lentisque (Pistacia lentiscus)……….2
I.1.1- Pistacia lentiscus………...2
I.1.2-Habitat et répartition de l’espèce Pistacia lentiscus………...2
I.1.3- Systématique de Pistachier lentisque………3
I.1.4- Description botanique de Pistacia lentiscus………..3
I.1.5-Exigences écologiques de Pistachier lentisque………..5
I.1.6- Usage de Pistacia lentiscus ………....5
I.1.7- Principaux composants phytochimiques………...6
I.2- Synthèse bibliographique sur les extraits végétaux………6
I.2.1-Méthode d’obtention des extraits végétaux………7
I.2.2-Domaine d’utilisation des extraits végétaux………..7
I.3- Synthèse bibliographique sur Fusarium sp………..8
I.3.1-Généralités………..8
I.3.2- Systématique………...8
I.3.3- Symptomatologie………..9
I.3.4- Cycle de vie ………11
I.3.5. Moyens de lutte………..11
I.4. Synthèse bibliographique sur les pucerons………13
I.4.3 - Cycle biologique……….15
I.4.4 - Dégâts causés par les aphides……….16
I.4.5- Facteurs de développement et de régression des populations des pucerons…………...18
I.4.6 - Lutte contre les pucerons………18
CHAPITRE II : Présentation de la région d’étude II.1- Présentation administrative et géographique de la zone d’étude……….20
II.1.1- Présentation administrative de la wilaya ………..20
II.1.2- Situation géographique………..20
II.1.3- Paysage géographique………21
II.2- Choix de la région d’étude………22
II.3- Données climatiques……….22
II.3.1- Précipitations ………22
II.3.2- Températures………...22
II.3.3- Humidité……….22
II.3.4- Evaporation……….23
II.3.5- Vents………23
CHAPITRE III : Matériel et méthodes IIӀ.1- Matériels utilisés………..24
IIӀ.1.1- Matériel biologique………...24
IIӀ.1.2- Matériel non biologique………25
IIӀ .2- Méthodologie……….25
IIӀ.2.3- Extraction par soxhlet………..29
IIӀ.2.4- Etude de l’activité insecticide ……….…….29
IIӀ.2.4.1- Mode opératoire ………30
IIӀ.2.4.2 -Analyse des données………..30
III.2.5. Etude de l’activité antifongique………31
III.2.5.1. Méthode d’obtention des souches pures de champignon étudié (Fusarium sp)……31
IIӀ.2.5.1.1. Préparation du milieu de culture………31
IIӀ.2.5.1.2. Isolement………31
IIӀ.2.5.1.3. Identification………..33
IIӀ.2.5.1.4. Repiquage et purification………33
IIӀ.2.5.2. Effet fongicide de l’extrait éthanolique de Pistachier lentisque……….33
IIӀ.2.5.2.1. Préparation des différentes concentrations de l’extrait éthanolique ………..34
IIӀ.2.5.2.2.Confrontation direct sur le milieu de culture………...34
IIӀ.2.5.2.3.Evaluation de la croissance mycélienne de Fusarium sp……….34
Chapitre IV: Résultats et discussion
IV.1- Résultats du screening phytochimique . . . 37IV.2- Effet insecticide de l’extrait éthanolique du Pistacia lentiscus . . . 37
IV.2.1.1-Effet insecticide de l’extrait éthanolique du Pistacia lentiscus sur les adultes d’Aphis nasturtii………..……….37
IV.2.1.2- Effet insecticide de l’extrait éthanolique du Pistacia lentiscus sur les larves d’Aphis nasturtii………37
IV.2.2.2- Mortalité corrigée de l’extrait éthanolique du Pistacia lentiscus des larves d’Aphis
nasturtii………39
IV.3- Etude de l’activité antifongique d’extrait éthanolique des feuilles de Pistacia lentiscus………40
IV.3.1- Evaluation de la croissance mycélienne………..40
IV.3.2- Vitesse de la croissance mycélienne de Fusarium sp……….41
IV.3.3-Taux d’inhibition………..42
Conclusion générale……….46
Références bibliograohiques………48 Annexes
Les plantes médicinales sont utilisées depuis l’antiquité, pour soulager et guérir les maladies humaines. En fait, leurs propriétés thérapeutiques sont dues à la présence de certaines, voire des milliers de composés naturels bioactifs appelés : les métabolites secondaires (BOUDJOUREF, 2011). Selon CROSBY (1966), l‘utilisation des extraits de plantes comme insecticide est connu depuis longtemps, en effet le pyrèthre, la nicotine et la roténone sont déjà connu comme agents de lutte contre les insectes. D’après (ANKITA et DWIVEDI, 2012) les extraits de plantes possèdent aussi un effet fongicide.
La position géographique particulière de notre pays en région méditerranéenne et de l’impressionnant gradient bioclimatique Nord-Sud, a fait qu’une grande diversité de biotope occupée par une importante richesse floristique le caractérise. Comptant une panoplie d’écosystèmes. L’Algérie est connue par sa diversité en ressources végétales, parmi lesquelles cet arbre spontané qui pousse sur tout le bassin méditerranéen : porte le nom de pistachier lentisque (Pistacia lentiscus).
Le Pistachier lentisque est un arbre aux usages multiples, il est connu par sa vaste utilisation en médicine traditionnelle, dentisterie, cosmétique, alimentaires, industrie et en pharmacie. Malgré l’intérêt qu’il possède, peu de travaux scientifiques ont été réalisés sur son utilisation en lutte contre les ravageurs et les maladies des cultures. Ceci, nous a incités à étudier l’activité insecticide et fongicide des métabolites secondaires de cette plante à travers son extrait éthanolique.
C’est dans ce contexte que ce présent travail, vise à déterminer les métabolites secondaires du Pistachier lentisque et à tester l’activité insecticide et l’activité antifongique de l’extrait éthanolique du Pistacia lenticus.
Ce mémoire est structuré en quatre chapitres répartir en parties : Le premier chapitre constitue l’étude bibliographique ;
Le deuxième chapitre présent la région d’étude ;
Le troisième chapitre traite la phase expérimentale en deux parties ;
-la première partie s’intéresse au matériel étudié, au corpus d’étude (échantillons) ;
-la deuxième partie se focalise sur Screening phytochimique, étude de l’activité insecticide et de l’activité antifongique du Pistacia lentiscus.
Le quatrième chapitre est consacré à la description et la discussion des résultats obtenus. Des références bibliographiques et des annexes viennent compléter le texte élaboré en mémoire inauguré par une introduction générale et clôturé par une conclusion.
Chapitre I - Synthèse bibliographique
La première partie de ce mémoire sera consacrée à la synthèse bibliographique regroupant les principales informations sur la plante médicinale Pistacia lentiscus et des généralités sur les extraits végétaux, la fusariose et les pucerons.
I.1- Synthèse bibliographique sur le Pistachier lentisque (Pistacia lentiscus)
I.1.1- Pistacia lentiscus
C’est un arbre dispersé généralement dans l’Algérie au-dessus du littoral entier (LEV et AMAR, 2000). Il joue un rôle fondamental dans l’entretient des écosystèmes par sa forte résistance aux changements climatiques (SEIGUE, 1985).
Le terme Pistacia est issu du grec pistaké qui signifie arbre à résine et lentiscus vient du latin lentus qui veut dire visqueux (OZTURK et al. 2010).
I.1.2-Habitat et répartition de l’espèce Pistacia lentiscus
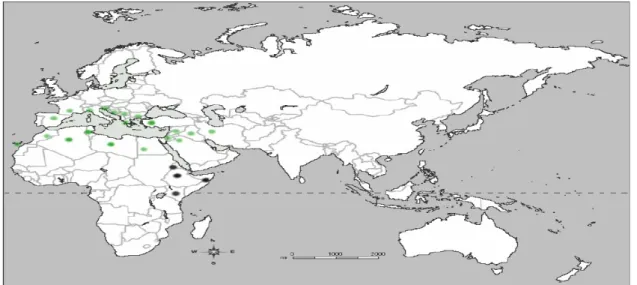
Pistacia lentiscus est une espèce commune caractérisant la région méditerranéenne, où il contribue à constituer les forêts, les broussailles, et les maquis, on le trouve à l’état naturel dans toute l’Algérie (le nord algérien) (Fig.1) (QUEZEL et SANTA, 1993; QUEZEL, 2000 et RAMEAU et al. 2008).
Figure 1: Carte de distribution du lentisque (Pistacia lentiscus) dans le monde. Noir= Pistacia lentiscus subsp. emarginata. Vert= Pistacia lentiscus subsp. lentiscus (AL-SAGHIR,
I.1.3- Systématique du Pistachier lentisque
Selon GUIGNARD et DUPONT (2004) et PELL (2004) Pistacia lentiscus est classée comme suivant :
Embranchement : Spermatophytes. Sous- embranchement : Angiospermes Classe : Dicotylédones Sous-classe : Rosidees Ordre : Sapindales Famille : Anacardiaceae Genre : Pistacia
Espèce : Pistacia lentiscus Noms vernaculaires
Le pistachier lentisque est connu sous l’appellation de : Tidekth, Amadagh en kabyle, Darou, Edharw ou drou en arabe local, lentisque et arbre au mastic en Français et lentisk en Anglais (CHERAFT, 2011).
I.1.4- Description botanique de Pistacia lentiscus
C’est un arbrisseau de 1 à 3 mètres de hauteur (Fig.2), courant en sites arides de la région méditerranéenne (de l’Asie, l’Europe, l’Afrique, jusqu’aux Canaries) (BELAKHDAR, 2003).
Figure 2 : Arbrisseau
Les feuilles sont persistantes, paripennées, avec 4 à 10 folio pétiole est nettement ailé (Fig.
Les fleurs : brunâtres, constituent des denses grappes spiciformes. Elles sont à de petites drupes rouges, puis noires à maturité, sub globuleuses
On différencie les fleurs femelles (vert jaunâtre) des fleurs males (rouge foncé) grâce à leur couleur. Les fleurs mâles et femelles poussent sur des arb
Mars à Mai (BELFADEL, 2009).
Le Fruit : Est une baie globuleuse (de 2 à 3 mm) de diamètre, monosperme, sa couleur est d’abord rouge, et devient brunâtre à sa maturité, qui est complète à l’auto
Le Mastic : Si l'on incise le tronc de ce végétal, il s'en écoule un suc résineux nommé Mastic qui, une fois distillé, fournit une essence employée en parfumerie
Arbrisseau de Pistacia lentiscus (BELFADEL, 2009)
feuilles sont persistantes, paripennées, avec 4 à 10 folioles coriaces et luisantes et le Fig.3).
Les fleurs : brunâtres, constituent des denses grappes spiciformes. Elles sont à de petites drupes rouges, puis noires à maturité, sub globuleuses (BOULLARD,
On différencie les fleurs femelles (vert jaunâtre) des fleurs males (rouge foncé) grâce à leur couleur. Les fleurs mâles et femelles poussent sur des arbustes différents. Floraison
, 2009).
Le Fruit : Est une baie globuleuse (de 2 à 3 mm) de diamètre, monosperme, sa couleur est d’abord rouge, et devient brunâtre à sa maturité, qui est complète à l’auto
ise le tronc de ce végétal, il s'en écoule un suc résineux nommé Mastic qui, une fois distillé, fournit une essence employée en parfumerie
, 2009)
coriaces et luisantes et le
Les fleurs : brunâtres, constituent des denses grappes spiciformes. Elles sont à l’origine (BOULLARD, 2001).
On différencie les fleurs femelles (vert jaunâtre) des fleurs males (rouge foncé) grâce à ustes différents. Floraison est de
Le Fruit : Est une baie globuleuse (de 2 à 3 mm) de diamètre, monosperme, sa couleur est d’abord rouge, et devient brunâtre à sa maturité, qui est complète à l’automne.
Figure 3 : Feuilles et fruits du pistachier lentisque (BELFADEL, 2009)
I.1.5- Exigences écologiques du Pistachier lentisque
Le pistachier lentisque est un arbrisseau qui préfère les sols siliceux et sec, il se développe sur des sols calcaires, une plante considérée comme thermophile et xérophile. C’est une espèce indifférente aux propriétés physico-chimiques du sol mais préfère des sols à faible concentration en phosphore et potassium conjugués avec des concentrations différentes en carbonates de calcium et en azote (DOGAN et al. 2003). Du part son houppier composé de branches imbriquées et dense, le lentisque assure la protection du sol et crée les conditions favorables pour l’humification de la matière organique et l’enrichissement de ses propriétés biologiques (DIAZ BARRADAS et CORREIA, 1999).
Son système radiculaire est puissant et bien développé, s'accrochant sur les pentes rudes et les terrains rocheux, c'est un couvre sol idéal.
I.1.6- Usage de Pistacia lentiscus
Le lentisque est un arbre aux usages multiples : s’il est essentiellement exploité pour la résine qu’il secrète dans ses tiges, on se sert également de ses feuilles, de son bois et de ses fruits pour des usages alimentaires, domestiques ou médicinaux. Quant aux racines, elles seraient capables d’émettre, lorsqu’elles sont vieilles, une certaines luminescence (RIVERA-NUÑEZ et OBÕN DE CASTRO, 1991).
La résine a été utilisée en Europe, au début du siècle, en médecine (comme antidiarrhéique, antiscorbutique), en dentisterie (pour l’occlusion des dents cariées) et pour la
fabrication de vernis et de colles (DORVAULT, 1928). Cette résine est connue par son effet analgésique, antibactérien, antifongique, antioxydant, antithérogenique, expectorant, stimulant, diurétique et spasmolytique (ABDEL RAHMAN et SOAD, 1975 ; MAGIATIS et al. 1999 ; DEDOUSSIS et al. 2004). Par conséquent, cliniquement, le mastic est souvent cité comme un remède efficace contre certaines maladies telles que l'asthme, diarrhée, infections bactériennes, ulcères gastroduodénaux et comme un agent antiseptique du système respiratoire (BAYTOP, 1984; HUWEZ et Al-HABBAL, 1986; Al-Said et al. 1986; TUZLACI et al. 2001; MARONE et al. 2001).
Les feuilles disposent d’une action anti-inflammatoire, antibactérienne, antifongique, antipyrétique, astringente, hépatoprotective, expectorante et stimulante (VILLAR et al.
1987; MAGIATIS et al. 1999; PARASCHOS et al. 2007; JANAKAT et AL-MEIR, 2002; KORDALI et al. 2003). Elles sont également utilisées dans le traitement d’autres maladies telles que l’eczéma, infections buccales, diarrhées, lithiases rénales, jaunisse, maux de tête, ulcères, maux d'estomac, asthme et problèmes respiratoires (VILLAR et al. 1987 ; ALI-SHTAYEH et al. 1999 ; ALI-SHTAYEH et al, 2000; LEV et AMAR, 2002 ; SAID et al. 2002).
La décoction des racines séchées est efficace contre l’inflammation intestinale et d’estomac ainsi que dans le traitement de l’ulcère (OUELMOUHOUB, 2005).
I.1.7- Principaux composants phytochimiques
Les composés phytochimiques (métabolites secondaires) du pistachier peuvent être extraits à partir de différentes parties de l’arbre. Par hydrodistillation des feuilles, une huile essentielle peut être extraite. Une analyse par spectroscopie de masse révèle plus d’une centaine de composés représentés majoritairement par le myrcène, le limonène et le β gurjunène. En outre, l’huile essentielle provenant des fruits est caractérisée par une forte proportion d’α-pinène, de limonène et de terpinéol. A partir du tronc du pistachier exsude un mastic appelé gum. Cette partie de la plante est la plus étudiée. Elle renferme un très grand nombre de composés bioactifs d’intérêt médical et pharmacologique. L’huile essentielle provenant du mastic a également été étudiée. Son analyse a mis en évidence la présence de composés biologiquement actifs tels que l’α-terpinéol. Parmi les composés majoritaires identifiés nous pouvons citer : α et β pinène, β myrcine et le camphene (DJENANE et al. 2011 ; ARAB et al. 2014).
I.2- Synthèse bibliographique sur les extraits végétaux
Les extraits sont des préparations liquides, obtenues à partir de drogue végétale généralement à l’état sec. Un extrait végétal est un ensemble composé de molécules volatiles, odorantes renfermées dans les organes producteurs de certains végétaux extraites de celle-ci par différentes méthodes d’extraction. Ces substances se trouvent dans les feuilles et les fleurs, mais également dans les graines, les racines, les écorces des plantes (BENSAID, 2011).
I.2.1-Méthode d’obtention des extraits végétaux
Selon BENSAID (2011), l’extraction est une opération qui consiste à séparer certains composés d’un organisme selon diverses techniques. L’extraction de molécules organique est une phase primordiale dans les domaines de la chimie des substances naturelles et de la chimie thérapeutiques.
Les techniques d’extraction sont nombreuses et leur mise en œuvre, est plus au moins facile. Certains sont utilisés de longue date par l’homme d’autres sont le résultat d’avancées récentes. Chaque procédé à un type de matière première dans la quête de son essence et toute ont pour but de récupérer un corps pur (arome, médicament…) nous citons :
-
Décoction : Les plantes finement divisés sont placés dans de l’eau froide ou un autre solvant et le tout est porté à ébullition.-
L’infusion : Les végétaux finement divisés sont trempés dans l’eau bouillante ou dans tous autre solvant à chaud, de façon à y dissoudre les principes actifs. Ce procédé est utilisé pour la préparation des tisanes.-
La macération : Les végétaux finement divisés sont trempés à froid, dans un liquide pour en extraire les constituants solubles.I.2.2-Domaine d’utilisation des extraits végétaux
Les extraits végétaux sont connus et utilisé dès l’antiquité dans plusieurs domaines tels que : la parfumerie, le cosmétique, la pharmacie, l’industrie…..etc.
En médecine : selon AMJAD (2005), les essences sont utilisés tant que médicament pour l’homme notamment contre le diabète
En cosmétique : d’après PORTER (2011), les extraits trouvent plusieurs secteur d’application en cosmétique pour des produits de beauté, des parfums….etc.
En protection des végétaux : en plus des services que rendent ces extraits à l’homme, certains plantes se sont montrées actives contre les insectes ravageurs, et de ce fait auraient un intérêt dans le domaine de la protection des végétaux. Sont utilisées dans le souci de lutter contre les insectes ravageurs surtout ceux des denrées stockées, et cela grâce à leur molécule chimiques a propriétés insecticides, les premières recherches ont été orientés vers l’utilisation des extraits de plantes contre les acariens, nématodes, les insectes notamment acridiens et lépidoptères (BENSAID, 2011).
Selon SEFTA(1999), les extraits foliaires de la fleur bleue d’aube Ipomea leari et du lantanier Lantana Camara montrent des effets répulsifs vis-à-vis de Phthorimaea operculella.
Le même phénomène a été observé avec les extraits foliaires de Melia azedarach et d’eucalyptus globulus (BOUDJEMAA ,1999).
I.3- Synthèse bibliographique sur la fusariose
I.3.1-Généralités
La fusariose est une maladie des céréales dite « à petits grains » que l’on retrouve partout dans le monde. La fusariose peut être causée par une vingtaine d’espèces du genre Fusarium (PARRY et al. 1995) dont le nom donné est relié à l’allure fusiforme de ses spores (PAGEAU et FILLION, 2009).
Le genre Fusarium tire son nom du latin fusus car ses spores sont en forme de fuseau. La première et véritable description du genre Fusarium a été réalisée par LINK (1809), ce dernier a créé le genre pour des espèces présentant des spores cloisonnées, fusiformes, formées sur des stromas ; ses descriptions sont basées sur l’observation d’un « Fusarium roseum », mais aujourd'hui l'espèce type est F. sambucinum.
I.3.2- Systématique
Ce genre est classé dans les Deutéromycètes, il appartient à la famille des Tuberculariaceae, l’ordre des Moniliales, la classe des Hyphomycetes. Ce genre se rapporte aux Hypocréales (Ascomycota), et les formes sexuées (téléomorphes) de plusieurs espèces appartiennent au genre Gibberella (Nectriaceae, Hypocreales, Hypocreomycetidae,
Sordariomycetes, Ascomycota, Fungi) et un certain nombre au genre Nectria (Nectriaceae, Hypocreales, Ascomycètes) (KEITH et SEIFERT, 2001; LESLIE et SUMMERELL, 2006). I.3.3- Symptomatologie
Les fusarioses sont des maladies qui peuvent attaquer les céréales du semis à la récolte, des racines aux épis (CARON, 2000).
1. Symptômes sur la partie basale des plantes du blé
Les symptômes se manifestent par des nécroses sur les talles inferieurs, le collet, entre nœuds, et brunissement de la partie supérieure des racines (SCHILLING et al. 1996 ; AGRIOS, 2005) (Fig.8).
2. Symptômes sur la tige et les nœuds
On observe les symptômes de la montaison jusqu’à la maturité : - Taches brunes sous forme de trait de plume. Absence de stroma. -Le plus souvent, un anneau brun violacé est observé sur les nœuds. -Une tache diffuse entre le plateau de tallage et le premier nœud. -Plusieurs taches nettes entre le plateau de tallage et le deuxième nœud. -Nœuds nécrosés avec parfois présence de mycélium rose violacé (Fig.4).
Figure 4 : Symptômes : (A) Brunissement diffus des tiges, (B) Nœud brun violacé, (C) Attaque superficielle de la tige, (D) Tache brune sous forme de trait de plume, (E)
Brunissement diffus de la gaine. (ARVALIS, 2015) 3. Symptômes
Epi : une partie ou la totalité des épillets peuvent être échaudées, le champignon peut attaquer les glumes, l’attache d’un épillet, le rachis ou le col de l’épi après la floraison, il peut avoir un dessèchement précoce suite aux attaque des espèces de Fusarium. Une coloration rose clair ou saumon peut apparaitre à la base ou tout au long des épillets infestés suite à une sporulation abondante du champignon. L’attaque sur le col et le rachis de l’épi donne une coloration brune violacée (CLAVEL, 2006 ; CARVER, 2009).
Grains : selon l’attaque, les grains peuvent être peu échaudés (attaque tardive), très échaudés, voir avortés (fortes attaques début floraison). Les grains peuvent donner un aspect sain mais contienne nt des mycotoxines (DAMMER et al. 2011).
A
B
C
Feuilles : en fin montaison, on peut observer des taches ovales, verdâtres devenant ensuite marron, puis se desséchant souvent au bord de la feuille ; en attaque grave, les taches se rejoignent induisant la déchirure de la feuille dans le sens de la longueur (CLAVEL, 2006). I.3.4- Cycle de vie
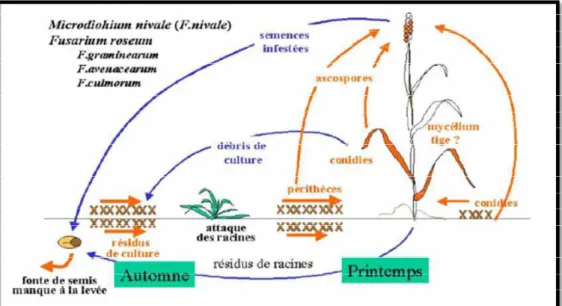
Sur les parcelles de blé, les grains sont la principale source de Fusarium. Toutefois, le champignon peut également survivre sur les débris du sol. Lors des périodes de forte hygrométrie pendant la floraison et la formation des grains, les spores sont dispersées par éclaboussures des parties inférieures des plants, ce qui provoque le blanchiment des épis et une infection par les grains. Au cours de ces mêmes périodes, l’infection par les grains peut sérieusement compromettre le développement de la culture, sauf si les grains sont traités par un fongicide dirigé contre Fusarium. (ANONYME, 2016), (Fig.5).
Figure 5 : Cycle parasitaire des fusarioses des céréales (ANONYME, 2016)
I.3.5. Moyens de lutte 1. Pratiques culturales
− Utilisation des semences saines.
− Etant donné que les Fusaria survivent sur les résidus de culture, il est déconseillé fortement d’ensemencer du blé ou de l’orge l’année qui suit une culture de céréales (maïs, avoine, orge, seigle, triticale) ou de graminées fourragères.
− La réalisation d’une rotation d’au moins deux ans en dehors des céréales (alterner avec légumineuses), cela réduit la densité de l’inoculum (GILLBERT et TEKAUZ, 2000).
− S’il est absolument impossible de pratiquer une rotation avec une espèce non graminée, l’enfouissement profond des résidus de culture contaminés par incinération est une pratique à adopter afin de réduire l’inoculum de Fusarium spp.
− La répression des mauvaises herbes graminées est aussi importante.
− Utilisation de la fumure azotée de façon rationnelle (MAULER et al.1997).
− L’utilisation de la solarisation, qui peut réduire les populations pathogènes et l’incidence de la maladie (PANDY et al. 1996).
2. Lutte génétique
La création de variétés résistantes semble la méthode la plus économique et la plus favorable pour la protection de l’environnement (WEST et al. 2011). La recherche de telle résistance fait depuis longtemps l’objet de plusieurs travaux. Mais étant donné que l’action parasitaire de l’agent pathogène est peu spécifique il ne faut pas s’attendre à l’obtention de variétés complètement résistantes (résistance verticale) mais plutôt à des variétés à résistance variables (résistance horizontale) (DAMMER et al. 2011; WEST et al. 2011).
3. Lutte chimique
L’utilisation des fongicides cette dernière décennie est devenue très répandue car elle s’est révélée efficace de 50 à 70% dans la réduction de la maladie une fois appliqué aux temps appropriés.
4. Lutte biologique
La définition adoptée par l’organisation internationale de lutte biologique (OILB) est : « utilisation par l’homme d’ennemis naturels tels que des prédateurs, des parasitoïdes ou des agents pathogènes pour contrôler des populations d’espèces nuisibles et les maintenir en dessous d’un seuil de nuisibilité » (SUTY, 2010).
Bio-pesticides :
Ce sont des préparations contenant les agents de lutte biologique, agissent en réduisant l’inoculum et /ou interférant avec une ou plusieurs étapes du cycle infectieux du phytopathogène (JIJAKLI, 2003).
I.4. Synthèse bibliographique sur les pucerons
I.4.1 - Systématique
Les aphides ou pucerons classés dans le Super-ordre des Hémiptéroïdes, appartiennent à l’ordre des Homoptera au sous–ordre des Aphidinea, et à la Super-famille des Aphidoidea (FRAVAL, 2006). Cette dernière se subdivise en deux grandes familles qui sont les Chermisidae et les Aphididae. Cette dernière est divisée en huit sous familles; celles des Telaxidae, des Pemphigidae, des Lachnidae, des Chaitoridae, des Callaphididae, des Aphididae, des Adelgidae, des Phylloxeridae (BONNEMAISON, 1962).
La famille des Aphididae est divisée en trois sous-familles, celle des Blatichaitophorinae, des Pterocommatinae et des Aphidinae. Les espèces de cette dernière sont réparties entre deux tribus, les Aphidini et les Macrosiphini (ORTIZ-RIVAS et MARTINEZTORRES, 2010)
REMAUDIERE et al. (1997) classent les pucerons dans leur catalogue « les Aphididae du monde » comme suit :
Embranchement : ….Arthropodes
Classe :………... Insectes
Ordre : ………..Homoptera
Super /famille : ………Aphidoidae
Famille : ………..Aphididae
I.4.2 - Caractéristiques morphologiques et critères de classification des aphides
Les pucerons sont des insectes aux téguments mous de petite taille, mesurant entre 2 à 4mm avec un corps ovale un peu aplati (TANYA, 2002). Ce dernier est partagé en trois parties bien distinctes (la tête, le thorax, et l’abdomen) (Fig.6).
1 - Tête
Généralement, elle est bien séparée du thorax chez les formes ailées, mais non chez les aptères ; elle porte deux antennes de longueur très variable de 3 à 6 articles, sont insérées directement sur le front ou sur des tubercules frontaux plus ou moins proéminentes. Certains
articles antennaires possèdent des organes sensoriels appelés les sensoria ; leurs partie distale amincie est nommée fouet ou processus terminalis à l’arrière de l’œil composé (TANYA, 2002, FRAVAL, 2006).
2 - Thorax
Il comprend trois segments : le prothorax, le mésothorax, et le métathorax, porte 3 paires de pattes et primitivement deux paires d’ailes. Cependant, chez la plupart des espèces
des pucerons coexistent des formes adultes ailées et des formes adultes aptères. D’après HEIN (2005), chez certaines espèces, la nervation des ailes peut être caractéristique ;
les ailes antérieures présentent plusieurs nervures. Ce sont toutes des nervures simples, sauf la nervure médiane qui se manifeste chez la plupart des espèces. Selon GODIN et BOIVIN (2002), cependant la nervation peut être :
- Non ramifiée;
- Ramifiée, une seule fois; - Ramifiée, deux fois. 2.3 - Abdomen
L’abdomen porte généralement dans sa partie postérieure une paire de cornicules (ou siphons) de forme et de longueur très variables, Parfois pourvues d’une réticulation ou surmontées d’une collerette (HEIN, 2005). Les cornicules manquent dans quelques genres et parfois même selon les formes dans une même espèce (LIEN et SPARKS, 2001).
Le dernier segment abdominal (10ème) forme la queue (cauda) plus ou moins développée et de forme variable selon les espèces (FREDON, 2008).
I.4.3 - Cycle biologique
Le cycle évolutif des pucerons est dit hétérogonique c’est-à-dire caractérisé par l’alternance d’une génération sexuée et d’une ou plusieurs générations parthénogénétiques (asexuées) (CHRISTELLE, 2007), avec une reproduction asexuée largement dominante sur la reproduction sexuée. Selon LAMBERT (2005), la conséquence de cette reproduction asexuée est due à une multiplication très rapide de la population de pucerons. Les femelles fécondées sont toujours ovipares, alors que les femelles parthénogénétiques sont vivipares (elles donnent directement naissance à de jeunes larves capables de s'alimenter et de se déplacer aussitôt produites).
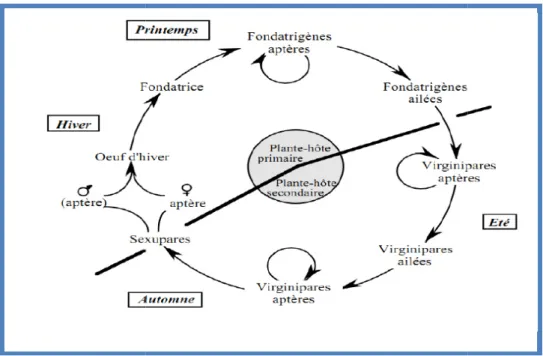
Selon SIMON (2007), il existe différents types de cycles de vie des pucerons selon les espèces. Certaines espèces accomplissent la totalité de leur cycle évolutif sur des plants de la même espèce ou d’espèces très voisines ; elles sont dites monœciques. Par contre d’autres espèces nécessitent pour l’accomplissement de leur cycle complet deux plantes hôtes non apparentées botaniquement. Ces espèces sont dites hétéroeciques (ou dioeciques). La plante sur laquelle est pondu l’œuf d’hiver est appelée l’hôte primaire, l’autre étant l’hôte secondaire, généralement c’est une plante herbacée sur lequel émigre les fondatrigènes ailées.
Dans les régions tempérées, les pucerons présentent un cycle annuel complet (holocycle) à deux hôtes (dioécique). Dans les conditions défavorables de l’hiver, la plupart des pucerons hivernent sous forme d'œufs sur les plantes vivaces ou dans les débris végétaux. Ils peuvent résister à des températures plus basses de l’ordre de -10°C à -15°C. Certains hivernent sous forme de femelles adultes (EATON, 2009). Les œufs fécondés éclosent au printemps et produisent une génération de femelles aptères appelées fondatrices qui s’installent sur les feuilles, les pousses, et parfois sur les fleurs (LABRIE, 2010). Ils commencent à fonder de nouvelles colonies en produisant des descendants par parthénogenèse. Celles-ci peuvent donner naissance à 10 femelles ou plus par jour (ANONYME, 2009). Parallèlement, les fondatrices adultes pondent elles-mêmes des larves qui donneront des adultes aptères appelés fondatrigènes (BAHLAI et al. 2007). Plusieurs générations vont se succéder dans lesquelles apparaîtront des ailés qui irons contaminer les différents hôtes secondaires. Par parthénogénèse, les fondatrigènes engendrent un certain nombre de générations des femelles appelées virginogènes.
A l’automne, la diminution de la température, de la durée de jour et de la qualité du plant induit le retour des ailés vers leur hôte primaire et l’apparition des femelles capables
d’engendrer des sexués. Ces sexupares produisent des mâles (ce sont des andropares) ou des femelles (gynopares) ou les deux (amphotères) (
ailé et la femelle aptère. Cette femelle, c’est la seule de toute cette succession de générations et de formes, pond un œuf, l’œuf
recommence (KLASS., 2009; DEWEY
Figure 7 : Représentation schématique du cyc
I.4.4 - Dégâts causés par les aphides
Les pucerons sont des parasites majeurs des végétaux dans le monde, avec des conséquences économiques négatives sur l'agriculture, les forêts et l'horticulture (FOURNIER, 2010). Ils peuvent causer de graves pertes aux plantes cultivées (
al, 2004).
D’après CHRISTELLE sont de deux types:
1 - Dégâts directs
D’après HARMEL et al
plantes. Les piqûres alimentaires sont également irritatives et toxiques pour la plante, induisant l’apparition de galles qui se traduisent par la déformation des feuilles ou des fruits et donc une perte de rendement (
d’engendrer des sexués. Ces sexupares produisent des mâles (ce sont des andropares) ou des femelles (gynopares) ou les deux (amphotères) (LABRIE, 2010). Généralement, le mâle est tère. Cette femelle, c’est la seule de toute cette succession de générations œuf d’hiver. Ces œufs éclosent au printemps suivant et le cycle KLASS., 2009; DEWEY, 2004).
: Représentation schématique du cycle de vie des pucerons en régions tempérées égâts causés par les aphides
Les pucerons sont des parasites majeurs des végétaux dans le monde, avec des conséquences économiques négatives sur l'agriculture, les forêts et l'horticulture
2010). Ils peuvent causer de graves pertes aux plantes cultivées (
(2007) et EATON (2009), les pertes que causent les pucerons
al, (2008), c'est le prélèvement et l’absorption de la sève des plantes. Les piqûres alimentaires sont également irritatives et toxiques pour la plante, induisant l’apparition de galles qui se traduisent par la déformation des feuilles ou des fruits et donc une perte de rendement (CHRISTELLE, 2007).
d’engendrer des sexués. Ces sexupares produisent des mâles (ce sont des andropares) ou des , 2010). Généralement, le mâle est tère. Cette femelle, c’est la seule de toute cette succession de générations d’hiver. Ces œufs éclosent au printemps suivant et le cycle
s pucerons en régions tempérées
Les pucerons sont des parasites majeurs des végétaux dans le monde, avec des conséquences économiques négatives sur l'agriculture, les forêts et l'horticulture 2010). Ils peuvent causer de graves pertes aux plantes cultivées (QUBBAJ et
(2009), les pertes que causent les pucerons
et l’absorption de la sève des plantes. Les piqûres alimentaires sont également irritatives et toxiques pour la plante, induisant l’apparition de galles qui se traduisent par la déformation des feuilles ou des fruits et
2 - Dégâts indirects
Les dégâts indirects des pucerons sont essentiellement de deux ordres qui sont: 2.1 - Miellat et fumagine
Les produits non assimilés de la digestion de la sève, riches en sucre, sont éjectés sur la plante sous forme de miellat. Cette substance peut contrarier l’activité photosynthétique de la plante soit directement en bouchant les stomates, soit indirectement en favorisant le développement de champignons saprophytes. Ceux-ci provoquent des fumagines qui entravent la respiration et l’assimilation chlorophyllienne ou souillent les parties consommables (fruits par exemple) et les rendent ainsi impropres à la commercialisation (CHRISTELLE, 2007; GIORDANENGO et al. 2010).
2.2 - Transmission des virus phytopathogènes
En se déplaçant d’une plante à une autre, les pucerons créent des contacts indirects entre les végétaux distants et immobiles (BRAULT et al, 2010). Cette caractéristique a été efficacement exploitée par les virus des plantes, incapables de se déplacer d’un hôte à un autre de façon autonome. Ainsi, de très nombreuses espèces virales utilisent l’action itinérante des pucerons pour se propager et se maintenir dans l’environnement.
D’après HARMEL et al, (2008), les pucerons sont susceptibles de causer jusqu’à 20 % de pertes en rendement dans le Nord de la France.
2.2.1 - Modes de transmission
HULLE et al (1999), notent que les virus transmis par les pucerons sont regroupés selon leurs caractéristiques structurelles, les symptômes qui sont provoquées ou leur mode de transmission.
- Les virus circulaires (persistants). - Les virus non circulaire.
- Virus non persistants. -Virus semi-persistants.
I.4.5- Facteurs de développement et de régression des populations des pucerons
1 - Facteurs abiotiques
Les facteurs abiotiques sont représentés par les différentes conditions climatiques intervenant dans la dynamique de populations des aphides.
-les températures. -les précipitations. -la durée d’insolation. -Le vent.
- L’humidité de l’air. 2 - Facteurs biotiques
Les facteurs biotiques constituent essentiellement par des facteurs liés au potentiel biotique des espèces aphidiens, le rôle de la plante hôte, l’action des ennemis naturels et les différentes méthodes de lutte déployée par l’Homme.
I.4.6 - Lutte contre les pucerons
Le niveau des populations de pucerons dans les cultures est extrêmement variable d’une année à l’autre et peut évoluer très rapidement au sein d’une même culture. Il dépend bien sûr des capacités reproductives propres aux différentes espèces mais aussi de facteurs extérieurs dépendant de l’environnement physique et biologique. Ces facteurs peuvent être très nombreux, ce qui explique les différences rencontrées dans les tentatives de modélisation de leur influence sur le développement des populations de pucerons (HULLE et al, 1999).
1 - Lutte préventive
Elle se base sur les différentes pratiques culturales et l’entretien de la culture car l’enfouissement pendant l’hiver des plantes ayant reçu des œufs d’hiver ainsi que la destruction par des hersages ou sarclages des plantes sauvages susceptibles d’héberger des espèces nuisibles aux plantes cultivées au début du printemps (WANG et al. 2000; LAMBERT, 2005).
2 - Lutte curative
2.1 - Lutte chimique
Pour réduire les dégâts d'insectes, l’utilisation des pesticides reste le moyen le plus largement utilisé et le plus efficace aujourd’hui (FERRERO, 2009).
Selon HULLE et al (1999), les principes de la lutte chimique sont:
-L’empêchement d’acquisition du virus lors de piqûres d’essai par l’utilisation d’huiles végétales non phytotoxiques.
-Le choix des produits: ils doivent être avant tout sélectifs afin de préserver la faune utile. Ces produits doivent aussi être dotés d’un effet de choc élevé, et d’une bonne rémanence, en plus ils doivent appartenir à des familles chimiques différentes afin d’éviter ou de retarder le phénomène de résistance. Il est de préférence que le choix porte sur des produits systémiques qui touchent même les pucerons protégés par l’enroulement des feuilles.
2.2 - Lutte biotechnique
Ce moyen de lutte est basé sur le comportement de certains insectes qui sont attirés par différents attractifs visuels (couleur) ou olfactifs (aliments, phéromones). Ces couleurs et ces substances peuvent être utilisés pour le piégeage de masse, le piégeage d’avertissement ou des traitements par tâches (RYCKEWAERT et FABRE, 2001).
2.3 - Lutte biologique
D’après l’organisation internationale de la lutte biologique contre les animaux et les plantes nuisibles l’O.I.L.B (1971) ; HAUTIER (2003) ; LAMBERT (2005) et MAISONHAUTE (2009), la lutte biologique est l'utilisation des organismes vivants (insectes, bactéries, nématodes,…) ou de leurs dérivés pour contrôler les populations de nuisibles et empêcher ou réduire les pertes ou dommages causés aux cultures.
II- Présentation de la région d’étude
Ce chapitre a pour objet de présenter la monographie de la wilaya de Bouira. Il convient de connaitre le cadre naturel dans lequel s’est déroulée notre étude, de présenter le secteur agricole, et sa richesse en plantes médicinales ainsi que l’échantillon choisi pour effectuer cette étude.
Nous rappelons que les données traitées dans cette partie sont issues principalement des statistiques collectées au niveau de la Direction des Services Agricoles (DSA) et de la subdivision agricole.
II.1- Présentation administrative et géographique de la zone d’étude
La connaissance du milieu est importante, car ses caractéristiques déterminent les contraintes ou les atouts par rapport au mode de vie suivi par la population de la région. II.1.1- Présentation administrative de la wilaya
Elle est issue du découpage administratif institué par ordonnance n° 74/69 du 02 Juillet 1974, relative à la refonte de l’organisation territoriale des Wilayas.
Elle hérite d’une partie des territoires des Wilayas limitrophes de Médéa et de Tizi-Ouzou.
Elle se subdivise en 12 Daïra et 45 Communes. II.1.2- Situation géographique
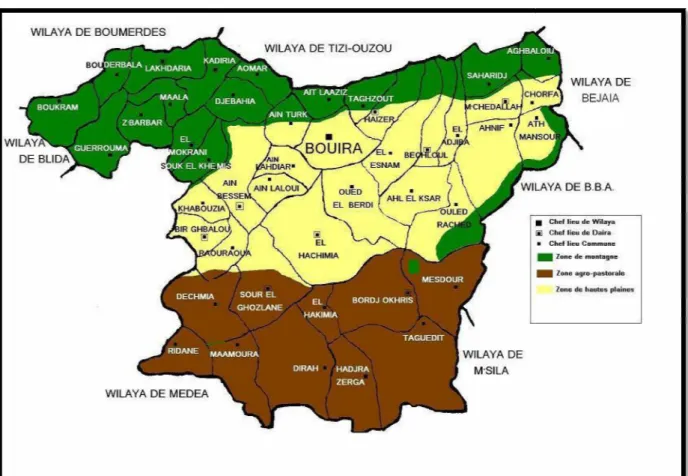
La wilaya de Bouira se situe dans la région Centre Nord du pays avec une superficie totale de 4456,26 km² représentant 0,19% du territoire national. Le chef lieu de wilaya est situé à près de 120 km de la capitale Alger.
La wilaya de Bouira est délimitée :
- Au nord par la wilaya de Boumerdes, Tizi-Ouzou et Bejaia ; - A l'est par la wilaya de Bordj Bou Arreridj;
- Au sud par la wilaya de M'Sila;
La grande chaîne du Djurdjura d’une part et les monts de Dirah d’autre part, encadrent la Wilaya qui s’ouvre de l’Ouest vers l’Est sur la vallée de la Soummam.
Figure 8 : Carte limites administrative
II.1.3- Paysage géographique
Le territoire de la Wilaya de Bouira est caractérisé par 05 grands espaces géographiques:
- La dépression centrale ;
- La terminaison orientale de l’Atlas Blidéen - Le versant du Djurdjura ;
- La chaîne des Bibans et les hauts reliefs du sud - La dépression Sud Bibanique.
La grande chaîne du Djurdjura d’une part et les monts de Dirah d’autre part, encadrent la Wilaya qui s’ouvre de l’Ouest vers l’Est sur la vallée de la Soummam.
Carte limites administratives de la wilaya de Bouira Source : DSA de la wilaya de
Paysage géographique
Le territoire de la Wilaya de Bouira est caractérisé par 05 grands espaces
La terminaison orientale de l’Atlas Blidéen ;
Bibans et les hauts reliefs du sud ;
La dépression Sud Bibanique. La grande chaîne du Djurdjura d’une part et les monts de Dirah d’autre part, encadrent
s de la wilaya de Bouira
DSA de la wilaya de Bouira, 2017
Le territoire de la Wilaya de Bouira est caractérisé par 05 grands espaces
II.2- Choix de la région d’étude
En premier lieu, la région est connu par l’importance de la production végétale notamment les plantes médicinales qui constitue la production prédominante de la région, en raison de la place privilégié qu’elle occupe.
Ensuite, être des résidents dans cette région nous a facilité le déroulement de cette étude, le contact avec les personnes clé de la culture en raison de la connaissance du terrain et d’autre considération telle que les moyens financiers
II.3- Données climatiques
Le climat de la wilaya de Bouira est un climat méditerranéen qui est chaud et sec en été, froid et pluvieux en hiver.
II.3.1- Précipitations
La Wilaya de Bouira se caractérise par une pluviométrie favorable notamment dans la partie Nord (Atlas Blidéen et versant Sud du Djurdjura) et une assez importante partie de la chaîne des Bibans où elle est en moyenne de 660 mm/an .Sur les sommets du Djurdjura, les précipitations peuvent dépasser les 2000 mm/an.
Les plus faibles volumes sont enregistrés dans la dépression Sud Bibanique, où elles n’atteignent parfois que 200 mm à 300 mm/an (Sud de la Wilaya).
II.3.2- Températures
La wilaya présente un hiver rigoureux et un été chaud, avec des amplitudes annuelles fortes, atteignant respectivement entre 20 et 40 °C de Mai à Septembre et entre 2 à 12 °C de Janvier à Mars.
Les températures moyennes mensuelles relevées au titre de l’année 2010, par certaines stations de la Wilaya, sont :
- 8,4°C à 27°C à la station de Bouira ; - 8,5°C à 28,1°C à la station de M’chedellah ; - 16°C à 25°C à la station d’El-Esnam ;
II.3.3- Humidité
L’humidité est très élevée surtout au printemps et l’été, jusqu’à 60 à 80 %. II.3.4- Evaporation
L’évaporation est assez importante durant les mois de juillet et aout ou elle peut atteindre 70 à75% de l’évaporation annuelle.
II.3.5- Vents
IIӀ- Matériel et méthode
Notre travail consiste à déterminer le pouvoir insecticide et fongicide des extraits végétaux de pistachier lentisque (
- La première partie porte sur l’étude phytochimiques de la plante. - La deuxième partie traite l’activité insecticide.
- La troisième partie porte sur l’activité fongicide lentisque.
IIӀ.1- Matériels utilisés IIӀ.1.1- Matériel biologique III.1.1.1- Matériel végétal
Le matériel biologique végétale utilisé est composé de la partie aérienne de la plante médicinale Pistacia lentiscus
mars jusqu’au mois de mai 2018 dans III.1.1.2- Matériel animal
Nous avons testé l’extrait éthanolique du (KALTENBACH, 1843) (Puceron du nerp
cycle évolutif de cette espèce est dit holocyclique d anholocyclique dans les régions tempérées
Figure 9: Puceron
Notre travail consiste à déterminer le pouvoir insecticide et fongicide des extraits végétaux de pistachier lentisque (Pistacia lentiscus), il comporte trois parties
La première partie porte sur l’étude phytochimiques de la plante. l’activité insecticide.
La troisième partie porte sur l’activité fongicide de l’extrait éthanolique du
Le matériel biologique végétale utilisé est composé de la partie aérienne de la plante .Cette espèce est récolté durant la période allant du mois de mars jusqu’au mois de mai 2018 dans la région de Maillot et Chorfa.
s testé l’extrait éthanolique du Pistacia lentiscus sur l’insecte BACH, 1843) (Puceron du nerprun) qui a été collecté au nive
cycle évolutif de cette espèce est dit holocyclique diœcique dans les régions froides et dans les régions tempérées. (TURPEAU et al 2016).
uceron Aphis nasturtii (aptère) observé sous microscope optique (original)
Notre travail consiste à déterminer le pouvoir insecticide et fongicide des extraits parties :
de l’extrait éthanolique du pistachier
Le matériel biologique végétale utilisé est composé de la partie aérienne de la plante .Cette espèce est récolté durant la période allant du mois de
sur l’insecte Aphis nasturtii u niveau de Beraki. Le dans les régions froides et
III.1.1.3- Microorganisme testés
Le champignon (Fusarium sp) auquel nous avons subi un ensemble d’étapes (isolement) au niveau du laboratoire de mycologie de l’institut national de la protection des végétaux d’Alger (INPV).
IIӀ.1.2- Matériel non biologique
Le matériel non biologique utilisé est composé d’un ensemble de réactifs et de produits chimiques, il comprend aussi des équipements, appareillage et verrerie (annexe01).
IIӀ.2- Méthodologie
Afin de réaliser cette étude, nous avons utilisé plusieurs méthodes :
-Screening phytochimique pour l’étude de métabolites de la plante Pistacia Lentiscus. -Extraction par soxhlet dans le but d’obtention de l’extrait éthanolique.
-Evaluation de l’effet insecticide des extraits végétaux de pistachier lentisque. -Evaluation de l’effet fongicide des extraits végétaux de pistachier lentisque.
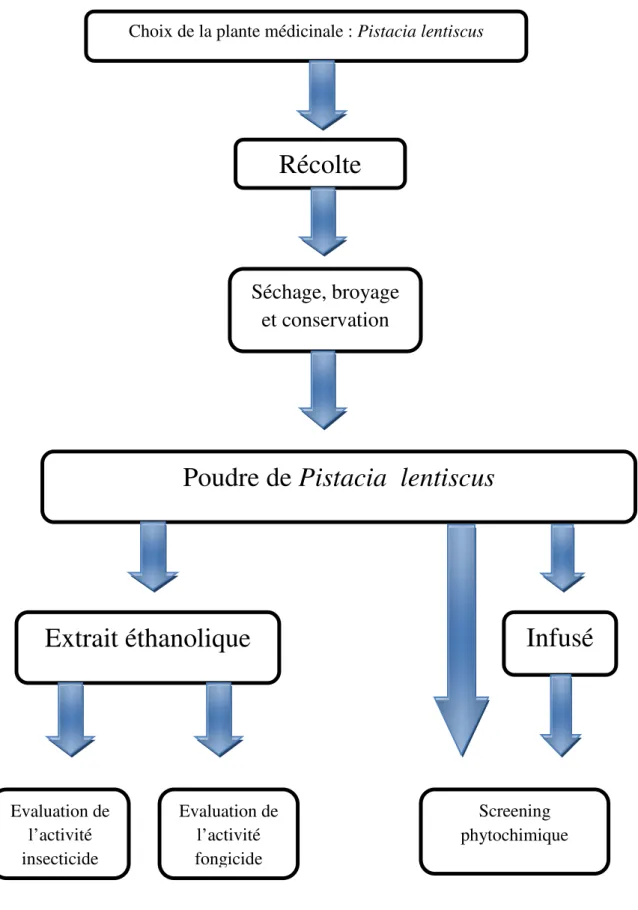
Figure 10 : Schéma résumant les différentes étapes du travail expérimental Choix de la plante médicinale : Pistacia lentiscus
Récolte
Séchage, broyage
et conservation
Poudre de Pistacia lentiscus
Extrait éthanolique
Evaluation de l’activité insecticide Evaluation de l’activité fongicideInfusé
Screening phytochimiqueIIӀ.2.1-Récolte, séchage, broyage
La plante est récoltée au début de mois de mars, nous avons prélevé la partie aérienne de la plante de pistacher a l’état végétatif, la couleur des feuille est verdâtre.
Après la récolte nous avons déposé les feuilles sur u
à l’ombre ; les feuilles prennent en moyenne un temps de 25 jours pour être complètement séchées.
A l’aide d’un broyeur électrique nous avons broyé toute la partie aérienne de la plante en poudre très fine conservée à l’abri de l’air, de l’humidité et de la lumière afin d’éviter tout risque de dégradation ou de dénaturation. Son stockage est à une temp
flacon en verre hermétiquement fermé et couvert avec du papier aluminium
Figure 11 : Séchage et broyage des feuilles de pistachier
IIӀ.2.2- Screening phytochimique
Le screening phytochimique, nous a permet à identifier les métabolites primaire et secondaire du plante Pistacia lentiscus. Il est effectué soit sur la poudre, soit sur son infusé, nous avons caractérisé les différents groupes chimiques en nous référant au
décrites dans les travaux de TONA et Préparation de l’infusé a 20g
Nous avons appliqués les étapes suivantes
-Une quantité de 20g de poudre végétale est ajoutée à 100ml d’eau distillée bouillante. -Laisser infuser pendant 15min avec agitation de temps en temps.
-Le mélange est filtré afin d’éliminer les résidus de la poudre. Récolte, séchage, broyage
La plante est récoltée au début de mois de mars, nous avons prélevé la partie aérienne de la plante de pistacher a l’état végétatif, la couleur des feuille est verdâtre.
Après la récolte nous avons déposé les feuilles sur un papier sec et propre à l’air libre et ; les feuilles prennent en moyenne un temps de 25 jours pour être complètement
A l’aide d’un broyeur électrique nous avons broyé toute la partie aérienne de la plante en poudre très fine conservée à l’abri de l’air, de l’humidité et de la lumière afin d’éviter tout risque de dégradation ou de dénaturation. Son stockage est à une température de 25°C dans un flacon en verre hermétiquement fermé et couvert avec du papier aluminium
: Séchage et broyage des feuilles de pistachier (originale) Screening phytochimique
Le screening phytochimique, nous a permet à identifier les métabolites primaire et secondaire du plante Pistacia lentiscus. Il est effectué soit sur la poudre, soit sur son infusé, nous avons caractérisé les différents groupes chimiques en nous référant au
décrites dans les travaux de TONA et al. (1998) et LONGAGA et al. (2000). Préparation de l’infusé a 20g
les étapes suivantes :
Une quantité de 20g de poudre végétale est ajoutée à 100ml d’eau distillée bouillante. r infuser pendant 15min avec agitation de temps en temps.
Le mélange est filtré afin d’éliminer les résidus de la poudre.
La plante est récoltée au début de mois de mars, nous avons prélevé la partie aérienne de la plante de pistacher a l’état végétatif, la couleur des feuille est verdâtre.
n papier sec et propre à l’air libre et ; les feuilles prennent en moyenne un temps de 25 jours pour être complètement
A l’aide d’un broyeur électrique nous avons broyé toute la partie aérienne de la plante en poudre très fine conservée à l’abri de l’air, de l’humidité et de la lumière afin d’éviter tout érature de 25°C dans un flacon en verre hermétiquement fermé et couvert avec du papier aluminium (Fig.11).
(originale)
Le screening phytochimique, nous a permet à identifier les métabolites primaire et secondaire du plante Pistacia lentiscus. Il est effectué soit sur la poudre, soit sur son infusé, nous avons caractérisé les différents groupes chimiques en nous référant aux techniques
(2000).
Figure 12: Etapes de préparation de l’infusé(originale)
IIӀ.2.2.1- Identification des Tanins catéchiques
A 5ml d’infusé, additionné 7ml de réactifs de Stiansy (annexe02). La réaction donne une précipitation rouge en présences des tanins catéchiques. IIӀ.2.2.2- Identification des Amidons
A 2g de poudre végétale rajouter quelques gouttes d’Iodes (I²). Formation d’une coloration bleu violette indique la présence d’amidon. IIӀ.2.2.3- Identification des Saponines
0,2g de chaque extrait a été agité avec 5ml de l’eau distillée, en suite chauffé à ébullition. Mousser (l’apparition de misse crémeuse de petites bulles) montrent la présence de saponines
IIӀ.2.2.4- Identification des Glucosides
Rajouter quelques gouttes d’H2SO4 a 2g de poudre végétale.
La formation d’une coloration rouge brique ensuite violette indique la présence des Glucosides.
IIӀ.2.2.5- Identification des Mucilages
Dans un bécher introduire 1ml d’infusé et ajouter 5ml d’alcool absolu agité pendant 10min.
IIӀ.2.2.6- Identification des Irridoides
Introduire 2ml d’infusé dans un bécher, ajouter quelque gouttes d’HCL, puis chauffé a l’aide d’une plaque chauffante.
Formation d’une coloration bleue indique la présence des Irridoides. IIӀ.2.2.7- Identification des Coumarines
Faire bouiller a reflux 2g de poudre dans 20ml d’alcool éthylique pendant 15 minutes puis filtrer, a 5ml de filtrat rajouter 10 gouttes de la solution alcoolique de KOH
(annexe02),et quelque gouttes d’HCL à
La formation d’un trouble indique la présence des coumarines. IIӀ.2.3- Extraction par soxhlet
Dans une cartouche nous avons mis 10 dans le ballon 200ml d’éthanol,
laissé poursuivre pendant 5 cycles,
récupéré dans une fiole bien fermée, et couverte du papier aluminium.
Figure 13: Extraction par soxhl
IIӀ.2.4- Etude de l’activité insecticide L’étude a porté sur Aphis nasturtii
insecte est collecté au niveau de la commune de Baraki (Alger). Un des objectifs de ce travail est d’étudier l’effet insecticide
Identification des Irridoides
Introduire 2ml d’infusé dans un bécher, ajouter quelque gouttes d’HCL, puis chauffé a l’aide d’une plaque chauffante.
Formation d’une coloration bleue indique la présence des Irridoides. Identification des Coumarines
Faire bouiller a reflux 2g de poudre dans 20ml d’alcool éthylique pendant 15 minutes , a 5ml de filtrat rajouter 10 gouttes de la solution alcoolique de KOH
),et quelque gouttes d’HCL à 10%.
rmation d’un trouble indique la présence des coumarines. Extraction par soxhlet
s une cartouche nous avons mis 10g de la poudre végétale de Pistachier 00ml d’éthanol, uis nous avons ajusté la température à 80°C
sé poursuivre pendant 5 cycles, après le refroidissement total des ballons, l’extrait est récupéré dans une fiole bien fermée, et couverte du papier aluminium.
: Extraction par soxhlet de l’extrait éthanolique du Pistachier lentisque ctivité insecticide
Aphis nasturtii (KALTENBACH, 1843) (Puceron du nerprun), cet insecte est collecté au niveau de la commune de Baraki (Alger). Un des objectifs de ce travail d’étudier l’effet insecticide de l’extrait éthanolique du Pistachier lentisque obtenus par Introduire 2ml d’infusé dans un bécher, ajouter quelque gouttes d’HCL, puis chauffé a
Faire bouiller a reflux 2g de poudre dans 20ml d’alcool éthylique pendant 15 minutes , a 5ml de filtrat rajouter 10 gouttes de la solution alcoolique de KOH à 10%
istachier lentisque, et uis nous avons ajusté la température à 80°C. L’extraction est après le refroidissement total des ballons, l’extrait est
istachier lentisque (originale)
(KALTENBACH, 1843) (Puceron du nerprun), cet insecte est collecté au niveau de la commune de Baraki (Alger). Un des objectifs de ce travail istachier lentisque obtenus par
l’extraction par soxhlet (extrait éthanolique) sur le puceron Aphis nasturtii hémiptère de la famille des Aphididae.
IIӀ.2.4.1- Mode opératoire
Afin d’évaluer la toxicité de l’extrait éthanolique, nous avons pris 4 boites de pétrie, dont chacune contient 10 adultes d’Aphis nasturtii, puis nous avons ajoutés pour chaque boite une partie de néflier (bourgeon et jeune feuille) Mespilus germanica pulvérisé avec l’extrait éthanolique. Nous avons réalisés le même protocole pour les larves.
Pour les témoins, nous avons mis dans une boites de pétri 10 adultes d’Aphis nasturtii et nous avons ajouté une partie de néflier (bourgeon et jeune feuille) Mespilus germanica, pulvérisé seulement avec l’éthanol à 100%. Nous avons répétés le même protocole avec les larves.
Figure 14 : Test de l’activité insecticide de l’extrait éthanolique de pistachier lentisque (original)
Nous avons répétés le même travail expérimental avec les doses 5%, 12.5%, 25% et 50% pour l’extrait éthanolique.
IIӀ.2.4.2- Analyse des données III.2.4.2.1- Correction de mortalité
Les comptages des adultes et des larves morts sont réalisés après 12 heures ,24heures ,48heures et enfin 72 heures les mortalités observées sont exprimées après correction par la formule d’ABBOTT, 1925) :
Avec :
Mc : Mortalité corrigé, en %.
Mt : Mortalité enregistré chez le témoin, en %.
Mo : Mortalité enregistrée dans les échantillons traités, en %.
IIӀ.2.5. Etude de l’activité antifongique
IIӀ.2.5.1. Méthode d’obtention des souches pures de champignon étudié (Fusarium sp)
Fusarium sp
L’espèce fongique du genre Fusarium sp a été isolée de notre part au niveau du laboratoire de mycologie de l’institut Nationale de la Protection des Végétaux d’Alger El Harrache (INPV, EL HARRACHE).
IIӀ.2.5.1.1. Préparation du milieu de culture
Le milieu que nous avons utilisé pour nos manipulations est le milieu MALT. C’est un milieu organique simple favorable pour la croissance des champignons phytopathogène. Pour 500 ml de milieu de culture :
- Mesurer 10g d’Agar à l’aide d’une balance électrique et le mettre dans un flacon de 500ml. - Mesure de 5g d’extrait du MALT et le rajouter dans le flacon.
- Ajuster ensuite le volume du mélange au moyen de l'eau distillée jusqu'à 500 ml.
- Mettre le mélange dans l’Autoclave à la température de 120° C, la pression de 1,1 bar pendant 20 minutes.
- Sous une hotte à flux laminaire, couler la solution obtenue sur des boîtes de Pétri .Le milieu de culture doit couvrir les 1/3 de la boite.
- Laisser sécher pendant 24 à 48 heures.
Pour le cas des boites de Pétri, une fois le milieu est coulé et desséché, les boites sont renversées pour éviter la condensation de l’eau sur les couvercles.
IIӀ.2.5.1.2. L’isolement
L’isolement d’un agent pathogène, c’est l’obtention de cet agent sur un milieu artificiel. L’isolement est réalisé à partir de front d’attaque (c’est-à-dire la partie se situant entre la partie saine et la partie attaquée) des tiges du blé présentent les symptômes caractéristiques de la Fusariose. La méthode est faite dans des conditions aseptiques.
À l’aide d’un scalpel stérile on
ils sont désinfectés dans 2% d’eau de Javel stérile pendant 5 minutes, puis rincés dans l’eau distillé stérile pendant 5 minutes (3 bains), puis séché sur papier buva
désinfection est effectuée pour éliminer les microflores exogènes.
- Ces fragments sont déposés dans des boite de pétri, contenant le milieu MALT. - Les boites sont par la suite mises à incuber à une température de 25C°.
Figure 15
Après avoir déposé les boites de Pétri dans l’incubateur pendant 7jours :
Figure
n découpe les la partie infectée en petits fragments
ils sont désinfectés dans 2% d’eau de Javel stérile pendant 5 minutes, puis rincés dans l’eau distillé stérile pendant 5 minutes (3 bains), puis séché sur papier buva
désinfection est effectuée pour éliminer les microflores exogènes.
sont déposés dans des boite de pétri, contenant le milieu MALT. Les boites sont par la suite mises à incuber à une température de 25C°.
Figure 15 : Isolement à partir des tiges de blé
Après avoir déposé les boites de Pétri dans l’incubateur pendant 7jours :
Figure 16 : Apparition des champignons
e en petits fragments. Par la suite, ils sont désinfectés dans 2% d’eau de Javel stérile pendant 5 minutes, puis rincés dans l’eau distillé stérile pendant 5 minutes (3 bains), puis séché sur papier buvard stérilisé. La