HAL Id: hal-02404281
https://hal.archives-ouvertes.fr/hal-02404281
Submitted on 17 Oct 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
L’élimination des macrophages tumoraux
Elisa Peranzoni, Emmanuel Donnadieu
To cite this version:
Elisa Peranzoni, Emmanuel Donnadieu. L’élimination des macrophages tumoraux : Une voie pour améliorer l’efficacité de l’immunothérapie anticancéreuse. médecine/sciences, EDP Sciences, 2019, 35 (3), pp.207-209. �10.1051/medsci/2019043�. �hal-02404281�
NOUVELLES
MAGAZINE
207 m/s n° 3, vol. 35, mars 2019
https://doi.org/10.1051/medsci/2019043
9. Sharon E, Sibener LV, Battle A, et al. Genetic variation in MHC proteins is associated with T cell receptor expression biases. Nat Genet 2016 ; 48 : 995-1002.
10. Birnbaum ME, Mendoza JL, Sethi DK, et al. Deconstructing the peptide-MHC specificity of T cell recognition. Cell 2014 ; 157 : 1073-87.
11. Bernard-Valnet R, Yshii L, Quériault C, et al. CD8 T cell-mediated killing of orexinergic neurons induces a narcolepsy-like phenotype in mice. Proc Natl Acad Sci
USA 2016 ; 113 : 10956-61.
12. Kebir H, Carmant L, Fontaine F, et al. Humanized mouse model of Rasmussen’s encephalitis supports the immune-mediated hypothesis. J Clin Invest 2018 ; 128 : 2000-9.
5. Dendrou CA, Petersen J, Rossjohn J, et al. HLA variation and disease. Nat Rev Immunol 2018 ; 18 : 325-39.
6. Jacob L, Dauvilliers Y. La narcolepsie avec cataplexie : une maladie auto-immune ? Med Sci (Paris) 2014 ; 30 : 1136-43.
7. Ahmed SS, Volkmuth W, Duca J, et al. Antibodies to influenza nucleoprotein cross-react with human hypocretin receptor 2. Sci Transl Med 2015 ; 7 : 294ra105.
8. Luo G, Ambati A, Lin L, et al. Autoimmunity to hypocretin and molecular mimicry to flu in type 1 narcolepsy. Proc Natl Acad Sci USA 2018 ; 115 : E12323-32.
RÉFÉRENCES
1. Waisman A, Liblau RS, Becher B. Innate and adaptive immune responses in the CNS. Lancet Neurol 2015 ; 14 : 945-55.
2. Latorre D, Kallweit U, Armentani E, et al. T cells in patients with narcolepsy target self-antigens of hypocretin neurons. Nature 2018 ; 562 : 63-8.
3. Liblau RS, Vassalli A, Seifinejad A, et al. Hypocretin (orexin) biology and the pathophysiology of narcolepsy with cataplexy. Lancet Neurol 2015 ; 14 : 318-28.
4. Dauvilliers Y, Arnulf I, Mignot E. Narcolepsy with cataplexy. Lancet 2007 ; 369 : 499-511.
1Inserm, U1016, Institut Cochin, 22, rue Méchain, 75014 Paris, France.
2CNRS, UMR8104, Paris, France.
3Université Paris Descartes, Sorbonne Paris Cité, Paris, France. 4Institut de Recherches Servier, 125, Chemin de Ronde, 78290 Croissy-sur-Seine, France.
emmanuel.donnadieu@inserm.fr
> Les immunothérapies sont une véri-table révolution thérapeutique en can-cérologie comme l’atteste l’attribu-tion du prix de Nobel de physiologie ou médecine 2018 à James Allison et Tasuku Honjo. L’objectif de cette stra-tégie est d’activer, de façon efficace et ciblée, le système immunitaire du patient chargé de détruire les cel-lules tumorales, notamment les lym-phocytes T cytotoxiques. Cela peut se faire, par exemple, par administra-tion d’anticorps monoclonaux, tels que les anti-PD1 (programmed cell death
1). Dans plusieurs cancers, comme le
mélanome, les résultats cliniques sont extrêmement prometteurs et parfois mêmes très spectaculaires, avec des guérisons de malades comme nous ne l’avions jamais observé auparavant. Mais ces stratégies ne bénéficient pas à tous les patients : une proportion de patients (inférieure à 30 %) atteints de mélanome, de cancers du poumon et de cancers du rein, répond aux anti-corps anti-PD-1, mais d’autres can-cers et notamment ceux de la prostate et du pancréas sont pour le moment
réfractaires à ces traitements. Les recherches actuelles se concentrent donc sur l’identification des différents obstacles à l’action anti-tumorale des lymphocytes T cytotoxiques afin de les contourner et de proposer des voies de traitement contre le cancer plus per-formantes et plus générales [1].
Les lymphocytes T sont rarement capables d’atteindre les cellules cancéreuses
Pour que le lymphocyte T cytotoxique accomplisse sa fonction, il doit recon-naître et répondre correctement à des antigènes tumoraux qui sont exprimés à la surface de la cellule cancéreuse. Certaines tumeurs accumulent peu de mutations ; elles ne sont donc pas ou peu reconnues par les lymphocytes T. Les tumeurs constituent également un environnement particulièrement hostile à l’action anti-tumorale des lympho-cytes T.
Outre PD-1, d’autres molécules sont susceptibles d’empêcher les lymphocytes T d’attaquer la tumeur. Par ailleurs, une activité destructrice des lymphocytes T
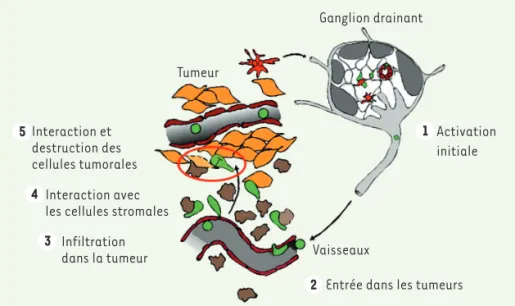
envers la tumeur n’est pas suffisante. Comme le montre la Figure 1, la capacité des lymphocytes T à former un contact avec la cellule maligne dépend en effet de plusieurs étapes durant lesquelles ces cellules se déplacent activement [2]. Comme pour toute réponse immunitaire, la première étape se déroule dans le ganglion le plus proche de la tumeur, le ganglion drainant. Dans cet organe, des lymphocytes T CD8 naïfs qui recon-naissent un antigène tumoral présenté à la surface d’une cellule dendritique vont subir un changement d’état leur permettant d’acquérir leurs fonctions cytotoxiques, mais également des capa-cités à migrer très spécifiquement vers la tumeur. Ces lymphocytes vont ensuite pénétrer dans les tumeurs en traversant les vaisseaux sanguins puis successive-ment naviguer dans le stroma tumoral, entrer en contact avec des cellules et des composants du stroma, et finalement, interagir avec la cellule cancéreuse afin de la détruire. Chez certains patients atteints de cancers, il est désormais admis qu’une, voire plusieurs de ces étapes, ne s’effectuent pas normalement
L’élimination des macrophages
tumoraux
Une voie pour améliorer l’efficacité
de l’immunothérapie anticancéreuse
Elisa Peranzoni1-4, Emmanuel Donnadieu1-3
NOUVELLE
m/s n° 3, vol. 35, mars 2019 208
des macrophages, y compris une sup-pression des fonctions lymphocytaires T. Cependant, les bases moléculaires et cellulaires de cette action négative des macrophages sur les lymphocytes T restent incomprises.
En utilisant la microscopie par imagerie dynamique sur des tranches de tumeurs fraîches isolées de patients atteints d’un cancer du poumon, nous avons remar-qué que, dans le stroma, les macro-phages forment des interactions de longue durée avec les lymphocytes T, les rendant relativement statiques [9]. Les lymphocytes T qui ne sont pas en contact avec les macrophages sont en revanche plus mobiles et plus suscep-tibles de migrer vers les cellules tumo-rales. Ces résultats suggèrent que les macrophages séquestrent les lympho-cytes T loin des cellules tumorales, les empêchant de remplir leur rôle destruc-teur de cellules cancéreuses. Nous avons testé cette hypothèse dans deux modèles murins de cancer du sein. Les macro-phages ont été éliminés à l’aide du pexi-dartinib, un antagoniste du récepteur du CSF 1 (colony-stimulating factor 1), une cytokine responsable de la survie et du recrutement de ces cellules dans les tis-sus. Nos résultats indiquent que ce trai-tement, en éliminant les macrophages, relance la migration des lymphocytes T CD8 et rend possible leur infiltration dans les îlots tumoraux. Nous avons également montré que si le traitement ne diminuait pas drastiquement le développement des tumeurs, sa combinaison avec une immu-nothérapie anti PD-1 était, en revanche, très efficace. Précisément, cette double approche augmente considérablement la proportion de lymphocytes T en contact stable avec les cellules tumorales et conduit à des tumeurs plus petites que celles observées chez des souris traitées avec l’un ou l’autre des traitements seuls. L’ensemble de ces résultats montre que l’élimination des macrophages libère les lymphocytes T qui peuvent alors migrer et infiltrer les îlots de cellules cancéreuses et répondre efficacement aux anticorps d’immunothérapie [9]. Ces données four-L’enjeu des recherches actuelles vise à
identifier les mécanismes à l’origine de l’incapacité des lymphocytes T à infiltrer l’épithélium tumoral.
Pour aborder ce point, nous avons mis au point et utilisé une approche expéri-mentale d’explants tumoraux maintenus en survie, qui, à l’aide de techniques d’imagerie de fluorescence, nous ont permis d’analyser la migration de lym-phocytes T au sein d’un microenviron-nement préservé [7, 8]. Nos travaux précédents ont montré que la matrice extracellulaire, particulièrement dense dans les tumeurs solides en progression, contrôle de façon négative les déplace-ments des lymphocytes T et leur capa-cité à entrer en contact avec les cellules tumorales [7, 8].
Les macrophages des tumeurs : un obstacle au contact entre lymphocytes T et cellules tumorales
Les tumeurs solides sont aussi enrichies en macrophages qui ont été décrits comme étant associés à un mauvais pronostic dans de nombreux cancers
[9]. Plusieurs mécanismes peuvent rendre compte de l’action pro-tumorale
[3]. Premièrement, l’entrée des lym-phocytes T dans les tumeurs est souvent défectueuse, liée à des anomalies des vaisseaux sanguins des tumeurs et à l’expression altérée de certaines molé-cules d’adhérence. Cependant, même lorsque les lymphocytes T parviennent à infiltrer les tumeurs, ils sont rarement en contact avec les cellules tumorales, mais s’accumulent
dans le stroma
(Figure 2)[4, 5](➜). Ce défaut d’inte-raction entre lym-phocytes et cellules
malignes pourrait contribuer à expliquer pourquoi certaines immunothérapies anticancéreuses ne donnent pas toujours les résultats attendus. D’ailleurs, des essais cliniques indiquent que chez les patients qui répondent bien aux anticorps anti-PD-1, les tumeurs, avant le trai-tement, sont enrichies en lymphocytes T CD8 en contact avec des cellules tumo-rales. À l’inverse, chez certains patients réfractaires à ces stratégies, les tumeurs contiennent bien des lymphocytes T CD8, mais ces derniers sont localisés en dehors des amas tumoraux [6].
Ganglion drainant
Activation initiale
Vaisseaux
Entrée dans les tumeurs Tumeur
Interaction et destruction des cellules tumorales
Interaction avec les cellules stromales
Infiltration dans la tumeur T 1 2 3 4 5
Figure 1. Migration des lymphocytes T au cours d’une réponse antitumorale. Pour atteindre la cellule cancéreuse, les lymphocytes T doivent franchir différentes étapes durant lesquelles ils se déplacent activement. Dans un premier temps, ils migrent du ganglion drainant vers la tumeur
(1). Puis, ils vont traverser les vaisseaux sanguins de cette dernière (2) et se déplacer dans le
stroma (3-4). Enfin, ils pourront éventuellement entrer en contact avec la cellule cancéreuse
avant de la détruire (5). (➜) Voir la Nouvelle de H. Salmon et E. Donnadieu, m/s n° 10, octobre 2012, page 824 Nouvelles_Mars.indd 208 11/03/2019 13:40:02
NOUVELLES
MAGAZINE
209 m/s n° 3, vol. 35, mars 2019
https://doi.org/10.1051/medsci/2019044
3. Joyce JA, Fearon DT. T cell exclusion, immune privilege, and the tumor microenvironment. Science 2015 ; 348 : 74-80.
4. Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature 2014 ; 515 : 563-7.
5. Salmon H, Donnadieu E. La matrice extracellulaire : un obstacle au contact entre les lymphocytes T et les cellules tumorales. Med Sci (Paris) 2012 ; 28 : 824-6.
6. Salmon H, Franciszkiewicz K, Damotte D, et al. Matrix architecture defines the preferential localization and migration of T cells into the stroma of human lung tumors. J Clin Invest 2012 ; 122 : 899-910.
7. Bougherara H, Mansuet-Lupo A, Alifano M, et al. Real-time imaging of resident T cells in human lung and ovarian carcinomas reveals how different tumor microenvironments control T lymphocyte migration.
Front Iimmunol 2015 ; 6 : 500.
8. Mantovani A, Marchesi F, Malesci A, et al. Tumour-associated macrophages as treatment targets in oncology. Nat Rev Clin Oncol 2017 ; 14 : 399-416.
9. Peranzoni E, Lemoine J, Vimeux L, et al. Macrophages impede CD8 T cells from reaching tumor cells and limit the efficacy of anti-PD-1 treatment. Proc Natl Acad
Sci USA 2018 ; 115 : E4041-50.
l’immunothérapie anticancéreuse chez un grand nombre de patients (essais NCT02452424 et NCT02713529). Elles permettent également d’envisager de nouvelles approches thérapeutiques qui empêcheraient la formation de contacts entre les lymphocytes T et les macro-phages tumoraux.‡
Improving efficacy of cancer immuno-therapy through targeting of macro-phages
LIENS D’INTÉ RÊ T
Les auteurs dé clarent n’avoir aucun lien d’inté rê t concernant les donné es publié es dans cet article. RÉFÉRENCES
1. Anderson KG, Stromnes IM, Greenberg PD. Obstacles posed by the tumor microenvironment to T cell activity: A case for synergistic therapies. Cancer Cell 2017 ; 31 : 311-25.
2. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017 ; 541 : 321-30.
3. Debets R, Donnadieu E, Chouaib S, Coukos G. TCR-engineered T cells to treat tumors: Seeing but not touching? Semin Immunol 2016 ; 28 : 10-21.
nissent une explication mécanistique aux essais cliniques en cours qui com-binent le pexidartinib et les anticorps anti PD-1 dans le but de lever la résistance à
Figure 2. Distribution des lymphocytes T, des macrophages et des cellules tumorales dans
une tumeur pulmonaire humaine.Les cellules
tumorales (bleu) s’organisent en îlots com-pacts entourés de lymphocytes T (vert) et de macrophages (rouge) (échelle : 100 µm).
NOUVELLE
Visualisation en temps réel
de l’infection de la muqueuse
génitale par le VIH
Fernando Real1-3, Morgane Bomsel1-3
1Laboratoire Entrée Muqueuse du VIH et Immunité Muqueuse, Département Infection Immunité et Inflammation, Institut Cochin, Université Paris Descartes, Sorbonne Paris Cité, 22, rue Méchain, 75014 Paris, France. 2CNRS UMR8104, 75014 Paris, France. 3Inserm U1016, Institut Cochin, 22, rue Méchain, 75014 Paris, France. morgane.bomsel@inserm.fr Les muqueuses génitales, principale
porte d’entrée du VIH-1
Le Sida (syndrome d’immunodéficience acquise) est une maladie sexuellement transmissible. Son vecteur, le virus de l’immunodéficience humain (VIH-1), est majoritairement transmis lors de rapports sexuels non protégés. Le virus est en effet présent dans les sécrétions génitales infectées. Il traverse les barrières épi-théliales de la muqueuse génitale pour infecter des cellules immunitaires qui constitueront des réservoirs cellulaires pour le virus. Nos études précédentes ont suggéré que l’entrée du VIH dans l’orga-nisme au niveau des muqueuses se fait
efficacement par contact entre les cel-lules infectées présentes dans les sécré-tions génitales infectieuses et les cellules épithéliales recouvrant les muqueuses génitales. Le virus libre, quant à lui, ne pénètre pas sauf s’il est présent en quan-tités bien supérieures à celles détectées dans les secrétions génitales infectieuses
[1-3]. Cependant, la séquence des évè-nements permettant l’entrée du virus dans la muqueuse, puis l’infection des cellules immunitaires insérées dans cette muqueuse, reste mal comprise. D’autres voies d’entrée du virus au travers des muqueuses ont par ailleurs été propo-sées.
Muqueuse immuno-compétente reconstruite in vitro pour l’observation des premières étapes de la pénétration de la muqueuse par le VIH-1
Afin d’étudier ce processus, nous avons développé un modèle original in vitro per-mettant de suivre en temps réel par vidéo-microscopie multidimensionnelle en temps réel l’infection du VIH au niveau d’une muqueuse [4]. Nous avons ainsi recons-truit in vitro des tissus humains muqueux d’urètre pénien immuno-compétents et polarisés, constitués d’un épithélium cultivé sur un stroma. Celui-ci est composé de fibroblastes (tissu de soutien des cel-lules épithéliales) dans lequel sont insérés