Royaume du Maroc
Université Mohammed V
Faculté de Médecine et de Pharmacie
Rabat
Mémoire de Fin d’Etudes pour l’obtention du
Diplôme National de Spécialité
Spécialité Chirurgie Générale
DILATATION KYSTIQUE CONGENITALE
DE LA VOIE BILIAIRE PRINCIPALE CHEZ
L’ADULTE :
A PROPOS DE 7 CAS
Présenté par
:
Docteur Dahmane Hicham
Sous la direction du :
Professeur Al Mountacer Charif Chefchaouni
Service de Chirurgie A CHU Ibn Sina Rabat
SOMMAIRE
INTRODUCTION 7
PATIENTS ET METHODES 8
I. Type de l’étude : 8
II. Objectif de l’étude : 8
III. Population étudiée : 8
1. Les critères d’inclusion sont : 8
2. Les critères d’exclusion sont : 8
IV. Echantillonnage : 8
V. Variables étudiées : 8
VI. La collecte des données : 9
HISTORIQUE 10
RAPPELS 11
I. RAPPEL EMBRYOLOGIQUE 11
A. Embryogenèse des voies biliaires : (fig1- 2) 11
B. En post-natal : 13
II. RAPPEL ANATOMIQUE [28,29] 16
A. VOIES BILIAIRES INTRA HEPATIQUES 16
B. VOIES BILIAIRES EXTRA HEPATIQUES 17
RESULTATS 22
I. Age 22
II. Sexe 22
III. Antécédents 22
IV. Signes cliniques 22
A. Signes fonctionnels 22 B. Signes physiques 23 V. Données paracliniques 23 A. Biologie 23 B. Imagerie 24 VI. Traitement 29 A. Traitement médical 30 B. Traitement chirurgical 30
VII. Suites opératoires 36
DISCUSSION 37
I. Epidémiologie : 37
A. Fréquence : 37
B. Age 37
C. Sex-ratio 37
II. Etude clinique : 37
A. La douleur 37
B. L’ictere 38
C. Masse abdominale 38
D. Les autres manifestations cliniques 38
III. Etude paraclinique 38
A. Biologie 38
B. L’IMAGERIE 39
V. EVOLUTION ET COMPLICATIONS 44
A. Evolution : 44
B. Complications : 44
CONCLUSION 59
TABLE DES ACRONYMES
DKC : dilatation kystique du choledoque DKVB : dilatation kystique des voies biliaires
DKVBP : dilatation kystique de la voie biliaire principale AJBP : Anomalie de jonction biliopancréatique
VBP : voie biliaire principale
VBIH : voies biliaires intrahepatiques VBEH : voies biliaires extrahepatiques VB : vesicule biliaire
HCD : hypochondre droit TDM : tomodensitometrie
IRM : imagerie par raisonnance magnetique BD : bilirubine directe
BI : bilirubine indirecte BT : bilirubine totale
GOT : Gamma-Glutamyl transpeptidase GPT : Glutamate Pyruvate Transaminase GGT : Gamma glutamyl transferase PAL : phosphatases alcalines TP : taux de prothrombine TCA : taux cephaline activée
ACE : antigene carcino embryonaire
NFS-PQ : numeration de la formule sanguine avec taux de plaquettes PNN : polynuceaires neutrophiles
CA19-9 : Antigène carbohydrate 19-9
CPRE : cholangiopancréatographie rétrograde endoscopique HTP : hypertension portale
ATB : antibiotique
TABLE DES FIGURES
Figure 1: Ébauches hépatobiliaires et pancréatiques (à environ 35 jours).
Figure 2: chronologie et chématisation du developpement pancréatique humain Figure 3 : Cholangiographie directe par ponction percutanée de la branche du seg-ment III : anatomie normale des voies biliaires intrahépatiques et de la convergence. Figure 4: Représentation schématique des variations d’abouchement des voies biliaires intrahépatiques droites (a, b, c) et gauches (d).
Figure 5 : Vascularisation artérielle des voies biliaires. Artère cystique et ses variations principales. 1. Artère cystique « courte ». 2. Artère cystique « longue » en position précholédocienne. 3. Artère pancréatico-duodénale postéro-supérieure. 4. Artère hépatique droite. 5. Artère hépatique propre. 6. Artère hépatique commune. 7. Artère gastroduodénale.
Figure 6: Représentation schématique des variations de la convergence des voies biliaires selon Couinaud.
Figure 7 : Signes fonctionnels
Figure 8: Kyste du choledoque lithiasique
Figure 9: VBP de grand calibre et vésicule biliaire a paroi épaisse renfermant des micro calculs
Figure 10 : voie biliaire principale très large sans lithiase
Figure 11 : Dilatation des VBIH et du choledoque sans obstacle individualisable Figure 12: Dilatation kystique type I du cholédoque siège d’une lithiase
Vésicule biliaire non individualisable
Figure 13 : DKC type IVb avec un cholédoque dilaté a 5 cm tortueux jusqu’en bas, visibilité du Wirsung qui est plat, VB en place non dilatée.
Figure 14 : diatation de la partie distale de la VBP et les VBIH (convergence biliaire basse), bas cholédoque de calibre normal
Figure 15 : DKC type IV
Figure 16 : DKC type IV avec distension vésiculaire et lithiases de la VBP et VBIH non obstructive
Figure 17 : Dissection des adhérences entre la vésicule biliaire distendue et le kyste du cholédoque
Figure 18 : Cholédoque disséqué et mis sur lac, vesicule biliaire liberée mais cystique non encore sectioné
Figure 19 : Dissection de la VBP proximale
Figure 20 : Section au niveau du bas cholédoque aprés dissection intra pancréatique Figure 21 : Section de la VBP principale au niveau de la convergence biliaire supérieure
FIGURE 22 : Vue per opératoire : A et B) flèche bleue : le cholédococèle ; C) pièce de résection
FIGURE 23 : kyste du choledoque Type IV chez une femme de 54ans
FIGURE 24: A : Kysto-jéjunostomie sur anse exclue de BRAUN B : Kysto-jéjunostomie avec anse jéjunale sur anse en Y
FIGURE 25: Exérèse du kyste jusqu'à la convergence en le décollant du plan vasculaire postéro-interne
FIGURE 26: Anastomose hépatico-jéjunale termino-latérale sur une anse jéjunale en Y, montée dans la région sous-hépatique par voie transmésocolique.
INTRODUCTION
La dilatation kystique de la voie biliaire principale est une malformation congénitale, Consistant en une ectasie segmentaire d’aspect kystique, de dimensions variables, siégeant sur le canal cholédoque. Elle est en principe limitée à la voie biliaire principale, mais le prolongement de la dilatation sur les canaux hépatiques, droits et/ou gauches, peut s’observer. Cette malformation est souvent associée à une anomalie de la jonction biliopancréatique, sous forme d’un canal commun anormalement long [1] favorisant le reflux du liquide pancréatique dans la voie biliaire. La dilatation peut être totale ou segmentaire et selon Todani [10] elles sont regroupées en cinq types en fonction du siège, de l’étendue et la morphologie de la dilatation des voies biliaires qui peut être anévrysmal ou fusiforme, rarement diverticulaire. Le caractère kystique de la dilatation n’est pas constant, et c’est souvent une dilatation diffuse et fusiforme de toute la voie biliaire qui constitue la lésion. Cette malformation est rare en Afrique, en Occident avec une incidence de seulement 1 cas sur 200 000 naissances avec une fréquence multipliée par 150 au japon. Elle représente cependant la malformation congenitale la plus fréquente des voies biliaires après l’atrésie des voies biliaires. Cette affection se voit surtout chez le sujet jeune avec une nette prédominance chez le sexe féminin.
Nous décrivons et discutons dans ce travail les difficultés diagnostiques et thérapeutiques de cette pathologie à partir de sept cas de dilatation kystique de la voie biliaire principale colligés à la Clinique Chirurgicale « A », centre hospitalier universitaire ibn Sina de rabat, entre janvier 2011 et decembre 2019.
A la lumière de nos observations et grâce aux données de la littérature nous proposons d’analyser la sémiologie clinique, d’apprécier l’intérêt des examens paracliniques et de discuter la stratégie thérapeutique.
PATIENTS ET METHODES
I. Type de l’étude :
Il s’agit d’une étude rétrospective sur une série de 7 cas de patients admis pour prise en charge thérapeutique d’une dilatation kystique congénitale de la voie biliaire principale, à la Clinique Chirurgicale A du centre hospitalier universitair IBN SINA de Rabat, sur 9 ans entre janvier 2011 et décembre 2019.
II. Objectif de l’étude :
Notre objectif est d’établir le profil épidémiologique, diagnostique, thérapeutique et évolutif des patients inclus et de comparer notre série aux données de la littérature.
III. Population étudiée :
1. Les critères d’inclusion sont :
Tous les patients admis pour dilatation kystique de la VBP
2. Les critères d’exclusion sont :
Les patients sortis contre avis médical et ceux perdus de vue ou dont le dossier médical est incomplet.
IV. Echantillonnage :
Un échantillon accidentel de sept malades a été colligé au niveau de la Clinique Chirurgicale A du centre hospitalier universitair IBN SINA Rabat.
V. Variables étudiées :
Données épidémiologiques : L’âge, le sexe et l’origine géographique. Données cliniques :
- Les circonstances de découverte, le délai de consultation, les antécédents personnels (médicaux / chirurgicaux) et familiaux.
- Les signes fonctionnels : Douleur abdominale, nausées vomissements, signes de cholestase, ictère et fièvre.
- Les signes physiques : Sensibilité abdominale, défense abdominale, hépatomégalie et masse de l’HCD.
Les données paracliniques :
- Résultats de l’échographie abdominale comme étant l’examen de première intention.
- Résultats du bilan biologique : Bilan hépatique (GOT/GPT/Bilirubine totale/Bilirubine conjuguée/PAL /GGT), lipasémie, amylasémie, bilan d’hémostase (TP/TCA), hémogramme.
Les données thérapeutiques : - Médicales.
- Endoscopiques. - Chirurgicales.
Les données évolutives :
Complications postopératoires immédiates et postopératoires tardives.
VI. La collecte des données :
Une fiche d’exploitation a étée conçue pour collecter les différentes données épidémiologiques, cliniques, paracliniques, thérapeutiques et évolutives à partir des dossiers des malades, des registres du bloc opératoire, des données de suivi en consultation afin d’avoir des données cohérentes et exhaustives.
HISTORIQUE
En 1723, le kyste du cholédoque a été constaté par Vater puis décrit par Douglas en 1852.
Entre 1907 et 1926 Judd et Green n’observent qu’un seul cas sur 17381 interventions au niveau des voies biliaires. [1]
En 1909 Laverson rapporte 280 cas dont 35 ont été publiés par Walter en 1917. [2]
Depuis 1920 de nombreuses publications ont été focalisées sur ce sujet afin de proposer des concepts étiopathogéniques ou thérapeutiques. En effet, il s’agit des travaux de :
- Terrada et Yogi en 1931. - Zinniger et Cash en 1932. - Yotuyanagi en 1936. - Poate en 1936.
- Tsoudakas et Robinette en 1956.
- Entre 1923 et 1954 sur 192507 admissions seulement 2 cas ont été constatés au Cleveland Clinic Hospital.
En 1959, Alonso-Lej, Rever et Pessagno [3] ont décrit dans une revue de la littérature mondiale que sur 419 cas, 16 cas douteux et 403 cas certains dont 94 feront l’objet d’une étude détaillée en vue d’une classification anatomique. La pratique courante de la cholangiographie a permis, de plus en plus, de faire le diagnostic de kyste du cholédoque avant l’intervention chirurgicale. Par contre, la cholécystographie orale n’a pu qu’exceptionnellement être positive. C’est à Moseley [4] (1957) qu’on rapporte le premier cas.
Depuis cette époque de nouvelles observations ont été rapportées. Entre autre, on cite : - Liebner (1958) [5] ; - Hankamp (1959). [6] - Colon et Brust (1962). [7] - Silberman et Glaessner (1964). [8] - Ferris et Yadean (1964). [9]
- En 1975, Todani et collaborateurs modifient la classification d’Alonso-Lej. [10]
Actuellement et du fait de développement des techniques diagnostiques de la pathologie biliaire, le nombre de cas retenus augmente régulièrement.
RAPPELS
I. RAPPEL EMBRYOLOGIQUE
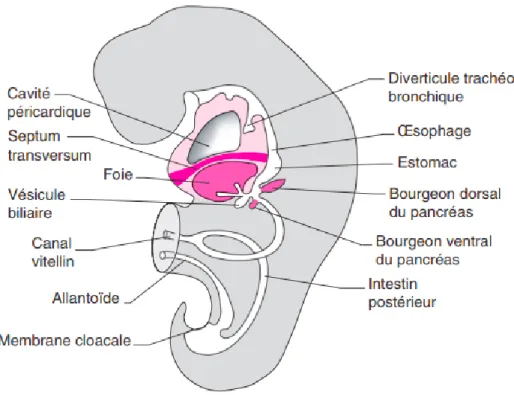
A. Embryogenèse des voies biliaires : (fig1- 2)
1) Embryogenèse des voies biliaires extra-hépatiques :
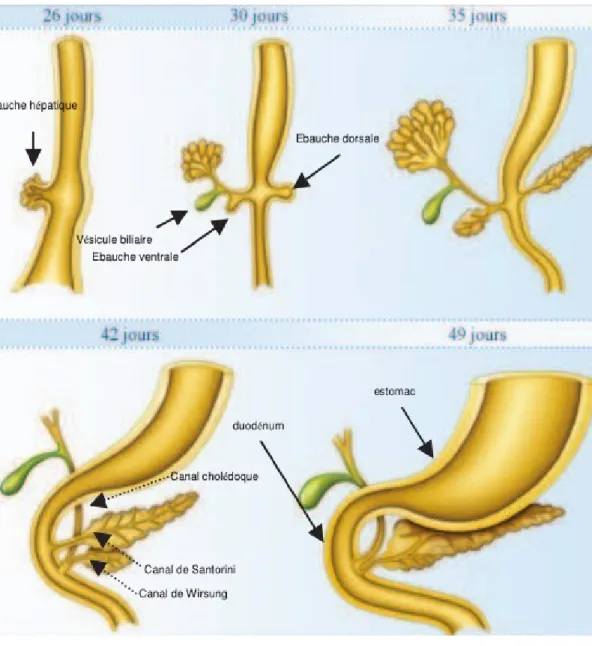
Chez l’embryon humain, la première ébauche des voies biliaires et du foie est le diverticule hépatique ou bourgeon hépatique, formé à 22 jours de gestation. Il commence comme un épaississement de l'épithélium endoblastique dans la paroi ventrale de la portion céphalique de l'intestin antérieur (le duodénum dans l’avenir), ce diverticulum présente deux protubérances correspondant selon les auteurs à une portion crâniale (pars hepatica), et une portion caudale (pars cystic). [11] La portion caudale croît en longueur et représente l’ébauche de la vésicule biliaire, le cystique et le cholédoque (ductus choledocus), cet arbre biliaire extrahépatique se développe à la 8éme semaine de gestation et prend une forme canalaire avec une lumière dés le début de sa formation et reste en continuité avec le foie durant toutes les étapes du développement biliaire commun. [12] La vésicule biliaire apparait comme une dilatation antérolatérale droite le long de la moitié distale du diverticulum hépatique au 29 éme jour après la fécondation, et le canal cystique n’est individualisable qu’au 34ème jour. Le canal hépatique (ductus hepaticus) se développe à partir de la portion crâniale du diverticulum hépatique et le développement de sa portion proximale était mal compris jusqu’à ce que Tan et Moscoso ont apporté le détail de son développement [13,14] : Au 34 ème jour d’embryogenèse, le canal hépatique commun a la structure d’un entonnoir large sans canal hépatique droit ni gauche reconnaissables, et durant la 5ème semaine de gestation, une prolifération rapide de l’entoderme prend place au dessus de la jonction entre le canal biliaire commun et le canal cystique, cette prolifération aboutit à la formation de replis puis des canaux hépatiques droit et gauche au niveau du hile (porta hepatis), et il a été rapporté que ce remodelage explique en partie les variantes anatomiques de la configuration des canaux hépatiques droit et gauche. En effet la jonction en Y de ces deux canaux avec le canal hépatique commun n’est retrouvée que chez 57% des adultes.[13] La portion proximale du canal hépatique droit et du canal hépatique gauche se développe à partir de la plaque canalaire. [14] Les VBEH et l’arbre biliaire intra-hépatique maintiennent une continuité luminale dés le début de l’organogénèse et durant toutes les étapes du développement, ainsi les résultats obtenus chez différents auteurs suggérant que le système biliaire extra-hépatique se développe indépendamment de l’arbre biliaire intra-hépatique et que ces deux systèmes sont initialement discontinus puis ils se réunissent ultérieurement. [15] Selon les auteurs, l’épithélium des VBEH exprime une protéine dite Hes 1 dont le défaut de synthèse in vivo est responsable d’une agénésie de la vésicule biliaire et une hypoplasie des VBEH. [16]
2) Embryogenèse des voies biliaires intra-hépatiques :
Plusieurs investigations ont été réalisées pour préciser le moment du développement des voies biliaires intra-hépatiques et ont permis de définir que la formation de ces canaux se fait entre la 5ème et la 9 ème semaine de gestation [17]. Une étude récente a mentionné que la 8 ème semaine est le premier temps de leur développement et décrit la jonction entre les VBEH et la 1ère structure biliaire intra-hépatique au niveau du hile intra-hépatique. [18,19]
Plusieurs théories ont été suggérées sur le développement des VBIH : Une théorie qui suppose que l’arbre biliaire intra-hépatique provient de l’épithélium non développé des VBEH [13] ; une autre qui estime que le système du drainage biliaire intra-hépatique se développe à partir des cellules précurseurs des hépatocytes [14], et une 3ème théorie qui combine les idées des deux théories précédentes, mais plusieurs auteurs renforcent la seconde théorie. L’origine hépatoblastique des VBIH a été appuyée par plusieurs études réinvestigant le développement embryologique des VBIH avec les techniques d’immunohistochimie [20, 21, 22, 14] en utilisant des colorations de cytokératine, l’ACE, l’Ag épithélial membranaire et d’autres marqueurs des cellules parenchymateuses et biliaires, néanmoins les études ayant solidement établi l’origine hépatoblastique des VBIH n’ont pas été encore validées [23]. L’immunocoloration de cytokératine a été particulièrement utilisée pour révéler le changement du phénotype des cellules, en effet les cytokératine sont des filaments intermédiaires du cytosquelette caractéristique des cellules épithéliales, et plusieurs cytokératines ont été identifiés et catalogués. A un stade précoce de son développement le foie de l’embryon humain est composé de cellules précurseurs (hépatoblastes) qui expriment les cytokératines 8, 18 et 19 [24] en plus de cytokératine 14 à partir de la 10 ème et la 14 ème semaine de gestation. Le développement des VBIH est déterminé par le développement des branches de la veine porte et commence au niveau du hile hépatique. Vers la 8 ème semaine de gestation les hépatoblastes forment une couche au niveau du hile hépatique et qui va entourer les branches portales comme un cylindre pour former ce qu’on appelle la plaque canalaire ou ductale qui va se dédoublée d’une seconde couche avec plus de cellules riches en cytokératine.
A partir de la 12 ème semaine de gestation le remodelage de la plaque ductale prend place et des dilatations tubulaires apparaissent dans sa lumière, ces tubules ainsi formés représentent les futures canaux biliaires et ils restent en continuité avec la plaque ductale dont le reste de l’épithélium non transformé en tubules disparait graduellement [25], et la ramification de l’arbre biliaire intra-hépatique se continue durant la vie foetale et ceci vers la périphérie du foie. Le processus du développement des VBIH nécessite schématiquement les composantes suivantes :
- Le changement graduel du phénotype des hépatoblastes en cellules biliaires (cholangiocytes).
- Le remodelage tridimensionnel de la structure de la plaque ductale. - La maturation des canaux tubulaires remodelés.
Le changement phénotypique des hépatoblastes en cholangiocytes consiste en une série complexe d’expression de nouvelles molécules comme cytokératine 7, l’ACE, l’Ag épithélial membranaire ainsi que le changement de l’expression des glycoprotéines de surface. Le remodelage de la plaque ductale implique:
- Le changement de l’épithélium avec construction de nouvelles structures épithéliales (par prolifération) et délétion simultanée des autres structures (par apoptose).
- L’influence du mésenchyme péri-épithélial. - L’influence de la veine porte.
- La stimulation autocrine de la prolifération de la plaque ductale.
Le développement normal des VBIH fait intervenir des interactions épithéliomésenchymateuse prenant naissance au niveau hilaire et se poursuivant le long des branches portales. Le défaut de remodelage de la plaque ductale entraine la persistance et un excès en structures canalaires biliaires embryonnaires.
B. En post-natal :
Après la naissance, le modelage des canaux biliaires intra-hépatiques est incomplet, il nécessite 6 semaines de plus [23,25]. Certains auteurs ont défini un ratio entre le nombre des canaux biliaires et le nombre des branches portales, appelé BD/PT ratio (bile duct/portal tract) et qui est utilisé pour estimer le degré de ductupenie dans le foie, et un ratio BD/PT < 0,9 peut être normal chez le prématuré. [26] L’étape finale de la maturation des glandes peri-biliaires est obtenue à l’âge de 15 ans, la masse hépatique augmente de 125g à la naissance, 255g à 1an, 430g à 2ans, 530g à 5ans, pour atteindre 1400 g à l’âge adulte. Il existe peu d’informations sur le développement lobulaire de foie humain depuis la naissance jusqu’à l’âge adulte, Landing et Wells proposent en se basant sur des observations que le développement post-natal du foie humain commence par augmentation du nombre des lobules périphériques associée à une élongation des voies portales accompagnantes [27]. Dans le foie d’un adulte la séquence complète des VBIH depuis les canaux hépatiques jusqu’aux canalicules comprend 11 à 12 ordres de division, mais la cholangiographie ne permet pas de visualiser les ramifications fines. Il est estimé que dans le foie d’un adulte l’arbre biliaire comprend entre 18 et 20 ordres de division qui réalisent une division d’un demi-million des canaux biliaires terminaux nécessaires pour assurer le drainage biliaire d’environ 440000 unités (définies par les lobules).
II. RAPPEL ANATOMIQUE [28,29]
A. VOIES BILIAIRES INTRA HEPATIQUES
1) Anatomie normale
L’anatomie des voies biliaires intrahépatiques est calquée sur celle du système porte. D’une manière générale, les voies biliaires sont adjacentes et antéro-supérieures aux branches portales.
Le canal hépatique gauche draine les segments II, III et IV. Le canal du segment III, de disposition antérieure, rejoint après un trajet vers l’arrière le canal du segment II plus postérieur pour constituer le canal hépatique gauche au niveau du récessus de Rex. Le segment IV est drainé par plusieurs branches rejoignant directement le canal hépatique gauche au niveau du hile hépatique.
Le canal hépatique droit draine les segments V, VI, VII et VIII. Les canaux des segments V et VIII se rejoignent pour for- mer le canal du secteur paramédian qui est antérieur et de dis- position verticale. Les canaux des segments VI et VII se rejoignent pour former le canal du secteur latéral droit qui est postérieur et de disposition plus horizontale. Le segment I comporte un drainage biliaire variable: dans 80 % des cas, il est bilatéral; dans 15 % des cas, il se fait uniquement dans le canal hépatique gauche ; et dans 5 % des cas, dans le canal hépatique droit.
Figure 3 : Cholangiographie directe par ponction percutanée de la branche du seg-ment III : anatomie normale des voies biliaires intrahépatiques et de la convergence.
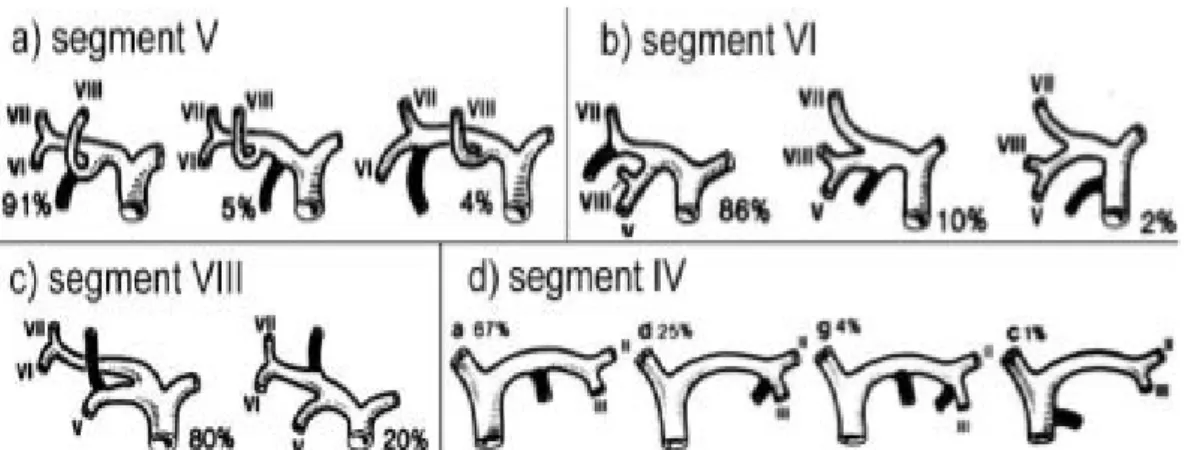
2) Variations anatomiques
Les variations anatomiques des voies biliaires intrahépatiques sont fréquentes. Les voies segmentaires droites V, VI et VIII ont un drainage ectopique dans près de 40 % des cas, constituant autant de modalités anormales de convergence des voies
biliai-res intrahépatiques droites. Ces anomalies peu- vent en outre s’associer au point de rendre difficile l’identification précise des branches segmentaires sur les vues cholangiographiques. Il n’y aurait en revanche pas d’anomalie décrite de la voie segmentaire VII. Une autre ano- malie, observée dans 20 à 50 % des cas, est la présence d’un canal sous-vésiculaire droit longeant le lit vésiculaire pour rejoin- dre la voie biliaire principale sous-hilaire ou le canal cys- tique. Ces canaux aberrants ne drainent pas un territoire hépatique spécifique. Ils peuvent être lésés lors d’une cholécys- tectomie et, quoique peu significatifs sur le plan fonctionnel, être à l’origine d’une fuite biliaire post-opératoire. Enfin, la présence de canaux biliaires droits se drainant directement dans la vésicule biliaire ou dans le canal cystique est également bien éta- blie. À gauche, les anomalies ne concernent que le ou les canaux du segment IV qui peuvent rejoindre le canal du segment III, le canal hépatique gauche ou encore plus rare- ment la voie biliaire principale, dans 30 % des cas. Les canaux II et III sont toujours de disposition normale.
Figure 4: Représentation schématique des variations d’abouchement des voies biliaires intrahépatiques droites (a, b, c) et gauches (d).
B. VOIES BILIAIRES EXTRA HEPATIQUES
1) Le canal hépatique gauche
Il est formé de la réunion des canaux segmentaires des seg- ments II et III au-dessus du récessus de Rex. Extrahépatique dans cette portion, il se dirige transversalement dans le hile, de gauche à droite. D’abord au bord supérieur de la branche portale, il s’infléchit pour croiser son bord antérieur et s’unir au canal droit. Il est assez long: de 1,5 à 3,5 cm, le trajet extra hepatique du canal hepatique gouche facilite son identification et son utilisation pour les anastomose hepatico jejunales.
2) Le canal hépatique droit
Il est formé de la réunion des deux canaux droits principaux (antérieur et postérieur). Ce confluent est en règle au-dessus de la branche droite de la veine porte, en position extrahépatique. Le canal droit est court et vertical: de 0,5 à 2,5 cm, Cette
petite longueur et l’abord necessitant une dissection profonde rend difficile les anastomoses sur le canal et doit faire preferé une anastomose sur la convergence quand cela est possible.
3) La réunion des canaux droit et gauche
Elle forme la convergence biliaire qui se situe soit en avant de la branche portale droite, soit au niveau de la bifurcation por- tale, au-dessus et à droite de la bifurcation de l’artère hépa- tique dont la branche droite croise la face postérieure de l’hépatocholédoque à son origine.
4) La voie biliaire principale
Elle prend naissance à partir de la convergence biliaire ou con- fluent biliaire supérieur. Elle descend dans le pédicule hépatique, puis en arrière de la tête du pancréas. Au cours de ce trajet, elle reçoit la voie biliaire accessoire, l’abouchement du canal cystique constituant le confluent biliaire inférieur. La voie biliaire prend le nom de canal cholédoque à partir de cette jonction. La ter- minaison de la voie biliaire se fait après un court trajet intrapan créatique au niveau de l’ampoule de Vater où elle rejoint le canal de Wirsung. L’ampoule de Vater est ouverte dans le deuxième duodénum au niveau de la grande caroncule. L’ampoule de Vater comporte un système sphinctérien complexe. Le sphincter d’Oddi entoure l’extrémité des deux canaux et se prolonge sur chaque canal en amont de la paroi duodénale, constituant un sphincter propre du canal cholédoque long de 10 mm et un sphincter propre du canal de Wirsung long de 4 mm. Vers le bas, cet appareil sphinctérien traverse la paroi duodénale à travers une ouverture de la musculeuse appelée fenêtre duodénale. Le sphincter d’Oddi adhère intimement à la musculeuse duodénale sauf en arrière, ce qui explique la possibilité de diverticules juxta-papillaires à ce niveau.
5) La vésicule biliaire
Elle est logée dans la fossette cystique creusée à la face inférieure du foie entre le segment IV et le segment V. Cette fossette vient en avant échancrer le bord inférieur du foie et aboutit en arrière à l’extrémité droite du hile hépatique. En général, piriforme à grosse extrémité antérieure, on lui décrit trois portions :
• le fond vésiculaire qui peut dépasser en avant si la vésicule est tendue ;
• le corps de la vésicule dirigé obliquement en haut, en arrière et à gauche vers le hile hépatique et se rétrécissant progressivement ;
• l’infundibulum vésiculaire, de forme conique et se terminant par le canal cystique. Le col est disposé dans un axe différent du corps vésiculaire formant un angle aigu avec celui-ci. Le canal cystique va du col vésiculaire à la voie biliaire principale. Après un nouveau coude à angle aigu avec le col vésiculaire, il décrit une courbe concave en bas et à droite pour se rapprocher du bord droit de la voie biliaire principale au niveau de son tiers moyen-tiers inférieur d’ou la necessitée lors des cholecystectomies de tracter vers l’avant et la droite l’infidibulum permettant de
d’ecarter le canal cystique de la voie biliaire principale et de disséquer le triangle de callot.
6) La vascularisation des voies biliaires
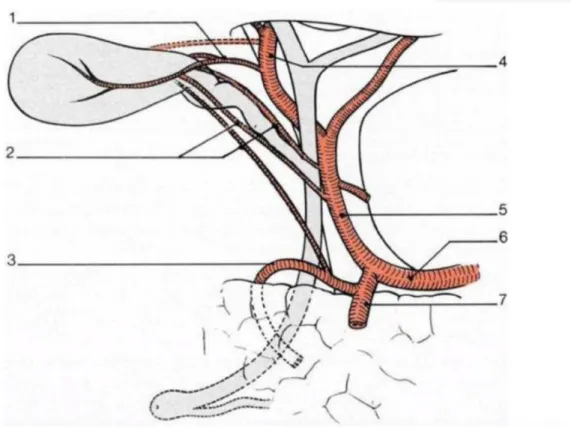
Celle des voies biliaires hilaires est assurée par de fins rameaux artériels issus des branches droite et gauche de l’artère hépati- que. Celle de la voie biliaire principale se fait par l’intermédiaire d’artères axiales courant le long des bords droit et gauche de la voie biliaire. Ces artères axiales sont elles-mêmes issues de l’artère hépatique droite et de l’artère gastroduodénale, constituant un réseau anastomotique entre ces deux artères. La vési- cule biliaire est vascularisée par l’artère cystique généralement issue de l’artère hépatique droite. L’artère cystique se situe dans le triangle de Callot, formé par le bord inférieur du foie, le canal cystique et la voie biliaire principale et dont la dissection soi- gneuse est un temps essentiel de la cholécystectomie. Les lésions ischémiques des voies biliaires sont inhabituelles en raison de la disposition en réseau des artères. Elles peuvent toutefois s’obser- ver après cholécystectomie, expliquant l’apparition de sténoses post-opératoires tardives de la voie biliaire ou de la convergence, ou encore après embolisation sous forme de cholécystites isché-miques ou de gravissimes nécroses hilaires.
Figure 5 : Vascularisation artérielle des voies biliaires. Artère cystique et ses variations principales. 1. Artère cystique « courte ». 2. Artère cystique « longue » en position précholédocienne. 3. Artère pancréatico-duodénale postéro-supérieure. 4. Artère hépatique droite. 5. Artère
hépatique propre. 6. Artère hépatique commune. 7. Artère gastroduodénale.
7) Variations anatomiques
Les variations anatomiques de la convergence biliaire
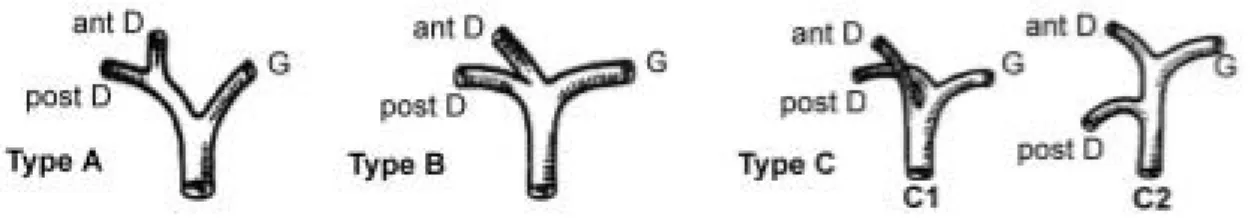
Elles ont été décrites par Couinaud en 1957. La disposi- tion normale (type A), faite de la réunion du canal hépatique droit et du canal hépatique gauche au niveau du hile, ne s’observe que dans 60 à 70 % des cas. La triple conver- gence (type B) qui réunit les voies antérieures droites, les voies postérieures droites et le canal hépatique gauche en un seul point s’observe dans 12 % des cas environ. Le drai- nage d’une voie biliaire droite directement dans le canal hépa- tique commun s’observe dans 20 % des cas. Cette disposition anormale concerne la voie antérieure droite (type C1) dans 16 % des cas, et la voie postérieure droite (type C2) dans 4 % des cas. Les autres variations sont plus rares et se présentent sous forme d’un drainage d’une voie biliaire droite dans le canal hépatique gauche ou d’une absence de canal hépatique gauche.
Figure 6: Représentation schématique des variations de la convergence des voies biliaires selon Couinaud.
Les variations anatomiques de la voie biliaire principale
Elles prédominent sur le confluent pancréatique. L’existence d’un canal bilio-pancréatique commun anormalement long est souvent constaté en cas de kyste du cholédoque. L’hypothèse avancée est que l’absence d’appareil sphinctérien propre à la voie biliaire dans cette configuration anatomique favoriserait le reflux de liquide pancréatique dans le cholédoque qui entraînerait à terme des lésions pariétales biliaires à l’origine de la dilatation kystique.
La vésicule biliaire peut être agénésique ou double avec un ou deux canaux cystiques
Elle peut également présenter une cloison interne à paroi mus- culaire réalisant un aspect de diverticule vésiculaire. Plus fré- quentes sont les anomalies de position de la vésicule biliaire qui peut être latéralisée à gauche ou intrahépatique, posant respec- tivement des problèmes diagnostiques ou chirurgicaux. Les ano- malies
d’abouchement du canal cystique sont également bien connues car elles constituent des pièges chirurgicaux classiques lors des cholécystectomies. Rarement, le canal cystique peut rejoindre le canal hépatique droit plutôt que la voie biliaire principale. Son abouchement à la voie biliaire principale peut également être variable, selon que le canal est court abou- ché à angle droit, long avec un trajet parallèle au bord droit de la voie biliaire et une jonction basse, ou encore spiralé autour de la voie biliaire avec un trajet postérieur et une jonction sur son bord gauche.
anomalie de la jonction biliopancréatique
Normalement, le cholédoque et le canal de Wirsung se jettent dans le duodénum par la grande papille selon deux modalités : soit séparément, soit, dans 65 à 90 % des cas, par l’intermédiaire d’un canal commun dont la longueur moyenne est de 4,6 ± 2,6 mm chez l’ adulte.
L’anomalie de jonction biliopancréatique (AJBP) répond à une définition anatomique basée sur plusieurs critères anatomoradiologiques :
– un critère majeur : il existe un canal commun biliopancréatique d’une longueur supérieure à 10 mm chez l’adulte, dit « canal commun long » ;
– deux critères mineurs :
– jonction extraduodénale en amont du sphincter d’Oddi des canaux biliaire et pancréatique ;
– angle de raccordement cholédocopancréatique supérieur à 30°.
Le canal commun biliopancréatique favorise un reflux pancréaticobiliaire chronique. Une AJBP était associée à 72% des DKVB[30].
RESULTATS
I. Age
L’Age moyen de nos patients au moment du diagnostic est de 46 ans variant entre 18 ans et 73 ans
II. Sexe
Prédominance féminine avec 6 femmes pour 1 hommes
III. Antécédents
Une patiente avait déjà bénéficié d’une cholécystectomie et une deuxième avait bénéficié d’une cholécystectomie plus pose de drain de kehr toutes les deux prises en charges initialement au sein d’autres unités, le reste des malades n’avaient pas d’antécédents pathologiques particuliers
IV. Signes cliniques
A. Signes fonctionnels
Le signe fonctionnel le plus fréquent était la douleur épigastrique chez 6 de nos malades et des coliques hépatiques chez une malade, associés à des vomissements dans 2 cas. Un syndrome de cholestase intermittent (urines foncées et selles décolorés) sans ictère était présent dans un cas, un ictere cholestatique dans 3 cas tandis que la fièvre était présente dans 2 cas, complétant un tableau d’angiocholite.
douleurs epigastriques coliques hepatiques ictere cholestatique cholestase sans ictere vomissements fievre
0 1 2 3 4 5 6 7
Figure 7 : Signes fonctionnels
L’examen clinique était pauvre, un ictère était présent chez 3 de nos patients une sensibilité au niveau de l’hypochondre droit était présente chez trois de nos patients La triade clinique classique (ictère, sensibilité abdominale et masse de l’hypochondre droit) n’était complète dans aucun cas de notre série
V. Données paracliniques
A. Biologie
1) Signes de cholestase
- Une hyperbiluribinémie directe est observée chez deux patients avec des chiffres variables entre 2 et 36 fois la normale.
- Une hyperbilirubinémie totale est observée chez 2 patients avec des chiffres variables entre 2 et 21 fois la normale.
- Une augmentation du taux de PAL (>200UI/l) est observée chez 4 patients avec des chiffres variables entre 1.2 et 4 fois la normale
- Une augmentation des GGT (>27UI/l) est observée chez 4 patients avec des chiffres variables entre 2 et 10 fois la normale.
2) Signes de cytolyse :
- Une augmentation des transaminases est observée chez 3 patients avec un taux variable entre 2 et 43 fois la normale.
3) Signes d’insuffisance hépatocellulaire : Le taux de prothrombine est diminué chez 1 patiente Le TCA est allongé chez une patiente
4) Hémogramme
Tous les patients de notre série ont bénéficié d’une NFS-PQ, elle a objectivé : - Une anémie hypochrome microcytaire chez 4 patients soit 57% des cas. - Une hyperleucocytose à prédominance PNN chez 2 patients soit 28% des cas. - Le taux de plaquette est augmenté chez une malade.
- Un hémogramme normal est objectivé chez 2 malades soit des 28% cas. 5) Enzymes pancréatiques :
- Une lipasémie revenue élevée chez 2 patients soit des cas. - Une amylasémie revenue élevée chez 2 patients soit des cas.
La CA19-9 etait augmentée chez une patiente.
B. Imagerie
1) Echographie abdominale
Une échographie abdominale a été réalisée en première intention chez tous nos patients et elle a permis le diagnostic de la dilatation kystique chez 4 de nos malades
Figure 9: VBP de grand calibre et vésicule biliaire a paroi épaisse renfermant des micro calculs
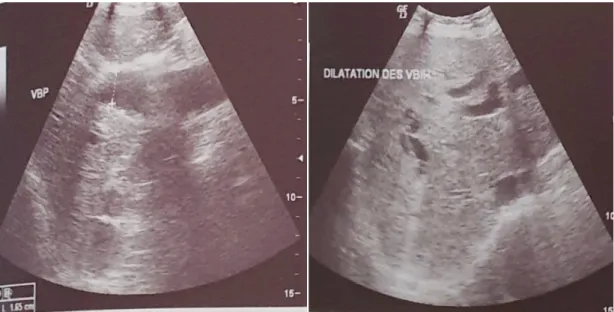
Figure 11 : Dilatation des VBIH et du choledoque sans obstacle individualisable 2) TDM abdominale
Une TDM abdominale était réalisée chez 4 de nos malades elle a permis le diagnostique de dilatation kystique dans 2 cas.
3) BILI-IRM
Une Bili-IRM a été faite chez 6 malades soit 85% des cas et a posé le diagnostic avec certitude. Un kyste de Type I selon la classification de TODANI est trouvé chez 2 patients et 4 cas avec un kyste de Type IVa. Un pancréas devisum complet a été observé chez un malade. Dans notre série, à l’IRM nous n’avons pas noté de signe de pancréatite ni de lithiase du canal de Wirsung. A noté q’une lithiase vésiculaire a été observée chez 3 patients et des lithiases de la VBP observées dans 2 cas
Figure 12: Dilatation kystique type I du cholédoque siège d’une lithiase Vésicule biliaire non individualisable
Figure 13 : DKC type IVb avec un cholédoque dilaté a 5 cm tortueux jusqu’en bas, visibilité du Wirsung qui est plat, VB en place non dilatée.
Figure 14 : diatation de la partie distale de la VBP et les VBIH (convergence biliaire basse), bas cholédoque de calibre normal
Figure 15 : DKC type IV
Figure 16 : DKC type IV avec distension vésiculaire et lithiases de la VBP et VBIH non obstructives
4) Echoendoscopie
Réalisée chez une patiente a trouvé une dilatation de la voie biliaire principale sans obstacle individualisable et sans épaississement pariétal
5) Cholangiographie rétrograde per endoscopique Non réalisée dans notre série
A. Traitement médical
Les patients en angiocholite ont beneficié d’une antibiotherapie probabiliste a spectre large couvrant les anaerobies puis adaptée aux resultats des hemocultures et des prelevements per-operatoires de bile.
Une suplementation en vitamine K administrée pas voie orale ou intra musculaire en cas de TP bas.
Une rehydratation et une correction des troubles hydro-electrolytiques chez tout nos patients.
B. Traitement chirurgical
Le risque de cancérisation de la dilatation kystique du cholédoque justifie un traitement chirurgical par résection en bloc de la VBP et une anastomose hepatico jejunale sur anse en Y avec un examen extemporané sur la pièce opératoire.
Le choix du type d’anastomose chirurgicale n’a pas été modifié par le type de dilatation kystique. La résection de la convergence biliaire était d’autant plus étendue que celle ci était kystique. La section de la partie basse du canal cholédoque était toujours la plus complète possible avec tunnelisation intrapancréatique. La cholécystectomie était systématique. La section de la partie basse du canal cholédoque laissait au minimum 3 mm de Pour ne pas léser la papille et le canal de Wirsung.
Ce traitement a été réalisé chez tout nos patients l’examen extemporané est revenu en faveur d’une cancérisation de la lésion dans un seul cas et le geste opératoire réalisé était une duodénopancréatectomie céphalique.
Figure 17 : Dissection des adhérences entre la vésicule biliaire distendue et le kyste du cholédoque
Figure 18 : Cholédoque disséqué et mis sur lac, vesicule biliaire liberée mais cystique non encore sectioné
Figure 21 : Section de la VBP principale au niveau de la convergence biliaire supérieure
VII. Suites opératoires
Les suites opératoires immédiates étaient simples chez 6 de nos patientes.
La patiente qui a bénéficié une duodénopancréatectomie céphalique a présenté une fistule pancréatique à j4 post operatoire et qui s’est tarie progressivement sous sandostatine apres 4 semaines.
Une de nos patiente a présenté à j+12 post opératoire un etat de choc hemodynamique avec deglobulisation sans hemmoragie exteriorisèe la tomodensitometrie abdominale a fait le diagnostique d’un faux anévrisme de la branche droite de l’artère hépatique. Une reprise chirurgicale a été décidée et une mise a plat a été réalisée, par la suite la patiente est décédée en réanimation a j+2 de la reprise chirurgicale par defaillance multiviscerale.
Pour les suites opératoires tardives une complication a été notée chez la patiente qui avait une dégénérescence maligne de la DKC, elle a été réadmise à 5 mois de sa chirurgie pour des vomissement incoersibles avec altération de l’état général, la TDM réalisée était en faveur d’une récidive tumorale locale. Une laparotomie a été réalisée elle a découvert une carcinose péritonéale généralisée. La patiente est décédée un mois plus tard.
DISCUSSION
I. Epidémiologie :
A. Fréquence :
Les dilatations kystiques du cholédoque représentent une entité anatomoclinique rare. L'incidence des DKC varie de 1 pour 100 000 à 1 pour 150 000 personnes dans les pays occidentaux [30]. Elle est beauccoup plus élévée au Japon ou elle atteint 1 pour 13 000 personnes [31].
B. Age
Près de 80% des cas sont diagnostiqués chez les nourrissons et les jeunes enfants au cours de la première décennie de vie [32,33]. Le caractère congénital de la pathologie est souligné par la notion de cas découvert à l’échographie anténatale. Les formes de l’adulte correspondent à une lésion qui existe déjà dès l’enfance et reste inaperçue car bien tolérée. L’âge moyen au moment du diagnostic dans notre serie est de 46 ans ctémoiganat d’un relatif retard au diagnostic.
C. Sex-ratio
C’est une pathologie 4 fois plus frequente chez les femmes que chez les hommes [34]. Dans notre série, le sex-ratio est de 6 (6F/1H)
II. Etude clinique :
La triade symptomatique classique révélatrice d’une DKC faite de douleurs abdominales, d’un ictère et d’une masse abdominale palpable ne serait complete que dans moins d’un tiers des cas, dans près des deux tiers des cas les patients présentent un ou deux des trois symptoms dans notre serie aucun patient ne presente la triade complete
A. La douleur
C’est le principal motif de consultation, quasi-constante chez l’adulte [35], elle est en rapport avec l’hyperpression régnant dans les voies biliaires, du fait de l’obstacle latent. Son siège habituel est l’hypochondre droit, mais plus rarement elle peut siéger au niveau de l’épigastre ou de la région péri-ombilicale, parfois elle est diffuse à tout l’abdomen.
L’évolution de cette douleur se fait par crises intermittentes, accompagnées parfois de nausées et de vomissements.
Dans notre série contrairement a la littérature la douleur epigastrique etait predominante.
B. L’ictere
En général c’est un ictère rétentionel avec urines foncées et des selles décolorées pouvant s’accompagner de prurit. Son intensité est variable.
Dans notre serie 4 patients ont presenté un ictere (57%)
C. Masse abdominale
Il s’agit d’une masse arrondie de l’hypochondre droit, bien limitée, régulière, lisse et mobile latéralement. Elle est habituellement indolore.
La masse palpable s’observe le plus souvent chez l’enfant et rarement chez l’adulte [34].
Dans notre serie aucun patient n’a presenté une masse abdominale palpable.
D. Les autres manifestations cliniques
· Syndrome fébrile : a pour origine l’infection biliaire, il peut prendre plusieurs aspects :
Fébricule à 38°C
Fièvre de type angiocholitique 38°-39°C, accompagnée souvent de frissons, de vomissements bilieux et d’ictère.
· Hépatomégalie.
· Signes généraux : amaigrissement et altération de l’état général.
· Signes fonctionnels : nausées, vomissements, urines foncées et selles décolorées. La triade classique : douleur, ictère et masse rénitente sous hépatique, n’a été objectivée chez aucun patient de notre série, les formes mono et bi symptomatiques sont par ailleurs les plus fréquentes ce qui correspond parfaitement aux données de la littérature.
III. Etude paraclinique
A. Biologie
Elle est sans intérêt diagnostique puisqu’elle n’a aucune spécificité. Elle apprécie la fonction hépatique.
Elle recherche les signes de cholestase, la cytolyse, les signes d’insuffisance hepato-cellulaire, un sydrome infectieux, une pancreatite
Dans notre serie la cholestase etait presente dans 57% des cas, la cytolyse 42%, un syndrome infectieux 28% et une pancreatite 28%.
B. L’IMAGERIE
1) ECHOGRAPHIE ABDOMINALE
L'échographie est la modalité d'imagerie la plus utilisée étant donné son faible coût et son accessibilité.
Une voie biliaire principale mesurant plus de 10 mm chez un adulte doit alerter le médecin sur les possibilités de dilatation kystique de l'arbre biliaire ou de lithiase biliaire obstructive. Il est important de noter que la dilatation biliaire intrahépatique est une indication pour une imagerie plus poussée afin de différencier les kystes de type I du type IVA [37].
Il est exceptionnel de mettre en évidence l’anomalie de la jonction biliopancréatique. En échographie, le diagnostic différentiel se pose en période néonatale avec une atrésie des voies biliaires de forme kystique, et chez le grand enfant ou l’adulte jeune avec une dilatation des voies biliaires secondaires à une lithiase du bas cholédoque, ainsi qu’avec les lésions kystiques de la tête du pancréas.
2) TOMODENSITOMETRIE ABDOMINALE
La tomodensitométrie (TDM) abdominale met en évidence une tumeur liquidienne bien limitée, étendue entre la confluence portale et le duodénum ; une cartographie de l’arbre biliaire et une délimitation précise de la lésion sont ainsi obtenues [38]. Elle intervient dans le diagnostic différentiel entre maladie de Caroli et maladie poly kystique du foie [39].
3) SCINTIGRAPHIE BILIAIRE
La scintigraphie biliaire au technétium 99 marquée à l’acide triméthylindodiacétique est une méthode simple, reproductible, non invasive, ayant une bonne sensibilité pour l’évaluation morphologique et la classification des kystes cholédociens ; cependant, cette sensibilité diminue pour l’appréciation de l’extension intra hépatique des lésions kystiques [40].
Examen non realisé dans notre serie
4) BILI IRM
Examen de référence non invasive et ne nécessitant pas d'irradiation ni de contraste oral ou intraveineux permettant une exploration multi plan des voies bilio pancréatiques. Elle montre l’ensemble des malformations de l’arbre biliaire permettant le diagnostic différentiel avec une pathologie obstructive [41].
C’est l’examen de reference pour le diagnostic et la classification de ce type de lesions.
Elle permet de faire suspecter la dégénérescence en montrant : une tumeur endoluminale polyploïde et / ou un aspect irrégulier épaissi de la paroi kystique.
Realisée chez 6 de nos malades elle a parmis le diagnostic positif et la classification des DKC.
5) CHOLANGIOGRAPHIE TRANSHEPATIQUE PERCUTANEE
C’est un examen que l’on pourrait proposer en préopératoire et même en présence d’ictère. En cas de dilatation kystique du cholédoque, les voies biliaires intrahépatiques ne sont pas toujours dilatées ce qui rend difficile la ponction trans hépatique. Cet examen a un rendement faible, mais reste toujours utile dans certains cas [42]. Cet examen n’a pas été réalisé dans notre série.
6) LA CHOLANGIOGRAPHIE PEROPERATOIRE
Elle montre parfaitement l’anatomie complète des systèmes pancréatique et biliaire, mais dans certains cas, le cholédoque distal n’est pas opacifié. Il est important d’opacifier les voies hautes à la recherche d’une seconde dilatation siégeant sur un canal hépatique, et de rechercher une lithiase.
7) CHOLANGIOPANCREATORAPHIE RETROGRADE ENDOSCOPIQUE (CPRE)
C’est une technique de référence dans le diagnostic et le traitement des affections bilio-pancréatiques. Ses indications se sont modifiées : la CPRE est maintenant moins utilisée pour ses applications diagnostiques en raison des performances obtenues par les autres méthodes diagnostiques telles que le scanner, l’IRM et l’écho-endoscopie [43]. Elle précède, le plus souvent, un geste thérapeutique endoscopique.
8) ECHO ENDOSCOPIE BILIOPANCRÉATIQUE
Son apport n’a été que rarement évalué. Certaines études ont confirmé l’excellente sensibilité de cette technique pour le diagnostic de kyste cholédocien, pour la recherche et l’analyse de la variété d’une AJBP ainsi que pour la recherché d’éventuels arguments en faveur d’une lésion tumorale associée, notamment vésiculaire [44,45].
IV. CLASSIFICATION
Le kyste du cholédoque a été découvert pour la 1ére fois par l’anatomiste allemand Abraham Vater en 1723, mais le 1ercas décris dans la littérature anglaise a été celui
d’une jeune fille de 17 ans, rapporté par Halliday Douglas of Edinburgh en 1852. La 1ére classification qui a été proposée par Alonso-Lej et ses collègues en 1959 [13-3], décrit 3 types de dilatation du cholédoque. En 1977, Todani et ses collègues ont élargi cette classification, qui est typiquement morphologique, en introduisant les dilatations intra hépatiques et les kystes multiples extra-hépatiques. Actuellement c’est la classification la plus utilisée.
Type I : il représente près de 90% des kystes du cholédoque. L’anomalie se développe sur la voie biliaire extra hépatique au-dessous des voies biliaires hépatiques et au dessus de la portion pancréatique du canal biliaire.
Le volume de la poche est variable ; il peut contenir jusqu’à plusieurs litres de bile. Ce type comprend 3 sous groupes :
Le type Ia : dilatation sacciforme. Le type Ib : dilatation segmentaire. Le type Ic : dilatation fusiforme
Type II : est un diverticule de la voie biliaire principale, rattaché par un pédicule habituellement court et étroit à une voie biliaire principale non kystique.
Type III : correspond au cholédococèle, qui est une dilatation kystique de la portion terminale du canal cholédoque faisant saillie dans la lumière duodénale : la voie biliaire principale sus-jacente est le plus souvent normale ou dilatée mais non kystique.
FIGURE 22 [46] : Vue per opératoire : A et B) flèche bleue : le cholédococèle ; C) pièce de résection
Type IV : comprend deux formes différentes :
IVa : est une dilatation kystique de la voie biliaire principale, quelque soit son type, associée à des dilatations kystiques intra hépatiques.
IVb : est une dilatation kystique multiple des voies biliaires uniquement extra hépatiques pouvant regrouper plusieurs des types précédents.
Type V : il s’agit de la maladie de Caroli [48].
C’est une dilatation congénitale non obstructive qui intéresse uniquement les voies biliaires intra hépatiques. C’est une maladie autosomique récessive rare, don’t la prévalence ne dépasse pas 1/1000000 de la population. Jusqu’à 1984, juste 162 cas qui sont rapportés.
Les résultats de notre série ne correspondent pas aux données de la littérature, les kystes types IVa sont les plus frequents 57% suivis du type I 43%.
V. EVOLUTION ET COMPLICATIONS
A. Evolution :
L’évolution spontanée des DKC est le plus souvent défavorable : la choléstase chronique et l’infection pouvant aboutir dans des délais plus ou moins rapides à une cholangite ascendante et à une cirrhose biliaire secondaire avec hypertension portale, la stase bilaire donne de plus une precipitation des sels bilaires qui entraine à son tour la formation de calculs qui eggravent la cholestase et l’infection.
Certaines complications émaillent, en l’absence du traitement, leur histoire naturelle ; il s’agit de complications mécaniques et infectieuses et surtout de cancerisation de la DKC.
B. Complications :
Elles sont principalement dues à la stase biliaire pouvant etre agravèe par la presence de calculs, la poussée de cholangite ou d’angiocholite, la perforation du kyste ou le cholepéritoine, la surinfection et la cirrhose secondaire et l’HTP.
Cependant la complication la plus grave est la cancérisation de la paroi du kyste Consecutive à une dysplasie croissante initiée et entretenue par l’inflammation chronique de l’épithélium bilaire du kyste [49].
1) LES COMPLICATIONS INFECTIEUSES :
a) Infection du contenu du kyste :
Due à la stase biliaire, les germes les plus responsables sont les germes Gram négatif. Cliniquement se manifeste par des épisodes récurrents de fièvre modérée, résolus par un traitement médical, mais les récidives sont fréquentes. [50,51]
b) L’angiocholite :
Se manifeste par la triade de Villard à savoir : douleur de l’hypochondre droit, la fièvre et un ictère dans cet ordre dans un délai de 24-72 heures au maximum.
La prise en charge se base sur le traitement médical et chirurgical[50]. c) La cholécystite :
C’est une complication rare mais peut révéler une DKC. d) Abcès du foie : rare
2) LES COMPLICATIONS MÉCANIQUES :
a) Lithiase intra kystique :
La stase biliaire favorise la formation de lithiase, qui peut bloquer le bas cholédoque [52].
b) La rupture :
La rupture spontanée est rare[53]. Son incidence est de 1.8% [54] à 2% [55], dans la majorité des cas [56] elle survient chez les enfants âgés de moins de 4ans. Son site habituel [57] est la jonction du canal cystique avec la voie hépatique commune dans 50% des cas, elle peut survenir [58] au niveau du kyste distal (25% des cas), ou au niveau de sa jonction avec le canal hépatique gauche. La cause de cette complication n’est pas bien élucidée. Le tableau clinique est habituellement une distension abdominale progressive, vomissements, et état de choc avec ou sans ictère.
c) La compression :
fonctionnel important.
En cas de kyste géant, il peut y avoir une compression de l’uretère avec Hydronéphrose.
d) La cirrhose biliaire secondaire :
La fibrose hépatique due essentiellement à la stase biliaire d’une part et l’infection d’autre part. La cirrhose reste une complication assez rare. L’hypertension portale s’installe avec splénomégalie, ascite, circulation
veineuse collatérale et varices oesophagiennes avec le risque d’hémorragie digestive.
3) LA DÉGÉNÉRESCENCE MALIGNE :
C’est la principale complication qui peut survenir sur n’importe quelle partie du kyste. Dans environ trois quarts des cas il s’agit d’un adénocarcinome [53-54-59]. Le risque de survenue de Cholangiocarcinome est 20 fois plus élevé chez les malades porteurs de DKC que dans la population générale.
Une récente expérience japonaise rapporte une prévalence de 35% chez les patients présentant un kyste du cholédoque associé à une anomalie de la jonction bilio-pancréatique, cette dernière est considérée comme un facteur de risque de la carcinogénèse biliaire [60-61]. En outre des concentrations importantes de substances cancérigènes ont été identifiées dans le contenu biliaire en présence de l’anomalie da la jonction bilio-pancréatique [62].
Le pourcentage de dégénérescence augmente lorsque la découverte du kyste est plus tardive, il atteint 50% des cas lorsque le kyste est découvert au-delà de 50ans [59-61].
La cancérisation est habituellement située dans la zone dilatée, mais la convergence biliaire, la partie basse du cholédoque, les voies biliaires intrahépatiques, et plus rarement la vésicule biliaire peuvent être atteints [59]. Tous les types de dilatation sont concernés, mais les types I et IV le sont plus souvent [10-59-63]. Le diagnostic radiologique de la dégénérescence du kyste repose sur la recherche d’un épaississement localisé ou diffus de la paroi kystique [64-65].
Le carcinome peut également survenir après dérivation biliaire sans excision de la dilatation kystique, sur la poche kystique laissée en place.
Dans notre serie la DKC s’est compliquée d’angiocholite dans 2 cas, des lithiases intra kystiques etaient observées dans 3 cas, et on a noté un seul cas de degenerescence maligne.
VI. TRAITEMENT
A. LES BUTS DU TRAITEMENT :
vers le tube digestif, d’éviter les complications et la dégénérescence.
B. LES MÉTHODES THÉRAPEUTIQUES :
1) TRAITEMENT MÉDICAL :
Il vise à traiter les complications aigues et a préparer ou accompagner les traitements instrumental et/ou chirurgical.
a) Traitement des perturbations métaboliques :
Il est essentiel au cours d’une septicémie avec ou sans insuffisance rénale. Perfusion intraveineuse permettant de rétablir un équilibre hydro-électrolytique et nutritionnel.
Traitement du choc septique, hypovolémique ; par un remplissage vasculaire sous contrôle de la pression veineuse centrale et de la diurèse ; lutte contre l’acidose métabolique.
Une épuration extra-rénale peut être indiquée avant le traitement spécifique de la lithiase biliaire [94].
b) Antibiothérapie curative de l’infection aigue :
Elle est toujours nécessaire, doit être entreprise d’emblée.
But: contrôler la dissémination bactérienne locale, hématogène en stérilisant les lésions tissulaires.
La choléstase associée n’empêche pas une concentration tissulaire hépatique normale ou élevée des ATB diffusibles, alors qu’elle diminue l’éventuelle excretion dans la bile.
Avant l’identification des germes : ATB à large spectre, actifs sur les BGN et les anaérobies : Aminoside+Ampicilline + nitromidozole [94].
2) TRAITEMENT ENDOSCOPIQUE :
Il se fait par une sphinctérotomie endoscopique: qui a pour but d’assurer un drainage biliaire efficace. Elle permet l’évacuation spontanée ou instrumentale de calculs biliaires. En cas d’obstacle bilio-pancréatique inextirpable la sphinctérotomie biliaire autorise le passage de drains ou de prothèses[66].
Gold et al ont décrit le placement d'un stent endobiliaire dans le lobe hépatique droit seul pendant 2 ans chez un patient atteint de DKC de type V avec une bonne réponse clinique. Ciambotti et al ont traité un patient atteint de la maladie de Caroli monolobaire et plusieurs calculs intrahépatiques par mise en place de stent pour 1 an, en association avec l'administration d'ursodésoxycholique acide (UDCA), jusqu'à ce que la charge calculs soit éliminé. L'utilisation continue de l'UDCA empêche formation de calculs intrahépatiques, en particulier chez des patients ayant une bile sursaturèe en cholestérol[66].
La sphincterotomie endoscopique utile dans le traitement des angiocholites graves mais represente egalement une indication therapeutique particuliere dans les
cholédochocèles « type III » de TODANI surtout chez des sujets agés vu le faibe risque de transformation maligne dans ce type de DKC [66,67].
3) TRAITEMENT RADIOLOGIQUE :
Le traitement radiologique ou le drainage par voie percutanée trouve peux d’indications en cas de DKC, il peux etre proposé en cas d’angiochlite aigue grave chez un sujet agé avec contre indications a l’anesthesie generale [65].
4) TRAITEMENT CHIRURGICAL:
a) Drainage externe:
Il peut être réalisé par cholédocotomie et mise en place d’un drain de Kher. Actuellement cette technique est abandonnée.
b) Drainages internes: La cholédocorraphie:
Réalisée par résection subtotale du kyste, cette technique n’assure pas un passage normal de la bile vers l’intestin ce qui rend la réintervention nécessaire[68].
La sphinctérotomie chirurgicale:
C’est une technique consistant à sectionner le sphincter d’Oddi pour ouvrir largement la voie biliaire, permettant ainsi un drainage adéquat de la bile. Mais les complications de cette méthode sont graves, à savoir :
- La pancréatite aigue
- La stase et l’infection du contenu de la poche kystique laissée en place augmente. - La sténose cicatricielle de la sphinctérotomie.
Cette technique pratiquée la première fois par Roux en 1958, est actuellement abandonnée.
Les Anastomoses kysto-digestives :
C’est une technique qui peut donner un bon drainage biliaire dans l’immédiat, mais peut exposer aux complications vu la stase biliaire possible.
Elles Peuvent se faire avec le duodénum, le jéjunum ou l’estomac. L’anastomose kysto-duodénale :
Réalisée la première fois par Braun et Hartmann (1898) [69-70-71].
C’est une anastomose qui doit être large (3cm) et se situer sur le point le plus déclive du kyste.
Elle est facilement réalisable, mais cette intervention entraine de multiples complications secondaires au reflux du contenu duodénal dans la dilatation et l’arbre
biliaire, entrainant une cholangite ascendante récurrente. La boucle de l’anastomose est également un facteur de formation d’une sténose entrainant une obstruction, la stase biliaire, la formation de calcul et par conséquent la cholangite récurrente ce qui impose une réintervention.
L’anastomose kysto-jéjunale sur anse exclue: Il existe deux techniques dans la littérature:
· Anse en Omega de Braun: n’est plus utilisée (figure24).
· La technique de Roux ou le montage en « Y »; utilisée la première fois par
l’auteur Tsujumura (1927), actuellement a la préférence par la plupart des auteurs. La technique consiste à sectionner le jéjunum au niveau de la 2éme ou 3éme anse et l’arcade vasculaire liée à ce niveau et à anastomoser l’extrémité d’aval à la voie biliaire, l’extrémité d’amont est réimplantée sur le jéjunum en termino-latéral à une distance suffisante pour que l’exclusion soit effectuée (40 à 60cm) (Figure). Cette intervention est plus longue et plus complexe que la kystoduodénostomie, protège la voie biliaire principale de tout reflux du liquide digestif et diminue ainsi les risques d’angiocholite. Le risque occlusif doit être prévenu par une péritonisation soigneuse[72].
FIGURE 24: A : Kysto-jéjunostomie sur anse exclue de BRAUN B : Kysto-jéjunostomie avec anse jéjunale sur anse en Y
Actuellement cette anastomose est rarement effectuée, car elle présente une morbidité importante due au reflux massif du contenu gastrique dans les voies biliaires.
les anastomoses hépatico-digestives avec exclusion de la dilatation kystique : [73]
Décrite par HEPP, cette technique consiste à sectionner le canal hépatique en amont de la poche s’il est de calibre convenable, ou en gardant une collerette du pole supérieur du kyste pour permettre une anastomose plus large. La dilatation kystique est fermée et laissée en place puis on réalise l’anastomose du canal hépatique et de l’anse exclue en « Y ».
Le risque de cette méthode est le reflux pancréatique dans la cavité kystique, favorisé par des anomalies d’abouchement sous-jacent.
c) Exérèse totale du kyste avec anastomose bilio-digestive:
Proposée la première fois par Mac-Werther (1924) et défendue par les auteurs anglo-saxons (Alonso-Lej) et asiatique (Kasaï, Ishida).
Actuellement, la résection totale du kyste suivie d’une anastomose hépaticojéjunale sur anse en Y est le traitement de choix [74], car elle réduit le risque de stase biliaire [73-76] et de la dégénérescence néoplasique [75-77], ainsi qu’elle assure la meilleure dérivation biliaire. L’exérèse peut être totale ou partielle:
Conduite de l’intervention: L’exploration:
- La dilatation kystique se présente sous forme d’une poche sous tension (Figure 26-A et B).
- Le foie peut être d’aspect normal, rétentionel ou cirrhotique.
- Il faut par ailleurs apprécier l’état du pancréas qui peut être le siège d’une pancréatite chronique ou aigue récente.
Exérèse de la poche kystique: o Exérèse totale:
La méthode la plus simple et la plus prudente est de sectionner la poche à sa partie moyenne et de disséquer son pôle supérieur de bas en haut: en progressant on doit surveiller la section afin de respecter la zone de convergence qui doit être conserve pour confectionner une seule anastomose (Figure 25).
poche kystique s’arrête au bord supérieur du pancréas l’exérèse totale est simple, ainsi la section inférieure va intéresser la voie biliaire normale dont la fermeture se fait par ligature ou suture au fil résorbable. Mais lorsqu’elle est en contact étroit avec la tête du pancréas alors le risque de léser le canal de Wirsung est majeur, on a recours donc à l’exérèse partielle [68].
FIGURE 25: Exérèse du kyste jusqu'à la convergence en le décollant du plan vasculaire postéro-interne
o Exérèse partielle:
Elle est préconisée dans le cas où la dilatation s’enfonce dans l’épaisseur du pancréas, dans ce cas l’extrémité inférieure de la partie dilatée du cholédoque est abandonnée sur place comme »un fond de coquetier ».
o Réparation: rétablissement
Deux montages sont possibles, mais le plus utilisé c’est l’anastomose hépaticojéjunale sur une anse en Y (Figure 26).
FIGURE 26: Anastomose hépatico-jéjunale termino-latérale sur une anse jéjunale en Y, montée dans la région sous-hépatique par voie transmésocolique.
Réparation par une anse jéjunale en Y:
Après section de l’arcade vasculaire, le jéjunum est sectionné au niveau de la deuxième ou la troisième anse, l’anse exclue est montée en transmésocolique au devant du 2éme duodénum et fermée à son extrémité par agrafage mécanique ou par suture. L’anastomose bilio-jéjunale est effectuée sur la convexité anté-mésentérique de l’anse montée, près du cul de sac avec un fil à résorption lente et en un seul plan.
La continuité jéjunale est rétablie par une anastomose termino-latérale. Pour éviter le reflux, l’anse exclue doit avoir 70cm de longueur.
La dissection, qui doit être délicate, en plein pédicule hépatique rend l’intervention difficile à réaliser et le temps opératoire plus long [78].
Réparation par une anse jéjunale isolée:
On isole une anse jéjunale de 30cm, qui reste vascularisée par les artères jéjunales correspondantes alors que l’arcade anastomotique est sectionnée pour assurer une mobilisation suffisante du segment isolé. Ce dernier est passé en transmésocolique au-devant du deuxième duodénum. La continuité jéjunale se fait par une anastomose jejuno-jéjunale termino-terminale. On fait une anastomose hépatico-jéjunale termino-latérale et on ferme l’extrémité supérieure de l’anse par agrafage ou par suture. Au niveau de son extrémité inférieure on réalise une anastomose jéjuno-duodénale termino-latérale en un plan à la soie avec la partie basse du deuxième duodénum. La brèche mésocolique est fermée autour du mésentère de l’anse jéjunale montée [79-80-81].