Résultats & discussion
Résultats et discussion
Chapitre 1 : Paramètres morpho-métriques
1.1 Résultats 1-1-1 - Taille
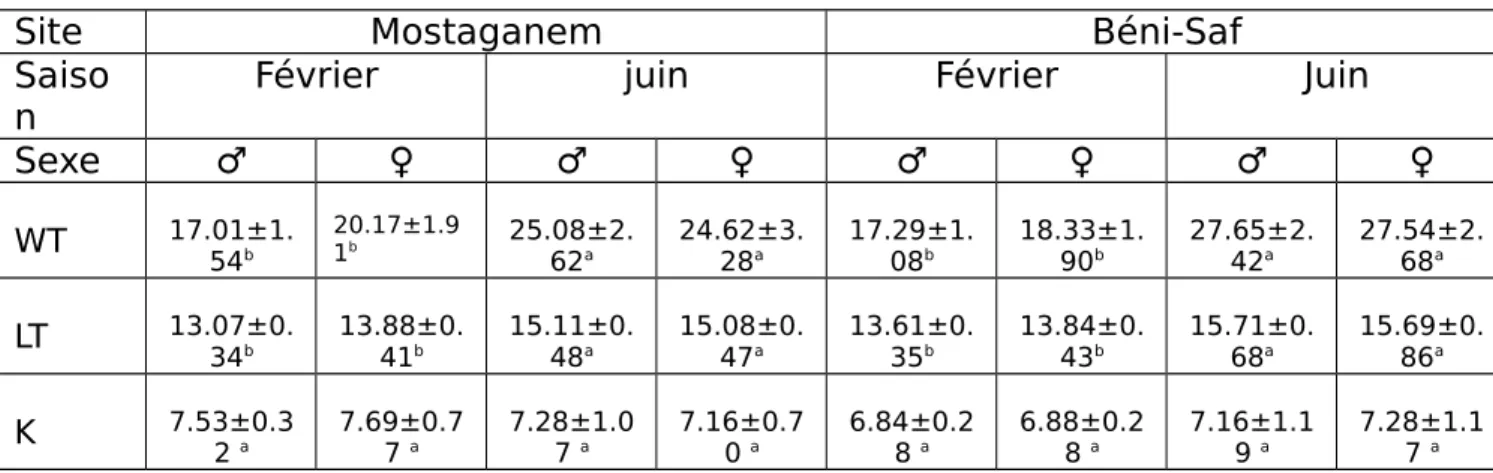
La mesure de la taille des sardines échantillonnées au niveau des deux sites (Béni-Saf et Mostaganem), durant les saisons hiver et été (février et juin) ; est présentée dans le tableau 11. Il ressort que les sardines pêchées au mois de juin dépassent celles de l’hiver de 2cm en moyenne (P<0.05). Les mesures des tailles indiquées précédemment, montrent une variabilité en fonction de la saison avec un maximum allant de (15.08 vs 15.71 cm) chez le mâle et la femelle et un minimum allant de (13.07 vs 13.88 cm) chez la femelle et le mâle (figure 18).
Tableau 11 : Taille des sardines échantillonnées (cm).
Site Mostaganem Béni-Saf
LT (cm) Février Juin Février Juin
Mâle 13.07±0.34 b 15.11±0.4
8 a 13.61±0.35
b 15.71±0.6
8 a Femelle 13.88±0.41 b 15.08±0.4
7 a 13.84±0.43
b 15.69±0.8
6 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=30). Les moyennes affectées d’une lettre
différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05). LT : longueur totale
Résultats & discussion
0 2 4 6 8 10 12 14 16 18
lo ngueu t t e r o al
M l â e ll s Feme e
lo r n gu e u (c m )
Figure 18 : Evolution de la taille de la sardine des sites étudiés.
1-1-2 - Poids
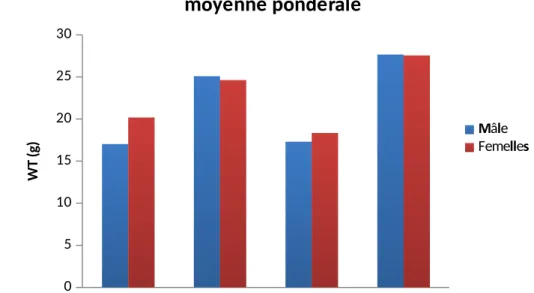
Les poids des deux sexes durant les mois de juin et février sont illustrés dans le tableau 12. Les sardines du mois de juin sont plus lourdes que celles du mois de février notamment pour le site de Béni-Saf. Toutefois, on trouve une légère différence entre les deux sexes mâles et femelles 15 et 2 % à Mostaganem, 6 et 0.5% à Béni-Saf respectivement février et juin.
Tableau 12 : Poids des sardines échantillonnées (g).
Site Mostaganem Béni-Saf
WT(g) Février Juin Février Juin
Mâle 17.01±1.54 b 25.08±2.62 a 17.29±1.08 b 27.65±2.42 a Femelle 20.17±1.91 b 24.62±3.28 a 18.33±1.90 b 27.54±2.68 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=30). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05). WT : poids
Résultats & discussion
Les paramètres de poids des échantillons mesurés montrent une supériorité de 39 % à
(P< 0.01) durant le mois de juin par rapport au mois de février pour les deux sexes et dans les deux sites (27.65 vs 17.01 g) (figure 19).
0 5 10 15 20 25 30
o o d ral
m yenne p n é e
M l â e ll s Feme e
W T (g )
Figure 19 : Evolution du poids de la sardine des deux sites.
1-2-Discussion
1 2-1- Taille
Il est à signaler qu’une légère hétérogénéité a été constatée entre le mâle et la femelle dans les deux zones pendant les deux saisons en faveur de la saison estivale avec une différence de 16.8%.
Généralement, la taille de la sardine varie selon les années, la zone et le sexe. L’analyse moyenne de la taille des échantillons est comparable avec celle obtenue par Mendez-Vilamil et al., (1997) effectuée aux Iles canaries, pour les femelles avec une valeur moyenne de 15.3cm.
Les valeurs de la taille des mâles concordent avec ceux obtenu par Abard et al., (1993) pour la mer d’Alboran ,avec une taille moyenne de 13.6 cm.
Par ailleurs, les résultats observés sur la taille des mâles et des
femelles sont légèrement inférieurs à celles obtenus par Amenzoui. et al .,
Résultats & discussion
(2005) de la région de Laâyoune au Maroc avec une différence respective de 16.5 % et 12.7%, probablement due aux conditions du milieu et au phénomène du upwelling responsable d’enrichir le milieu par des sels nutritifs et faisant apparaître des variations saisonnières marquées, influençant directement le cycle biologique de la sardine.
1-2-2 -Poids
Une perceptible différence de poids est notée entre les deux sexes au sein d’une même zone (Mostaganem) durant le mois de février (20.17 vs 17.01g) avec une différence de 16% probablement relative à la charge en œufs des femelles pendant l’activité de reproduction retardée, en comparaison à des femelles de la zone de Béni-Saf dont la ponte est précoce relative à la richesse du milieu marin.
Dans cette étude, la morphologie générale (taille, poids, sexe) sont des facteurs qui séparent les individus (Pinheiro et al., 2005) et mettent en évidence des différences inter origine de morphologie liées à la fois à des divergences génétiques entre les individus échantillonnées mais également aux conditions environnementales.
Or, Tudela (1999) a montré que les différences de poids entre des anchois d’origine géographiques diverses présentent aussi une variabilité liée aux conditions environnementales de leur milieu. L’effet des facteurs environnementaux sur le poids à déjà été décrit chez d’autres espèces, notamment chez les salmonidés (Imre et al., 2002).
Compte tenu de la dimension des sites étudiés et leurs complexités, les variations saisonnières observées dans les poids des sardines pourraient également suggérer l’existence, de différents morphotypes au sein d’un même site, comme cela a été décrit chez l’éperlan d’Amérique Osmerus moda (Lecomte et Dodson, 2005).
En outre, dans notre étude, les lieux de pêche varient avec les
saisons en fonction des pratiques de pêche et de l’activité des poissons. Or,
Résultats & discussion
aucune information suffisamment précise n’a pu être obtenue auprès des pêcheurs.
Conformément à la littérature, la variabilité pondérale pourrait être liée à de nombreux facteurs comme les mouvements, la quantité et la qualité de la nourriture, le niveau de stress ou la qualité de l’eau comme la rapporté Sara et al., (1999 ); Roncarati et al.,( 2001).
1-2-3- Facteur de condition (K)
Les valeurs de la condition K dans ce cas expriment la relation poids/
taille du poisson, sont représentées dans le tableau 13.
Tableau 13 : Coefficient de condition K.
Site Mostaganem Béni-Saf
Saiso
n Février juin Février Juin
Sexe ♂ ♀ ♂ ♀ ♂ ♀ ♂ ♀
WT 17.01±1.
54
b20.17±1.9
1
b25.08±2.
62
a24.62±3.
28
a17.29±1.
08
b18.33±1.
90
b27.65±2.
42
a27.54±2.
68
aLT 13.07±0.
34
b13.88±0.
41
b15.11±0.
48
a15.08±0.
47
a13.61±0.
35
b13.84±0.
43
b15.71±0.
68
a15.69±0.
86
aK 7.53±0.3
2
a7.69±0.7
7
a7.28±1.0
7
a7.16±0.7
0
a6.84±0.2
8
a6.88±0.2
8
a7.16±1.1
9
a7.28±1.1 7
aLes résultats sont présentés sous forme de moyenne ± écart type (n=30). Les moyennes affectées d’une lettre
différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
K= (WT/L
3)*10
3(Tesch,1971 ; Lalèyè et al.,1995 b).
Résultats & discussion
L’analyse du coefficient K, de nos échantillons, dans les deux sites, durant les deux saisons fin d’hiver et début d’été, respectivement février et juin (7.03 vs 7.10), fait ressortir une légère différence approximative à 0.9%.
Ces résultats se rapprochent de ceux obtenus par Amenzoui et al., (2005) avec une différence de K saisonnière d’environ 0.25 durant la 2eme année de l’étude effectuée dans la région de laâyoune du Maroc (figure 20).
0 5 10 15 20 25 30
WT LT W T/ LT K
Figure 20 : Facteur de condition K.
La faiblesse du facteur K " appelé aussi facteur du bien être
nutritionnel" de la région méditerranéenne, qualifiée d’oligotrophe est
relative à la faible production de zooplancton par rapport à la zone
atlantique, génératrice d’upwelling jouant un rôle déterminant dans le
contrôle de la production primaire et le développement de la nourriture,
Résultats & discussion
rendant ainsi l’habitat favorable à la production des poissons pélagiques (Ould Telmidi, 2005).
En effet, les facteurs de la condition K du mois de juin des deux régions de Béni-Saf et de Mostaganem n’ont pas exprimé une élévation proportionnelle avec l’augmentation de la température de l’eau, considérée comme facteur favorable à la croissance et au développement corporel des sardines (Silva et al., 2008).
Cet état stationnaire du K exprimé durant le deuxième prélèvement peut être en rapport d’une part à la faible intensité d’upwelling méditerranéenne, par comparaison aux côtes océaniques et d’autres part à l’entrée des eaux superficielles de l’atlantique par le détroit de Gilbraltar (Lioris et Rucabado, 1998) et (Obaton,1998) et l’absence de la remontée vers la colonne superficielle des eaux profondes plus froides, plus salées et plus riches en nutriments (nitrates, phosphates et silicates) nécessaires à la production du zooplancton . Cet état influe sur la diminution de la teneur en acide gras polyinsaturés au niveau des sites de stockage chez la sardine durant le mois de juin.
Chapitre 2
Composition biochimique du filet
2-1-Résultats
2-1-1- Matière sèche
Les valeurs de la matière sèche du filet sont représentées dans le tableau14. Elle exprime des différences significatives entre les deux saisons à (P < 0.05) avec un taux d’humidité de l’ordre de 73%, relativement élevé en février par rapport à juin, avec une différence respective de 14 % et 16%
pour les deux sites (Mostaganem et Béni-Saf).
Résultats & discussion
Tableau 14 : Teneur de matière sèche de la sardine en g/100g.
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
Matière sèche 22.9±2.0
b
26.7±0.5
a
21.9±2.3
b 26.1±0.8 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=3). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
2-1-2- Matière minérale
Globalement les teneurs en matière minérale enregistrées ne présentent aucune différence significative entre les deux sites et durant les deux périodes (tableau15).
Tableau 15: Teneur de matière minérale de la sardine en g/100g de matière fraiche.
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
Matière minérales 4.1±0.1 a 4.4±0.6 a 4.2±0.1 a 4.1±0.2 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=3). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
Les teneurs en minéraux présentées dans le filet de la sardine analysée sont variables. (tableau 16). Elles laissent observer que le phosphore et le sodium prédominent en juin et dans les deux sites. Par contre, le magnésium présente un taux légèrement élevé en février par rapport à juin dans les deux sites respectivement à Mostaganem et Béni- Saf. Le calcium présente une similarité à l’exception de juin à Béni-Saf 82.33%.
Tableau16 : Teneur en sels minéraux de la sardine en mg/100g de filets.
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
Résultats & discussion
Phosphore 196±2 b 211±2,94 a 217,33±9,45 a 223±3,6 a Calcium 76±3,6 b 72,33±2,08 b 71,66±2,51 b 82,33±3,20 a Magnésium 21±2,64 a 18,33±2,08 a 22,66±2,08 a 21,66±1,52 a Sodium 95,66±2,51 b 99,67±2,08 b 97,33±2,1 b 107±2,64 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=3). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
Dans l’ensemble les proportions des différents minéraux se rapprochent pour l’ensemble des échantillons analysés (figure 21).
0 50 100 150 200 250
os or Ph ph e (mg)
al
C cuim (mg) Ma gné uim (mg) s
od
S uim (mg)
M g
Figure 21: Minéraux analysés dans la chair de sardine.
2-1-3- Protéines
Les teneurs en protéines du filet de la sardine, représentées dans le tableau 17 présentent une supériorité (P<0.05), durant le mois de juin respectivement à Mostaganem et Béni-Saf 23.22 et 23.95.
Tableau 17: Teneur en protéines la chair de sardine (g/100g de filet).
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
Protéine 19,25±8,9
5 b
23,22±9,95
a
21,19±10,25
b
23,95±12,2
Résultats & discussion
a
Les résultats sont présentés sous forme de moyenne ± écart type (n=3). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
Une différence de 16% et 12% respectivement durant le mois de juin et février dans les deux zones (figure 22) a été notée.
0 5 10 15 20 25
ro s
P téine
ro P téine
ra g m m e
Figure 22: Teneur en protéines des sardines analysées en g/100g.
2-1-4-Lipides totaux
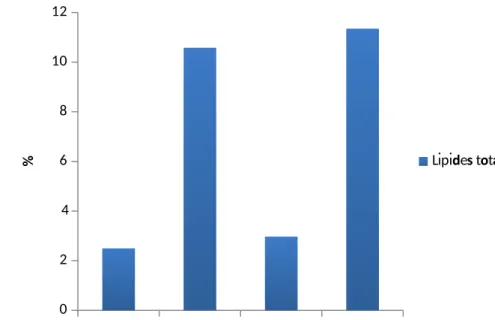
L’analyse des lipides obtenus de la sardine, au niveau des deux régions et durant les deux périodes de l’année révèle une prédominance des lipides pendant le mois de juin par rapport au mois de février (tableau 18).
Tableau 18 : Teneur en lipides de la sardine au niveau des deux sites en g/100g de matière fraiche.
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
Résultats & discussion
Lipides Totaux 2,49±0,85
b 10,58±0,73
a 2,97±0,93 b 11,35±1,29 a
Les résultats sont présentés sous forme de moyenne ± écart type (n=10). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
Les valeurs exprimées en pourcentage, montrent des taux élevés en lipide équivalentes (figure23) à cinq fois plus, durant le mois de juin par rapport à février. Une nette ressemblance à été observée entre le site de Mostaganem et Béni-Saf durant le mois de juin (10.58 vs 11.35%) ainsi que durant le mois de février (2.49 vs 2.97%).
0 2 4 6 8 10 12
d s o a Lipi e t t ux%
%
Figure 23 : lipides totaux des échantillons au niveau des deux sites.
2-1-5 -Le profil des acides gras
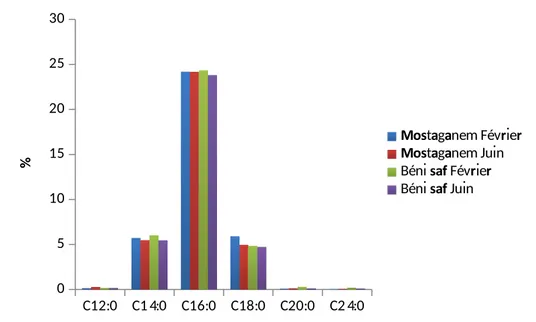
Les acides gras identifiés (tableau19) laissent observer un profil dominé respectivement par les AGPI (C22 :6, C20 :5, C18 :3, C20 :4, C18 :2), les AGMI (C18 :1, C16 :1, C14 :1) et les AGS (C16 :0, C18 :0, C14 :0).
Tableau 19 : Composition en acides gras du filet de la sardine (en % d’AG
identifiés).
Résultats & discussion
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
C12:0 0,16±0,02
b0,28±0,14
a0,17±0,01
b0,17±0,11
bC14:0 5,74±0,14
a5,49±0,12
b6,01±0,43
a5,47±0,34
bC14:1 1,33±0,13
a1,47±0,07
a1,21±0,13
b1,22±0,16
bC16:0 24,21±0,61
a24,18±0,19
a24,33±0,69
a23,82±0,68
aC16:1(n-7) 4,59±0,33
a4,5±0,33
a3,83±1,25
b4,61±1,14
aC18:0 5,92±0,24
a4,98±0,25
b4,85±0,75
b4,73±0,22
bC18:1(n-9) 14,54±1,68
a13,74±1,98
a12,92±2,95
b10,63± 1,90
bC18:2(n-6) 1,79±0,17
a1,98±0,68
a1,81± 0,36
a1,89±0,21
aC20:0 0,09±0,07
b0,14±0,07
b0,31± 0,45
a0,12± 0,06
bC18:3(n-3) 2,83±0,39
a2,22±0,29
b2,22±0,24
b2,83±0,46
aC20:1(n-9) 0,31±0,05
b c0,24±0,02
c0,59±0,187
a0,36±0,06
bC20:2 0,06±0,03
b0,12±0,018
b0,25±0,20
a0,14±0,02
aC20:3(n-6) 0,32±0,11
b0,34±0,01
b0,43±0,24
a0,31±0,02
bC20:4(n-6) 2,63±1,12
a1,16±0,07
b2,23± 0,55
a1,63± 0,65
bC20:5(n-3) EPA 10,49±0,59
b10,57±0,76
b9,85±1,02
b11,41± 0,58
aC24:0 0,05±0,07
b0,07±0,03
b0,21±0,26
a0,12±0,04
aC24:1(n-9) 0,71±0,10
b0,68±0,07
b1,02±0,14
a0,69±0,08
bC22:5(n-3) DPA 1,70±0,19
c1,55±0,07
c2,47±0,44
a1,95± 0,21
bC22:6(n-3) DHA 25,48±1,87
a b26,59±1,35
a26,66±1,88
a24,08±2,31
bAGS 34,98±0,78
b35,02±0,42
b37,06±2,34
a34,52±0,77
bAGM 19,86±1,90
b20,63± 1,83
a17,27± 1,64
c21,41±2,22
aAGPI 45,32±1,77
a44,52±1,89
b45,95±1,89
a44,24±2,20
bdont n-6 4,73±0,97
a3,48±0,71
b4,49±0,59
a3,83±0,59
bdont n-3 40,77±2,03
b41,29±1,51
a41,66±2,09
a40,57±2,18
bLA/ALA 0,65±0,14
a0,93±0,38
a0,82±0,09
a0,70±0,25
aLes résultats sont présentés sous forme de moyenne ± écart type (n=10). Les moyennes affectées d’une lettre différente dans une même ligne indiquent un effet significatif de l’aliment (P<0,05).
Les AGPI exprimés en mg/100g d’échantillon sont deux fois supérieurs aux teneurs d’AGMI obtenus. Ils sont dominés majoritairement par le DHA et EPA (tableau20).
Tableau 20: Composition en acide gras du filet de sardine en mg/100g échantillon.
Site Mostaganem Béni-Saf
Saison Février Juin Février Juin
LT % 2,52±0,70
b10,62±0,76
a2,73±0,86
b11,44±1,48
aC12:0 1,92 ±0,57
c9,05±1,03
a5,03±6,80
b10,29±7,33
aC14:0 68,65±22,82
b297,53±41,87
a88,25±63,70
b343,11±47,99
aC14:1 15,37±4,83
b79,91±11,13
a17,21±10,72
b75,77±8,96
aC16:0 289,61±94,17
b1313,60±169,5 364,16±268,57 1497,69±217,0
Résultats & discussion
8
a b9
aC16:1(n-7) 54,20 ±15,85
c244,12±44,42
b55,85±49,75
c296,03±90,39
aC18:0 57,19±19,85
b269,95±34,91
a91,31±78,11
b305,00±47,85
aC18:1(n-9) 151,97±44,99
c750,59±110,18
b
154,66±105,21
c
923,23±217,21
a
C18:2(n-6) 21,78±8,24
b105,69±37,83
a27,03±20,26
b118,35±15,49
aC20:0 1,10±0,55
b7,99±3,10
a7,95±15,75
a6,97±3,03
aC18:3(n-3) 33,9±11,15
c120,63±21,63
b33,54±24,19
c178,71±41,65
aC20:1(n-9) 3,66±1,17
c13,25±2,16
b9,29±9,38
bc22,66±4,56
aC20:2 1,16±0,46
c6,52±1,44
b5,18±8,09
b8,99±1,94
aC20:3(n-6) 3,83±1,81
c18,27±2,39
a8,10±9,66
b19,48±2,92
aC20:4(n-6) 27,31±9,38
c63,22±8,75
b33,65±28,28
c105,98±59,28
aC20:5(n-3)
EPA 126,46±44,44
c571,25±105,08
ab
142,09±89,56
b717,14±108,33
a
C24:0 0,73±0,72
b4,15±1,96
a5,02±9,26
a6,93±3,11
aC24:1(n-9) 8,80±3,75
c37,21±5,29
a14,96±11,02
b42,73±5,25
aC22:5(n-3)
DPA 20,57±7,07
c84,04±11,45
b36,32±27,13
c122,81±22,16
aC22:6(n-3)
DHA
307,00±113,54
b
1445,46±205,0 0
a388,22±254,26
b
1502,06±161,9 1
aAGS
419,19±137,35
c
1902,27±245,1 7
b561,73±438,88
c
2169,99±306,4 3
aAGM 233,99±69,37
b1125,08±142,0 8
a251,98±169,64
b
1360,00±300,6 0
aAGPI
542,01±181,80
c
2415,07±354,9 6
b674,16±455,25
c
2773,93±361,6 6
adont n-6 52,92±14,25
c187,18±43,49
b68,79±57,15
c243,80±68,37
adont n-3
491,75±175,83
b
2239,64±329,1 7
a608,29±401,71
b