Partie bibliographique
Chapitre I : Les Produits Marins
I. La pêche et l’aquaculture dans le monde
I.1. Intérêt du poisson
Le poisson joue un rôle important dans la nutrition humaine en raison de ses qualités nutritionnelles mais aussi pour le vaste choix qu’il offre au niveau gustatif, de la texture ou de la forme sous laquelle il est commercialisé : entier ou en filet, frais, congelé, salé, fumé, séché ou transformé (Conserves, plats préparés, surimi…). En 2001, la consommation moyenne au niveau mondiale était de (16,3 kg/hbt) (Duma, 2006).
Cependant, les apports en protéines animales moyens sont encore majoritairement issus de la viande, la volaille et des produits laitiers (FAO fisheries departement – 2004). Cette différence serait due essentiellement à des problèmes de goût et de culture (Roy et Durand, 1997). Pourtant les qualités nutritionnelles du poisson sont en général supérieures ou égales à celles de la viande, la teneur en protéines de la chair de poisson étant, quelle que soit l’espèce, équivalente à celle de la viande (Piclet, 1987).
I.2.Analyse de la Production mondiale
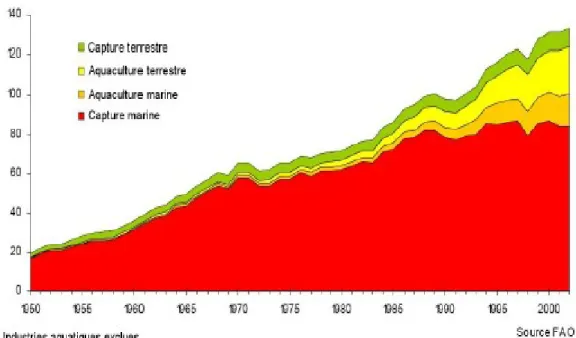
La production mondiale des pêches de capture et de l’aquaculture a fourni en 2002 environ 133 millions de tonnes de poissons dont 101 millions sont destinées à la nutrition humaine. Les 24%
restant sont, quant à eux, destinés principalement à la production d’huiles et de farines (FAO fisheries
departement - 2004). Depuis les années 50, la production mondiale des produits de la pêche est passée
de 20 à 130 millions de tonnes (Figure 1).
Partie bibliographique
Figure 1 : Production mondiale des pêcheries en millions de tonnes provenant des pêches de capture et de l’aquaculture de 1950 à nos jours (FAO fisheries departement - 2005).
Les quantités mondiales débarquées provenant des pêches de capture restent relativement stables depuis la fin des années 90. En effet, depuis cette date, les quotas de pêches fixés ont été atteints et l’augmentation de la production totale des produits de la pêche est due principalement au développement de l’aquaculture. La Chine est de loin le plus gros pays producteur avec, selon les quantités déclarées, 44,3 millions de tonnes en 2002 (16,6 millions de tonnes provenant des pêches de capture et 27,7 millions de tonnes de l’aquaculture).
I.3. Analyse de la production nationale
L’analyse de la production halieutique nationale toutes espèces confondues, montre trois périodes bien distintincts ; la première allant de 1990 à 1994, marquée par un accroissement continu de la production. Elle est passée de 91 mille tonnes à 135 mille tonnes, soit une progression de 48.3 %.
De 1995 à 1999, la production nationale connaît un fléchissement très remarquable. L’année
1999 marquait la production la plus faible sur toute la décennie. Dans cette année, la production totale
retombait à près de 98 milles tonnes. La troisième phase coïncidait avec la création du Ministère de la
pêche est des ressources halieutiques. Cette phase allant de 2000 à 2003 est caractérisée par un
accroissement rapide de la production nationale, soit une progression de 42.5 %. (Figure 2).
Partie bibliographique
Figure 2. Evolution annuelle de la production halieutique nationale (source MPRH-2004).
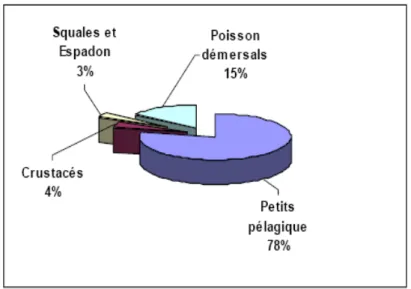
Par ailleurs, les captures des petits pélagiques constituent les apports les plus importants (Figure3) avec une moyenne d’environ 78% de la production totale nationale en 1998 (CNDPA, 1999) contre 22% pour les autres espèces (crustacés, mollusque, squales, espadons et poissons (démersaux).
(Kadari,1984).
En effet, l’abondance des petits pélagiques est liée à l’abondance de la nourriture, en particulier le plancton. Ce dernier est étroitement lié aux conditions climatiques (courantologie, températures et les sels nutritifs, etc.).
Figure 3 : Répartition de la production nationale par groupe de poisson
(Source CNDPA, 1999).
Partie bibliographique
1.3.1 Analyse de la production de la sardine
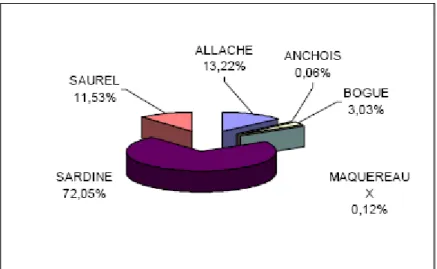
Cette analyse montre l’importance de la sardine dans les débarquements des petits pélagiques, comme le montre la figure4 ci-dessous, plus de 70% des débarquements des petits pélagiques sont constitués par la sardine.
Figure 4 : Proportion des espèces dans les captures (source DPRH 2004).
II. Biologie du poisson II.1 Classification
Deux types de poisson sont distingués : Cartilagineux et osseux, un autre type ne possédant pas de mâchoires présente peu d’intérêt. Par ailleurs, les poissons peuvent être divisés en espèces grasses ou maigres mais ce type de classification se fonde sur des caractéristiques biologiques et technologiques (Tableau 1).
Tableau 1 : Classification des poissons (Thurman et Weber, 1984).
Super ordre Caractères biologiques Caractères technologiques Exemples
Cyclostomes Poissons
sans mâchoires
Chair grasse et savoureuse Lamproie Chondrichthyes Poissons
cartilagineux
Teneur en urée élevée dans le muscle
Requin,
raie, pocheteau Téléostéens
ou poissons osseux
Pélagiques Poissons gras
(emmagasinant des lipides Dans le foie seulement)
Hareng, maquereau,
sardine, thon, sprat
II.2 Structure cellulaire du muscle
Partie bibliographique
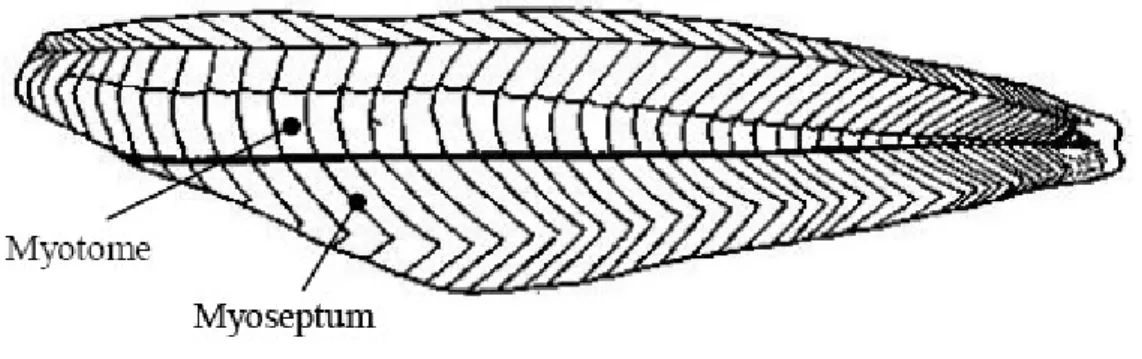
Les muscles ont une structure caractéristique en métamères. La chair de poisson est organisée en feuillets musculaires, appelés myotomes séparés par des cloisons de tissu conjonctif, les myoseptums (Figure 5).
Figure 5: Structure du muscle de poisson (d'après Borresen, 1995).
Deux types de fibres musculaires sont recensés chez le poisson (Luther et al., 1995). Les fibres rouges, qui composent les muscles rouges, sont caractérisées par une forte proportion en mitochondries et en myoglobine. Ce type de muscle est très fortement vascularisé et sert à des mouvements lents et répétés. Il se situe généralement sous la peau sur les flancs du poisson. Les fibres blanches, qui constituent l'essentiel du muscle du poisson, permettent une contraction rapide et courte. La part de ces différents muscles varie entre les espèces d’où des différences de couleur de filet. En effet, chez les espèces pélagiques, comme la sardine, le hareng ou le maquereau, qui nagent plus ou moins continuellement, plus de 48% du poids du corps est constitué de muscles rouges (Love, 1970). Les espèces démersales, qui se nourrissent sur ou à proximité du fond, ne possèdent que très peu de muscles rouges. La sardine contient 24g de muscle brun pour 100 g de muscles totaux, alors qu’il est présent en plus faible proportion chez les poissons maigres, 0,5 g de muscle brun pour 100 g de muscles totaux de cabillaud (Suzuki et Watabe, 1986 ; Shimizu et al., 1992).
Les pigments responsables de la couleur de la chair sont représentés à 90 % par la myoglobine,
les autres pigments étant l’hémoglobine et des cytochromes. Le muscle blanc des poissons maigres
contient environ 6 mg de myoglobine et d’hémoglobine pour 100 g de muscle alors que dans le cas des
poissons gras (sardine et maquereau), ce taux atteint 20 mg pour 100 g de muscle. Ainsi, le muscle
blanc des poissons gras est plus sombre que celui des poissons blancs car il contient plus de pigments
héminiques,(Shimizu et al., 1992).
Partie bibliographique
Les différences entre le muscle blanc et le muscle brun sont inhérentes à la fonction physiologique de ces muscles. Les muscles blancs contiennent une majorité de fibres musculaires qui présentent un métabolisme de type glycolytique. Les muscles rouges présentent un métabolisme de type oxydatif, ils contiennent une majorité de fibres à contraction lente dont l’activité ATPasique est faible. Ces fibres sont pauvres en glycogène et tirent leur source d’énergie essentiellement de la ß-oxydation des acides gras. Ce métabolisme explique la forte teneur en lipides des muscles rouges des poissons gras (Henderson et Tocher, 1987 ; Hillgartner et al., 1995).
III. Qualité nutritionnelle du poisson
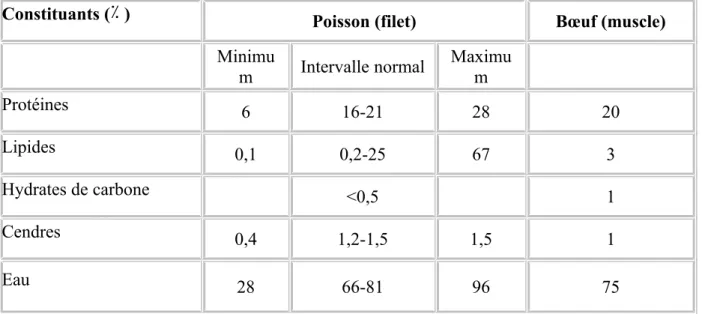
D’une espèce à l’autre mais également d’un individu à l’autre, les teneurs des principaux composants de la chair de poisson peuvent varier dans de larges proportions: 53 à 81% d’eau, 13 à 24% de protéines et à 31% de lipides (Dunajski, 1979) (Tableau 2). Généralement, l’eau et les lipides représentent environ 80% du poids frais du muscle de poisson (Ackman, 1995). Ces variations sont dépendantes à la fois de facteurs endogènes (facteurs génétiques, taille, sexe, stade de vie) et exogènes (facteurs environnementaux, alimentaires,…) (Shearer et al., 1994). Par ailleurs, les teneurs en lipides, en protéines et en eau sont inter-dépendantes (Yeannes et Alimandos, 2003).
Tableau 2 : Principaux composants des muscles de poisson et de bœuf.
(Source: Stansby, 1962, Love , 1970).
Constituants (٪ ) Poisson (filet) Bœuf (muscle)
Minimu
m Intervalle normal Maximu m
Protéines 6 16-21 28 20
Lipides 0,1 0,2-25 67 3
Hydrates de carbone <0,5 1
Cendres 0,4 1,2-1,5 1,5 1
Eau 28 66-81 96 75
III.1. Protéines et acides aminés libres
Partie bibliographique
Les protéines sont les constituants organiques majeurs des tissus de poissons, puisqu'elles constituent environ 60 à 75% du poids sec de ces tissus (Puwastien et al., 1999; Sterner et George, 2000; Tanner et al., 2000), soit 18 à 22% du poids frais (Haard, 1992).
Les protéines du tissu musculaire de poisson peuvent être regroupées en 3 groupes (Tableau 3):
- les protéines de structure (protéines myofibrillaires) telles que l'actine, la myosine, les tropomyosines, les troponines, la desmine, la titine, la nébuline, l'α-actinine (Ladrat et al., 2003) qui constituent 70 à 90% des protéines totales (Borresen, 1995).
- les protéines sarcoplasmiques, incluant la myoglobine,la globuline et les enzymes (Hernandez- Herrero et al., 2003), qui représentent 10 à 30% des protéines totales (Haard, 1992;
Borresen, 1995).
- les protéines du tissu conjonctif, élastine et collagène essentiellement (Purslow, 2005), qui constituent 3 à 10% des protéines chez les Téléostéens (Haard, 1992; Borresen, 1995).
La chair des poisons osseux contient environ 3% de tissus conjonctifs dont le composant principal est le collagène (Rasmussen, 2001), alors que pour les poissons cartilagineux, cette teneur peut atteindre 10%( Dunajski, 1979). La teneur en collagène et sa distribution dans le muscle peuvent être liées au mode de nage des poissons (Yoshinaka et al., 1988).
La teneur en protéines des poissons est globalement stable (Karakoltsidis et al., 1995) et indépendante du sexe et de la taille des individus (Robards et al., 1999). Cependant, une réduction de la teneur en protéines a tout de même été observée chez le saumon en période de migration et de reproduction (Aksnes et al., 1986), chez la morue (Gadus morhua) lors d'un jeûne prolongé (de 15.1% à 14.7% de protéines du poids frais) (Beaulieu et Guderley, 1998).
Tableau 3:Teneur des différentes fractions protéiques dans le muscle de poisson et de bœuf
(D'après Haard, 1992).
Partie bibliographique
Par ailleurs, certains auteurs montrent qu'une augmentation de la teneur en protéines de l'aliment induit un accroissement de la teneur en protéines du poisson (Britz et Hecht, 1997; Gunasekera et al., 1997), tandis qu'aucun effet n'est mis en évidence dans d'autres études comme chez la perche commune (Mathis et al., 2003), le saumon (Sveier et al., 1999) ou le red drum (Sciaenops ocellatus) (Thoman et al., 1999).
Ces différences sont probablement à mettre en relation avec les teneurs en protéines des aliments.
En effet, un apport trop faible en protéines ou une carence en acides aminés essentiels de l'aliment induisent une diminution de la croissance ou une perte de poids du fait de l'utilisation des protéines des tissus non-vitaux pour assurer le fonctionnement des tissus vitaux (Wilson.2002).
III. 2. Lipides et acides gras
Les poissons possèdent deux types de lipides: les lipides neutres (triglycérides) et les lipides polaires (phospholipides). Les réserves énergétiques du poisson se font principalement sous la forme de triglycérides. Les phospholipides eux, sont plus des lipides de structure puisque ce sont les constituants majeurs des membranes cellulaires. Le stockage des lipides peut se faire dans plusieurs tissus: foie, muscle, tissu adipeux périviscéral et parfois, tissu adipeux sous-cutané (Sheridan, 1988).
L’importance de ces sites de stockage varie selon les espèces. D’une manière globale, les viscères et le
foie sont les lieux de stockage principaux pour les espèces d’eau douce: tissu périviscéral chez la
perche commune (Kestemont et al., 2001; Xu et Kestemont, 2002) et chez les Salmonidés (Zhou et al.,
1996;Morgan et al., 2002), alors que c’est principalement le foie pour les espèces marines (Corraze,
1997; Corraze et Kaushik,1999). De plus, des différences de teneurs en lipides existent au sein d'un
même filet (Toussaint et al., 2005).
Partie bibliographique
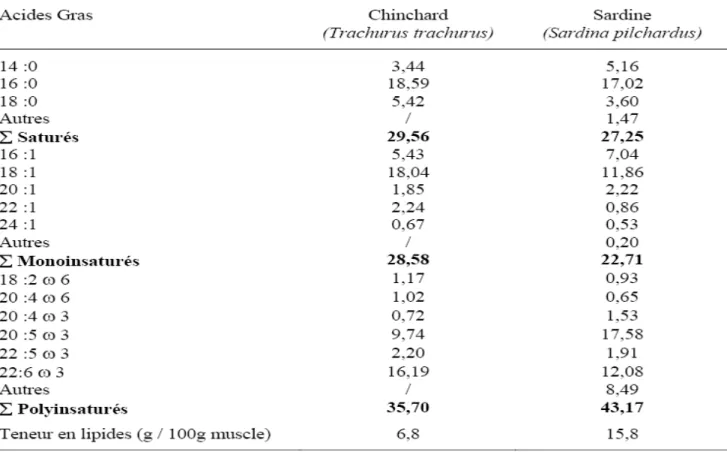
Les poissons possèdent toutes les classes de lipides connues dans le monde animal. Toutefois, ce sont par excellence les animaux qui ont les tissus les plus riches en acides gras polyinsaturés de la série n-3 (15 à 36% de l’ensemble des acides gras présents contre 1% chez le porc, 2% chez le bœuf et 4% chez le poulet) (Corraze,1997). Cette richesse en n-3 AGPI est liée au régime alimentaire, puisque les acides gras du phytoplancton sont composés en moyenne de plus de 40% de n-3 AGPI, lesquels sont conservés aux niveaux trophiques supérieurs: 15 à 20% dans le zooplancton et environ 20% chez les poissons (Sargent et al., 1989).
Tableau 4 Composition en acides gras (g/100 g acides gras totaux) des lipides de chinchards (Trachurus trachurus) capturés en novembre 1997 (Bandarra et al., 2001) et de sardines
(Sardina pilchardus) capturées en novembre 1994 (Bandarra et al., 1997).
Il existe par ailleurs des différences importantes de composition en acides gras entre les
poissons marins et dulçaquicoles. Ces différences peuvent trouver leur origine dans la composition des
Partie bibliographique
proies ingérées. Dans le milieu marin, les proies présentent des teneurs faibles en AGPI n-6 mais de fortes teneurs en acide eicosapentaénoique (EPA) et en acide docosahexaénoique (DHA).
Par conséquent, les poissons marins sont caractérisés par de fortes teneurs en AGPI n-3, notamment en EPA et en DHA (Steffens, 1997). Dans les écosystèmes d’eau douce, les proies sont essentiellement constituées d'acide linoléique (C18:2n-6), mais également d'acide linolénique (C18: 3 n-3) et de DHA (Henderson et Tocher, 1987). Le métabolisme lipidique entre les poissons d'eau douce et les poissons marins diffère. En effet, la capacité à la bioconversion du C18:3n-3 en EPA et en DHA est très faible pour les poissons marins, du fait des faibles activités enzymatiques de la Δ5 désaturase et des C18-C20 élongases (Sargent et al., 2002). Ainsi, l'alimentation des poissons marins doit inclure des matières suffisamment riches en EPA et en DHA, de manière à couvrir les besoins nutritionnels de ces poissons.
III.2.1. Facteurs de variation de la teneur en lipides et de la composition en acides gras La teneur en protéines totales étant quasiment stable, les variations de la composante nutritionnelle de la qualité des poissons concernent essentiellement la teneur en lipides et la composition en acides gras. Les teneurs en lipides ainsi que la composition en acides gras sont soumises à de nombreux facteurs de variations.
a. Facteurs intrinsèques a.1. Taille/âge du poisson
Pour la grande majorité des poissons, une augmentation graduelle de la teneur en lipides corporels intervient avec l’âge et la taille (Fauconneau et al., 1995; Weatherup et McCracken, 1999;
Sogard et Spencer, 2004), bien que cela ne soit pas le cas chez le hareng (Nielsen et al., 2005).
Cependant, cette augmentation n'est pas toujours linéaire puisque, chez le tilapia (Oreochromis mossambicus), la teneur en lipides corporels est maximale pour des poissons âgés de 6 mois, puis diminue progressivement par la suite (Ramachandran Nair et Gopakumar, 1982). De plus, il est rapporté que le profil en acides gras de la chair varie avec l'âge du poisson (Kiessling et al., 2001;
Kiessling et al., 2005).
Ceci semble lié non pas à l'accroissement des lipides musculaires avec l'âge mais à une
incorporation sélective de certains acides gras, notamment des acides gras monoinsaturés et
Partie bibliographique
polyinsaturés n-3, dont les teneurs augmentent et diminuent respectivement avec l'âge (Kiessling et al., 2005).
a.2. Etat physiologique/saison
Les poissons ont un cycle de reproduction saisonnier, impliquant des phases de développement et de maturation. Au cours de ce cycle, se succèdent des périodes de stockage d'énergie sous forme de lipides, de mobilisation et de transfert de ces lipides des sites de dépôt vers le foie pour y être métabolisés, puis transportés vers les gonades (Craig et al., 2000; Grigorakis et al., 2002). Chez la perche commune, plus de 86% de l’énergie stockée essentiellement dans les tissus périviscéraux est utilisée pour la maturation des gonades (Craig, 1977). Chez la sole (Solea solea), le contenu lipidique du filet passe de 0.8 à 0.2% (poids frais) entre le début et la fin de la maturation des gonades (Gökçe et al., 2004). Globalement, chez les Salmonidés, les lipides musculaires diminuent durant cette même période de 40 à 60% et ceux des viscères de plus de 70% (Nassour et Leger, 1989).
Une saisonnalité dans la composition en acides gras peut aussi être observée, comme chez la sole (Gökçe et al., 2004), la sardine Sardinops melanostictus (Shirai et al., 2002b), le poisson chat japonais Silurus asotus (Shirai et al., 2002a). Cette saisonnalité est décrite comme dépendante de l'espèce et affecte différemment les acides gras. En effet, le dépôt des lipides est un processus non sélectif pour les acides gras (Thomassen et Rosjo, 1989), contrairement au processus de mobilisation des réserves lipidiques (Borresen, 1995; Chatzifotis et al., 2004). C’est le cas par exemple chez la morue où l'acide docosahexaénoique (DHA, C22:6n-3) est mobilisé préférentiellement (Takama et al., 1985). Chez la sole, les acides gras de la série n-6 sont utilisés préférentiellement à ceux de la série n-3 (Gökçe et al., 2004).
Classiquement, les acides gras C14:0, C16:1, C18:1 et C20:1 sont mobilisés les premiers. Cette
sélection préférentielle serait motivée par des besoins énergétiques mais également par la nécessité de
maintenir l'intégrité des cellules et la fluidité membranaire (Durazo-Beltran et al., 2004). Cependant,
les différences saisonnières de teneur en lipides et de composition en acides gras sont le plus souvent à
mettre en relation avec l'activité alimentaire des poissons (intense à la saison favorable) et avec les
variations saisonnières de la qualité nutritionnelle des proies ingérées (profil en acides gras et teneur en
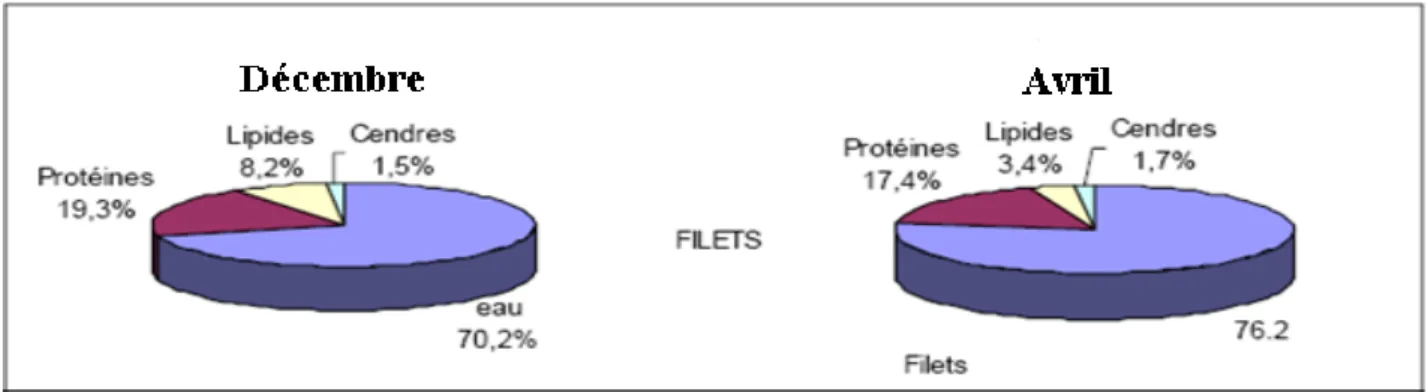
lipides) (Figure 6).
Partie bibliographique
Figure 6 : Influence des variations saisonnières sur la composition biochimique des filets, de la chair de sardines (Sardina pilchardus). (D’après Nunes et al., 1992a).
b. Facteurs trophiques
b.1. Teneur en lipides alimentaires
Il est clairement établi que l'alimentation est le facteur qui joue un rôle prépondérant sur la composition en acides gras et la teneur en lipides des filets. Dans de nombreuses études, les poissons nourris avec des aliments riches en lipides augmentent significativement leur teneur en lipides corporels (dans le filet des poissons chats (Fauconneau et Laroche, 1996). Cependant, cette relation est dépendante du tissu, l'influence la plus marquée touchant les sites préférentiels de stockage. Chez P.
fluviatilis l'augmentation de la teneur en lipides de l'aliment n'a aucun effet sur celle du muscle (Xu et al., 2001; Mathis et al.,2003).
L’augmentation des lipides tissulaires ne se répercute pas de la même manière sur toutes les classes lipidiques. La teneur en phospholipides reste presque constante et ce sont les lipides neutres qui sont responsables de la quasi-totalité de l’accroissement observé (Haard, 1992; Johansson et al., 1995;
Kiessling et al., 2001). En effet, les lipides alimentaires sont stockés préférentiellement dans les tissus.
b .2. Profil en acides gras de l'aliment
Comme la teneur en lipides, la composition en acides gras de la chair reflète largement celle de
l'aliment (Sargent et al., 2002). Ainsi, en milieu naturel, les fluctuations saisonnières de la composition
en acides gras chez la sardine correspondent à un changement qualitatif du plancton consommé (Shirai
et al., 2002b). Par ailleurs, la composition en acides gras des lipides neutres est plus proche de celle de
l'aliment que celle des phospholipides (Sargent et al., 1989; Jobling et Bendiksen, 2003). Cependant,
bien que la teneur en lipides et la composition en acides gras du muscle reflètent largement celle de
l'aliment, certains auteurs soulignent que les variations dans les teneurs en lipides du poisson peuvent
Partie bibliographique
être liées à des facteurs non-alimentaires comme le génotype ou l’état physiologique (Dunajski, 1979 ; Shearer et al., 1994; Gjedrem, 1997).
b.3. Facteurs environnementaux b.3.1. Température
Pour des organismes le poisson, la température est un des facteurs environnementaux les plus importants pour la régulation de l'activité métabolique, y compris le métabolisme lipidique. L'effet de la température sur la constitution des dépôts lipidiques est controversé (Corraze et al., 1999). En fait, la température agirait indirectement sur le contenu lipidique qui est lié, dans le milieu naturel, à la disponibilité en nourriture et, en élevage, à la prise alimentaire plus importante lorsque la température augmente (Henderson et Tocher, 1987).
En outre, la température influence également la composition en acides gras du filet (Ramachandran Nair et Gopakumar, 1981). Chez la truite arc-en-ciel, les proportions en DHA et EPA dans le muscle augmentent avec la diminution de la température d'élevage (Ingemansson et al., 1993).
D'une manière générale, la diminution de la température induit une réduction de la proportion en acides gras saturés et une augmentation des acides gras insaturés (Hwang et Lin, 2002; Hsieh et al., 2003; Jobling et Bendiksen, 2003), de façon à assurer le maintien de la fluidité membranaire (Stillwell et Wassall, 2003; Los et Murata, 2004). Par conséquent, ce phénomène est principalement visible pour les acides gras des phospholipides (Corraze et Kaushik, 1999; Farkas et al., 2001).
b.3.2. Salinité
La salinité n’a pas d’effet sur la teneur en lipides totaux, mais a une influence sur la composition en acides gras, notamment pour les phospholipides (Corraze et Kaushik, 1999).
Cependant, il est rapporté que les bars (Dicentrarchus labrax) élevés en eau douce contiennent
significativement plus de lipides que ceux élevés en eau de mer (respectivement 4.2% et 3.8% de
lipides totaux dans le filet) (Eroldogan et al., 2004). En outre, chez cette même espèce, Cordier et al.,
(2002) trouvent une corrélation négative entre la salinité de l’eau et le pourcentage de DHA dans les
phospholipides du muscle. De plus, la salinité est à l'origine d'une différence du rapport DHA/EPA
chez la truite arc-en-ciel (Haliloglu et al., 2004). La salinité, en modulant l’activité des enzymes qui
interviennent dans le métabolisme lipidique, pourrait induire des changements dans la composition en
acides gras permettant le maintien des propriétés de perméabilité et de fluidité des membranes
cellulaires.
Partie bibliographique
III.3. Les micronutriments a- Les vitamines
Le contenu en vitamines de la chair des poissons est très variable selon l’espèce, la saison et la zone géographique d’habitat, mais comme pour les lipides, le facteur majeur de variation est l’apport alimentaire. Les vitamines liposolubles sont plus concentrées lorsque la chair est grasse et contiennent des quantités appréciables de vitamines A, D et E (Southgate et Greenfield,2007).
La préservation de l’intégrité des acides gras de la chair par la vitamine E permet une meilleure conservation des qualités nutritionnelles du produit au cours du stockage (Médale et al., 2005).
La teneur en vitamines hydrosolubles dans la chair de poisson augmente avec l’apport alimentaire jusqu’à atteindre un plateau correspondant à la saturation des capacités de stockage par le tissu musculaire.
b- Les minéraux et oligo-éléments caractéristiques
Les organismes aquatiques puisent ces micro-nutriments à la fois dans leur nourriture et dans l’eau. L’apport par l’eau est bien plus important pour les poissons marins que pour les poissons d’eau douce. La chair de poisson contient plus de 60 micro-éléments (Murray et al., 1969).
Les minéraux sont stockés en majorité dans le squelette, cependant on en trouve aussi dans la chair des poissons. Le potassium est l’élément minéral le plus abondant, sa concentration est semblable à celle des viandes (300 à 500 mg/kg). La chair de poisson se caractérise aussi par sa richesse en phosphore (8 à 15 fois plus que les viandes) qui est apporté majoritairement par l’alimentation (Lall et Lewis-McCrea, 2007). Le calcium, que le poisson puise dans l’eau, est présent en faible quantité dans la chair. Enfin, contrairement à sa réputation, le poisson n’apporte pas davantage de sodium que les viandes.
Le poisson est considéré comme une source majeure de sélénium pour l’alimentation humaine.
Dans la chair, le sélénium est principalement associé aux protéines solubles.
IV- Evolution biochimique post mortem du poisson
Partie bibliographique
Chez le poisson, les phénomènes d’apparition et de résolution de la rigidité cadavérique sont rapides.
L’évolution du muscle après la mort peut être divisée en quatre phases : - la phase pré-rigor dite d’excitabilité musculaire et de contraction fibrillaire.
- la phase de rigidité cadavérique (rigor mortis).
- la phase post-rigor dite de résolution de la rigidité cadavérique.
- la phase d’autolyse (Linden et Lorient, 1994).
La contraction post-mortem et la chute de pH restent modérées chez les poissons. Le pH s’abaisse généralement de 7 à 6,5-6,0 dans le cas de poissons maigres et à 6,0-5,6 dans le muscle brun de poissons gras. Cet abaissement de pH du muscle est généralement insuffisant pour inhiber ou ralentir le développement microbien. En plus d’une activité protéolytique susceptible d’amollir rapidement les tissus, des enzymes telles que les lipases et les phospholipases restent remarquablement actives au froid et dégradent les lipides. Les modifications post-mortem des muscles de poisson gras qui se traduisent par une baisse de solubilité des protéines, une fragilisation des cellules, et la libération d’acides gras est plus rapide que celle des poissons blancs. Afin de limiter ces dégradations il est nécessaire de réfrigérer immédiatement les poissons après capture et de les transformer rapidement (Malle ,1994).
V- Valeur calorique du poisson
Elle varie essentiellement avec la composition du poisson. Le tableau(5) indique la valeur calorique de quelques espèces de poissons, ou il apparaît que la valeur calorique est élevée chez les poissons migrateurs.
Tableau 5 : La valeur calorique de quelques espèces de poissons (Tremoliere et al., 1980 ; Apfelbaum et al, 1981).
Espèces Cal/Kg
Merlan Raie Truite Carpe Sardine Rouget Thon Anguille
96
99
114
123
134
137
160
260
VI -Les petits pélagiques
Partie bibliographique
Les petits poissons pélagiques constituent un potentiel halieutique important le long des côtes représentant 40 à 50 % des captures totales mondiales. Ces espèces, telles que les petits pélagiques gras ou poissons bleus : sardines, maquereaux, chinchards, sont abondantes mais peu exploitées.
Ces espèces représentent une matière première de faible coût comparé notamment à celui des poissons blancs. Les petits pélagiques sont également estimés par les consommateurs sous toutes ses diverses formes (frais, en conserves, marinades et salaisons).
VI-1- La sardine
Le terme « sardine » est apparu au XIII
esiècle. Il vient de l’expression latine sardaesine sardinae, littéralement « poisson de Sardaigne ».
VI-1-1 Classification
La nomenclature courante de la sardine est Sardina pilchardus (Walbaum, 1792) (Figure 7).
En tant que groupe, les sardines comptent quelque 18 espèces réparties sous trois genres, à l’échelle mondiale (Culley, 1971).
Figure 7 : photographie de la sardine (Sardina pilchardus) Noms Vernaculaires FAO :
UK- Européen pilchard Es -Sardina
Fr- Sardine commune
Les espèces sont regroupées de façon hiérarchique :
Embranchement : Vertébrés
Partie bibliographique
Sous Embranchement : Enatostomes Super class : poisson
Classe : Ostéichtyens
Sous classe : Actinopterigiens Super ordre : Téléostéens Ordre : Clupéiformes
Sous ordre : Clupeoides Famille : Clupéidés Genre : Sardina
Espèce : pilchardus VI-1-2 Répartition géographique
La sardine Sardina pilchardus est une espèce de l’atlantique du nord- est. Son aire de répartition s’étend de la Norvège et l’Ecosse jusqu'à Sénégal et en Méditerrané (Forest-2001) (Figure8) ; elle vit au dessus du plateau continental jusqu'à des fond de 150m (Quéro, 1984). Elle est totalement grégaire, se déplace en bancs très importants ; d’où sa capture facile pour les pêcheurs professionnels. On reconnaît deux sous espèces, une méditerranéenne (Sardina pilchardus sardina), l’autre atlantique (Sardina pilchardus pilchardus).
Figure 8:
Délimitation de la zone de pêche FAO n°37 : Méditerranée et mer noire (FAO fisheries departement -2005).
VI-1-3 Morphologie
Partie bibliographique
La sardine est petit poisson osseux possédant un corps élancé, de section ovale avec une série de scutelles sur le profil, mais ne formant pas de carène très aigue. Les mâchoires tubérales partie inférieure de l’opercule aux fines rayures entre 3-5 stries rayonnantes très marquées avec un bord postérieur de la fonte operculaire sans excroissances charnues, origine de la nageoire dorsale. Un peu en avant du milieu du corps la nageoire anale très en arrière de la dorsale, les deux derniers rayons nettement plus longs que les autres ; pelviennes à 8 rayons, insérés sous la base de la dorsale. La tête quant à elle porte de grands yeux munis de paupières adipeuses.
Coloration : dos vert ou bleu, flancs dorés devenant blanc argenté sur le ventre ; une série de taches sombres sur le haut des flancs avec parfois une deuxième ou même une troisième rangée au dessous environ 80 écailles recouvrent le corps, caduques, les une grandes, quadrangulaires, les autres petites et cordiformes (FAO, 1977). Sa taille varie de 08 à15 cm dont la longueur n'excède pas une vingtaine de centimètres.
VI-1-4 Cycle biologique VI-1-4-1-Reproduction
La reproduction de la sardine a fait l’objet de nombreux travaux sur la mer Méditerranée et l’océan Atlantique. La période de reproduction est très étalée dans le temps et l’espace, l’extension des zones de ponte est très variable. Chaque femelle peut pondre entre 50 000 et 60 000oeufs/an ; ces œufs prennent la forme d’une sphère, et éclosent entre 2-4 jours après la ponte. Les larves font environ 30,5 mm de longueur, et le sac vitellin est complètement résorbé quatre à sept jours après leur naissance ; à l’âge de deux à trois mois, elles font environ 34 mm de longueur et les petites sardines atteignent 115mm à la fin de la première année.
Les mâles et les femelles ont une stratégie similaire dans l’utilisation des apports énergétiques au cours de la maturation des gonades et de la ponte. La valeur maximale correspond au mois qui précède le démarrage de la reproduction, cela implique une accumulation de réserves chez la sardine avant la période de reproduction (Abad et al., 1993 ; Fréon et al., 1997 ; Zwolinski et al,. 2001) puis un transfert de l’énergie vers la production des gamètes.
En été, saison pendant laquelle les conditions trophiques sont favorables (Somaoue, 2004) que
les sardines se nourrissent abondamment tout en accumulant des réserves (Tsuruta, 1987). En automne,
phase de maturation des gonades, les réserves sont investies dans l’élaboration des produits sexuels et
que leur développement comprime de plus en plus le tractus digestif du poisson (Lahaye, 1980). En
hiver, le zooplancton est moins abondant (Somaoue 2004), le poisson se nourrit peu et l’émission des
Partie bibliographique
œufs contribue à accentuer la diminution de sa masse. Cette perte de poids cesse avec la reprise de l’alimentation avec l’amélioration des conditions au printemps. Dans la méditerranée, la reproduction de la sardine à lieu toute l’année, avec des variations saisonnières bien marquées, avec un repos sexuel (Tableau6).
Tableau 6 : Périodes de reproduction de Sardina pilchardus sur son aire de répartition.
(SMS. : Résultat d’étude des stades de maturité sexuelle ; Ichty. : Résultats d’étude d’ichtyoplancton ;
R.G.S. : Résultats d’étude du rapport gonado-somatique et K : Résultat d’étude de coefficient de condition K).
Ainsi, la ponte de la sardine est maximale en hiver, saison du minimum de production zooplanctonique. Elle est faible en été, saison de maximum de production de nutriments.
Mer Méditerranée
J F M A M J J A S O N D Méthodes Auteurs
Golfe de Lion Ichty.SMS Chavance 1980
Baie d’Alger SMS Bouchereau 1981
Côtes algéroises
SMS Djabali et al., 1989
Baie d’Oran RGS Tomasini et al,. 1989
Mer d’Alboran (Malaga)
RGS Abad et al,. 1993 Océan
atlantique J F M A M J J A S O N D Méthodes Auteurs
Côte atlantique marocaine
Ichty. Furnestin et al., 1959
Nord du Golfe de Gascogne
Ichty. L’Herrou, 1971
Côte nord occidental de
l’Espagne
RGS Pérez et al., 1985
Nord du portugual
Ichty. Ré et al., 1990
Baie Douarnenez
Atlantique France
RGS Le Duff 1997
Iles Canaries SMS-RGS Mendez-Vilamil et al.,
1997 Côtes du
Portugal
RGS Zwolinski et al., 2001
Cap oujdor- Cap Blanc (Atlantique Marocain)
Ponte principale en hiver et secondaire en été
(l’étude n’a porté que sur deux saisons : hiver et été)
Ichty. Ettahiri et al., 2003
Région de laâyoune
(Maroc)