E
Ellaabboorrééppaarr::
Docteur Sara HAIAT
S
Soouussllaaddiirreeccttiioonndduu
Professeur Nazha BIROUK
Année Universitaire : 2019-2020
M
M
é
é
m
m
o
o
i
i
r
r
e
e
d
d
e
e
f
f
i
i
n
n
d
d
’
’
é
é
t
t
u
u
d
d
e
e
s
s
Pour L’obtention du Diplôme National de Spécialité
en
NEUROLOGIE MEDICALE
Intitulé
ROYAUME DU MAROC
Université Mohammed V - Rabat Faculté de Médecine et de Pharmacie
RABAT
N
N
E
E
U
U
R
R
O
O
P
P
A
A
T
T
H
H
I
I
E
E
E
A notre Maitre Mme le professeur Nazha Birouk
Je vous remercie de m’avoir accordé ce travail et du temps consacré pour l’élaborer. J’espère avoir mérité votre confiance. Veuillez accepter l’expression de mes immenses et
profonds sentiments de respect et de reconnaissance.
À l’âme de nos Maitres les Professeurs M.YAHYAOUI et E.AIT BENHADDOU
Je dédie ce travail à l’âme de nos maitres Professeur M.YAHYAOUI et Professeur E.AIT BENHADDOU qui nous ont marqué par leurs qualités humaines leur générosité
et esprit de partage, Ce travail est pour moi l'occasion pour témoigner ma profonde gratitude.
A nos Maitres les professeurs : Mr R.OUAZZANI et Mr. M.EL ALAOUI
FARIS :
Nous saluons votre engagement dans la formation de différentes générations de jeunes neurologues. Veuillez croire en notre profond respect et notre très haute
considération.
A nos Maitres les professeurs : Mr.A. BENOMAR, Mme.W.REGRAGUI :
Nous avons eu le privilège de travailler parmi votre équipe, et d’apprécier votre pédagogie d’enseignement, votre grande générosité scientifique aussi bien que votre
énergie positive qui nous a assuré une magnifique ambiance d’apprentissage. Veuillez accepter ici, chers maîtres, l’expression de ma gratitude et ma profonde
reconnaissance.
A mes Maitres les professeurs : A.Bourazza , S.AIDI, M.BENABDELJLIL, M.
RAHMANI, H.BELAIDI, L. ERRGUIG, F.LAHJOUJI, B. KABLY.
Votre sérieux, votre dévouement au travail et votre gentillesse valent l’estime que l’on vous porte. Veuillez trouver, ici, l’expression de nos remerciements pour toute l’aide
Liste des Tableaux
Tableau I : Definition of peripheral neuropathy according to Common Toxicity
Criteria of the National Cancer Institue
Tableau II : Components of the Total Neuropathy Score (TNS)
Tableau III : Recommandations de gestion de la NP liée au bortézomib. Tableau IV : Recommandation pour le traitement de la CIPN au cours du MM
Tableau V : répartition des données cliniques et ENMG selon la molécule utilisée en
chimiothérapie
Liste des figures
Figure 1 : répartition des patients selon le sexe
Figure 2 : répartition des patients selon les antécédents Figure 3 : répartition des isotypes de myélome
Figure 4 : répartition des patients selon l’ENMG prethérapeutique Figure 5 : répartition des patients selon les résultats de l’ENMG Figure 6 : répartition selon les molecules utilisées en chimiothérapie
Figure 7 : répartition des patients sous thalidomide selon les signes fonctionnels,
l’examen clinique et le résultat de l’ENMG
Figure 8 : répartition des patients sous thalidomide + Bortezomib selon les signes
Liste des abréviations
BiPN : Neuropathie périphérique induite par le Bortezomib
BM : Biopsie médullaire
CiPN : Neuropathie périphérique chimio-induite
CTD : Cyclophosphamide ; thalidomie ; dexaméthasone
DFG : Le débit de filtration glomérulaire
ENMG : Electroneuromyogramme
EPP : L’électrophorèse des protéines
FLC : Chaînes Légères libres
GM : Gammaathie monoclonale
HTA : Hypertension artériel
Ig : Immunoglobuline
L’O.M.S : L’organisation mondiale de la santé
MGUS : Gammapathie monoclonale de signification indéterminée
MM : Myélome multiple
MPT : Melphalan, prednisone, thalidomide
MSG : Membre superieur gauche
NCI-CTCAE : Critères de toxicité communs pour les événements indésirables NGF : Trophique Nerve Growth Factor
NP : Neuropathie périphérique
Pn SM : Olynueroathie sensitivo motrice
PR : Polyarthrite rhumatoide
TiPN : Neuropathie périphérique induite par le Thalidomide
TNS : Total Neuropathy Score
TSQ : Tests sensitifs quantitatifs
Introduction ...1 Partie théorique...3 I- Le myélome multiple ...4 1- Historique ...4 2- Epidémiologie ...4 3- Physiopathologie ...5 4- Diagnostique ...6 a- Circonstances de découverte ...6 b- Diagnostique positif ...6
II- La neuropathie secondaire au myélome ...7
1- Epidémiologie ...7
2- Mécanisme physiopathologique ...8
3- Tableau clinique et electrophysiologique ...9
III- La neuropathie chimio-induite ... 10
1- La NP induite par le Bortezomib ( BiPN) ... 11
a- Définition et mécanisme d’action de la molécule ... 11
b- Mecanisme physiopathologique du BiPN ... 11
c- Incidence et facteurs de risque ... 12
d- Tableau clinique ... 13
2- La NP induite par le Thalidomide (TiPN) ... 13
a- Incidence ... 13
b- Mécanisme physiopathologique ... 14
c- Tableau clinique et électrophysiologique ... 14
1- L’évaluation de la CiPN ... 15
a- Les critères de toxicité communs pour les événements indésirables NCI-CTCAE ... 15
b- Les tests sensitifs quantitatifs (TSQ) ... 16
c- Total Neuropathy Score (TNS) ... 16
2- La prise en charge de la BiPN ... 17
3- Traitement symptomatique de la CiPN ... 18
Notre étude ... 20
I- Matériels et méthodes ... 21
1- Matériels ... 21
1-1- Type et cadre de l’étude ... 21
1-2- Définition des patients éligibles ... 21
2- Méthodes ... 22
II- Résultats ... 23
1- Description des patients ... 23
2- Caractéristiques démographiques des patients ... 24
3- Date de diagnostic du myélome par rapport à l’ENMG ... 25
4- Type de myélome ... 25
5- L’ENMG préthérapeutique ... 26
6- Etude clinique et électrophysiologique ... 27
6-1- Groupe sans traitement ... 27
6-2- Groupe sous traitement ... 28
III- Discussion ... 33
3- Les antécédents ... 33
4- Isotype de myélome ... 34
5- L’ENMG Préthérapeutique ... 34
6- Etude clinique et électrophysiologique ... 35
Conclusion ... 37
Résumé ... 39
Références ... 41
Le myélome multiple (MM) ou maladie myélomateuse ou maladie de kahler est une hémopathie maligne caractérisée par la prolifération d’un clone plasmocytaire maligne diffuse, mais à localisation initiale préférentielle dans la moelle osseuse [1]. Ce dernier synthétise une immunoglobuline monoclonale (Ig) complète ou incomplète dans le sang et/ou dans les urines [2].
Le MM représente 10% des hémopathies malignes et 1 à 2% des cancers [3], avec un taux de mortalité de 1% dans les pays occidentaux [4,5]. Il peut être responsable de complications neurologiques par compression médullaire ou radiculaire ou par le biais de la neuropathie périphérique (NP).
Les neuropathies liées aux gammapathies, appelées aussi neuropathies associées aux pararotéinémies, représentent 10 % des neuropathies apparemment idiopathiques [3]. Elles sont souvent liées à une gammapathie monoclonale de signification indéterminée (MGUS) mais, elles peuvent être secondaires ou même révéler un MM dont l’incidence ne dépasse pas 7.2% [4,5].
Cependant, avec l’avènement des molécules de dernière génération (thalidomide, bortézomib), la neurotoxicité iatrogène est passée au premier rang des causes de NP en cas de myélome. La gestion de ces nouvelles formes de NP est devenue un enjeu important étant donné qu’elles peuvent limiter les perspectives thérapeutiques et représenter un défi pour les cliniciens, sur le plan diagnostique et thérapeutique [5].
Les neuropathies chimio-induites sont fréquentes, elles ont des caractéristiques spécifiques selon la molécule. En dehors de leur impact sur la poursuite du protocole optimale de chimiothérapie, elles ont un effet délétère sur la qualité de vie chez les patients même après leur guérison du myélome.
Ce travail a été réalisé sur des patients atteints de myélome, qu’ils avaient reçu, ou pas, un traitement à base de thalidomide ou bortezomib, et qui sont admis au service de neurophysiologie pour réaliser un examen ENMG à la recherche d’une NP liée au MM ou à son traitement. L’analyse de cette série nous permettra de mieux comprendre les caractéristiques cliniques et électrophysiologiques de la neuropathie dans ce contexte afin d’optimiser sa prise en charge.
I- Le myélome multiple
1- HistoriqueLe myélome multiple a été décrit pour la première fois par MAC INTYR et BENCE JONES .Ce dernier a découvert la protéinurie thermosoluble en 1850 [2]. Vingt-trois ans plus tard, RUSTISKY l’a décrit comme étant des tumeurs multiples du squelette, développées au dépend de la moelle osseuse [6].
En 1889 VAN KAHLER était le premier qui a pu établir la relation entre la protéinurie de BENCE JONES et l’existence de ces multiples tumeurs, et a donné une description clinique détaillée de cette affection. Dès lors, elle a pris son nom « maladie de KAHLER» [2]. Depuis, plusieurs auteurs ont travaillé sur cette entité pathologique. Ce n’est qu’en 1980 que WRIGHT a pu définir la cellule néoplasique responsable de cette maladie [7]
Selon L’O.M.S, il s’agit d’une néoplasie systématisée de plasmocytes, de degré de différenciation variable, responsable de production tumorale circonscrite et/ou d’une infiltration diffuse, intéressant habituellement la moelle osseuse, mais aussi les autres organes. La maladie de Kahler est habituellement associée à une gammapathie monoclonale à Ig G, Ig A ou chaines légères, décelables dans le sang et/ou les urines [6].
2- Epidémiologie :
- Incidence :
Le MM représente environ 1 % de tous les cancers et 10 % de toutes les hémopathies malignes, ce qui en fait l’hémopathie maligne la plus fréquente après les lymphomes [8].
Dans la plupart des pays occidentaux industrialisés, l’incidence annuelle du MM est comprise entre 4 et 7 pour 100 000 habitants [9].
Au Maroc, il existe un registre des cancers à Rabat et qui montre que l’incidence du MM, en 2005 était de 2,12 nouveaux cas pour 100 000 habitants chez les hommes, et de 0,94 pour 100 000 habitants chez les femmes [10].
Le MM est responsable d’environ 1% de décès par cancer et d’environ 19% de décès par hémopathie maligne [11]
- Origine ethnique
Les MM, comme les gammapathies monoclonales de signification indéterminée (MGUS), sont deux fois plus fréquents chez les Africains et les Américains d’origine africaine que chez les Caucasiens [12].
Les incidences les plus élevées sont observées chez les Noirs américains et les sujets originaires des îles du Pacifique.
Les Caucasiens d’Europe et d’Amérique du Nord ont des incidences de MM intermédiaires.
Les Asiatiques (l’Asie ou l’Amérique du Nord) ont des incidences faibles.
3- Physiopathologie
Le MM est caractérisé par l’émergence et l’accumulation dans la moelle osseuse d’un clone de plasmocytes malins. Ces plasmocytes malins expriment tous la même chaîne légère et la même chaîne lourde à leur surface, et sécrètent dans le sérum une Ig toujours identique.
C’est de cette identité structurale que découle l’identité isotypique et de charge responsable de l’allure monoclonale du pic à l’électrophorèse des protéines (EPP) [13].
Le MM est souvent précédé d’un état «prémyélomateux », un processus tumoral non malin, nommé gammapathie monoclonale de signification indéterminée (MGUS) [14]. Cette gammapathie est constituée de moins de 10% de plasmocytes médullaires, et se transforme en un vrai MM, exprimant le même clonotype et le même isotype d’immunoglobuline, à un taux de 1% par
4- Diagnostique :
a- Circonstances de découverte :
Le myélome multiple est une maladie très « polymorphe», toutes les disciplines médicales peuvent être confrontées aux manifestations d'un myélome non connu, il peut donner:
- Un syndrome douloureux osseux,
- Un syndrome anémique,
- Des complications : infection, insuffisance rénale, complications neurologiques (radiculalgies symptomatiques, compressions médullaires, syndrome de la queue de cheval…), fractures pathologiques, manifestation viscérale d’une amylose…
- A l’examen biologique systématique ou en raison d’une altération de l’état général (découverte d’une augmentation de la vitesse de sédimentation (VS), d’une anomalie de l’hémogramme, d’un pic monoclonal à l’électrophorèse des protides ou d’une hypercalcémie symptomatique) [15]
b- Diagnostique positif :
Le diagnostic de MM repose sur la présence d’une plasmocytose médullaire supérieure à 10 %, souvent dystrophique, ce qui différencie le MM de la MGUS (moins de 10 % des plasmocytes médullaires par définition).
Les critères diagnostiques actuels distinguent le MM symptomatique (présence d’au moins un des critères CRAB, décrits ci-dessous) et le MM asymptomatique [2]. La distinction est fondamentale car à l’état actuel, seul le MM symptomatique justifie la mise en place d’un traitement spécifique
Les critères diagnostiques sont :
- Plasmocytes clonaux de BM > 10% ou plasmacytome osseux prouvé par biopsie ou plasmacytome extramédullaire
- 1 ou plus d’évènement définissant le myélome comme :
Critères CRAB :
C = Hypercalcémie: calcium sérique> 0,25 mmol / L au-dessus limite supérieure de la normale ou> 2,75 mmol / L (> 11 mg / dL)
R = Insuffisance rénale: DFG<40 ml/min ou sérum créatinine> 177 mol/L
A = Anémie : hémoglobine 2,0 g / dL sous la limite inférieure de normal ou <10 g / dL
B = lésions osseuses : ≥ une lésion détectée par radiographie, tomodensitométrie ou tomographie par émission de positrons
Critères SLiM :
S = ≥ plasmocytose médullaire superieur à Soixante pourcent (≥60%)
Li = rapport chaînes Légères libres (FLC) impliquées/non impliquées≥ 100
M = Plus qu’une lésion focale à l'IRM (de diamètre supérieur à 5 mm)
II- La neuropathie secondaire au myélome :
1- Epidémiologie :La neuropathie associée au myélome a été décrite en premier par VICTOR et aL en 1958 à propos d’un cas.
Depuis, de nombreuses publications ont permis de préciser les caractères principaux de ce type de neuropathie (DAVIS et DRACHMAN, 1972; KELLY etal., 1981; MAC LEOD et al., 1984).
Rapidement, il fut noté que les myélomes ou plasmocytomes solitaires et surtout les formes condensantes ou ostéosclerotiques, donnent beaucoup plus souvent une neuropathie que les formes classiques [16].
Les manifestations neurologiques du myélome les plus fréquentes sont les compressions médullaires et/ou radiculaires occasionnant des douleurs et la paralysie. En dehors d’un mécanisme compressif, l’association d’une neuropathie au myélome ostéolytique est rare et rapportée dans moins de 5 % des cas. [17]
2- Mécanisme physiopathologique
Les mécanismes impliquant la protéine monoclonale dans la genèse de la neuropathie sont multiples.
Outre les mécanismes infiltratifs qui sont consécutifs aux proliférations lymphoplasmocytaires malignes, l’activité pathogène de l’immunoglobuline monoclonale peut être :
– secondaire à une activité cryoglobulinémique (de type I ou II le plus souvent) occasionnant alors des lésions inflammatoires nerveuses périphériques, mises en évidence sur la biopsie nerveuse ;
– secondaire à une activité anticorps dirigée contre une composante myélinique ou axonale du nerf ;
– secondaire à un dépôt endoneural de la protéine monoclonale dans l’endonèvre. Néanmoins, leur mise en évidence s’avère souvent difficile que ce soient par les techniques d’immunofluorescence ou de microscopie électronique ;
– responsable de dépôts amyloïdes. La capacité à former des dépôts
d’amylose ou une cryoglobuline dépend de propriétés
physicochimiques propres à la GM. Une amylose survient chez 20 à 40 % des patients atteints de myélome multiple [17 ; 18]
– Des études récentes suggèrent l’implication des cytokines pro-inflammatoires avec des peptides vasoactifs dans ce phénomène [19]
3- Tableau clinique et électrophysiologique :
La neuropathie liée au MM donne des symptômes sensitifs tels que des paresthésies et des douleurs des membres, rarement un déficit moteur [20]
La NP secondaire aux myélomes ostéocondensants est essentiellement une polyneuropathie axonales sensitivomotrices distale à prédominance sensitive ou plus exceptionnellement à prédominance motrice avec évolution très progressive. Cette neuropathie peut être infraclinique et découverte au cours du myélome. [17]
Dans d’autre cas, elle peut être en rapport dans quatre cas sur dix avec l’amylose. La présence d’une polyneuropathie sensitive avec atteinte prédominante des petites fibres et dysautonomie doit faire évoquer ce diagnostic. L’atteinte des nerfs crâniens, parfois rapportée, correspond le plus souvent à une ostéolyse de la base du crâne ou une méningite plasmocytaire. Il peut s’agir d’une infiltration plasmocytaire maligne endoneurale dans le cadre de neuropathies multifocales. [17]
L'étude de Kelly et al. a montré que la neuropathie associée au MM est une entité hétérogène ressemblant à la neuropathie carcinomateuse [19]
Étant donné le lien étroit entre la neuropathie préexistante et son exacerbation par le traitement de la maladie ces résultats soulignent la nécessité d’un dépistage et d’un protocole de traitement spécifique pour les patients à risque. [18]
III- La neuropathie chimio-induite :
Les patients atteints d'un MM nouvellement diagnostiqué sont classés en deux grandes catégories: éligibles et non éligibles pour la transplantation des cellules souches (SCT). [21]
Cette thérapie nécessite une cure d’induction avant la SCT et une cure de consolidation post transplantation dont les molécules qui ont prouvé leur efficacité à travers plusieurs essais cliniques sont : le thalidomide, le bortezomib et la dexamethasone, avec une survie plus prolongé après la transplantation par rapport aux anciens schémas de chimiothérapie [22]
Le traitement des patients inadmissibles à une greffe comprend généralement une thérapie de première intention d'intensité réduite combinant le melphalan, la prednisone et les nouvelles thérapies (par exemple, VMP – bortézomib, melphalan, prednisone; MPT - melphalan, prednisone, thalidomide) suivi d'un traitement d'entretien optionnel. Une autre option recommandée est un traitement associant de lénalidomide et de dexaméthasone à faible dose [21]
Chaque classe thérapeutique a son propre profil d'effets indésirables.
La toxicité associée aux médicaments et aux régimes utilisés pour le traitement du MM comprend : la myélosuppression, la thrombose veineuse, les infections, la fatigue, les troubles gastro-intestinaux, les événements cardiaques et la neuropathie périphérique.
Depuis l’introduction du thalidomide et du bortezomib, la neuropathie périphérique chimio-induite(CiPN) est devenue la cause principale de NP associée au MM remplaçant la NP secondaire au myélome lui-même qui présente un facteur prédictif du développement ou d’un caractère plus méchant de la CiPN, ce qui peut entraîner une réduction de la dose, un retards, voire l'arrêt précoce du traitement. [21,22]
1- La NP induite par le Bortezomib ( BiPN)
a- Définition et mécanisme d’action de la molécule:
Le bortézomib est un acide dipeptidyl boronique, appartenant à une nouvelle classe d'inhibiteurs du protéasome, approuvé en 2004 par les autorités américaines et européennes pour le traitement du myélome multiple et en 2006 pour le traitement du lymphome non hodgkinien des cellules du manteau. C’est un traitement essentiel du myélome multiple aussi bien au début de traitement que pour les récidives. Seul ou combiné aux autres traitements, il a approuvé son efficacité par une très bonne gestion de la maladie et par l’augmentation de l’espérance de vie des patients [23]
Le bortézomib agit en perturbant les diverses voies et signaux cellulaires, conduisant ainsi à l'arrêt du cycle cellulaire, l'apoptose et l’inhibition de l'angiogenèse. Le bortézomib inhibe le NF-B, interférant ainsi avec la survie cellulaire, la croissance tumorale et l’angiogenèse [24]
b- Mecanisme physiopathologique du BiPN
Bien que la BiPN soit particulièrement parlante sur le plan clinique, sa physiopathologie reste mal connue.
- l’atteinte du réticulum mitochondrial et endoplasmique semble joue un rôle important dans la genèse du BiPN car le bortezomib est capable d’activer la voire apoptotique mithochondriale. [24]
- les résultats d'une étude neurophysiologique appliquant des tests sensoriels quantitatifs chez des patients recevant du bortézomib pour traitement du MM ou du lymphome non hodgkinien a démontré que la douleur induite par le bortézomib est associée à un déficit des 3 principaux types de fibres, c'est-à-dire les fibres afférentes primaires A ß, Aδ; et C. [24]
- Dans un modèle murin (rat), G. Cavaletti et al. (4) ont montré que le bortézomib entraîne une réduction significative des vitesses de conduction des fibres nerveuses sensitives, de manière dose-dépendante, avec une récupération en quelques semaines.
- L’examen au microscope des fibres nerveuses (nerf sciatique) montrait des modifications légères à modérées dans les cellules de Schwann et la gaine de myéline, à type de vacuolisations intracytoplasmiques secondaires à des lésions du réticulum endoplasmique (RE) et des mitochondries ; des lésions de dégénérescence axonale étaient également présentes. Ces altérations ont été observées aussi dans les cellules satellites des ganglions rachidiens sensitifs, mais pas au niveau de la corne antérieure de la moelle (ce qui explique l’atteinte clinique prédominante sur les fibres sensitives).
- Sur le plan biochimique, il y aura une dysrégulation des neurotrophines : le bortézomib inhibe l’activation du NF-κB, inhibant par la suite la transcription du facteur trophique Nerve Growth Factor (NGF) (un facteur trophique important pour les fibres nerveuses). [25]
c- Incidence et facteurs de risque :
L'incidence de la BiPN est généralement liée à des facteurs de risque, notamment le calendrier de perfusion, une neuropathie périphérique préexistante d'origine héréditaire le terrain paranéoplasique, le diabète et l’abus d’alcool. Plusieurs études ont incriminé systématiquement la dose cumulative des 5 premières cures et la neuropathie préexistante dans l’augmentation de l’incidence de BIPN.
La Neuropathie préexistante et les comorbidités telles que le diabète peuvent également prédire la survenue de BIPN et sont généralement corrélés à sa gravité. Par contre, l'administration prolongée de bortézomib n'est pas significativement associée à une incidence et une gravité accrues du BIPN [24]
d- Tableau clinique :
Les caractéristiques cliniques de la NP liée au bortézomib commencent à être de mieux en mieux définies.
La BiPN est généralement une axonopathie à prédominance sensitive associée à des dysesthésies, une sensation de refroidissement des extrémités, un engourdissement, une hyperesthésie et/ou des fourmillements et picotements toujours dans une distribution en gants et chaussettes.
La douleur neuropathique est une caractéristique importante de cette CIPN. Elle est présente dans 25 à 80 % des cas avec un caractère spontané et des crampes sévères. Des signes et des symptômes de dysautonomie peuvent survenir, chez 12 à 50 % des patients à type de constipation, hypotension orthostatique et troubles du rythme cardiaque. Les fibres motrices sont rarement affectées [23].
À l’examen, les patients peuvent présenter une diminution des réflexes achilléens et de la sensibilité vibratoire.
L’atteinte motrice est plus rare, même si les douleurs et les picotements des extrémités entraînent une diminution de l’activité, compliquant le diagnostic des faiblesses musculaires pures. S. Gupta et al. ont récemment rapporté les deux seuls cas d’atteinte motrice sévère (grade 4) [23]
La BiPN peut être une complication précoce. Cette CIPN est liée à la dose cumulée et apparaît généralement au cours des 5 premiers cycles de traitement pour atteindre un plateau au 5ème cycle [23].
2- La NP induite par le Thalidomide (TiPN):
a- Incidence :
L'incidence de la TiPN varie de 37 % à 83 %, elle dépend du type de populations, des types de traitement et des critères diagnostiques [26]. Il semble plus sévère que la majorité des anticancéreux neurotoxiques. La TiPN est associée à la dose cumulée [84], mais il est difficile de définir un seuil de dose
b- Mécanisme physiopathologique
Les mécanismes de la NP liée au thalidomide ne sont pas clairs non plus. Il semble qu’il y ait une altération du processus habituel de la dégénérescence wallérienne du fait d’une diminution du TNFα, et une inhibition secondaire à l’activation du NF-κB. Des études fondées sur des biopsies de nerf sural ont montré des signes de dégénérescence wallérienne et une perte sélective des fibres de gros diamètre sans démyélinisation [25].
c- Tableau clinique et électrophysiologique
Le thalidomide provoque une neuropathie périphérique distale douloureuse pour plus de la moitié des patients après un traitement sur une période suffisamment longue, cette NP touche les petites et les grandes fibres, responsable de fourmillements, picotements ou des dysesthésies et un engourdissement des membres inférieurs. Son apparition est habituellement plus lente par rapport au BiPN. Une légère altération motrice semble également présente, mais elle n'est significative que dans les cas graves. Les manifestations végétatives, comprenant des désordres gastro-intestinaux (constipation, anorexie et nausées) et cardiovasculaires (hypotension et bradycardie) sont fréquemment observées [23].
IV- La prise en charge de polyneuropathie chimioinduite CiPN :
Une évaluation complète de la neuropathie doit impliquer une combinaison entre les antécédents du patient, l'examen clinique et les tests neurophysiologiques. Le diagnostic de toute affection ou comorbidité sous-jacente pouvant augmenter le risque de PN liée au traitement est un élément essentiel dans cette évaluation. La gravité de la PN doit être précisée à chaque évaluation pour surveiller la progression de la neuropathie et déterminer si un changement de régime ou un autre type d'intervention thérapeutique est indiqué. L'éducation des patients est importante pour améliorer la sensibilisation et encourager la notification des symptômes.
1- L’évaluation de la CiPN
Les outils d'évaluation de la neurotoxicité peuvent être utiles pour quantifier la gravité de la NP. Les patients doivent être évalués au départ, avant l'initiation ou le changement d’un schéma thérapeutique et devant l’apparition de nouveaux signes ou l’aggravation des symptômes de NP, ainsi que périodiquement tout au long du traitement. Les facteurs de risque propres au patient ou au médicament peuvent nécessiter des évaluations plus rapprochés ou ciblées [29]
a- Les critères de toxicité communs pour les événements
indésirables NCI-CTCAE
Les critères d’évaluation de la CiPN d’après lesquelles on pose l’indication d’une modification du schéma thérapeutique sont basés sur les critères de toxicité communs pour les événements indésirables du National Cancer Institue (NCI-CTCAE) [28]
Évalués par le clinicien, ce sont un ensemble de critères pour la classification normalisée des effets indésirables des médicaments utilisés dans le traitement du cancer.
Tableau I : Definition of peripheral neuropathy according to Common Toxicity Criteria of
b- Les tests sensitifs quantitatifs (TSQ)
La CiPN peut aussi être évaluée par des explorations
électroneurophysiologiques ou encore des explorations sensitives quantitatives (quantitative sensory testing [QST])
Le test sensitif quantitatif (TSQ) est une méthode de test psychophysique qui étudie l'état fonctionnel du système somatosensoriel d'un sujet ou d'un patient
Les tests sensitif quantitatifs mesurent les seuils sensitif pour la douleur, le toucher, les vibrations et les sensations de température chaudes et froides.
Ces tests permettent l’évaluation de la fonction des fibres C non myélinisées, des fibres A-delta finement myélinisées et des fibres A-bêta fortement myélinisées y compris leurs voies de projection vers le cerveau.
c- Total Neuropathy Score (TNS) :
Le Total Neuropathy Score est un moyen de mesure qui comporte les
symptômes, les signes à l’examen clinique, et les mesures
électrophysiologiques. C’est une deuxième version du NCI-CTC. Le TNS a montré une sensibilité plus élevée par rapport au NCI-CTC pour évaluer à la fois l’évolution et la gravité du CIPN.
Tableau II : Components of the Total Neuropathy Score (TNS)
2- La prise en charge de la BiPN :
Les patients qui présentent une neuropathie sévère préexistante peuvent être traités par bortézomib après une évaluation rigoureuse du rapport bénéfice/risque.
Une évaluation clinique régulière des symptômes et des capacités fonctionnelles, avant le début du traitement et au cours de celui-ci, est capitale pour suivre les changements cliniques chez les patients. Ceux-ci doivent être encouragés à rapporter rapidement la moindre difficulté ou limitation fonctionnelle (écrire, s’habiller, boutonner et déboutonner un vêtement, etc.). Le diagnostic précoce est essentiel.
La NP liée au bortézomib est dose-dépendante, souvent réversible, et nécessite l’utilisation d’un algorithme de modifications du schéma thérapeutique. L’apparition d’une NP avec des douleurs impose de diminuer les doses, en passant sous le seuil de la dose usuelle de 1,3 mg/m2.[25]
La réduction de dose ou l’espacement des intervalles entre les cures est une stratégie efficace pour prévenir l’aggravation des symptômes et poursuivre le traitement plus longtemps et sans qu’il y ait de perte de l’efficacité antimyélomateuse. En général, les symptômes s’améliorent ou se stabilisent à l’arrêt ou à la réduction du traitement. La durée médiane d’amélioration est cependant plus longue dans les atteintes de grade 3-4 que dans celles de grade.[25]
Tableau III: Recommandations de gestion de la NP liée au bortézomib.
3- Traitement symptomatique de la CiPN
La prise en charge de la CiNP est habituellement purement symptomatique. Le traitement par des antalgiques ou des antidépresseurs semble être bénéfique (amitriptyline ; inhibiteurs de la recapture de la sérotonine, duloxétine ; antiépileptiques, gabapentine).
L’emploi de topiques cutanés peut être utile chez certains patients (crème à la capsaïcine). Certains auteurs utilisent des compléments vitaminiques (B6, L-carnitine). Cependant, plusieurs études ont montré que les fortes doses de pyridoxine entraînent des lésions sur les neurones sensitifs (surtout en cas d’insuffisance rénale ou de régime hypoprotéique).[25]
Tableau IV : Recommandation pour le traitement de la CIPN au cours du MM
L’emploi de la vitamine C est déconseillé, car elle peut interférer avec le métabolisme du bortézomib et diminuer son efficacité.
L’amélioration des signes cliniques, parfois observée après injection d’immunoglobulines polyvalentes, pourrait suggérer une composante dysimmunitaire dans la physiopathologie de cette NP.
A cause du risque de neuropathie dysautonomique, le bortézomib doit être utilisé avec précaution chez les patients avec les antécédents de syncopes, ceux qui ont un risque de déshydratation ou ceux qui sont sous médicaments hypotenseurs.
La prise en charge de cette complication peut nécessiter un ajustement des posologies des antihypertenseurs, une bonne hydratation, une supplémentation en apports sodiques ou l’administration de corticoïdes à effet minéralocorticoïde [30].
I- Matériels et méthodes
1- Matériels :1-1- Type et cadre de l’étude :
Il s’agit d’une étude rétrospective réalisée au service de neurophysiologie clinique de l’hôpital des spécialités de Rabat, incluant 29 patients
1-2- Définition des patients éligibles :
Critères d’inclusion :
- Les patients de tout âge, hommes et femmes.
- les patients admis au service de neurophysiologie pour réaliser un examen ENMG :
devant des signes cliniques d’une neuropathie périphérique, confirmée à l’ENMG dont le bilan étiologique avait mis en évidence un pic monoclonal à l’EPP secondaire au myélome
dans le cadre d’un bilan préthérapeutique chez les patients nouvellement diagnostiqués atteints de myélome, quelque soit leurs antécédents
dans le cadre de suivi chez les patients qui ont déjà reçu un traitement pour le myélome notamment le thalidomide et/ou le bortézomib
Critères d’exclusion :
Les patients sous thalidomide ou le bortézomib pour une pathologie autre que le myélome qui sont admis au service pour un examen ENMG de contrôle
fiche d’exploitation : voir annexe
Contient :
Les caractéristiques démographiques des patients : âge et sexe
l’ENMG préthérapeutique
les renseignements sur le traitement : type de molécules nombre de cures
les caractéristiques cliniques : antécédents, les signes fonctionnelles leurs types et date de survenue par rapport au diagnostic du myélome, l’examen neurologique
Les caractéristiques électro physiologiques : les données des résultats de l’examen ENMG ainsi que les anomalies retrouvées.
2- Méthodes :
Nous avons réparti la population étudiée en deux groupes :
Groupe 1 : des patients dont le diagnostic de myélome est récemment établi et qui sont vierge de tout traitement anti-myélome
Groupe 2 : des patients sous chimiothérapie anti-myélome, dont l’ENMG a été demandé dans le cadre de suivi ou devant des signes de neuropathie périphérique
Les critères de jugement sont : les anomalies électro physiologiques
-Diminution des amplitudes motrices et sensitives
- Allongement des latences distales motrices (LDM).
-Ralentissement des vitesses de conduction motrice et sensitive.
- Anomalies d’onde F (abolition des ondes F ou allongement de ses latences).
Le diagnostic de polyneuropathie axonale sensitive a été retenu devant
La réduction de l’amplitude des potentiels sensitifs
Le ralentissement des vitesses de conduction sensitive
Le diagnostic de polyneuropathie axonale sensitivo- motrice
La réduction de l’amplitude des potentiels sensitifs et moteurs
Le ralentissement des vitesses de conduction sensitives et motrices
Un allongement des latences distales motrices
Les valeurs normales de référence figurent dans le chapitre annexe. Le recueil des données
Les données ont été collectées et étudiés à l’aide du programme EXCEL
Les variables quantitatives ont été exprimées en moyenne, et les variables qualitatives en nombre (pourcentage)
II- Résultats :
1- Description des patients :
Il s’agit de 29 patients qui ont été admis pour une exploration ENMG devant les indications suivantes :
La majorité avait présenté des signes fonctionnels d’une NP suite à des cures de thalidomide ou bortézomib
Une minorité était admise pour un examen ENMG de contrôle à la recherche systématique d’une NP secondaire au traitement par thalidomide ou Bortezomib
La recherche d’une NP chez des cas de myélome nouvellement diagnostiquée et qui sont programmés pour une thérapie par le thalidomide et le Bortezomib
Des patients qui ont présenté des signes fonctionnels de NP, dont le bilan étiologique avait révélé un myélome multiple.
2- Caractéristiques démographiques des patients :
L’âge :
L’âge moyen des patients était de 60.62 ans, avec des extrêmes allants de 42 à 81 ans,
Le sexe :
Le sexe ratio dans cet étude est considéré à 1 vu que le nombre totale des patients était impaire 14 hommes / 15 femmes
Les antécédents :
2 cas de diabète, 2 cas d’HTA, insuffisance rénale, amylose AL, ostéoporose, PR
Figure 2 : Répartition des patients selon les antécédents
3- Date de diagnostic du myélome par rapport à l’ENMG :
Variait entre 2 mois et 10 ans, avec une moyenne de 1 an et demi.
4- Type de myélome :
L’isotype de myélome a été précisé sur la demande d’ENMG chez 14 patients.
Les pics monoclonaux étaient par ordre de fréquence : IgG k, IgA ƛ, chaine légère k
Figure 3 : Répartition des isotypes de myélome
5- L’ENMG préthérapeutique
19 Cas de cet échantillon avaient bénéficié d’un ENMG près thérapeutique.
Parmi les patients qui ont déjà commencé un traitement anti-myélome, l’ENMG prétherapeutique n’a été demandé que chez 47.3% d’entre eux
6- Etude clinique et électrophysiologique
Les patients étudiés ont été répartis en deux groupes :
Un groupe nouvellement diagnostiqué qui n’ont reçu aucun traitement pour leur myélome et dont l’ENMG a été demandé dans le sens de détecter une NP secondaire au myélome lui-même et qui doit être prise en considération dans le protocole thérapeutique
Un groupe qui a déjà reçu la chimiothérapie anti-myélome
6-1 Groupe sans traitement :
Ce groupe contient 10 cas :
Signes cliniques :
- 3 Cas de ce groupe avaient des signes fonctionnels à type de douleur du MSG et sciatalgies L5 dont 2cas avaient l’antécédent de diabète et d’insuffisance rénale
- L’examen clinique était sans particularité chez ce groupe
Les données de l’examen ENMG :
Protocole de l’ENMG:
Le protocole envisagé chez tous les cas de cette série consiste sur l’étude de:
- La conduction nerveuse motrice d’un nerf sur deux pour chaque membre
- La conduction nerveuse sensitive des deux nerfs suraux et d’un nerf sur deux au niveau des membres supérieurs
Résultats de l’examen ENMG :
Les deux cas de polyneuropathie étaient associés à un syndrome de canal carpien bilatéral. L’un de ces deux cas avait l’antécédent de diabète et l’autre avait l’antécédent d’insuffisance rénale.
Figure 5 : Répartition des patients selon les résultats de l’ENMG
6-2 Groupe sous traitement :
Définition du groupe :
Ce groupe comporte 19 cas. Comme déjà cité, seulement 9 cas qui ont bénéficié d’un ENMG pré- thérapeutique, et qui a objectivé une NP chez 4 d’entre eux
Type de molécules :
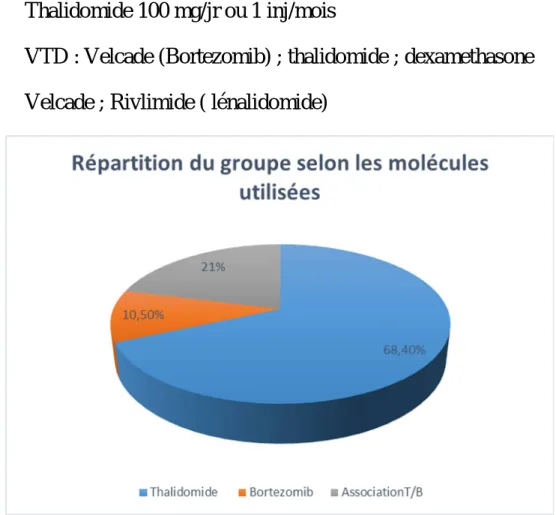
Les molécules utilisées chez les cas de cette série et qui sont inducteur d’une neuropathie sont le thalidomide et le borthézomib
Protocoles utilisés :
Les protocoles suivis sont
- CTD : cyclophosphamide ; thalidomie ; dexaméthasone - Thalidomide 100 mg/jr ou 1 inj/mois
- VTD : Velcade (Bortezomib) ; thalidomide ; dexamethasone - Velcade ; Rivlimide ( lénalidomide)
Figure 6 : Répartition selon les molecules utilisées en chimiothérapie
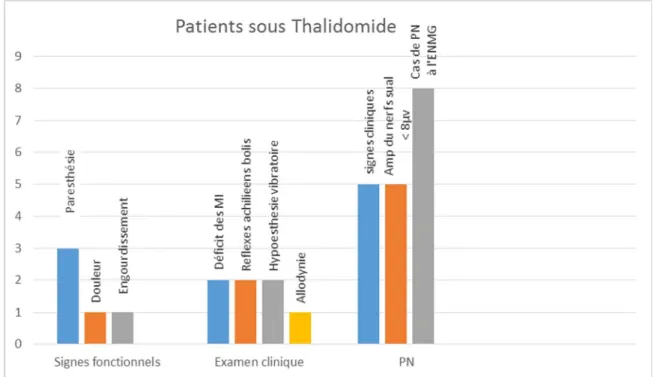
Patients sous thalidomide :
Le nombre des patients sous thalidomide était 13 /19
Les signes fonctionnels étaient présents chez 5 cas (38.4%), sous forme de paresthésie ou de douleur ou de lourdeur des 2 membres inférieurs.
l’examen clinique : 5 patients avaient des anomalies à l’examen clinique. Ces anomalies variaient entre :
- Des réflexes achilléens abolis chez 2 cas
- Une allodynie au niveau des plantes des pieds chez un seul cas - Une hypoesthésie vibratoire au niveau des chevilles chez 2 cas Résultats ENMG :
- Les cas qui présentaient des signes cliniques avaient tous une NP à l’ENMG
- 5 cas /13 (38.4%) avaient une amplitude du potentiel d’action du nerf sural inférieure à 8 µV
- 8 cas /13 (61.5%) avaient à l’ENMG une NP axonale longueur dépendante, répartie équitablement entre sensitive et sensitivo-motrice.
Figure 7 : Répartition des patients sous thalidomide selon les signes fonctionnels,
Patient sous bortezomib seul:
Ils sont au nombre de deux
Les deux cas avaient des signes fonctionnels sensitifs à type de paresthésie, des réflexes abolis et une hypoésthesie tactile et vibratoire des membres inférieurs
Résultats ENMG :
1 seul cas avait une PN axonale sensitivo-motrice longueur dépendante
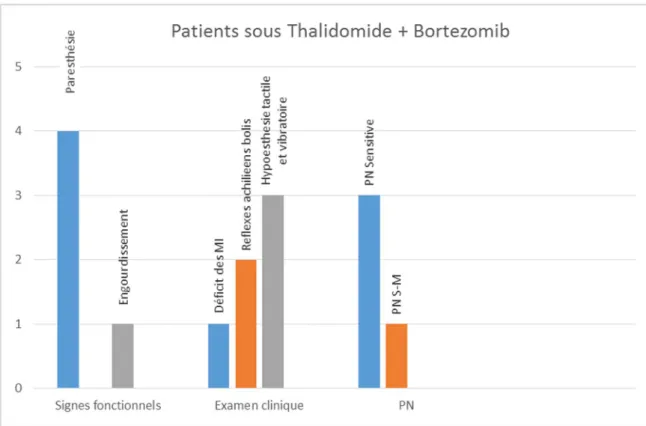
Patients sous association thalidomide/ bortézomib :
4 patients
Ils avaient tous des signes fonctionnels sensitifs au niveau des membres inférieurs,
A l’examen clinique, les réflexes au niveau des membres inférieurs étaient abolis chez 2
Avec une hypoesthésie tactile et vibratoire chez 3 Résultats ENMG :
Tous les patients qui ont reçu l’association thalidomide bortézomib avaient une PN axonale à l’ENMG dont le caractère sensitif est prédominant 75%
Figure 8 : Répartition des patients sous thalidomide + Bortezomib selon les signes
fonctionnels, l’examen clinique et le résultat de l’ENMG
Tableau V : Répartition des données cliniques et ENMG selon la molécule utilisée en
chimiothérapie
Thalidomide Bortézomib Thalidomide+
Bortézomib Nombre de cas 13 2 4 Signes fonctionnels 5/13 ( 38,4%) 2 ( 100%) 4 (100%) Signes de Np sur l’examen clinique (Areflexie achilléenne, hypoesthésie sensitive et/ ou vibratoire) 5/13 2 ( 100%) 3/4 (75%) Résultats ENMG - 8/13 (61,5%) Pn axonale - Sensitive 50% - Sensitivo-motrice 50% -1/2 Pn sensitivo-motrice - 100% Pn axonale - 3/4 (75%) sensitive - 25 % sensitivo-motrice
III- Discussion :
1- L’âge :L’âge moyen de nos patients était de 60.62 ans. La prévalence des gammapathies est de 1% dans la population générale et de 3 % chez les sujets âgés plus de 50 ans [31]
Le MM est une pathologie des personnes âgées dont la fréquence est en augmentation et croît avec l’âge. La médiane d’âge au diagnostic est de 62 ans chez l’homme et de 61 ans chez la femme [15].
La cohorte de patients atteints de MM est en grande partie une population de patients âgés 60. [20]
L'âge avancé est associé à une baisse de la densité d'innervation (par exemple, la densité des corpuscule de Meissner ). [18]
2- Le Sexe :
Le sexe ratio dans notre série était de 1 contrairement aux résultats de la littérature
D’une façon générale, l’incidence augmente rapidement avec l’âge, et les hommes sont plus souvent atteints que les femmes [32]
Au Maroc, il existe un registre des cancers de Rabat et qui montre que l’incidence du MM, en 2005 était de 2,12 nouveaux cas pour 100 000 habitants chez les hommes, et de 0,94 pour 100 000 habitants chez les femmes. [15]
3- Les antécédents :
Les antécédents de nos patients variaient entre l’amylose, l’insuffisance rénale, diabète et l’HTA
La prévalence d’amylose est élevée chez les patients atteints de MM (21,4%).
Il a été noté que les patients atteints de myélome associé à l’amylose ont une neuropathie sur le plan clinique dans 66% des cas et électrophysiologique dans 50% [19]
L’insuffisance rénale peut être secondaire au myélome et qui présente une cause directe au aggravant de la neuropathie périphérique
Le diabète donne un tableau de neuropathie similaire à celui de la NP secondaire au myélome
Une étude a été faite en Brésil Pour étudier la prévalence et l'incidence de la NP liée au traitement antinéoplasique chez les personnes atteintes de myélome multiple a trouvé 72% des patients avec des maladies chronique tel que l’hypertension artériel et le diabète, dont 40 % sont suivi pour HTA [20].
Une étude réalisée aux États-Unis avec 2587 patients atteints de MM avancé qui visait à analyser les risques d'effets indésirables associés aux traitements du MM chez les personnes âgées, a constaté que les patients atteints d’HTA , événements thromboemboliques et maladies cardiaques avaient un risque plus élevé de développer une toxicité dans 6 à 12 mois après le début du traitement [33]
4- Isotype de myélome :
Les isotypes retrouvés dans notre étude par ordre de fréquence sont IgG, IgA et chaine légère k, ce qui rejoint les données de la littérature car environ 55% des MM présentent un isotype de l’immunoglobuline de type G (IgG), 25%, de type IgA, et 15 % sont purement à chaînes légères [34]
5- L’ENMG Préthérapeutique :
Une étude a été menée en Italie en 2016 sur 153 patients nouvellement diagnostiqués de MM à la recherche de la prévalence de la NP lié au myélome se basant sur l’examen clinique et l’ENMG et qui a objectivé 7.2% des NP [35]
Les patients présentant une NP secondaire au MM ont un risque accrus d’une aggravation de cette neuropathie sous chimiothérapie surtout les molécules connus inducteurs de NP comme le thalidomide et le bortezomib, nécessitant ainsi un protocole différent surtout pour le bertezomib tenant compte de la neuropathie avec un monitoring stricte et intensifier de la CINP
6- Etude clinique et électrophysiologique :
Dans notre étude, nous avons réparti les cas de myélome qui ont été admis pour un examen ENMG en deux groupes :
a) Un groupe qui n’a pas encore reçu de traitement et un autre qui était déjà sous chimiothérapie.
L’objectif de l’ENMG chez le premier groupe était le dépistage d’une neuropathie secondaire au myélome.Nous n’avons pas exclus de ce groupe les patients ayant les antécédents des pathologies qui sont aussi responsables de neuropathie comme le diabète, l’insuffisance rénale et l’amylose.
L’ENMG avait objectivé une neuropathie chez deux patients de ce groupe. Un d’entre eux avait l’antécédent de diabète et l’autre l’antécédent d’insuffisance rénale. Donc cette neuropathie est très probablement secondaire à ces antécédents vu sa fréquence élevée dans le contexte de diabète et d’insuffisance rénale par rapport au myélome
b) Le deuxième groupe qui avait déjà reçu le traitement de MM a été subdivisé en 3 sous-groupes en fonction des molécules inductrice de neuropathie utilisée dans le protocole thérapeutique
Généralement l’incidence de la NP sous thalidomide varie entre 37 % à 83% [36]. Dans notre étude, 13 cas de ce groupe étaient sous thalidomide, 38.46% avaient des signes cliniques de NP et 61.5% avaient la confirmation de la neuropathie à l’ENMG. Cette neuropathie est axonale, répartie équitablement entre sensitive et sensitivomotrice rejoignant ainsi les données de la littérature
Le thalidomide est connue par ses lésions permanente du système nerveux périphérique, et les symptômes du TiPN peuvent survenir même après l’arrêt du traitement. Le thalidomide est responsable d’une neuropathie axonale sensitive ou sensorimotrice, longueur dépendante, responsable généralement de picotements ou paresthésie distale et douloureuse affectant les pieds et parfois les mains, ainsi qu’une hypoesthésie tactile au niveau des membres inférieurs. Les patients atteints de TiPN peuvent présenter une faiblesse musculaire ou, plus fréquemment, un tremblement. [37]
Les patients sous bortezomib seul étaient au nombre de deux, ils avaient tous les deux des signes cliniques de NP mais un seul d’entre eux qui avait une NP confirmée à l’ENMG
4 patients de ce groupe étaient sous l’association Thalidomid – bortezomib, 75% avaient un tableau clinique de NP . A L’ENMG, le nerf sural avait une amplitude inférieure à 8 µV chez seulement 50%, alors que la conclusion de l’ENMG était en faveur d’une NP chez 100%, dont la majorité avait un caractère sensitif.
Le bortezomib donne essentiellement une neuropathie sensitive et moins sévère que le thalidomide bien que des cas des NP sévère et motrice ont été rapporté dans plus de 15% [37]
Les patients sous bortezomib que ça soit seul ou en association avec le thalidomide et qui ont développé une CiNP avaient reçu en moyenne 5 cures, rejoignant ainsi les données de la littérature qui précisent une dose cumulée de 5 à partir duquel les patients sous bortezomib développent une NP, contrairement au thalidomide dont la dose cumulée est difficile à préciser.
La prévalence de la NP secondaire au myélome est certainement sous-estimée devant le pourcentage important des cas qui ont déjà entamé leur traitement par des médicaments inducteur de NP sans pouvoir bénéficier d’un ENMG prè-thérapeutique. L’intérêt de ce dernier est de bien définir le statut pré- thérapeutique du patient par la demande systématique d’un examen ENMG chez tout malade ayant un diagnostic positif de myélome, afin d’optimiser la gestion du protocole de la chimiothérapie tout en évitant une aggravation d’une neuropathie préexistante.
Les résultats de notre étude étaient comparativement similaires à ceux de la littérature concernant les caractéristiques clinique et éctrophysiologique de la NP chimio-induite, soulignant l’intérêt d’un examen clinique minutieux et un control ENMG stricte et régulier des patients sous thalidomide et bortezomib dans le but de limiter l’handicap induit par le myélome et son traitement.
Résumé
Titre : neuropathie et myélome multipleAuteur : HAIAT Sara
Mots-clés : neuropathie, myélome multiple, NP chimio-induite
Objectif de l’étude : étudier les caractéristiques cliniques et ENMG des neuropathies associé au myélome multiple
Méthodes
Il s’agit d’une étude rétrospective sur 29 cas de MM colligés au service de neurophysiologie clinique, dont l’ENMG a été demandé à la recherche d’une NP secondaire au MM lui-même, ou dans le cadre de suivi des patients sous traitement neurotoxique notamment le thalidomide et le bortézomib.
Résultats
L’âge moyen de nos patients était de 60 ans, et le sexe ratio de 1. Les pics monoclonaux étaient par ordre de fréquence : IgG k, IgA ʎ et chaine légère k. 10 ENMG /29 ont été faites en pré-thérapeutique, objectivant une PNP chez 2cas dont l’antécédent de diabète ou d’insuffisance rénal peut être incriminé. 19 cas/29 avaient déjà reçu un traitement, dont seulement 9 ont bénéficié d’un ENMG pré-thérapeutique. Les molécules utilisées chez nos patients étaient: le thalidomide chez 13 cas, l’association thalidomide – bortézomib chez 4 cas et le bortézomib seul chez 2 cas. Parmi les cas qui ont reçu le thalidomide, 3/13 avaient des signes cliniques de NP et 7/13 (53%) avaient à l’ENMG une PNP axonale, sensitive ou sensitivomotrice. Les cas qui ont reçu l’association thalidomide-bortézomib ou bortézomib seul avaient une moyenne de cure à 5 et un tableau clinique et électrique de PNP chez tous les malades, avec une prédominance du caractère sensitif.
Discussion
Malgré sa faible incidence (3.5%), la PNP secondaire au MM lui-même reste sous-estimée vu que l’ENMG pré-thérapeutique n’a été demandé que chez la moitié des patients sous traitement. Bien que le thalidomide et le bortézomib représentent des avancées majeures dans le traitement de MM, ils sont aussi accompagnés d’un risque accru de NP. Le bortézomib induit généralement une axonopathie sensitive qui apparait après une dose cumulative de 5 cycles, tandis que la NP secondaire au thalidomide peut être sensitive ou sensitivomotrice et dont la dose cumulative est difficile à préciser.
Conclusion
Devant l’incidence élevée des NP secondaires au MM ou à ses traitements, la connaissance du statut pré-thérapeutique des patients candidats au thalidomide et bortézomib reste primordiale, et doit être complété par un contrôle ENMG stricte vue le caractère irréversible de certaines NP chimio-induites.
[1] Kyle RA, Rajkumar SV. Multiple myeloma. N Engl J Med 2004;351: 1860–73.
[2] (MONCONDUIT M , LE LOET X. Le myélome multiple.
EMC.H.I.R(parisFrance) sang 13014 A puissance 10 ; 7-1989 ;14p.
[3] Kyle RA et al. Multiple myeloma. Blood 2008; 111: 2962-2972.
[4] Belot A et al. Cancer incidence and mortality in France over the period 1980-2005. Rev Epidemiol Sante Publique 2008. Jun; 56 (3) : 159-175.
[5] F. Pasquier et al. Modalités thérapeutiques du myélome multiple. Réanimation 2006; 15: 290-296
[6] BOUKHIRI I. Le myélome multiple en médecine interne (83 cas) Thèse de médecine Rabat Numéro 130,1994 .
[7] SAIM k .Le myélome multiple à propos de 13 cas. Thèse de médecine Rabat Numéro 275,1990 .
[8] Arnulf B. Myélome multiple des os. Rev Prat 2013;63:101–8.
[9] Kyle RA, Rajkumar SV. Epidemiology of the plasma-cell disorders. Best Pract Resh Clin Haematol (2007); 20(4): 637-64
[10] http://www.emro.who.int/ncd/pdf/cancer_registry_mor_rabat.pdf
[11] Mahindra A et al. Multiple myeloma : biology of the disease. Blood Reviews 2010; Suppl1: S5-S11
[12] Landgren O, Gridley G, Turesson I. Risk of monoclonal gammopathy of undetermined significance (MGUS) and subsequent multiple myeloma among African American and white veterans in the United States. Blood 2006;107:904–6.
[13] El Mezouar I, Bono W. Myélome multiple (à propos de 58 cas). Thèse de Médecine N°060/2010 : 199 p.
[14] R.Berrady. Myélome multiple chez le sujet jeune (à propos de sept cas ). Volume 73 , Issues 10-11,November 2006, Page 21214 : s.n.,Revue du Rhumatisme .
[15] I. EL FASSI. LE MYELOME MULTIPLE :APPORT DE LA CLASSIFICATION OMS 2016. Thèse de médecine Rabat Numéro : 178, 2019
[16] P. Bouche. LES NEUROPATHIES PERIPHERIQUES ASSOCIEES AUX GAMMAPATHIES MONOCLONALES. INTERET DES ETUDES ELECTROPHYSIOLOGIQUES. Rev. E.E.G. Neurophysiol., 1985, 15:255-265
[17] D. Adams. Neuropathies périphériques au cours des dysglobulinémies. EMC, 17-101-A-10
[18] K. Kosturakis. Subclinical Peripheral Neuropathy in Patients With Multiple Myeloma before Chemotherapy Is Correlated With decreased
Fingertip Innervation Density. JOURNAL OF CLINICAL
ONCOLOGY .volume 32 N°28. 3156. OCTOBER 1 2014.
[19] P.Malhotra. Prevalence of peripheral neuropathy in multiple myeloma at initial diagnosis. Leukemia & Lymphoma, November 2011; 52(11): 2135–2138
[20] M.Moreira. Peripheral neuropathy in people with multiple myeloma. Acta Paul Enferm. 2018; 31(4):439-45.
[21] K.Luczkowska. PATHOPHYSIOLOGY OF DRUG-INDUCED PERIPHERAL NEUROPATHY IN PATIENTS WITH MULTIPLE MYELOMA. Journal of physiology and pharmacology 2018, 69, 2, 165-172
[22] S.Koeppen. Treatment of Multiple Myeloma: Thalidomide-,Bortezomib-, and Lenalidomide-Induced Peripheral Neuropathy. Oncol Res Treat 2014;37:506–513
[23] Kerckhove N, et al. Neuropathies périphériques chimio-induites :
symptomatologie et épidémiologie. Bull Cancer (2018),
https://doi.org/10.1016/j.bulcan.2018.07.009
[24] A. Argyriou. Bortezomib-induced peripheral neuropathy in multiple myeloma: a comprehensive review of the literature. BLOOD, 1 SEPTEMBER 2008 VOLUME 112, NUMBER 5
[25] M. Mohty. Neuropathie périphérique et nouvelles thérapeutiques du myélome multiple : état des lieux et recommandations pratiques. Correspondances en Onco-hématologie - Vol. III - n° 4 - octobre-novembre-décembre 2008.187
[26] G. Richardson. Complications of Multiple Myeloma Therapy, Part 1: Risk Reduction and Management of Peripheral Neuropathy and Asthenia. Journal of the National Comprehensive Cancer Network | Volume 8 Supplement 1 | February 2010
[27] A. Beijers. The magnitude of neurotoxicity in patients with multiple myeloma and the impact of dose modifications: results from the
population-based PROFILES registry. Ann Hematol DOI
[28] A. J. M. Beijers. Chemotherapy-induced neuropathy in multiple myeloma: influence on quality of life and development of a questionnaire to compose common toxicity criteria grading for use in daily clinical practice. Support Care Cancer (2016) 24:2411–2420
[29] P.Richardson. Complications of Multiple Myeloma Therapy, Part 1: Risk Reduction and Management of Peripheral Neuropathy and Asthenia. Journal of the National Comprehensive Cancer Network | Volume 8 Supplement 1 | February 2010
[30] S.Miguel.Update on the use of bortezomib in the management of multiple myeloma. Oncologist 2006;11:51-61
[31] Y.LANOUARI. Gammaathie monoclonale: étiologies, diagnostic biochimique classique et apport des nouveaux biomarqueurs sériques. These de medecine Rabat N°49/2018
[32] S. Manier. Myélome multiple : diagnostic clinique et perspective de traitement. Recommandations de l’International Myeloma Working Group (IMWG). Immuno-analyse et biologie spécialisée (2011) 26, 125—136
[33] Y.Chen. Risk of adverse events associated with front-line anti-myeloma treatment in Medicare patients with multiple myeloma. Ann Hematol. 2018;97(5):851–63.
[34] Belot A et al. Cancer incidence and mortality in France over the period 1980-2005. Rev Epidemiol Sante Publique 2008. Jun; 56 (3) : 159-175.
[35] C. Leone. An observational study assessing peripheral neuropathy related to multiple myeloma. Neurol Sci (2016) 37:1141–1143
[36] PG. Richardson. Complications of multiple myeloma therapy. Part 1: risk reduction and management of peripheral neuropathy and asthenia. J Natl Compr Canc Netw 2010;8:S4–12.
[37] PG Richardson. Management of treatment-emergent peripheral neuropathy in multiple myeloma. Leukemia (2012) 26, 595–608
Fiche d’exploitation
Etude de PNP au cours du myélome
Nom et prénom
Age
IP
N°
ENMG
F/H
ATCD (diabète ++) Date de début des symptômes Mois Année Date de Dc de myélome Mois Année Type de myélome Ig G Ig A Ig M ĸappa Lamda
ENMG avant le TTT Fait Non fait
Conclusion ENMG avant TTT Date de début de TTT Type de molécules utilisées Nombre de cures
Signes fonctionnels Paresthésies/ fourmillements
Douleur Début Topographie
Signes fonctionnels moteurs
Score MRC
Membres supérieurs
Flexion du poignet Flexion de l’avant-bras Abduction de l’épaule
D G D G D G
Membres inférieurs
Dorsiflexion du pied Extension du genou Flexion de la hanche
D G D G D G
Réflexes ostéotendineux
Membres supérieurs
Bicipital Stilo-radial
Présent Absent Présent Absent
Membres inférieurs
Rotulien Achilléen
Présent Absent Présent Absent
Sensibilité tactile Membres
supérieurs
Hypoesthésie Anesthésie Allodynie Topographie
Membres inférieurs
Sensibilité vibratoire Membres
supérieurs
Poignet Coude Epaule
Membres inférieurs
ETUDE ELECTRONEUROGRAPHIQUE
I- CONDUCTION NERVEUSE MOTRICE
Gauche Droit
Latence Amplitude VCM Latence Amplitude VCM
N. Tibial N. Péronier
N. Médian N. Ulnaire
II- CONDUCTION NERVUESE SENSITIVE
Gauche Droit Amplitude VCS Amplitude VCS N. Sural N. Musculo-cutané N. Ulnaire N. médian Conclusion ENMG :
Les valeurs normales de références
Nerf médian : LDM < 4 ms, amplitude motrice > 4,8 mV, VCM > 48 m/s, latence F < 32 ms, amplitude sensitive > 12 µV, VCS > 40 m/s.
Nerf ulnaire: LDM < 3,5 ms, amplitude motrice > 4,8 mV, VCM > 48 m/s, latence F < 32 ms, amplitude sensitive > 7 µV, VCS > 40 m/s.
Nerf péronier : LDM < 5 ms, amplitude motrice > 2 mV, VCM > 40 m/s, latence F < 52 ms, amplitude sensitive > 7 µV, VCS > 35 m/s.
Nerf tibial : LDM < 6 ms, amplitude motrice > 2 mV, VCM > 40 m/s, latence F < 54 ms.
![Tableau I : Definition of peripheral neuropathy according to Common Toxicity Criteria of the National Cancer Institue [24]](https://thumb-eu.123doks.com/thumbv2/123doknet/15063289.699479/25.892.112.800.845.1127/definition-peripheral-neuropathy-according-toxicity-criteria-national-institue.webp)