HAL Id: hal-02961850
https://hal.inrae.fr/hal-02961850
Submitted on 8 Oct 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
tanins condensés
Elodie Opet
To cite this version:
Elodie Opet. Mise au point et validation d’une méthode de dosage des tanins condensés. Chimie. 2012. �hal-02961850�
ANNEE 2011-2012
MISE AU POINT ET
VALIDATION D’UNE
MÉTHODE DE DOSAGE
DES TANINS CONDENSÉS
MASTER 1 CHIMIE PARCOURS ENSEIGNEMENT PHYSIQUE CHIMIE ET
MEDIATION SCIENTIFIQUE | OPET ELODIE
SOMMAIRE
REMERCIEMENTS ... 3 LEXIQUE ... 4 INTRODUCTION ... 5 A – ÉTUDE BIBLIOGRAPHIQUE ... 6 1) Les tanins ... 6 a) Définition ... 6b) Les tanins condensés ... 6
2) Les différentes méthodes de dosage des tanins condensés ... 8
a) Les avantages et les inconvénients des méthodes ... 8
b) La méthode « mise au point » au laboratoire ... 9
B - LA DÉMARCHE UTILISÉE POUR LA VALIDATION DE LA MÉTHODE PAR LE PROFIL D’EXACTITUDE .. 10
1) Matériels et méthodes ... 10
a) Extraction des tanins condensés ... 10
b) Dosage de la gamme d’étalonnage ... 10
c) Dosage des échantillons ... 11
d) Paramètres importants du test d’exactitude ... 11
2) Résultats ... 12
a) Variation de la gamme d’étalonnage ... 12
b) Mesures réalisées sur les échantillons ... 14
c) Résultats des tests statistiques ... 15
3) Discussions ... 17
CONCLUSION ... 18
BIBLIOGRAPHIE ... 19
ANNEXES ... 20
1) Présentation de l’entreprise ... 20
2) Protocole de l’extraction des tanins condensés ... 21
3) Protocole du dosage des tanins condensés ... 23
REMERCIEMENTS
Je remercie tout d’abord Madame MARIE MAGDELEINE CHEVRY Carine, en tant que
Responsable de Laboratoire et Chercheur qui m’a permis d’effectuer mon stage et m’a donné des directives concernant mon thème de stage.
Je remercie particulièrement Monsieur PHILIBERT Lucien en qualité de Technicien de
recherche au sein de l’institut, qui m’a soigneusement guidé et été d’une grande aide dans les recherches et les analyses de mon sujet de stage.
Je remercie également Monsieur ARCHIMEDE Harry en tant que Chercheur de l’Unité de
Recherche Zootechnique qui m’a soutenu et guidé dans la rédaction de mon rapport de stage.
Je tiens à remercier également les Techniciens de recherche Madame SILOU Tatiana, Madame
CALIF Suzitte, Monsieur FELICITE Yoann ainsi que les autres stagiaires pour leur accueil, leur
LEXIQUE
❖ Alcaloïdes : Composés organiques, azotés, plus ou moins basiques possédant une activité pharmacologique significative. Ils existent à l’état de sels et sont formés biosynthétiques à partir d’un acide aminé. Ils peuvent être utilisés comme médicaments, relaxants musculaires, analgésiques, tranquillisants ou encore psychotropes.
❖ Nématicide : Se dit d'une substance capable de tuer les nématodes.
❖ Nématodes : Ver némathelminthe cylindrique ou effilé, aquatique ou parasite, tel que l'ascaris.
INTRODUCTION
J’ai effectué un stage de recherche au sein de l’Unité de Recherche Zootechnique à l’INRA Antilles Guyane où j’ai travaillé sur la « Mise au point et validation d’une méthode de dosage des tanins condensés »
Les tanins sont des métabolites secondaires présents dans les plantes et qui affectent positivement ou négativement l’alimentation et la santé animale. Généralement, les tanins sont des antioxydants et des inhibiteurs enzymatiques (MacheuxX et al., 2005). Ils peuvent
également avoir un effet nématicide chez les petits ruminants, et contribue à la lutte contre certains parasites gastro-intestinaux (Athanasiadou et al., 2001; Hoste et al., 2006; Marie-magdeleineet al., 2010 ; Harbone, 1988).
Il n’y a pas de méthode standard pour doser les tanins du fait de leur grande diversité et la complexité des molécules. On distingue deux grands groupes de tannins différents à la fois par leur réactivité chimique et par leur composition : les tanins hydrolysables appelés communément tanins galliques et les tanins condensés (ou tanins catéchiques). Ils sont différents par leur structure aussi bien que par leur origine biogénétique.
Les tanins sont des formes phénoliques condensées capables de se lier aux protéines en solution et de les précipiter. Nous nous intéressons plus particulièrement aux tanins condensés. En effet, la structure des tanins condensés est vraisemblablement importante notamment la dimension des molécules puisqu’elle détermine les propriétés de ceux-ci. Ainsi, si nous parvenions à déterminer par l’analyse chimique le degré de polymérisation des tanins nous pourrions interpréter les transformations dans lesquelles ces constituants interviennent et ceci aura certainement des applications dans différents domaines de la chimie végétale et de la chimie alimentaire (RIBEREAU-GAYON, 1968).
L’objectif qui m’a été confié était de valider une méthode de dosage des tanins condensés mis au point à l’unité à partir de méthodes préexistantes dans la bibliographie. Nous avons utilisé la méthode du profil d’exactitude. Nous avons travaillé les feuilles ou les racines de manioc (Manihot esculenta) qui contiennent des quantités variables de tanins condensés.
A – ÉTUDE BIBLIOGRAPHIQUE
1) Les tanins
a) Définition
Il est difficile de donner une définition des tanins, car cette expression englobe un ensemble de corps à fonctions phénols qui sont reliés entre eux, non par analogie de structure, mais par un ensemble de propriétés communes. En effet, on peut dire que les principales propriétés des tanins sont liées à leur aptitude à se combiner aux protéines et à d’autres polymères tels que la cellulose ou les pectines. D’après SWAIN et BATE-SMITH (1962) : « il semble plus correct
d’appeler tanins toutes les substances naturelles qui ont des propriétés physiques et chimiques voisines de celles des substances qui sont aptes à la préparation du cuir ». Ceci signifie que ces substances doivent être des composés phénoliques solubles dans l’eau, avoir des poids moléculaires compris entre 500 et 3000 et donner les réactions classiques des phénols. En effet, elles doivent avoir certaines propriétés spéciales, telles que l’aptitude à la précipitation des alcaloïdes, de la gélatine et des autres protéines.
Par ailleurs, on distingue deux types de structures de tanins : les tanins hydrolysables et les tanins condensés. Dans la suite, on s’intéressera aux tanins condensés qui résultent de la polymérisation de molécules élémentaires de flavanes (catéchines ou leucoanthocyanidines). On les appelle aussi les « tanins catéchiques » et sont contrairement aux autres types de tanins résistants à l’hydrolyse.
b) Les tanins condensés
Les tanins condensés sont nettement plus importants que les tanins hydrolysables mais leur connaissance est beaucoup moins avancée. En effet, il reste encore de nombreux éléments de leur structure à identifier.
Les tanins condensés d’un tissu végétal sont donc constitués par un mélange de plusieurs polymères, résultant eux-mêmes de la condensation des molécules de flavanes qui sont actuellement appelées flavolanes (Figure 1). La polymérisation joue un rôle important sur les propriétés qui, pour un même
poids de tanin, sont certainement différentes selon qu’il s’agit de flavanes sous forme de dimère, de trimère, de tétramères, etc… . Comme par exemple les biflavanes qui sont des dimères qui ont été trouvés dans plusieurs fruits faisant intervenir une molécule de flavanol-3 (Figure 2) et une molécule de flavanediol-3,4 (Figure 4). Ainsi, ces biflavanes joueraient un rôle important non seulement dans l’élaboration des structures des tanins condensés mais aussi parce qu’elles ont un poids moléculaire supérieur à 500. Par ailleurs, ces molécules possèdent certaines propriétés des tanins notamment elles sont astringentes. Plusieurs formules ont été proposées pour interpréter la constitution des biflavanes mais aucune ne semble définitivement démontrée.
Il serait donc particulièrement intéressant de connaître la nature des liaisons mises en jeu dans les tanins condensés. Cette question est largement étudiée, mais elle n’est pas définitivement
Figure 1: Taxifoline (flavanonol)
résolue. D’autre part, le rôle des flavanols–3 encore appelés catéchines (8, 9, 10) (Figure 2) dans la constitution de ces tanins dit catéchiques est connue depuis longtemps. Ils possèdent une structure en C6-C3-C6 voisine de celles des anthocyanes, des flavones, et des dérivés voisins. En revanche, leur comportement par chauffage en milieu acide les différencie des flavanediols-3,4. En effet, que ce soit des formes monomères ou des formes partiellement condensées, les catéchines subissent une polymérisation qui les transforme en produits bruns-jaunes insolubles de poids moléculaires élevés.
Figure 2: Catéchine
En ce qui concerne les flavanediols-3,4 autrement dits les leucoanthocyanidines qui sont des composés organiques incolores de la famille des flavonoïdes proches des anthocyanidines et des anthocyanes, ont la particularité de se transformer, au moins partiellement, en anthocyanes colorés par chauffage acide, d’après BATHE-SMITH et SWAIN (1954 et 1956).
D’autre part, selon BATHE-SMITH et LERNER (1954) les leucoanthocyanes seraient « les
composés les plus fréquents et les plus typiques de la classe des substances des tanins » sur les feuilles d’un grand nombre d’espèces.
Figure 4: Flavanediols-3,4
Figure 3 :
2) Les différentes méthodes de dosage des tanins
condensés
a) Les avantages et les inconvénients des méthodes
Si l’on souhaite doser les tanins d’un échantillon, il faut d’abord résoudre le problème du dosage global de ces corps. La dimension des molécules de tanins d’un échantillon est, d’autre part, une donnée fondamentale. En effet, un même échantillon de tanin naturel contient des molécules condensées de dimensions différentes telles que les flavolanes. Il serait donc judicieux de connaître les proportions relatives de chacune d’elle dans cet échantillon. Il faudrait ainsi supposer un fractionnement des différents constituants des tanins condensés, tels qu’ils sont extraits des organes végétaux. À l’heure actuelle, il existe de nombreuses questions qui traduisent la complexité du dosage des tanins condensés.
L’un des premiers dosages des tanins, à l’aide de la réaction des leucoanthocyanes, a été appliqué par LABORDE (1910) sur les différents organes de la vigne et sur le vin. Avec cette
réaction, on peut opérer selon deux possibilités : en milieu aqueux avec la méthode de TAYEAU et al. (1951) et MASQUELIER et al. (1959), ou en milieu alcoolique avec la méthode de
PIGMAN et al. (1953) et SWAIN et HILLIS (1959). Le dosage en milieu alcoolique permet
d’obtenir un meilleur rendement mais pas de résultats reproductibles. Alors que qu’en optant pour un dosage en milieu aqueux les résultats sont plus facilement reproductibles. Mais, la plus grande difficulté est la nécessité de rapporter les résultats obtenus à un produit de référence dont la constitution n’est pas forcément identique au tanin étudié.
Afin de déterminer les variations respectives du tanin et des dérivés cinnamiques LAURENT
(1975) réalise un dosage spectrophotométrique de la coloration obtenue avec la vanilline sulfurique sur des extraits de prothalles. Ce réactif est spécifique aux flavanols. Or, le tanin des prothalles est un produit de la condensation des catéchines et des leucoanthocyanes, LAURENT (1966). La technique utilisée pour ce dosage est celle de SWAIN et HILLIS (1959)
modifiée par RIBEREAU-GAYON (1966). Un des inconvénients de cette méthode est l’utilisation
d’acide sulfurique à 70% et le maintien du milieu réactionnel à une température faible. Cependant, elle n’apporte pas de solution unique et définitive. Elle comporte ainsi une part d’incertitude puisqu’elle intègre dans sa réponse non seulement l’aspect quantitatif, mais aussi le degré de condensation des monomères constitutifs du tanin. En revanche, si l’on couple cette méthode à une technique de dosage global des composés phénoliques elle pourrait apporter de précieux renseignements sur le degré de condensation de flavanols.
D’autre part, la PVP1 a été utilisé par M
ITJAVILA et al. (1971) afin de séparer les substances
phénoliques non tannantes des tanins, présents dans diverses boissons telles que le vin, les bières et les jus de fruits pour les doser ensuite séparément les uns et les autres par la méthode de Folin et Ciocalteu. Ce procédé se déroule selon trois opérations telles que la formation du complexe soluble tanin-PVP, puis la précipitation de ce complexe par l’acide trichloracétique et enfin la séparation du précipité contenant le tanin et du surnageant par centrifugation.
Ainsi, le dosage du tanin est effectué par la technique de Folin sur le précipité après redissolution dans l’eau.
L’analyse de cette méthode a montré qu’elle ne représente pas un progrès réel car il peut leur être reproché de ne pas séparer les tanins des substances phénoliques non tannantes. Cependant, cette technique est la seule parmi d’autres permettant de réaliser une évaluation séparée des tanins et des autres substances phénoliques des extraits de prothalles.
HAGERMAN et al. (1988) admettent que le butanol acide est spécifique pour la détermination
des proanthocyanidines d’après la méthode de PORTER et al (1986), et que la vanilline est
quant à elle spécifique aux flavanols. Ainsi, la réaction avec le butanol acide ne doit pas avoir lieu en milieu aqueux car la solution se décolore en présence d’eau et la coloration dépend du solvant utilisé. En revanche, la technique avec la vanilline peut déterminer les flavanols même en présence de tanins hydrolysables et d’autres composés phénoliques.
Ces deux méthodes peuvent être combinées afin de déterminer le degré de polymérisation des tanins condensés.
b) La méthode « mise au point » au laboratoire
La méthode mise au point au laboratoire permet de dosés les tanins condensés des parties (feuilles et tiges) du manioc. Les tanins condensés sont des proanthocyanidols comportant des liaisons entre le C-4 d’une unité flavanol et le C-8 (ou C-6) d’une autre unité flavanol monomère. La réaction avec la vanilline n’est pas universelle. Cette réaction est positive par exemple pour les flavan-3 –ol, les oligomères de procyanidines mais pas pour les gallotanins, les acides phénoliques ou les héterosides de flavonols et de flavones (tanins hydrolysables). Suite à des essais réalisés par le laboratoire précédemment avec différents réactifs, plusieurs hypothèses ont été émises dont la principale a été l’influence de la concentration de l’acide sulfurique. Après avoir testées différentes concentration d’acide sulfurique, nous déduisons que les absorbances augmentent en fonction des concentrations.
D’autre part, le méthanol influe également sur les résultats c’est pour cela que la prise d’essai en méthanol a été réduite. En effet, en présence d’une trop grande quantité de méthanol la coloration devient bleue ce qui fausse les résultats, nous utiliserons donc de la vanilline sulfurique à 1%. La vanilline réagit avec les monomères catéchiques et les unités terminales des proanthocyanidines pour former un complexes chromophore rouge qui absorbe à 500nm. Elle ne réagit pas avec les unités intermédiaires des proanthocyanidines car son site de fixation (carbone 6) est pris dans la liaison monomère – monomère C4 –C6.
D’un point de vue pratique, il convient qu’avant chaque réaction que les solutions d’acide sulfurique à 70% et de vanilline sulfurique 1% doivent être homogènes, froids et préparés le jour du dosage. Le zéro est fait avec de l’acide sulfurique à 70% et de l’eau.
B - LA DÉMARCHE UTILISÉE POUR LA VALIDATION DE
LA MÉTHODE PAR LE PROFIL D’EXACTITUDE
Le protocole de dosage des tanins a été validé par la méthode du profil d’exactitude (Feinberg M., 2010, Validation des méthodes d’analyse quantitative par le profil d’exactitude, Numéro spécial du cahier des techniques de l’INRA). Cette validation se fait en 10 étapes, elle permet de vérifier si une méthode répond aux exigences fixées dont la reproductibilité et la justesse. Dans la méthode de dosage il y a une étape importante qui est l’extraction des tanins condensés qui n’est pas pris en compte dans la validation de la méthode.
Le profil d’exactitude est basé sur une application directe des principes décrits dans les normes de la série ISO 5725 (1, 2, 3, 4 ; 1994). Ainsi, un modèle statistique est proposé pour estimer l’exactitude (justesse et fidélité) d’une méthode.
Pour simplifier la présentation, la notion de « série » sert à désigner un ensemble de répétitions effectuées sous des conditions de répétabilité. D’une façon générale, afin d’organiser les séries de mesures, le choix des sources de variation doit refléter au mieux les composantes de l’incertitude qui risquent d’apparaître lors de l’application en routine de la méthode à valider. Dans la méthode du profil d’exactitude, il est indispensable de collecter les données en plusieurs séries et en contrôlant les sources de variation. Sinon, il sera impossible de construire un profil d’exactitude.
1) Matériels et méthodes
a) Extraction des tanins condensés
La méthode de dosage des tanins condensés est une méthode indirecte. Par conséquent, nous utilisons un standard pour constituer notre gamme d’étalonnage lors du dosage. Compte-tenu de la diversité et la complexité des tanins condensés il est recommandé d’utiliser les tanins condensés de la plante à doser. Pour cela, il faut d’abord extraire les tanins condensés de la plante étudiée : le manioc amer dans notre cas. La méthode d’extraction permet non seulement d’extraire mais aussi d’isoler les tanins condensés en utilisant le gel Sephadex LH 20.
L’extraction des tanins est précédée d’une opération de dégraissage qui permet de réduire la fraction chlorophyllienne du végétal testé. Cette opération quoique pas obligatoire va tout de même faciliter l’extraction des tanins condensés. Lors de l’étape d’extraction nous utilisons du gel Sephadex LH 20, car celui-ci permet de séparer les composés phénoliques non tanins des tanins condensés. Grâce à leur capacité d’absorption, les tanins condensés sont retenus par le Sephadex.
b) Dosage de la gamme d’étalonnage
La gamme d’étalonnage des tanins permet de construire la courbe de calibration pour déterminer les valeurs de proanthocyanidines des échantillons. À partir d’une solution mère de 1 mg/ml nous préparons sept points de gamme allant de 1 mg/mL à 0.0157 mg/mL de TC
dans du méthanol. Cet étalon a été repris chaque jour soit sept jours consécutifs. Nous déterminons le premier jour les valeurs de référence de chaque niveau de concentration de l’étalon.
c) Dosage des échantillons
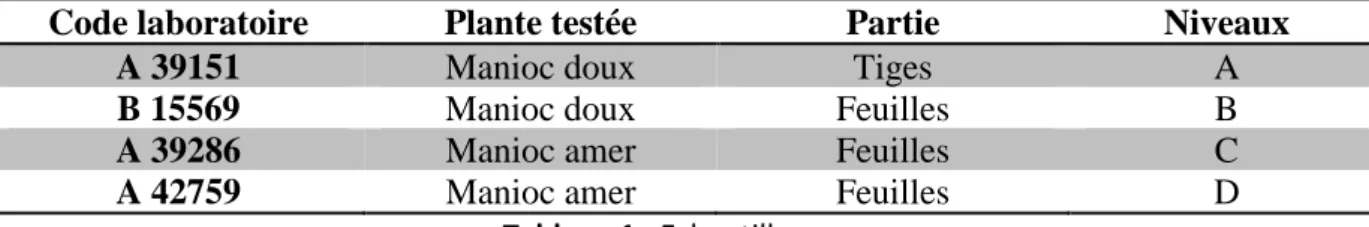
Les échantillons utilisés pour la validation sont présentés dans le Tableau1. Niveaux= niveaux de concentration.
Code laboratoire Plante testée Partie Niveaux
A 39151 Manioc doux Tiges A
B 15569 Manioc doux Feuilles B
A 39286 Manioc amer Feuilles C
A 42759 Manioc amer Feuilles D
Tableau 1 : Echantillonnage
Nous avions deux variétés de manioc telles que Manioc doux et Manioc amer qui se différencient par leurs teneurs en acide cyanidrique et en tanins. Pour chacune des variétés, les feuilles et les tiges ont été prélevés sur la plante au même stade de maturité et à la même position.
Afin de définir les limites d’acceptabilité, nous devons déterminer les concentrations théoriques encore appelées valeurs de référence de chaque échantillon, Les valeurs de référence sont mesurées le premier jour avec la même méthode de dosage (Protocole présenté en annexe).
Pour chacun des échantillons l’opération a été répétée trois fois sur sept séries consécutives. L’absorbance finale de tous les échantillons est calculée selon la formule :
A = (As-Ab)-Ac. Avec As : l’absorbance de filtrat d’échantillon ;
Ab : l’absorbance du blanc du filtrat d’échantillon ; Ac : l’absorbance du blanc vanilline sulfurique à 1 %.
Nous travaillons donc à l’identique d’un jour à l’autre sur les sept séries. Ainsi, l’essai a été réalisé de la même façon sur les mêmes échantillons.
d) Paramètres importants du test d’exactitude
L’exactitude d’une méthode est un modèle statistique qui tient compte de la justesse et de la fidélité des résultats obtenus. La justesse est, par définition, l’étroitesse entre la moyenne d’un nombre infini de valeurs mesurées répétées et une valeur de référence. La fidélité peut être estimée sous plusieurs conditions, comme la répétabilité, la fidélité intermédiaire ou la reproductibilité.
Dans tous les cas, la fidélité est quantifiée par un écart-type, qu’il soit de répétabilité (sr), de fidélité intermédiaire (sFI) ou de reproductibilité (sR). À partir de l’écart-type de fidélité intermédiaire ou de reproductibilité, calculé selon les recommandations de la norme ISO 5725-2, on construit un intervalle de tolérance d’espérance β qui contient une proportion de 80% de futurs résultats. Cet intervalle caractérise la dispersion des résultats obtenus mais
permet aussi de prévoir ceux qui seront obtenus lors de futurs mesurages. L’intervalle de tolérance est différent de l’intervalle de confiance car ce dernier caractérise un paramètre statistique. L’intervalle de confiance λ permet d’établir avec un niveau de confiance donné un intervalle autour de la moyenne observée dans lequel la moyenne vraie a de grandes chances de se trouver.
Nous construisons donc le profil d’exactitude à partir d’un graphique qui présente les valeurs de référence assignés aux niveaux en fonction des limites des intervalles de tolérance d’espérance β et des intervalles d’acceptabilité. Les limites des intervalles de tolérance sont calculés sur les concentrations retrouvées et exprimées en pourcentage sous la forme d’un taux de recouvrement, et les intervalles d’acceptabilité servent à délimiter un intervalle autour de la valeur de référence et sont également exprimés en pourcentage.
2) Résultats
a) Variation de la gamme d’étalonnage
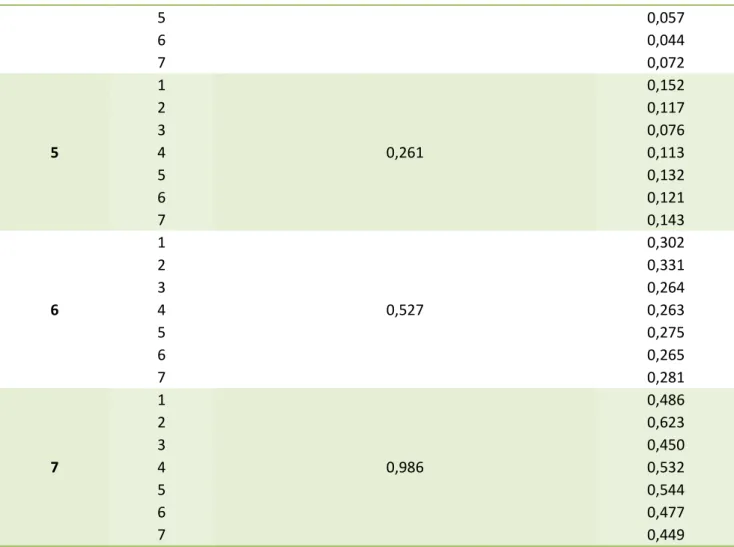
Le plan d’étalonnage est une présentation des valeurs de référence ainsi que des réponses instrumentales (absorbances) de chaque série Tableau 2. Pour chaque niveau de concentration noté 1 à7, allant de 0,0157 à 1,00 mg/ml de tanins condensés, nous avons 7 séries (7 jours) soit 49 essais.
Niveaux de concentration
de l’étalon
Séries
(Jours) Valeurs de référence de l'étalon
Réponses instrumentales Y 1 1 0,0157 0,015 2 0,007 3 -0,035 4 -0,028 5 -0,004 6 0,005 7 0,007 2 1 0,029 0,018 2 -0,008 3 -0,021 4 -0,020 5 0,002 6 0,010 7 0,013 3 1 0,054 0,033 2 0,019 3 -0,015 4 0,000 5 0,024 6 0,022 7 0,027 4 1 0,112 0,067 2 0,059 3 0,019 4 0,035
5 0,057 6 0,044 7 0,072 5 1 0,261 0,152 2 0,117 3 0,076 4 0,113 5 0,132 6 0,121 7 0,143 6 1 0,527 0,302 2 0,331 3 0,264 4 0,263 5 0,275 6 0,265 7 0,281 7 1 0,986 0,486 2 0,623 3 0,450 4 0,532 5 0,544 6 0,477 7 0,449
Tableau 2 : Plan d'étalonnage
Comme la méthode est indirecte, il est nécessaire d’exprimer la réponse instrumentale Y en fonction des concentrations X des étalons.
Le modèle choisi est donc une droite du type Y = a0 + a1X , avec : • Y : réponse instrumentale (absorbance) ;
• X : concentration des étalons ;
• a0 : blanc (ordonnée à l’origine de la droite) ; • a1 : sensibilité (origine de la droite).
Les paramètres du modèle, présentés dans le Tableau 3, sont obtenus à partir de la courbe de la gamme d’étalonnage de chaque série :
Tableau 3 : Estimations des coefficients des paramètres Série Blanc a0 Sensibilité a1
Jour 1 -0,0014 0,6051 Jour 2 -0,0202 0,6497 Jour 3 -0,0513 0,6054 Jour 4 -0,0384 0,6027 Jour 5 -0,0114 0,5594 Jour 6 -0,0047 0,4923 Jour 7 -0,0035 0,5727
b) Mesures réalisées sur les échantillons
Le plan de validation (Tableau 4) décrit, pour les 4 niveaux de concentrations des échantillons, les valeurs de référence et les valeurs estimées de tanins condensés de chaque répétition (3 répétitions) sur les 7 séries (jours). Nous avons donc 7 × 4 × 3 = 84 essais. Les valeurs de référence varient et coïncident à 2.269 à 12.155 de TC par mg de prise d’essai et sont exprimées en mg/mL. Les niveaux sont codés A, B, C et D2 ; et les séries Jour 1, Jour 2, Jour 3, etc... .
2 A: Tiges de manioc doux ; B: Feuilles de manioc doux ; C: Feuilles de manioc amer ; D: Feuilles de manioc amer
Tableau 4 : Plan de validation Niveaux de concentration des échantillons Valeurs de référence X des échantillons de validation Série Répétition 1 Répétition 2 Répétition 3 A 2,269 1 3.76 4.07 4.07 2 2.31 1.12 2.31 3 4.90 4.28 3.97 4 1.21 2.30 1.52 5 3.50 2.78 2.42 6 4.35 3.66 4.12 7 2.66 2.31 2.66 B 3,861 1 4.17 4.46 5.49 2 3.96 4.61 3.57 3 5.27 5.12 5.85 4 4.17 3.72 4.17 5 4.62 3.92 6.19 6 4.78 5.44 5.22 7 3.35 3.51 3.35 C 9,452 1 11.8 9.83 10.3 2 9.19 8.39 8.53 3 10.3 13.4 13.7 4 5.71 6.47 6.32 5 8.21 8.90 9.76 6 8.38 8.38 7.69 7 6.23 6.75 6.92 D 12,155 1 11.9 15.2 14.7 2 12.6 14.4 12.2 3 14.0 15.3 14.6 4 9.47 9.17 8.56 5 11.7 13.6 13.2 6 15.5 14.8 15.9 7 11.7 11.3 12.0
c) Résultats des tests statistiques
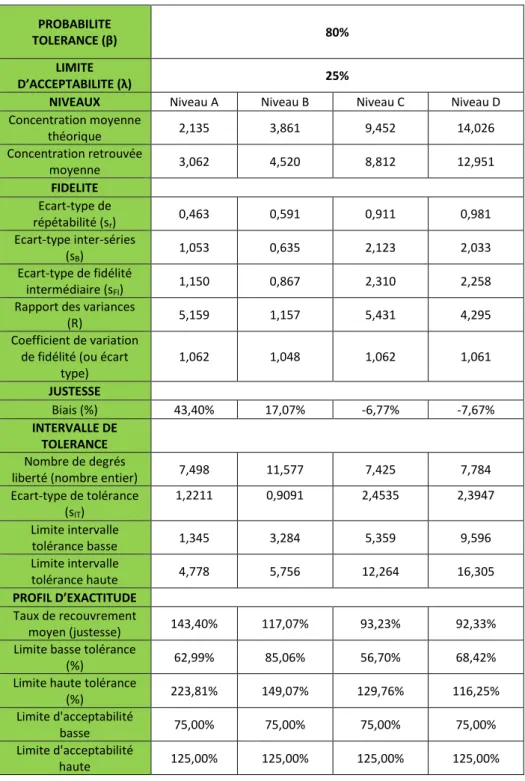
Le Tableau 5 est un récapitulatif décrivant les critères de fidélité, les limites des intervalles de tolérance ainsi que les limites des intervalles pour les 4 niveaux de concentrations du manioc. À partir de ces résultats nous pouvons construire le graphique correspondant (Figure 5). Les détails des calculs de chaque niveau de concentration sont indiqués dans les Tableaux 6 en annexe. Nous déduisons que le niveau A n’est pas satisfaisant car son biais est plus élevé et son taux de recouvrement est nettement supérieur à 100%. Alors que les biais des trois autres trois niveaux sont plus ou moins proches de 3% et leurs taux de recouvrement sont proches de 100%.
Tableau 5: Récapitulatif des critères de validation et des éléments du profil d'exactitude
PROBABILITE
TOLERANCE (β) 80%
LIMITE
D’ACCEPTABILITE (λ) 25%
NIVEAUX Niveau A Niveau B Niveau C Niveau D Concentration moyenne théorique 2,135 3,861 9,452 14,026 Concentration retrouvée moyenne 3,062 4,520 8,812 12,951 FIDELITE Ecart-type de répétabilité (sr) 0,463 0,591 0,911 0,981 Ecart-type inter-séries (sB) 1,053 0,635 2,123 2,033 Ecart-type de fidélité intermédiaire (sFI) 1,150 0,867 2,310 2,258
Rapport des variances
(R) 5,159 1,157 5,431 4,295
Coefficient de variation de fidélité (ou écart
type) 1,062 1,048 1,062 1,061 JUSTESSE Biais (%) 43,40% 17,07% -6,77% -7,67% INTERVALLE DE TOLERANCE Nombre de degrés
liberté (nombre entier) 7,498 11,577 7,425 7,784 Ecart-type de tolérance (sIT) 1,2211 0,9091 2,4535 2,3947 Limite intervalle tolérance basse 1,345 3,284 5,359 9,596 Limite intervalle tolérance haute 4,778 5,756 12,264 16,305 PROFIL D’EXACTITUDE Taux de recouvrement moyen (justesse) 143,40% 117,07% 93,23% 92,33% Limite basse tolérance
(%) 62,99% 85,06% 56,70% 68,42%
Limite haute tolérance
(%) 223,81% 149,07% 129,76% 116,25%
Limite d'acceptabilité
basse 75,00% 75,00% 75,00% 75,00%
Limite d'acceptabilité
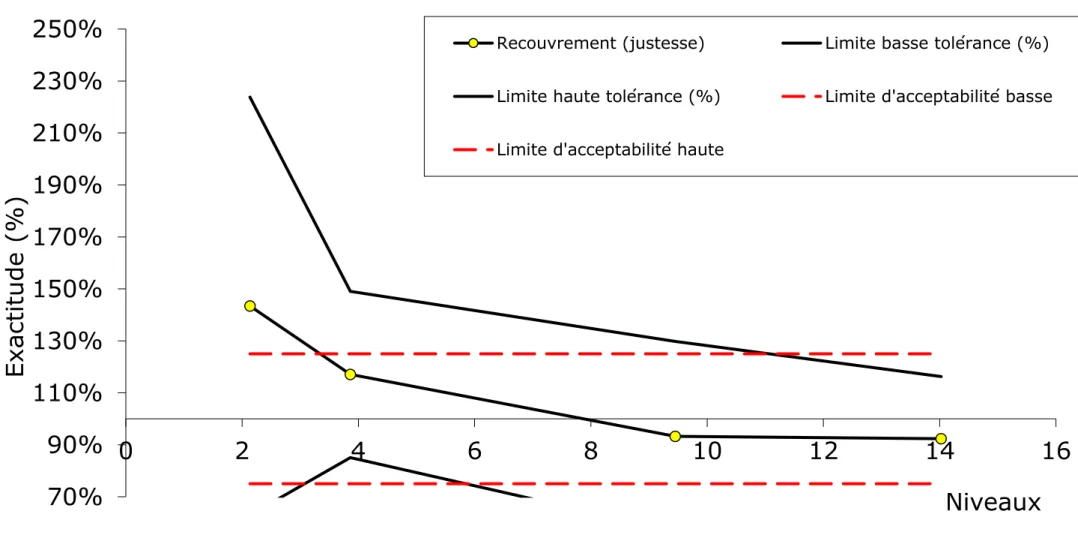
Figure 5 : Profil d'exactitude du dosage des tanins condensés
Chaque cercle jaune représente la concentration retrouvée pour chaque niveau et quantifie la justesse. Les lignes pointillées en rouge délimitent l’intervalle d’acceptabilité et les lignes continues en noir l’intervalle de tolérance calculé à partir des écarts-types de fidélité intermédiaire pour chaque niveau.
70%
90%
110%
130%
150%
170%
190%
210%
230%
250%
0
2
4
6
8
10
12
14
16
Exact
it
ude
(%
)
Niveaux
Recouvrement (justesse) Limite basse tolérance (%)
Limite haute tolérance (%) Limite d'acceptabilité basse
3) Discussions
D’une manière générale, la méthode est globalement satisfaisante. En revanche, si l’on tient compte des valeurs du Tableau 5, la validation est moyennement satisfaisante car les taux de recouvrement et les biais calculés de chaque échantillon varient beaucoup.
Nous pouvons aussi nous demander pourquoi la validation de la méthode n’est pas totalement satisfaisante. Les valeurs mesurées de la gamme d’étalonnage pourrait influencer les résultats obtenus pour chaque échantillon, il faudrait que ces valeurs soient répétables pour toutes les séries. Les écarts-types ainsi que les biais absolus et les bais relatifs entre chaque répétition sont également des éléments essentiels, car s’ils sont élevés cela traduit qu’il existe d’importants écarts entre les valeurs de référence et les concentrations retrouvées des échantillons.
Pour mieux comprendre les résultats, il faudrait dans un premier temps présenter les sources d’erreurs d’une part, de la qualité de l’extraction des TC de référence, car les tanins sont plus ou moins purs. D’autre part, les valeurs de référence de l’étalon et celles des échantillons peuvent être des valeurs extrêmes plutôt que médianes. Etant données qu’elles servent de référence, elles vont amplifier les biais car les courbes d’étalonnage quotidiennes ainsi que les échantillons dosés sur les 7 jours vont se répartir suivant une loi normale.
Quand les résultats sont analysés dans les détails, si l’on s’en tient à l’échantillon B, il n’y a que 2 des 7 séries qui ont des valeurs supérieures à celle de la série qui a permis de calculer la concentration théorique.
Afin d’améliorer la méthode nous pouvons proposer, par exemple, au-delà du test d’exactitude pour la gamme d’étalonnage un travail avec un extrait moyen pour améliorer sa représentativité.
En conclusion générale, la méthode semble être moyennement répétable si l’on s’en tient aux paramètres issus du test d’exactitude du tableau 5. Probablement, les mesures de référence contribuent fortement à ce résultat moyen.
Le profil d’exactitude d’une méthode permet donc de connaître les performances de cette méthode et d’en déduire des indications précieuses pour l’élaboration du plan expérimental à mettre en œuvre. Donc, cette caractérisation garantit que le dosage des tanins condensés effectué est compatible avec les possibilités qu’offre la méthode avec une incertitude liée aux critères de fidélité et de justesse.
CONCLUSION
J’ai effectué mon stage de recherche de la première année de Master Chimie formation des professeurs certifiés en physique-chimie et médiation scientifique au sein de l’Institut National de Recherche Agronomique de la Guadeloupe dans l’Unité de Recherche Zootechnique. Lors de ce stage de 6 semaines, j’ai pu mettre en pratique mes connaissances théoriques acquises durant ma formation, de plus, je me suis confrontée aux difficultés réelles rencontrées dans un laboratoire de recherche.
Après ma rapide intégration dans l’équipe, j’ai eu l’occasion de réaliser plusieurs tâches qui ont constitué une mission de stage globale. Je garde du stage un excellent souvenir, il constitue désormais une expérience professionnelle valorisante et encourageante pour mon avenir.
Je pense que cette expérience dans un institut de recherche m’a offert une bonne préparation concernant mes connaissances professionnelles car elle fut pour moi une expérience enrichissante et complète qui mon désir d’exercer mon futur métier d’enseignant en physique-chimie.
Enfin, je tiens à exprimer ma satisfaction d’avoir pu travaillé dans de bonnes conditions matérielles et un environnement agréable.
BIBLIOGRAPHIE
Feinberg M., 2010. Les cahiers des Techniques de l’Inra, Validation des méthodes d’analyse quantitative par le profil d’exactitude, Numéro spécial.
Lauren S., 1975. Étude comparative de différentes méthodes d’extraction et de dosage des tanins chez quelques péridophytes, Archives Internationales de Physiologie et de Biochimie.
Ribéreau-Gayon P., 1968. Les composés phénoliques des végétaux, Dunod.
Swain T., et al., 1959. The phenolic constituents of prunus domestica, J. Sci. Food Agric. Ventura J., et al., 2008. Fungal biodegradation of tannins from creosote bush (Larrea tridentata)
and tar bush (fluorensia cernua) for gallic and ellagic acid production, Food technol. Biotechnol 46 (2) 213-217.
Waterhouse A.-L., et al., 1999. Reversed-phase high-performance Liquid chromatography methods for analysis of wine polyphenols, RP-HPLC analysis of wine polyphenols, Methods in enzymology vol. 299.
- Sitographie
http://fr.wikipedia.org/wiki/Leucoanthocyanidine http://fr.wikipedia.org/wiki/Flavonol
ANNEXES
1) Présentation de l’entreprise
➢ LE CENTRE ANTILLES-GUYANE
Le Centre Antilles-Guyane accentue principalement ses recherches sur l’agriculture, l’alimentation et l’environnement, dans la Zone Caraïbe depuis 60 ans. L’INRA s’implique également dans l’enseignement et dans la formation au développement durable de l’agriculture.
➢ L’UNITE DE RECHERCHE ZOOTECHNIQUE
L’URZ permet de développer les itinéraires techniques des productions animales au sein d’une grande diversité d’exploitations agricoles et de mettre en avant les espaces naturels par l’animal dans le cadre de l’aménagement.
Ainsi, les activités de recherches sont structurées au sein de 3 projets : - Adaptation des animaux aux contraintes d’élevage
- Caractérisation et gestion des ressources animales
- Conception et évaluation de systèmes d’élevage alternatifs
L’URZ travaille avec plusieurs structures locales comme l’Université des Antilles et de la Guyane, le Lycée Agricole de Guadeloupe, le Parc National, la Chambre d’Agriculture, l’Office National des Forêts et la Société d’Aménagement Foncier et d’Equipement Rural. Les chercheurs de l’URZ entretiennent d’étroites collaborations avec les autres équipes de l’INRA au sein de réseaux de compétences. Des collaborations avec le CIRAD et le CEMAGREF permettent de valoriser les complémentarités et de développer une offre commune de recherches dans la zone tropicale. L’URZ travaille avec différentes structures nationales et internationales des pays de la zone Caraïbe et Amérique Latine d’Afrique et d’Europe.
On retrouve donc au sein de cette unité 56 agents dont 12 chercheurs et 3 groupes de recherche d’approche pluridisciplinaire, un laboratoire d’analyses, une antenne située en Martinique et deux domaines expérimentaux tels que l’Unité expérimentale de Gardel et l’Unité expérimentale en production et santé animale.
➢ LE LABORATOIRE
Le laboratoire a pour mission et vocation d’effectuer des analyses physico-chimiques et biologiques nécessaires des aliments du bétail, des contenus digestifs et des excrétas et sur la qualité des produits animaux.
On y effectue donc divers dosages tels que dosages des matières minérales, des matières organiques et azotées totales, du glucose, de l’amidon et bien d’autres sur les aliments, les fourrages verts et les produits animaux, à partir de techniques analytiques précises. Mais également des mesures de parasitologie comme des coproscopies, des coprocultures et des analyses biochimiques sur des échantillons sanguins.
2) Protocole de l’extraction des tanins condensés
Centre Antilles-Guyane
Unité : Unité de Recherches Zootechniques
Service/équipe :
Nature du document : MODE OPERATOIRE
Extraction des tanins condensés)
Rédigé par : L.PHILIBERT Code : MO-domaine-numéro Nombre
de pages :
3
Revu par : utilisateur N° Version : 1
Validé par : responsable AQ Emis le : 14/02/04 Destinataires : tt agent laboratoire Modifiée le : 23/05/12
1. Objet et domaine d’application
Cette procédure permet à partir de l’extraction des tanins d’une plante d’isoler les tanins condensés en utilisant le Sephadex LH 20.
2. Documents de référence
Bertha I Giner – Chavez et al. A method for isolating condensed tannins from crude plant extract with trivalent ytterbium.
3. Liste de diffusion et si nécessaire niveau de confidentialité Tout agent de laboratoire, stagiaire…
4. Hygiène et sécurité
Il est important de manipuler avec des gants. De plus il est préférable dans la mesure du possible de préparer et d’utiliser les réactifs sous une hotte.
5. Principe de la méthode
Le Sephadex LH 20 permet de par leur capacité d’absorption des tanins condensés, de les séparer des phénoliques non tanins.
6. Matériels nécessaires • Lyophilisateur • Rotavapor • Glace • Spectrophotomètre • Creuset filtrant • Entonnoir filtrant
• Erlenmeyer à grand col, béchers, ballon à évaporer • Mixeur, glace, thermomètre
• Ampoule à décanter, coton, entonnoir • Tamis en plastique
7. Réactifs (chimiques et biologiques) • Ethanol
• Sephadex LH 20 • Acétone • Ethyle acétate • Eau distillée
• Diéthyl éther ou éther de pétrole 8. Contraintes de la méthode
Il est préférable d’utiliser des solutions préparées récemment. 9. Contenu du mode opératoire
L’extraction des tanins sera précédée d’une opération de dégraissage qui va permettre de réduire la fraction chlorophyllienne des végétaux testés. Cette opération quoique pas obligatoire va tout de même faciliter l’extraction des tanins condensés.
9.1. Dégraissage
• Couper en petits morceaux ou broyer le matériel végétal à l’aide du mixeur.
• Peser la fraction végétale obtenue.
• Introduire au fond de l’ampoule à décanter un morceau de coton. Il empêchera la perte du
matériel végétal lors des différents rinçages.
• Imbiber le coton avec un peu de diéthyl éther (ou d’éther de pétrole).
• Introduire le matériel végétal broyé dans l’ampoule à décanter.
• Recouvrir entièrement la fraction végétale broyée par du diéthyl éther (ou de l’éther de pétrole) en veillant à noter la quantité de solvant utilisée.
• Laisser agir au moins dix minutes.
• Récupérer le filtrat qui doit être jeté dans un bidon de déchets approprié et recommencer
l’opération de rinçage jusqu’a obtenir un filtrat clair. Bien noter chaque volume de rinçage.
• Une fois le dégraissage terminé récupérer la fraction végétale sur du papier aluminium et la laisser sécher sous la hotte.
9.2. Extraction
Le mode opératoire est adaptable à la quantité de matériel végétal nécessaire aux diverses applications.
• Mettre 1g de matériel végétal lyophilisé (ou broyé) dans un erlenmeyer a grand col. Ajouter 10mL d’une solution d’acétone à 70% (v/v). Les quantités peuvent être modifiées ; l’important étant que tout le matériel végétal soit recouvert par l’acétone.
• Mettre des morceaux de glace dans le sonicateur et y placer les erlenmeyers pendant au moins 20minutes. La température doit être comprise entre 0 et 5°C. Laisser décanter.
• Récupérer le surnageant dans un ballon à évaporer. Le ballon à évaporer sera muni d’un entonnoir bouché par du coton et surmonté d’un tamis afin de récupérer les éventuels débris végétaux pour les remettre en extraction.
• Conserver le filtrat dans de la glace. • Evaporer l’acétone au rotavapor à 35°C.
Remarques 1 : Vérifier bien que l’évaporation de l’acétone est totale car l’acétone peut empêcher
l’absorption des tanins condensés par le Sephadex LH 20.
Remarques 2 : Si la phase d’extraction et d’évaporation à l’acétone ne peuvent être réalisés le même
jour, laisser le filtrat toute la nuit sous la hotte et évaporer le lendemain. • Noter la durée de l’extraction.
• Récupérer le filtrat dans un bécher et rincer le ballon à évaporer avec un volume connu
d’éthanol à 80%.
• Mélanger le filtrat avec 100 ml de Sephadex LH 20 imbibé d’éthanol à 80%. • Agiter pendant 3 minutes
• Filtrer totalement le mélange avec un entonnoir fritté de 500ml sans faire le vide.
• Après filtration, les composés phénoliques non tanins sont séparés du gel par élution avec une solution d’éthanol 95 % (v/v) .Prendre une petite quantité et mesurer l’absorbance à 280 nm. Poursuivre l’élution jusqu'à ce l’absorbance mesurée soit proche de zéro ou stable. • Ensuite, les polymères de tanins sont extraits sur le gel par élution avec 300ml d’acétone
50% (v/v).
• Evaporer l’acétone à 35°C.
• Laver la solution aqueuse trois fois avec un volume égal d’éthyle acétate. Les traces d’éthyle acétate sont évaporées sous vide à une température inférieur à 30 °C.
• Congeler puis lyophiliser la phase aqueuse.
• La poudre de tanin obtenue est conservé e au congélateur, à l’abri de la lumière et dans un dessiccateur à -20°C.
3) Protocole du dosage des tanins condensés
Centre Antilles-Guyane
Unité : Unité de Recherches Zootechniques
Service/équipe :
Nature du document : MODE OPERATOIRE
Dosage des proanthocyanidines(tanins condensés)
Rédigé par : responsable technique Code : MO-domaine-numéro Nombre de pages :
3
Revu par : utilisateur N° Version : 1
Validé par : responsable AQ Emis le : 14/02/04 Destinataires : tt agent laboratoire Modifiée le : 23/05/12
1. Objet et domaine d’application
Les tanins sont des substances phénoliques naturels que l’on peut retrouver dans toutes les parties d’une plante (racine, feuille, écorce, fruit, fleur, rhizome…). Ils se subdivisent en deux groupes :
❖ Les tanins hydrolysables scindés en deux sous groupes en fonction de la structure chimique
• Les tanins galliques ou gallotanins • Les tanins ellagiques ou ellagitanins ❖ Les tanins condensés
2. Nous nous intéresserons aux tanins condensés qui sont des proanthocyanidols.Liste de diffusion et si nécessaire niveau de confidentialité
Tout agent de laboratoire, stagiaire… 3. Hygiène et sécurité
Il est important de manipuler avec des gants.
Il est recommandé de préparer et d’utiliser les réactifs sous une hotte. 4. Principe de la méthode
La vanilline réagit avec les monoméres catéchiques et les unités terminales des proanthocyanidines pour former un complexes chromophore rouge qui absorbe à 500nm. Elle ne réagit pas avec avec les unités intermédiaires des proanthocyanidines car son site de fixation(carbone 6) est pris dans la liaison monomère – monomère C4 –C6.
5. Matériels nécessaires - Bain d’eau glacé - Spectrophotomètre - Agitateur
- Pipettes, tubes, béchers, fioles - Entonnoirs, coton
- Portoirs
6. Réactifs (chimiques et biologiques) ❖ H2SO4 70 % (v/v)
• 178 mL de H2SO4 à 98 % qsp 250 mL H2O
• Ou bien 180 mL de H2SO4 à 97% qsp 250 mL H2O.
Remarques 1 : La solution H2SO4 en méthanol est exothermique avec risques de projections. Réaliser
le mélange en plaçant la fiole dans un bain de glace et le laisser refroidir. Une fois la solution froide, Agiter délicatement tout en laissant dans la glace afin d’homogénéiser (les deux phases devant totalement disparaître).
❖ Vanilline 1%
• 1g de vanilline dans 100ml de solution d’acide sulfurique à 70 %
Agiter et attendre que la vanilline soit complètement dissous. Mettre la solution de vanilline sulfurique à 1% dans un bain de glace.
❖ Méthanol
❖ ou Tanins Condensés de la plante étudiée (ou catéchine)
• Préparer à partir d’une solution mère de 1 mg/ml, une gamme allant de 10 à 500 µg/ml avec six points de gamme.
Remarques 2 : Il sera toujours préférable d’utiliser les tanins condensés de la plante à doser compte tenu de la diversité des tanins. Les tanins condensés de la plante sont obtenus par extraction (voir protocole Extraction des tanins condensés)
7. Contraintes de la méthode
Il est préférable d’utiliser des solutions le jour même. Il faudra donc ajuster la préparation à la quantité nécessaire au dosage du jour.
8. Contenu du mode opératoire
8.1 Préparation de l’échantillon
Peser environ 200 mg de plantes broyées. Noter le poids.
Ajouter 3 ml de méthanol, laisser reposer 30 minutes puis filtrer sur du coton.
Ajouter 2 ml de méthanol puis filtrer à nouveau sur le coton. Presser le coton pour récupérer le filtrat tout en évitant de laisser passer des particules.
8.2 Mode opératoire
➢ Chaque blanc, point de gamme ou filtrat d’échantillon est fait en triple.
➢ Tous les filtrats d’échantillons (F) et les points de gamme (G) sont faits avec un « blanc » échantillon (FB) ou un « blanc » gamme(GB)
Répartir 0.05 ml de chaque point de gamme ou de blanc ou de filtrat d’échantillon dans les tubes correspondants
Remarques 3 : Il importe que la quantité de méthanol dans le mélange soit la plus faible possible car il y aune fausse réaction bleutée qui masque la réaction. Une quantité de 0.05 ml est acceptable. Dans les tubes à essai mettre,
▪ FB ou GB : 0.05 ml de point de gamme ou 0.05 ml de filtrat d’échantillon + 1 ml de H2O distillée + 2 ml H2SO4 70%.
▪ F ou G : 0.05 ml de point de gamme ou le filtrat d’échantillon + 1 ml d’H2O distillée + 2 ml de vanilline 1%.
Faire trois blancs :
▪ Blanc vanilline (BV): 0.05 ml d’ H2O + 1 ml d’H2O distillée + 2 ml de vanilline 1%.
▪ Blanc Vanilline MeOH (BV Me): 0.05 ml de MeOH + 1 ml d’H2O distillée + 2 ml de vanilline 1%.
▪ Blanc H2SO4 : 0.05 ml de point de gamme ou l’échantillon + 1 ml de H2O distillée + 2 ml H2SO4 70%.
Agiter vigoureusement et laisser 20 min à température ambiante.
Remarques 4 : L’acide sulfurique est un acide lourd et l’agitation est un critère pouvant agir directement sur la qualité des résultats. L’agitation pour un tube peut durer de 30 secondes à une minute. Il faudra donc bien vérifier que l’agitation est homogène.
Mettre en marche parallèlement le spectrophotomètre ; la lecture se fait à 500nm. Faire le zéro absorbance avec le blanc H2SO4.
La densité optique finale est calculée de la manière suivante : Soit A la DO finale : A= (As – Ab) – Ac.
La courbe de calibration est construite à partir de la gamme des tannins de la plante étudiée, et les valeurs en proanthocyanidines des échantillons sont calculées à partir de l’équation issue de cette courbe.
4) Tableaux des concentrations retrouvées par prédiction
inverse pour les niveaux A, C et D
A partir des coefficients de la droite et des réponses Y des échantillons de validation rassemblées aux Tableaux 1 et 3, les concentrations prédites inverses Z (Tableaux 6) de chaque répétition sont calculées, en prenant soin d’utiliser les modèles obtenus pour chaque série, selon le calcul : 𝒁 =(𝒀−𝒂𝟎)
𝒂𝟏
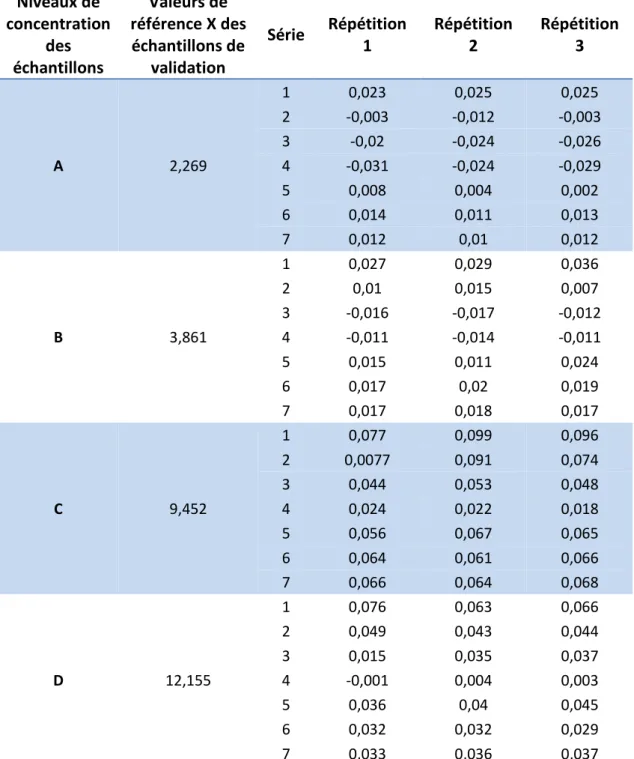
Tableau 4 : Concentration retrouvée par prédiction inverse pour les 4 niveaux de concentration Niveaux de concentration des échantillons Valeurs de référence X des échantillons de validation Série Répétition 1 Répétition 2 Répétition 3 A 2,269 1 0,023 0,025 0,025 2 -0,003 -0,012 -0,003 3 -0,02 -0,024 -0,026 4 -0,031 -0,024 -0,029 5 0,008 0,004 0,002 6 0,014 0,011 0,013 7 0,012 0,01 0,012 B 3,861 1 0,027 0,029 0,036 2 0,01 0,015 0,007 3 -0,016 -0,017 -0,012 4 -0,011 -0,014 -0,011 5 0,015 0,011 0,024 6 0,017 0,02 0,019 7 0,017 0,018 0,017 C 9,452 1 0,077 0,099 0,096 2 0,0077 0,091 0,074 3 0,044 0,053 0,048 4 0,024 0,022 0,018 5 0,056 0,067 0,065 6 0,064 0,061 0,066 7 0,066 0,064 0,068 D 12,155 1 0,076 0,063 0,066 2 0,049 0,043 0,044 3 0,015 0,035 0,037 4 -0,001 0,004 0,003 5 0,036 0,04 0,045 6 0,032 0,032 0,029 7 0,033 0,036 0,037
Figure 6a : Concentrations retrouvées par prédiction inverse pour le niveau A
Niveau Concentration
théorique X Série
Concentration
retrouvée Z Biais absolu
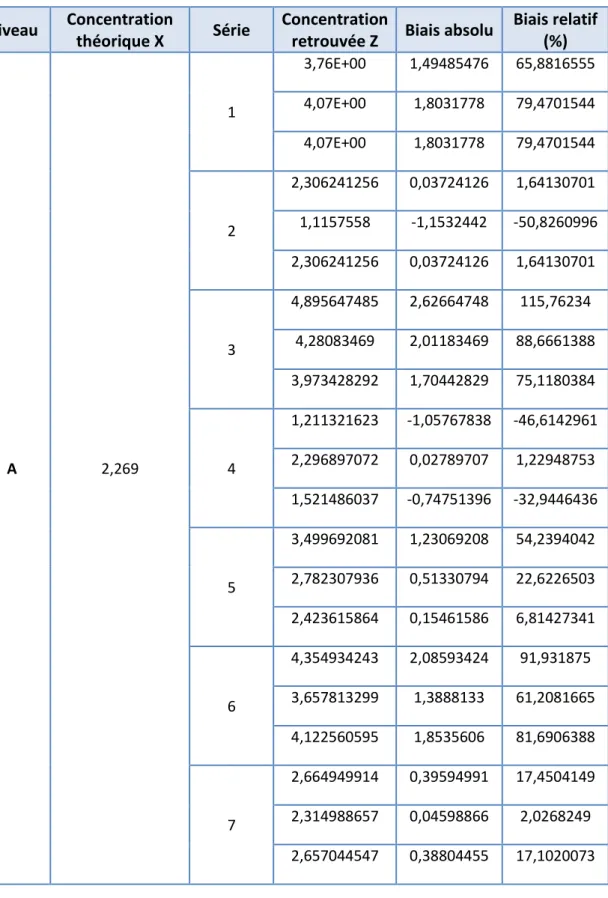
Biais relatif (%) A 2,269 1 3,76E+00 1,49485476 65,8816555 4,07E+00 1,8031778 79,4701544 4,07E+00 1,8031778 79,4701544 2 2,306241256 0,03724126 1,64130701 1,1157558 -1,1532442 -50,8260996 2,306241256 0,03724126 1,64130701 3 4,895647485 2,62664748 115,76234 4,28083469 2,01183469 88,6661388 3,973428292 1,70442829 75,1180384 4 1,211321623 -1,05767838 -46,6142961 2,296897072 0,02789707 1,22948753 1,521486037 -0,74751396 -32,9446436 5 3,499692081 1,23069208 54,2394042 2,782307936 0,51330794 22,6226503 2,423615864 0,15461586 6,81427341 6 4,354934243 2,08593424 91,931875 3,657813299 1,3888133 61,2081665 4,122560595 1,8535606 81,6906388 7 2,664949914 0,39594991 17,4504149 2,314988657 0,04598866 2,0268249 2,657044547 0,38804455 17,1020073
Niveau Concentration
théorique X Série
Concentration
retrouvée Z Biais absolu
Biais relatif (%) B 3,861 1 4,17E+00 3,06E-01 7,92835792 4,46E+00 5,99E-01 15,5247265 5,49E+00 1,63E+00 42,1120165 2 3,956570164 9,56E-02 2,47526973 4,606483888 7,45E-01 19,308052 3,56662193 -2,94E-01 -7,62439964 3 5,26634511 1,41E+00 36,3984748 5,119557356 1,26E+00 32,5966681 5,85349613 1,99E+00 51,6057014 4 4,167268987 3,06E-01 7,93237469 3,717974567 -1,43E-01 -3,70436241 4,167268987 3,06E-01 7,93237469 5 4,620874568 7,60E-01 19,680771 3,923829782 6,28E-02 1,62729297 6,189225337 2,33E+00 60,3010965 6 4,783846136 9,23E-01 23,9017388 5,443887488 1,58E+00 40,9968269 5,223873704 1,36E+00 35,2984642 7 3,34534698 -5,16E-01 -13,3554266 3,50823652 -3,53E-01 -9,13658326 3,34534698 -5,16E-01 -13,3554266
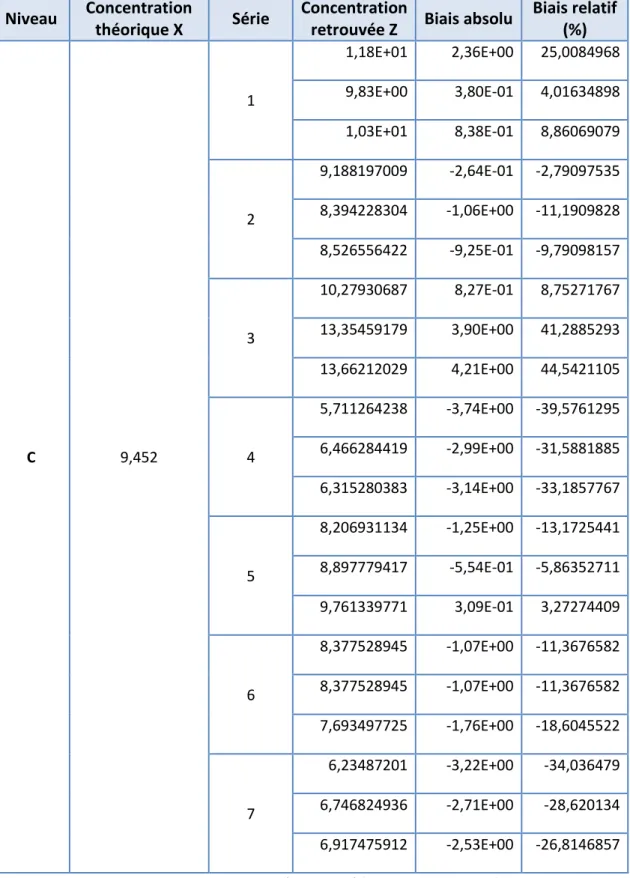
Figure 6c : Concentrations retrouvées par prédiction inverse pour le niveau C Niveau Concentration
théorique X Série
Concentration
retrouvée Z Biais absolu
Biais relatif (%) C 9,452 1 1,18E+01 2,36E+00 25,0084968 9,83E+00 3,80E-01 4,01634898 1,03E+01 8,38E-01 8,86069079 2 9,188197009 -2,64E-01 -2,79097535 8,394228304 -1,06E+00 -11,1909828 8,526556422 -9,25E-01 -9,79098157 3 10,27930687 8,27E-01 8,75271767 13,35459179 3,90E+00 41,2885293 13,66212029 4,21E+00 44,5421105 4 5,711264238 -3,74E+00 -39,5761295 6,466284419 -2,99E+00 -31,5881885 6,315280383 -3,14E+00 -33,1857767 5 8,206931134 -1,25E+00 -13,1725441 8,897779417 -5,54E-01 -5,86352711 9,761339771 3,09E-01 3,27274409 6 8,377528945 -1,07E+00 -11,3676582 8,377528945 -1,07E+00 -11,3676582 7,693497725 -1,76E+00 -18,6045522 7 6,23487201 -3,22E+00 -34,036479 6,746824936 -2,71E+00 -28,620134 6,917475912 -2,53E+00 -26,8146857
Tableau 6d : Concentrations retrouvées par prédiction inverse pour le niveau D Niveaux Concentration
théorique X Série
Concentration
retrouvée Z Biais absolu
Biais relatif (%) D 14.026 1 1,1860E+01 -2,17E+00 -15,4404766 1,52E+01 1,16E+00 8,28333222 1,47E+01 7,08E-01 5,04826738 2 12,58985065 -1,44E+00 -10,239194 14,39872546 3,73E-01 2,65738956 12,20223462 -1,82E+00 -13,0027476 3 14,0202988 -5,70E-03 -0,0406474 15,33635392 1,31E+00 9,3423208 14,60521218 5,79E-01 4,12956069 4 9,468178265 -4,56E+00 -32,4955207 9,166753106 -4,86E+00 -34,6445665 8,563902787 -5,46E+00 -38,942658 5 11,67589613 -2,35E+00 -16,7553391 13,57813187 -4,48E-01 -3,19312796 13,23227083 -7,94E-01 -5,65898453 6 15,50727317 1,48E+00 10,5609096 14,83051657 8,05E-01 5,73589458 15,95844424 1,93E+00 13,7775862 7 11,68297134 -2,34E+00 -16,7048956 11,34694659 -2,68E+00 -19,1006232 12,01899608 -2,01E+00 -14,3091681