HAL Id: tel-02787777
https://hal.inrae.fr/tel-02787777
Submitted on 5 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
L’incorporation de matière grasse laitière et de L.
fermentum dans des préparations pour nourrissons
programme le microbiote et la physiologie intestinale de
l’adulte : étude dans un modèle miniporc
Marion Lemaire
To cite this version:
Marion Lemaire. L’incorporation de matière grasse laitière et de L. fermentum dans des préparations pour nourrissons programme le microbiote et la physiologie intestinale de l’adulte : étude dans un modèle miniporc. Sciences du Vivant [q-bio]. 2018. Français. �tel-02787777�
ANNÉE 2018
THÈSE / UNIVERSITÉ DE RENNES 1
sous le sceau de l’Université Bretagne Loire
pour le grade de
DOCTEUR DE L’UNIVERSITÉ DE RENNES 1
Mention : Nutrition et Pathologies Métaboliques
Ecole doctorale Biologie-Santé
présentée parMarion Lemaire
Préparée à l’unité de recherche Institut NuMeCan, INRA 1341
Nutrition Métabolismes et Cancer
Université de Rennes 1
L’incorporation de
matière grasse laitière
et de L. fermentum
dans des préparations
pour nourrissons
programme le
microbiote et la
physiologie intestinale
de l’adulte ; étude
dans un modèle
miniporc
Thèse soutenue à Rennes le 7 juin 2018
devant le jury composé de :
Anne-Judith WALIGORA-DUPRIET
Maître de conférences, Université Paris Descartes, Paris / rapporteure
Umberto SIMEONI
Professeur des universités-praticien hospitalier néonatologue, CHUV de Lausanne, Lausanne /
rapporteur
Benoit CUDENNEC
Maître de conférences, Université de Lille-1, Lille /
examinateur
Vincent RIOUX
Professeur, Agrocampus Ouest, Rennes /
président du jury
Isabelle LE HUËROU-LURON
Directrice de Recherche, Institut NuMeCan, INRA 1341, Saint-Gilles / directrice de thèse
Sophie BLAT
Chargée de Recherche, Institut NuMeCan, INRA 1341, Saint-Gilles / co-encadrante de thèse
Amélie DEGLAIRE
Maître de conférences, Agrocampus Ouest, Rennes / co-encadrante de thèse
Philippe GERARD
Directeur de Recherche, INRA, Micalis UMR 1319, Jouy-en-Josas/ co-encadrant de thèse
Remerciements
Cette thèse est l’aboutissement du travail d’un grand nombre de collaborateurs que je tiens à remercier chaleureusement. Leur implication et leur soutien tout au long de ces années de thèse ont permis de mener à bien ce projet.
Je tiens tout d’abord à remercier Anne-Judith Waligora-Dupriet et Umberto Simeoni d’avoir accepté d’évaluer ce travail de thèse et d’en être rapporteurs. Je remercie également Benoit Cudennec et Vincent Rioux d’avoir accepté d’en être examinateurs.
Je remercie également les membres de mon comité de suivi de thèse, Olivier Loréal, Alain Dabadie et Anne Gabory, pour les échanges enrichissants et leurs conseils. Je te remercie tout particulièrement Anne de m’avoir fait découvrir le monde de la recherche lors de mon cursus ingénieur et donné l’envie de poursuivre en thèse.
Je remercie ensuite le groupe Lactalis pour le financement de cette thèse dans le cadre d'une convention industrielle de formation par la recherche (CIFRE). Au-delà de toute l’équipe du service nutrition, je tiens à remercier plus particulièrement Pascale Le Ruyet et Charlotte Baudry de m’avoir donné l’opportunité de réaliser cette thèse et accordé leur confiance. Un grand merci à toi Charlotte pour ton encadrement, ta disponibilité et tous nos échanges. Tu m’as permis de découvrir et d’apprécier ce qu’est la recherche en entreprise.
J’adresse mes sincères remerciements à Isabelle Le Huërou-Luron, ma directrice de thèse. Je te remercie Isabelle pour ton implication et ton intérêt dans l’avancée des travaux de thèse, tes conseils, ton écoute et ta grande disponibilité pour toutes mes « petites questions ». Je te remercie aussi pour la confiance que tu m’as accordée et ton soutien tout au long de ces années de thèse, d’autant plus lors de la finalisation de ce manuscrit et la projection dans l’après-thèse. Je remercie également très chaleureusement Sophie Blat, co-encadrante de cette thèse. Je te remercie Sophie pour ta bienveillance, ton écoute, ta disponibilité et tes conseils toujours avisés. Je vous remercie de tout cœur Isabelle et Sophie pour tout ce que j’ai appris à vos côtés - toujours dans la bonne humeur - sur le plan professionnel et humain. Vous avez su trouver les mots pour me guider, me conseiller et m’encourager à chacune de nos entrevues. Je vous remercie aussi pour vos nombreuses relectures méticuleuses de ce manuscrit de thèse.
Je remercie également Amélie Deglaire et Philippe Gérard, co-encadrants de cette thèse. Merci pour votre disponibilité, votre accueil chaleureux dans vos unités de recherche respectives, vos conseils pertinents et votre implication dans la relecture de ce manuscrit et des articles associés.
Merci aussi à Cécile Canlet, Didier Dupont, Mahendra Mariadassou, Olivia Ménard et Marie Tremblay-Franco, avec qui j'ai eu de la chance et le plaisir de travailler et d'échanger au cours de cette thèse. Merci pour votre expertise et votre bienveillance.
Cette thèse repose en grande partie sur le soutien et l’aide de tous les membres de l’équipe NGB que je tiens à remercier chaleureusement. Merci pour votre excellent accueil et pour les conditions de travail privilégiées qui m’ont été offertes durant ces années de thèse. Merci aussi pour votre aide, votre disponibilité, votre bonne humeur et vos taquineries sur mon accent gapençais, aujourd’hui très largement atténué ! Merci à Gaëlle Boudry et Stéphanie Ferret-Bernard d’avoir suivi d’un œil bienveillant et averti le déroulement de ce projet et pour leur expertise scientifique. Un grand merci aussi à Eric Bobillier, Armelle Cahu, Nicolas Coquery, Michèle Formal, Nicole Guéguen, Sylvie Guérin, Régis Janvier, Laurence Le Normand, Paul Meurice, Isabelle Nogret, Gwénaëlle Randuineau, Véronique Romé, Yann Serrand et David Val-Laillet pour leur implication directe et indirecte dans ce projet et pour tous nos échanges. Cela a été un réel plaisir de travailler avec vous durant ces dernières années et j’ai beaucoup apprécié nos échanges sur de célèbres émissions de télé !
Je remercie ensuite les membres de l’UEPR et plus particulièrement Mickaël Génissel, Julien Georges et Francis Le Gouevec qui ont veillé au bon déroulement des expérimentations animales. Merci à vous pour votre implication, votre professionnalisme, votre partage des connaissances et votre respect pour les miniporcs.
A mes collègues doctorants, post-doctorants et stagiaires, passés au laboratoire ou encore présents aujourd’hui : Mathilde, Charlène, Cindy, Alexis, Ying, Yasmine, Samir, Pauline, Juliette, Yentl, Mélanie, Sophie, Ilario… Un grand merci pour votre bonne humeur, l’entraide et tous les moments de détente et les échanges que nous avons partagés. Un merci particulier à Servane Le Page pour son aide dans le cadre de son stage. Je te souhaite une bonne poursuite en thèse.
A ma famille (Lemaire, Girousse, Magnin) et à mes amis de longue date qui m’ont vu partir -selon leurs dires - dans le « Nord » (j’ai depuis eu l’occasion de revoir ma géographie). Merci pour votre soutien, vos encouragements et tous les moments (trop peu nombreux) passés ensemble. Vous êtes une source de motivation extraordinaire !
A Adrien, merci pour ta sérénité à toute épreuve et pour ton soutien moral et logistique, notamment durant les derniers mois de rédaction. Tout simplement merci d’être là pour moi.
A ma maman et à ma petite sœur, ces dernières années ne nous ont pas épargnées mais nous en sommes ressorties encore plus soudées. Merci pour votre amour et votre soutien sans faille.
A toi mon papa, qui m’a encouragée à me lancer dans cette aventure et à qui je dédie cette thèse. J’aurais tant aimé que tu puisses assister au résultat de ce travail dont tu serais, j’en suis certaine, très fier. Merci pour toutes les valeurs que tu m’as transmises et pour veiller sur moi depuis là-haut.
Publications et communications et scientifiques
Publications scientifiques à comité de lecture Lemaire M., Le Huërou-Luron I., Blat S. (2018). Effects of infant formula composition on long-term metabolic health. J Dev Orig Health Dis: 1-17.
Le Huërou-Luron, I., Lemaire M., Blat S. (2018). Health benefits of dairy lipids and MFGM in infant formula. OCL. https://doi.org/10.1051/ocl/2018019.
Lemaire M., Dou S., Cahu A., Formal M., Le Normand L, Romé V., Nogret I., Ferret-Bernard S., Rhimi M., Cuinet I., Canlet C., Tremblay-Franco M., Le Ruyet P, Baudry C., Gérard P., Le Huërou-Luron I., Blat S. (2018). Addition of dairy lipids and probiotic L. fermentum in infant formula programs gut microbiota and entero-insular axis in adult minipigs (Accepté à Scientific reports sous réserve de corrections mineures).
Lemaire M., Mariadassou M., Ferret-Bernard S., Le Page S., Le Normand L., Randuineau G., Romé V., Cuinet I., Canlet C., Tremblay-Franco M., Le Ruyet P., BaudryC., BoudryG., GérardP., Blat S., Le Huërou-LuronI. (2018). The effects of dairy lipids and probiotic L. fermentum addition in infant formulas on gut microbiota and physiology are age- and site-dependent in a minipig model (En préparation).
Lemaire M., Ménard O., Cahu A., Nogret I., Briard-Bion V., Cuinet I., Le Ruyet P., Baudry C., Dupont D., Deglaire A., Blat S., Le Huërou-Luron I. (2018). Addition of dairy lipids and probiotic L. fermentum in infant formulas increases proteolysis and lipolysis in Yucatan piglets (En préparation).
Communications orales
En interne
- Journée Des Doctorants de l’Institut NUMECAN. Rennes (15/01/16).
- Journée Des Doctorants de l’Institut NUMECAN. Rennes (16/03/17).
- Journée Des Doctorants du centre INRA de Saint-Gilles. Saint-Gilles (19/04/16).
- Journée recherche organisée par l’industriel partenaire. Bourgbarré (24/06/16).
- Journée recherche organisée par l’industriel partenaire. Laval (29/06/17).
National
- SF-DOHaD. Paris (1-2/12/16).
Lemaire M.*, Boudry G., Ferret-Bernard S., Nogret I., Le Normand L., Randuineau G., Formal M., Guérin S., Cahu A., Le Ruyet P., Cuinet I., Baudry C., Blat S., Le Huërou-Luron I. Dairy lipids and L. fermentum incorporation in infant formula has long-term effects on intestinal permeability and immunity but no effect on metabolic dysfunction induced by an obesogenic diet in a minipig model.
- «Pitchez votre projet». Les Doctoriales, Lorient (4/17).
- GIS NAMS (3èmes Rencontres Nutrition-Alimentation-Métabolisme-Santé). Rennes (17/11/17).
Lemaire M.*. Modulation du microbiote intestinal par la composition de la formule infantile chez le nouveau-né. Conséquences physiologiques et métaboliques.
International
- International Conference on Food Digestion (ICFD). Rennes (5-6/04/17).
Lemaire M.*, Boudry G., Ferret-Bernard S., Ménard O., Formal M., Le Normand L., Randuineau G., Nogret I., Rhimi M., Maguin E., Cuinet I., Le Ruyet P., Baudry C., Dupont D., Gérard P., Deglaire A., Blat S., Le Huërou-Luron I. Neonatal modulation of gut digestion and microbiota by addition of dairy lipids and probiotic
L. fermentum CECT 5716 in infant formula programs adult gut microbiota and
physiology in a minipig model.
- 3rd International Neonatology Association Conference (INAC). Lyon (7-8/07/17). Lemaire M.*, Dou S., Canlet C., Tremblay-Franco M., Formal M., Ménard O., Nogret I., Cuinet I., Le Ruyet P., Baudry C., Dupont D., Gérard P., Deglaire A., Blat S., Le Huërou-Luron I. Early modulation of gut digestion and microbiota in piglets by addition of dairy lipids and probiotic L. fermentum in infant formulas.
Communications affichées
En interne
- Journée recherche organisée par l’industriel partenaire. Bourgbarré (24/06/16). Lemaire M.*, Le Normand L., Randuineau G., Ranaivo D., Ferret-Bernard S., Boudry G., Le Ruyet P., Blat S., Le Huërou-Luron I. Long-term effects of milk lipids and L. fermentum incorporation in infant formula on glucose metabolism, intestinal permeability and immune responses in a Yucatan minipig model.
National
- Journées Francophones de Nutrition (JFN). Montpellier (30/11 au 2/12/16).
Lemaire M., Boudry G., Ferret-Bernard S., Nogret I., Le Normand L., Randuineau G., Formal M., Guérin S., Cahu A., Le Ruyet P., Cuinet I., Baudry C., Blat S.*, Le Huërou-Luron I. L’incorporation de matière grasse laitière et L fermentum dans des formules infantiles modifie les fonctions barrière et immunitaire intestinales sans effet sur les conséquences métaboliques d’un régime hyperénergétique chez le miniporc adulte.
- Journées Francophones de Nutrition (JFN). Nantes (13-15/12/17).
Lemaire M., Dou S., Cahu A., Romé V., Canlet C., Tremblay-Franco M., Rhimi M., Cuinet I., Le Ruyet P., Baudry C., Gérard P., Blat S., Le Huërou-Luron I. La matière grasse laitière et le probiotique L. fermentum CECT 5716 incorporés dans des formules infantiles programment la composition du microbiote et la fonction endocrine intestinale dans un modèle miniporc.
International
- Nutrition and Growth (N&G). Amsterdam (2-4/12/16).
Lemaire M.*, Boudry G., Ferret-Bernard S., Nogret I., Le Normand L., Randuineau G., Formal M., Guérin S., Cahu A., Romé V., Le Ruyet P., Cuinet I., Baudry C., Blat S., Le Huërou-Luron I. Incorporation of dairy lipids and
Lactobacillus fermentum in infant formulas: long-term effects on intestinal
- ESPGHAN. Prague (11-13/05/17).
Lemaire M.*, Boudry G., Ferret-Bernard S., Nogret I., Formal M., Cahu A., Le Normand L., Randuineau G., Guérin S., Romé V., Rhimi M., Le Ruyet P., Cuinet I., Baudry C., Gérard P., Blat S., Le Huërou-Luron I. Addition of dairy lipids and probiotic Lactobacillus fermentum CECT 5716 in infant formula programs gut microbiota, epithelial permeability, immunity and GLP-1 secretion in adult minipigs.
- DOHaD. Rotterdam (15-18/10/17).
Lemaire M., Dou S., Canlet C., Tremblay-Franco M., Boudry G., Ferret-Bernard S., Rhimi M., Cuinet I., Le Ruyet P., Baudry C., Dupont D., Deglaire A., Gérard P., Blat S., Le Huërou-Luron I.* Dairy lipids and probiotic L. fermentum in infant formulas differently program gut microbiota and physiology in a minipig model.
- ESPGHAN. Genève (10-13/05/18).
Lemaire M.*, Boudry G., Dou S., Formal M., Cahu A., Nogret I., Randuineau G., Le Normand L., Canlet C., Tremblay-Franco M., Ménard O., Cuinet I., Le Ruyet P., Baudry C., Gérard P., Dupont D., Deglaire A., Blat S., Le Huërou-Luron I. Neonatal modulation of gut digestion, microbiota and physiology by addition of dairy lipids and probiotic L. fermentum in infant formulas.
Formations
MISTER 1 et 2 : Maîtriser l’Information Scientifique et Technique en Recherche - 29/01 et 2/02/15, INRA Le Rheu.
Introduction à la statistique avec R - 19 et 20/03/15, INRA Le Rheu.
Ecole d’été du département Alimentation Humaine - 6-9/07/15, Châtelaillon-Plage. Visite d’une usine de fabrication de poudres infantiles - 16/06/15, Craon.
Visite du site pilote Bionov (un jour de fabrication de nos poudres expérimentales) -29/09/15, Rennes.
Diplôme d’Ecole d’Expérimentation Animale : Conception et réalisation de procédures expérimentales (ex Niveau I) - 7-16 octobre 2015, ONIRIS Nantes.
Communiquer ses recherches en anglais, Université Rennes 2. o Module « Présenter ses recherches à l’oral » - 6 et 13/06/16. o Module « Rédiger et communiquer en anglais » - 7 et 14/06/16. Forum Docteurs & Entreprises - 17/06/16, Rennes.
Formation à l’analyse des métabolomes bactérien (eaux fécales) et de l’hôte (plasma, urine) en RMN (préparation et passage des échantillons, analyses statistiques, annotation des spectres) - 3-14/10/16, Toulouse, unité INRA Toxalim.
Visite Compagnie des Fromages et RichesMonts - 7/11/2016, Manche.
Atelier pratique de métabolomique - Pour comprendre et initier des analyses en métabolomique - 12-13/12/2016, IMBE, Station Marine d’Endoume, Marseille.
Doctoriales 2017 : « Le Doctorat, un accélérateur d’innovation et de création » - 10-13/04/17, Université Bretagne Sud, Lorient.
Etude de données métabolomiques dans le contexte des réseaux métaboliques - 26-27/04/17, Toulouse.
Construire et affiner son projet professionnel, apprendre à le communiquer - (7 jours, 2017), INRA le Rheu.
Co-organisation de l’édition 2017 du festival de médiation scientifique rennais « Sciences en Cour[t]s » (9/05/17, Rennes) et de la finale nationale « Action!Sciences » (1/04/17, Paris).
1
Table des matières
Liste des abréviations ... 4
Liste des figures ... 7
Liste des tableaux ... 11
CHAPITRE 1 - Concept des Origines Développementales de la Santé et des Maladies (DOHaD) ... 17
1.1. Des origines fœtales des maladies aux origines développementales de la santé et des maladies de l’adulte ... 17
1.1.1. Premières évidences épidémiologiques et définition du phénotype d’épargne ... 17
1.1.2. Evolution vers le concept de DOHaD ... 18
1.1.3. Les 1000 premiers jours de vie ... 20
1.2. DOHaD et nutrition ... 21
1.2.1. Preuves par les modèles animaux ... 21
1.2.1.1. Modèles animaux de sous-nutrition maternelle ... 22
1.2.1.2. Modèles animaux de surnutrition maternelle ... 23
1.2.2. Focus sur la période postnatale précoce ... 24
1.3. Mécanismes de programmation ... 25
1.3.1. Les mécanismes épigénétiques dans le concept de DOHaD... 26
1.3.1.1. Définitions ... 26
1.3.1.2. Nutrition, épigénome et métabolisme ... 29
1.3.2. Microbiote intestinal ... 31
1.3.2.1. Composition du microbiote intestinal : gradients de diversité et de densité .... 31
1.3.2.2. Mise en place du microbiote intestinal et facteurs influents ... 33
1.3.2.3. Fonctions exercées par le microbiote intestinal ... 34
1.3.2.4. Modulation précoce du microbiote et effets à long terme : focus sur les lipides et les probiotiques ... 37
1.3.3. Microbiome et épigénome ... 40
CHAPITRE 2 - Nutrition précoce : l’allaitement maternel et les préparations pour nourrissons ... 43
2.1. Nutrition précoce : allaitement maternel ... 43
2.1.1. Recommandations nutritionnelles ... 43
2.1.2. Composition, structure et conséquences fonctionnelles ... 44
2.1.2.1. Protéines ... 45
2.1.2.2. Glucides ... 46
2.1.2.3. Lipides ... 46
2
2.2.1. Historique des préparations pour nourrissons et réglementation actuelle... 48
2.2.2. Conséquences sur la composition des préparations pour nourrissons par comparaison au lait humain et bovin ... 49
2.3. Digestion du lait maternel et des préparations pour nourrissons ... 51
2.4. Principales améliorations des préparations pour nourrissons et conséquences sur leur digestion ... 53
Chapitre 3. Nutrition précoce et effets à court et long termes sur l’intestin... 58
3.1. Structure et fonctions de l’intestin ... 58
3.1.1. Structure ... 58
3.1.2. Fonction barrière non-immunitaire ... 60
3.1.3. Fonction immunitaire ... 62
3.1.3.1. Immunité innée ... 62
3.1.3.2. Immunité adaptative ... 63
3.1.4. Fonction endocrine ... 64
3.2. Développement et maturation de la physiologie intestinale ... 65
3.2.1. Développement in utero ... 65
3.2.2. Maturation structurelle et fonctionnelle postnatale : importance de l’alimentation 66 3.2.2.1. Morphologie et physiologie de l’intestin ... 67
3.2.2.2. Fonction barrière ... 68
3.2.2.3. Fonction immunitaire ... 70
3.2.2.4. Fonction endocrine ... 72
3.3. Conséquences de l’amélioration des préparations pour nourrissons sur la structure et les fonctions intestinales ... 73
3.3.1. Modification de la nature des lipides des PPN ... 73
3.3.1.1. MFGM ... 73
3.3.1.2. Supplémentation en MFGM en conditions basales ... 74
3.3.1.3. Supplémentation en MFGM en conditions inflammatoires ... 74
3.3.1.4. Potentialisation des effets des MFGM par d’autres composants ... 75
3.3.1.5. AGPI à longue chaîne ... 76
3.3.2. Supplémentation des PPN en probiotiques ... 77
3.3.2.1. Le probiotique Lactobacillus fermentum CECT 5716 (Lf) ... 78
3.3.2.2. Effets synergiques entre les probiotiques et les lipides ... 79
3.3.2.3. Préparations pour nourrissons fermentées ... 80
CHAPITRE 4 – Nutrition précoce et effets à court et long termes sur le métabolisme ... 82
4.1. Développement et maturation de la fonction endocrine pancréatique ... 82
4.1.1. Anatomie et fonctions du pancréas endocrine ... 82
3
4.1.2.1. Biosynthèse et régulation de la sécrétion de l’insuline ... 83
4.1.2.2. Action de l’insuline sur ses tissus cibles ... 84
4.1.3. Maturation du pancréas endocrine ... 85
4.1.3.1. Durant la vie fœtale ... 85
4.1.3.2. Durant la vie post-natale ... 86
4.2. Régulation du métabolisme glucidique durant la vie périnatale ... 86
4.2.1. Avant la naissance ... 86
4.2.2. A la naissance ... 87
4.3. Effets à long terme de la composition des préparations pour nourrissons sur la santé métabolique ... 87 HYPOTHESE ET OBJECTIFS ... 89 STRATEGIE EXPERIMENTALE ... 93 ARTICLE 1 ... 100 ARTICLE 2 ... 122 ARTICLE 3 ... 180 DISCUSSION GENERALE ... 221
1. La MGL et le probiotique Lf modifient la digestion des PPN, la maturation des fonctions de défense de l’intestin et modulent l’implantation du microbiote intestinal ... 224
2. Révélation d’une empreinte nutritionnelle à long terme induite par l’ajout de MGL et du probiotique Lf dans des PPN sur les réponses endocrine et immunitaire dans un contexte d’alimentation HE ... 231
3. Les effets observés à long terme sur la physiologie de l’hôte peuvent-ils être expliqués par une modulation persistante de la composition et du métabolisme du microbiote? ... 236
4. Forces et limites de la stratégie expérimentale et des techniques « omiques » mises en œuvre ... 237
CONCLUSION ET PERSPECTIVES ... 241
ANNEXE ... 244
4
Liste des abréviations
AAP : Académie Américaine de Pédiatrie ADN : Acide DésoxyriboNucléique AG : Acide gras
AGCC : Acide gras à chaîne courte AGMI : Acide gras monoinsaturé AGPI : Acide gras polyinsaturé AGS : Acide gras saturé
AGT : Acides gras totaux ALA : Acide alpha-linolénique ARA : Acide arachidonique ARN : Acide RiboNucléique ARNr 16S : ARN ribosomique 16S BSSL : Bile Salt-Stimulated Lipase CCK : Cholécystokinine
CE : Commission européenne CEM : cellule épithéliale mammaire DHA : Acide docosahexaénoïque
DOHaD : Developmental Origins of Health and Disease DPPIV : Dipeptidyl-peptidase IV
DT2 : Diabète de type 2
EPA : Acide eicosapentaénoïque
ESPGHAN : Société Européenne de Gastroentérologie, Hépatologie et Nutrition Pédiatrique FAO : Organisation des Nations unies pour l'alimentation et l'agriculture
FAS : Fatty acid synthase
FDA : Agence américaine des produits alimentaires et médicamenteux FFAR : Free fatty acid receptor
FOAD : Fetal Origins of Adult Disease G6Pase : Glucose-6-phosphatase
GALT : Gut Associated Lymphoid Tissue
GIP : Glucose-dependant insulinotropic polypeptide GLP-1 : Glucagon-like peptide-1
5 GRAS : Generally recognized as safe
HMO : Human Milk Oligosaccharide Hnf4a : Facteur nucléaire hépatocytaire 4 IGF2 : Insulin-like growth factor II IL : Interleukine
IRS : Insulin receptor substrate Km : Constante de Michaelis LA : acide linoléique
Lf : Lactobacillus fermentum CECT 5716 LPS : Lipopolysaccharide
MafA : V-maf musculoaponeurotic fibrosarcoma oncogene homolog A MAPK : Mitogen-Activated Protein Kinase MAP Kinase
MFGM : Milk Fat Globule Membrane MGL : Matière grasse laitière
miRNA : microARN
MLN : Mesenteric Lymph Node Ngn3 : Neurogenin3
OMS : Organisation Mondiale de la Santé OTU : Operational taxonomic unit
PAMP : Pathogen associated molecular pattern Pdx1 : Pancreatic and duodenal homeobox 1 PEPCK : Phosphoénolpyruvate carboxykinase PI3K : Phosphoinositide 3-Kinase
PLRP2 : Pancreatic lipase-related protein-2 PPN : Préparation pour nourrisson
PYY : Peptide YY
SD : Semaine de développement sIgA : Immunoglobuline A sécrétoire
SREBP-1c : Sterol response element-binding protein 1 Th : Lymphocyte T auxiliaire « helper »
TLR : Toll-Like Receptor TNF : Tumor Necrosis Factor Treg : Lymphocyte T régulateur
6 UNICEF : Fonds des Nations Unies pour l'Enfance
7
Liste des figures
INTRODUCTION BIBLIOGRAPHIQUE CHAPITRE 1
Figure 1 : Représentation du risque de développer une maladie chronique en fonction des interactions entre l’environnement rencontré au cours du développement et à l’âge adulte. Figure 2 : Représentation schématique du concept des origines développementales de la santé et des maladies de l’adulte (DOHaD).
Figure 3 : Evolution du concept des origines développementales de la santé. Figure 4 : Représentation schématique de l’épigénétique.
Figure 5: Régulation de la transcription génique par les marques épigénétiques.
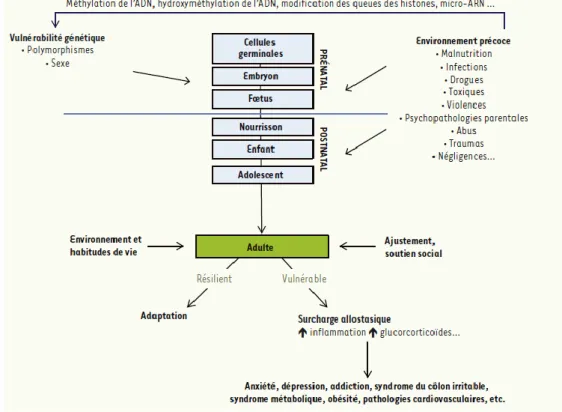
Figure 6 : Régulations épigénétiques précoces, surcharge allostatique et vulnérabilité à l’âge adulte.
Figure 7 : Transmissions multigénérationnelle et transgénérationnelle.
Figure 8 : Mécanismes mis en jeu dans les interactions entre les facteurs environnementaux tels que l’alimentation et les modifications épigénétiques.
Figure 9 : Effets de la nutrition précoce sur le système immunitaire.
Figure 10 : Composition microbienne (bactéries, eucaryotes et virus) des niches physiologiques du tractus gastro-intestinal humain.
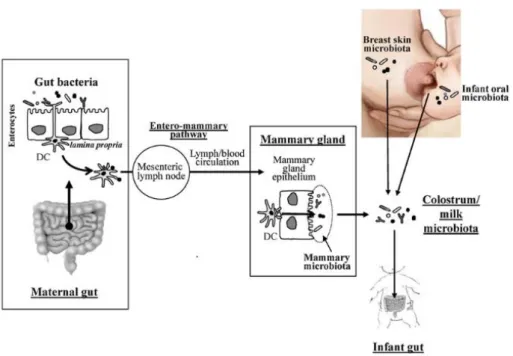
Figure 11 : Sources potentielles des bactéries présentes dans le colostrum et le lait humain. Figure 12 : Modulation du microbiote intestinal de l’Homme au cours de la vie et des perturbations rencontrées.
Figure 13 : Principales fonctions exercées par le microbiote intestinal.
Figure 14 : Synthèse des acides gras à chaîne courte (AGCC) par la fermentation de polysaccharides non digestibles par les bactéries commensales.
Figure 15 : Acides gras à chaîne courte, physiologie de l’hôte et immunité.
Figure 16 : Représentation schématique des principaux récepteurs de l’immunité innée (PRR). Figure 17 : Régulation des cellules T par les AGCC.
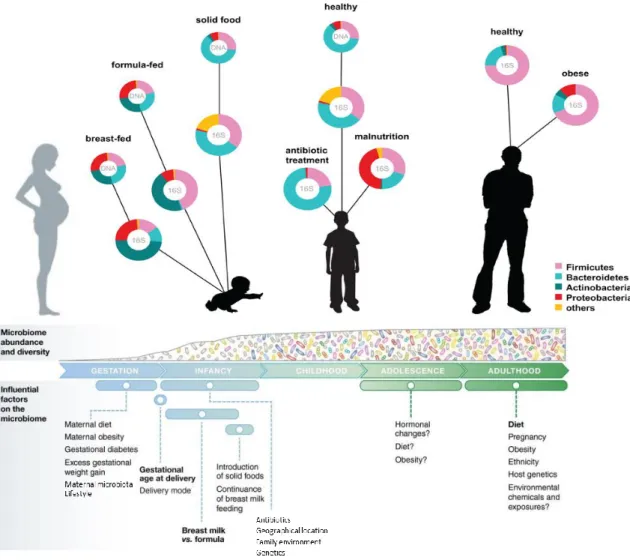
Figure 18 : Facteurs influençant la composition du microbiome du lait humain ; différences de composition du microbiote intestinal entre enfants allaités au sein et recevant des PPN et conséquences possibles sur la santé.
Figure 19 : Distribution des espèces de bactéries lactiques présentes dans le lait, l’alimentation, et les microbiotes de la mère et de l’enfant.
8 Figure 20 : Origine globale (A) et par âge (B) des communautés bactériennes retrouvées dans les fèces de l’enfant en fonction du degré d’allaitement maternel.
Figure 21 : Bilan des mécanismes suivant lesquels des perturbations périnatales peuvent mener au développement de troubles à l’âge adulte.
CHAPITRE 2
Figure 22 : Répartition mondiale de l’allaitement maternel à l’âge de 12 mois. Figure 23 : Impact du revenu du pays sur la prévalence de l’allaitement maternel.
Figure 24 : Fonctions principales des composants protecteurs présents dans le lait maternel. Figure 25 : Principales fonctions des protéines bioactives du lait maternel.
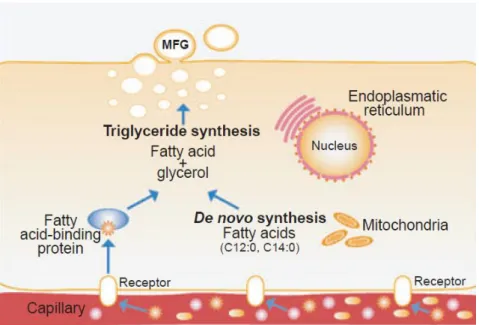
Figure 26 : Synthèse des lipides du lait maternel dans la cellule alvéolaire mammaire. Figure 27 : Structure du globule gras du lait maternel et de certaines de ses fractions.
Figure 28 : Origine de l’acide linoléique et de l’acide arachidonique présents dans le lait maternel.
Figure 29 : Historique des étapes importantes en termes d’évolution de la réglementation et de la recherche scientifique ayant eu un impact sur la production des préparations pour nourrissons.
Figure 30 : Diagramme de fabrication des préparations pour nourrissons.
Figure 31 : Différences de structure entre le globule gras natif du lait maternel et les gouttelettes lipidiques présentes dans les préparations pour nourrissons.
Figure 32 : Principales caractéristiques des fonctions digestives chez le nouveau-né humain. Figure 33 : Devenir des triglycérides des préparations pour nourrissons à base d’huiles végétales lors de la digestion par rapport au lait maternel.
Figure 34 : Domaines de recherche et d’innovation basés sur une analyse récente des études cliniques, du web of science et des brevets sur les préparations pour nourrissons.
Figure 35 : Modèles de triglycérides structurés pouvant être incorporés dans les préparations pour nourrissons.
Figure 36 : Différences de structure entre le globule gras natif du lait maternel et du lait de vache.
Figure 37 : Résumé des principaux effets bénéfiques exercés par les probiotiques chez l’enfant.
CHAPITRE 3
9 Figure 39 : (A) Représentation schématique histologique de la paroi digestive et (B) illustration de la multiplication par 600 de la capacité totale d’absorption de l’intestin grêle. Figure 40 : Organisation de la paroi intestinale.
Figure 41 : (A) renouvellement de l’épithélium de l’intestin grêle et (B) types cellulaires identifiés.
Figure 42 : Evolution de la barrière intestinale entre l’intestin grêle et le côlon. Figure 43 : Perméabilité (A) para- et (B) trans-cellulaire.
Figure 44 : Jonctions régulant la perméabilité intestinale avec un focus sur les jonctions cellule-cellule.
Figure 45 : Le GALT, tissu lymphoïde associé au tube digestif. Figure 46 : Différenciation des cellules T naïves.
Figure 47 : Sécrétion de peptides régulateurs par les types cellulaires présents le long du tractus gastro-intestinal.
Figure 48 : Développement (a) pré- et (b) post-natal du tissu lymphoïde associé au tube digestif.
Figure 49 : Développement du système immunitaire et du microbiote intestinal tout au long de la vie de l’individu.
CHAPITRE 4
Figure 50 : Anatomie du pancréas.
Figure 51 : Structure des îlots de Langerhans et interactions paracrines.
Figure 52 : Principaux facteurs humoraux et nerveux de contrôle de la sécrétion d’insuline. Figure 53 : Mécanisme de stimulation de la sécrétion d'insuline au niveau de la cellule bêta pancréatique par la voie dépendant des canaux K+ sensibles à l’ATP.
Figure 54 : Transduction du signal induit par le GLP-1 sur la cellule bêta pancréatique et menant à la sécrétion d’insuline.
Figure 55 : Effets du GLP-1 sur ses différents organes cibles. Figure 56 : Principaux effets de l’insuline sur ses organes cibles.
Figure 57 : Prolifération des cellules bêta chez l’homme au cours de la période fœtale et des six premières années de vie.
Figure 58 : Localisation des cellules sécrétant de l’insuline (en rouge) et du glucagon (en vert) chez le fœtus humain (22 semaines d’aménorrhée) et l’adulte (donneuse âgée de 16 ans). Figure 59 : Facteurs de transcription régulant la différenciation des lignées cellulaires du pancréas endocrine.
10 Figure 60 : Evolution de la taille et de l’aspect des îlots de Langerhans (en marron) de l’âge de 2 semaines à l’âge de 19 ans chez l’Homme.
Figure 61 : Représentation schématique de l’évolution de la croissance cellulaire bêta (néogenèse, apoptose et réplication) de la naissance à l’âge adulte.
STRATEGIE EXPERIMENTALE
Figure 62 : Anatomie du système digestif du porc, de l’estomac au rectum.
Figure 63 : Temporalité de la maturation de l’intestin chez l’Homme, le porc et le rat.
Figure 64 : Comparaison de coupes pancréatiques d’îlots de Langerhans provenant de l’Homme, du singe, de la souris et du porc.
Figure 65 : Mise en place du microbiote intestinal chez le porc : évolution temporelle de la composition, de la diversité et de la richesse bactériennes et facteurs influents.
Figure 66 : Evolution de la composition du microbiote du porc entre l’âge de un et six mois. Figure 67 : Stratégie expérimentale globale.
DISCUSSION GENERALE
Figure 68 : Risque de développer une maladie chronique au cours de la vie et efficacité d’une intervention en fonction de sa période de mise en œuvre.
Figure 69 : Données relatives aux défenses intestinales (J28). Figure 70 : Concentration plasmatique en cholestérol (J28).
Figure 71 : Représentation du métabolome plasmatique des individus sur le premier axe de l’analyse PLS-DA discriminant les trois groupes expérimentaux des animaux du groupe allaité (J28).
Figure 72 : Liens proposés entre le microbiote intestinal et l’axe entéro-insulaire, sur la base de corrélations.
Figure 73 : Représentation du métabolome plasmatique des individus sur les deux premiers axes de l’analyse ACP discriminant les trois groupes expérimentaux des animaux du groupe ‘contrôle’ (J140).
Figure 74 : Mécanismes potentiels mis en œuvre menant aux réponses différentielles observées à long terme.
Figure 75 : Evaluation des effets induits par le régime hyper-énergétique.
Figure 76 : Représentation du métabolome (A) fécal, (B) plasmatique et (C) urinaire des individus sur les deux premiers axes discriminants les mâles des femelles (J140).
11
Liste des tableaux
INTRODUCTION BIBLIOGRAPHIQUE CHAPITRE 1
Tableau 1 : Résumé des études de cohortes sur la nutrition précoce et la santé à long terme. Tableau 2 : Altérations du système immunitaire intestinal chez les souris axéniques.
CHAPITRE 2
Tableau 3 : Effets potentiellement bénéfiques de l’allaitement maternel pour le nourrisson et la mère.
Tableau 4 : Type d’alimentation lactée (allaitement maternel vs. préparations pour nourrissons du commerce) à la naissance et à 3, 6 et 12 mois, Épifane 2012-2013, France.
Tableau 5 : Composition du lait maternel reçu par des enfants nés à terme en fonction du stade de lactation.
Tableau 6 : Règlementation européenne sur les teneurs en énergie et macronutriments des préparations pour nourrissons.
Tableau 7 : Différences de composition entre le lait humain, le lait de vache et les préparations pour nourrissons.
Tableau 8 : Recommandations actuelles de composition de la fraction lipidique des préparations pour nourrissons.
Tableau 9 : Composition en acides gras de différentes sources lipidiques utilisées dans les préparations pour nourrissons (exprimée en % des acides gras totaux).
Tableau 10 : Positionnement des principaux acides gras du lait maternel, du lait de vache et de différentes huiles végétales sur le squelette de glycérol.
STRATEGIE EXPERIMENTALE
Tableau 11 : Comparaison anatomique du système digestif de l’Homme et de différents modèles animaux (souris, rat et porc).
Tableau 12 : Comparaison des périodes critiques de développement du pancréas entre l’Homme, la souris, le rat, le mouton et le porc.
Tableau 13 : Comparaison des phyla et genres dominants retrouvés chez l’Homme et le porc de l’estomac aux fèces.
Tableau 14 : Table d’équivalence d’âge entre l’Homme, le porc conventionnel et le miniporc. Tableau 15 : Composition moyenne du lait maternel, du lait de vache et du lait mature de truie.
12 Tableau 16 : Comparaison du régime HE avec un régime standard.
DISCUSSION GENERALE
13
AVANT-PROPOS
14 Le paradigme des Origines Développementales de la Santé et des Maladies (DOHaD) postule que des perturbations environnementales au cours du développement précoce, de la période préconceptionnelle jusqu’aux deux premières années de vie de l’enfant (voire au-delà), peuvent conditionner la santé de l’individu devenu adulte et le prédisposer à développer des maladies chroniques. La première année de vie est une période particulièrement importante pour la croissance et le développement de l’enfant, pendant laquelle son microbiote intestinal se met en place et de nombreux organes tels que l’intestin et le pancréas poursuivent leur maturation.
L’importance du rôle joué par l’environnement nutritionnel précoce, notamment durant la période d’allaitement, sur la programmation des fonctions physiologiques et métaboliques de l’enfant est aujourd’hui largement reconnue. C’est pour cela que toutes les organisations, nationales et internationales, telles que l’Organisation Mondiale de la Santé (OMS), recommandent un allaitement maternel exclusif durant les six premiers mois de vie de l’enfant. Les taux d’allaitement maternel restent cependant bien en-deçà des recommandations. Pour les enfants nés à terme et en bonne santé, les seules alternatives à l’allaitement maternel sont les préparations pour nourrissons (PPN). Les PPN sont soumises à des normes strictes établies par les législations française et européenne pour que leur composition soit la plus proche possible de celle du lait maternel. Cependant, malgré ces précautions et les diverses améliorations apportées aux PPN au cours des dernières décennies, celles-ci ne parviennent toujours pas à mimer tous les effets physiologiques du lait maternel. La croissance, la composition corporelle, la physiologie de l’intestin ou encore le métabolisme des enfants nourris avec des PPN diffèrent de ceux d’enfants allaités par leur mère, les rendant plus susceptibles à développer des troubles métaboliques tels qu’une insulino-résistance ou un diabète de type 2 (DT2) à l’âge adulte.
Dans ce contexte, les approches visant à se rapprocher de la fonctionnalité du lait maternel constituent une stratégie majeure pour optimiser la santé des nouveau-nés et tenter ainsi d’enrayer l’épidémie actuelle de maladies chroniques. Les différences observées entre les enfants allaités au sein et les enfants nourris avec des PPN pourraient en partie être expliquées par la structure et la composition très particulière de la matrice lipidique du lait maternel et par son microbiote. La matière grasse laitière (MGL) des PPN a progressivement été remplacée par un mélange d’huiles végétales (palme, coprah, tournesol etc.) riches en acides gras essentiels mais dont le profil lipidique est éloigné du lait maternel. Sa réintroduction pourrait permettre d’obtenir un profil lipidique plus proche de celui du lait maternel, aussi
AVANT-PROPOS
15 bien en termes de composition que de structure. Le microbiote du lait maternel, dont le rôle essentiel sur la colonisation du tube digestif du nouveau-né et dans le développement de ses interactions avec l’hôte a été démontré, n’est à ce jour pas reproductible dans les PPN. La supplémentation en une ou plusieurs souches probiotiques pourrait être une solution pour se rapprocher de la fonctionnalité du microbiote du lait maternel.
Ainsi, l’objectif de ce travail de thèse, financé par le groupe Lactalis dans le cadre d’une convention CIFRE, a-t-il été d’étudier les bénéfices santé à court et long termes de la réintroduction de MGL dans des PPN et de leur supplémentation en une souche probiotique (Lactobacillus fermentum CECT 5716, Lf, isolée du lait de femmes en bonne santé), en utilisant le miniporc Yucatan comme modèle de l’Homme.
La première partie de ce manuscrit abordera l’état de l’art, à travers quatre chapitres que sont 1- le concept de DOHaD, 2- la nutrition précoce (allaitement maternel et PPN) et ses effets à court et long termes sur 3- l’intestin et 4- le métabolisme. Ce dernier chapitre inclut un article de synthèse qui a été publié dans Journal of DOHaD (2018). L’hypothèse et les objectifs du projet, ainsi que la stratégie expérimentale seront ensuite présentés avant d’introduire les résultats sous la forme de trois chapitres correspondant à trois articles scientifiques, dont l’un vient d’être accepté pour publication dans Scientific Reports, sous réserve de modifications mineures, et deux en préparation. Les résultats feront ensuite l’objet d’une discussion générale aboutissant aux principales conclusions et perspectives de ce travail de thèse.
16
INTRODUCTION
BIBLIOGRAPHIQUE
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
17
CHAPITRE 1 - Concept des Origines Développementales de la Santé et des
Maladies (DOHaD)
1.1. Des origines fœtales des maladies aux origines développementales de la santé et des maladies de l’adulte
1.1.1. Premières évidences épidémiologiques et définition du phénotype d’épargne L’idée suivant laquelle l’environnement précoce pourrait avoir des effets à long terme sur la santé est apparue dès l’antiquité, dans des écrits d’Hippocrate puis a été retrouvée plus récemment dans ceux de Freud (Hanson et al., 2014). En 1934, Kermack et al. ont établi un lien entre l’environnement rencontré durant les 15 premières années de vie et la santé future, soulignant notamment un lien entre des conditions de vie précaires dans l’enfance et une mortalité prématurée. Au début des années 1970, l’épidémiologiste Forsdahl a postulé que des facteurs tels que des conditions de vie précaires au cours de l’enfance et de l’adolescence suivies par une surabondance alimentaire à l’âge adulte, contribueraient au développement de maladies cardiovasculaires (Forsdahl, 1977). Le terme « programmierung », pour programmation, a été introduit pour la première fois en 1975 par le professeur Dörner, qui conclut que les concentrations hormonales, en métabolites et en neurotransmetteurs au cours des périodes précoces du développement pourraient pré-programmer le développement cérébral et l’apparition de troubles métaboliques entre autres (Dörner, 1975). Une interaction entre la génétique et l’environnement au cours du développement précoce dans la détermination des fonctions chez l’adulte a alors été évoquée. Le terme de programmation sera par la suite repris par Barker (1990), Lucas (1991), et par bien d’autres groupes (McMillen et al., 2005).
Les premières observations épidémiologiques se sont focalisées sur le système cardiovasculaire. Higgins et al. démontrèrent par exemple en 1980 une association entre des complications durant la grossesse et la tension artérielle de la descendance devenue adolescente, soulignant un lien de l’environnement in utero plutôt que de la génétique et la nécessité d’inclure de ce fait les mères et leurs enfants dans les études prospectives (Higgins
et al., 1980). Par la suite Wadsworth et al. démontrèrent, en 1985, une association inverse entre le poids de naissance et la pression artérielle systolique à l’âge de 36 ans (Wadsworth et
al., 1985). Les études basées sur des cohortes anglaises et publiées par Barker et al. à partir
des années 1986 (Barker et al., 1986 ; Barker et al., 1989a ; Barker et al., 1989b ; Osmond et
Figure 1 : Représentation du risque de développer une maladie chronique en fonction des interactions entre l’environnement rencontré au cours du développement et à l’âge adulte (Godfrey et al., 2010)
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
18 le poids à l’âge de un an, et une plus grande prévalence d’hypertension, de maladies cardiovasculaires et du syndrome métabolique à l’âge adulte. Ces travaux ont mené à l’hypothèse d’une origine fœtale des maladies de l’adulte (FOAD en anglais) et à celle du phénotype d’épargne (thrifty phenotype en anglais) (Hales et al., 1992). Le phénotype d’épargne désigne une plasticité phénotypique et des adaptations métaboliques, physiologiques et endocriniennes se mettant en place chez le fœtus en réponse à une malnutrition maternelle ou fœtale. Il permet d’assurer la survie du fœtus in utero en privilégiant les organes vitaux tels que le cerveau, aux dépens d’autres organes tels que le pancréas. Il permet à l’individu de s’adapter à l’environnement lui faisant face et confère ainsi un avantage sélectif si l’environnement rencontré par la suite demeure similaire (Simeoni et
al., 2016). Cependant, il rend le fœtus inapte à faire face à un environnement postnatal
différent de celui expérimenté in utero, par exemple lors du passage d’une dénutrition fœtale suivie d’une surnutrition en période postnatale, expliquant la plus grande susceptibilité à développer des maladies chroniques à l’âge adulte (Godfrey et al., 2010) (Figure 1).
1.1.2. Evolution vers le concept de DOHaD
Si l’hypothèse d’une origine fœtale des maladies a initialement été très critiquée (Joseph et
al., 1996), le recours à de très grandes cohortes permit de confirmer l’association entre un
faible poids de naissance et de nombreuses pathologies à l’âge adulte : troubles de la pression artérielle et maladies cardiovasculaires (Rich-Edwards et al., 1997 ; Leon et al., 1998 ; Bergvall et al., 2005 ; Kajantie et al., 2005 ; Lawlor et al., 2005; Gamborg et al., 2007) ou encore insulinorésistance et DT2 (Newsome et al., 2003 ; Berends et al., 2012 ; Eriksson et
al., 2015). Des études portant sur des cohortes ayant fait face à des modifications extrêmes de
l’environnement comme en période de guerre vinrent également appuyer l’hypothèse. La cohorte ayant subi la famine hollandaise (hiver 1944-1945), a permis de mettre en évidence différentes périodes critiques d’exposition à une restriction calorique maternelle (400-800 calories par jour) sur la santé à long terme (Roseboom et al., 2006). Ainsi, les fœtus exposés à la sous-nutrition en début de grossesse n’étaient pas plus petits à la naissance que ceux dont les mères n’avaient pas subi de famine mais ils étaient plus susceptibles de développer une obésité et des pathologies cardiovasculaires à l’âge adulte alors que ceux exposés entre le milieu et la fin de la grossesse avaient un plus faible poids de naissance et une tolérance au glucose réduite à l’âge de 50 ans, par comparaison avec des individus nés l’année ayant précédé ou suivi la famine (Ravelli et al., 1998). La sous-nutrition in utero, en particulier au début de la vie fœtale, a également été associée à des effets délétères sur la fonction cognitive
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
19 à l’âge adulte et à des troubles psychiatriques (de Rooij et al., 2010), ainsi qu’à une préférence accrue pour les aliments gras et une tendance à une moindre activité physique (Lussana et al., 2008). D’autres études réalisées sur cette cohorte ont cependant soulevé des contradictions sur les liens entre la restriction calorique in utero et le syndrome métabolique (de Rooij et al., 2007) ou l’hypertension (Roseboom et al., 1999 ; Stein et al., 2006).
L’existence de différentes périodes critiques d’exposition à la famine, avec des effets propres sur la descendance, a été confirmée sur d’autres cohortes. Une étude réalisée sur une cohorte durant la grande famine en Chine de 1958 à 1961 a montré une augmentation du risque d’hypertension de l’ordre de 1,3 à 1,8 suivant la période et la durée de l’exposition (Wang et al., 2012). En revanche, dans le cadre de cette étude, une exposition sur toute la vie
in utero n’a pas eu d’effet sur le risque d’hypertension. Dans une autre étude réalisée sur des
adultes nés avant, pendant ou après la guerre civile au Nigéria (1967-1970), un risque plus élevé de développer une hypertension et une altération de la tolérance au glucose à l’âge de 40 ans a été observé en réponse à une sous-nutrition durant la vie fœtale et postnatale (Hult et al., 2010). A l’inverse, l’exposition à une malnutrition durant le siège de Leningrad, durant la seconde guerre mondiale, n’a pas été associée à une intolérance au glucose, une dyslipidémie, une hypertension ou encore à des maladies cardiovasculaires à l’âge adulte (Stanner et al., 1997). Cette absence de troubles métaboliques pourrait être expliquée par le fait que la malnutrition a perduré de longues années après la guerre et que les individus étaient donc adaptés à cet environnement nutritionnel suboptimal, corroborant l’hypothèse de la réponse adaptative. En outre, le problème soulevé par ces études est la coexistence de nombreux facteurs autres que la malnutrition, tels qu’un changement radical d’alimentation (l’ingestion de bulbes de tulipes aux Pays-Bas par exemple) ou encore le stress. La relation entre un faible poids de naissance et des marqueurs de risque cardiovasculaire ou encore une insulinorésistance a cependant été retrouvée chez des cohortes nées dans des conditions plus favorables (Zureik et al., 1996 ; Leger et al., 1997). La susceptibilité à développer des maladies chroniques à l’âge adulte a également été associée à un environnement in utero hyperglycémique et à un poids de naissance élevé, soulignant l’existence d’une relation en « U » pour la propension à développer un diabète de type 2 à l’âge adulte en fonction du poids de naissance (McCance et al., 1994).
Le concept des origines fœtales des maladies (FOAD) a ainsi évolué vers celui des origines développementales de la santé et des maladies (DOHaD), soulignant une fenêtre de sensibilité plus longue, couvrant tout le développement et prenant en compte la diversité des facteurs de
Figure 2 : Représentation schématique du concept des origines développementales de la santé et des maladies de l’adulte (DOHaD)
Figure 3 : Evolution du concept des origines développementales de la santé (Charles et
al., 2016)
Environnement
Troubles métaboliques et inflammatoires
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
20 causalité et organes affectés, ainsi que la diversité des conséquences chez l’adulte (Gillman et
al., 2007). On parle même désormais de paradigme de DOHaD. Celui-ci postule que des
perturbations environnementales au cours du développement précoce peuvent prédisposer un individu au développement de maladies chroniques à l’âge adulte (Figure 2). Les facteurs de causalité sont multiples : nutritionnel, physique et chimique (contaminants, polluants, climat, ondes électromagnétiques etc.), biologique [virus, parasites, microbiote (cf paragraphe 1.3.2) etc.] ou encore psychosocial (stress, adversité, niveau socio-économique etc.) (Figure 3). Les organes cibles ne se limitent plus au système cardiovasculaire mais incluent les systèmes métabolique, endocrine, gastro-intestinal, rénal, cérébral et reproducteur. La période de sensibilité s’étend quant à elle de la conception, voire même en amont (périodes préconceptionnelle et périconceptionnelle), aux deux premières années de vie. Les différents effets ayant pu être observés en réponse à un même stimulus appliqué à des périodes de développement différentes s’expliquent par le fait que les organes se développent durant des fenêtres de croissance différentes.
Le concept de DOHaD sous-tend l’idée d’un facteur statistique de risque, une susceptibilité rendant l’individu plus sensible face à un environnement inadapté mais ne signifie pas un risque systématique de maladie. Dans la plupart des cas, un révélateur (stress psychologique, environnement nutritionnel inadapté, etc.) sollicitant la capacité d’adaptation de l’individu est nécessaire. Ainsi, l’empreinte laissée par une perturbation rencontrée durant le développement, demeure-t-elle silencieuse tant que l’individu évolue dans des conditions environnementales dites « optimales ». Le contexte nutritionnel actuel (pléthorique), à l’opposé de celui rencontré par les cohortes à l’origine du concept de DOHaD, à savoir des conditions de privations nutritionnelles (Delpierre et al., 2016), peut être un révélateur de l’empreinte.
1.1.3. Les 1000 premiers jours de vie
L’initiative des 1000 premiers jours de vie lancée par l’Organisation Mondiale de la Santé (OMS) vise à concentrer les efforts sur cette période cruciale pour l’avenir de l’enfant et tenter ainsi d’enrayer l’épidémie de maladies chroniques, représentant près de 70% des décès dans le monde en 2015 (WHO, 2015 ; https://thousanddays.org/). Les 1000 premiers jours de vie représentent une fenêtre unique d’opportunité, caractérisée par une grande vulnérabilité de l’individu. Ils peuvent être subdivisés en trois périodes clés : la période pré ou périconceptionnelle durant laquelle la maturation des ovocytes et la préparation de l’environnement utérin peuvent être impactées, la grossesse, elle-même subdivisée en trois
Tableau 1 : Résumé des études de cohortes sur la nutrition précoce et la santé à long terme (Hoffman et al., 2017)
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
21 trimestres et durant laquelle l’environnement utérin et le transfert de nutriments via le placenta peuvent être impactés et enfin, la période postnatale, avec les deux premières années de vie, incluant la phase d’allaitement puis celle de diversification alimentaire (Paparo et al., 2014).
1.2. DOHaD et nutrition
Le rôle de l’alimentation et en particulier de la nutrition maternelle en tant que facteur contributif de DOHaD a été mis en évidence par de nombreuses études épidémiologiques (depuis 1986 jusqu’à nos jours, Tableau 1) et animales. La plupart des études concernent les conséquences à long terme de carences nutritionnelles, telles que les famines évoquées précédemment, au cours de différentes fenêtres du développement, sur le phénotype de la descendance. Des effets ont également été observés lorsque la mère présente un surpoids, une obésité ou encore un diabète. Mais des variations de l’environnement nutritionnel précoce plus subtiles, dans les limites de la normalité, peuvent également induire des conséquences à long terme. Les études actuelles se concentrent désormais plus sur le suivi à long terme de cohortes de grossesses normales et non plus extrêmes en termes de poids de naissance (Hanson et al., 2014).
1.2.1. Preuves par les modèles animaux
Bien que les études de cohortes humaines soient d’une grande valeur, elles peuvent être biaisées par l’influence de variables non contrôlables telles que la génétique et l’environnement socioculturel. De plus, les données obtenues à partir de cohortes rétrospectives et prospectives ne permettent pas d’identifier les mécanismes biologiques impliqués et sont limitées en termes de tissus biologiques analysés. Les modèles animaux permettent, grâce au contrôle des conditions, de la fenêtre d’exposition et aux prélèvements accessibles à différents stades, de reproduire les observations faites chez l’Homme et d’étudier les mécanismes à l’origine de la programmation précoce des maladies chroniques. Les modèles animaux concernent principalement l’étude d’une malnutrition maternelle : une sous-nutrition (par restriction calorique globale ou protéique, une déficience en micronutriments ou une réduction de l’apport de nutriments au fœtus par ligature des artères utérines) ou une surnutrition (par l’induction d’une obésité et/ou d’un DT2 par un régime délétère hyper-énergétique, riche en lipides/glucides/protéines ou par la réduction de la taille de portée) durant certaines périodes de la gestation et/ou la lactation. Les principaux modèles animaux utilisés pour investiguer les effets à long terme du régime maternel sur la descendance sont le rongeur, le mouton, le porc et le primate non humain.
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
22 Chaque modèle animal présente des avantages et des limites qui lui sont propres. Pour les rongeurs par exemple, si la caractérisation de leur génome, la courte durée de gestation et leur petite taille sont des avantages, ils restent assez éloignés de l’Homme en termes de croissance
in utero et post-natale, et l’utilisation quasi systématique de régimes purifiés ou semi-purifiés
pour les nourrir est controversée (Hanley et al., 2010). Les primates non-humains, le porc et le mouton sont quant à eux proches de l’Homme en termes de physiologie et de croissance in
utero et post-natale mais leur utilisation est restreinte du fait de leur entretien plus complexe
et plus coûteux (Hanley et al., 2010 ; Alfaradhi et al., 2011).
Les premières études expérimentales menées dans les années 1970 chez le rat ont mis en évidence des conséquences à court et long terme du diabète gestationnel (Aerts et al., 1979) ou d’une sous-nutrition fœtale objectivée par un retard de croissance (De Prins et al., 1982), sur le développement du pancréas endocrine et le métabolisme glucidique de la descendance. L’importance de ces travaux ne fut cependant reconnue que tardivement, plus d’une dizaine d’années après leur publication (Hanson et al., 2014). Depuis, de nombreuses données ont permis de mettre en évidence les effets d’une malnutrition maternelle (sous ou sur-optimale) ou de l’alimentation post-natale, indépendamment de l’état nutritionnel de la mère, sur la programmation de différents organes. Ces études ont notamment permis de préciser l’importance des différentes fenêtres d’exposition et de désigner le pancréas et l’intestin comme deux organes cibles de la programmation nutritionnelle.
1.2.1.1. Modèles animaux de sous-nutrition maternelle
Chez le rat, une restriction calorique de l’ordre de 20% durant la première moitié de la gestation uniquement a été associée à une dérégulation persistante à l’âge adulte du métabolisme glucidique de la descendance (Palou et al., 2012). Une sous-nutrition maternelle, induite par restriction calorique ou protéique, durant la gestation a également été associée à une altération de l’anatomie et de la fonction du pancréas endocrine de la descendance à court (Alvarez et al., 1997 ; Garofano et al., 1997 ; Dumortier et al., 2007) et à long terme (Bertin
et al., 1999), ainsi qu’à des défauts de sensibilité à l’insuline (Delamaire et al., 2012). Des
effets différents ont cependant été observés suivant le type de restriction maternelle (calorique ou protéique) appliqué en fin de gestation (Bertin et al., 1999 ; Dumortier et al., 2007), avec un effet mesuré sur l’anatomie du pancréas uniquement suite à une restriction protéique (Bertin et al., 1999), suggérant des mécanismes différents. La fonction barrière intestinale de la descendance était également impactée à long terme par une restriction protéique maternelle appliquée pendant toute la gestation (altération du développement de la couche de mucus et
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
23 de l’expression de mucines) (Fanca-Berthon et al., 2009). Une restriction calorique plus marquée (de plus de 70%) durant toute la gestation a été associée à une réduction du poids de naissance de la descendance et à une hyperphagie et des désordres métaboliques à l’âge adulte (hyperleptinémie, hyperinsulinémie, augmentation de la pression artérielle systolique et adiposité rétropéritonéale élevée) par comparaison à la descendance de mères nourries ad
libitum, et ce, indépendamment de la quantité d’aliment distribuée en post-sevrage (Vickers et al., 2000).
Une sous-nutrition maternelle durant la gestation et se poursuivant durant la lactation a été associée à une altération persistante de la fonction du pancréas endocrine à l’âge adulte (Garofano et al., 1998 ; Garofano et al., 1999) et de l’homéostasie glucidique en lien notamment avec le développement d’une insulinorésistance (Garofano et al., 1999 ; Petry et
al., 2001; Ozanne et al., 2003 ; Fernandez-Twinn et al., 2005). De façon intéressante, ces
altérations étaient plus marquées que lorsque la restriction ne concernait que la période de gestation (Garofano et al., 1999). De plus, une augmentation du pourcentage de tissu endocrine, du nombre d’îlots et du nombre de cellules bêta pancréatiques a été observée chez des ratons restreint en protéines durant la gestation et recevant durant la lactation une PPN riche en protéines (Delamaire et al., 2012). Cette étude souligne l’importance de l’alimentation postnatale, à-même de « réparer » un phénotype.
Ces études démontrent une programmation nutritionnelle de certains organes tels que le pancréas ou l’intestin, programmation d’autant plus importante lorsque la restriction maternelle est appliquée pendant la gestation et maintenue durant la période de lactation.
1.2.1.2. Modèles animaux de surnutrition maternelle
De nombreuses études ont également démontré les effets délétères d’une surnutrition maternelle, associée ou non à une obésité, sur la santé métabolique de la descendance entraînant notamment le développement d’une insulinorésistance (Chen et al., 2009 ; Alfaradhi et al., 2011). De façon générale, les modèles animaux de surnutrition maternelle durant les 1000 premiers jours de vie semblent converger, chez la descendance, vers un phénotype hyperphagique, insulinorésistant, hypertendu et présentant une adiposité plus importante (Alfaradhi et al., 2011).
A l’instar des études de sous-nutrition maternelle, les études de surnutrition maternelle soulignent l’importance de la durée et de la période d’exposition sur les conséquences éventuelles à long terme chez la descendance. Chez la souris, seule la progéniture exposée au régime hyperlipidique in utero présentait une intolérance au glucose et une résistance à
INTRODUCTION BIBLIOGRAPHIQUE – CHAPITRE 1
24 l’insuline ainsi qu’une augmentation de la cholestérolémie, cette dernière concernant également le groupe exposé durant la gestation et la lactation (Gregorio et al., 2010). La période de lactation semblait quant à elle une fenêtre critique pour la programmation de la triglycéridémie (Gregorio et al., 2010). Chez le rat, un régime hyper-protéique (40% vs 20% pour le régime contrôle isocalorique) administré durant toute la gestation et la lactation entraînait chez la descendance adulte une augmentation du poids (femelles) ou une augmentation de la tension artérielle (mâles), sans effet sur la tolérance au glucose (Thone-Reineke et al., 2006). Dans une autre étude, une exposition à un régime hyper-protéique (55%) durant la gestation et, dans une moindre mesure durant la lactation, a engendré chez la descendance à long terme un risque plus élevé de développer une intolérance au glucose, un poids et une adiposité élevés (Desclee de Maredsous et al., 2016).
Des études relativement récentes suggèrent aussi un impact de la nutrition paternelle. Ainsi, chez le rat, une exposition paternelle à un régime hyperlipidique a-t-elle entraîné un dysfonctionnement des cellules bêta chez la descendance femelle ainsi qu’une altération de la tolérance au glucose et de la sensibilité à l’insuline (Ng et al., 2010).
Toutes ces études mettent en évidence des effets différents sur la descendance en fonction de la période d’exposition.
1.2.2. Focus sur la période postnatale précoce
Une surnutrition pendant la période de lactation par réduction de la taille de la portée de rates a été associée à un surpoids, une hyperphagie et de nombreux troubles métaboliques chez la descendance tels qu’une hyperinsulinémie, une altération de la tolérance au glucose, une triglycéridémie élevée et une augmentation de la pression artérielle systolique (Plagemann et al., 1999). De même, les ratons de mères ayant consommé un régime de type cafétéria pendant la gestation, la lactation et en post-sevrage ont développé une hyperphagie par rapport à des ratons issus de mères ayant consommé un régime cafétéria pendant la gestation, un régime standard pendant la lactation et placés sous régime cafétéria en post-sevrage (Bayol et al., 2007). Ces effets pourraient avoir été induits par une modification de la production et de la composition du lait ou encore du comportement des mères allaitantes par le régime (cafétéria vs standard). L’analyse de la composition du lait de rates rendues obèses a en effet révélé une concentration en insuline plus importante (+128%) et des concentrations en acides gras polyinsaturés (AGPI) et monoinsaturés (AGMI) moins importantes par rapport à celles du lait de rates minces (Gorski et al., 2006). L’adoption de la descendance de rates résistantes à l’obésité par des rates génétiquement obèses durant la lactation a mené à une