______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Introduction
Après un demi-siècle d'utilisation des antibiotiques, l'émergence et la dissémination de la résistance bactérienne posent un problème de santé publique très important. L'augmentation de la résistance aux antibiotiques se traduit dans la pratique hospitalière par une augmentation de la morbidité et de la mortalité, des coûts d'hospitalisation et par l'apparition de microorganismes résistants à l'ensemble des antibiotiques disponibles.
Les entérobactéries résistantes aux β-lactamines occupent une place importante dans les infections nosocomiales, notamment en milieu de réanimation. Ces bactéries deviennent de plus en plus résistantes aux antibiotiques et à franchir les limites de l’hôpital pour émerger dans la communauté.
La dissémination de ces bactéries présente une menace grave qui met en cause la validité de l’arsenal antibiotique actuellement disponible, d’autant plus qu’aucune classe nouvelle d’antibiotique n’est attendue dans les prochaines années.
Les causes de l'émergence et de la dissémination de cette résistance sont multiples, mais l'utilisation excessive et/ou inappropriée des ces antibiotiques est, sans conteste, la principale raison de cette évolution.
Face à cette problématique, nous allons envisager dans ce travail d’étudie : L’évolution de cette résistance aux β-lactamines au CHU IBN SINA de Rabat au cours de la période qui s’étend de 2005 à 2007.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Première partie :
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
I.
Définition :
L’antibiorésistance c’est la capacité d’une souche bactérienne de se développer en présence d’une concentration d’antibiotique notamment plus élevée qui inhibe le développement de la plupart des autres souches de même espèce.
La définition de la résistance bactérienne peut être clinique ou microbiologique.
On appelle résistance microbiologique la possibilité pour une bactérie de se multiplier in vitro en présence de concentration d’antibiotique supérieure à celle qui permet normalement d’inhiber la croissance des bactéries de même espèce.
On appelle résistance clinique l’évolution clinique défavorable d’une infection sous traitement antibiotique, cet échec de l’antibiothérapie peut avoir des coûts multiples [1].
Cette antibiorésistance s’explique par l’existence, chez les bactéries, de gènes leurs permettant d’échapper à l’action des antibiotiques. Elles sont capables de transférer ces gènes à d’autres bactéries qui deviennent résistantes à leur tour. Il s’agit donc d’une forme transmissible de la résistance [2]
.
Elle est liée au mauvais usage des antibiotiques, prescris en cas d'infections virales, ventes d'antibiotiques sans prescription, pratiques d'automédication [3].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
II. Les différents types de résistance :
• Naturelle [4]
: existence d’un ou de plusieurs mécanismes de résistance innés, donc propres à l’espèce bactérienne. Elle intervient dans la définition du spectre clinique d’un antibiotique (Fig. 1).
Figure 1. Phénotype de résistance naturelle aux pénicillines à large spectre
d’une souche de Klebsiella pneumoniae.
• Acquise [5] : acquisition d’un mécanisme de résistance pour une souche
d’une espèce habituellement sensible (Fig. 2).
Figure 2.
A. Phénotype de résistance acquise aux pénicillines à large spectre chez Escherichia coli. B. Phénotype sauvage.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines • Clinique [5, 6]
: expression habituelle de la résistance in vivo par l’échec thérapeutique. La corrélation entre la réponse in vitro obtenue avec l’antibiogramme et celle in vivo n’est pas possible sans l’expérience clinique. Un exemple significatif est celui de la lecture de l’antibiogramme non interprétée, bien qu’il y ait « sensibilité in vitro » à la pipéracilline (CMI de 2 mg/l) pour une souche sauvage de Klebsiella pneumoniae (Fig. 1). Il y a souvent résistance clinique lors du traitement d’une pneumopathie par cette pénicilline à large spectre. Cet exemple est, par ailleurs, symbolique de la lecture interprétative, compte tenu de la présence d’un mécanisme de résistance naturel en relation avec un effet inoculum.
• Croisée [5]
: fait référence au spectre d’inactivation lié à un même mécanisme de résistance vis-à-vis de divers antibiotiques appartenant à la même famille ou sous-groupe. Cette notion est utilisée lors de la lecture interprétative de l’antibiogramme. Les souches de Klebsiella pneumoniae sont naturellement de phénotype « pénicillinase de bas niveau » avec une résistance à l’amoxicilline et à la ticarcilline aisément détectée in vitro. La résistance est croisée avec les autres aminopénicillines telles l’ampicilline, l’épicilline, la métampicilline, etc., ou les carboxypénicillines telle la carbénicilline. Il y a résistance croisée entre toutes les β-lactamines, quelle que soit la valeur de CMI obtenue in vitro.
• Chromosomique [4] : résistance liée au chromosome. Il s’agit ainsi
d’expliquer le déterminisme génétique d’une résistance naturelle ou acquise dont le ou les gènes est ou sont lié (s) au chromosome. Aussi compte tenu de la localisation naturelle de ce ou ces gènes de résistance au chromosome, cette résistance est souvent propre à certaines espèces.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines • Extrachromosomique [4] : la résistance est liée à l’acquisition d’un fragment d’ADN porteur d’un ou plusieurs gènes de résistance, le plus souvent en position cytoplasmique tel un ADN plasmidique identifié facilement après une électrophorèse sur gel suivie d’une révélation avec un colorant fluorescent (cf. infra, plasmide). Le synonyme de cette résistance, qui est donc acquise, est plasmidique.
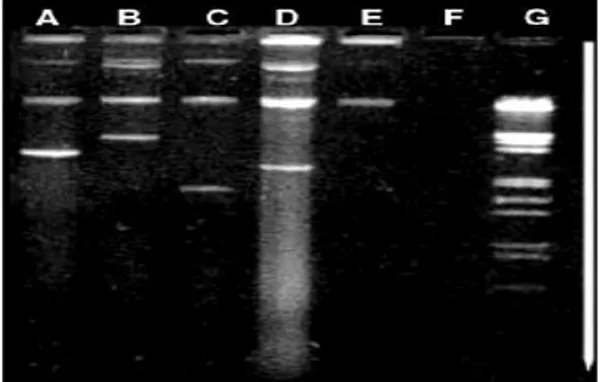
• Plasmidique [4] : le support génétique de la résistance est un ADN additionnel porteur d’un ou plusieurs gènes de résistance, le plus souvent en position cytoplasmique, donc facilement détectable (cf. extrachromosomique). Le contenu plasmidique de souches bactériennes peut être inventorié par une électrophorèse sur gel d’agarose (étape de séparation) puis révélation avec un colorant fluorescent se fixant sur l’ADN (bromhydrate d’éthidium) (Fig. 3). La taille des plasmides varie de 0,5 kilobase (kb) à 450 kb. Plus leur taille est importante, plus grand sera le nombre de gènes codant la résistance, par exemple, résistance à plusieurs familles d’antibiotiques ou encore aux antiseptiques, etc. (cf. résistance associée).
Figure 3. contenu plasmatique de souches
d'Escherichia coli (A à F) résistantes à plusieurs familles d’antibiotiques telles que les β-lactamines, aminosides, tétracyclines, sulfamides, etc.
En F, souche sans plasmide. En G, marqueurs de taille en acide désoxyribonucléique.
La flèche blanche indique le sens de la migration des ADN sur le gel.
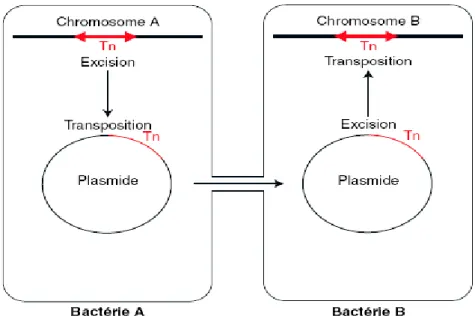
______________________________ Antibiorésistance des entérobactéries aux β-lactamines • Associée [4] : cette résistance est médiée par un plasmide codant la résistance à des antibiotiques de familles différentes (cf. résistance plasmidique). • Transposable [4] : gène(s) de résistance localisé(s) sur un ADN « mobile » ayant une organisation particulière. Le transposon peut transposer d’un plasmide à un chromosome ou vice versa. Cet ADN additionnel augmente la taille du génome, de l’ordre de 4 à 30 kb (Fig. 4).
Figure 4. Modèle de mobilisation de transposon (Tn) d’un chromosome d’une bactérie
donatrice à gauche à un plasmide (acide désoxyribonucléique cytoplasmique). Après conjugaison (modèle le plus fréquent de transfert de gènes de résistance) du plasmide à la bactérie réceptrice B, il peut y avoir excision, et transposition du Tn, donc insertion sur le
chromosome de cette bactérie. • Génétique [7,8]
: sa définition pourrait être : « modification du patrimoine génétique d’une bactérie entraînant des augmentations limitées de CMI (× 4 à 8 fois), souvent peu apparente ». De légères modifications du patrimoine génétique d’une bactérie peuvent entraîner une moindre sensibilité à un antibiotique ou plusieurs de la même famille selon le mécanisme de résistance ;
______________________________ Antibiorésistance des entérobactéries aux β-lactamines diminution des diamètres d’inhibition (mm) (antibiogramme par diffusion ou méthode des disques). L’échec clinique n’est pas obligatoirement connu lors de l’émergence de telles souches de sensibilité diminuée. Cette situation a été celle de l’émergence, dès 1983, des premières souches d’entérobactéries telles
Klebsiella pneumoniae ou Escherichia coli productrices de β-lactamases à
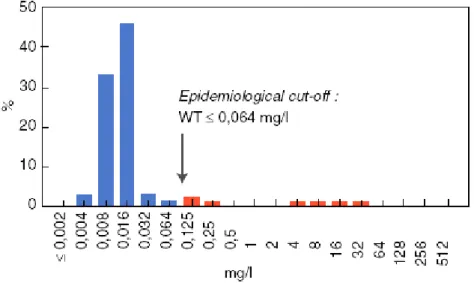
spectre élargi (BLSE).Cette modification de la sensibilité d’une espèce bactérienne a été prise récemment en compte dans la définition de la concentration épidémiologique (epidemiological cut-off) par l’European Committee on Antimicrobial Susceptibility Testing (EUCAST) (Fig. 5).
Figure 5. Escherichia coli : exemple de distribution des concentrations minimales inhibitrices
(CMI) (mg/l) de la ciprofloxacine avec prise en compte de epidemiological cut-off value par l’European Committee on Antimicrobial Susceptibility Testing (EUCAST). 4416
observations. Point critique clinique : S ≤0,5 mg/l. R > 1 mg/l.
• Inductible [4] : ce terme évoque l’expression augmentée de la résistance
en présence d’un inducteur de type antibiotique. Il y a donc une diminution de l’activité antibactérienne lors de l’association de deux antibiotiques de la même famille dont l’un est inducteur et l’autre sensible à cette augmentation de l’expression du mécanisme de résistance. La détection de la résistance inductible
______________________________ Antibiorésistance des entérobactéries aux β-lactamines est simple par la méthode de diffusion avec la mise en évidence d’un antagonisme (diminution d’activité).
La détection d’un tel mécanisme entraîne, en pratique quotidienne, une interprétation pour les antibiotiques des familles des MLS. L’effet régulé ou variable de l’expression de la sensibilité vis-à-vis de certains antibiotiques d’une même famille ou d’une famille voisine a eu pour conséquences pratiques de rechercher à commercialiser des molécules non inductrices comme les macrolides à 16 atomes. La deuxième conséquence pratique est d’éviter d’associer deux antibiotiques de la même famille dont l’une est inductrice et l’autre sensible à l’induction. Cette règle a été oubliée dans les années 1980 lors d’association de type carbénicilline + céfoxitine pour le traitement d’infections à bacilles à Gram négatif chez le neutropénique. En effet, diverses espèces telles
Enterobacter cloacae, Enterobacter aerogenes, Citrobacter freundii présentent
une résistance inductible à nombre de β-lactamines en présence de céfoxitine. Enfin, la troisième conséquence est liée à l’éventualité d’isoler, lors de traitement avec des antibiotiques appartenant à la même famille que celui qui est inducteur, un clone ou un variant présentant une dérégulation du mécanisme de résistance entraînant une hyperproduction de l’enzyme inactivatrice (cf. résistance constitutive).
• Constitutive [5,9]
: suite à une modification de l’ADN codant un gène
impliqué dans la résistance inductible (mutation, insertion d’IS, etc.), il s’agit alors d’une expression augmentée de la résistance. La détection en pratique du phénotype MLSB constitutif est relativement facile. Un autre synonyme de cette résistance pourrait être déréprimée. Au plan expérimental, il est plus difficile de
______________________________ Antibiorésistance des entérobactéries aux β-lactamines l’activité enzymatique d’une souche hyperproductrice. Un exemple de résistance constitutive est celui lié à l’introduction, dans les années 1980, de céphalosporines stables aux pénicillinases de l’époque (céphalosporines de 3eme
génération [C3G]). Dès les premiers traitements lors d’infections à Enterobacter
cloacae par exemple, avec une C3G telle la céfotaxime, ont été rapportés des
échecs liés à la sélection de variantes devenus résistants par hyperproduction de leur céphalosporinase chromosomique de base (Fig. 6).
Figure 6. Enterobacter cloacae.
A. Phénotype «Céphalosporinase inductible». B. Phénotype «Hyperproducteur ou déréprimé »
• De bas niveau [4]
: l’individualisation de ce type de résistance, dont l’expression est faible en termes de diamètre ou de CMI, s’oppose à une expression plus importante du même mécanisme. Il y a une conséquence dans le choix thérapeutique de bien distinguer la résistance de bas niveau (naturelle) de celle de haut niveau (acquise). L’exemple le plus caractéristique est celui des aminosides (gentamicine, par exemple) qui peuvent être associés, lors de résistance de bas niveau, avec un antibiotique d’une autre famille telle β-lactamine ou glycopeptide, pour obtenir une synergie bactéricide. En pratique au laboratoire, la distinction entre ces deux types de résistance s’effectue avec un
______________________________ Antibiorésistance des entérobactéries aux β-lactamines choix judicieux de concentrations d’aminosides (par exemple, disques hautement chargés ou concentration plus élevée).
III. Mécanismes biochimiques
[4]Préciser le déterminisme biochimique de la résistance présente un intérêt avant tout scientifique mais aussi pratique. Car pour des cliniciens, il amène à comprendre la résistance croisée entre antibiotiques de la même famille. L’intérêt scientifique permet d’imaginer de nouvelles molécules plus actives, car échappant à l’action de tel ou tel mécanisme.
Ainsi le renouveau des β-lactamines dans les années 1980 (C3G et carbapénèmes) chez les bacilles à Gram négatif a été l’obtention de molécules d’hémisynthèse plus hydrophiles, donc ayant d’une part une meilleure diffusion à travers les porines (canaux aqueux), d’autre part une meilleure affinité pour leurs cibles, à savoir les protéines liant la pénicilline (PLP) (radioactive), leur synonyme étant penicillin binding protein (PBP). Le choix d’une nouvelle β-lactamine pouvait aussi porter sur une moindre affinité pour les β-lactamases, donc une éventuelle plus grande stabilité à l’inactivation enzymatique.
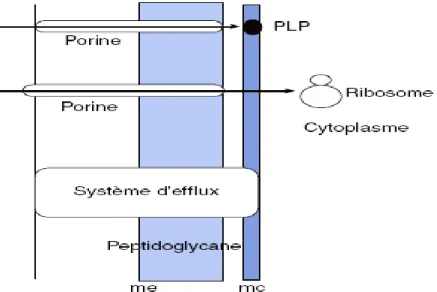
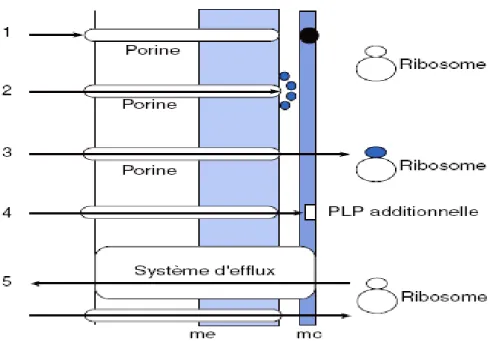
La figure 7 est une représentation très schématique du mode d’action d’un antibiotique (exemple d’une β-lactamine).
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Figure 7. Représentation schématique du mode d’action d’un antibiotique (exemple d’une
bêtalactamine). me : membrane externe ; mc : membrane cytoplasmique.
Le mode d’action des antibiotiques comme celui des β-lactamines permet aussi une meilleure compréhension des mécanismes de résistance éventuels. Depuis quelques années, cinq mécanismes ont été individualisés pour expliquer la résistance naturelle et surtout acquise des bactéries aux antibiotiques
(Fig. 8) : • Imperméabilité ;
• Inactivation enzymatique ; • Affinité diminuée ;
• Substitution de cible ; • Efflux.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Figure 8. Mécanismes biochimiques de la résistance bactérienne. me : membrane externe ;
mc : membrane cytoplasmique.
III.1. Interférence avec le mécanisme de transport de type imperméabilité
Ce mécanisme est connu depuis très longtemps et explique pour partie la résistance naturelle de nombreux bacilles à Gram négatif aux antibiotiques hydrophobes comme les premières β-lactamines telles benzylpénicilline, méticilline, oxacilline, les macrolides (érythromycine) ou encore les glycopeptides (vancomycine) [10].
La résistance acquise par imperméabilité est aussi décrite en liaison avec le dysfonctionnement d’une porine. Ce mécanisme de résistance a été par le passé difficile à distinguer de celui qui fut découvert plus tardivement et appelé efflux (cf. infra). Chez les bacilles à Gram négatif, son expression phénotypique est de niveau peu élevé, les CMI étant augmentées d’un facteur 4-8 fois pour certains antibiotiques tels que β-lactamines, quinolones, triméthoprime, fosfomycine,
______________________________ Antibiorésistance des entérobactéries aux β-lactamines chloramphénicol ou encore tétracyclines (Fig. 9A, B). Il peut être associé à un autre mécanisme de résistance [11].
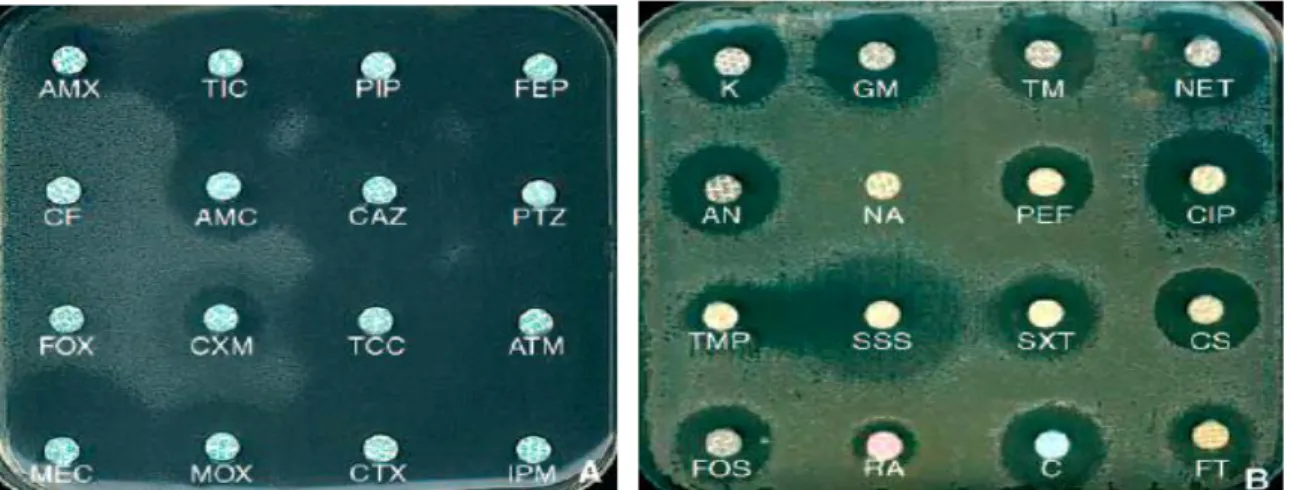
Figure 9. Expression phénotypique usuelle d’une souche d’Escherichia coli imperméable K : kanamycine ; GM : gentamicine ; TM : tobramycine ; NET : nétilmicine ; AN : amikacine
; NA : acide nalidixique ; PEF : péfloxacine ; CIP : ciprofloxacine ; TMP : triméthoprime ; SSS : sulfamides ; SXT : cotrimoxazole ; CS : colistine ; FOS : fosfomycine ; RA :
rifampicine ; C : chloramphénicol ; FT : nitrofuranes.
III.2. Inactivation ou détoxification enzymatique
La résistance par destruction des molécules d’antibiotiques soit à l’extérieur de la bactérie (enzyme exocellulaire) soit dans la bactérie (enzyme endocellulaire ou périplasmique) est soit naturelle, soit plus fréquemment acquise et touche plusieurs familles d’antibiotiques.
Si l’on examine la famille des β-lactamines, une étonnante diversité d’enzymes dénommées β-lactamases est maintenant individualisée, au moins 350 ; ce qui montre la prédominance de ce mécanisme de résistance, en particulier dans la résistance acquise. Il est d’ailleurs intéressant de constater depuis un peu plus d’une décennie, au niveau mondial, une émergence continuelle de nouveaux types enzymatiques pour expliquer la résistance vis-à-vis des C3G ou encore des carbapénèmes [12,13].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines Ainsi, la résistance vis-à-vis des C3G apparue dans les années 1985 était en relation avec des pénicillinases mutées de type TEM ou sulfhydril-variable (SHV) et dénommées BLSE [14]. Plus de 150 enzymes modifiées sont à l’heure actuelle identifiées dans le monde. Cependant, le mécanisme allait se compliquer avec l’émergence de nouvelles BLSE aux dénominations le plus souvent exotiques comme brazilian extended spectrum (BES-1), guyana extended spectrum (GES-1), Pseudomonas extended résistance (PER-1), Serratia fonticola (SFO-1), Tlahuicas (TLA-1), tribu mexicaine, et enfin Vietnam extended spectrum (VEB-1). Cependant, le groupe émergent le plus important reste celui dénommé céfotaximase (CTX-M) [15, 16].
La résistance acquise aux carbapénèmes, imipénème par exemple, est plus récente. Quelques souches d’Enterobacter productrices d’enzymes inactivatrices ont été isolées dans les années 1985 avec l’individualisation des types imi-1, sme-1, etc. [17, 18]. Plus récemment, de nouveaux types plasmidiques ont été rapportés, dénommés Klebsiella pneumoniae carbapenemases (KPC). Ces enzymes sont heureusement encore exceptionnelles, car isolées presque uniquement en Amérique du Nord [13].
Enfin, un exemple de cette complexité croissante des enzymes inactivatrices des β-lactamines est celui des souches d’Acinetobacter baumannii pour lesquelles les β-lactamases produites appartiennent à la classe D, soit des oxacillinases (OXA) [19].
III.3. Modification d’affinité de la cible
La modification d’affinité d’une ou plusieurs cibles affecte plus les bactéries à Gram positif que celles à Gram négatif. L’exemple le plus important
______________________________ Antibiorésistance des entérobactéries aux β-lactamines émergence fut longue, les premières souches résistantes en France ont été isolées dans les années 1985 [20]. Cette modification d’affinité de la cible a pour effet d’exiger une plus grande concentration de l’antibiotique concerné, donc la CMI de l’antibiotique sera supérieure [21, 22]
.
Si l’exemple des β-lactamines chez le pneumocoque illustre bien ce type de résistance, d’autres antibiotiques auraient pu être cités.
III.4. Substitution de cible [5]
Ce mécanisme a été individualisé depuis plusieurs décennies avec l’exemple des sulfamides. Mais un exemple aussi contributif est celui de la résistance intrinsèque ou méticillinorésistance des staphylocoques, d’autant que la cible additionnelle PLP2A identifiée dans les souches résistantes court-circuite les autres PLP. La conséquence majeure au plan thérapeutique concerne la résistance croisée entre toutes les β-lactamines.
III.5. Interférence avec le mécanisme de transport de type efflux
La résistance non enzymatique liée à des modifications de protéines membranaires évoquant d’une part un rôle éventuel des porines (imperméabilité) et d’autre part d’autres mécanismes de résistance est rapportée depuis plus de 15 ans [23, 24]. La résistance par systèmes d’efflux, de découverte plus récente, apparaît être le principal mécanisme chez les bactéries à Gram négatif et divers gènes codent pour des protéines membranaires permettant l’efflux de l’antibiotique hors de la cellule et donc empêchant son accumulation intracellulaire. Ces protéines, de l’ordre de 40-46 kDa, montrent des homologies structurales entre elles ainsi qu’avec d’autres protéines d’efflux comme celles des systèmes multidrug resistance (MDR) [25, 26].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines Les gènes chromosomiques codant des protéines membranaires de transport peuvent être responsables de la résistance à divers antibiotiques. Chez
Escherichia coli, le système multiple antibiotic resistance (mar) est un système
qui augmente le niveau de résistance à de nombreux antibiotiques dont les β-lactamines. Constitué de plusieurs gènes tels marA, marB, marRAB, marC, etc. marA code un activateur transcriptionnel qui agit au niveau de plusieurs promoteurs, et dont la synthèse est réprimée en l’absence d’antibiotique par un répresseur, produit du gène marRAB. La surexpression de MarA entraîne la diminution de l’expression de la porine OmpF et la surexpression de la pompe à efflux AcrAB et la résistance à divers antibiotiques. Des mutants résistants aux β-lactamines dans d’autres systèmes d’efflux homologues au système AcrAB ont été décrits chez d’autres entérobactéries qu’Escherichia coli [6]
.
IV. Mécanismes génétiques
[27, 28]Le déterminisme génétique de la résistance, qu’elle soit naturelle ou acquise, est de mieux en mieux appréhendé grâce aux progrès des méthodes d’analyses moléculaires incluant le clonage de gènes, l’amplification génique (polymerase chain reaction [PCR]), le séquençage et plus récemment l’amplification génomique. La résistance acquise d’une bactérie offre un éventail très diversifié de solutions génétiques que celle-ci peut développer à l’égard des antibiotiques.
Parmi les définitions de la résistance proposées ci-dessus, plusieurs d’entre elles sont d’ailleurs en relation directe avec le déterminisme génétique comme les résistances chromosomique, extrachromosomique, plasmidique, transposable, inductible, constitutive ou déréprimée, etc.
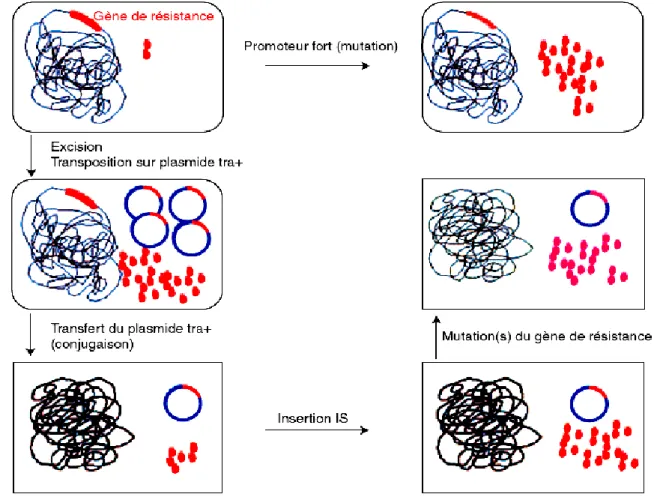
______________________________ Antibiorésistance des entérobactéries aux β-lactamines De manière un peu schématique, les mécanismes génétiques sont de deux types : modification d’ADN chromosomique par mutation et transferts d’ADN plasmidiques ou non, ces deux mécanismes pouvant survenir simultanément ou successivement. Ces deux grands types d’événements peuvent survenir de manière très variée comme l’illustrent les exemples suivants ou encore, schématiquement, la Figure 10.
Figure 10. Destins possibles d’un gène de résistance aux antibiotiques. tra : transférable.
Il peut s’agir d’un gène de résistance en position chromosomique spécifique d’espèce et responsable de la résistance naturelle à plusieurs antibiotiques de la même famille, par exemple les pénicillines telles l’ampicilline, l’amoxicilline et la ticarcilline. Ce gène peut se transposer sur un
______________________________ Antibiorésistance des entérobactéries aux β-lactamines ADN cytoplasmique de type plasmide multicopie qui va alors générer une plus grande quantité d’enzyme, donc un niveau de résistance beaucoup plus important incluant maintenant la pipéracilline, les céphalosporines de première et de deuxième génération (C1G, C2G). Le gène transposé sur un plasmide conjugatif, dit « tra+ » pour transférable, peut alors diffuser dans d’autres bactéries, jusque-là naturellement sensibles à ces antibiotiques. Cependant, dans des conditions de survie difficiles liées à une pression antibiotique à la suite d’un traitement, certaines bactéries transposent du chromosome au plasmide, en amont du gène de résistance, une séquence d’insertion IS. La conséquence est une production d’enzyme très augmentée. Un autre événement génétique, banal en apparence, permet à la bactérie de surmonter le dernier traitement à base de C3G. Le gène de résistance peut muter, c’est-à-dire qu’à la faveur du renouvellement de l’ADN (réplication), un changement minimal d’une base va entraîner dans l’enzyme le codage d’un nouvel acide aminé. Cette mutation dite « ponctuelle » va modifier la structure tertiaire de l’enzyme et donc lui donner, peut-être, beaucoup plus d’affinité pour la C3G (Km [constante de Michaelis] diminuée) et donc permettre de l’inactiver. D’une pénicillinase spécifique d’espèce, la bactérie, en quelques événements génétiques de fréquence faible, de l’ordre du millionième pour chacun d’entre eux, a donné la possibilité à d’autres bactéries de parenté proche de survivre à une attaque par C3G. Si le dernier recours reste les carbapénèmes telle l’imipénème, la grande question que l’on peut se poser est la suivante : existe-t-il une mutation ponctuelle permettant à l’enzyme codée d’inactiver l’imipénème ? C’est une probabilité possible ; elle peut être appréciée soit in vitro au laboratoire par sélection de mutants, soit en clinique avec l’émergence de souches résistantes.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines Le scénario précédent pourrait s’appliquer en pratique à la β-lactamase chromosomique de l’espèce Klebsiella pneumoniae dénommée SHV-1 ou encore, comme démontré beaucoup plus récemment, chez une autre entérobactérie de l’environnement, d’isolement rare en pratique médicale,
Kluyvera ascorbata, progéniteur probable des β-lactamases du groupe CTX M.
Le terme CTX-M désigne une plus grande activité de ces enzymes vis-à-vis du céfotaxime (C3G) que de la ceftazidime (autre C3G). Elles peuvent ensuite évoluer par mutation et donc acquérir la résistance vis-à-vis de cette dernière C3G.
Si nos connaissances au plan génétique ont fantastiquement progressé au cours de la dernière décennie, l’usage de plus en plus répandu des techniques d’analyse moléculaire au plan mondial permet de nouvelles découvertes, expliquant partiellement la diffusion de nouveaux gènes de résistance. L’acquisition d’éventuels gènes de résistance s’effectue donc, le plus souvent par conjugaison ou sexualité bactérienne, par simple contact entre deux bactéries pouvant être d’espèces différentes. Ces gènes de résistance sont portés sur diverses structures génétiques de type plasmide, intégron avec un ou plusieurs gènes cassettes. Les analyses comparatives de séquences ont conduit à la découverte récente de nouvelles structures génétiques avec les common region (CR) et leurs probables recombinases.
En conclusion, les bactéries, en particulier commensales, constituent d’importantes populations, de l’ordre de 108
à 1010 individus par millilitre ou gramme dans lesquelles peuvent préexisté des variantes moins sensibles ; aussi la pression de sélection d’un antibiotique actif peut favoriser leur émergence, d’où de constante évolution probable.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
V. Évolution
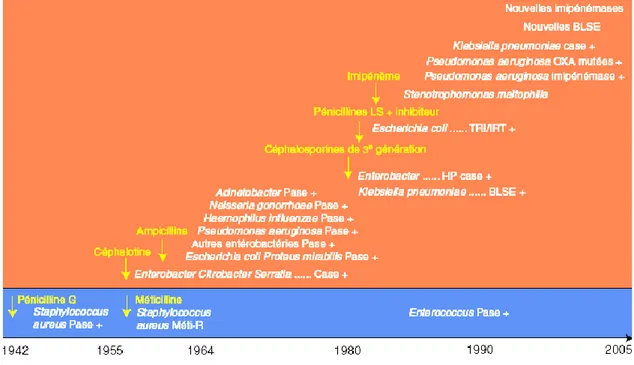
[4]Les déterminismes biochimiques et surtout génétique de la résistance bactérienne amènent à un constat pessimiste en raison de cet extraordinaire potentiel d’adaptation dont disposent les bactéries. La résistance bactérienne est donc une fatalité mais d’importance variable selon le pays, l’espèce bactérienne et l’antibiotique, fonction de son succès, donc de son utilisation. Nous illustrons d’abord cette constante évolution à l’aide d’exemples puisés à partir de la principale famille d’antibiotiques, les β-lactamines (Fig.11). La résistance bactérienne acquise présente certaines caractéristiques en termes d’évolution.
Figure 11. Évolution de la résistance aux bêtalactamines entre 1940 et 2005. TRI/IRT :
résistant aux inhibiteurs/inhibitor TEM resistant ; OXA : oxacillinases ; Case : carbapénémase ; Pase : pénicillinase ; Méti-R : méticillinorésistant.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
V.1. Émergence rapide
Dès la découverte d’un nouvel antibiotique, il a été constaté l’isolement d’espèces bactériennes naturellement résistantes à celui-ci. Ainsi avant les premiers essais cliniques de la pénicilline G, il a été découvert la résistance naturelle des entérobactéries dont Escherichia coli lors de la production industrielle de cet antibiotique. Plus de 40 ans après, lors de la découverte de l’imipénème, des espèces naturellement résistantes à ce dernier antibiotique ont été identifiées telles Stenotrophomonas maltophilia, Burkholderia cepacia,
Chryseobacterium meningosepticum, etc.
Les premières souches d’entérobactéries résistantes à l’ampicilline, première pénicilline à large spectre introduite en Europe en 1963 et productrices de TEM, émergent en 1964 en Grèce (Fig. 11). La première C3G a été introduite en 1980, les premiers échecs de traitement par hyperproduction de céphalosporinase (HP case) sont observés dès les premiers essais cliniques ; puis les premières souches de Klebsiella pneumoniae productrices de BLSE [9, 14, 29].
Cette émergence rapide de la résistance acquise en clinique est initialement limitée à quelques espèces bactériennes [30].
V.2. Fréquence du mécanisme émergent rapidement en augmentation [31]
La prévalence des souches d’Escherichia coli résistantes aux pénicillines à large spectre est maintenant de 50 %.
Cependant, si la prévalence peut rapidement augmenter après l’émergence des premières souches, celle-ci peut heureusement régresser très significativement lorsque le nouveau mécanisme de résistance est bien détecté au laboratoire comme celui de la production de BLSE chez les entérobactéries et
______________________________ Antibiorésistance des entérobactéries aux β-lactamines la mise en œuvre de mesures spécifiques. Nous analyserons ultérieurement ces mesures qui peuvent être prises dans un souci de nette diminution de la fréquence de résistance.
V.3. Résistance diffusible, car transférable [4]
Une des explications de cette prévalence de résistance augmentant inexorablement est liée soit au déterminisme génétique de celle-ci, soit aux aptitudes de la bactérie en cause. Dans le premier cas, il s’agit de gènes facilement transférables comme ceux intégrés dans un plasmide, un transposon, voire un intégron. La résistance est alors détectée dans diverses espèces bactériennes, cela dans de nombreux pays. L’exemple le plus probant reste la diffusion épidémique du gène codant la β-lactamase TEM.
V.4. Évolution possible d’un gène de résistance
Diverses observations illustrent le potentiel évolutif d’un gène de résistance bactérien avec, comme exemple, la découverte dans les années 1985 des BLSE
[7, 8]
et, quelques années après, celles dénommées TEM résistant aux inhibiteurs (TRI) ou encore inhibitor TEM resistant (IRT) [32], résultats de mutations dans des positions différentes du gène codant l’enzyme précédemment citée, TEM-1 ou TEM-2 (Fig. 12).
______________________________ Antibiorésistance des entérobactéries aux β-lactamines Ainsi, selon les besoins d’évolution de la bactérie pour sa survie, un même gène peut, selon les conditions environnementales, évoluer dans deux sens opposés. D’une part, il peut y avoir l’évolution vers une plus grande résistance aux β-lactamines dont les C3G ; dans ce cas, les mutations ont été observées toujours dans les mêmes positions du gène codant, à savoir 104, 164, 237 et/ou 238 [14, 29]. L’effet de cette ou de ces substitutions en acides aminés est une meilleure affinité (Km diminuée) pour les β-lactamines.
À l’inverse, la β-lactamase TEM peut évoluer par mutation du gène dans les positions 69 et 244 ou d’autres, identifiées par la suite, vers une plus grande sensibilité à certaines β-lactamines sans conséquences thérapeutiques notables. Cette substitution d’acide(s) aminé(s) a pour effet d’obtenir une enzyme modifiée avec un Km augmenté (μM), donc ayant une moindre affinité pour les β-lactamines, dont l’acide clavulanique. Cette diminution d’affinité a comme conséquence une plus grande concentration de l’inhibiteur pour obtenir le même effet. Cette résistance aux inhibiteurs définit les enzymes TRI ou IRT [33]. L’obtention de mutants mixtes, BLSE et TRI, est possible mais rare. On parle d’enzymes CMT pour complexe mutant TEM [34]
.
Cette évolution d’un gène de résistance n’est pas seulement liée au gène de structure mais elle peut être en relation avec une mutation dans le système de régulation (dérépression ou hyperproduction) en relation vers une plus grande résistance comme celle vis-à-vis des C3G (ceftazidime) est aussi observée chez les bacilles à Gram négatif naturellement producteurs d’une case tels qu’Enterobacter cloacae, Enterobacter aerogenes, Pseudomonas aeruginosa [8]
______________________________ Antibiorésistance des entérobactéries aux β-lactamines La résistance acquise peut être, donc, extrêmement modulable. Une telle souplesse permet au monde bactérien une adaptation possible aux thérapeutiques, même les plus récentes.
V.5. Évolution de la résistance aux C3G (nouvelles β-lactamases à spectre élargi)
Parmi les autres exemples de résistance enzymatique aux C3G chez les entérobactéries prédomine au plan mondial un groupe d’enzymes dénommé CTX-M (pour céfotaximase) qui conférait, à l’origine, un plus haut niveau de résistance au céfotaxime (ou ceftriaxone), céfépime et aztréonam qu’à la ceftazidime [12, 15, 16]. Certaines d’entre elles ont, plus récemment, évolué par mutation (ponctuelle ou non) générant un haut niveau de résistance à la ceftazidime telles que les enzymes M-15, M-16, M-19, CTX-M-23 ou encore très récemment CTX-M-32 dérivant par simple mutation (Asp240Gly) de CTXM- 1. Ce groupe d’enzymes rencontré chez diverses espèces de bacilles à Gram négatif telles qu’entérobactéries (Escherichia coli,
Klebsiella pneumoniae, Proteus mirabilis, Salmonella enterica, Shigella flexneri, etc.) ou autres (Vibrio cholerae) est maintenant très largement répandu
dans le monde.
La phylogénie de ces nouvelles BLSE montre actuellement un regroupement au sein de cinq branches. Les analyses génétiques ont montré que les gènes progéniteurs appartiennent au genre Kluyvera, entérobactéries d’isolement très rare en bactériologie médicale [16, 27]
. Ainsi le phylum CTX-M-2 dérive de la β-lactamase naturelle de Kluyvera ascorbata alors que le phylum CTX-M-8 vient de Kluyvera georgiana. L’environnement génétique de
______________________________ Antibiorésistance des entérobactéries aux β-lactamines inconnues comme la séquence d’insertion ISEcp1 apportant un promoteur ou encore l’IS513. Si le mécanisme exact de la mobilisation de ces gènes est encore mal précisé, il reste la question essentielle du lieu de capture de ces gènes : environnement hydrique, tellurique, alimentaire, voire agronomique, etc.
D’autres BLSE caractérisées par un haut niveau de résistance à la ceftazidime et parfois à l’aztréonam plutôt qu’au céfotaxime ont une distribution moins large que le groupe CTX-M [4, 17,35]. Dans ce groupe sont individualisées BES-1, GES-1, PER-GES-1, SFO-GES-1, TLA-GES-1, et enfin VEB-1. Des enzymes proches de GES-1 ont été découvertes en Grèce, malheureusement dénommées à tort integron borne cephalosporinase (IBC-1, IBC-2) [36].
L’existence, pour ces nouvelles enzymes, de localisation géographique préférentielle rend compte d’une distribution géographique différente. Ainsi l’enzyme VEB-1 est très répandue dans le Sud-Est asiatique, PER-1 est prépondérante en Turquie alors que PER-2 n’a été décrite qu’en Argentine [16]. Enfin TLA-1 n’a été observée qu’au Mexique. Néanmoins, elles peuvent être observées en France comme PER-1, GES-1 et même sous une forme épidémique comme récemment VEB-1 chez Acinetobacter baumannii [37].
La β-lactamase plasmidique SFO-1 n’a été identifiée qu’une seule fois dans une souche d’Enterobacter cloacae au Japon. Elle présente la particularité d’avoir pour progéniteur une entérobactérie d’isolement rare en bactériologie médicale, l’espèce Serratia fonticola. Enfin, les gènes correspondant à ces BLSE sont le plus souvent retrouvés dans des structures de type intégron comme gènes cassettes (VEB-1, IBC-1, GES-1, GES-3) et donc sous la dépendance de promoteurs situés à l’extrémité 3' du gène de l’intégrase.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
V.5.1. Résistance acquise aux C3G, aux céfamycines et aux inhibiteurs
enzymatiques (classe C) par acquisition d’une céphalosporinase plasmidique :
Ce n’est que vers 1988 que sont apparues aux États-Unis et en Europe les premières souches cliniques de Klebsiella (Klebsiella pneumoniae, Klebsiella
oxytoca) montrant un phénotype de résistance de type céphalosporinase alors
qu’elles n’en produisent pas naturellement [38-39]
. La découverte de « céphalosporinases plasmidiques » originaires d’entérobactéries, productrices naturelles, indiquait une nouvelle et importante étape de la résistance acquise aux antibiotiques (C3G en particulier) par mobilisation de gènes chromosomiques.
Cette émergence d’un mécanisme de résistance tout à fait inédit et important allait s’amplifier et être démontrée chez diverses espèces d’entérobactéries : Klebsiella pneumoniae, Klebsiella oxytoca, Salmonella
enterica, Proteus mirabilis, Escherichia coli, Enterobacter cloacae, Enterobacter aerogenes, Shigella, etc. De très nombreuses publications
confirment cette émergence dans de nombreux pays avec la prédominance d’un ou deux types dont CMY-2, et même chez l’animal. Les perspectives sont inquiétantes, liées à l’isolement de Salmonella productrices de case, en particulier, d’origine animale [40]
.
Le phénotype de résistance observé est similaire à celui d’une céphalosporinase chromosomique hyperproduite avec, généralement, une résistance aux C3G, une sensibilité au mécillinam, aux « C4G » (céfépime, cefpirome) et à l’imipénème et enfin une résistance aux associations avec l’acide
______________________________ Antibiorésistance des entérobactéries aux β-lactamines La majorité des souches productrices est résistante à la céfoxitine, à l’exception de celles productrices de l’enzyme ACC-1 [39]
. Si ces enzymes en position chromosomique sont inductibles, caractère aisément détecté dans l’antibiogramme par diffusion par un antagonisme entre une β-lactamine inductrice (imipénème) et une C3G, les enzymes plasmidiques sont, le plus souvent, non inductibles, à l’exception d’ACT-1, de DHA-1 et de CFE-1. Par séquençage, il a été démontré la présence d’un gène régulateur ampR en amont du gène de structure, ampC. L’interprétation de l’antibiogramme pour ce mécanisme de résistance est identique à celle de l’hyperproduction chromosomique.
Ce nouvel aspect de la résistance acquise aux C3G a eu, pour première conséquence, de clairement démontrer la possible mobilisation de gènes chromosomiques au sein du monde bactérien. Ainsi pour plusieurs de ces enzymes transférables, les progéniteurs ont été identifiés : groupe CMY (Citrobacter freundii), DHA-1 (Morganella morganii), groupe FOX (Aeromonas caviae), ACT-1 (Enterobacter asburiae) et ACC-1 (Hafnia alvei). Cette dernière céphalosporinase présente la particularité d’être inhibée par la céfoxitine, donc la souche productrice apparaît sensible à cette β-lactamine. L’étude de l’environnement génétique de ces gènes a démontré que la mobilisation de ces gènes faisait intervenir des séquences d’insertion déjà évoquées pour certaines BLSE telles ISEcp1, orf513 ou encore des IS de type IS de transposon composite [28]. Si le mécanisme exact de la mobilisation de ces gènes est encore mal précisé, il reste la question majeure du ou des lieux de telle mobilisation de gènes. L’environnement hydrique peut être évoqué ; en effet, l’agriculture et l’aquaculture a utilisé, ou utilise les antibiotiques. Que
savons-______________________________ Antibiorésistance des entérobactéries aux β-lactamines nous de la consommation d’antibiotiques en horticulture, par exemple, pour le traitement du feu bactérien ou encore dans l’alimentation, etc. ?
V.5.2. Résistance acquise aux C4G (cases chromosomiques à spectre élargi)
La résistance chromosomique acquise aux C3G liée à l’hyperproduction de la case (mutation du gène régulateur ampD) s’individualise par une résistance à diverses β-lactamines dont la ticarcilline, la pipéracilline, les céfamycines, les C3G ou encore l’aztréonam mais quelques β-lactamines restent épargnées telles mécillinam, C4G (céfépime, cefpirome) et carbapénèmes (imipénème).
Cependant a émergé, depuis peu en clinique, la résistance acquise aux C4G, en particulier en France [41, 42]. Les rares souches cliniques isolées (Enterobacter cloacae, Enterobacter aerogenes, Serratia marcescens) sont souvent hyperproductrices de leur céphalosporinase chromosomique, par ailleurs modifiée soit par mutation ponctuelle (par exemple L-293-P), soit par délétion de plusieurs bases (9 à 12) au niveau de la région codante de la case, dite alpha 10. Des mutants ponctuels in vitro ont déjà été rapportés et étaient liés à des substitutions d’acides aminés dans la même région du gène ampC. Ces deux types de modification génique diminuent le Km de l’enzyme qui a pour effet d’augmenter le rapport k (cat)/K(m) vis-à-vis par exemple du céfépime. Il y a donc une résistance additionnelle aux C4G (céfépime, cefpirome).
V.5.3. Résistance aux carbapénèmes
Commercialisés depuis plus de 15 ans, l’imipénème ou encore le méropénème restent toujours des molécules très actives, donc apparaissent souvent, pour le clinicien, le dernier recours thérapeutique. Cependant, quelques
______________________________ Antibiorésistance des entérobactéries aux β-lactamines majoritairement transférables, dénommées IMP, VIM, SPM, GIM, KPC, GES, OXA, etc. chez des bactéries opportunistes comme Pseudomonas aeruginosa et
Acinetobacter baumannii mais beaucoup plus rarement chez des entérobactéries
en France [13,17, 18, 19].
Les métallobêtalactamases (classe B) sont d’isolement rare chez les entérobactéries en France. Ces enzymes ont été rapportées en particulier sur des souches de Pseudomonas aeruginosa.
Deux mécanismes « anciens », au moins, sont déjà connus. L’un combine l’hyperproduction d’une céphalosporinase à celle de la perte d’une porine comme déjà décrit dans les années 1980 chez Enterobacter cloacae ou
Enterobacter aerogenes [43]. Ce type d’association est maintenant observé lors de production d’une case plasmidique chez Klebsiella pneumoniae, Salmonella
enterica, etc. [44,45]. d L’autre mécanisme de résistance, connu depuis les années
1980, se caractérise par un haut niveau de résistance à l’aztréonam et une sensibilité presque normale aux C3G. Il s’agit de la production d’une carbapénémase en position chromosomique de classe A (NMC-A, Sme-1, Sme-2, IMI-1, IMI-2). Ces enzymes sont restées heureusement marginales.
La dernière évolution identifiée depuis peu est beaucoup plus inquiétante, car elle est liée à la découverte de carbapénémases plasmidiques, majoritairement de type KPC. Ces enzymes sont heureusement encore exceptionnelles, car isolées presque uniquement en Amérique du Nord [13]. Néanmoins, un cas vient d’être identifié en France [46]
.
Phénotypiquement, KPC-1, KPC-2, KPC-3 confèrent un haut niveau de résistance aux C3G contrairement aux carbapénémases chromosomiques ayant une sensibilité presque normale aux C3G (NMC-A, Sme-1, Sme-2 et IMI-1). De
______________________________ Antibiorésistance des entérobactéries aux β-lactamines plus, pour le groupe KPC, la résistance est croisée entre carbapénèmes (imipénème, méropénème, ertapénème, doripénème). Identifiées chez diverses entérobactéries telles Klebsiella pneumoniae, Salmonella enterica, Escherichia
coli, Klebsiella oxytoca, et causes d’épidémies hospitalières, les gènes KPC
sont, au moins, plasmidiques et se transmettent facilement par conjugaison. Les gènes cassettes codant les BLSE de type GES-1, voire GES- 3 peuvent, par mutation, acquérir une activité carbapénémase, voire céphamycinase ; il s’agit au moins de GES-4, récemment identifié au Japon et en Grèce [36].
V.6. Association de mécanismes
La dernière évolution notable de la résistance acquise aux β-lactamines au sein des bacilles à Gram négatif concerne l’isolement de souches multirésistantes présentant une accumulation de mécanismes de résistance. À titre d’exemple, chez diverses entérobactéries, l’association d’une céphalosporinase et d’une imperméabilité au niveau d’une porine et/ou associée à un efflux génère la résistance à de nombreuses β-lactamines (spectre de la céphalosporinase) à laquelle s’ajoute celle aux carbapénèmes dont l’imipénème. La β-lactamase AmpC ou céphalosporinase peut être chromosomique, en général hyperproduite (Enterobacter cloacae, Enterobacter aerogenes, etc.), ou plasmidique [43,45]. Il n’est pas rare, maintenant, d’isoler des souches de
Klebsiella pneumoniae, productrices de trois, voire de quatre β-lactamases [35,46]. À l’heure actuelle, un constat préoccupant sur la résistance acquise aux C3G chez Salmonella doit être dressé, aussi bien pour des souches d’origine humaine qu’animale. Ainsi ont été identifiées diverses
______________________________ Antibiorésistance des entérobactéries aux β-lactamines dont de nombreux continents. Le constat est tout aussi préoccupant pour les souches de Salmonella productrices de diverses cases transférables telles CMY-2, CMY-4, ACC-1, ou encore DHA-1. Récemment a été rapportée en France une épidémie de toxi-infection alimentaire collective (TIAC) de 14 cas liée à la consommation d’une viande de cheval importée et contaminée mais d’origine inconnue [40]
. En conclusion, il apparaît urgent de mettre en oeuvre une surveillance beaucoup plus étroite de ce groupe bactérien. Cependant, la détection de ces enzymes exige une implication beaucoup plus grande des autorités en moyens et en matériel ; la difficulté sera, quelque fois, l’association de plusieurs mécanismes de résistance enzymatique comme CMY-7 + SHV-9 (61) ou encore SHV-2a + CMY-4 + CTX-M-3.
V.7. Évolution globale [4]
Les diverses évolutions évoquées ci-dessus ont amené les divers acteurs de la santé, il y a plusieurs années, à tenter de diminuer cette inexorable augmentation de la résistance, en particulier initialement en Amérique du Nord. Un autre élément capital de cette réflexion était l’absence de découverte, donc d’éventuelle commercialisation de nouveaux antibiotiques. Si l’on n’y avait pas pris garde, nous nous serions retrouvés avant l’ère des antibiotiques.
Au plan européen, l’European Antimicrobial Resistance Surveillance System (EARSS) rassemble 45 pays européens et fournit des informations sur un nombre limité d’espèces. Il est à prévoir que dans quelques années, les bases de données seront beaucoup plus conséquentes.
Bien évidemment, au plan international, se mettent en place divers réseaux comme au Center for Diseases Control (CDC) aux États-Unis avec, en
______________________________ Antibiorésistance des entérobactéries aux β-lactamines particulier, le National Antimicrobial Resistance Monitoring System (NARMS) créé dès 1996 en collaboration avec la Food and Drug Administration. Celui-ci surveille, en particulier, la sensibilité des entérobactéries d’origine humaine et animale. D’autres initiatives concourent à cette prise de conscience à destination du corps médical (recommandations) ou encore du grand public (bonne prescription).
Voici Un exemple de surveillance de la résistance au sein des hôpitaux de l’Assistance publique de Paris est celui de la fréquence d’isolement de souches productrices de BLSE au sein des entérobactéries (Fig. 13).
Figure 13. Évolution du pourcentage d’entérobactéries productricesde β-lactamases à spectre
élargi (BLSE) entre 1995 et 2003 au sein des hôpitaux de l’Assistance publique-hôpitaux de Paris.
VI. Conclusion
À partir des années 1945, les antibiotiques ont révolutionné nos pratiques médicales, mais ils sont aujourd’hui en danger, suite à une utilisation excessive
______________________________ Antibiorésistance des entérobactéries aux β-lactamines le type de résistance examiné, il est à noter que la résistance bactérienne est une fatalité à plus ou moins long terme en raison de l’étonnant arsenal génétique que les bactéries sont en mesure d’opposer à nos thérapeutiques. L’exemple des β-lactamines, principale famille d’antibiotiques, en est une parfaite illustration, en particulier chez les bactéries à Gram négatif comme les entérobactéries.
Comme la découverte et la commercialisation de nouveaux antibiotiques devenaient de plus en plus aléatoires, une prise de conscience du milieu médical, relayé par les pouvoirs publics, a tenté et tente de juguler cette émergence continuelle de bactéries résistantes. Il convient donc de mettre en œuvre, au plan planétaire, diverses stratégies ou mesures correctrices telle celle du bon usage des antibiotiques et pas seulement à l’hôpital avec son référent « antibiotique ». Parmi les autres mesures, il convient de sensibiliser le malade lui-même ou son entourage sur le non-intérêt de leur prescription devant certains types d’infection ; d’autant que la surveillance comparative de la consommation d’antibiotiques entre pays peut convaincre les sceptiques, etc. Enfin, la mise en place d’observatoire de la résistance permettra de mieux évaluer l’intérêt de certaines mesures comme la détection des bactéries multirésistantes (BMR), suivie de marquage et de mesures d’isolement. Restreindre leur usage dans d’autres domaines apparaît d’autant plus évident que nous connaissons mal les conséquences en termes de sélection de pression dans d’autres écosystèmes comme ceux de l’agriculture dont l’harboriculture, l’aquaculture, par exemple.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Principes de mesure de la sensibilité aux antibiotiques
L'activité des antibiotiques sur les bactéries rencontrées en pathologie est évaluée in vitro. L'effet bactériostatique est étudié par la détermination de la CMI. Les méthodes de référence sont des méthodes de dilution en gélose ou en milieu liquide. En pratique courante, la sensibilité aux antibiotiques est étudiée par des méthodes de diffusion en milieu solide comme l'antibiogramme ou par des techniques automatisées. La concentration minimale bactéricide (CMB) rend compte de l'effet bactéricide des antibiotiques. Il est cependant préférable d'étudier la bactéricidie de manière cinétique en fonction du temps [48].
I. Définition concentration minimale inhibitrice (CMI)
C'est le test le plus utilisé pour évaluer in vitro l’activité d’un antibiotique sur une bactérie. La CMI est la plus faible concentration d'antibiotique capable d'inhiber toute croissance visible de la souche bactérienne étudiée (bactériostase) exprimée en mg/l ou μg/ml [49]
.
II. Méthodes de mesure :
II.1. Dilution en milieu solide (méthode de dilution en gélose)
C'est la méthode de référence en France (CA-SFM Comité de l'Antibiogramme de la Société française de Microbiologie). Elle consiste à incorporer des quantités croissantes de l'antibiotique dans la gélose coulée en boîte de Pétri, réalisant une gamme de concentrations en progression géométrique de raison 2. Les souches bactériennes sont ensemencées en strie ou en spot (en « tache ») à l'aide d'un ensemenceur multiple de type Steers
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
II.2. Dilution en milieu liquide
C'est la méthode de référence du NCCLS (National Committee for Clinical Laboratory Standards), à côté de la méthode de dilution en gélose. La gamme de concentrations d'antibiotiques est réalisée en bouillons nutritifs ensemencés avec la souche à tester. La CMI correspond au tube dans lequel il n'y a pas de croissance visible.
Cette méthode peut être automatisée en utilisant des plaques de microtitration (micro dilution en milieu liquide). Des souches de contrôle doivent être incluses dans toute étude de CMI. La méthode de dilution fournit une bonne appréciation de l'activité d'un produit, mais elle est relativement imprécise [49].
II.3. Diffusion en milieu solide : E-test
Le E-test est une technique d'étude de la sensibilité des bactéries par diffusion en gélose, donnant une lecture directe de la CMI [49]. Le principe de la technique repose sur l'utilisation d'une bandelette imprégnée avec un gradient de concentrations d'antibiotique. Elle est déposée sur une gélose préalablement ensemencée avec la souche bactérienne, selon des recommandations précises indiquées par le fournisseur (AB BIODISK). Après 18-24 heures d'incubation, il se forme une zone d'inhibition de croissance bactérienne en forme d'ellipse autour de la bandelette. La CMI est lue à l'intersection entre l'ellipse et la bandelette.
Cette technique permet de fournir des résultats de CMI en général bien corrélés avec les techniques de référence. Elle ne remplace cependant pas ces
______________________________ Antibiorésistance des entérobactéries aux β-lactamines techniques et son coût élevé en limite l'utilisation. D'autre part, des variations importantes peuvent être observées selon la composition des milieux utilisés [50].
II.4. Antibiogramme par diffusion en gélose (méthode des disques)
Les méthodes de dilution ne sont pas réalisées en pratique courante sur toutes les souches isolées au laboratoire, plusieurs antibiotiques devant être testés. C'est la méthode de diffusion en gélose qui est couramment utilisée, son principe étant la détermination indirecte de la CMI [48].
Des disques de papier buvard imprégné d'une quantité définie d'antibiotique sont déposés à la surface d'un milieu gélosé préalablement ensemencée avec le germe à étudier. À partir du disque, l'antibiotique diffuse dans la gélose, y créant un gradient de concentrations.
Après incubation (18-24 h à 37 °C), chaque disque est entouré d'une zone d'inhibition de la croissance bactérienne : la culture s'arrête là où dans la gélose la concentration d'antibiotique est égale à la CMI de la souche bactérienne étudiée.
L'antibiogramme est une méthode simple, fiable et reproductible mais sensible à certains facteurs :
milieu de culture : standardisé : Mueller-Hinton, épaisseur 4 mm, pour les bactéries à croissance rapide sur milieux usuels ;
inoculum bactérien : standardisé : 2-3 106 bactéries par ml ; conservation des disques (+ 4 °C) [19]
______________________________ Antibiorésistance des entérobactéries aux β-lactamines La CMI est une caractéristique de la souche étudiée. Elle permet, par comparaison aux concentrations critiques fixées annuellement pour chaque antibiotique et espèce bactérienne, et classer la souche dans une des trois catégories : sensible, intermédiaire ou résistante [49].
Les concentrations critiques sont des bornes supérieures et inférieures de sensibilité ou de résistance fixées en fonction des caractères bactériologiques, pharmacocinétiques et des confrontations des données in vitro aux données cliniques [48].
La CMI est estimée à partir de la mesure du diamètre d'inhibition par une relation établie au préalable sur un grand nombre de souches (courbe de concordance). Celle-ci permet de calculer des diamètres discriminants (critiques) correspondant aux CMI critiques. Le classement sensible/intermédiaire/résistant de la bactérie est calculé par rapport à des valeurs préétablies soit de diamètres d'inhibition (D, d), soit de concentrations d'antibiotiques ou concentrations critiques (C, c).
Une souche est catégorisée comme sensible à un antibiotique lorsque la CMI de l'antibiotique considéré est inférieure ou égale à la concentration critique inférieure (c) pour cet antibiotique. Il y a alors une forte probabilité de succès thérapeutique dans le cas d'un traitement systémique à dose recommandée.
La souche est résistante si la CMI de l'antibiotique est supérieure à la concentration critique supérieure (C). Il y a alors une forte probabilité d'échec thérapeutique avec cet antibiotique.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines La souche est intermédiaire quand la CMI de l'antibiotique est comprise entre c et C, le succès thérapeutique étant alors imprévisible [48].
La lecture interprétative de l’antibiogramme permet :
De détecter les anomalies d'un phénotype et de les prendre en considération ;
La prédiction de la valeur d'autres antibiotiques ou au contraire les antibiotiques qui ne pourront avoir de meilleure activité ;
La suppression des fausses sensibilités qui en réalité, sous l'influence des mécanismes de résistance impliqués et interférant ne peuvent être valablement retenus pour actifs dans le cadre d'une antibiothérapie. Accessoirement, cette lecture interprétative de l’antibiogramme est un pas dans la surveillance des résistances [51,52].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Problème de la résistance en milieu hospitalier
Pendant longtemps le problème de la résistance était considéré comme strictement hospitalier réservé aux bactéries responsables d’infections nosocomiales, parce que l’hôpital constitue un environnement propice au développement et à la dissémination des résistances bactériennes.
L’émergence et la fréquence croissante à l’hôpital de bactéries multi résistances aux antibiotiques ont été favorisés par un certains nombres de facteurs :
-Une augmentation du nombre de patients à risque infectieux élevé du fait des procédures invasives et des traitements immunosuppresseurs.
-L’utilisation massive des antibiotiques favorisant la sélection des bactéries les plus résistantes.
-La transmission croisée par l’intermédiaire du personnel soignant permettant la dissémination des bactéries multi résistantes.
La recrudescence des bactéries mulirésistantes en milieu hospitalier est un phénomène mondial observé pour toutes les espèces bactériennes mais à des degrés variables selon les pays et les services en fonction des habitudes de prescription et des pratiques d’hygiène.
Le développement et la fréquence des bactéries résistantes parmi les espèces communément responsables d’infections nosocomiales ont eu pour conséquence une consommation accrue de certains antibiotiques, plus précisément les molécules les plus récentes comme les nouvelles β-lactamines, les glycopepetides, et les Fluoroquinolones entraînant ainsi une escalade de résistances [1].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Deuxième partie :
Les Bêta-lactamines
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
I. Introduction :
Les β-lactamines sont les antibiotiques les plus prescrits en médecine générale.
Leur spectre d’activité et leur diffusion sont très variables. Ce sont souvent des molécules à spectre très large dont l’utilisation doit être réfléchie afin de respecter l’écologie bactérienne et d’éviter, ou tout au moins de limiter, la sélection de bactéries résistantes.
Famille d’antibiotiques majeure, elle regroupe les pénicillines, les inhibiteurs de β-lactamases (IBL), les carbapénèmes, les monobactames, Les céphalosporines.
Ces différents groupes se caractérisent par :
• Une structure de base commune : le noyau β-lactame
• Un mode d’action commun : lyse bactérienne par inhibition de la synthèse du protéoglycane par fixation sur les protéines de liaison des pénicillines (PLP) au niveau de la membrane cytoplasmique
• Des mécanismes de résistance bactérienne secondaires à ce mode d’action : production d’enzymes d’inactivation appelées β-lactamases, diminution de la perméabilité de la paroi bactérienne, modification des protéines de liaison des pénicillines, efflux [53].
.
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
II. Classification :
La majorité des β-lactamines, sont classées en fonction de la nature du noyau entrant dans leur structure de base (Tableaux I Aet IIA) [54].
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Tableau IIA. Classification des β-lactamines (céphèmes et oxacéphèmes, monobactames).
La structure du noyau de base, qui comporte toujours le cycle b-lactame, permet de répartir ces produits en trois grands groupes (Fig.14, 15) : les dérivés
______________________________ Antibiorésistance des entérobactéries aux β-lactamines de l’acide 6-amino-pénicillanique, les dérivés de l’acide 7-amino-céphalosporanique et les monobactames.
Cycle commun β-lactame (B)
Dérivés de l'acide 6-amino-pénicillanique
Cycle β-lactame (B) + cycle thiazolidine (A)
• Pénames (pénicillines)
- Pénicillines G et V sensibles aux pénicillinases - Pénicillines antistaphylococciques résistantes aux pénicillinases : pénicillines M semi-synthétiques
- Pénicillines à large spectre (ampicilline et apparentés) et pénicillines actives sur Pseudomonas aeruginosa (carboxypénicillines et uréidopénicillines)
- Amidinopénicillines (pivmécillinam)
- Pénicillines sulfones (sulbactam et tazobactam)
• Carbapénèmes
• Clavames ou oxapénames
- Acide clavulanique
______________________________ Antibiorésistance des entérobactéries aux β-lactamines
Dérivés de l'acide 7-aminocéphalosporanique
Cycle β-lactame B + cycle dihydrothiazine C (noyau céphème)
• Céphalosporines
• Céphamycines
Céfoxitine, céfotétan : radical α-méthoxy en C7
• Oxacéphèmes
Monobactames
Figure 15. Classification des β-lactamines : dérivés de l’acide 7-amino-céphalosporanique et
monobactames.
II.1. Dérivés de l’acide 6-amino-pénicillanique
Il intègre le grand groupe des β-lactamines ayant un noyau péname, caractéristique des pénicillines, parmi lesquelles il y a lieu de distinguer au moins sept sous-groupes différenciés par leur structure chimique, leur stabilité, leur spectre et leur activité antibactérienne. Ce sont (Fig. 14) : les phénoxypéniciIlines et analogues de la pénicilline G, la méthicilline et les