HAL Id: tel-01775710
https://hal.univ-lorraine.fr/tel-01775710
Submitted on 24 Apr 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Caractérisation in situ des degrés d’oxydation III et VI
du chrome à l’état solide par spectrométrie de masse
LAMMA
Serge Gondouin
To cite this version:
Serge Gondouin. Caractérisation in situ des degrés d’oxydation III et VI du chrome à l’état solide par spectrométrie de masse LAMMA. Autre. Université Paul Verlaine - Metz, 1986. Français. �NNT : 1986METZ018S�. �tel-01775710�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le jury de
soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement lors de
l’utilisation de ce document.
D'autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact : ddoc-theses-contact@univ-lorraine.fr
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/V2/leg/leg_droi.php
THESE
p r é s e n t é e à
L'UNIVERSITE
DE METZ
p o u r lrobtention d u g r a d e d e
DOCTEUR DE L'UNIVERSITE DEMETZ
M e n t i o n C I T I M I E M O L E C U L A I R E par
Serge GONDOU lN
M a î t r e è s - S c i e n c e sC A R A C T E R I S A T I O N I N S I T U D E S D E G R E S D ' O X Y D A T I O N
I I I E T V I D U C H R O M E A U E T A T S O L I D E P A R
S P E C T R O M E T R I E D E M A S S E L A M M A
Soutenue Ie 15 juillet 1986 devant ta cornmission d'examen
Président : J.F. MULLER, Professeur à I'Université de li[ETZ
O. EVRARD, Professeur à I'Université de NANCY
i
I
J.J. HEIZIIANN, Professeur à lrUniversité de
F . K I J I N , D i r e c t e u r - A d j o i n t a u L . E . C . E . S .
X86 oS6-t
Examinateurs :
à ma Mère
à lvlonique
R E M E R C I E M E N T S Q u e M o n s i e u r J e a n F r a n ç o i s M U L L E R , P r o f e s s e u r à 1 ' U n i v e r s i t é d e M E T Z , t r o u v e i c i I e t é m o i g n a g e . d e m a g r a t i t u d e P o u r I ' a c c u e i l q u ' i 1 m ' a f a i t a u s e i n d e s o n l a b o r a t o i r e d e s p e c t r o m é t r i e d e m a s s e e t d e c h i m i e I a s e r e t p o u r s e s c o n s t a n t s e n c o u r a g e m e n t s t o u t a u l o n g d e c e t t e t h è s e . J ' e x p r i m e a u s s i t o u t e m a r e c o n n a i s s a n c e a u x m e m b r e s d u j u r y : M o n s i e u r O . E V R A R D , P r o f e s s e u r à 1 ' U n i v e r s i t é d e N A N C Y I ; M o n s i e u r J . l . H E l Z M A N N , P r o f e s s e u r à 1 ' U n i v e r s i t é d e M E T Z ; M o n s i e u r F . K L E I N , D i r e c t e u r - A d j o i n t a u L . E . C . E . S . d e M A I Z I E R E S L E S M E T Z ; M o n s i e u r J . M . M E R M E T , D i r e c t e u r d e R e c h e r c h e a u C . N . R . S . , d ' a v o i r b i e n v o u l u p a r t i c i p e r a u j u r y d e c e t t e t h è s e e t d e j u g e r c e t r a v a i l . J e r e m e r c i e l e L . E : C . E . S . p o u r m ' a v o i r f i n a n c é t o u t a u l o n g d e c e s d e u x a n s d e t r a v a i l . J e r e m e r c i e M M J . A N T O T N E ( D i r e c t e u r d u L E C E S ) , F . K L E I N ( D i r e c -t e u r - A d j o i n -t d u L E C E S ) , O . D E C H E L E T T E (I n g é n i e u r a u L E C E S ) p o u r l a c o n f i a n c e q u ' i l s o n t s u m ' a c c o r d e r e t p o u r l e u r s d i s c u s s i o n s t o u j o u r s f r u c -t u e u s e s -t o u -t a u l o n g d e c e s d e u x a n n é e s . J e r e m e r c i e é g a l e m e n t M o n s i e u r G . K R I E R d u L a b o r a t o i r e d e S p e c -t r o m é -t r i e d e M a s s e e -t d e C h i m i e L a s e r ( M E T Z ) , M e s s i e u r s C . L E C O N T E e t B A Y E U L d u L a b o r a t o i r e d e M i n é r a l o g i e e t d e C r i s t a l l o g r a p h i e ( N A N C Y ) , M o n s i e u r JEANNOT du Laboratoire de Chimie Minérale (NANCY ) , M o n s i e u r l . D R U S d e 1 ' E c o l e d ' A p p l i c a t i o n d e s H a u t s P o l y m è r e s ( S T R A S B O U R G ) , p o u r l e u r a i d e q u ' i l s m ' o n t a p p o r t é t o u t a u l o n g d e c e t r a v a i l d a n s l e s d i f f é -r e n t e s t e c h n i q u e s e m p l o Y é e s . M e s r e m e r c i e m e n t s v o n t a u s s i à M a d a m e S . A R N O R L D , à M e s d e m o i -s e l l e -s c . v A N D E N B E R G H E , M . J A E G E R e t M . L A M B O U L E , à M e s s i e u r s c . G I A N C A S P R O , P . N A S S O Y , M . S T A E B E L , E . T O T l N O , J . L . T O U R M A N N e t F . V E R D U N d u L a b o r a t o i r e d e S p e c t r o m é t r i e d e M a s s e e t d e C h i m i e L a s e r p o u r I ' e s p r i . t d ' e n t r a i d e e t d e c a m a r a d e r i e d o n t i l s o n t t o u j o u r s f a i t p r e u v e à m o n é g a r d . E n f i n , e u € t o u t e s l e s p e r s o n n e s q u e j ' a u r a i s p û o u b l i e r , s o i e n t i c i r e m e r c i é e s
Tab1e des matières AVANT-PROPOS
I L E C I I R O M E . . o . . . . . . , . .
I.1 Propriétés physiçfues . . . . L . 2 P r o p r i é t é s c h i n i q u e s . . . .
L . z . L L e c h r o m e t r i v a l e n t . . . . L . 2 . 2 L e c h r o m e h e x a v a l e n t
1 . 2 . 2 . L U t i l i s a t i o n s d u c h r o m e . . . . 1.3 Le chrome dans ltenvironnement
L.4 Toxicologie du chrome et de ses dérivés 1 . 4 . 1 V o i e s d e p é n é t r a t i o n d a n s l r o r g a n i s m e 1 3 3 4 c 5 6 I o . . 9 9 . 1 0 . 1 0 . 1 0
. 1 r
I e s 1 4 1 . 4 . 1 . I P a r v o i e a é r i f è r e . . I . 4 . L . 2 P a r v o i . e c u t a n é e . . 1 . 4 . 1 . 3 P a r i n g e s t i o n . . . L.4.2 Carcinogénicité du chrome cheza a
I I homme
I . 4 . 2 . L M u t a g é n è s e . . . .
1.4.3 Foruration des oxydes ou sels de chrome dans poussières I . 4 . 3 . 1 D a n s l e s f u m é e s d e s o u d a g e . . . . L . 4 . 3 . 2 D a n s l e s p o u s s i è r e s d r o r i g i n e s industrielles t 4 1 5
I.5 Principales néthodes de dosage du chrome . . I . 5 . I M é t h o d e s d r a n a l y s e s c h i m i q u e s 1 . 5 . 1 . 1 C o l o r i r n é t r i e o . . . 1 . 5 . 1 . 2 A b s o r p t i o n a t o m i q u e . . . . 1 . 5 . 1 . 3 R é s i n e s é c h a n g e u s e s d r i o n s 1 . 5 . 1 . 4 C o l o r i m é t r i e s u r r é s i n e é c h a n g e u s e . t 7 . 1 8 . 1 8 . 1 9 . 1 9 d r i o n s t 9
1 . 5 . 1 . 5 C h i n i e l u m i n e s c e n c e a a a a a a
1 . 5 . 1 . 6 C o n c l u s i o n . . . .
L . 5 . 2 M é È h o d e s d r a n a l y s e p h y s i c o - c h i n i q u e s
EÎUDE DES MEcAI.IrsMEs D ' roNrsATroN DE rÀ pHÀsE soLrDE 26 2 . 1 I n t é r a c t i o n l a s e r m a t i è r e . . . 2 7 2 . L . I E q u i l i b r e t h e r m o d y n a n i q u e 1ocal (L.T.E. ) 2 7 2 . 1 . 1 . 1 T e r n p é r a È u r e a u p o i n t d r i n p a c t d e l a . c i b r e 2 9 2 . L - r . 2 A b s o r p t i o n d e lrénergie en phase gazeuse 33 2 . 1 . 1 . 3 E f f e t B r e m s t r a h t u n g inverse 3 4 2 . L . I . 4 E f f e t J o u l e . . . . . . . 3 5 2 . 1 . 1 . 5 p e r t e s é n e r g é t i q u e s . . . . . . 3 g 2 . L . I . 6 C o n c l u s i o n . . . o . . . 3 9 2 . ! . 2 F o r m a t i o n d,es clusters . . 4 0 2 0 2 2 2 3
CÂRÂCTERISATION DES ETATS D'OXYDATION IIT ET VI DU CHROME PAR MICROSONDE A IMPACT IÀSER I,AMMA
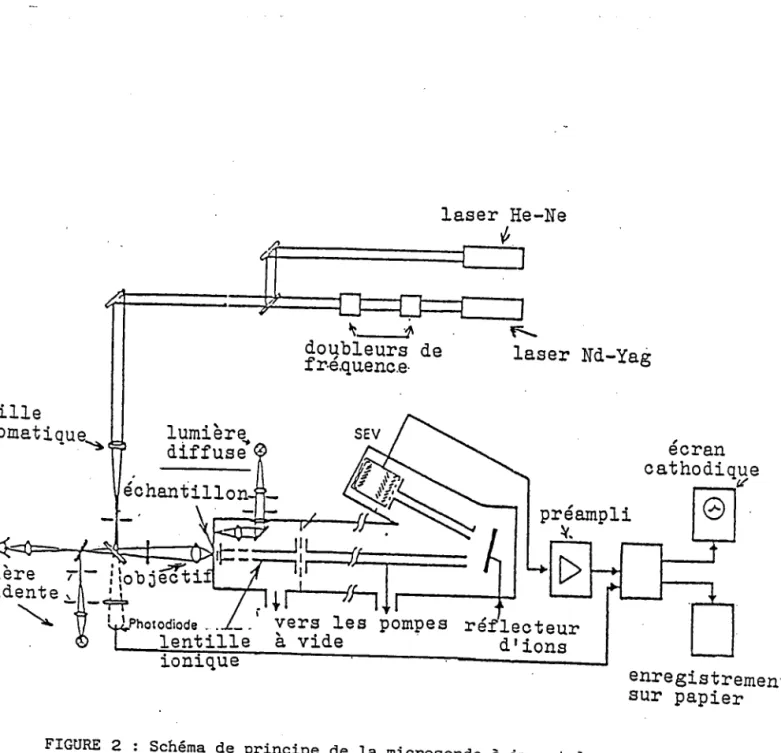
3.1 La microsonde à impact laser LAMMA . . . . . 3 . 2 M o d e d r é c h a n t j . I l o n n a g e . . . . . . 3 . 3 I n f l u e n c e d e l t é n e r g i e l a s e r . . . . 3.4 Rappel bibliographique sur les ions clusters
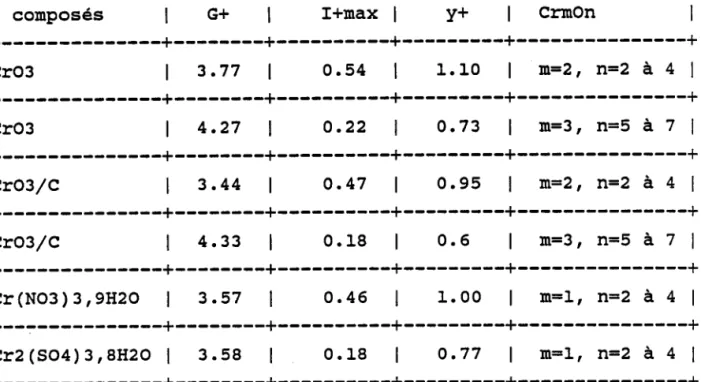
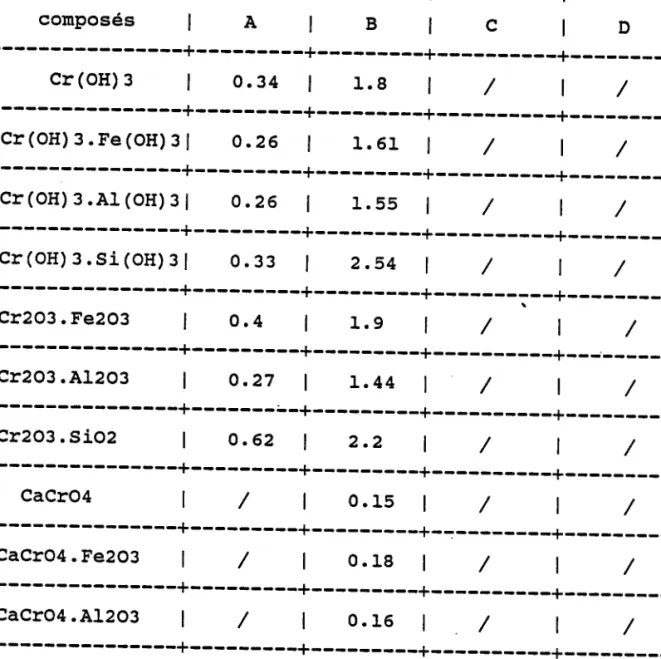
3 . 4 . 1 D é f i n i t i o n . . . . . . . . 3 . 4 . 2 S È a b i l i t é d e s i o n s c l u s t e r s . . . . 3 . 4 . 3 M o d è l e d e v a l e n c e . . . . 3 . 4 . 4 A n a l y s e d e s s e l s e t o x y d e s d e a a a a chrome de 4 5 . 4 6 . 5 1 . 5 2 . 5 8 . 5 8 . 5 9 . 6 0 6 1 référence
3 . 4 . 5 P r é p a r a t i o n d e s composés du chrome sur matrice 6 1 3 . 5 M é t h o d o l o g i e . . . . . . 6 3
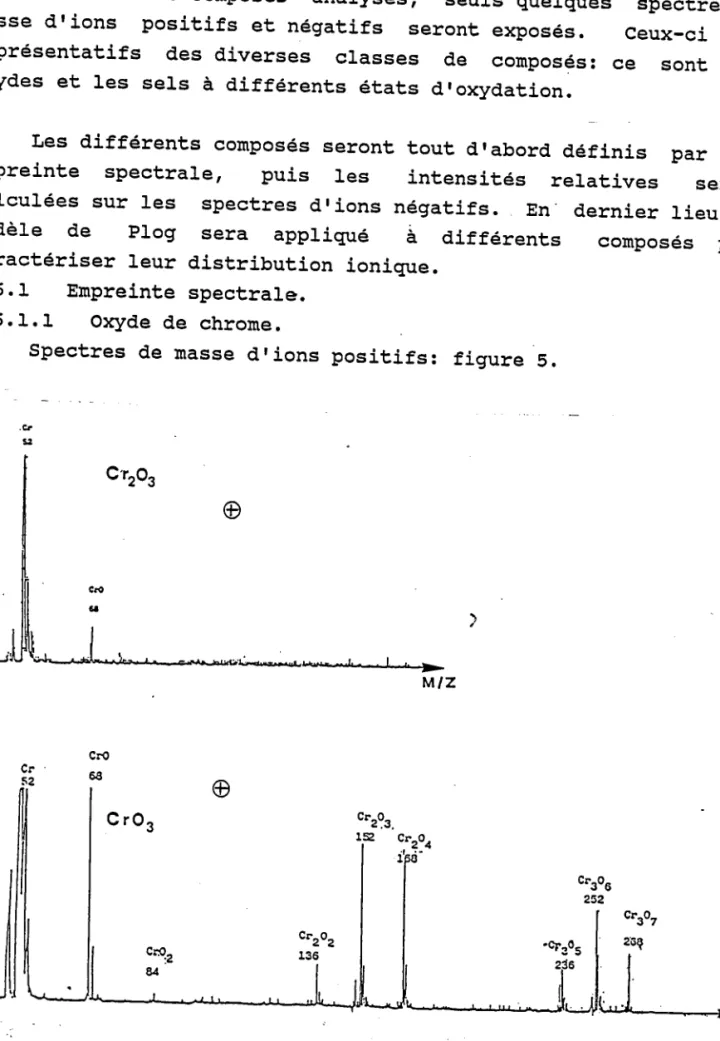
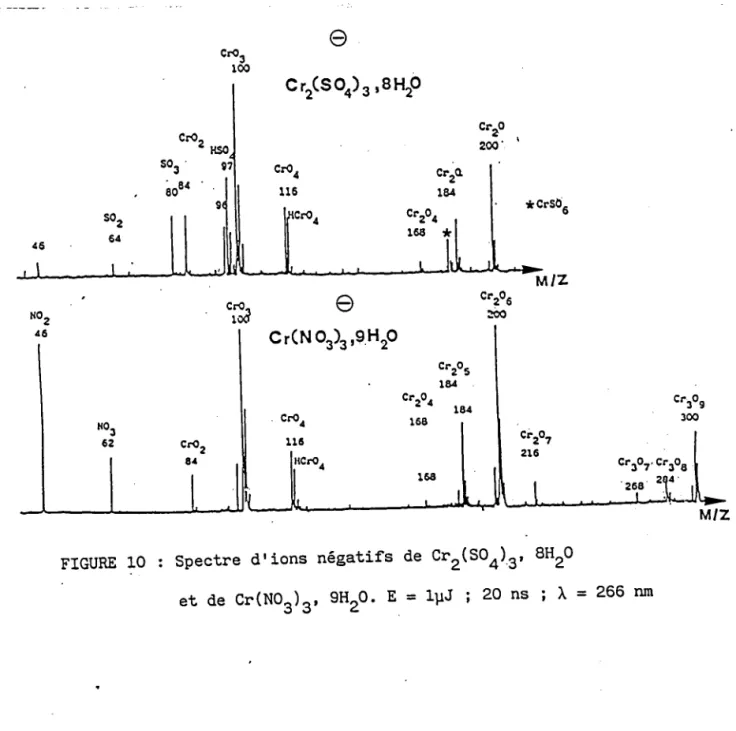
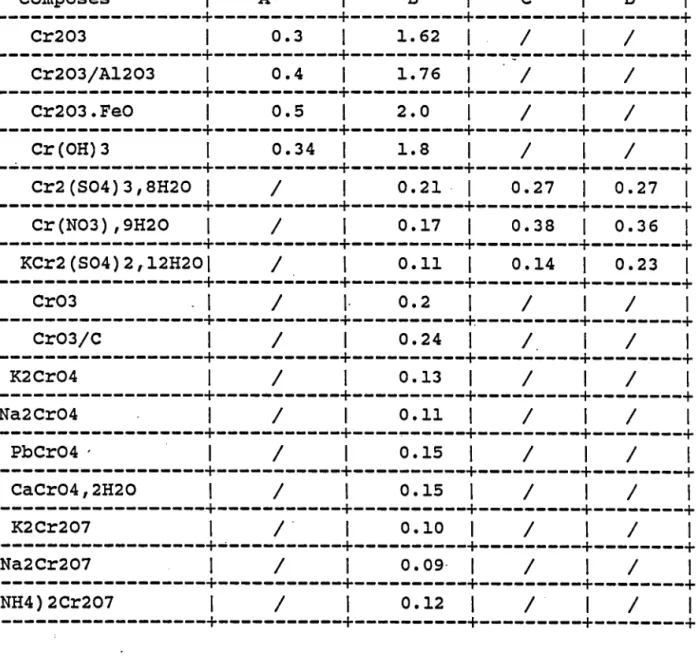
3.6 Résultats expérimentaux . . . . 3 . 6 . 1 E r n p r e i n t e s p e c t r a l e . . . . 3 . 6 . 1 . 1 O x Y d e d e c h r o m e . . . . 3 . 6 . L . 2 S e l s d e c h r o n e V I . . . . 3 . 6 . 1 . 3 S e l s d e c h r o m e I I I h y d r a t é s . 3 . 6 . 1 . 4 S e l s d e c h r o m e t r o i s t y p e s p i n e l l e 3 . 6 . 1 . 5 C o n c l u s i o n . . 3 . 6 . 2 I n t e n s i t é s r e l a t i v e s . . . . 3 . 6 . 2 . I M o d è l e d e v a l e n c e . . . . 3 . 6 . 2 . 2 R é s u l t a t s d e s c o m p o s é s d u c h r o m e matrice
CARACTERISATION DES COMPOSES DIORIGTNE SIDERIIRGIQUE 4 . L E c h a n t i l l o n d e r é f é r e n c e . . . . 4 . 2 D i f f u s i o n R a m a n . . . . . . . . o . . . . 4 . 2 . 7 , R é s u l t a t s . . . . 4 . 2 . 2 C o n c l u s i o n . . . . 4 . 3 D i f f r a c t i o n d e s r a y o n s X . . . . . o 4 . 3 . I R é s u l t a t s . . . . 4 . 3 . 2 R e m a r q u e . . . ' ' ' ' 4 . 3 . 3 C o n c l u s i o n . . . . 4 . 4 I n f r a - R o u g e à T r a n s f o r m é e d e F o u r i e r I . R . T . F ' 4 . 4 . L o r i g i n e d e s b a n d e s d e v i b r a t i o n s . . 4 . 4 . 2 P r i n c i p e d , e l r a p p a r e i l . . . . '-' :: 'f'l sur 6 4 6 4 6 4 6 6 5 8 7 0 7 3 7 4 8 0 8 7 9 8 9 9 9 9 r 0 0 L02 r 0 2 1 0 5 1 0 7 r 0 7 1 0 8 r 0 8 r15 3 . 7 l o n i s a t i o n r é s o n a n t e . . . . . . 3 . 7 . L R é s u l t a t s . . . o . . o . . . . . 3 . 7 . 2 C o n c l u s i o n . . . o . . . . 9 3 9 3 9 6
t 4 .4.3 Résultats extrlérinentaux. . 4 . 4 . 4 C o n c l u s i o n . . . . 4.5 Spectroscopie photo-électronique 4 . 5 . 1 R é s u l t a t s . . . . ou sidérurgigue d I oxydation E . S . C . À . IIf et Vf 1 1 7 L24 L25 r27 1 3 0 1 3 1 L32 1 3 s L44 1 4 5 4 . 5 . 2 C o n c l u s i o n . . 4 . 6 A n a l y s e d e s composés IÀMMA 4 . 6 . L R é s u l t a t s . . 4 . 6 . 2 f d e n t i f i c a t i o n du chrome a a o a a d I origine a a a a a des états 4 . 6 . 3 C o n c l u s i . o n . . 4 . 7 C o n c l u s i o n r e l a t i v e a a a a a a
aux techniques analytiques . . .
CONCLUSION GENERALE BIBLIOGRAPHIE
Par contre, cette investigation peut être thodes spectroscopiques adaptées à 1rétat particulièrement avec I t aide d,es microsondes.
rnenée avec les né-solide et plus
Malheureusement, Iorsque les analyses composés bruts ou sur des échantillons toujours délicat dtobtenir une réponse guantifiable.
sreffectuent sur des hétérogènes, il est spectrale ponctuelle
Pour notre part, nous avons tenté dtidentifier les états dro-xydation du chrome en phase solide à Itaide d,e diverses techniques spectroscopigues telles que lrinfra-rouge à transformée de Fourier, la spectroscopie photoéIectronique, la diffraction d,es rayons x ou à rraide de microsondes Raman ou à irnpact raser.
Nous avons testé ces différenÈes technigues et cherché à éla-borer une méthodologi.e qui puisse être appliquée aisément sur divers nratériaux de 1renvironnenenÈ sidérurgigue ou sur des déchets drorigine industrielle. Lressentiel de notre Èravail a porté sur Irélaboration drune rnéthod,ologie pour lranalyse in situ des degrés dtoxydation du chrome par nicrosonde à inpâct laser IÀMMA.
Les résultats acquis ont toujours été conformes à ceux obte-nus sur les nêmes échantillons par les méthod,es nentionnées auparavant afin dravoir des critères permettant drévaluer Ie degré de confiance des mesures. 11 est en effet reconnu gu,il faut toujours combiner plusieurs Èechniques lorsque lron veut caractériser un composé aussi comprètement que possible.
AVAIIT PROPOS
Lorsque les biologistes ont découvert que certaines maladies étaient liées à la présence dans lrenvironnement de métaux sous divers états dtoxydation, Ia caractérisation non ambigruë et les techniques de dosages précises de ceux-ci ont pris un regain d r i n p o r t a n c e
En effet, Ie contrôle des déchets dtorigine urbaine ou indus-trielle susceptibles de contenir des composés pouvant, êÈre des vecteurs cancérigènes ou mutagènes pour lrhomme et son envirohnement devenait une nécessité.
Malheureusement, si le dosage et Itidentification de ces é1é-ments sont relativenent aisés tant par des nréthodes chiniques çlue p h y s i c o - c h i m i q u e s , i l n f e n n r e s t p l u s d e m ê m e lo r s q u t i l s t a g i t d e caractériser ceux-ci dans leurs divers états d,roxydation.
Si les néthodes chiniques classiques dites par voie hunide pe:mettent Itidentification et Ia quantification de ceux-ci l o r s g u r i l s s o n t e n s o l u t i o n , c e l a n r e s t p l u s v r a i l o r s q u e I e composé à doser est dans sa phase solide et qui plus est en présence drune matrice pouvant rnodifier ses états droxydation lors de Ia phase de ninéralisation de 1téchantillon Ie rendant soluble.
De plus, les techniques par voie hunide ne permettent pas dt identifier Ifenvironnement chiniEre de ces élénents, Iesguels peuvent influer sur son évolution lors de stockages dans des décharges eu sur des crassiers.
Par contre, ceÈte investigation peut être thodes spectroscopiques adaptées à IréÈat particulièrement avec ltaide des microsond.es.
menée avec les né-solide et plus
Malheureusement, lorsque Ies analyses sreffectuent sur des composés bruts ou sur des échantilrons hétérogènes, il est toujours déIicat drobtenir une réponse spectrale ponctuelle quantifiable.
Pour notre part, nous avons tenté dtidentifier 1es états dro-xydation du chrome en phase solid,e à I t aid,e de diverses techniques spectroscopiqrres telles que I I infra-rouge à transformée de Fourier, la spectroscopie photoélectronigue, 1a diffraction des rayons x ou à lraide de nicrosondes Ranan ou à irnpact laser.
Nous avons testé ces différentes techniqrles et cherché à éla-borer une méthodologie qui puisse être appliquée aisément sur divers nrat,ériaux de I I envj.ronnement sidérurgigue ou sur des déchets dtorigine industrielle. Lressentiel de notre travail a porté sur 1'éIaboration drune néthodologie pour Iranalyse in situ des degrés dtoxydation du chrone par microsonde à irnpact laser I,AMMA.
Les résuLtats acquis ont toujours été conformes à ceux obte-nus sur les mêmes échantillons par les méthodes mentionnées auparavant afin dravoir des critères permettant drévaluer le degré de confiance des mesures. 11 est en effet reconnu guril faut toujours conbiner plusieurs techniques lorsque rron veut caractériser un composé aussi courplètement que possibre.
-L L E C H R O M E . . . . . . . 3 1.1 Propriétés physiçlues . . . o o . . o . . . . 3 J-.2 Propriétés chiniçlues . . . 4 1 . 2 . 1 L g c h r o m g t r l v a l g n t . . . . . . . . 5 L.2.2 Lg chrome hexavalgnt . . . I . . . s L . 2 . 2 . L U t l l l s a t L o n E d u c h r o m e . . . o . 6 1.3 Le chromg dans llenvironnement . . o . . . I 1.4 Toxicologie du chrome et de ses dérivés . . . 9
1 . 4 . 1 V o i e s d e p é n é t r a t l o n d a n s l t o r g a n i s n e . . . 9 1 . 4 . 1 . 1 P a r v o i g a é r i f è r g r . . . 9 1 . 4 . 1 . 2 P a r v o i . g c u t a n é g . . . 1 0 1 . 4 . I . 3 P a r i n g e s t i o n . . . o . . I O 1.4.2 Carcinogénicité d,u chrone chez lthomme . . . 10 l . 4 . 2 r l M u t a g é n è s e . . . I l 1.4.3 Fornation des oxydes ou sels de chrome dans les 14
poussières
1 . 4 . 3 . 1 D a n s l e s f u m é e s d e s o u d , a g e . . . . . L . 4 . 3 . 2 D a n s l e s p o u s s i è r e s d t o r i g i n e s
Lndustrielles
1.5 Princlpales méthodes d,e dosage du chrome . . . . 1.5.1 Méthodes dranalyses chiniçlues . . . .
I 4 1 5 I . 5 . I . l C o l o r i n é t r i g . . . . . . . . . . . . 1 . 5 . 1 . 2 A b s o r p t i o n a t o n J . q u e . . . . L7 1 8 1 8 I9 1 . 5 . 1 . 3 R é s i n e s é c h a n g e u s e s d r i o n s . . . 1 9 1.5.1.4 ColorinétrLe sur résine échangeuse dtions 19 I . 5 . 1 . 5 C h l n l e l u m i n e s c e n c e . . . 2 0 1 . 5 . I . 6 C o n c l u s i o n . . . 2 2 1 . 5 . 2 M é t h o d e s d r a n a l y s e p h y s l c o - c h l n i q u e s . . . . . 2 3
LE CHROME CHAPITRE I
Les principales caractéristiques du chrome sous ses diffé-rents états dtoxydaÈion sont répertoriées pour mémoire ci-après, de même que les différents problèmes tiés à leur toxicité. En outre, nous développerons également les mécanismes de formation permettant de comprendre Ia présence de cet éIénent à différents états dtoxl;dation dans les rejets drorigine industrielle et plus particulièrement dans ceux dtorigine sidérurgique.
L. I Propriétés PhYsiç[ues
Le chrome (Cr) est un élément de transition qui appartient, avec Ie molybdène et Ie tungstène, au groupe VI A de la classification périodigue des éléments.
Nnméro atonique 24 M a s s e a t o r n i q u e 5 1 . 9 9 6 D e g r é s d t o x y d a t i o n - 2 , 0 , I , 2 t 3 t 4 , 5 , L e s p l u s s t a b l e s 0 , 3 , 4 , 6 Température de fusion 1903'C Température dr ébullition 2480' C D e n s i t é 7 . L 4 I s o t o p e s n a t u r e l s n o n r a d i o a c t i f s 5 0 ( 4 . 3 I 8 ) , 5 2 ( 8 3 . 7 6 ) 5 3 ( 9 . 5 5 t ) , 5 4 ( 2 . 3 8 8 )
Leur répartition informatisée est d'onnée par la figure I
o = +) n N -1 0 0 9 0 8 0 70 6 0 5 0 4 0 3 0 : 2 0 l 0
t l r
+
F I r::E
0 so s.t s2 ss dmasse-rapport isotopique informatisé du chrome
FIGURE 1 :
I s o t o p e s r a d i o a c t i f s 4 8 , 4 9 , 5 I , 5 5 e t 5 6
L t i s o t o p e radioacÈif ( 5 1 ) émet une radiation y d'énergie 3zo M e v e L sa durée de derni_vie e s t d e 2 7 . B j o u r s . 1 1 e s t principalement uÈilisé pour le dosage
d.u chrome en rnilieu b i o l o g i g u e .
1.2 Propriétés chirnicrues
setrls seront ici décrit,s I"es deux états droxydat,ion les plus fréquernment rencontrés, crest-à-dire res état,s +3 et +6 d,u chrome.
L.2.L Le chrorne trivalent
C t e s t l t é t a t d t o x y d a t i , o n l e p l u s s t a b l e . L r i o n t r i v a l e n t n r e -xiste pas en solution açfueuse à cause de sa forte tendance à forner des conplexes de coordination et des chéIates. Les molécules d,reau serrrent de ligant et se recombinent au chrone trivaLent pour donner des complexes octaédriçlues de couleur v i o l e t t e ( C r ( H 2 O ) 6 C 1 3 ) .
Les sels chromiqr:es sont des halogénures (le plus souvent C l 3 C r ) r o u d u s u l f a t e d e c h r o m e C r 2 ( S O 4 ) 3 , c r i s t a l l i s é e n g r o s octaèdres violets, se comportant comme Ie sulfate draluminium et pouvant donner des aluns.
Les sels chromiques sont ernployés comme mordants pour Ia peinture et le tannage des Peaux.
L . 2 . 2 L e c h r o m e h e x a v a l e n t
Les dérivés du chrome VI sont fortement o4;dants. On d.istin-gue :
les chromates CrO4--, généralement jaunes. Les chromates al-calins, solubles dans lreau, sont obtenus à partir de la chromite, calcinée vers IOOO'C en présence de carbonate de sodium. Les chromates alcalino-terreûx sont très peu solubles (surtout BaCrO4). Le chromate de plomb insoluble est utilisé comme pignnent.
- Ies dichrornates Cr2O7--, dê couleur orange. Ils sont obtenus à partir de chromates en nilieu acide.
bichro-mate de sodium par Iracide sulfuriqrre. r o u g e s s o l u b l e s dans lreau.
f1 forrne des aiguilles
1 . 2 . 2 . I U t i l i s a t i o n s d u c h r o n e
Les utilj-sations du chrome, aujourdrhui., sont très diversifi-ées. une étude réalisée par stern (1) indique sous forme de dia-gramme quels sont les produits et alliages nétalliques fabriqués à partir de la chronrite naturelle (cr2o3 Feo).
sur le tableau I, on peut voir quelles sont les principales activités ind,ustrielles responsables de rejets contenant du chrone et ses d,érivés ainsi çtoe les activités professionnelres presentant un ri.sque dtexposj.tion au chrome.
Les industries les plus particulj.èrement concernées sont 1es industries de tannage, de chronage et des aci.ers i.nox.
H i n e r a i : Chronite . ( F e , l l 9 ) 0 ( C r , F e , A l ) 2 0 3
c
AI s i G r i l la g e a v e c > 2 r c l < 2 / c Chromate de Sodium lla2Cr0q Ferrochromes Traitement par (NH'{)zS0'{ + H2SOe F i l t r a t i o n e t . 0 i c h r o m a t e d e Sodium N a 2 C r 2 0 7 , 2 H 2 0 i> Réducti on N a 2 C r 0 3+ C a O ' { t r a i t e m e n t p a r H2S0q Fusion avec S e t F i l t r a t i o n P r o c é d é s d i v e r s a v e c H2S0q T a n n a g e IA
lectrolyse Electro'lyse R é d u c t i o n Chromage À A l l i a g e s a v e c l e s a c i e r s Procêdês de Purification TABLEAU I : Diagrammedérivés. Les procédés
Lami nage f.la rte I age H o u l a g e C o u l a g e
F> so;auliolil!1."'
simplifié de Ia producti_on. du chrome et de ses
pour lesquels existe un risque d'exposition A l u n d e C r e t d rArmonium N H r , C r ( S O q ) 2 , 1 2 H 2 0 Liqueur basique d e C r ( I I I ) Cr E'lectrolytique Cr nÉtal Chroræ ductile P r o d u i t s s p é c l a u x
1.3 Le chrone dans lrenvironnement
Le chrome dans Irenvironnement provient de différentes sour-ces d'e plus ou moins grande inportance qui sont :
Ies sources naturelles (ninerai)
les productions ind,ustrielres d, I aciers spéciaux res utilisations industrielles (tannage, chromage)
lrexploitaÈion des combustj.bles fossiles (par exemple Ie charbon)
Le chrone énj-s dans lratmosphère est dt principalement à ra production des ferrochromes et à rraffinage des métaux.
De prus, drautres activités indusÈrj.elles contribuent à cette charge at'nosphérique dans un degré noindre, telles que 1es ind,ustries chimiques et des réfractaires, ainsi que les sources indirectes comme la combustion du charbon (environ 60 ppru) par exempre.
Le chrone dans les eaux est d,t principalement aux rejets des eaux usées des industries de chromage et de tannage, dont celles-ci contiennent des quantités assez irnportantes en chrorue
( d e 10 à 300 ppn). r l s t y t r o u v e ra plupart d u t e n p s
s o u s s a forme hexavalente.
Les valeurs limiÈes des composés cornportant d,u chrome à 1r é-tat droxydation vr soluble ou partiellement solubLe ont
ét,é fi-x é e s à 0 . 0 5 mg par m3 (2) d,ans rrair et à 50 ppb dans res eaufi-x p o t a b l e s ( 8 ) .
1.4 Toxicologie du chrorne et de ses dérivés
La nocivité du chrome varie suivant ses différents états dro-xydation (3). loutes les études se rapportant à la toxicité du chrome sraccordent à considérer les états dtoxydation III et VI comme les plus dangereux pour lrhornne et son environnement (1) (4)
( 5 ) ( 6 ) ( 7 ) .
, Depuis quelques années, les recherches entreprises ont pe:mis d.e d,érnontrer gue les dérivés hexavalents, inpliqués le plus sou-vent dans des intoxications aiguës ou à long terme, étaient da-vantage toxiques que les dérivés trivalents.
Cette nocivité peut se manifester de plusieurs manières: elle peut provoquer des lésions pulnonaires, cutanées ou des troubles gastriques par ingestion.
I . 4 . 1 V o i e s d e p é n é t r a t i o n d a n s l r o r g a n i s m e
1 . 4 . 1 . 1 P a r v o i e a é r i f è r e
Ctest Ia voie principale de contamination chez les sujets ex-posés de par leur profession. Le risque toxicologique dépend à la fois de Ia taille des particules inha.lées et de la solubilité du sel ou de lroxyde de chrome dans lreau.
Pour les dérivés très solubles, Ia distribution granulométri-çJue des poussières est moins importante que pour des composés renfermant des produits insolubles.
particules joue un rôle prépondérant. En effet, cerles de dia-nètre supérieur à 5 urn restent dans les voies aérifères supéri-eures (bouche, fosses, nasales) tandis que celles dont la Èail1e sréchelonne entre 2 et 5 um pénèt,rent dans lrarbre bronchiÇluê, et que res plus petites aÈteignent ra région alvéoraire.
L . 4 . L . 2 P a r v o i e c u t a n é e
Les dérivés hexavalents du chrome aÈtaquent la peau et provo-quent des ulcères, des dermatoses ou de Itirritation chronique. Leur pénétration est dix nille fois supérieure à celle d,u chrome trivalent(8). Cette pénétration d.épend de Ia concentration: eIIe est relaÈivement plus faibte pour les concentrations élevées que p o u r les basses.
Après passage à travers la peau, Ies d,érivés hexavalents sont réduits en dérivés trivalents par les acides aninés soufrés ou par l r a c i d e l a c t i q u e .
or Ie chrome sous sa forae trivalente se lie dix fois plus fac j-Ieruent aux protéines du sang çlue sous sa forrne hexavalente. 1 . 4 . 1 . 3 P a r i n g e s t i o n
Cinq à huit centigrammes de dichromate de potassium provo-quent des troubles gastriques, et la dose la prus faible çri ait entraÎné la nort pour un homrne est dtenviron 30 centigrammes.
De pIus, les intoxications par re dichromate de potassium lranhydride chronique entrai.nent des insuffisances rénales.
I.4.2 Careinogénicité du chrome chez Irhomme
Lrévidence du risque carcinogène chez lthoni:me en contact avec Ie chrome sous ses fotmes variéesr ên particulier hexavalenter rrê
L.4 Toxicologie du chrome et de ses dérivés
La nocivité du chrorne varie suivant ses différents états dfo-xydation (3). Toutes les études se rapportant à la toxicité du chrome sraccordent à considérer les états dtoxydation III et VI comme les plus dangereux pour lrhomme et son environnenent (1) (4)
( s ) ( 6 ) ( 7 ) .
, Depuis quelques années, Ies recherches entreprises ont pe:mis de démontrer que les dérivés hexavalents, irnpliqués Ie plus sou-vent d.ans des intoxications aig"uës ou à long terme, étaient da-vantage toxiques çlue les dérivés trivalents.
Cette nocivité peut se nanifester de plusieurs manières: elIe peut provoçluer des lésions pulmonaires, cutanées ou des troubles gastriques par ingestion.
1 . 4 . 1 V o i e s d e p é n é t r a t i o n d a n s I r o r g a n i s m e
1 . 4 . 1 . I P a r v o i e a é r i f è r e
Crest Ia voie principale de contamination chez les sujets ex-posés de par leur profession. Le risque toxicologique dépend à Ia fois de Ia tailIe des particules inha.Iées et de la solubilité du sel ou de lroxyde de chrome dans lreau.
Pour les dérivés très solubles, Ia distribution granulométri-que des poussières est moins irnportante que pour des composés renfer:mant des produits insolubles.
particules joue un rôle prépondérant. En effet, cerles de dia-mètre supérj.eur à 5 um restent dans les voies aérifères supéri-eures (bouche, fosses, nasales) tandis que celles d,ont ra tairle sf échelonne entre 2 eE 5 um pénètrent dans lrarbre bronchiÇluêr et que res plus petites atteignent ra région alvéorai.re.
L . 4 . L . 2 P a r v o i e c u t a n é e
Les dérivés hexavalents du chrome attaquent la peau et provo-quent des u1cères, des dermatoses ou de ltirritation chronique. Leur pénétration est dix mille fois supérieure à celle d,u chrome trivalent(8). Cette pénétration dépend, de Ia concentration: elle est relativement plus faible pour les concentrations éIevées que p o u r les basses.
Après passage à travers la peau, les dérivés hexavalents sont réduits en dérivés trivalents par les acides aurinés soufrés ou par I I a c i d e l a c t i q u e .
Or le chrone sous sa forme trivalente se lie facirement aux protéines du sang çlue sous sa forme
1 . 4 . 1 . 3 P a r i n g e s t i o n
Cinq à huit centigrammes de guent des troubles gastriques, et entrainé la nort pour un honne est
dix fois plus hexavalente.
dichronrate de potassium provo-la dose provo-la plus faible qui aiÈ drenviron 30 centigrarnmes.
De plus, Ies intoxications par le dichromate de potassium ou lranhydride chrornique entrainent des insuffisances rénales.
1 . 4 . 2 C a r c i n o g é n i c i t é d u c h r o n e c h e z Irhomme
Lrévidence du risque carcinogène chez Ithoninre en contact avec le chrome sous ses fotmes variéesr ên particulj.er hexavalenter 1ê
Les principales industries concernées sont: lrindustrie rné-tallurgigqe, Itindustrie chinique, Iê fabrication des pigments et des peintures à base d.e chromates, êt ltindustrie du chromage'
L . 4 . 2 . L M u t a g é n è s e
Les arguments en faveur du passage obligatoire de Ia routation d,e 1rÀ.D.N. (acide déoxyribonucléique) avant Ia cancérisation' sous lraction d,u carcinogène, sont tels que la najorité des auteurs sont draccord sur ltinportance des mécanismes génétiques dans Ie processus de cancérisation (mutations génétiques des cellu1es Procaryotes et Eucaryotes) '
cependant, iI faut noter qurune substance non mutagène peut peut être carcinogène et réciproquement'
Les ctrro nates sont mutagènes pour Escherichia coli, pour sal-monella Thlphirium dans Ie test de Ames et entrai'nent des pertur-bations dans ra réparation de rrÀDN de Bacirrus subtiris (7) (9)
( r 0 ) .
fait actuellement aucun doute (4) biologistes dénontrèrent lrexistence
I t apparition d,es cancers du poumon et dans des usines de chromates'
Les ctrromates semblent être te sans qurune activation Par n é c e s s a i r e .
( 7 1 ( 8 ) , d e P u i s q u e l e s de corrélations entre I t extrlosi.tion des ouvriers
des mutagènes Par lraction direc-des fractions roicrosomales soit
sernblent en général avoir une activi-dans les sYstènes bactériens'
Les sels de Chrome III té rnutagène faible ou nulle
; ^t FI ^ I Fi ^ I ât ^ eae vY'9 A,À+J 'r-'l O >+J-! qq 6 m 8.9 tQ) tr O x:4 4 È -(I'00
a"
g
va t4 H€ .. +J Z ?^ 'o 5 a .Q.O_' H I(D FJ È{ |1ç.of-'r a a +l)À 9 '' o 'z F'-(/ioa Y.a+rgS * $i É ctF{ I "-i (D .il !ÉÉ,3$.9ÈË
.e?'3i?g'X
a
!
8.9
,t:a+Jlr,.{4J .hq@oid Ë 5 a à.h ,^1+t EË v.vtd (l)ro!"i ELiD 'lv t!t-tFoi gao6 J .- - -9ldt^ "l v, ,= ,\ .çç o ËE 'd C .r.{ ,8fÆfie? è0a-XX .^9o.iû jr+l.o.n ,9Y27o6 HJé-q a o ô,ô ru#n,-{b0 !)Ëa,gg3
! '9, h ,q .q) .g: - = E 5t+<Êl Ula g.6.oo! H V V v ; td Fl E4 ,"L C'L.lt r4, eg oqrx -:tËss
vl ,VC ?+r(u PFE,sa:'
-g rq, Ft-F. F.all eômrNNcrlrt Èl Fl I tô € ttt' f- \a \o cn N c,r ,-r .-r r-. F. È. FIN +++ +.+ + | cn aÊt ZD oo HH E<= r{o HE FIO () I (t.L r(U +) +++++++++++++
+
tn Ê: z5 oo HH E{ E{ EiZ =CJ + ++++++ ++++ t t..t t t t +++ +++ û z oz Fr E-t Fl (âl I CrF IË gëËËe
+ +l+ I t*tt + + +t+t+ t + ++++++r | |It+ t+++ t++n+ èè ôô8gg
ùôôFgsS
ttg
ù(5ù
Faâ èËË(3ôù
ùùÊaâ
eitia ûôù3
rÊrdq
."-$ËgE
E E
o'
ô ,-a' zgsgË
Le tableau 3 propose un schéma possible tentant d.texpliquer et de résumer le mécanisme de la carcinogénicité du chrome hexavalent (7) . I1 apparait que les sels ou oxyd,es d,e chrome VI sont surtout dangereux parce gutils traversent plus facileroent les parois cellulaires, bien qutils soient plus volumineux (du fait de
la présence des atomes d.toxygène) que les dérivés du chrome III. '
Par contre, après Ie passage à travers Ia membrane cellulai-tèt ils sont rapidenenÈ réduits en chrome III, Iequel se fixe probablernent sous la forme ionique Cr3+. Crest donc en définitive la forme réellement active du chrome.
v r u t e u E X T R e c E L L U L n t n E C É L L U L A I R EM É M E R A N E Captago par la systèmc Nucléophiles der lÂrcromolécglcs cr3t -DNA collulairor çr3* -trotdirq Mub,tion lnhibition
schéma simplifié de Ia carcinogénicité du chrome vI d'après I'lercier (8) 3 i Microsomos + NADPH do tnnsport der sulfates SfstÀnp réércteur extracallulairo C A N C Ë R TABTEAU
1'4'3 Formation des oxydes ou sels d,e chrome dans les poussières
Lorsque la toxicité des dérivés du cr rrr et d,u cr vr est ap_ parue comne patente, de nombreuses équÀpes se sont penchées sur r | étude de ra foraation de ceux-ci dans les fumées (plus particulièrenent de soudage) ou dans les déchets
drorigine sidérurgigue. cette approche est fond,amentale si lron
veut dans lravenir être en mesure de réduire leurs émissi.ons.
La fo:mation de ces courposés dans les fumées d,e dans les déchets d r origi.ne sid,érurgique sont décrits ment.
soudage et
respective-1 . 4 . 3 . respective-1 D a n s l e s f u m é e s d e s o u d â g e
\ ,
suivant le mode de soudage emproyé MMA ( Manual Metal Arc )ou MIG( Metal rnert Gas ), Ia quantité de chrome soluble dans lreau v a r i e é n o r r n é m e n t (10) (11) (12).
Les techniques analytiques ernployées dans cette étude pour caractériser les poussières sont
la colorirnétrie avec rnise en solution acide ou basique pour déterminer les quantités de chrome soluble ou insolubre.
1 r é n i s s i o n d e s r a y o n s x i n d u i t e p a r p r o t o n s p . r . x . E . ( 1 g ) (58) pour lrobtention du chrome total et Ia diffraction des rayons x afin de caractériser les éléments associés aux principaux éIéments recherchés(Fe, Cr) .
Deux aciers alliés identlEres ont, été utilisés par d.eux mé-thodes de soudages différentes.
Dans le chrome présent, dans res furnées d,e soudage MMÀ, on trouve environ 5 à 338 de cr (rII) ou rnétallique insoluble d.ans l r e a u , e È 67 à 958 dans la forme cr (vr), insoluble d,e o à r3&.
pour les firmées recueillies dans Ie procédé MIG (Argon+I/2O2) le chrome présent conporte 98 à 99* sous sa forme III ou nétallique totalement insoluble et 1 à 28 dans Ia forme VI dont 60 à 9Ot est soluble dans lreau. Les funées MlLA contiennent des chromates ou des dichromates de sodiun et de potassir.rm tandis que les fgmées MIG ont un degré de cristallinité éIevé indiquant Ia p o s s i b i l i t é d r ê t r e d e s c o m p o s é s s p i n e l l e s C r - F e .
La forrnation du chrone VI est proportionnelle à la quantité d t o x y g è n e i n È r o d u i t e d a n s I r a r c é l e c t r i q u e ( M I G ) .
La quantité de chrome VI soluble dans les différents modes de soudage est due à la composj-tion de lrenrobage des baguettes de soudure, Iesquelles contiennent beaucoup de sodium et de potas-s i u m .
Dans le procédé MIG, toutes les particules possédant du chro-me contiennent également du fer et de Ia silice, rnais 30* contien-nent soit du nickel, soit du manganèse, mais pas les deux en mêrue tenps.
Dans les poussières venant des funées produites par le procé-dé MMA, toutes les particules contenant du chrome ont en. même t e m p s C â , A l , S e t T I .
L . 4 . 3 . 2 D a n s l e s p o u s s i è r e s d r o r i g i n e s i n d u s t r i e l l e s
Lors de Ia fabrication des aciers alliés, les fumées draéro-sols néta11içpes se produisent à des ternpératures supérieures à I8OO.C. A ces teurpératures, Ies composés de chrôme hexavalents ne sont pas stables.
II est plus vraisemblable lent interryient aPrès celle tenpérature tombe en dessous de
que Ia formation du chrome hexava-d e l r a é r o s o I , c e c i l o r s q u e l a 1 3 o o ' c ( 1 3 ) ( 1 4 ) ( l s ) ( 1 6 ) ( 1 7 )
I
Les procédés chiniques mis en cause dans re des aérosors sont prus compriqués et moins bien procédés physiques (refroidissement, aggromération.
Après cond.ensation et refroidissement initial de fumées, lroxydation hétérogène pourrait conduire de composés de chrone hexavalents par des réactions
ceux-ci peuvent être divisés en deux catégories
: les uns ap-pelés honogènes, incluant les intéractions entre les constituants des particules de furnée, et les autres dits hétérogènes,
incluant à Ia fois res constituants de la fumée et des gaz atmosphériques ÈeIs que lroxygène ou le dio:qgde de carbone.
La plupart des furuées sont formées droxyde de nétal et d,e rné-taux mélangés avec une structure de type spinelre nagnétite
( F e o - F e 2 o 3 ) et d r o x y d e d e f e r - c h r o m e ( F e o - c r 2 o 3 ) , q u i s o n t probabrement produits Èrès rapid,ement à très hautes ternpératures dans 1es premières étapes de ra forrnation d,e ra fumée.
vieillissenent connus que 1es
. . ) .
des particules à la fornation. telles que
FeO Cr2o3 + 2o2 + 2M _à Fer + t42Cr2o7
ofi U peut être n t inporte 1eEre1 composé ou éIément.
Une telle réaction pourrait pideurent la particule de furnée 1 | atmosphère oxydante.
des nétaux présents en tanÈ que
être inhibée en ou en enlevant
refroidissant ra-1a particule de
Ces deux réactions peuvent se produire si Ia particule est collectée dans une suspension aç[ueuse.
1 6
métaux dtétats droxYdation bas
3 F e ( I r ) + c r ( v r ) - + 3 F e ( I I I ) + c r ( I I I )
La réaction se produit rapidement en solution mais elle peut également avoir lieu dans Ia phase solide à des tenpératures de plusieurs centaines de degrés centigrade, et se produit sans doute dans d,es particules d,e fumées, avant qutelles soient refroidies dans Ia phase finale(ctest-à-dire hors du systène réactif) '
On peut srattendre à ce que les particules de fumée en des-sous d.u micron se refroidissent si rapidement çJue I I obsenration du vieillissement des particules ne peut pas être réalisée.
Cependant, nombre de réactions chiniques dans lraérosol tel-les que 1toxydation du métal sont exother:miques et aident à maintenir une température de Ia particule élevé.e ( 13 ) .
De plus, les réactions dans la phase solide intenriennent en-tre les différentes particules de taitle plus éIevée et sont relativement lentes. Elles sont régies par les procédés de transfert de masse tels Ia diffusion des espèces réactives.
Nous allons naintenant nalytiques enPloYées Pour états dtoxYdation.
rappeler les différentes techniques a-caractériser ce composé dans d'ivers
1.5 Principales méthodes de dosage du chrome
Les techniques du chrone dans ses celui-ci se trouve
petmettant lranalyse si possible quantitative différents états dtoxydation sont nombreuses si en phase aqueuse.
Nous distinguerons celles apperées analyses
chiniques et qui nécessitent une rninéralisation préalable si rréchantillon
à analyser est dans sa phase solide de cerles gui
sont effectuées directement sur re solide. ces dernières sont
en générar des techniques spectroscopi.ques d,énornmées analyses physico-chimiques.
1 . 5 . 1 M é t h o d e s dranalyses chiniEres
1 . 5 . 1 . 1 C o l o r i m é t r i e ( 1 9 ) ( l e ) ( 2 o ) ( 2 t ) ( 2 2 ) ( 2 3 ) ( 2 4 )
Beaucoup de méthodes ont été rê, mais la différence essentielle solution des échantillons (e11e b a s i q u e ) .
répertoriées dans la littératu_ entre celles-ci est Ia mise en
peut être soit aclde soit
Lréchantillon solide, par ninéralisation,
est mis en soLution par un nélange acide (HNo3-H2so4) et la complexation
avec la diphénylcarbazid,e I o""
) d,onne un comprexe cororé rouge vioret. La nesure quantitative sreffectue
à une longrueur dronde de 540 nm. Lréchantillon solide est mis en solution par un mérange basi-que' on peut opérer en deux tenps si lron
veut connaitre la fraction du chrome vr solubre et celle insoluble. pour connaî.tre ra fraction soruble du chrone vr, ra mise en sorution se fait par un mérange basigtre dilué. La solution obtenue est alors nesurée à une l0ngueur dronde de 370 nm ( ou à 540 nn pour une complexation a v e c 1 a D p C ) .
Pour détenniner ra fraction insoluble en chrome vr, ra mi.se en sorution de r!échantillon solide est faite à chaud avec un nréIange basj'que concentré. on procède de Ia mêrne nanière que ci-d.essus pour la mesure. Les linites de détection varient de o.o1 à 10 ppn suivant que les nesures 'se font avec ou sans extraction d,e la
phase à analYser.
1 . 5 . 1 . 2 A b s o r p t , i o n a t o m i q u e ( 2 5 ) ( 2 6 ) ( 2 7 ) ( 2 8 )
La nise en solution de ltéchantillon solide se fait toujours de manière acide. On peut ou non effectuer une extraction avec Ia DpC avant le passage en absorption atomique (flanne air acétylène) o u f o u r à g r a P h i t e ( 2 9 ) ( 3 0 ) .
La complexation d,u chrome III par le thiocyanate se fait dans le tétrachlorométhane et celle du chrome VI par un sel dramine quaternaire dans Ie toluène. Les solutions ainsi obtenues sont analysées à une longueur dr onde de 357 .9 nm. I,a linite de d é t e c t i o n e s t d e l r o r d r e d e 0 . 0 1 p p m .
De p1us, Iâ déterrrination du chrone total se fait par une mi-se en solution oxydante (H2SO4, HNO3) suivie par une complexation par Ia DpC. Lranalyse sreffectue d,ans les nêmes conditions que ci.-dessus.
1 . 5 . 1 . 3 R é s i n e s é c h a n g e u s e s d r i o n s ( 2 6 ) ( 2 7 ) ( 3 1 ) ( 3 2 ) ( 3 3 )
Àprès la nise en solution tenues sont passées à travers
séparation du chrome III et du p H = 3 - 5 .
des échantill,ons, Ies solutions ob-des résines échangeuses drions. La
chrome VI est quantiÈative Pour un
A cette valeur, lê risque de réd,uction du Cr VI en Cr III est négligeable. Le d,osage quantitatif se fait par absorption
atomique à une longueur dronde de 357.9 nm.
I . 5 . 1 . 4 C o l o r i m é t r i e s u r r é s i n e é c h a n g e u s e d r i o n s ( 3 4 ) ( 3 5 )
C r est une méthode spécif lque pour Ia détermination du chrone vI dans les eaux. A un échantillon dreau, on ajoute de lracide
de la résine donneuse H+(DOWEX 5OWX2).
Le conplexe de chrome VI développe(apparition de la d I i o n s .
formé avec la diphénylcarbazide se couleur) sur la résine échangeuse
La mesure de la solution de résine sreffectue après le déve-roppernent de la coureur à lraid,e d.run spectromètre, à une rongueur dronde de 550 nm. La liruite de d,étection est d.e lrordre du ug par I i t r e .
Lrinconvénient majeur est ra présence du cu rr en solution si la concentration de cerui-ci est dix
fois cerle du chrone vr. En effet, le complexe de cu avec ra DPC absorbe à la longueur d,ronde utilisée pour la mesure du conplexe de chrone
(ceci d,onne une e r r e u r drenviron 5 à lSt sur Ia mesure).
cette néthode peut être ernployée pour doser Ie chrorne total en ajoutant à la solution à analyser du sulfate
cérique gui o>qgd,e tout le chrome présent en chrome VI.
1 . 5 . 1 . 5 C h i n i e l u m i n e s c e n c e ( 3 6 ) ( 3 2 ) ( 3 g ) ( 3 9 ) ( 4 0 )
Cette néthode permet de doser le
dation trois dans les eaux. chrone dans son état
d,roxy-Le principe de cette technique srappuie sur le rôle catalyti_ ç[ue des ions nétarliques vis-à-vis de certains réactifs organiques. Le réactif organigtre utilisé
est Ie luruinol (5 arnino 2-3 dihydrophtalazine 1-4 dione) avec le péroxyd,e d,rhydrogène d.ans une solution basique.
La réaction qui intervient dans Ie dosage par chimie luminescente peut étre décrite
des éIéments mêtalliques de Ia façon suivante:
L U M I N O L
M : t d E T A L E T U D I E
on a donc:
L . M O z H
avec I'hypothése de Ia formation d'un
H r O r : P E R O X Y D E D ' H Y O R O G E N E H r O 2 - M O 2 H r H ' + . N z _ M+. ^ = 4 3 O n m m a t complexe intermédiaire de Ia forme:
Lrappareil utilisé est un spectromètre à fluorescence qui me-sure Ie signal dtintensité h:mineuse à une longueur d,rond,e de 430 r 1 r û . L e s i o n s . g é n a n t s t e l s q u e C u I I , F e I I , C o I I . . . s o n t éliroinés par lrajout dtEDTA (Ia cinétique de formation d,u complexe d,e chrome est beaucoup plus lente) (36) .
Cependant, Ie principal lytique est la linitation d.e
inconvénient de Ia plage de pH
cette technique ana-( p H = 1 0 . 6 ) .
1 . 5 . 1 . 6 C o n c l u s i o n
De toutes les techniques décrites ci-dessus, res prus couram-ment enproyées sont la cororinétrie et trabsorption atomigqe. La première petmeÈ de connaître la quantité
de chrome vr dans 1r échantilron solide tandis
çtue 1a second.e d,éter:rnine la concent'ration en chrome Èotal d.e celui-ci. La différence
d,es d.eux mesures donne la quantité de chrone trivar.ent.
De prus, rranalyse avec Ies résines échangeuses d,rions eÈ passage en absorption atomique pernet également une différencia-tion des états d t oxyd'adifférencia-tion d,u chrome en sorudifférencia-tion et reurs d,osages de nanière précise.
'Malheureusement,
si toutes les techniques analytiques décri-tes ci-dessus peraettent I t identificatj.on et le dosage d,u chrome dans ses divers états droxyd,aÈion, une fois celui-ci
passé en solution, les résultats obtenus ne reflètent pas toujours
res quantités de chrome rrr ou vr contenues dans 1féchantillon
solide de départ (réactions de réd,uction, oxydation lors d,e Ia
mise en solution) .
11 nous a fa.llu trouver des techniqrres analytiques physico_ chiniques nous pe'rnettant d r identifi.er ceux-ci.
Les technigues les plus appropriées d,écrites d.ans Ia biblio-graphie ont, été employées, sachant gue chacune drentre elles était linitée pour le donai.ne drinvestigation fixé.
Les techniques physico-chiniques emproyées sont la diffusion Raman, Irinfra-rouge à transformée d,e Fourier, Ia diffraction
des rayons x, ra spectroscopie photoéIecÈronique, ra spectrométrie drions secondaires et Ia microsonde LAMMA.
Toutes ces techniques bref rappel bibliograPhique et seront ensuite rePrises relatifs à ces techniques échantilIons.
physico-chiniques feront I t objet drun caractérisant leur champ dtapplication (sauf pour Ie SIMS) dans des chapitres
lors des analYses in situ de nos
L.5.2 Méthodes dr analyse physico-chirniques
La diffusion Raman (42) (43) et lrinfra-rouge à transfornée d e F o u r i e r ( 1 3 4 ) ( 1 3 5 ) , Pât lrinte:médiaire d e s r a i e s ( o u d e s bandes) spectrales permettent de caractériser les groupements
anioniques présentant un certain caractère covalent. L,a connaissance de ce groupement anionique fournit 1tétat d'toxydation d,u rnéta1 inclus dans celui-ci.
Cependant, ces deux techniques présentent des inconvénients rnaj eurs qui sont:
- En diffusion Raman, Ia présence dtéIéments fluorescents dans les conposés analysés perturbe considérablement
la réPonse
- En infra-rou9êr les nombreuses interférences spectrales possibles entre bandes drabsorption des divers composés drun matériau ou dtun minéral nixte rendent les inter-prétations des spectres déIicates.
En outre, toutes deux ont une sensibilité relativenent fai-b I e .
La spectroscopie photoélectronique(60) (61) et Ia diffraction d,es rayons x (11) (12) sont les techniques décrites dans Ia bibliographie comme étant les plus perfotmantes pour ltétude des
états dtoxydation des élénents à 1tétat solide. Cependant la spectrométrie photoélectronique ne donne qurune infor:mation qualitative sur la concentratlon des divers états dtoxydation des
élénents. Cette technique permet très
caractérisation de 1 r environnement, chirnique d,e difficilenent 1a 1 f é I é m e n t étudié. par contre, ta diffraction des rayons x sur poudre donne à la fois I t état d I oxyd,atj.on de I t élénent et son environnement, chinique par 1r intermédiaire d,es d,iffractogramnes obtenus
rors d,es a n a l y s e s .
La complexité de ltinterprétation des spectres de diffration rorsque les échantillons à analyser contiennent plus d,e lrois com-posés inconnus en fait une méthode difficilemen! utilisable pour lrobtention de résultats rapid.es.
cependant, 1e principal inconvénient
d,e ces deux techniques est leur manque de sensibirité (0.1 et rt) pour ra spectroscopie photoérectroniEre et Ia diffraction
d,es rayons x respectivement. ce manque de sensibilité fait gue seuls des composés ruajoritaires seront déÈectés dans des composés comprexes conme par exemp1e res produits provenant de nilieux industriels.
Pami res techniques physico-chinriques décrites d,ans la bi-bliographie pour essayer d,tid,entifier
1es états d,roxydatj.on des é-léments, la spectrométrie de masse constj.tue une nouvelre approche à ces problèrnes.
De toutes les techniques d,e spectrométrie de masse existantes deux seulement seront décrites ci-après. ce sont ra spectrométrie de masse drions secondaires srMS et Ia spectrométrie de nasse à tenps de vor rÀMMA, cette dernière consÈituant lrobjet d,e cette t h è s e .
La spectrométrie de masse dtions secondaires (srMs) peut être uËiIlsée pour ltidentification des éIéments purs dans reurs d,ivers é t a t s d r o x y d a t i o n ( 4 7 ) ( 5 1 ) .
2 4
b i l i t é s d r i n v e s t i g a t i o n . C r e s t I r a n a l o g i e a v e c l a t e c h n i g u e S I M S (spectres de masse drions positifs et négatifs sinilaires) $ri a p e r m i s à p l u s i e u r s a u t e u r s e t n o È a n m e n t à R . G i j b e l s e t a I . ( 6 5 ) ( 6 6 ) d.e transposer les modèles empiriques développés en spectronétrie SIMS à Ia spectrométrie IÀMMÀ pour Itidentification des composés binaj-res oxygénés.
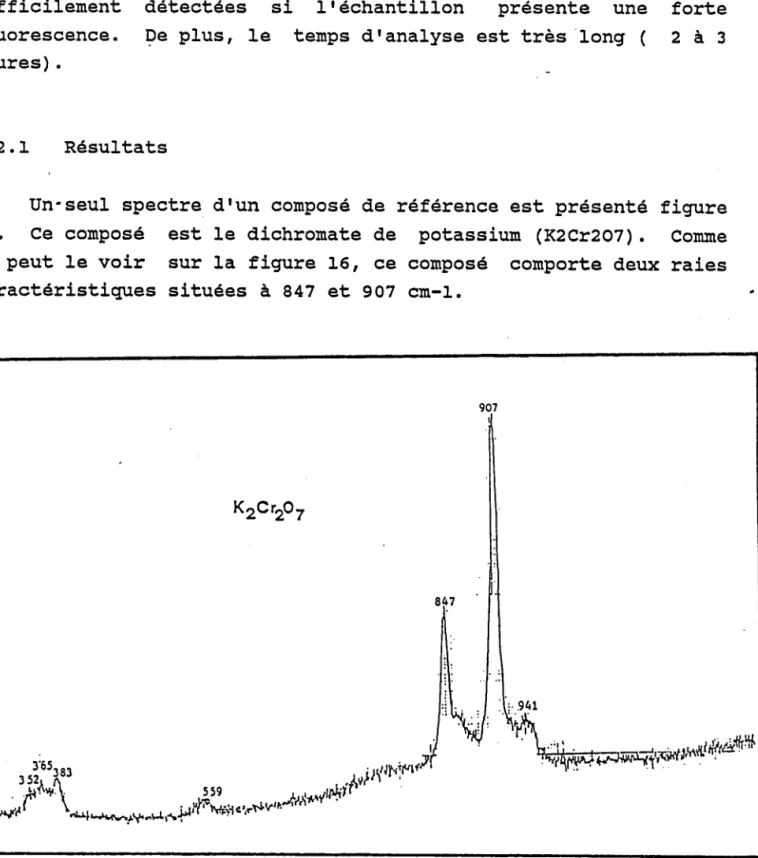
De mêne, Ies études des ernpreintes spectrales des composés ont serrri à Bruynseels et al . (67) pour caractériser les différents composés ninéraux dans les aérosols dtorigine marine ou urbaine.
Lridentification de ceux-ci, très largenent rnajoritaires au niveau particulaire, peut être réalisée à ltaide de la microsonde IÀMMA en utilisanÈ les empreintes spectrales des coutposés purs de référence.
Les processus gouvernant Ia fomation des ions clusters r sur laquelle sIappuie la néthodologie ernployée pour permettre Ia d,ifférenciation des états dtoxydation ne sont pas encore t,otalement expliqués .
Crest tra raison pour laquelle iI nous a paru très inportant de rappeler dans le prochain chapitre les principales caractéris-tiques de Itintéraction laser-matière et les processus d,rionisation des atomes au sein du plasma fotmé.
ETUDE DES MECAI{ISI{ES D I IONISATION DE I,A PHASE SOIJIDE . . . 26 2.L Intéraction laser matière o . . .
2.1.1 Equtlibre thermodynanlque local (IJ.T.E. ) . . . 27 2.I.1.1 Tenpérature au point dtinpac-t de la cible 29 2 . L . 1 . 2 À b s o r p t i o n d e 1 r é n e r g i e e n p h a s e g a z e u s e 3 3 2 . 1 . I . 3 E f f e t B r e m s t r a h l u n g i n v e r s e . . . 3 4 , 2 . 1 . 1 . 4 E f f g t , f o u l g . . . o . . . . 3 5 2 . I . 1 , . 5 P g r t e s é n e r g é t i ç l u e g . . . 3 8 2 . 1 . 1 . 6 C o n c l u s i . o n . . . o . . . 3 9 2 . L . 2 F o n n a t i o n d g s c ] . u s t g r s . . . . ' 4 0
I
I
I
I
l l
EruDE DES MECANISMES D'IONISATION DE I CHAPITRE 2 IÀ PHASE SOLIDE I
I
I
I
I
La spectronrétrie de rnasse couplée à une source ionisante Ia-ser a pris un essor considérable dans tous les domaines de recherches.
Lrun des principaux avantages de cette nouvelle spectrométrie est de pouvoir analyser presque tous les composés dans leur état solide, et en ce qui concerne plus particulièrenênt la chinie rninérale, Iâ caractérisation possible des états dtoxydation des éIéments.
y.A. Bykovskii(63) a étudié, avec un spectromètre de masse à temps de vol pounru drun analyseur éIectrostatique, les nolécules solides de Ia forme AnBnCp (avec par exemple A=Cs ; B=Cll ; C=Cl) pour des d.ensités de flux supérieures à 2 IO9 W par cn2. 11 a ainsi déterminé la stoechiométrie des composés irradj.és en se basant sur lrintensité des pics ioniques monochargés et ayant une énergie cinétique drenviron lOO ev. Ceci fournit une erreur expérimentale de lrordre de 88 par rapport à la stoechiométrie du composé théorique annoncée.
De même, c.G. Derryatikh (64) a étudié différents conposés bi-n a i r e s ( S i O , S i O 2 , S i C , 4 1 2 0 3 1 . . . ) p a r l a m e s u r e d e s s p e c t r e s dténergie de chaque ion.
R . G i j b e 1 s ( 6 5 ) ( 6 6 ) e s t I e p r e n i e r à a v o i r u t i l i s é l a m i c r o -sond.e à irnpact laser LAMMA pour identifier et caractériser les composés inorganiçlues en se serrrant soit de 1r empreinte spectrale des composés de référence (fingerprint) soit des valeurs des
intensités relatives des ions pour les o:<ydes binai.res pour identifier leur stoechionétrie. cette néthodologie
a été enployée par Bruynseels (67) pour identifier les composés d,es nitrates, nitrites et des sulfates, sulfites dtorigine marine et urbaine respectivement, lorsqurau ni.veau particulaire,
res espèces en constituent Ia majeure partie.
2 . 1 I n t é r a c t i o n l a s e r m a t i è r e
En r-963 res premiers spectromètres d,e nasse couprés
à une source ionisante laser ont fait leur apparition
dans re donaine de l r a n a l y s e c h i r o i q u e . ; r . F . R e a d y ( 6 g ) , R.E.Honig
( 6 9 ) ( 7 0 ) e t w'E'Linlor (7r) ont les premiers nontré Itirnportance
des lasers comme générateurs de source d,I ions quelque soj.t re d,ouraine d | étude des composés à analyser et quelque soit
1e mod,e d,rionisation utilisé (désorption, thermique, nultiphotonique.
. . ) .
Lrabsorption de la radiation laser par la natière
se fait surtout par rrinterrrédiaire des électrons ribres,
créés par I t élévation de Ia teurpérature au point d I impact d,u faisceau laser avec la cible, Çlui sont capables drabsorber la runière incidente.
Nous allons décrire différents phénonènes relatifs à cette intéraction raser natière afin de déterruiner
res processus dtionisation des atomes au sein du plasna fornré.
2 . 1 . I E g u i l i b r e t h e r m o d y n a n i q u e local (L.T.E. )
Différents auteurs ont décrit ce phénornène par rapport à l,é_ quilibre thermodynanique totar (72) (73) (74).
Dans une enceinte en équilibre therrnodynarniqrre, i1 existe une seure ternpérature
qui fixe toutes res fonctions de distributj.on (Maxwel1, Boltzmann, saha, planck) crest-à-dire Te=Ti=Trayon. 11 y
a arors
microréversibilité des. rayonnement.
processus dûs aux collisions et au
En particulier, la microréversibilité des processus dts au rayonnenent entraî.ne que tout photon émis est innédiatement réabsorbé; le ruilieu est dit optiquenent épais, le flux sortant dténergie est nuI. La répartition de Itintensité avec la fréquence est continue, le rayonnement dans lrenceinte étant un rayonnement de corps noir (distribution de Planck).
Dans les plasnas créés dans les laboratoires, lranalyse du rayonnement sortant montre que Ia répartition de lténergie nrest pas continue mals discontinue, et présente donc des raies drabsorption ou drémission. Ce rayonnement sortant ne suit pas la Ioi de Planck(Ioi du corps noir), le flux dténergie radiative nrest pas nul dans lrenceinte dans laquelle existent probablement des gradients de tenpératures.
Les physiciens ont donc introduit la notion dtéquilibre ther-n o d y ther-n a m i g u e l o c a l ( L . T . E . ) , a f i n d e l e u r p e t m e t t r e l r é t u d e d u r a -yonnement d,u plasma.
on reurplace le système unique d,e teurpérature du nilieu par des sous-systènes ayant des tenpératures différentes. Chaque
sous-système vérifie localement les lois de Boltzmann, Maxwell, et de Saha à sa tenpérature propre.
Le concept du L.T.E. ne peut être appligué certains critères de validit,é sont respectés (73)
-Grande densité électronigue (avec une valeur férieure : 10 /l et Lott cm-3 ) .
-La distribution de vitesse des éIectrons est
au plasna que si ( 7 5 ) ( e 8 ) :
supérieure et in-rna><wel1ienne.
Crest-à-dire que cette loi permet' de connaÎtre, pour une température T, Ie nonbre de particules drune espèce donnée dont la vitesse est conprise entre v et v+dv.
Elle stexpri.me mathénatiguement sous la forae:
* =(#)"t
N
r g n e T /
ry[--
uL/zkT)x4n utàv
où N est le nornbre total de particules d,e leur nasse, k la constante de Boltamann, n i l i e u .
l r e s p è c e considérée, m T la terupérature du
-Le teutps de transfert de Irénergie des électrons aux atomes est suffisamnent court.
- L e s processus drexcitation, i o n i s a t i o n . . . , i n d , u i t s p a r collision doivent être plus importants que res processus ind.uits radiativement.
-La fréquence de la rad,iation laser doit être plus grande que Ia fréquence droscillation du plasma.
Le principal problèrne pour les études d,es plasmas générés en Iaboratoire est la déternrj.nation exacte de la tenpérature. comne nous ltavons dit ci-d,essus, crest le paranètre qui gouverne t,ous les processus existant dans un plasma. Dans ce qui sult, nous allons donc essayer de Ia déterminer au point dtinpacÈ du faisceau laser avec la cible étudiée.
2 . I . I . r r e n p é r a t u r e au point drirnpact d,e la cible.
Lrévaluation de la ternpérature au point dtinpact du faisceau l a s e r a v e c I a cible a été décrite par J.L.Dumas (76), R.E.Kelly
(82) et répond à 1téquation suivante:
hrFf"
Kc)
,-ï7
9=
('1-R) (
où I, l, R, K, C sont respectivement lrintensité du faisceau laser en !,ratt par centirnètre carré, Ie tenps dtimpulsion du laser, Ie pouvoir reflecteur de Ia surface, Ia conductivité themique et la capacité calorifiEre de 1réchantillon.
La principale incertitude se situe au ni.veau de 1r évaluation du coefficient de réflexion R des surfaces solides analysées. Si lfon considère les travaux de N.G. Basov (77) qui étudie Ie pouvoir réflecteur des surfaces solj.desr oD constate que celui-ci atteint un dixièrne de sa valeur nominale (relevé à 20'C) pour des flux laser supérieurs à 4Ag W cm-2. Pour ce fai.re, oD prend en compte Ia constante de réflexion, pour la plage dténergie de notre étude, êt égale à 0.45 de nanière arbitraire. Cette valeur correspond au pouvoir réflecteur de lraluminiun draprès Basov.
Sachant que Ie pouvoir réflecteur drune surface est fonction de.la longueur dronde du faisceau incidentr oî fera une erreur systérnatiqre sur le calcul de la tenpérature.
Connaissant la lirnite notre nodèIe, on va:
déterniner les tenpératures atteintes à la surface d'es échantillons analysés pour une énergie laser voisine de t
ltl "t avec les constantes relatives aux différents éIénents tirés de
( 7 6 ) ( Z B ) . L e s v a l e u r s s o n t r é s u m é e s d a n s I e t a b l e a u c i - d e s s o u s .
l l F e l c u l A l l Pb I unités I
I K | 0 . 7 5 | 3 . 8 8 1 1 . 7 | 0 . 3 4 I W * c n - I * K - l I