Année universitaire 2016/2017
Etude de l’adsorption d’acide gallique sur
l’hydroxyde double lamellaire Mg-Al-HDL
Université Akli Mohand OULHADJ - BOUIRA Faculté des Sciences et des Sciences Appliquées
Département de Génie des Procédés
MÉMOIRE
Présenté par
BELKHIRI KHOUKHA KESRAOUI FATMA
Pour l’obtention du diplôme de
MASTER
Filière : Génie des Procédés
Option : Science et Génie de l’Environnement
Thème
Soutenu le : 03/10/2017 Devant le jury composé de :
Nom et Prénom Grade
LOUNICI Hakim Professeur Univ- Bouira Président AOUDJIT Farid MAA Univ- Bouira Examinateur HADIOUCHE Dalila MCB Univ- Bouira promotrice
Page i
Remerciements ... iii
Liste des figures ... iv
Liste des abréviations ... v
Liste des tableaux ... vi
Introduction générale ...1
Chapitre I Étude bibliographique I.1. Les composés phénoliques ... 3
I.1.1. Classification des composés phénoliques ... 3
I.1.2. Impact des composés phénoliques sur l’environnement ... 5
I.2. L’adsorption ... 6
I.2.1 Types d'adsorption ... 6
I.2.2. Mécanisme d’adsorption ... 7
I.2.3. Facteurs influençant le phénomène d’adsorption ... 8
I.2.4 Les différents types d’adsorbants ... 9
I.2.5 Équilibre d’adsorption ... 11
I.2.5.1. Classification des isothermes d’adsorption ... 11
I.2.5.2.Modèle des isothermes d’adsorption ... 13
I.2.6. Cinétique d’adsorption ... 17
I.2.7. Les paramètre thermodynamiques ... 20
I.3. Les Hydroxydes Doubles Lamellaires [HDL] ... 21
I.3.1. Structure et propriétés des matériaux HDLS ... 21
I.3.2. Propriétés des hydroxydes doubles lamellaires ... 24
I.3.3. Méthodes de préparations ... 24
I.3.4. Valorisation des HDLs ... 25
I.3.5. Description des différentes techniques physico-chimiques d’analyse utilisées ... 25
Chapitre II Matériels et Méthodes II.1. Synthèse de l'adsorbant HDL Mg-AL-HDL ... 29
II.2. Caractérisations physico-chimiques de l'adsorbant ... 31
Page ii
II.2.4. Diffraction des rayons X (DRX) ... 32
II.2.5. Spectroscopie infrarouge à transformée de Fourier (IR) ... 33
II.2.6. L’analyse thermogravimétrique ... 34
II.3. Étude de l'adsorption d'acide gallique sur l'HDL ... 35
II.3.1. Dosage des polyphénols par le réactif de Folin-Ciocalteu ... 35
II.3.2. Effet de la masse de l’adsorbant ... 35
II.3.3. Effet du pH ... 36
II.3.4. pH du milieu pour laquelle la résultante des charges ... 36
II.3.5. Cinétique d’adsorption (effet du temps de contact) ... 37
II.3.6. Effet de la température (Thermodynamique) ... 37
Chapitre III Résultats et discussion III.1. Effet de la masse de l’adsorbant ... 38
III.2. Effet du pH sur l’élimination d'acide gallique ... ...39
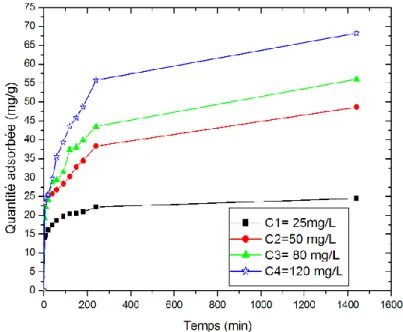
III.3.Cinétique de l’adsorption ... 40
III.5. Cinétique de pseudo-premier ordre ... 42
III.6. Cinétique de pseudo-second ordre ... 43
III.7. Diffusion intraparticullaire ... 44
III.8. Modèle d’Elovich ... 45
III.9. Effet de la température. Thermodynamique ... 46
III.10. Isothermes d’adsorption ... 47
III.10.1. Modèles de Langmuir ... 48
III.10.1. Modèle de Freundlich ... 49
Conclusion générale ... 51
Page iii C’est avec humilité et gratitude que nous reconnaissons ce que nous devons :
Nous tenons à remercier et rendre grâce à dieu le tout puissant de nous avoir donné le courage et la volonté de mener à bon terme ce travail.
Nos remerciements vont en particulier à notre promotrice Mme HADIOUCHE et notre co-promoteur Mr. CHEDRI qui nous ont dirigés et beaucoup aidés afin de mener à bien ce
travail.
Nous tenons aussi à remercier tous les enseignants du département de génie des procédés sans exception.
Nous tenons à remercier également nous enseignants de différents niveaux d’enseignements.
Notre sincère reconnaissance à l’ensemble des personnels de laboratoire de recherche au niveau de Faculté des Sciences de Nature et Science de Vie pour leurs collaborations et
leurs accueils chaleureux.
Que tous ceux qui ont contribué de prés ou de loin à la réalisation de ce travail et ceux qui ont fait l’honneur de juger ce mémoire.
Je dédie ce travail à :
Les personnes qui donnent un sens à ma vie (ma mère et mon père), et toute ma
famille qui m’encouragée pour arriver à ce point là. Mes sœurs (Siham. Malika. Nadia. Sarah).
Mes frères, Ismail et Islam Mes amies son exception, surtout ma copine Hayat .
A tous le groupe de master 2 sciences et génie de l’environnement, et
ceux qui me sont chers, et qu’ils trouvent leur place dans mon cœur
Pour que ma réussite soit complète je la partage avec tous les
personnes que j’aime, je dédié ce modeste travail à :
Mes très chers parents pour leur amour et pour le coure qu’ils m’ont
inculqués
A toi ma mère
Toi, tu a qui si je devais offrir tous les très ors de la terre, je ne
sonrais te rendre ce que je dois.
A toi mon père
toi a qui si je passais toute ma vie penser a tous bienfait, je ne
sonrais les comptes, que dieu te. bénisse.
A ma grande mère.
A mes frères : Brahim, Boualem, Slimane, Zohir.
A mes sœurs khadidja Rebiha
A mon binôme Khoukha.
A tous le groupe de master 2 sciences et génie de l’environnement.
k.fatma
Page iv Liste des Figures
Figure I.1 d’acide caféique et d’acide gallique………...……… p 4
Figure I.2 Le mécanisme d’adsorption ………... p 7 Figure I.3 Classification des isothermes d’adsorption selon Gilles et coll …… p 11
Figure I.4 Courbe illustrant de modèle Langmuir ………. p 14
Figure I.5 la structure de la brucite Mg (OH)2 ………. p 22
Figure I.6 Structure d'un Hydroxyde Double Lamellaire ………. p 22
Figure I.7 Agencement des atomes dans la couche octaédrique ………. p 22
Figure I.8 Schéma présente les liaisons d’hydrogène………... p 22
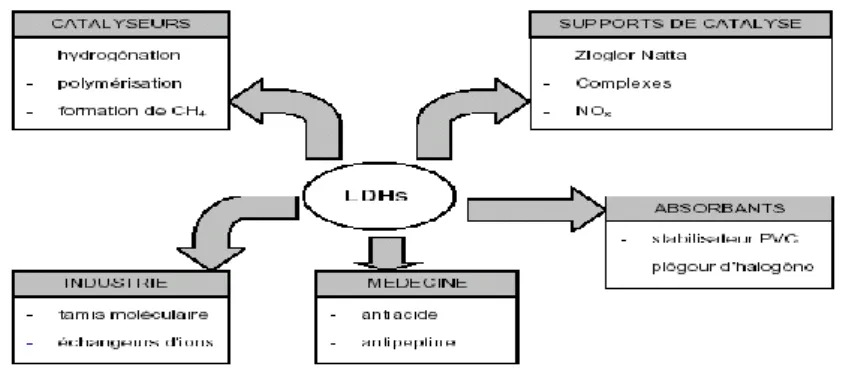
Figure I.9 Applications des Hydroxydes doubles lamellaires……….. p 25
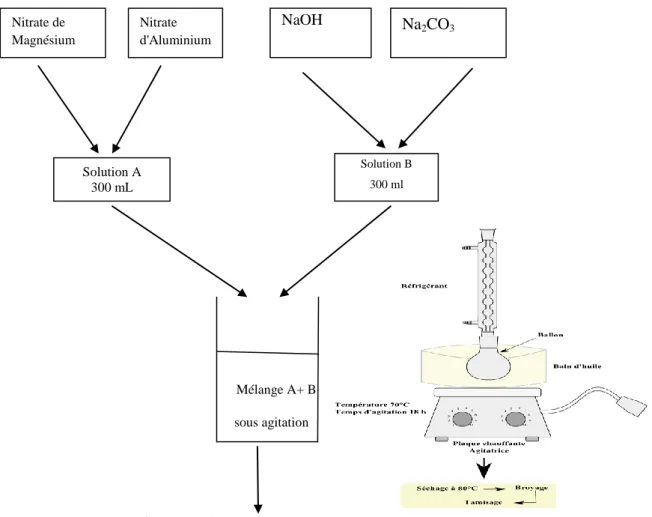
Figure II.1 Schéma de préparation de Mg-Al-HDL………. p 30
Figure II.2 Les images de MEB……….. p 31
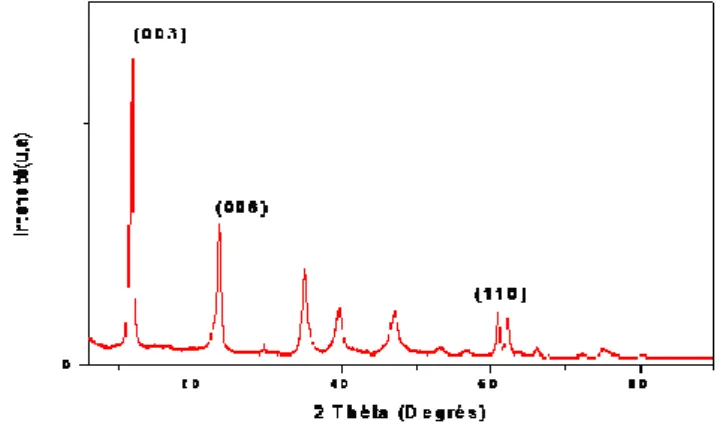
Figure II.3 Diffractogramme d'hyhdrotalcite Mg-Al-HDL ……….. p 33
Figure II.4 Figure II.5 Figure III.1 Figure III.2 Figure III.3 Figure III.4 Figure III.5 Figure III.6 Figure III.7
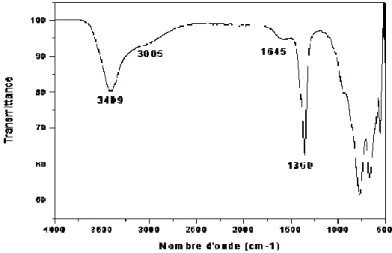
Spectres IR de l'échantillon Mg-Al-HDL……… Courbes de perte de masse totale (TG), différentielle (DTG)……… Effet de le masse de HDL sur l’adsorption d’acide gallique par l’HDL Effet de ph sur l’adsorption d’acide gallique par l’HDL………... détermination du pHPZC de l'HDL sur l’adsorption d'acide gallique en solution aqueuse……… Structure chimique d’acide gallique……….. Effet de temps de contact de HDL sur l’adsorption d’acide gallique par l’HDL……….. Application de modèle pseudo premier ordre pour l’adsorption d’acide gallique par l’HDL………
Application de modèle pseudo scande ordre pour l’adsorption d’acide gallique par l’HDL……… p 34 p 34 p 38 p 39 p 39 p 40 p 42 p 43 p 44
Page v Figure III.8 Figure III.9 Figure III.10 Figure III.11 Figure III.12 Figure III.13
Application de modèle intraperticullaire pour l’adsorption d’acide gallique par l’HDL………. Application de modèle d’Elovich pour l’adsorption d’acide gallique par l’HDL………... Effet de température sur l’adsorption d’acide gallique par l’HDL…… Isotherme d’adsorption d’acide gallique en solution aqueuse par l’HDL………... Application de modèle de Langmuir pour l’adsorption d’acide gallique par l’HDL……… Application de modèle de Freundlich pour l’adsorption d’acide gallique par l’HDL……….. p 45 p 45 p 47 p 48 p 48 p 50
Liste des abréviations
HDL :hydroxyde double laimllaire
L: Langmuir.
CEA: Capacité d’échange anionique. DRX: La diffraction par Rayons X.
BET : brunauer- emmet- teller.
IRTF: La Spectroscopie Infrarouge à transformer de Fourier. UV: Ultra violet.
DRK: Dubinin-kaganer-Radushkevick. pHi: pH initial.
pHe: pH à l'équilibre.
C0: La concentration initiale de la solution d’acide gallique(mg/L).
Ce: La concentration résiduelle à l’équilibre (mg/L).
V: Le volume de la solution (L). m: La masse de l’adsorbant (g). λ: Longueur d'onde.
qe : quantité adsorbée à l’équilibre (mg/g).
t: temps (heures).
β: La constante de désorption (g /mg).
kid : La constante de la diffusion intra particulaire (mg/g.min0.5).
qads: Quantité de substance adsorbée à l'équilibre par unité de poids de l'adsorbant «
capacité d'adsorption » (mg.g-1).
qm: Capacité d'adsorption à la saturation (mg.g-1) et qui correspond à la formation
d'une monocouche (c’est aussi le nombre de sites actifs par unité de masse de la phase solide).
KL: La constante de Langmuir.
q: Quantité adsorbée par gramme du solide.
Kf et 1/n: constantes de Freundlich caractéristiques de l'efficacité d'un adsorbant
donné vis-à-vis d'un soluté donné.
β: Constante reliée à l’énergie d’adsorption (mole2/j2). qm: Capacité de saturation théorique (mole/g).
: Potentiel Polanyi (kJ/mol). T: température en kelvin (K).
K: constante de vitesse de la cinétique d’adsorption. d: La distance inter-réticulaire
: Largeur angulaire a mi-hauteur du pic de diffraction en radian. θ: Angle de Bragg.
Page vii
Liste de Tableaux
Tableau II.1 Tableau II.2
Analyse chimique par absorption atomique ………. Caractérisation de Mg-Al-HDL par l'adsorption à l'azote gazeux…
p 32 p 32
Tableau III.1 Constantes de la cinétique de l'adsorption d'acide gallique sur
l’HDL……….. p 46
Tableau III.2 Paramètres thermodynamiques de l'adsorption d'acide gallique sur
l’HDL……….. p 47
Tableau III.3 Paramètres de Langmuir et Freundlich de l’adsorption d’acide gallique par l’HDL………..
1
Introduction générale
Les rejets liquides industriels contiennent des polluants organiques, en particulier des composés phénoliques, causant de fortes nuisances tant à la flore qu’à la faune aquatique, et sur la santé de l’homme par voie de la chaîne alimentaire. Une réglementation de plus en plus stricte encourage le développement de technologies propres et à instaurer la dépollution systématique des effluents liquides avant leur rejet dans le milieu naturel.
Les composés phénoliques sont des molécules bactéricides présentes dans les effluents industriels pouvant venir d'activités agroalimentaires et agricoles (fabrication d'huile d'olive, vinification, … etc.). Les tentatives de traitements biologiques de ces effluents restent limitées à cause de la présence des composés phénoliques toxiques qui sont difficilement biodégradables et inhibiteurs de l’activité biologique.
Une des techniques de séparation les plus utilisées dans le traitement des effluents est l’adsorption. C'est une technique physico-chimique qui implique la fixation d’un soluté ‘adsorbât’ se trouvant en phase fluide, sur la surface d’un matériau solide dit ‘adsorbant’. Des progrès considérables sont enregistrés dans le domaine de l’adsorption de composés organiques contenus dans les eaux. Cette technique classique est très largement employée, pour sa facilité de mise en œuvre, son efficacité et son faible coût. Néanmoins le choix d’un matériau ayant de bonnes caractéristiques d’adsorption est essentiel pour avoir un taux d’adsorption élevé.
Les techniques d'adsorption utilisant un adsorbant solide ont été largement utilisées pour éliminer certaines catégories de polluants chimiques des eaux usées, comme les composés phénoliques .il a été démontré que divers adsorbants sont disponibles en tant que choix d'adsorbant utilisé pour éliminer les composées phénoliques d'effluents via processus d'adsorption, Comme l'écorce , boues activées, résines, alumine modifiée et charbon actif .
Dans cette étude, nous nous sommes intéressés aux hydroxydes lamellaires « HDLS » appelés aussi les argiles anioniques. Elles sont des adsorbants qui possèdent une bonne efficacité dans l’élimination des variétés polluants anioniques. Elles présentent des propriétés d’échange anioniques, magnétiques et électrochimiques et physico-chimiques très importantes. Ces dernières années, un intérêt croissant est porté sur ces matériaux en raison des nombreuses recherches effectuées sur leurs multiples applications.
2
L’objectif de ce travail est d'obtenir dans un premier temps une argile anionique « hydroxydes doubles lamellaires » préparé par la méthode Co-précipitation. Ensuite, l’étude du procédé d’adsorption d'acide gallique sur cette argile Mg-Al-HDL préparée.
Notre travail est subdivisé en trois chapitres :
Le premier chapitre est constitué d’une revue bibliographique où l’on présentera d’une manière Générale les composes phénoliques, le phénomène d’adsorption et les hydroxydes doubles lamellaires (HDL).
Le deuxième chapitre est consacré à la description des techniques expérimentales utilisées au cours de ce travail.
Les résultats et leurs discussions faits l’objet du dernier chapitre. Nous terminons ce travail par une conclusion générale.
Page 3 Chapitre I
Étude bibliographique
Dans cette partie, nous allons exposer les notions générales sur les composés phénoliques notamment leur classification et leur impact sur l’environnement. Nous allons aussi parler du principe de l’adsorption, ses mécanismes et différents types d’adsorbants où les Hydroxydes doubles lamellaires « HDLs » seront largement discutés.
I.1. Les composés phénoliques
Les composés phénoliques regroupent un vaste ensemble de substances chimiques comprenant au moins un noyau aromatique, portant un ou plusieurs groupes hydroxyles ainsi que d’autre substituant [1]. Ils sont des substances présentes dans tous les végétaux et dans tous les organes de la plante [2 - 4]. Leur présence dans les tissus animaux est généralement due à l'ingestion d'aliments d'origine végétale [2]. Ils sont impliqués dans de nombreux processus physiologiques comme la croissance cellulaire, la germination des graines ou la maturation des fruits. Les plus représentés sont les anthocyanes, les flavonoïdes et les tanins [1].
Les principales sources des composés phénoliques sont le café (36,9%), le thé (33.6%), le chocolat (10.4%), les fruits (6.7%), suivis des oléagineux, du soja. [1]
I.1.1. Classification des composés phénoliques
A. Les formes les plus simples
Les formes phénoliques les plus simples présentent des structures chimiques allant du simple phénol en C6 aux flavonoïdes en C15. Ces substances sont présentes sous formes soluble dans la vacuole.
Les acides phénoliques
Les acides phénoliques peuvent être subdivisés en deux grands groupes, les dérivés de l’acide benzoïque et les dérivés de l’acide cinnamique.
Les dérivés de l’acide benzoïque ont une formule de base de type C6-C1, ils existent fréquemment sous forme d’ester ou glucosides et peuvent également être intégrés dans des structures complexes comme certains tanins et des lignines.
Page 4
Les dérivés de l’acide benzoïque (les acides hyroxybenzoïques) comportent les acides p- hyroxybenzoïques, protocatéchique, vanillique, syiringique et l’acide gallique [5 ,6].
Figure I.1 : L’acide caféique et l’acide gallique
Les dérivés de l’acide cinnamique (les acides hydrox cinnamique) représentent une classe très importante dont la structure de basse C6-C3 dérivée de celle de l’acide cinnamique. Ils comprennent les acides p-caumarique, caféique, férulique et l’acide sinapique. Ils sont principalement présents sous formes liées à des composants structurels de la paroi cellulaire telle que la cellulose, la lignine, et les protéines par le biais des liaisons esters. Les acides phénoliques sont connus pour réguler la croissance dans de nombreuses plantes, en contrôlant la biosynthèse de l’auxine et le métabolisme en agissant comme des inhibitrices oxydases [5 ,6].
Ensemble des flavonoïdes
Ensemble des flavonoïdes ont une structure générale en C15 (C6-C3-C6). Il comprend à lui seul plusieurs milliers de molécules regroupées en plus de dix classes, dont certaines ont une très grande importances biologique et technologique comme les pigments rouge ou bleus des fleurs et des fruits, les flavonols et les flavanes qui sont à l’origine de tanins condensés.
Autres phénols simples
Parmi les phénol simple, on peut citer le catéchol, le pyrogallol, la vanilline constituant majeur de la vanille, l’oleuropèine responsable de l’amertume de l’olive, certaines terpènes (thymol,gossypol…) des alcaloïdes (morphine, pasavérine…), les quinones.
B. Les formes condensées
Ces composés résultent principalement de la condensation de certaines formes simples précédemment évoquées :
tanins : sont des formes phénoliques condensées capables de se lier aux protéines en solution et de se précipiter.
Page 5 lignines : résultent de la polymérisation tridimensionnelle de trois unités phénoliques de base dénommées monolignols et qui sont les alcools commariylique, conférylique, et sinapylique, dérivant respectivement des acides p-coumarique, férulique et sinapique.
Forme liéesà des macromolécules non phénoliques : certains acides
hydroxycinnamiques peuvent êtres liés à des macromolécules non phénoliques telles que les composants glucidiques de la paroi pectocellulosique comme les composés pectiques.
I.1.2. Impact des composés phénoliques sur l’environnement
Les rejets dans les récepteurs naturels, les cours d’eau, sans aucun traitement préalable nuisent à la qualité de ces eaux de surface. La très forte charge en matière organique empêche ces eaux de s’auto- épurer et la pollution peut s’étendre sur de très longue distance.
Les composés phénoliques sont capables de piéger les radicaux libres d’oxygènes en particulier les radicaux peroxydes (ROO·), alkoxyles (RO·), superoxydes ( et les hydroxyles (OH·), générés en permanence par notre organisme ou formés en réponse à des agressions de notre environnement (polluants, infections...). En effet, leur rôle d’antioxydants naturels permet à l'organisme de lutter contre les agressions de l'oxygène qui sont à l'origine d'un grand nombre de maladies (cancer, des maladies inflammatoires…), ce qui suscite de plus en plus d'intérêt pour la prévention et le traitement des maladies [7-10].
L’oxydation des composés phénoliques par l’oxygène du milieu aqueux conduit a une quinonisation, ce qui conduit à l’asphyxie de toute vie aquatique, ce phénomène entraine la dégradation de la qualité des eaux potables [11].
L’hydroxytrosol, qui est un composé phénolique, présente une toxicité élevée vis-à-vis des micro-organismes [12]. Les acides protocatéchique, syringique et vanillique sont moins toxiques, alors que le phénol et le catéchol sont les plus toxiques [13].
Dans notre travail, nous sommes intéressés à acide gallique comme composé phénolique. L’acide gallique ou acide 3, 4, 5-trihydroxy-benzoïque est un membre de la classe des acides hydroxy-benzoïques ; c’est une substance naturellement retrouvée dans les noix de Galle et l’écorce de chêne, les feuilles de thé, l’épluchure de pomme, le raisin et le vin [14]. Des études récentes ont étudié l’effet anti-tumoral, pro-apoptotique et anti inflammatoire de l’acide gallique [15,16]. L’acide gallique a fortement inhibé la migration des cellules
Page 6 cancéreuses et les métastases via la suppression de l’expression des métalloprotéases (MLPs), et ces effets semblent inclure l’inhibition de plusieurs protéines incriminées dans les voies de métastases et la réorganisation du cytoskelette [15,17]. L’acide gallique a aussi induit une apoptose des lignées cancéreuses humaines par une régulation de la voie mitochondriale [18,19]. De plus, l’acide gallique pourrait supprimer l’expression des cytokines pro-inflammatoires et des chimiokines [16 ,20].
I.2. L’adsorption
L’adsorption est un procédé de transfert de matière entre une phase liquide (ou gazeuse) chargée en composés organiques ou inorganiques et une phase solide [21]. La substance qui se fixe sur le solide est appelée adsorbât, le solide qui est le siège de l’adsorption est nommé adsorbant. Ce phénomène spontané provient de l’existence de forces à la surface de l’adsorbant. Il se traduit en particulier par une modification de concentration à l’interface de deux phases non miscibles (gaz /solide ou liquide/solide) [22].
I.2.1 Types d'adsorption
Suivant la nature des liaisons entre le substrat et les particules adsorbées, on distingue deux types d'adsorption:
- La physisorption qui est due principalement à des forces physiques. - La chimisorption qui est due surtout à des forces chimiques.
A. La physisorption
C’est un phénomène réversible dû principalement aux forces de Van der Waals et aux liaisons hydrogènes entre les molécules d’adsorbât et les atomes de la surface de l’adsorbant La physisorption est caractérisée par :
- La rapidité de l’établissement de l’équilibre entre la phase adsorbée et la phase fluide.
- La réduction de la capacité d’adsorption avec l’élévation de la température. - La réversibilité est relativement facile [23].
Page 7 B. La chimisorption
Ce type d’adsorption résulte des forces de liaison de nature chimique, ionique, covalente ou par transfert de charge.
L’adsorption chimique est un phénomène irréversible géré par des interactions chimiques qui provoquent un transfert ou une mise en commun d’électrons entre l’adsorbât et la surface de l’adsorbant. On assiste donc à une destruction de l’individualité des molécules adsorbées et la formation de nouveaux composés à la surface de l’adsorbant. Ce type d’adsorption se développe à haute température et met en jeu une énergie élevée variant de 10 à 100 Kcal par mole [24,25].
I.2.2. Mécanisme d’adsorption
Il s’agit d’un transfert d’une phase liquide ou gaz contenant l’adsorbât vers une phase solide avec rétention des solutés à la surface du l’adsorbant [8]. Ce processus se déroule en trois étapes (Figure I.2) [9].
1- Diffusion externe: elle correspond au transfert du soluté du sein de la solution à la surface externe de l’adsorbant. Ce transfert de matière externe dépend des conditions hydrodynamiques de l’écoulement d’un fluide dans un lit d’adsorbant. Cette étape est rapide [8,9].
2- Diffusion interne: les particules du fluide diffusent dans la structure poreuse de la surface externe des grains vers les sites actifs sous l’influence du gradient de concentration du soluté. Cette étape est lente.
3- Interaction d’adsorption: elle correspond à la fixation des molécules sur la surface des pores. Une fois adsorbées, les molécules sont considérée comme immobiles. Cette étape est très rapide [8,9].
Page 8 I.2.3. Facteurs influençant le phénomène d’adsorption
L’efficacité d’un adsorbant vis-à-vis d’un adsorbât dépend d’un nombre important de paramètres dont les principaux sont :
A. Les conditions opératoires
La température
L’adsorption physique s’effectue à des basses températures (phénomène exothermique), alors que l’adsorption chimique demande des températures plus élevées (phénomène endothermique). Ce qui nécessite de fixer la température du processus dès le départ. En pratique, il n’y a pas de modification significative dans l’intervalle 5-20°C [28].
Le pH
Le pH joue un rôle important sur la cinétique d’adsorption[29]. Généralement les composés acides s’adsorbent à faible pH et les composés basiques à un pH plus élevé [30].
B. La nature de l’adsorbant
Le choix de l’adsorbant adéquat pour effectuer une séparation dépend de plusieurs paramètres :
Surface spécifique
Elle est définie comme étant sa surface par unité de masse (exprimée en m2/g), La quantité de substance adsorbée augmente avec l’accroissement de la surface absorbante, pour atteindre un effet d’adsorption important, il est nécessaire que la surface de l’adsorbant soit la plus grande possible [31].
La distribution de la taille des pores
L’adsorption d’une substance croit avec la diminution de la taille des particules et les dimensions des pores de l’adsorbant. Mais si le diamètre des pores est inferieur au diamètre des molécules, l’adsorption de ce composé sera négative, même si la surface de l’adsorbant a une grande affinité pour le composé. La distribution des tailles des pores joue un rôle important dans la cinétique globale du Processus d’adsorption [32].
C. La nature de l’adsorbât
Tout solide peut être considéré comme adsorbant potentiel [33], mais la capacité d’un adsorbant varie d’un adsorbant à un autre. Par exemple des substances ayant une structure
Page 9 spongieuse ou fortement poreuse; ou celles qui sont finement pulvérisées (état de dispersion élevée) constituent de bons adsorbants.
La polarité
L’affinité de l’adsorbant polaire pour le solvant est plus élevée quand ce dernier est plus polaire que le solvant [28].
La solubilité
D’après la règle de LUNDELUIS : « moins une substance est soluble dans le solvant, mieux elle est adsorbée ». Il faut rompre le lien entre les solutés et l’eau pour autoriser l’adsorption. La facilité avec laquelle l’adsorbant fixe l’adsorbât, est fonction de la taille de la molécule et de sa solubilité dans l’eau. L’adsorption des composés ionisés est faible. Un haut poids moléculaire réduit la diffusion de l’étape 3 par conséquent, la fixation. Il devient évident que les substances de caractère hydrophobe, peu affines avec l’eau, sont quantitativement adsorbées [34].
1.2.4 Les différents types d’adsorbants
Les solides agissant comme adsorbants sont caractérisés par une structure microporeuse développée, ce qui leur confère une très grande surface active par unité de masse. Les adsorbants utilisés dans la pratique sont, soit de nature organique (végétale ou animale), soit de nature minérale. Ils sont employés tels quels ou après un traitement d’activation ayant pour but d’augmenter la porosité [23].
Les adsorbants les plus utilisés dans les applications industrielles sont les suivants: [23,35]
A. Les zéolithes
Les zéolithes ne sont pas coûteuses, elles ont une large répartition géographique. L'une des premières applications de la zéolithe naturelle dans l'élimination des métaux lourds de la solution aqueuse remonte à la fin des années 70 [36].
Dans la dernière décennie, on a eu un intérêt croissant dans l'utilisation de zéolithes naturelles comme échangeur de cations dans le traitement des effluents contenant des métaux lourds. L’adsorption sur les particules zéolithiques est un processus complexe en raison de leur structure poreuse, présence d'ions échangeables, les surfaces intérieures et extérieures chargées, l'hétérogénéité minéralogique [35].
Les zéolithes permettent la séparation des molécules d’un mélange selon leur taille et leur forme, par exemple la séparation des hydrocarbures à chaine linéaire et à chaine ramifiée [23].
Page 10 B. Gels de silice
Les gels de Silice (SiO2, nH2O) se présentent sous la forme de grains durs et poreux avec une surface spécifique de 600 à 800 m²/g, dont la taille des pores varie de 20 à 50 Å. Ils s’obtiennent par action de l’acide chlorhydrique sur une solution de silicate de sodium [23]. Ils sont utilisés pour ôter l’eau de divers gaz, mais aussi, parfois, pour la séparation d’hydrocarbures [37].
C. Alumines activées
Les alumines activées disposent d’une surface de 200 à 500 m²/g avec des pores de 20 à 140 Å[23]. Elles sont obtenues par déshydratation thermique du tri hydrate d’alumine. Elles sont très hydrophiles et ont une affinité réelle pour l’eau et sont souvent utilisées pour sécher différents gaz [37].
D. Argiles
Parmi les matériaux naturels, l’argile est considérée comme un bon adsorbant suite à son faible coût, sa disponibilité en abondance, et surtout grâce à ses bonnes propriétés d’adsorption. Il existe différents types d'argiles telles que bentonite, argile commune, l'argile réfractaire, terre de Fuller et de kaolinite [38] . On obtient les argiles activées par addition d’eau à certaines qualités d’argiles (bentonite, kaolinite, terre de Fuller,…), puis incorporation à la pâte ainsi obtenue d’une certaine quantité d’acide chlorhydrique. L’opération est suivie d’un lavage et séchage. Ils sont généralement utilisés pour la décoloration et la purification des huiles minérales [23].
E. Charbon actif
Le charbon activé élimine les impuretés de l’eau en les fixant et en les faisant accumuler à sa surface, c’est pourquoi une grande surface par unité de volume et une forme poreuse constituent les caractéristiques les plus essentielles d’un charbon actif.
La fixation des impuretés dépend de la grosseur des pores de charbon actif. Ainsi, certaines molécules ne peuvent pas être adsorbées par des pores de trop petites tailles par rapport à leur grosseur. Les qualités d’adsorption du charbon actif sont fonction des matières premières et des procédés d’activation. Ce type d’adsorbant peut être produit à partir de différents matériaux comme le bois, le charbon, les noyaux de fruits [26].
Page 11 I.2.5 Équilibre d’adsorption
Les isothermes d’adsorption représentent la quantité adsorbée à l’équilibre d’un composé gazeux ou liquide sur une surface à pression et à température constantes. L’équation générale s’écrit :
qe F
Ce (Eq.I.1) Où qe représente la quantité de soluté adsorbée à l’équilibre par unité de masse decharbon (mg/g) et Ce la concentration de soluté à l’équilibre (mg/L) I.2.5.1 Classification des isothermes d’adsorption
Parmi les classifications proposées dans la littérature, on distingue celle de Brunauer et coll. et celle de Gilles et coll [39]. Cette dernière présente quatre classes nommées par convention S, L, H et C (figure I.10).
Page 12
Classe S
Les isothermes de cette classe décrivent la plupart du temps une adsorption coopérative, dans laquelle l'interaction adsorbat-adsorbat est plus forte que celle entre adsorbant et adsorbat. La courbe est sigmoïde et possède donc un point d'inflexion. Cette isotherme est toujours la conséquence de la compétition entre deux mécanismes opposés. Les molécules adsorbées favorisent l'adsorption ultérieure d'autres molécules. Ceci est dû aux molécules qui s'attirent par des forces de Van Der Waals, et se regroupent en îlots dans lesquels elles se tassent les unes contre les autres [40,41]. Les polluants organiques apolaires présentent ce type d'isotherme lors de leur adsorption sur les surfaces minérales chargées. En effet, ils ont une affinité médiocre avec ces surfaces. Mais le peu de composé apolaire qui commence à être adsorbé induit la création d'une surface apolaire pour laquelle les autres molécules du même composé ont davantage d'affinité [42,43 et 44].
Classe L
Les isothermes de classe L présentent, à faible concentration en solution, une concavité tournée vers le bas qui traduit une diminution des sites libres au fur et à mesure de la progression de l'adsorption. Ce phénomène se produit lorsque les forces d'attraction entre les molécules adsorbées sont faibles. Elle est souvent observée quand les molécules sont adsorbées horizontalement, ce qui minimise leur attraction latérale [41].Ces isothermes, dites «Langmuir», sont les plus fréquentes [44].
Classe H
Les isothermes de classe H décrivent une interaction forte entre adsorbat et adsorbant et représentent un cas extrême de la classe L, où la pente à l'origine est très élevée. Ce cas a été distingué pour représenter le cas où le composé possède une grande affinité pour la phase solide [42].
Classe C
Les isothermes de cette classe se caractérisent par une partition constante entre la solution et le substrat jusqu'à un palier. La linéarité montre que le nombre de sites libres reste constant au cours de l'adsorption. Ceci signifie que les sites sont créés au cours de l'adsorption. Ce qui implique que les isothermes de cette classe sont obtenues quand les molécules de soluté sont capables de modifier la texture du substrat en ouvrant des pores qui n'avaient pas été ouverts préalablement par le solvant [41].
Page 13 I.2.5.2.Modèle des isothermes d’adsorption
Dans un système solide-liquide, l'adsorption est le résultat d'un déplacement (un transfert) des molécules de solutés présentes dans la solution, suivi de leur accumulation à la surface du solide [42].
La masse de soluté adsorbé se mesure par la relation: [40]
(Eq. I.2)
X:masse de soluté adsorbée (mg).
:concentration initiale en soluté dans la solution (mg/l). : concentration à l’équilibre (finale) dans la solution (mg/l). V:volume de solution (l).
Isotherme de Langmuir
Langmuir fut le premier à proposer une relation entre la quantité d’un gaz adsorbé et sa pression d’équilibre [45] . Il définit l’équilibre d’adsorption comme un processus dynamique entre les molécules arrivant à la surface et celles quittant la surface. Il considère que la fixation se produit sur des centres possédant la même énergie et qu’il n’existe aucune interaction entre les molécules adsorbées.
C'est le modèle le plus utilisé pour commenter les résultats trouvés au cours de l'adsorption des composés organiques en solution aqueuse. A une température constante, la quantité adsorbée q est liée à la capacité maximale d'adsorption qm, à la concentration à l'équilibre Ce du soluté et à la constante d'affinité K par l'équation :
(Eq.I.3) La transformée linéaire de ce modèle a pour équation
:
= + . (Eq.I.4)En portant en fonction de on obtient une droite de pente et d'ordonnée à l'origine , cela permet la détermination des deux paramètres d'équilibre de l'équation et K.
L’isotherme de Langmuir est la courbe, à température constante, résultant de la représentation de la quantité adsorbée (qe) en fonction de la concentration de la solution en soluté (Ce).
Page 14 Figure I.4 : Courbe modèle de Langmuir
Isotherme de Freundlich
C'est une équation empirique largement utilisée pour la représentation pratique de l'équilibre d’adsorption [46] . Elle se présente sous la forme :
q e (Eq.I.5) Q : Quantité adsorbée par gramme du solide.
Ce : Concentration de l'adsorbât à l'équilibre d'adsorption.
Kf et : constantes de Freundlich caractéristiques de l'efficacité d'un adsorbant donné vis à- vis d'un soluté donné.
La transformée linéaire permettant de vérifier la validité de cette équation est obtenue par
passage en échelle logarithmique : Ln q = Ln Kf + Ln Ce [47]. (Eq.I.6) En traçant Ln q en fonction de Ln Ce, on obtient une droite de pente et d'ordonnée à
l'origine Ln Kf.
Isotherme d’Elovich
La relation d’Elovich (1962) diffère de celle de Langmuir au sujet de l'évolution des sites d'adsorption. Le nombre de site disponible varie dans ce modèle de manière exponentielle au cours de l'adsorption, ce qui implique une adsorption en plusieurs couches. L’isotherme d’Elovich s’exprime par :
Page 15
(Eq.I.7)
La linéarisation de l’équation donne :
Ln = Ln(K* ) + (Eq.I.8) où (mg. g-1) est la quantité maximale adsorbée par unité de masse de l'adsorbant, K est la
constante d’adsorption d’Elovich liée à l'affinité des sites de surface avec l’adsorbat [48].
Le modèle de Temkin
L’isotherme de Temkin tient compte du fait que la chaleur d'adsorption de l'ensemble des molécules de la couche de recouvrement diminue linéairement avec le recouvrement en raison de la diminution des interactions adsorbant-adsorbat. L'adsorption est caractérisée par une distribution uniforme des énergies de liaison en surface. L’isotherme de Temkin est exprimée sous la forme :
(Eq.I.9) ou sous la forme :
(Eq.I.10) Avec = (J/mol), la constante de Temkin relative à la chaleur de sorption et Kt , la
constante d'équilibre d’adsorption correspondant à l'énergie de liaison maximale [48].
Isotherme de Dubinin-Raduskevich
Une autre équation utilisée dans l'analyse des isothermes a été proposée par Dubinin et Radushkevich en 1947[48 -50]. Elle suppose une surface hétérogène. Cette équation est utilisée pour estimer les caractéristiques de porosités apparentes et l’énergie libre d’adsorption [52].L’équation est exprimée comme suit :
(Eq.I.11)
L’équation peut être linéarisée sous forme :
(Eq.I.12) Avec qm, la capacité maximum théorique d’adsorbat adsorbé à la surface du solide et ɛ, le
Page 16
(Eq.I.13) La constante « ɛ » représente l'adsorption de la molécule sur l’adsorbant suite à son transfert
depuis la solution. β et E (kJ. ) sont liés par la relation
(Eq.I.14) Ainsi, en traçant Ln (qe) en fonction de ɛ il est possible d'obtenir la valeur de qm
(mol. ) et β.
E : permet de savoir si l'adsorption suit un mécanisme d'échange d'ions ou si c’est une adsorption physique. Si E est comprise entre 8 et 16 kJ , le processus suit une adsorption par échange d'ions, tandis que pour les valeurs de E < 8 kJ. , le processus d'adsorption est de nature physique et si E > 16 kJ , le processus est dominé par la diffusion intra-particule [ 49,50].
Isotherme de Fowler-Guggenheim (1965)
Elle est basée sur la thermodynamique statique et prend en compte les interactions latérales entre molécules adsorbées, à partir du modèle de Langmuir.
Il s’agit toujours d’une couche d’adsorbat au plus adsorbée de manière mono-moléculaire. Elle est basée sur les hypothèses suivantes [51]:
- Une molécule adsorbée est liée à un site défini avec une énergie d’interaction et cette molécule peut diffuser d’un site à un autre ;
- Cette énergie d’interaction est constante et indépendante du recouvrement θ et par conséquent du nombre de la distribution des molécules adsorbées.
- Les molécules adsorbées sur les sites voisins ont une énergie d’interaction égale à o
Z est le nombre de voisin les plus proches ; W l’énergie d’interaction entre les molécules
adsorbées (kJ .mol-1) de Fowler-Guggenheim.
Elle est exprimé en fonction du taux de recouvrement θ par :
θ θ θ (Eq.I.15) Lorsque :
• <0, Si les molécules adsorbées s’attirent .
• 0 il y a alors répulsion entre molécules adsorbées. L’équation peut être linéarisée sous la forme :
Page 17
(Eq.I.16) Ce qui permet d’en déduire la constante d’adsorption et K et W, K étant une constante relative
aux interactions adsorbat-adsorbant.
Si = 0, l’isotherme obtenue est de la forme : KC=
(Eq.I.17)
On retrouve alors l’isotherme de Langmuir, qui peut être un cas particulier de l’isotherme de
Fowler-Guggenheim.
Isotherme de Hill (1946)
Ce type d’équation tient compte également des interactions entre molécules d’adsorbat. L’équation proposée par Hill (1946) et Boer (1953) en phase liquide en fonction du taux de recouvrement est la suivante :
(Eq.I.18)
Nous pouvons linéariser l’équation sous la forme :
(Eq.I.19)
Ce qui permet d’accéder aux deux constantes K1 et K2, respectivement une constante
d’équilibre représentant les interactions adsorbat-adsorbant et une constante énergétique d’interaction entre molécules d’adsorbat elles-mêmes [51].
I.2.6 Cinétique d’adsorption
Le phénomène d’adsorption, contrôlé par la diffusion des molécules atteint son équilibre rapidement (quelques secondes à quelques minutes). Mais, peut se prolonger sur des temps très longs pour les adsorbants microporeux en raison du ralentissement de la diffusion des molécules dans ces structures de dimensions voisines du diamètre des molécules du fluide [53-56].
L’étude de la cinétique d’adsorption repose sur la détermination des concentrations des substances étudiées dans une phase liquide en fonction du temps.
Page 18 L’étude cinétique des processus d’adsorption fournit des informations relatives au mécanisme d’adsorption et sur le mode de transfert des solutés de la phase liquide à la phase solide. A l’instar des équilibres d’adsorption, la cinétique d’adsorption d’un matériau peut être modélisée. A cet effet, la littérature rapporte un certain nombre de modèles cinétiques d’adsorption. Nous présentons ci-dessous quelques modèles.
A. Modèle de la cinétique du pseudo premier ordre
L’équation du pseudo premier ordre, dite équation de Lagergren (1898)[57] , décrit l’adsorption dans un système solide-liquide[58]. Il a été supposé dans ce modèle que la vitesse d’adsorption à l’instant t est proportionnelle à la différence entre la quantité adsorbée à l'équilibre, qe, et la quantité qt adsorbée à cet instant et que l'adsorption est réversible [42]. Autrement dit, l’adsorption est d'autant plus rapide que le système est loin de l'équilibre. Ce système peut être décrit par la relation:
[57]. (Eq.I.20)
Tel que: qe (mg/g) : quantité adsorbée à l’équilibre qt (mg/g): quantité adsorbée à l’instant t. k1: constante de vitesse de Lagergren.
L’intégration de cette équation entre 0 et t pour le temps et entre 0 et qt pour la quantité adsorbée permet d’obtenir la forme linéaire de Lagergren [57]:
ln (qe- qt)= ln qe- k1t (Eq.I.21) Le tracé la courbe ln (qe- qt) en fonction de t permet de déterminer la constante K1 et la
quantité adsorbée à l’équilibre qe
B. Modèle de la cinétique du pseudo seconde ordre
Le modèle du pseudo-second ordre est généralement utilisé pour décrire les phénomènes d’adsorption de type chimisorption et il s’exprime selon l’équation suivante [59] :
2 t e 2 t K q q dt dq (Eq.I.22) Tel que:Page 19 K2: constante de vitesse du modèle cinétique du 2ème ordre (mg.g-1.min-1).
L’intégration de cette équation entre 0 et t pour le temps et entre 0 et qt pour la quantité adsorbée permet d’obtenir la forme linéaire du modèle de pseudo seconde ordre:
t . q 1 q . K 1 q t e 2 e 2 t [58] . (Eq.I.23)
Le tracé la courbe t/ qt en fonction de t permet de déterminer la constante K2 et la quantité adsorbée à l’équilibre qe.
C. Modèle de la diffusion intra-particulaire
En général, n’importe quel processus d’adsorption peut être décrit par trois principales étapes:
1- la diffusion de surface.
2- La diffusion intra-particulaire ou dans les pores.
3-L’adsorption à l’intérieur des sites de l’adsorbant. Etant donné que la dernière étape est très rapide, il est supposé qu’elle n’a pas d’influence sur la vitesse d’adsorption et que l’adsorption est contrôlée soit par la diffusion de surface ou la diffusion intra-particulaire.
Le modèle de diffusion intra-particulaire de Weber-Morris a souvent été utilisé pour déterminer si une diffusion intra-particulaire est l'étape limitant de la vitesse. L'équation de diffusion intra-particulaire peut être écrite comme suit[57] :
= +C (Eq.I.24) : la constante de la diffusion intra-particule en (mg .g-1.min-1/2).
C : est une constante liée à l’épaisseur de la couche limite.
La constante est déduite de la pente de la partie linéaire de l'équation représentant ce modèle )
La courbe ) devrait être linéaire si la diffusion intra-particulaire est impliquée dans le procédé d'adsorption et si le graphe passe par l'origine, la diffusion intra-particulaire est la seule étape limitant la vitesse. Il a également été suggéré que dans les cas où la courbe est multilinéaire (plusieurs tronçons de droites sont observés), deux ou plusieurs étapes régissent le processus d'adsorption [57].
Page 20 L’effet de transfert de masse par diffusion externe (film) est significatif seulement au début du processus. Il est représenté par le premier tronçon de droite, les autres tronçons représentent la diffusion intra-particulaire.
D. Modèle d'Elovich
Elle peut être exprimée par [60] :
(Eq.I.25) Où:
la vitesse initiale d’adsorption (mg/g. min) et: la constante de désorption (g/mg). Pour simplifier l’équation d’Elovich il a été supposé que t=et que qt=0 à t= 0, donc on obtient :
= ln(β ln(t) (Eq.I.26) On trace qt= f (ln t) on peut déterminer les valeurs de
α
etβ
I.2.6. Les paramètre thermodynamiques
La compréhension des paramètres thermodynamiques est la condition la plus appropriée pour l’évaluation d’un procédé d’adsorption. Ces paramètres ont été développés sous l’hypothèse que la distribution de l’adsorbat est uniforme à la surface de l’adsorbant [61].
Le procédé d’adsorption est un processus réversible caractérisé par un équilibre thermodynamique entre le soluté en solution et celui adsorbé à la surface du solide.
La constante de distribution (Kd) est donnée par la relation:[62]
(Eq.I.27)
Les paramètres thermodynamiques sont déterminés à partir de La constante de distribution (Kd), La variation de l’énergie libre ∆G0
nous informe si l’adsorption est un processus spontané ou non spontané, Sa valeur est déduite de la relation:[61 et 62]
(Eq.I.28)
Page 21 Où: R est la constante des gaz parfaits (R=8.314 J mol-1 K-1), K est la température de la solution (K).
La courbe représentant la variation de Kd en fonction de 1/T conduit à aboutir aux valeurs de et . L’enthalpie de sa part informe sur l’exothermicité ou endothermicité du processus d’adsorption et l’entropie de l’autre part informe sur le degré de désordre à l’interface solide-liquide, et donc renseigne sur les interactions entre le soluté et les groupements fonctionnels à la surface du solide.
I.3 Les Hydroxydes Doubles Lamellaires [HDL]
Les hydroxydes doubles lamellaires appelés aussi les argiles anioniques. Elles sont des adsorbants efficaces dans élimination de variétés polluants anioniques. Elles présentent des propriétés d’échange anioniques, magnétiques et électrochimiques et physico-chimiques très importantes à cause de nombreuses recherches qui font ces dernières années l’objet d’un intérêt croissant en raison de leurs multiples applications [63].
Les HDLS ont une structure formée d’un empilement de feuillets analogues à la brucite. La charge positive induite par la présence simultanée de deux états d’oxydation bivalents ( ) comme , , etc. et trivalents ( ) comme , etc. est contrebalancée par des anions situés dans la partie inter lamellaire [64] .
Dans cette partie nous allons présenter la structure, les principales propriétés physicochimiques des (HDLs).
I.3.1. Structure et propriétés des matériaux hydroxydes doubles lamellaires HDLS A. Structure des hydroxydes doubles lamellaires
Les hydrotalcites sont des argiles anioniques de structure doubles lamellaires contenant des anions échangeables, analogue à celle de la brucite Mg(OH)2 ( figure I.5) dans laquelle les ions occupant les sommets des octaèdres sont remplacés par les ions ( figure I.6) [65,66].
Page 22
Les cations et occupent des octaèdres qui partagent leurs sommets de manière à former des couches (Figure I.7) qui empilées les unes sur les autres sont liées par des liaisons hydrogène de faible interaction ( Figure I.8) [67,68].
B. Formule générale de l’hydrotalcite et sa composition chimique
Dans l’hydroxyde double lamellaire, une fraction du métal divalent est substituée par un métal trivalent générant ainsi une charge positive. Cet excès de charge est neutralisé par la formation d’une structure lamellaire dans laquelle les couches positives ordonnées sont séparées les unes des autres par une couche désordonnée constituée d’anions et de molécules d’eau. La structure résultante possède donc des couches positives et négatives qui s’alternent. c’est pour cette raison que ces composés sont également connus comme hydroxydes mixtes organisés en couches dont l’anion est situé dans la région inter lamellaire [68,69].
Figure I.7 : Agencement des atomes dans la couche octaédrique [68].
Figure I.8: Schéma présente les liaisons d’hydrogène[68].
Figure I.6 : Structure d'un Hydroxyde Double Lamellaire [65].
Figure I.5 : la structure de la brucite Mg (OH)2 [65].
Page 23 La formule générale de la structure des (HDL) est :
C- Nature des feuillets
De nombreux métaux divalents et trivalents peuvent être combinés pour former des hydroxydes doubles lamellaires. Les feuillets les plus couramment synthétisés sont à base de magnésium (M+2) et d’aluminium (M+3), comme dans l’hydrotalcite naturelle. Néanmoins, d’autres cations peuvent être associés [69-71] :
Où M+2 = Mg+2, , , , , , , , ………….. etc M+3 = , , , , , …………etc
n : Charge de la couche.
m : Nombre de molécules d’eau
D. Les valeurs de x
La structure d’hydrotalcite peut exister pour des valeurs de x comprises dans la gamme (0,1- 0,5). Cependant, certains travaux, ont montré qu’il n’était possible de l’obtenir que dans la gamme 0,2 ≤ x ≤ 0,33
[70,71] (Eq.I.30)
E. Nature des anions (A-n) dans l’espace inter-feuillet
L’espace inter feuillet et les propriétés physico-chimiques du matériau sont définis par la nature des anions qui le constituent. Actuellement, aucune limite concernant la nature des anions intercalés, n’a été démontrée. Cependant il est nécessaire que :
- Ces anions soient stables dans les conditions opératoires.
- Que ces anions ne présentent pas de contrainte stérique ou géométrique.
Anions inorganiques: , , , , , , , , , , , ……… .[69].
Ions polyoxometallates : Molybdate, Ferrate………… .[69,71].
Cyanocomplexes (en électrochimie) : [Fe ] , [ Mo ]4…[69-72]. Héteropolyacides : [PMo12O40]-4
Page 24 Les acides organiques : acide adipique, acide oxalique, acide succinique, acide
malonique, acide acrylate [69].
I.3.2. Propriétés des hydroxydes doubles lamellaires
Les hydroxydes doubles lamellaires (HDL), présentent un certain nombre de propriétés - Des surfaces spécifiques relativement élevée (de l’ordre de 100 – 300 /g) [69,73].
- Des propriétés basiques [69] : la basicité des HDLS contenant des cations différents apparaît comme liée à l’électronégativité de ces cations.
- Ces matériaux présentent par ailleurs d’excellentes propriétés d’échange anionique qui permet l’intercalation d’une grande variété d’anions organiques, et inorganique.
I.3.3. méthodes de préparations
Les hydroxydes doubles lamellaires sont plus rares dans la nature que les argiles cationiques, raison pour laquelle, de nombreux travaux sont consacrés aux différents modes de mise au point de ces solides [74].
Il existe différentes technique de mise au point : Synthèse hydrothermique [75].
Echange anionique du précurseur [75,76].
Reconstruction structurale grâce à l’effet mémoire que présentent ces solides [76,77].
La synthèse directe par la Co- précipitation [75,76].
Les deux méthodes les plus utilisées sont la Co-précipitation directe et l’échange anionique [76].
A. Co-précipitation directe
La méthode de Co-précipitation est la méthode la plus utilisée pour la synthèse des hyrotalcites. Cette méthode consiste à provoquer la précipitation simultanée des cations métalliques par l’ajout d’une espèce basique à une solution de sels correspondants pris en proportions adéquates.
Les meilleurs résultats s’obtiennent en ajoutant simultanément dans un réacteur contenant de l’eau, la solution des sels métalliques et la solution basique de façon à maintenir le pH à une valeur constante ont peut synthétiser des hydrotalcites par la méthode de Co-précipitation en faisant varier le pH de 4 à 12 [77].
Page 25 B. Échange anionique
L’échange anionique est une importante propriété qui peut être utilisée afin d’obtenir de nouveaux matériaux doubles lamellaires. La réaction d’échange est une opération topotactique qui permet de ce fait de conserver la structure ion – covalente des feuillets, alors que les liaisons plus faibles anions / feuillets sont détruites.
I.3.4. Valorisation des HDLs
Les applications des hydrotalcites sont nombreuses dans des différents domaines comme le résume la figure (I.9) [70].
Figure I.9 : Applications des Hydroxydes doubles lamellaires
Les HDL sont étudiés dans un certain nombre de laboratoires en vue de leurs applications soit comme catalyseurs, adsorbants, dans le domaine de l’environnement, ou pour être utilisés dans le domaine médical et pharmaceutique.
Pour notre part, ce matériau sera mis au point en vue leur utilisation dans l'adsorption de l'acide gallique.
I.3.5. Description des différentes techniques physico-chimiques d’analyse utilisées
Dans le domaine d’adsorption, nous ne pouvons nous contenter d’examiner le l’uniquement sous son aspect réactif, de sorte que une bonne compréhension de minimisée d’adsorption de notre adsorbat il est souvent utile d’effectuer des études approfondies sur les propriétés physicochimiques intrinsèques qui pourraient permettre d’éventuelles corrélations entre comportement d’adsorbat et certaines des caractéristiques de l’échantillon. Dans le cas des hydrotalcites, diverses techniques sont généralement utilisées tel que : l’analyse chimique
Page 26 (absorption atomique), la diffraction des rayons X (DRX), la spectroscopie infrarouge (FTIR), la mesure des surfaces spécifiques (BET),....
A. L’absorption atomique
L’absorption atomique est l’une des méthodes les plus utilisées dans l’analyse chimique élémentaire. On peut citer entre autres avantages, la sensibilité, la rapidité d’exécution, la sélectivité de la méthode.
L’analyse chimique élémentaire nous permet de proposer une formulation chimique du matériau et de confirmer le rapport si important M (II)/M (III).
B. diffraction des rayons x (DRX)
L’utilisation de cette méthode a pour but de déterminer – entre autres- le degré de cristallinité des échantillons, ainsi que la structure cristallographique. Elle s’appuie sur la loi de Bragg :
nλ = 2d sinθ Où :
n : nombre entier correspondant à l’ordre de la diffraction. λ : longueur d’onde du rayonnement utilisé ( λKα =1,5418 A°). d : distance inter-réticulaire (A°).
θ : angle de diffraction [78].
C. spectroscopie infra- rouge à transformée de fourrier (IR)
Il s’agit sans doute de la technique spectroscopique la plus utilisée, du fait que toutes les molécules poly-atomiques ont un spectre infrarouge. Elle permet ainsi d’obtenir facilement des informations sur les propriétés superficielles de l’échantillon.
D. la technique BET (brunauer- émet- Teller) et la méthode bjh (barret- joyner- halenda)
La réaction catalytique est une réaction qui se produit à la surface du solide. L’activité catalytique d’un solide est souvent donnée par mole/ unité de surface.
La connaissance de la surface disponible susceptible d’être en contact avec les réactifs est donc indispensable pour la compréhension de l’acte catalytique.
Page 27 L’isotherme établie par BRUANAUER, EMETT et TAYLOR basée sur la physisorption [69], est utilisée pour évaluer la surface d’un solide (couramment désignée par surface spécifique). La technique est basée sur la détermination du volume nécessaire pour former une monocouche (Vm) et de la surface de l’aire moléculaire de la molécule adsorbée. La méthode cinétique conduit à l’équation suivante :
(Eq.I.31) P : pression d’équilibre d’adsorption.
P0 : pression de vapeur saturante de l’adsorbant à la température de l’expérience.
C : constante qui dépend des chaleurs d’adsorption et de liquéfaction du gaz. Va: volume de gaz adsorbé à la pression P.
Vm : volume de gaz nécessaire pour l’établissement d’une couche mono moléculaire
complète.
On procède au tracé de la transformation linéaire BET en portant (P/ P0)/ Va (1- P/P0) en fonction de P/P0. Avec : 0.05< P/P0 <0.35.
On obtient une droite de pente C-1 /Vm C (avec C-1 / C voisin de 1) et l’ordonnée à l’origine
est 1 /VmC [79].
E. Microscopie électronique à balayage (MEB)
La microscopie électronique à balayage (MEB) est une technique de microscopie basée sur le principe des interactions électrons-matière. Un faisceau d'électrons balaie la surface de l'échantillon à analyser qui en réponse, réémet certaines particules (électrons secondaires et photons X). Différents détecteurs permettent d'analyser ces particules et de reconstruire une image de la surface (la résolution se situe entre 1 nm et 20 nm).
Une sonde électronique fine est projetée sur l'échantillon à analyser. L'interaction entre la sonde électronique et l'échantillon génère des électrons secondaires, de basse énergie qui sont accélérés vers un détecteur d'électrons secondaires qui amplifie le signal. À chaque point d'impact correspond ainsi un signal électrique. L'intensité de ce signal électrique dépend à la fois de la nature de l'échantillon et de la topographie de l'échantillon au point considéré. Il est ainsi possible, en balayant le faisceau sur l'échantillon, d'obtenir une cartographie de la zone balayée.
Page 28 F. La thermogravimétrie ou l’Analyse Thermogravimétrique (DTG ou TG)
La thermogravimétrie (TG) ou l’Analyse Thermogravimétrique (ATG) est une méthode reconnue pour la caractérisation thermique des matériaux. Elle permet d’étudier la variation de la masse d’un matériau en fonction du temps (mode isotherme) ou de température sous une atmosphère contrôlée. Le dispositif constitué d’une microbalance et d’un système de chauffage mesure les gains ou les pertes enregistrées par un système d’acquisition. La thermogravimétrie permet, ainsi, d’obtenir une quantification de la perte d’éléments constituant les matériaux (polymères, huiles, plastifiants…) et de surveiller leurs stabilités thermiques [80-83].
Page 29 Chapitre II
Matériels et Méthodes
La première partie de ce chapitre est consacrée à la description du procédé d’élaboration des HDLs, notamment au comportement des précurseurs en solution en fonction des conditions opératoires. Nous présenterons en suite les différentes techniques physico-chimiques d’analyses utilisées telles que : Analyse par microscopie électronique à balayage (MEB) de la surface d'Mg-AL-HDL, l’analyse chimique élémentaire par absorption atomique (SAA), la mesure de la surface spécifique des adsorbants par la méthode de BET, la diffraction des rayons X (DRX), la spectroscopie infrarouge à transformée de fourrier (IRTF), et L’analyse thermogravimétrique (TG, DTG). Nous terminons par l’étude de l’acide gallique. II.1. Synthèse de l'adsorbant HDL Mg-AL-HDL
La performance des adsorbants est fortement liée aux conditions de leurs préparations, dont la température, la vitesse d’addition des réactifs, la concentration des solutions, la nature des anions intercalés, le pH des solutions et le rapport molaire (M2+/M3+).
La technique de préparation des hydroxydes doubles lamellaires la plus utilisée est la méthode de Co-précipitation. Cette méthode consiste à précipiter simultanément au moins deux éléments au sein d’une solution généralement aqueuse. Le premier élément doit être bivalent (M2+) et le seconde un élément trivalent (M3+), il faut d’abord choisir le rapport molaire (X) entre les deux métaux qui coexisteront dans la structure du composé final. Le solide Mg-Al-HDL a été préparé par la méthode de Co-précipitation à pH constant (pH ≈10), qui consiste à mélanger deux solutions. Pour cette synthèse, nous utilisons le protocole expérimental suivant :
- La formule de l’HDL est [Mg0.66 Al0.33(OH)2]0.33(NO3-),0.5H2O et la masse molaire correspondante : 88.4273 g/ mol.
- Nous désirons obtenir 20 g de produit, soit un nombre de mole n : n = (20/88.4273) = 0.2261 mol
- De ce fait, les masses mMg de nitrate de magnésium (Mg(NO3)2.8H2O) et mAl de nitrate d’aluminium (Al(NO3)2.9H2O) utilisées pour la synthèse seront de :
mMg = 38.2749 g dans 150 mL d’eau mAl = 27.9989 g dans 150 mL d’eau
![Figure I.2 Le mécanisme d’adsorption [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/13836920.443729/23.892.231.625.910.1101/figure-i-le-mécanisme-d-adsorption.webp)
![Figure I.10 : Classification de Gilles et coll [39]](https://thumb-eu.123doks.com/thumbv2/123doknet/13836920.443729/27.892.263.680.548.904/figure-classification-gilles-coll.webp)
![Figure I.5 : la structure de la brucite Mg (OH) 2 [65].](https://thumb-eu.123doks.com/thumbv2/123doknet/13836920.443729/38.892.103.805.134.716/figure-structure-brucite-mg-oh.webp)