HAL Id: tel-01452844
https://tel.archives-ouvertes.fr/tel-01452844
Submitted on 2 Feb 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Diagnostic et évaluation de la gravité des maladies
chroniques du foie : impact de l’elastographie par ondes
de cisaillement “ supersonic shear imaging ”
Christophe Cassinotto
To cite this version:
Christophe Cassinotto. Diagnostic et évaluation de la gravité des maladies chroniques du foie : impact de l’elastographie par ondes de cisaillement “ supersonic shear imaging ”. Ingénierie biomédicale. Université de Bordeaux, 2016. Français. �NNT : 2016BORD0231�. �tel-01452844�
THÈSE PRÉSENTÉE POUR OBTENIR LE GRADE DE
DOCTEUR DE
L’UNIVERSITÉ DE BORDEAUX
ÉCOLE DOCTORALE SCIENCES DE LA VIE ET DE LA SANTE SPÉCIALITÉ BIOIMAGERIE
Par Christophe CASSINOTTO
DIAGNOSTIC ET EVALUATION DE LA GRAVITE DES
MALADIES CHRONIQUES DU FOIE
IMPACT DE L’ELASTOGRAPHIE PAR ONDES DE CISAILLEMENT
« SUPERSONIC SHEAR IMAGING »
Sous la direction de : M. Victor DE LEDINGHEN Soutenue le 23 Novembre 2016
Membres du jury :
M. TRILLAUD Hervé Professeur Bordeaux Président
Mme VILGRAIN Valérie Professeur Paris Rapporteur
M. BOURSIER, Jérôme Professeur Angers Rapporteur
M. AUBE, Christophe Professeur Angers Examinateur M. GRENIER, Nicolas Professeur Bordeaux Examinateur
SOMMAIRE ABBREVIATIONS ... 4 INTRODUCTION ... 5 PIECE JOINTE n°1 ... 11 ETUDE 1 ... 33 PIECE JOINTE n°2 ... 57 ETUDE 2 ... 59 ETUDE 3 ... 90
DISCUSSION ET PERSPECTIVES ... 118
CONCLUSION ... 124
ABBREVIATIONS
ARFI : Acoustic Radiation Force Impulse
APRI : Aspartate Aminotransferase to Platelet Ratio Index cACLD : compensated advanced chronic liver disease kPa : kiloPascal
LSM : Liver Stiffness Median
NAFLD : Non-‐‑Alcoholic Fatty Liver Disease PBH : Ponction-‐‑Biopsie Hépatique
IQR : InterQuartile Range SSI : Supersonic Shear Imaging SWE : Shear Wave Elastography
INTRODUCTION
Les maladies chroniques du foie constituent un problème majeur de santé publique, étant responsables d’une morbi-‐‑mortalité spécifique touchant les pays du monde entier. Leur prise en charge ainsi que leur pronostic sont largement basés sur la présence et le développement d’une fibrose hépatique, qui peut survenir lors de toute hépatopathie chronique, qu’elle soit d’origine virale, métabolique, alcoolique, auto-‐‑ immune ou héréditaire. L’aggravation progressive de la fibrose hépatique va aboutir chez un certain nombre de patients au développement d’une cirrhose et de ses complications potentielles comme la décompensation hépatique, l’ascite, les hémorragies digestives sur rupture de varices oesophagiennes, l’encéphalopathie et le carcinome hépato-‐‑cellulaire (1-‐‑4). L’évaluation précise du degré de fibrose hépatique apporte au clinicien une estimation du pronostic dès la prise en charge initiale de ces patients, mais permet également la réalisation d’une surveillance évolutive, et intervient dans la décision et le choix d’un traitement (5,6). La ponction-‐‑biopsie hépatique (PBH) est toujours considérée comme la référence pour l’évaluation et la quantification de la fibrose hépatique. Cependant, cette méthode diagnostique est invasive, souvent douloureuse, et peut s’accompagner de complications rares mais sévères (7). Son efficacité diagnostique est également limitée par une variabilité liée à la représentativité des échantillons, ainsi que par des discordances inter et intra-‐‑ observateurs (8).
L’évaluation non-‐‑invasive de la fibrose hépatique, apparue au début du XXIème siècle a permis de révolutionner la prise en charge des malades atteints d’une maladie chronique du foie. Deux approches distinctes ont été développées ces dernières années :
- l’une biologique consistant au dosage de marqueurs sanguins de fibrose hépatique. Ainsi, le Fibrotest (Biopredictive, Paris, France ; Fibrosure-‐‑Labcorp, Burlington, VT), l’APRI (aspartate aminotransferase to platelet ratio index), ou le FIB-‐‑4 score ont montré une utilité certaine dans le diagnostic de fibrose ou de cirrhose (9-‐‑14).
- Une approche « physique », qui consiste à réaliser une mesure de l’élasticité hépatique. L’évaluation de la vitesse de propagation d’une onde dite de cisaillement permet d’approcher certaines propriétés physiques intrinsèques du parenchyme hépatique comme l’élasticité. Plus le parenchyme est fibreux donc « dur », plus l’onde de cisaillement se propage rapidement.
Le premier outil développé suivant cette approche physique est le Fibroscan® (Echosens, Paris, France) dont la première étude fut publiée en 2002. De nombreuses
études ont depuis confirmé son efficacité et sa reproductibilité dans le diagnostic de fibrose sévère et de cirrhose chez les patients atteints d’hépatopathie chronique (15-‐‑ 17). Au-‐‑delà de l’impact diagnostique, son intérêt est également pronostique. Chez les patients cirrhotiques, il existe une relation entre le score du Fibroscan® et la survenue des complications de la cirrhose (18). Une récente étude a aussi montré que l’élasticité hépatique mesurée par Fibroscan® était pronostique de la survie à 5 ans des patients atteints d’hépatite virale C (19).
Le Fibroscan® a cependant de nombreuses limites. Si ses performances sont bonnes pour le diagnostic de fibrose sévère ou de cirrhose, elles restent perfectibles pour le diagnostic de fibrose significative. De plus, des échecs de mesure ou des résultats non interprétables surviennent respectivement dans 5 et 15% des cas, avec comme principal facteur limitant l’obésité (20). En effet, l’accumulation de tissu adipeux sous-‐‑cutané atténue la transmission de l’onde de cisaillement et des faisceaux ultrasonores qui vont mesurer sa propagation. Compte tenu que la prévalence de l’obésité et de ses manifestations hépatiques associées augmente de manière alarmante dans les pays occidentaux, cette limite est un frein potentiel à l’utilisation de cette technique en pratique clinique. Pour pallier à cette insuffisance, une nouvelle sonde de Fibroscan®, la sonde « XL », dédiée aux patients en surcharge pondérale, a récemment été développée (21). Son évaluation est en cours dans plusieurs études cliniques mais déjà ses résultats préliminaires sont prometteurs. Enfin, Le Fibroscan® n’est pas couplé à un appareillage ultrasonographique, et est donc limité à la mesure de l’élasticité hépatique, sans analyse morphologique hépatique réalisable.
Depuis 2009, une nouvelle méthode diagnostique est apparue dans le domaine de l’élastographie hépatique. L’ARFI (Acoustic Radiation Force Impulse) est basé sur des principes physiques proches de ceux du Fibroscan®, mais présente toutefois quelques différences fondamentales. Contrairement au Fibroscan®, le système d’élastométrie impulsionnelle est directement incorporé sur un appareil d’échographie standard (Acuson S2000 ; Siemens Medical Solutions, Mountain view, Calif), et l’onde de cisaillement est localisée, émise à partir d’une région fixée par l’opérateur. Ainsi, une évaluation de l’élasticité hépatique reste réalisable chez des patients en forte surcharge pondérale ou lorsque s’interpose un épanchement ascitique. Plusieurs études préliminaires ont confirmé l’intérêt diagnostique de cette nouvelle méthode, qui semble, comme le Fibroscan®, présenter une performance diagnostique satisfaisante surtout pour le diagnostic de fibrose sévère ou de cirrhose (22-‐‑24).
Une société française (Supersonic Imagine, Aix-‐‑en-‐‑Provence, France) a très récemment conçu et développé une nouvelle évolution technologique dans le domaine
de l’élastographie hépatique. La méthode Supersonic Shear Imaging (SSI), autrement appelée Shear Wave Elastography, est également basée sur le principe de mesure de la vitesse de propagation d’une onde de cisaillement dans les tissus mous. Comme l’ARFI et contrairement au Fibroscan, cette méthode est incorporée sur un appareil échographique, et ne nécessite pas de vibrateur externe pour produire l’onde de cisaillement. Contrairement à l’ARFI et au Fibroscan où l’évaluation de la propagation d’une seule onde de cisaillement est réalisée à chaque mesure, la méthode SSI permet l’évaluation synchrone de la propagation de plusieurs fronts d’ondes de cisaillement et donc la réalisation d’une multitude de mesures de vitesses de cisaillement émises sur une large gamme de fréquence (25, 26). Cette imagerie quantitative va permettre d’approcher l’élasticité d’un tissu sur une surface par la réalisation d’une cartographie couleur. En plaçant une région d’intérêt au centre de cette surface, la valeur calculée correspondra à la moyenne de nombreuses valeurs au sein de l’aire analysée. Même si cette nouvelle technique paraît très prometteuse, très peu d’études ont pour l’instant évalué son efficacité dans le domaine des maladies chroniques du foie. L’élastographie hépatique étant un domaine en constante évolution, il est indispensable d’étudier en profondeur chaque nouvelle technologie mise à disposition sur le marché afin d’en connaître les avantages et inconvénients par rapport aux techniques existantes, et donc de préciser leur application dans la pratique clinique et l’évaluation non-‐‑invasive de la fibrose hépatique.
Ce document présente 3 études dont le but est d’analyser les performances diagnostiques de l’élastographie « Supersonic Shear Imaging » ainsi que sa place dans l’évaluation non-‐‑invasive des maladies chroniques du foie :
1. Dans une première étude, nous avons prospectivement analysé et comparé les performances diagnostiques de l’élastographie SSI par rapport au FibroScan et l’ARFI pour le staging de la fibrose hépatique sur une série de 349 patients avec une maladie chronique du foie diagnostiquée et gradée par PBH.
2. Dans une seconde étude, nous avons prospectivement étudié l’impact diagnostique de l’élastographie SSI sur le foie et la rate chez une population de 401 patients avec cirrhose pour l’évaluation de la gravité de la maladie cirrhotique.
3. Dans une troisième étude, nous avons réalisé une étude prospective bicentrique (Angers et Bordeaux) analysant la performance diagnostique de l’élastographie SSI, du FibroScan et de l’ARFI dans l’évaluation non-‐‑invasive de la fibrose hépatique sur une série de 291 patients avec stéatopathie non-‐‑alcoolique.
Références
1. Ikeda K, Saitoh S, Suzuki Y, et al. Disease progression and hepatocellular carcinogenesis in patients with chronic viral hepatitis: a prospective observation of 2215 patients. J Hepatol 1998;28:930–8.
2. Benvegnu` L, Gios M, Boccato S, et al. Natural history of compensated viral cirrhosis: a prospective study on the incidence and hierarchy of major complications. Gut 2004;53:744–9
3. Adams LA, Lymp JF, St Sauver J, Sanderson SO, Lindor KD, Feldstein A, Angulo P. The natural history of nonalcoholic fatty liver disease: a population-‐‑based cohort study. Gastroenterology 2005;129:113-‐‑121.
4. de Ledinghen V, Ratziu V, Causse X, Bail BL, Capron D, Renou C, Pilette C, et al. Diagnostic and predictive factors of significant liver fibrosis and minimal lesions in patients with persistent unexplained elevated transaminases. A prospective multicenter study. J Hepatol 2006;45:592-‐‑599.
5. Strader DB, Wright T, Thomas DL, et al. American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004;39:1147–1171. Hepatology 2000;32:477–81.
6. Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45: 507–539.
7. Cadranel JF, Rufat P, Degos F. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF).
8. Bedossa P, Dargere D, Paradise V. Sampling variability of liver fibrosis in chronic hepatitis C. Hepatology 2003;38:1449–57.
9. Ngo Y, Munteanu M, Messous D, et al. A prospective analysis of the prognostic value of biomarkers (FibroTest) in patients with chronic hepatitis C. Clin Chem 2006;52:1887– 1896.
10. Ngo Y, Benhamou Y, Thibault V, et al. An accurate definition of the status of inactive hepatitis B virus carrier by a combination of biomarkers (FibroTest-‐‑ActiTest) and viral load. PLoS One 2008;3:e2573.
11. Naveau S, Gaude G, Asnacios A, et al. Diagnostic and prognostic values of noninvasive biomarkers of fibrosis in patients with alcoholic liver disease. Hepatology 2009;49:97–105.Fontaine H,
12. Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003;38:518–526.
13. Sterling RK, Lissen E, Clumeck N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006;43:1317–1325.
14. Cales P, Oberti F, Michalak S, Hubert-‐‑Fouchard I, Rousselet MC, Konate A, Gallois Y, et al. A novel panel of blood markers to assess the degree of liver fibrosis. Hepatology 2005;42:1373-‐‑81.
15. de Ledinghen V, Vergniol J. Transient elastography for the diagnosis of liver fibrosis. Expert Rev Med Devices. 2010;7:811-‐‑23.
16. Fraquelli M, Rigamonti C, Casazza G, Conte D, Donato MF, Ronchi G, Colombo M. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut 2007;56:968-‐‑973.
17. Boursier J, Konate A, Guilluy M, Gorea G, Sawadogo A, Quemener E, Oberti F, et al. Learning curve and interobserver reproducibility evaluation of liver stiffness measurement by transient elastography. Eur J Gastroenterol Hepatol 2008;20:693-‐‑701. 18. Foucher J, Chanteloup E, Vergniol J, et al. Diagnosis of cirrhosis by transient
elastography (FibroScan): a prospective study. Gut 2006;55:403–408.
19. Vergniol J, Foucher J, Terrebonne E, et al. Noninvasive Tests for Fibrosis and Liver Stiffness Predict 5-‐‑Year Outcomes of Patients With Chronic Hepatitis C. Gastroenterology 2011;140:1970-‐‑1979.
20. Foucher J, Castera L, Bernard PH, Adhoute X, Laharie D, Bertet J, Couzigou P, et al. Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations. Eur J Gastroenterol Hepatol 2006;18:411-‐‑412.
21. de Ledinghen V, Fournier C, Foucher J, Miette V, Vergniol J, Rigalleau V, Merrouche W, et al. New FibroScan probe for obese patients. A Pilot study of feasibility and performances in patients with BMI ≥ 30 kg/m². Liver Intern 2010;30:1043-‐‑8.
22. Cassinotto C, Lapuyade B, Aït-‐‑Ali A, Vergniol J, Gaye D, Foucher J, et al. Liver fibrosis: non-‐‑invasive assessment with acoustic radiation force impulse elastography-‐‑ comparison with Fibroscan M and XL probes and FibroTest™ in patients with chronic liver disease. Radiology 2013;269:283–292.
23. Bota S, Herkner H, Sporea I, Salzl P, Sirli R, Neghina AM, et al. Meta-‐‑analysis: ARFI elastography vs. transient elastography for the evaluation of liver fibrosis. Liver Int 2013;33:1138–1147.
24. Friedrich-‐‑Rust M, Nierhoff J, Lupsor M, Sporea I, Fierbinteanu-‐‑Braticevici C, et al. Performance of acoustic radiation force impulse imaging for the staging of liver fibrosis: a pooled meta-‐‑analysis. J Viral Hepat 2012;19:e212–e219.
25. Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping. IEEE Trans Ultrason Ferroelectr Freq Control 2004;51:396–409.
26. Muller M, Gennisson JL, Deffieux T, Tanter M, Fink M. Quantitative viscoelasticity mapping of human liver using supersonic shear imaging: preliminary in vivo
Pièce jointe n°1
Elastography: French innovations in the spotlight
Cassinotto C.
Diagnostic and Interventional Imaging.
2016 Jan;97(1):1-‐‑2. doi: 10.1016/j.diii.2015.12.002.
In fifteen years elastography has undoubtedly got a mature technique status! But, who would have anticipated in the early 2000s that elastography would have become in a couple of years this routine diagnostic tool responsible for major changes in the management of so many conditions?
The story started in 1999 when researchers from the “Laboratoire Ondes et Acoustique” (LOA) of Paris VII-‐‑Diderot University proposed to quantify the stiffness of biological tissues using measurement of displacements induced by the propagation of pulsed shear waves [1]. Some of them designed and marketed the FibroScan® (Echosens, Paris, France) that was the first machine dedicated to the liver parenchyma stiffness measurement, because elastography was originally specifically designed for the liver. This innovation was followed by an impressive success as well as a uniform acknowledgment of the added medical value of this new technology. Later, in 2007, the French «Haute Autorité de Santé» approved the use in liver stiffness measurements for the staging of fibrosis in hepatitis C patients. This use was further approved by the European Association for the Study of the Liver (EASL) in 2011 [2]. Another key date was 2011 when a group of hepatologists in Bordeaux finally demonstrated that liver stiffness measurement was an independent prognostic factor of 5-‐‑years survival in patients with initial diagnosis of C viral hepatitis [3]. Since that time, the clinical impact of liver stiffness measurement has been validated worldwide [4].
Since then, elastography has become a rapidly developing field with frequent technological innovations. In this regard, each manufacturer or vendor offers an elastography program. But once again, the “LOA” of Paris VII-‐‑Diderot University played a pivotal role in this frantic technological race, with the development of Supersonic Shear Imaging (SSI), also named 2D-‐‑shear wave elastography (2D-‐‑SWE). SSI elastography available on Aixplorer® US machines (Supersonic Imagine, Aix-‐‑en-‐‑
Provence, France) is also based on the measurement of the velocity of a local shear wave through soft tissues, but herein the radiation force induced by an ultrasonic beam is combined with an ultrafast imaging sequence capable of catching in real time the propagation of the resulting shear waves. By generating a real-‐‑time color mapping of the elasticity encoded pixel by pixel in an image superimposed on the standard B-‐‑ mode, SSI allows a quantitative imaging of the tissue elasticity.
Although the SSI technique is quite recent, first studies demonstrated the potential clinical relevance and the accuracy of this new tool especially in the field of liver fibrosis or breast lesions [5]. In this issue of Diagnostic & Interventional Imaging, two well-‐‑designed studies confirmed the great role that SSI can play in the area of diagnostic ultrasonography. First, a nicely performed study by Guibal et al. demonstrated the high degrees of diagnostic accuracy of SSI for the staging of liver fibrosis [6]. Second, a well-‐‑designed study by Dorado-‐‑Cortez et al. investigated the reliability of SSI in the field of muscle elastography [7]. Both studies nicely participate to the mounting evidence that SSI is an accurate and reliable elastography technique. However, there is still a long way until elastography reaches its zenith. First, performing reliable stiffness measurements is not always easy and requires some experience, therefore raising the issue of the training of operators as well as the identification and validation of reliability criteria for each different elastography techniques. Second, each elastography technique has its own stiffness values, ranges and cut-‐‑offs. Regarding the liver, we noted in our experience and works that by chance, SSI values and cut-‐‑off values were quite close to those obtained with the FibroScan®, which is convenient for its wide dissemination among hepatologists already familiar with the range of FibroScan® values for many years. However, the multiple available elastography techniques may conceptually mirror the Tower of Babel [8]. Of note, should a patient have follow-‐‑up evaluation with different techniques, it will become difficult or even impossible to obtain a reliable assessment of possible changes. Ideally, all manufacturers and elastography researchers should work together to find how a harmonization of values should be possible between the different techniques, and if not possible, to find at least the way of converting or calibrating values between these different techniques. This issue of interplatform reproducibility has been addressed using magnetic resonance imaging [9] but not with ultrasound. Such a study would serve as a template for ultrasound [9].
Finally, the widespread implementation of elastography modules on most ultrasound machines had the advantage to expand the application scope of elastography to others organs than liver, such as breast, thyroid, kidney, spleen, muscles, or even vessel parietal wall. As evidences are not as mature in these organs as they are for the liver, many advances and progress are expected for these other applications in the coming years. As it has been done for the liver, we will also need to
increase our understanding of technical and patient factors that might affect elastography performances, regardless the type of organ or disease studied. Nevertheless, the implementation of elastography on almost all ultrasound machines allowed the radiological community to become the cornerstone regarding the development of elastography, from routine clinical application to future research trends. We have to prove now that we are capable to deal with and overcome all the challenges that elastography will have to face in the near future.
REFERENCES
1. Sandrin L, Catheline S, Tanter M, Hennequin X, Fink M. Time-‐‑resolved pulsed elastography with ultrafast ultrasonic imaging. Ultrason Imaging 1999;21:259-‐‑72. 2. Craxì A, Pawlotsky JM, Wedemeyer H, Bjoro K, Flisiak R, Forns X, et al. EASL
Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011;55:245-‐‑64.
3. Vergniol J, Foucher J, Terrebonne E, Bernard PH, le Bail B, Merrouche W, et al. Noninvasive tests for fibrosis and liver stiffness predict 5-‐‑year outcomes of patients with chronic hepatitis C. Gastroenterology 2011;140:1970-‐‑9.
4. Gennisson JL, Deffieux T, Fink M, Tanter M. Ultrasound elastography: principles and techniques. Diagn Interv Imaging 2013;94:487-‐‑95.
5. Klotz T, Boussion V, Kwiatkowski F, Dieu-‐‑de Fraissinette V, Bailly-‐‑Glatre A, Lemery S, et al. Shear wave elastography contribution in ultrasound diagnosis management of breast lesions. Diagn Interv Imaging 2014;95:813-‐‑24.
6. Guibal A, Renosi G, Rode A, Scoazec JY, Guillaud O, Chardon L et al. Shear wave elastography: an accurate technique to stage liver fibrosis in chronic liver diseases. Diagn Interv Imaging 2016;
7. Dorado Cortez C, Hermitte L, Ramain A, Mesmann C, Lefort T, Pialat JB. Ultrasound shear wave velocity in skeletal muscle: a reproducibility study. Diagn Interv Imaging 2016;doi: 10.1016/j.diii.2015.05.010.
8. https://www.biblegateway.com/passage/?search=Genesis11:1-‐‑9 (accessed on Dec 9, 2015)
9. Yasar TK, Wagner M, Bane O, Besa C, Babb JS, Kannengiesser S, et al. Interplatform reproducibility of liver and spleen stiffness measured with MR elastography. J Magn Reson Imaging 2015; doi: 10.1002/jmri.25077.
PRE-‐‑REQUIS : ELASTOGRAPHIE POUR LE DIAGNOSTIC NON-‐‑INVASIF DE LA FIBROSE HEPATIQUE
Au début du 21ème siècle sont apparus les scores non-‐‑invasifs sanguins de fibrose hépatique ainsi que la mesure de la dureté du foie par FibroScan® qui ont permis de révolutionner la prise en charge des malades atteints d'ʹhépatopathie chronique. En quelques années, ces méthodes non-‐‑invasives de diagnostic de la fibrose hépatique ont connu un tel essor qu’en 2007, la Haute Autorité de Santé a validé leur intérêt clinique en recommandant soit la PBH, soit le FibroTest, soit le FibroScan® dans la prise en charge initiale d'ʹune hépatite virale C sans comorbidité (1). Nous présentons ci-‐‑dessous les bases physiques des principales méthodes actuellement disponibles ainsi que les études scientifiques qui ont permis leur validation.
! Elastographie : bases physiques
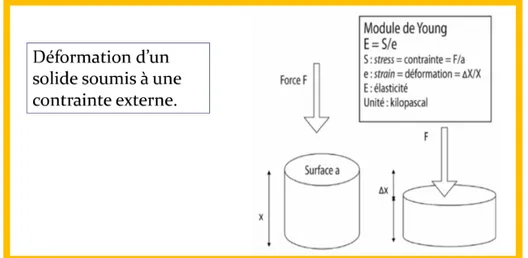
L’élastographie est une technique qui permet d’approcher les propriétés mécaniques des tissus. Les différents concepts d’élastographie reposent sur la même base : estimer la dureté d’un tissu via l’évaluation quantitative du module de Young :
" Soit par l’étude de la déformation du tissu soumis à une contrainte (Fig. 1)
Figure 1 : schéma descriptif du concept physique du module de Young
Cette approche peut être rapprochée de la mesure physique quantitative du geste qualitatif de palpation du médecin.
" Soit par la mesure de propagation d’ondes de cisaillement sensibles à la dureté du tissu :
E (module de Young) = 3.ρ.v
2
Où ρ est la masse volumique (constante ≈ 1000 kg/m2) et v la vitesse de l’onde en m/s. Plus la vitesse v est élevée, plus le milieu est dur.
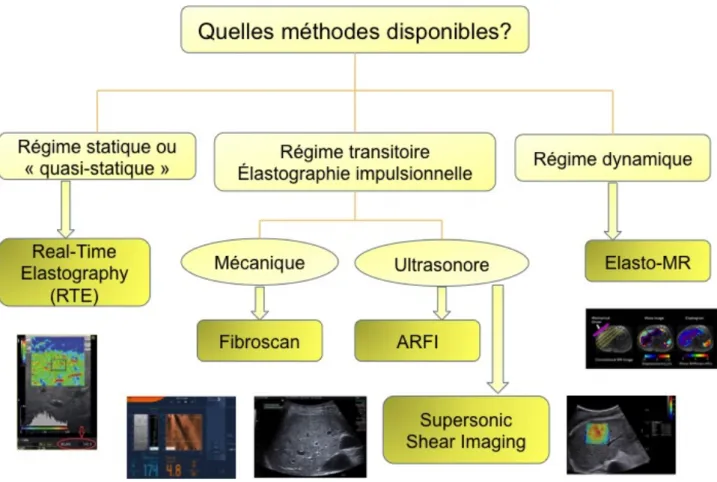
Ainsi, en fonction de la méthode utilisée pour évaluer le module de Young, et du régime appliqué pour évaluer la déformation du tissu ou la propagation de l’onde, plusieurs techniques d’élastographie ont été développés (Fig. 2) :
Figure 2 : organigramme résumant les différentes techniques d’élastographie disponibles en 2013
Dans ce document, nous nous sommes concentrés sur les techniques basées sur un régime transitoire, qui sont les principales utilisées en pratique clinique courante, et celles dont nous disposons actuellement au CHU de Bordeaux.
L’élasticité hépatique est donc le reflet direct de la dureté du foie et non de la fibrose hépatique. En effet, si dans les maladies chroniques du foie, la fibrose est le principal
facteur responsable d’une augmentation de la dureté du parenchyme hépatique, il n’est pas le seul, et bien d’autres facteurs confondants ont été décrits (Fig. 3) :
Figure 3 : facteurs intervenant dans la valeur d’élasticité hépatique
! La mesure de l’élasticité hépatique par FibroScan o Technique
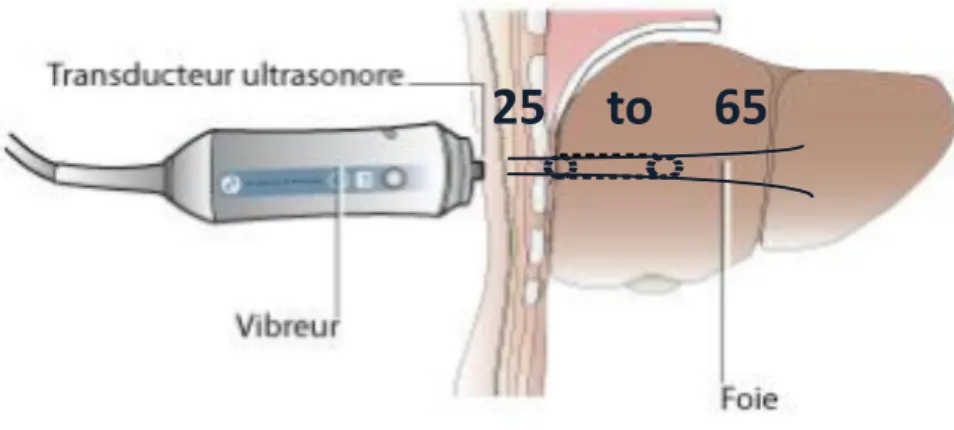
Le FibroScan (EchoSens, Paris, France), ou élastométrie impulsionnelle, est la méthode de référence dans l’évaluation non-‐‑invasive de la fibrose hépatique, car la première mise au point, et donc la plus étudiée. Le FibroScan est composé d’un vibreur monté sur un transducteur ultrasonore, le tout constituant la sonde de FibroScan (Figures 4-‐‑ 6). Après pression sur un bouton, le vibreur placé en région intercostale droite transmet une impulsion à la surface de la peau, ce qui va engendrer une onde mécanique dont la vitesse de propagation sera mesurée par ultrasons sur une longueur de 4 cm de long et 1 cm de diamètre. L’estimation de l’élasticité du tissu à partir de la mesure de la vitesse de l’onde est exprimée en kPa (kilopascal). Plus le foie est dur, plus l'ʹonde mécanique induite par le FibroScan se déplace rapidement, et plus les valeurs en kPa sont élevées.
Figure 4 : schéma représentant la sonde de FibroScan et l’impulsion mécanique en regard du lobe droit hépatique
Figure 5 : sonde de FibroScan
Figure 6 : FibroScan : vue d’ensemble de l’appareillage
25 to 65
mm
o Applications cliniques
Le FibroScan a été à l’origine du formidable essor de l’élastographie hépatique dans les années 2000. Il a jeté les bases de l’intérêt clinique de l’élastographie hépatique dans des domaines aussi variés que :
# Le dépistage (2)
# Le diagnostic de la fibrose (3,1) # Le suivi des patients traités (4)
# L’évaluation de la sévérité de la cirrhose (5) # Le prognostic des patients (6-‐‑8)
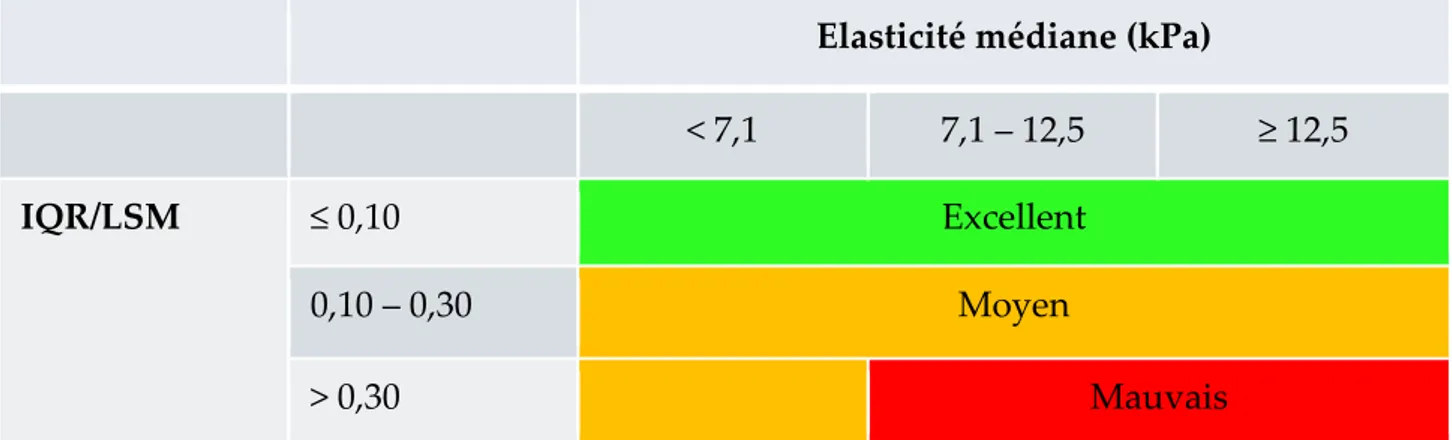
Les valeurs obtenues sont comprises entre 2 et 75 kPa. Le résultat final est la médiane de 10 mesures. L’appareil affiche aussi l’interquartile range (IQR), et le taux de réussite (nombre de mesures obtenues par rapport au nombre de tirs effectués). La durée totale de l’examen n’excède pas 5 minutes. Il a été démontré qu’une mesure pourra être considérée comme fiable ou valide essentiellement en fonction du ratio IQR/LSM (liver stiffness median) (Tableau 1) (9).
Elasticité médiane (kPa)
< 7,1 7,1 – 12,5 ≥ 12,5
IQR/LSM ≤ 0,10 Excellent
0,10 – 0,30 Moyen
> 0,30 Mauvais
Tableau 1 : classification décrivant la fiabilité de la mesure d’élasticité hépatique en fonction de la valeur d’élasticité et du ratio IQR/LSM. Source : Boursier et al. Hepatology 2013 (9)
La valeur moyenne d’élasticité hépatique chez les sujets « normaux » c'ʹest-‐‑à-‐‑dire dépourvus d’hépatopathie chronique, est de 5,5 ± 1,6 kPa (10). Les valeurs d’élasticité hépatique sont plus importantes chez les hommes que chez les femmes, chez les sujets obèses et chez les sujets avec syndrome métabolique.
C’est certainement pour le diagnostic de la cirrhose que le FibroScan a le plus grand intérêt, car sa performance est excellente, quelle que soit l’étiologie de la maladie hépatique. C’est dans les hépatites virales, et notamment l’hépatite C que la performance du FibroScan® a été la plus étudiée, mais il existe maintenant nombre
d’études scientifiques qui valident l’utilisation du FibroScan dans la plupart des étiologies de maladies chroniques du foie, dont la NAFLD (11,12).
Cependant, dans certains cas, aucune valeur n’est obtenue malgré 10 tirs (4 à 10% des cas selon les études). Les facteurs associés à un échec de mesure sont l’ascite, l’index de masse corporelle ainsi que l’épaisseur de la paroi thoracique et le tour de taille (13). Devant ces limites, les concepteurs du FibroScan ont développé vers 2008 une sonde de FibroScan dite « XL », adaptée aux patients en surcharge pondérale.
! La sonde XL de FibroScan
La nouvelle sonde de FibroScan, appelée sonde XL, a été conçue spécialement pour les malades en surcharge pondérale avec une fréquence d’ultrasons plus basse, un transducteur ultrasonore plus sensible, une mesure de l’élasticité hépatique plus profonde et une amplitude de vibration plus importante (Tableau 2) (10).
Tableau 2 : caractéristiques respectives des sondes M et XL de FibroScan
En quelques années, la littérature est déjà abondante sur la sonde XL, montrant son intérêt dans le diagnostic de la fibrose hépatique quelle que soit son étiologie. Il a notamment été montré que les performances diagnostiques des deux sondes semblent identiques mais avec des valeurs seuils pour l’interprétation des résultats plus basses avec la sonde XL qu’avec la sonde M (14). La sonde XL permet le diagnostic de la fibrose hépatique avec la même performance que la sonde M mais avec beaucoup moins d’échecs de mesure (2% d’échecs avec la sonde XL versus 10% avec la sonde M). Et chez les patients avec BMI > 25 kg/m2, la mesure avec la sonde XL est possible dans 75% des cas d’échec de mesure de la sonde M (15,16).
! La mesure de l’élasticité hépatique par Acoustic Radiation Force Impulse (ARFI)
o Technique
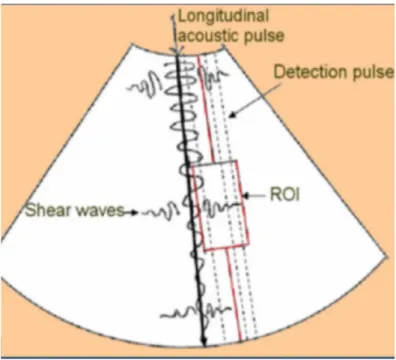
La technologie ARFI (Acoustic Radiation Force Impulse) consiste en un système d’élastométrie impulsionnelle incorporée sur un appareil échographique conventionnel (Acuson S2000) développé par Siemens (Siemens Medical Solutions, Mountain View, Calif). L’avantage d’un tel système est d’utiliser l’imagerie échographique temps réel pour cibler une région d’intérêt où l’opérateur souhaite réaliser la mesure d’élasticité. Dans la zone ainsi sélectionnée, la sonde d’échographie émet une onde (ou pulse) ultrasonore localisée, de haute intensité et de courte durée, suivie d’une série d’autres ondes diagnostiques qui vont permettre d’analyser la propagation de l’onde initiale au sein du tissu excité (Fig. 7, 8). La séquence ARFI est constituée d’impulsions de référence, suivie d’une impulsion d’excitation qui génère l’onde de cisaillement, et enfin d’impulsions de suivi qui enregistrent la réponse à la déformation du tissu induite par l’onde de cisaillement. La vitesse de l’onde de cisaillement est recueillie latéralement de part et d’autre d’une fenêtre centrale de 5 mm de profondeur sur 4 mm de largeur, positionnée au sein d’une région d’intérêt de 1cm sur 6mm (17). Les résultats sont exprimés en mètres par seconde. Contrairement au FibroScan, l’onde de cisaillement est transmise au tissu à distance de la sonde émettrice, les mesures d’élasticité pouvant donc être réalisées en présence d’ascite, ou d’une épaisseur pariétale importante.
Figure 8 : exemple de mesure d’élasticité hépatique en mode ARFI réalisée sur échographe Acuson S2000
Pour éviter la compression tissulaire liée au positionnement de la sonde, les mesures s’effectuent par voie inter-‐‑costale droite au niveau du parenchyme hépatique droit,
chez un patient en décubitus dorsal, a jeun, lors d’apnées coutes ou avec une respiration lente. La région d’intérêt est positionnée à distance de la zone sous-‐‑
capsulaire et des grosses structures vasculaires, en choisissant une fenêtre échographique où au moins 6 cm d’épaisseur de parenchyme hépatique sont visualisables. Comme pour le FibroScan, il est recommandé de réaliser plusieurs échantillonnages afin d’obtenir 10 mesures valides. La médiane de ces 10 mesures est la valeur d’élasticité finale retenue (Fig. 9). Les valeurs sont comprises entre 0,5 et 4,4
m/sec.
o Applications cliniques
La technologie ARFI a commencée à être appliquée à l’évaluation non-‐‑invasive de la fibrose hépatique à partir de l’année 2009. Plusieurs études puis méta-‐‑analyses ont rapidement confirmé que les performances de l’ARFI étaient satisfaisantes pour le diagnostic de fibrose sévère et de cirrhose (Tableau 3).
Auteurs Design Patients Pathologies AUROC Cut-‐‑offs
≥F2 ≥F3 F4 ≥F2 ≥F3 F4 Nierhoff 2013 (18) Méta-‐‑analyse 3951 Multi-‐‑étiologie 0.84 0.89 0.91 1.35 1.61 1.87 Friedrich-‐‑Rust 2012 (19) Méta-‐‑analyse 518 Multi-‐‑étiologie 0.87 0.91 0.93 1.34 1.55 1.80 Sporea 2012 (20) Multicentrique rétrospectif 914 VHC 0.79 0.83 0.84 1.33 1.43 1.55
Tableau 3 : performances diagnostiques de l’ARFI pour grader la fibrose hépatique
Comparativement au FibroScan, il a été montré que l’ARFI a des performances comparables pour le diagnostic de fibrose significative et de cirrhose (Tableau 4).
Tableau 4 : comparaison des performances diagnostiques de l’ARFI et du FibroScan. En jaune foncé lorsque la supériorité est significative, jaune clair les résultats d’une méta-‐‑analyse réalisée en 2013 et ne
retrouvant pas de différence significative entre les 2 techniques.
Auteurs Patients Pathologies ARFI FibroScan
≥F2 ≥F3 F4 ≥F2 ≥F3 F4 Lupsor 2009 (21) 112 VHC 0.85 0.87 0.91 0.94 0.93 0.95 Sporea 2012 (22) 223 Multi-‐‑étiologie 0.89 0.95 0.95 0.99 Rizzo 2011 (23) 139 VHC 0.86 0.94 0.89 0.78 0.83 0.80 Cassinotto 2013 (24) 321 Multi-‐‑étiologie 0.81 0.85 0.88 0.88 0.89 0.91 Bota 2013 Méta-‐‑ analyse (25) 1163 Multi-‐‑étiologie 0.85 0.93 0.87 0.93
Si la technologie ARFI a montré son intérêt potentiel dans le diagnostic et la stadification de la fibrose hépatique, d’autres études restent nécessaires pour affiner les valeurs seuils diagnostiques des différents degrés de fibrose, potentiellement variables selon l’étiologie de l’hépatopathie chronique, rechercher les critères de qualité d’une mesure fiable et les facteurs associés à des mesures d’élasticité non fiables. De plus, il faudra probablement se positionner pour homogénéiser et résoudre le problème de l’unité de mesure de l’élasticité hépatique. En effet, l’Acuson S2000 de Siemens exprime les résultats d’ARFI en mètre par seconde (m/sec), ce qui est assez perturbant pour des cliniciens maintenant habitués dans leur pratique quotidienne à utiliser le kiloPascal pour exprimer la dureté du foie. Enfin, comme le Fibroscan, l’ARFI est une technique d’évaluation unidimensionnelle. Une seule mesure est réalisée à chaque échantillonnage, évaluant la dureté d’une zone de parenchyme de petite taille, prédéfinie et non modifiable.
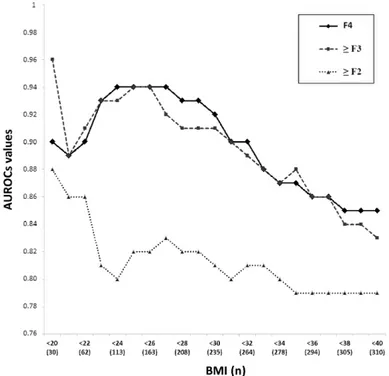
Une dernière limite de l’ARFI que nous avions décrite en 2013 est la baisse de ses performances diagnostiques chez les patients en forte surcharge pondérale (Fig. 10) (24). En effet, les échecs de mesure avec l’ARFI sont rares, mais en contrepartie, la fiabilité de ces mesures semble décroître avec la qualité de la fenêtre acoustique qui est intimement liée à l’épaisseur de paroi que les ondes ont à traverser et donc à l’indice de masse corporelle du patient. Cette notion renforce la nécessité de mettre au point des critères de qualité des mesures d’élastographie réalisées avec l’ARFI.
Figure 10 : Evolution des performances diagnostiques de l’ARFI en fonction de la limite supérieure d’indice de masse corporelle de la population étudiée. BMI= body mass index ; AUROC= Area under
! La mesure de l’élasticité hépatique par Supersonic Shear Imaging (SSI)
o Technique
L’élastographie SSI, aussi connue sous le nom de Shear Wave Elastography (SWE) et maintenant appelée 2D-‐‑SWE, a été mise au point par le laboratoire Ondes et Acoustique de Paris-‐‑VII, qui est l’unité de recherche également à l’origine du FibroScan. Comme avec l’ARFI, la technologie SSI est implémentée sur un échographe standard, l’Aixplorer (Supersonic Imagine, Aix-‐‑en-‐‑Provence, France), et réalisable avec une sonde d’échographie convexe standard. La technique est, comme avec l’ARFI, basée sur la mesure de la vitesse de propagation d’ondes de cisaillement générées par ultrasons. A la différence de l’ARFI, les forces radiaires générées par ultrasons ne sont pas appliquées à un point donné mais sont focalisées à des profondeurs croissantes générant un front d’onde de cisaillement qui se propage dans la zone explorée. La même sonde émettrice réceptionne à très haute fréquence les données de vitesse de propagation de cette multitude d’ondes de cisaillement. Le résultat est rendu sous forme d’une cartographie temps réel de l’élasticité pixel par pixel codée en couleur dans une image superposée au mode B standard (Fig. 11) (26-‐‑28).
Figure 11 : représentation d’une mesure d’élasticité hépatique en mode SSI avec l’échographe Aixplorer de Supersonic Imagine
Cette technologie innovante a été mise au point grâce au développement de l’imagerie ultra-‐‑rapide (UltraFastTM Imaging) qui est basée sur 3 principes :
- une onde plane
- une très grande fréquence de répétition de l’onde plane (jusqu’à 20000 Hz)
- et une très grande vitesse de traitement des données de réception (plusieurs GBytes/s)
En échographie conventionnelle, le temps d’acquisition est dépendant de la profondeur de l’écho le plus distant et du nombre de lignes composant l’image. Pour remplir 128 lignes, un faisceau est « focusé » 128 fois pour remplir la totalité de l’image. En imagerie ultra-‐‑rapide, une seule onde plane est émise pour la totalité de l’image, le temps d’acquisition ne dépendant plus alors que de la profondeur de l’écho le plus profond (Fig. 12).
Figure 12 : représentation schématique de la technique d’émission de l’onde plane avec la technologie UltraFast Imaging (Source : d’après J. Bercoff et C. Casalegno, Supersonic Imagine)
La création de l’onde de cisaillement est basée sur une technologie ARFI, avec une force radiaire émise à un point donnée en « focusant » un faisceau ultrasonore, et entraînant la propagation latérale d’une onde de cisaillement (Fig. 13).
Figure 13 : émission du faisceau radiaire ultrasonore et propagation de l’onde de cisaillement basée sur des principes d’ARFI (Source : d’après J. Bercoff et C. Casalegno, Supersonic Imagine)
Avec le SSI, les forces radiaires à l’origine des ondes de cisaillement seront successivement appliquées à 4 profondeurs croissantes sur la même ligne, et ce à une vitesse plus rapide que la vitesse de l’onde de cisaillement elle-‐‑même (Fig. 14).
Figure 14 : génération d’un front d’onde de cisaillement en mode SSI (Source : Mme Casalegno, Supersonic Imagine)
Il en résulte un front d’onde de cisaillement dont la vitesse de propagation est réactualisée en temps réel par imagerie ultra-‐‑rapide. L’élastographie SSI est dans la catégorie d’élastographie dite « transitoire » car l ‘émission des forces radiaires n’est pas continue mais la réactualisation des données en temps réel donne une impression d’élastographie « quasi-‐‑dynamique ».
o Applications cliniques
Au moment de débuter nos travaux en 2013, très peu d’études avaient analysé l’intérêt clinique de cette technique récente dans les maladies chroniques du foie. Seules 2 études pilotes, l’une de 2012 avec des patients ayant une hépatite chronique virale C (29), et l’autre de 2013 sur l’hépatite chronique virale B (30), semblaient présager de performances satisfaisantes comparativement au FibroScan .
Auteurs Patients Pathologies SSI Fibroscan
≥F2 ≥F3 F4 ≥F2 ≥F3 F4 Ferraioli (2012) (29) 121 VHC 0.92 0.98 0.98 0.84 0.96 0.96 Leung (2013) (30) 226 VHB 0.88 0.93 0.98 0.78 0.83 0.92 Tableau 5 : études pilotes présentant les performances diagnostiques de l’élastographie SSI pour grader
la fibrose hépatique en comparaison au FibroScan. En jaune lorsque la supériorité est significative.
! Synthèse des techniques actuellement disponibles et nouvelle nomenclature
Devant la multiplication des techniques d’élastographie ces dernières années, et leur dénomination plus basée sur des critères marketing que scientifiques, il est devenu nécessaire d’y voir plus clair et de définir une nouvelle nomenclature qui identifie clairement chaque technologie d’élastographie. Cela est d’autant plus vrai que le terme d’élastographie transitoire, caractérisant le FibroScan dans la littérature depuis sa conception, peut également s’appliquer à l’ARFI et au SSI. De même, aussi bien l’ARFI que le SSI sont basés sur une technologie ARFI, acronyme qui ne reflète que la technologie d’émission d’ondes radiaires par ultrasons. Depuis 2013, chaque société savante d’échographie a proposé des guidelines sur l’utilisation en pratique courante de l’élastographie hépatique, ainsi que sur les dénominations à utiliser (31-‐‑34). Il semblerait que la nomenclature proposée par l’EFSUMB (European Federation of Societies for Ultrasound in Medicine and Biology) en 2013 soit actuellement la plus utilisée (31).
Dans cette nomenclature, le FibroScan, qui a été la première technique développée, garde en anglais la dénomination de « transient elastography ». Aucune autre entreprise n’a reprise à son compte ou ne s’est associé à EchoSens pour la commercialisation de cette technologie. La technique d’élastographie initialement appelée ARFI et développée par Siemens (Siemens Medical Solutions, Mountain View, Calif) sous le terme de Virtual Touch Quantification® (VTIQ ou VTQ), est dorénavant dénommée point Shear Wave Elastography (pSWE) car basée sur la mesure de la vitesse de propagation d’une onde de cisaillement sur une petite zone de quelques millimètres (pouvant grossièrement s’apparenter à un point). Initialement implémentée sur l’échographe Acuson S2000, le pSWE a été ensuite implémentée sur les autres échographes Siemens. Cette technologie a par la suite équipée des échographes de marque Philips où elle était commercialisée sous le terme ElastPQ®. Ces 2 techniques de pSWE ont montré des résultats très reproductibles (35-‐‑37). Finalement, la technologie SSI, aperçue aussi sous le terme de shear wave
elastography (SWE), est renommée dans ces guidelines sous le terme de 2D-‐‑SWE ou real-‐‑time 2D-‐‑SWE. En effet, cette technique est également basée sur la mesure de la vitesse de propagation d’une onde de cisaillement mais cette mesure s’effectue sur une zone en 2 dimensions, bien plus importante qu’en pSWE, et avec une réactualisation en temps réel comme précédemment décrit. Dans ce manuscrit, nous garderons le terme de SSI car cette nomenclature était encore peu usitée au moment de la réalisation de nos travaux.
Références 1. http://www.has-‐‑sante.fr/portail/jcms/c_476486/criteres-‐‑diagnostiques-‐‑et-‐‑bilan-‐‑initial-‐‑ de-‐‑la-‐‑cirrhose-‐‑non-‐‑compliquee
2. Roulot D, Costes JL, Buyck JF, Warzocha U, Gambier N, Czernichow S, et al. Transient elastography as a screening tool for liver fibrosis and cirrhosis in a community-‐‑based population aged over 45 years. Gut 2011;60(7):977-‐‑84. doi: 10.1136/gut.2010.221382. 3. Craxì A, Pawlotsky JM, Wedemeyer H, Bjoro K, Flisiak R, Forns X, et al. EASL Clinical
Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011;55:245-‐‑ 64.
4. Vergniol J, Foucher J, Castéra L, Bernard PH, Tournan R, Terrebonne E, et al. Changes of non-‐‑invasive markers and FibroScan values during HCV treatment. J Viral Hepat 2009;16(2):132-‐‑40. doi: 10.1111/j.1365-‐‑2893.2008.01055.x.
5. Foucher J, Chanteloup E, Vergniol J, Castéra L, Le Bail B, Adhoute X, et al. Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study. Gut 2006;55:403– 408.
6. Vergniol J, Foucher J, Terrebonne E, Bernard PH, le Bail B, Merrouche W, et al. Noninvasive tests for fibrosis and liver stiffness predict 5-‐‑year outcomes of patients with chronic hepatitis C. Gastroenterology 2011;140:1970-‐‑9.
7. Vergniol J, Boursier J, Coutzac C, Bertrais S, Foucher J, Angel C, et al. Evolution of noninvasive tests of liver fibrosis is associated with prognosis in patients with chronic hepatitis C. Hepatology 2014 ;60(1):65-‐‑76. doi: 10.1002/hep.27069.
8. de Lédinghen V, Vergniol J, Barthe C, Foucher J, Chermak F, Le Bail B, et al. Non-‐‑ invasive tests for fibrosis and liver stiffness predict 5-‐‑year survival of patients chronically infected with hepatitis B virus. Aliment Pharmacol Ther 2013;37(10):979-‐‑88. doi: 10.1111/apt.12307.
9. Boursier J, Zarski JP, de Ledinghen V, Rousselet MC, Sturm N, Lebail B, et al. Determination of reliability criteria for liver stiffness evaluation by transient elastography. Hepatology 2013;57(3):1182-‐‑91. doi: 10.1002/hep.25993.
10. de Ledinghen V, Fournier C, Foucher J, Miette V, Vergniol J, Rigalleau V, Merrouche W, et al. New FibroScan probe for obese patients. A Pilot study of feasibility and performances in patients with BMI ≥ 30 kg/m². Liver Intern 2010;30:1043-‐‑8.
11. Wong VW, Vergniol J, Wong GL, Foucher J, Chan HL, Le Bail B, Choi PC, et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in Nonalcoholic Fatty Liver Disease. Hepatology 2010;51:454-‐‑62.
12. Yoneda M, Yoneda M, Mawatari H, Fujita K, Endo H, Iida H, et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with nonalcoholic fatty liver disease (NAFLD). Dig Liver Dis. 2008;40:371-‐‑8.
13. Foucher J, Castera L, Bernard PH, Adhoute X, Laharie D, Bertet J, Couzigou P, et al. Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations. Eur J Gastroenterol Hepatol 2006;18:411-‐‑412.
14. Myers RP, Pomier-‐‑Layrargues G, Kirsch R, Pollett A, Duarte-‐‑Rojo A, Wong D, et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology 2012;55(1):199-‐‑208. doi: 10.1002/hep.24624.
15. de Lédinghen V, Wong VW, Vergniol J, Wong GL, Foucher J, Chu SH, et al. Diagnosis of liver fibrosis and cirrhosis using liver stiffness measurement: comparison between M and XL probe of FibroScan®. J Hepatol 2012;56(4):833-‐‑9. doi: 10.1016/j.jhep.2011.10.017.
16. de Lédinghen V, Vergniol J, Foucher J, El-‐‑Hajbi F, Merrouche W, Rigalleau V. Feasibility of liver transient elastography with FibroScan using a new probe for obese patients. Liver Int 2010;30(7):1043-‐‑8. doi: 10.1111/j.1478-‐‑3231.2010.02258.x.
17. Friedrich-‐‑Rust M, Wunder K, Kriener S, Sotoudeh F, Richter S, Bojunga J, et al. Liver fibrosis in viral hepatitis: noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography. Radiology 2009;252(2):595-‐‑604. doi: 10.1148/radiol.2523081928.
18. Nierhoff J, Chávez Ortiz AA, Herrmann E, Zeuzem S, Friedrich-‐‑Rust M. The efficiency of acoustic radiation force impulse imaging for the staging of liver fibrosis: a meta-‐‑ analysis. Eur Radiol 2013;23(11):3040-‐‑53. doi: 10.1007/s00330-‐‑013-‐‑2927-‐‑6.
19. Friedrich-‐‑Rust M, Nierhoff J, Lupsor M, Sporea I, Fierbinteanu-‐‑Braticevici C, Strobel D, et al. Performance of Acoustic Radiation Force Impulse imaging for the staging of liver fibrosis: a pooled meta-‐‑analysis. J Viral Hepat 2012;19(2):e212-‐‑9. doi: 10.1111/j.1365-‐‑ 2893.2011.01537.x.
20. Sporea I, Bota S, Peck-‐‑Radosavljevic M, Sirli R, Tanaka H, Iijima H, et al. Acoustic Radiation Force Impulse elastography for fibrosis evaluation in patients with chronic hepatitis C: an international multicenter study. Eur J Radiol 2012;81(12):4112-‐‑8. doi: 10.1016/j.ejrad.2012.08.018.
21. Lupsor M, Badea R, Stefanescu H, Sparchez Z, Branda H, Serban A, et al. Performance of a new elastographic method (ARFI technology) compared to unidimensional transient elastography in the noninvasive assessment of chronic hepatitis C. Preliminary results. J Gastrointestin Liver Dis 2009;18(3):303-‐‑10.
22. Sporea I, Sirli R, Bota S, Popescu A, Sendroiu M, Jurchis A. Comparative study concerning the value of acoustic radiation force impulse elastography (ARFI) in comparison with transient elastography (TE) for the assessment of liver fibrosis in patients with chronic hepatitis B and C. Ultrasound Med Biol 2012;38(8):1310-‐‑6. doi: 10.1016/j.ultrasmedbio.2012.03.011.
23. Rizzo L, Calvaruso V, Cacopardo B, Alessi N, Attanasio M, Petta S, et al. Comparison of transient elastography and acoustic radiation force impulse for non-‐‑invasive staging of liver fibrosis in patients with chronic hepatitis C. Am J Gastroenterol 2011;106(12):2112-‐‑20. doi: 10.1038/ajg.2011.341.
24. Cassinotto C, Lapuyade B, Aït-‐‑Ali A, Vergniol J, Gaye D, Foucher J, et al. Liver fibrosis: noninvasive assessment with acoustic radiation force impulse elastography-‐‑-‐‑ comparison with FibroScan M and XL probes and FibroTest in patients with chronic liver disease. Radiology 2013;269(1):283-‐‑92. doi: 10.1148/radiol.13122208.
25. Bota S, Herkner H, Sporea I, Salzl P, Sirli R, Neghina AM, et al. Meta-‐‑analysis: ARFI elastography versus transient elastography for the evaluation of liver fibrosis. Liver Int 2013;33(8):1138-‐‑47. doi: 10.1111/liv.12240.
26. Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping. IEEE Trans Ultrason Ferroelectr Freq Control 2004;51:396–409. 27. Muller M, Gennisson JL, Deffieux T, Tanter M, Fink M. Quantitative viscoelasticity
mapping of human liver using supersonic shear imaging: preliminary in vivo feasability study. Ultrasound Med Biol 2009;35:219–229.
28. Bavu E, Gennisson JL, Couade M, Bercoff J, Mallet V, Fink M, et al. Noninvasive in vivo liver fibrosis evaluation using supersonic shear imaging: a clinical study on 113 hepatitis C virus patients. Ultrasound Med Biol 2011;37:1361–1373.
29. Ferraioli G, Tinelli C, Dal Bello B, Zicchetti M, Filice G, Filice C, et al. Accuracy of real-‐‑ time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study. Hepatology 2012;56:2125–2133.
30. Leung VY, Shen J, Wong VW, Abrigo J, Wong GL, Chim AM, et al. Quantitative elastography of liver fibrosis and spleen stiffness in chronic hepatitis B carriers: comparison of shear-‐‑wave elastography and transient elastography with liver biopsy correlation. Radiology 2013;269:910–918.
31. Cosgrove D, Piscaglia F, Bamber J, Bojunga J, Correas JM, Gilja OH, et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 2: Clinical applications. Ultraschall Med 2013;34:238–253.