L’érythropoïétine cérébrale: une nouvelle molécule
contre la dépression hypoxique chez le nouveau-né et
l’adulte.
Mémoire
Orlane Ballot
Maîtrise en neurobiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Orlane Ballot, 2016
III
Résumé
Durant l’hypoxie, l’érythropoïétine (Epo) agit sur le système nerveux central (SNC) pour réduire la dépression respiratoire. Mais nous ignorons si la présence de l’Epo endogène dans le SNC agit comme un stimulant respiratoire sexe-spécifique chez le nouveau-né et l’adulte, en hypoxie et en hypercapnie. Des souris âgées de 9 jours et de 3 mois reçoivent une injection intracisternale de l’antagoniste de l’Epo (sEpoR) ou d’un contrôle. 24h après, nous enregistrons les paramètres métaboliques et ventilatoires par pléthysmographie avec une période en normoxie, hypercapnie et différents cycles d’hypoxie. D’après nos résultats, sEpoR produit une dépression respiratoire en normoxie et en hypoxie, en raison d’une diminution de la fréquence respiratoire chez la femelle et du volume courant chez le mâle adulte et nouveau-né. De plus, une différence sexe-spécifique est remarquée en hypoxie seulement chez l’adulte. Cependant, ces résultats ne sont pas retrouvés en hypercapnie. L’Epo endogène est donc un important stimulant respiratoire en hypoxie.
V
Abstract
The erythropoietin (Epo) acts on the central nervous system (CNS) to reduce respiratory depression. However, we do not know whether the presence of endogenous Epo in the CNS acts as a respiratory stimulant sex-specific in newbons and adults, in hypoxia and in hypercapnia. Old mice 9 days and 3 months receive intracisternal injection of the antagonist Epo (sEpoR) or a control. 24 hours after we record the metabolic and ventilatory parameters by plethysmography with a period in normoxie, different cycles of hypoxia and in hypercapnia. According to our results, sEpoR produce a respiratory depression in normoxie and in hypoxia, due to a decrease in the respiratory frequency in the female and tidal volume in the male all both ages. In normoxia, sex-specific difference is noticed in two ages, but in hypoxia, only adults. However, this effect is not present in hypercapnia. Endogenous Epo is an important respiratory stimulant in hypoxia.
VII
Table des matières
Résumé ... III Abstract ... V Liste de tableaux ... XI Liste des figures ... XIII Liste des abréviations ... XVII Avant-propos ... XXI Remerciements ... XXIII
Chapitre I ... 1
Introduction ... 1
1. Le système respiratoire ... 3
1.1 Généralité sur le système du contrôle de la respiratoire ... 3
1.2 L’Hypoxie ... 4
1.2.1 La réponse ventilatoire à l’hypoxie ... 5
1.2.2 Implication des chémorécepteurs périphériques dans l’hypoxie ... 6
1.2.2.1 Anatomie des chémorécepteurs périphériques ... 6
1.2.2.2 Aspect physiologique de la réponse à l’hypoxie par les corps carotidiens ... 8
1.2.2.3 Mécanisme de chémosensibilité à l’O2 du corps carotidien (cellules de type I) ... 8
1.2.3 La contribution des chémorécepteurs centraux dans la réponse ventilatoire à l’hypoxie ... 10
1.3 L’hypercapnie ... 11
1.3.1 La réponse ventilatoire à l’hypercapnie ... 11
1.3.2. Contribution centrale à la réponse ventilatoire à l’hypercapnie ... 12
1.4 Maturation du système ventilatoire durant le développement postnatal .... 14
1.4.2 Développement de la réponse ventilatoire a l’hypercapnie ... 17
2. L’Érythropoïétine ... 18
2.1 Caractérisation et structure ... 19
2.1.1 Érythropoïétine ... 19
VIII
2.1.2.1 Le récepteur transmembranaire ... 21
2.1.2.2 Le récepteur soluble de l’Epo ... 23
2.2 Régulation de l’expression de l’érythropoïétine ... 24
2.3 Rôle classique de l’érythropoïétine : Érythropoïèse ... 25
2.4 Rôle non hématopoïétique de l’érythropoïétine (non classique)... 26
2.4.1 L’expression de l’Epo et L’EpoR et leurs régulations dans le cerveau ... 27
2.4.2 L’expression de l’Epo et EpoR dans le développement cérébral ... 28
2.4.3 L’Epo dans la neuroprotection ... 30
3. L’Érythropoïétine cérébrale et son implication dans le contrôle de la ventilation ... 32
3.1 L’expression des récepteurs de l’érythropoéïtine dans le système de contrôle respiratoire ... 32
3.2 Implication de l’érythropoéïtine dans l’activité respiratoire chez l’animal adulte... 33
3.3 L’implication de l’érythropoéïtine dans la réponse ventilatoire à l’hypoxie chez la souris adulte ... 33
4. Objectif de la recherche ... 37
Chapitre II ... 39
Endogenous brain erythropoietin is a potent sex-specific respiratory stimulant in adult and newborn mice ... 39
Résumé ... 41
1. Introduction... 43
2. Methods ... 45
2.1 Animals ... 45
2.2 Intracisternal Injection (ICI) ... 45
2.3 Respiratory recording using whole body plethysmography ... 46
Set-up details ... 46
Recordings and signals analysis ... 46
Statistical analysis ... 48
3. Results ... 49
3.1 In adult mice sEpoR decreases tidal volume in males and respiratory frequency in females ... 49
IX 3.2 In adult mice sEpoR decreases hypoxic ventilatory response in males but
not in females ... 49
3.3 In newborn mice sEpoR decreases tidal volume in males and females and respiratory frequency in females but not in males ... 50
3.4 In newborn male and female mice sEpoR decreases hypoxic ventilatory response ... 51
3.5. Age- and sex-specific of sEpoR on baseline respiratory and metabolic variables ... 52
4. Discussion ... 61
4.1 Methodological considerations ... 61
4.2. Cerebral Epo is a powerful endogenous respiratory stimulant. ... 62
4.3 The effect of Epo on the respiratory control system are sex dependent in adults... 63
4.4 The effects of Epo on the respiratory control system are sex dependent in newborn ... 64
5. Conclusion and perspectives ... 65
6. Acknowledgements ... 66
Chapitre III ... 67
The central chemosensitivity is not altered by cerebral erythropoietin ... 67
Résumé ... 69
Abstract ... 70
1. Introduction ... 71
2. Methods ... 73
2.1 Animals ... 73
2.2 Intracisternal Injection (ICI) ... 73
2.3 Respiratory recording using whole body plethysmography ... 74
Set-up details ... 74
Recordings and signals analysis ... 74
Statistical analysis ... 75
3.1 sEpoR does not alter the hypercapnic ventilatory response in adult mice 76 3.2 sEpoR does not alter the hypercapnic ventilatory response in newborn mice ... 76
X
4.1 Does sEpoR administrated by ICI bocks cerebral Epo? ... 81
4.2 Tidal volume discrepancy... 81
5. Conclusion and perspectives ... 83
6. Acknowledgements ... 83
Chapitre IV ... 85
Discussion et Conclusion... 85
1. Les forces et faiblesses des techniques utilisées ... 87
1.1 Utilisation de l’injection intracisternale ... 87
1.2 Utilisation de sEpoR ... 88
1.3 Utilisation de la pléthysmographie ... 89
2. L’érythropoéïtine cérébrale endogène dans la réponse ventilatoire à l’hypoxie et à l’hypercapnie ... 90
2.1 Les mécanismes d’action de l’Epo ... 90
2.2 Action centrale de l’Epo expliquant les effets en normoxie et en réponse à l’hypoxie. ... 92
2.3 Mécanismes de l’action central de l’Epo, pouvant expliquer ses effets sexe-spécifique. ... 94
2.4 Action directe de l’Epo dans la génération du rythme respiratoire ... 95
3. L’Erythropoéïtine : un agent thérapeutique? ... 96
4. Conclusion ... 97
5. Perspectives ... 97
XI
Liste de tableaux
Tableau 1: Body weight on the days of surgery and recording (24 hours later), difference between the two values (weight loss), and rectal temperature on the day of recording in adult male and female mice that received an intracisternal injection of saline (Cont) or sEpoR. Orlane Ballot, 2015. (Chapitre 2)
Tableau 2: Body weight on the days of surgery and recording (24 hours later), difference between the two values (weight loss), and rectal temperature on the day of recording in newborn male and female mice that received an intracisternal injection of saline (Cont) or sEpoR. Orlane Ballot, 2015 (chapitre 2)
Tableau 3: Summary of sex-specific effects of sEpoR injection in adult and newborn mice. Orlane Ballot, 2015 (chapitre 2)
Tableau 4: Body weight on the days of surgery and recording (24 hours later), difference between the two values (weight loss), rectal temperature at the beginning of the recording (T(i)) and at the end of the recording (T(f)), basal ventilation (VE), tidal volume (VT) respiratory frequency (fR), oxygen consumption (VO2) and dioxide de carbon production (VCO2) on the day of recording in adult male and female mice that received an intracisternal injection of saline (Control, Ctrl) or sEpoR. The number of animals used is indicated for each group. Orlane Ballot, 2015
(chapitre 3)
Tableau 5: Body weight on the days of surgery and recording (24 hours later), difference between the two values (weight loss), rectal temperature at the beginning of the recording (T(i)) and at the end of the recording (T(f)), basal ventilation (VE), tidal volume (VT) respiratory frequency (fR), oxygen consumption (VO2) and dioxide de carbon production (VCO2) on the day of recording in newborn male and female mice that received an intracisternal injection of saline (Control, Ctrl) or sEpoR. The number of animals used is indicated for each group. Orlane Ballot, 2015
XIII
Liste des figures
Figure 1: Illustration schématique de la localisation des chémorécepteurs artériels périphériques et leurs voies d’échanges vers le tronc cérébral. Hlastala & Berger,
2001.
Figure 2: Graphique représentant la réponse ventilatoire à l’hypoxie enregistrée chez un chat adulte. Vizek et al, 1987
Figure 3: Schéma de l’organisation anatomique de corps carotidiens. Pardal et al,
2010.
Figure 4: La réponse de la ventilation aux changements dans la pression d’oxygène (PO2) seule médiée par les chémorécepteurs périphériques. Feldman et McGrimmon,
2008
Figure 5: Illustration schématique de la chémotransduction de l’hypoxie au niveau du corps carotidien. Lopez-Barneo et al, 2008.
Figure 6: Graphique représentant la réponse ventilatoire à l’hypoxie chez un raton de 4 jours. Simakajornboon et al, 2004 ; Maxova et Vizek, 2001.
Figure 7: Graphique représentant la réponse à l’hypercapnie chez le nouveau-né rat.
Putnam et al, 2005.
Figure 8: Représentation de la molécule d’Epo. Lai et al, 1986.
Figure 9: Représentation des différentes formes du récepteur à l’Epo. Moritz et al,
1997
Figure 10: Voies de signalisation intracellulaire de l’Epo. Kumral et al, 2011
Figure 11: Représentation du récepteur soluble de l’Epo (sEpoR) comparé au récepteur transmembranaire (EpoR). Soliz J@
Figure 12: Les mécanismes d’action de l’Epo dans l’érythropoïèse. Testa et al, 2004. Figure 13: Représentation du mode d’action de l’Epo. Ballot O@
Figure 14: Modèle de l’expression de l’Epo/EpoR dans le cerveau. Marti et Rabie,
XIV
Figure 15: Expression de l’EpoR chez la souris durant le développement du cerveau. (a) Quantification de ARNm d’EpoR dans le cerveau de souris (cercle) comparé au foie (triangle) commençant au jour embryonique 10. Liu et al, 1994. (b) Hyperplasie du neuro-épithélium du 3ème ventricule au jour embryonique 12.5 chez les souris KO pour l’Epo (droite) comparé aux souris KO pour EpoR (gauche). Yu et al, 2002. Figure 16: Les mécanismes des effets protecteurs de l’Epo sur les cellules gliales et neuronales. Kumral et al, 2011.
Figure 17: Marquage par immunohistochimie des récepteurs à l’Epo chez la souris adulte. Soliz et al, 2005
Figure 18: Réponse ventilatoire en hypoxie et normoxie des Tg21 en comparaison à des souris WT. Soliz et al, 2005.
Figure 19: Réponse ventilatoire en hypoxie chronique chez des souris traitées avec sEpoR en comparaison à des souris contrôle. Soliz et al, 2007.
Figure 20: Effet de l’Epo et sEpoR sur l’activité respiratoire enregistrée sur une préparation de tronc cérébral isolé chez des souris nouveau-nées au 4ème jour de vie.
Khemiri et al, 2012.
Figure 21: Effects of sEpoR on ventilatory and metabolic parameters in normoxia in adult male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 22: Effects of sEpoR on ventilatory response to hypoxia in adult male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 23: Effects of sEpoR on metabolic and ventilatory responses to hypoxia in adult male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 24: Effects of sEpoR on ventilatory and metabolic parameters in normoxia in newborn male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 25: Effects of sEpoR on ventilatory response to hypoxia in newborn male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 26: Effects of sEpoR on metabolic and ventilatory responses to hypoxia in newborn male and female mice. Orlane Ballot, 2015 (chapitre 2)
XV Figure 27: Effects of sEpoR on respiratory pattern during hypoxic exposure in newborn male and female mice. Orlane Ballot, 2015 (chapitre 2)
Figure 28: Relative effects of sEpoR injection in newborn and adult mice. Orlane
Ballot, 2015 (chapitre 2)
Figure 29: The ICI of sEpoR does not affect the hypercapnic ventilatory response in adult mice. Orlane Ballot, 2015 (chapitre 3)
Figure 30: The ICI of sEpoR does not affect the hypercapnic ventilatory response in newborn mice. Orlane Ballot, 2015 (chapitre 3)
Figure 31: Localisation de la cisterna magna dans le cerveau de souris. Figure 32: Le système de plethysmographie. Seaborn et al, 2013
Figure 33: Schématisation du système respiratoire pour illustrer nos hypothèses.
XVII
Liste des abréviations
H+: hydrogène
Akt: Anti-apoptotic kinase
ARNm: Acide Ribonucléique Messager ATP: Adénosine TriPhosphate
BAK: Gène pro-apoptotique BCL-XL: Gène anti-apoptotique
BDNF: Brain-Derived Neurotrophic Factor (Facteur neurotrophique dérivé du cerveau)
BFU: Bursting Forming Unit (progéniteurs de l’Epo) BHE: Barrière Hémato-Encéphalique
CFU: Colony Forming Unit (progéniteurs de l’Epo) CO2 : Dioxyde de carbone
CO: Monoxyde de carbone Epo: Erythropoïétine
EpoR: Récepteur à l’érythropoïétine
ERK: Extracellular Signal-Regulated Protein Kinase (Protéine kinase régulée par un signal extracellulaire)
GABA: Acide γ-aminobutyrique
GM-CSF: Granulocyte-Macrophage Colony-Stimulating factor (Facteur stimulant les colonnies de granulocytes et macrophages)
HIF: Hypoxia Inducible Factor (Facteur inductible par l’hypoxie) ICI: Injection intracisternale
ICV: Injection Cérébro-Ventriculaire IP: Injection intrapéritonéale
XVIII
(a)LCR: Liquide Céphalorachidien (artificiel)
MAPK: Miogen-Activated Protein Kinase (Protéine kinase activée par miogène) NMDA: N-méthyl-D-aspartate
NTS: Noyau du Tractus Solitaire (Solitary tract nucleus) O2: Dioxygène
PaCO2: Pression artérielle de CO2
PaO2: Pression artérielle d’O2
PI3K: Phosphoinositide 3-kinase PRG: Groupe Respiratoire Pontique
RTN: Noyau Rétrotrapézoïde (retrotrapezoid nucleus) rhEpo: L’Epo Humaine Recombinante
sEpoR: Récepteur Soluble à l’Erythropoïétine SC: Injection sous-cutanée
SNC: Système Nerveux Central (central nervous system) Ve=VE=VE: Débit respiratoire ou ventilation-minute
Vt=VT=VT:Volume courant
fR: Fréquence respiratoire VO2: Consommation d’oxygène
VCO2: Production de dioxyde de carbone
XIX
Tout vient à point, à celui qui sait attendre
XXI
Avant-propos
L’article intitulé Endogenous brain erythropoietin is a potent sex-specific
respiratory stimulant in adult and newborn mice a été publié sur pubmed le 19 mars
2015 (118(11):1386-95. doi: 10.1152/japplphysiol.00143.2015) par le Journal of
Applied Physiology (JAP) et constitue le deuxième chapitre de ce mémoire. Je suis
l’auteur principal de cet article et j’ai participé à chacune des étapes ayant mené à la réalisation de ce travail. Tout d’abord, j’ai contribué à mettre au point le protocole expérimental, planifié mes reproductions d’animaux et fait l’achat des animaux nécessaires avec l’aide de la technicienne animalière (Mélanie Pelletier). Puis, j’ai réalisé toutes les expérimentations (injection intracisternale et enregistrements par pléthysmographie) et leurs analyses, ainsi que la compilation des résultats. Pour finir, j’ai également largement contribué à l’analyse statistique et à l’écriture de l’article scientifique. Cependant, tout cela a été possible grâce à l’aide de mes deux chercheurs, le D. Jorge Soliz et le D. Vincent Joseph, qui m’ont aidé, répondu à mes demandes et questions. Ils ont largement participé à la rédaction et correction de l’article et des résultats.
L’article intitulé The central chemosensitivity is not altered by cerebral
erythropoietin a été publié le 18 octobre 2015 par le journal Neuroscience Letters
(609:63-68. doi: 10.1016/j.neulet.2015.10.026). Il constitue le chapitre trois de ce mémoire. Dans cette étude, comme dans le chapitre 2, j’ai également largement contribué à chaque étape du travail: la planification du modèle et du protocole expérimental, les injections intracisternales et les enregistrements en pléthysmographie, ainsi que l’analyse et la compilation des données récoltées. J’ai interprété les résultats avec mes deux chercheurs, D. Jorge Soliz et D. Vincent Joseph. Ils m’ont également fortement aidé à l’écriture de l’article. De plus, d’autres membres du laboratoire et co-auteurs (étudiants : Sofien Louafa, Elisabeth Eliott ; assistante de recherche : Rose Tam ; chercheur français: Nicolas Voituron) ont participé à la rédaction de l’article scientifique et à l’interprétation des résultats.
XXIII
Remerciements
Dans un premier temps, j’aimerai remercier mes directeurs de recherche, le D. Jorge Soliz et le D.Vincent Joseph, qui m’ont aidé tout au long de ma maitrise, avec patience et sympathie. Cette expérience à leur côté m’a permis de pouvoir développer mes connaissances scientifiques, ma méthode de travail, ma manière d’analyser les résultats et des qualités essentielles, telles que l’autonomie, la réflexion, la persévérance et la détermination. Leur disponibilité et leur dévouement m’ont aussi permis d’avancer pendant ces deux années.
Dans un second temps, j’aimerai remercier les étudiants et professionnels de recherche dans le laboratoire et tous les membres de l’équipe de recherche de Saint François d’Assise avec qui j’ai pu travailler dans une ambiance agréable et avec qui j’ai pu partager des activités intéressantes. Ils ont également contribué à ma réussite dans la réalisation de ma formation, par leurs précieux conseils, leurs partages des connaissances et l’apprentissage de techniques expérimentales. De plus, j’ai pu avoir la chance de publier trois articles avec d’autres étudiants (Caravagna and al, 2015, Ballot et al, 2015). C’est une expérience enrichissante qui m’a apporté beaucoup de points positifs pour l’avenir.
Et pour finir, je compte remercier mes parents et ma sœur, qui m’ont supporté pendant deux ans (entre stress et travail), qui m’ont aidé tout au long de mon cheminement, de toutes les manières possibles et ce malgré la distance présente entre nos deux pays. Les savoir fier de moi est une des principales raisons qui m’a permis de toujours persévérer et d’exceller au cours de mes différentes formations, afin de pouvoir les rendre heureux lorsqu’ils parlent de mes accomplissements. Mon épanouissement personnelle n’était pas seulement dû à mon séjour au Canada mais aussi grâce à leur encouragement et soutien durant mes deux ans de maitrise en neurobiologie à Québec et mes deux années précédentes en baccalauréat de pharmacologie à Sherbrooke. Je tiens également à remercie mon conjoint, mes amis et ma famille, qui ont été également présent dans mon cheminement durant ces années et m’ont permis de voyager au Canada, lors de leur visite dans ce beau pays.
1
Chapitre I
3
1. Le système respiratoire
Chez les mammifères, le rôle essentiel de la respiration est le maintien des pressions partielles d'oxygène (PaO2) et de dioxyde de carbone (PaCO2) dans le sang artériel. Cette homéostasie est possible par un mécanisme complexe composé de différentes parties et par la coordination du système respiratoire et cardiovasculaire. De plus, le contrôle ventilatoire est immature à la naissance et requiert plusieurs semaines pour devenir complètement mature. En effet, l’immaturité postnatale de la ventilation chez le nouveau-né est associée à une longue période de vulnérabilité face aux stress environnementaux et est un facteur majeur dans plusieurs pathologies infantiles, telles que les apnées du prématuré, ou le syndrome de la mort subite du nourrisson (SIDS,
Sudden infant death syndrome) (Kinney et al, 2009).
1.1 Généralité sur le système du contrôle de la respiratoire
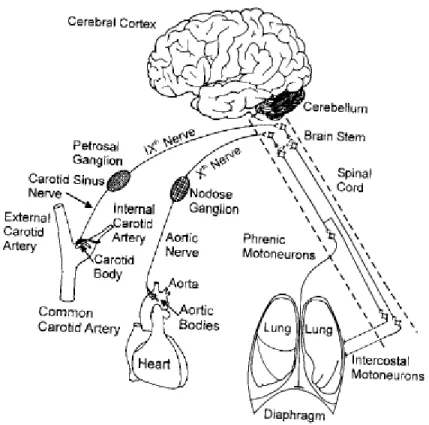
Lorsque la pression de l’oxygène dans le sang artériel (PaO2) diminue ou lorsque la pression de dioxyde de carbone (PaCO2) augmente, le système respiratoire répond par l’augmentation de la ventilation. Pour ce faire, des chémorecepteurs périphériques sont majoritairement responsables de la réponse ventilatoire à l'hypoxie (diminution de la PaO2), tandis que des chémorécepteurs centraux sont responsables de la réponse ventilatoire à l'hypercapnie (augmentation de PaCO2). Après leur activation, les chémorécepteurs périphériques fournissent les informations aux centres respiratoires du tronc cérébral, par le biais du nerf du sinus carotidien et le nerf glossopharyngien (ou nerf IX). Cette augmentation de l’activité du nerf sensoriel est intégrée au niveau du tronc cérébral et est transmise aux motoneurones des nerfs phréniques qui innervent le diaphragme, principal muscle respiratoire. Cette augmentation d'activité permet l'accélération de la fréquence et de l'amplitue de la respiration. (Cf. figure 1).
4
Figure 1: Illustration schématique de la localisation des chémorécepteurs artériels périphériques et leurs voies d’échanges vers le tronc cérébral. Les corps carotidiens, situés au niveau de la bifurcation de la carotide vont transmettre le stimulus par nerf du sinus carotidien, puis le nerf IX (ou nerf glossopharyngien, passant par le ganglion petreux), jusqu’au tronc cérébral. L'information sensitive intégrée dans le tronc cérebral est ensuite transmise aux motoneurones phréniques, pour contrôler la respiration. Les corps aortiques, situés dans l’aorte, transmettent le stimulus via le nerf aortique jusqu’au ganglion inférieur du nerf vague ("nodose ganglion"). L’information est ensuite envoyée au tronc céréral via le nerf X (ou nerf vague), puis au diaphragme, via les motoneurones phréniques. La contribution des corps aortiques répondent au même stimulus que les corps carotidiens mais de faҫon mineure. Hlastala & Berger, 2001
Dans les deux parties suivantes, les mécanismes de réponses à l’hypoxie et à l’hypercapnie vont être développés chez l’adulte et chez le nouveau-né.
1.2 L’Hypoxie
L’hypoxie est caractérisée par une diminution de l’apport en oxygène sanguin dans les tissus. L’hypoxie peut être causée par diverses conditions, telles que l’altitude, l’altération de l’hémoglobine, l’intoxication par le monoxyde de carbone (CO) ou par
5 d’autres éléments. Elle est également souvent la conséquence de différentes pathologies respiratoires chez l’adulte et chez l’enfant, comme les détresses respiratoires ou les apnées du sommeil. Différents problèmes peuvent également contribuer à aggraver le risque de faire une hypoxie: l’asthme, le tabagisme, les infections pulmonaires, des fibroses pulmonaires, l’anémie, le cancer du poumon, ainsi que certaines intoxications (qui inhibent la respiration mitochondriale) ou certaines manifestations allergiques ou crises de panique.
Dans les modèles expérimentaux, on distingue trois sortes d’hypoxie qui diffèrent selon leur durée d’exposition: l’hypoxie aigüe (quelques minutes), l’hypoxie chronique (plusieurs heures à plusieurs jours) et l’hypoxie intermittente (alternance de phases de normoxie et hypoxie sur plusieurs secondes ou plusieurs jours). Ces modèles d’hypoxie soulignent le fait que le système respiratoire adapte son activité pour ajuster la ventilation selon les besoins de l’organisme en réponse à l’hypoxie. En outre, lors d’hypoxie chronique, des ajustements ventilatoires sont nécessaires mais aussi des modifications hématologiques et vasculaires, pour maintenir l’homéostasie d’O2. 1.2.1 La réponse ventilatoire à l’hypoxie
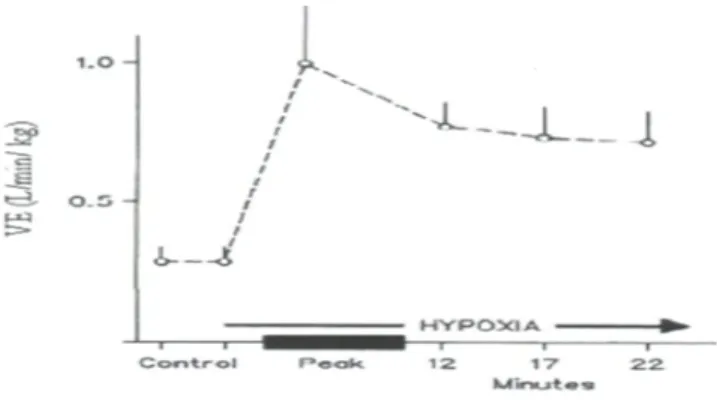
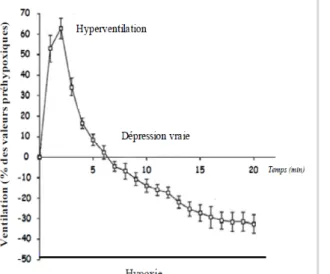
La réponse ventilatoire à l’hypoxie est un composé de réflexes d'origine périphérique, mais aussi centrale. En effet, lors d’une hypoxie, la première phase de réponse est une stimulation des chémorécepteurs périphériques, qui peut être suivie d’une dépression au niveau centrale et d’une réduction du métabolisme (consommation d’O2). Ces deux derniers facteurs réduisent l'activité de la commande respiratoire durant l’exposition à une hypoxie et provoque une réponse dite « roll-off » (Cf. figure 2). Cette réponse se caractérise par une vive augmentation de la ventilation au début de l’hypoxie, suivie par une diminution lente, restant largement supérieure à la valeur de base (Teppema et Dahan, 2010).
6
Figure 2: Graphique représentant la réponse ventilatoire à l’hypoxie enregistrée chez un chat adulte. La réponse est «roll-off », caractérisée par une augmentation rapide de la ventilation, suivie d’une légère dépression avec une ventilation demeurant largement supérieure à la valeur de base. Vizek et al, 1987.
1.2.2 Implication des chémorécepteurs périphériques dans l’hypoxie
Chez les mammifères, les chémosenseurs aux variations de PaO2 sont les chémorécepteurs périphériques, localisés au niveau des artères aortiques et carotidiennes.
1.2.2.1. Anatomie des chémorécepteurs périphériques
Les corps aortiques
Ces corps aortiques sont situés dans l’arc aortique (Prabhakar et al, 2004). Ils envoient l’information vers le NTS via le nerf vague (nerf X ; cf. figure 1) et contribuent à l’élaboration de la réponse ventilatoire à l’hypoxie. Ils répondent aux mêmes stimuli que les corps carotidiens mais leur contribution dans la régulation de la ventilation reste mineure (Lahiri et al, 2003). Cependant, des expériences démontrent que leur implication augmente suivant l’ablation chronique des corps carotidiens (Prabhakar et al, 2004).
Les corps carotidiens
L'implication des corps carotidiens dans la réponse ventilatoire à l’hypoxie a été démontré en 1930 par Heymans chez le chien (König et Seller, 1991). Ce sont les chémorécepteurs périphériques principaux à la PaO2 chez les mammifères, mais ils
7 répondent aussi aux variations de CO2 et de pH (Lopez-Barneo, 2003). Ils sont localisés bilatéralement à la bifurcation des artères carotidiennes internes et externes (Caroll et al, 2008). Ces corps carotidiens sont richement vascularisées, de petite taille (13 mg et 2-3 mm de diamètre chez l’adulte humain) et reçoivent également une quantité importante de sang (2000mL/100g/min chez l’Homme) (Gonzales et al, 1995). Cette vascularisation permet aux corps carotidiens de détecter rapidement les changements de la PaO2 (Lahiri et Foster, 2003). Les corps carotidiens contiennent également deux types de cellules :
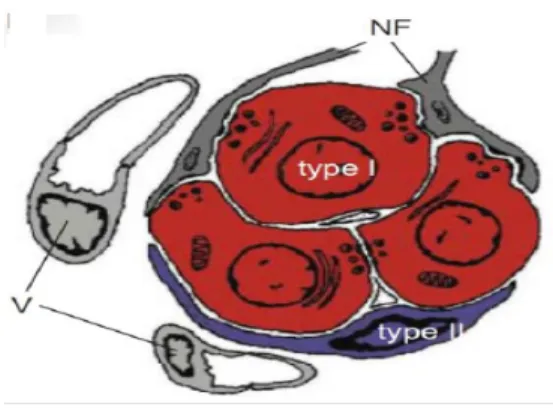
• Les cellules glomiques de type I dérivent de la crête neurale et sont les plus abondantes (soit environ 80-85%). Leurs structures cellulaires sont hétérogènes et leurs réseaux vasculaires sont denses. Lors d’une diminution d’oxygène sanguin, ces cellules se dépolarisent et libérent des neurotransmetteurs qui générent un potentiel d'action dans les fibres afférentes du nerf du sinus carotidien (branche du nerf glossopharyngien, nerf IX-cf. figure 1) (Alheid et McCrimmon, 2008). Ces cellules glomiques de type I expriment la tyrosine hydroxylase (TH, enzyme responsable de la synthèse des catécholamines) et de nombreux neurotransmetteurs excitateurs et inhibiteurs (Lopez-Barneo et al, 2010).
• Les cellules de type II sont proches des cellules gliales du système nerveux central (SNC) et représentent environ 15-20% des cellules du corps carotidien (Lopez-Barneo et al, 2010). Elles ont surtout un rôle de soutien et de support métabolique pour les cellules de type I (Kumar et Prabhakar, 2012). Elles sont aussi considérées comme des cellules souches capable de se diviser et de se différencier en cellules de types I fonctionnelles en cas d’hypoxie chronique (Lopez-Barneo et al, 2010).
8
Figure 3: Schéma de l’organisation anatomique de corps carotidiens. Les cellules de type I contiennent des vésicules de neurotransmetteurs et sont entourées par les cellules de type II. NF: fibre nerveuse - V: vascularisation. Pardal et al, 2010.
1.2.2.2 Aspect physiologique de la réponse à l’hypoxie par les corps carotidiens
L’activité chémosensorielle des corps carotidiens par rapport aux variations de la pression d’O2 (PO2) se caractérise par une hyperbole (Cf. figure 4). En effet, lors d’une diminution de PO2, l’activité de la cellule chémoréceptrice va augmenter de façon graduelle pour atteindre un maximum à des niveaux proches de 35 mmHg de PO2.
Figure 4 : La réponse de la ventilation aux changements dans la pression d’oxygène (PO2) seule
médiée par les chémorécepteurs périphériques. Ces variations sont caractérisées par une hyperbole. Ventilation (en litres/minute) en fonction de la PO2 (en mmHg). Feldman et McGrimmon, 2008.
1.2.2.3. Mécanisme de chémosensibilité à l’O2 du corps carotidien (cellules de type I)
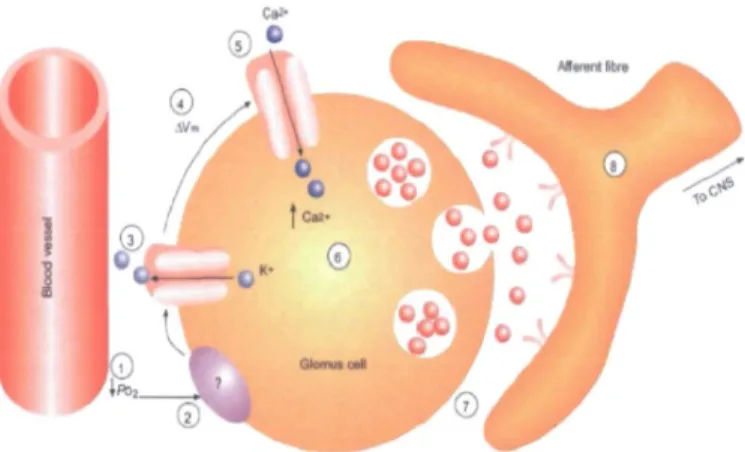
1) Les cellules chémoréceptrices de type I détectent l’hypoxie via l’inhibition de canaux potassiques transmembranaires, et mettent en jeu différents facteurs qui se lient
9 à ceux-ci. En effet, les canaux potassiques (BKca) peuvent être régulés par l’hème oxygénase 2 (HO-2) par le biais du CO (monoxyde de carbone), ou la protéine kinase AMPK et les ROS (radicaux libre à l’O2) (Peers et al, 2010).
2) A la suite de cette fermeture des canaux potassiques transmembranaires, la membrane plasmique se dépolarise, permettant l’ouverture des canaux calciques-voltage dépendants (type L et P/Q) (Rocher et al, 2005). Cette entrée de calcium dans la cellule de type I induit une sécrétion de neurotransmetteurs, qui incluent les bioamines (acétylcholine, noradrénaline, sérotonine, dopamine), les neuropeptides (substance P, enképhaline), et les purines (adénosine, ATP) (Bairam et Carroll, 2005 ; Lahiri et al, 2001). Plus précisément, les neurotransmetteurs excitateurs les plus importants sont l’acétylcholine et l’ATP. La dopamine est un neurotransmetteur inhibiteur qui induit une boucle de rétroaction négative sur l'activité des cellules glomiques. Elle contribue essentiellement à éviter une réponse trop intense et une tétanisation du corps carotidien.
3) Après cette libération de neurotransmetteurs, des récepteurs postsynaptiques au niveau des terminaisons efférentes du nerf sinus carotidiens sont activés.
4) L’activation des récepteurs postsynaptiques conduit à une augmentation de la fréquence des potentiels d’action des afférences chémo-sensorielles acheminées vers le NTS dans le tronc cérébral. (Cf. figure 5).
5) Au niveau central, les terminaisons nerveuses des corps carotidiens libèrent du glutamate qui se fixe aux récepteurs NMDA pour activer les neurones du NTS, qui à leur tour, modifient l'activité des centres impliqués dans la génération du rythme respiratoire.
10
Figure 5: Illustration schématique de la chémotransduction de l'hypoxie au niveau du corps carotidien. Au niveau de la cellule glomique de type I, la cascade moléculaire induite par l'hypoxie (1) est une activation d'un senseur de l'oxygène. (2) L'activation de ce senseur induit une fermeture des canaux potassiques (3), suivie d'une dépolarisation de la membrane plasmique (4). L'entrée de calcium, par le biais des canaux calciques voltage-dépendants (5), entraine une augmentation du calcium intracellulaire (6) ainsi qu'une sécrétion des vésicules de neurotransmetteurs dans la fente synaptique (7). La liaison du neurotransmetteur avec son récepteur postsynaptique, localisé au niveau des afférences sensorielles du nerf du sinus carotidien, initie la réponse à l'hypoxie. ∆Vm : dépolarisation de la membrane plasmique; PO2 : pression partielle en oxygène; CNS : nerf du sinus carotidien. Lopez-Barneo
et al, 2008.
1.2.3 La contribution des chémorécepteurs centraux dans la réponse ventilatoire à l’hypoxie
Au niveau central, les afférences provenant des corps carotidiens se projettent majoritairement au niveau du NTS (noyau du tractus solitaire) (Lahiri et al, 2006). Ce noyau est allongé rostro-caudalement, dans la partie dorsale du tronc cérébral. Le rôle du NTS consiste à la réception des informations pour la modulation du rythme respiratoire en réponse à l’hypoxie. De plus, il possède de nombreux neurotransmetteurs, comme par exemple la substance P, la cholescytokinine et la noradrénaline (Berk et al, 1993), le glutamate, la glycine, etc. (Lin, 2009). Il est donc possible de modifier de manière importante la réponse ventilatoire à l'hypoxie en agissant au niveau des structures centrales de la commande respiratoire.
11 1.3. L’hypercapnie
L’hypercapnie est un phénomène qui survient lorsque la pression partielle de CO2 dans le sang artériel (PaCO2) normalement voisine de 5.3 kPa ± 0.5 (40 mmHg ± 4) devient trop importante. La réponse ventilatoire à l'hypercapnie est un mécanisme très sensible puisqu'une augmentation d'à peine 2 mmHg de la pression de CO2 peut doubler la ventilation (Guyenet et al, 2010). On parle donc de surcharge du sang artériel en CO2. L'hypercapnie peut survenir de deux façons:
• soit par inhalation d’air ou de mélanges enrichis en CO2 (pollution de l’air par
du CO2). Elle est définie comme une hypercapnie exogène.
• soit par hypoventilation due:
o à une diminution des performances de l’échangeur pulmonaire
(insuffisance respiratoire).
o à une baisse de la sensibilité des centres respiratoires (hypoventilation
d’origine toxique ou pharmacologique, etc.). Elle est définie comme une hypercapnie endogène.
o à une réduction volontaire de la fréquence respiratoire (lors d’un
entraînement en hypoventilation). 1.3.1 La réponse ventilatoire à l’hypercapnie
La réponse ventilatoire à l’hypercapnie est caractérisée par une hyperventilation soutenue. De plus, des chercheurs ont démontrés par des études chez la chèvre (Pappenheimer et al, 1965) et chez le chat (Schlaefke et al, 1979), que les chémorécepteurs responsables de la réponse ventilatoire à l’hypercapnie étaient les chémorécepteurs centraux, par leur sensibilité importante au CO2, et par leur rôle majeur de stimuli dans la respiration (Guyenet et al, 2010 ; Nattie et Li, 2012). En effet, lors d’état d’éveil chez l’humain, une élévation de 1 mmHg de PaCO2 provoque une augmentation de 20 à 30% de la ventilation (Feldman et al, 2003). L’hypercapnie est également caractérisée par une augmentation de la concentration en ion H+ et la
12
réduction du pH (Guyenet et al, 2008), et c'est en fait cette réduction du pH qui déclenche la réponse ventilatoire à l'hypercapnie. Les protéines sensibles au pH comprennent les canaux potassiques TASK (Mulkey et al, 2007), les connexines des jonctions communicantes (Solomon et al, 2001), les transporteurs transmembranaires ioniques Na+/H+ (Putnam, 2001) et les récepteurs purinergiques P2X (Brown et al, 2000).
1.3.2. Contribution centrale à la réponse ventilatoire à l’hypercapnie
Des sites chémosensibles du CO2/H+ sont distribués dans plusieurs aires du tronc cérébral comme le NTS (Berquin et al, 2000), le complexe pré-Bötzinger (Klausen et al, 1996), le noyau raphé (Wang et al, 2002), le locus coeruleus (Nichols et al, 2008) et le noyau retro-trapéozoïde (RTN - Li et Nattie, 2002). Ainsi, plusieurs chercheurs soutiennent qu’il y aurait un réseau entre les différents sites qui assurent la chémosensibilité aux variations de CO2 et de pH. Cependant, d’autres études soutiennent l’hypothèse qu’un des sites jouerait un rôle majeur par rapport aux autres et d’autres suggèrent une contribution des chémorécepteurs qui peut être différente selon l’âge et l’état de vigilance. Toutefois, le RTN et le noyau raphé sont les sites majeurs de la détection du CO2/pH (Science, Kumar et al, 2015). En effet, des études ont localisé le senseur central du CO2 à différents sites spécifiques sur la surface ventrale de la médulla grâce à une application focale de solutions acides dans la région bulbo-ventrolatérale du tronc cérébral chez l’animal (Guyenet et al, 2010).
• Le RTN
Ce noyau est en contact direct avec le LCR (liquide céphalorachidien). Plus précisément, le RTN est localisé à la surface ventrale bulbopontique, en dessous du noyau facial et sous le complexe Bötzinger (Smith et al, 2009). Il peut détecter rapidement les variations de CO2 sanguin et du pH (Nattie et al, 2010). L’augmentation du CO2 entraîne une augmentation de décharge des neurones du RTN qui va augmenter l’activité rythmique respiratoire (Li et Nattie, 2002), et la stimulation du RTN entraîne une augmentation du volume courant et de la fréquence respiratoire chez l’animal (Abbott et al, 2009). De plus, lors de son activation, le RTN libère le glutamate et
13 active les centres de la respiration bulbaire qui génère le rythme respiratoire (Mulkey et al, 2007). Ces neurones glutamatergiques reçoivent également d’importantes afférences provenant des corps carotidiens aussi bien que de l’hypothalamus, du noyau du tractus solitaire (NTS), de la colonne ventrale respiratoire (VRC) et du groupe respiratoire pontique (PRG) (Mulket et al, 2007). Des preuves suggèrent aussi que le RTN peut être un important intégrateur de chémorécepteurs et d’autres afférences tout en étant chémosensibles au CO2 et H+ (Guyenet et al, 2009). Par ailleurs, 80 % des cellules activées par le CO2 sont des neurones, le reste étant des astrocytes (Wang et al, 2013). En effet, il a été démontré chez le rat in vivo, que l’activité calcique augmente dans les astrocytes du RTN lors d’une variation du pH (Gourine et al, 2010). Dans cette étude, les cellules astrocytaires expriment la protéine connexine 26 qui est capable de détecter l’hypercapnie (Spyer et al, 2004). Une autre étude prouve ces effets, par l’utilisation d’antagonistes à la connexine 26 qui diminuent la réponse ventilatoire à l’hypercapnie (Huckstepp et al, 2010). Des expériences soulignent également le rôle de l’ATP, puisque lors d’hypercapnie, une libération rapide et prononcée d'ATP a été détectée à l’aide de microéletrodes biosenseurs chez le rat anesthésié (Gourine et al, 2005). Ce résultat a été confirmé sur des tranches bulbaires de tronc cérébral de rat et démontre que lors d’injection d’ATP, une augmentation de l’activité de neurones du nerf phrénique est observée (Gourine et al, 2005). De plus, la chémosensibilité au CO2 dans les neurones du RTN implique les canaux potassiques sensibles à l’acide des canaux TASK-2 (Mulkey et al, 2007) et le récepteur GRP4 (récepteur couplés aux protéines G- protéine membranaire de 40 à 85 kDa) (Kumar et al, 2015). Pour preuve, des souris mutante TASK-2-/- et GRP4 ont été utilisées. Elles présentent des réponses ventilatoires à l’hypercapnie atténuée et une augmentation de la fréquence des apnées (Gestreau et al, 2010 ; Kumral et al, 2015). En effet, lors de la réintroduction de GPR4 dans les neurones du RTN, l’activation neuronale du RTN est restaurée et le phénotype ventilatoire est normalisé. L’élimination de TASK-2, le canal potassique sensible au pH, exprimé dans les neurones du RTN, abolit essentiellement la réponse ventilatoire au CO2 (Gestreau et al, 2010 ; Kumral et al, 2015).
14
Les noyaux du raphé sont un ensemble de structures sous-corticales du cerveau, présentes au niveau du bulbe rachidien, du pons et du mésencéphale. Ces noyaux sont composés de neurones sérotoninergiques qui semblent jouer un rôle important dans la chémosensibilité centrale au CO2 (Richerson et al, 2004). Bien que l’hypothèse reste controversée sur le fait que les neurones du raphé seraient des senseurs CO2/H+ in vivo, leur rôle dans la modulation du rythme respiratoire a bien été prouvé avec des souris génétiquement modifiées qui ne possèdent pas de neurones sérotoninergiques. En effet, le facteur de transcription PET-1 (gène ETS) est spécifique à la différenciation des neurones sérotoninergiques et la délétion du facteur de transcription LMX1B chez les souris KO PET-1 élimine tous les neurones sérotoninergiques. Ces souris mutantes montrent une hypoventilation sévère et une apnée centrale prolongée en réponse à l’hypercapnie (Hodges et al, 2009). De plus, des preuves ont mis en évidence l’implication de ces neurones qui fournissent d’importantes afférences toniques aux centres respiratoires, pouvant varier selon les états de vigilance (Smith et al 2009 ; Nattie et al, 2010).
1.4. Maturation du système ventilatoire durant le développement postnatal De façon générale, la commande respiratoire apparaît lors du développement embryonnaire. En effet, les mouvements respiratoires sont détectés in utero dès la 20ème semaine de grossesse chez l’humain et au 15ème jour de gestation chez les rongeurs (Fortin et Thoby-Brisson, 2009). À la naissance, le réseau respiratoire est fonctionnel pour permettre au nouveau-né de faire ces échanges gazeux. Cependant, il reste immature, ce qui peut être dangereux dans le cas de certaines pathologies infantiles de la respiration (détresse respiratoire, etc.) (Carroll et al, 2008). C’est donc lors de son développement postnatal que les caractéristiques électrochimiques (récepteurs et neurotransmetteurs) et anatomiques (connections synaptiques et neurones) évoluent. En effet, tout au long du développement postnatal, les noyaux principaux (NTS et pré-Bötzinger) subissent un processus de développement (Ohtake et al, 2000). D’autres changements sont visibles comme les modifications de conductances neuronales, avec une augmentation des courants Na+ persistant dans les cellules du réseau et un changement au niveau des co-transporteurs de Cl- (Liu et Wong-Riley, 2012).
15 L’expression des neurotransmetteurs et facteurs neurotrophiques peut également modifier le système respiratoire, comme la somatostatine qui augmente entre les jours prénatals 17 et postnatals 7 (Pagliardi et al, 2003), et le BDNF qui varie entre les jours postnatals 0 et postnatals 21 par exemple (Renn et al, 2006). D’autres neurotransmetteurs (comme GABA, glutamate, etc.) changent également leur expression vers le jour postnatal 12, qui est critique dans la maturation du contrôle respiratoire (Wong-Riley et al, 2013).
1.4.1. Développement de la réponse ventilatoire a l’hypoxie
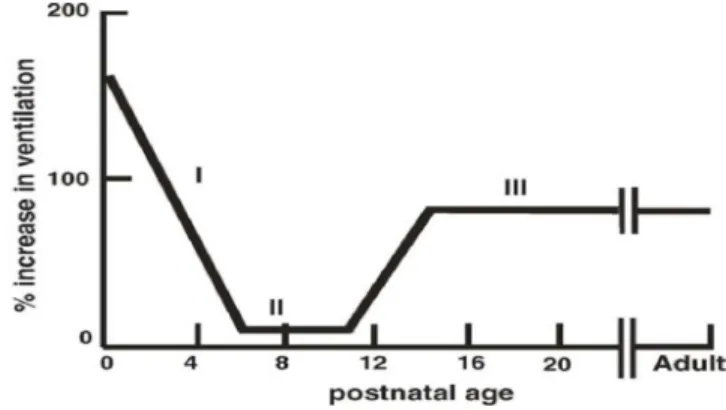
La maturation de la réponse ventilatoire à l’hypoxie a été étudiée chez de nombreuses espèces (chat, rat, primate, agneau, et homme). Comme introduit précédemment chez l'adulte, la réponse du nouveau-né est aussi biphasique, mais la phase de dépression centrale est beaucoup plus marquée. En effet, lors de la deuxième phase de la réponse, la ventilation peut devenir largement inférieure au niveau de base (Cf. figure 6). Par ailleurs, ce phénomène est plus sévère chez les prématurés (Horne et al, 2005). Ce caractère biphasique persiste pendant quelques jours voire quelques semaines après la naissance, selon l’espèce (Horne et al, 2005). Les corps carotidiens sont les acteurs de la première phase de la réponse ventilatoire à l’hypoxie lors de leur activation (Teppema et Dahan, 2010) et le métabolisme joue un rôle important dans la seconde phase. En effet, chez le nouveau-né, le métabolisme est plus grand en comparaison de l’adulte (Mortola et al, 2010). L’organisme va donc pouvoir diminuer la demande métabolique en réponse au stress hypoxique, ce qui diminue la demande en O2. Ainsi, exprimer la ventilation en fonction des besoins métaboliques (Ve/VO2) permet de déterminer l’efficacité de la ventilation. Chez le nouveau-né, on retrouve une hyperventilation relative puisque le ratio Ve/VO2 est augmenté même si la ventilation diminue (Teppema et Dahan, 2010).
16
Figure 6: Graphique représentant la réponse ventilatoire à l’hypoxie chez un raton de 4 jours. La réponse biphasique est nettement plus prononcée chez le nouveau-né que chez l’adulte (Cf.figure 2) Simakajornboon et al, 2005.
Les corps carotidiens ont un rôle important dans la réponse ventilatoire lors du développement postnatal. En effet, chez des souris mutantes avec délétion du gène homeobox HOXA3 (gène homéotique A3), les corps carotidiens sont absents et ces souris meurent à la naissance. D’autres études suggèrent que le développement des corps carotidiens in utero est contrôlé par PHOX2B. En effet, ce gène est un régulateur de la formation du système autonomique et chez des souris qui n'expriment pas ce gène, les corps carotidiens vont dégénérer et disparaitre avant la naissance (Dauger et
al, 2003). De plus, la réactivité des corps carotidiens pour l’O2 est immédiatement basse après la
naissance et augmente avec l’âge postnatal. Chez le rat, cette maturation s'étale sur une période de 2 à 3 semaines (Caroll et al, 2008). Chez l’humain, une étude chez des enfants âgés de 1 jour, 3 jours, 10 jours et 10 semaines, montre que la réponse ventilatoire à l'hypoxie augmente tout au long de cette période (Caroll et al, 2008). Les mécanismes permettant l’augmentation postnatale de la réactivité des corps carotidiens ne sont pas compris totalement mais il apparaît une implication de l’âge reliée à l’augmentation de l’inhibition hypoxique des canaux potassiques des cellules glomiques, aussi bien que des changements dans la modulation de neurotransmission durant la maturation (Caroll et al, 2008). Au niveau cellulaire, des preuves démontrent
17 également l’augmentation des terminaisons nerveuses afférentes et la formation de nouvelles synapses (Wang et Brisgard, 2005). Le neurotransmetteur inhibiteur le plus important dans les corps carotidiens étant la dopamine (Bairam et Carroll, 2005), sa concentration dans les corps carotidiens diminue dans les premières heures de vie et intervient ensuite dans le développement postnatal comme modulateur principal. En effet, l'expression de la Tyrosine Hydroxylase (TH, enzyme de la synthèse de la dopamine) diminue avec l’âge (Bairam et al, 2006), tandis que l’expression d’ARNm des récepteurs dopaminergiques de type D2 augmente (Bairam et al, 2006). Les systèmes cholinergiques et purinergiques jouent également un rôle important dans le développement postnatal. En effet, l'expression de la protéine de synthèse de l’acétylcholine et ses récepteurs nicotiniques augmentent avec l’âge dans les corps carotidiens et le ganglion pétreux (Bairam et al, 2006). Tandis que le récepteur purinergique P2X reste stable au cours du temps dans les corps carotidiens, il est diminué de 50% (après les 15 premiers jours de vie) dans le ganglion pétreux (Bairam et al, 2007).
Au niveau central, le développement de nouvelles synapses, les modifications de communications intercellulaires et les neurotransmetteurs mis en jeu sont modifiés durant le développement postnatal du système central de la respiration (Putnam et al, 2005). En effet, des études démontrent que les neurotransmetteurs inhibiteurs (GABA, adénosine) jouent un rôle plus important dans la phase de dépression de la réponse ventilatoire à l’hypoxie (Liu et Wong-Riley, 2005). Cet effet s’inverse avec le développement postnatal et l’expression de neurotransmetteurs excitateurs (glutamate) qui devient plus importante (Liu et Wong-Riley, 2005).
1.4.2. Développement de la réponse ventilatoire a l’hypercapnie
Les premières études montrent que la réponse ventilatoire à l’hypercapnie est réduite à la naissance et augmente avec le développement postnatal. En effet, lors d’expérimentation sur le chien, elle a été démontrée inférieure chez le nouveau-né par rapport à l’adulte (Nattie et Edwards, 1981). D’autres études montrent que la réponse ventilatoire au CO2 diminue avec l’âge, atteignant le point le plus bas et par la suite augmente. En effet, la maturation est non linéaire et semble se dérouler en 3 phases
18
chez le rat: entre les jours postnatals 1 à 5, la réponse est robuste, entre les jours postnatals 5 à 12, elle décline, puis elle remonte jusqu’au jour postnatal 16 pour atteindre les niveaux qu’elle aura chez l’adulte (Cf. figure 7) (Stunder et al, 2001). Et d’autres encore suggèrent que la réponse ventilatoire au CO2 est élevée à la naissance par rapport à l’âge adulte chez le rat (Putnam et al, 2005). Et plusieurs autres montrent aussi que la réponse aux chémorécepteurs périphériques au CO2 est stable après la naissance chez quelques espèces (tel que l’agneau-Canet et al, 1996) et augmente chez d’autres (tel que le chat-Carroll et al, 1993).
Figure 7: Graphique représentant la réponse à l’hypercapnie chez le nouveau-né rat. La réponse est triphasique avec une phase 1 de diminution de la ventilation, une phase 2 de stabilisation du Ve, et une phase 3 qui où la droite remonte et se stabilise de nouveau jusqu’à l’âge adulte. Putnam et al, 2005.
2. L’Érythropoïétine
L’érythropoïétine (Epo) est une hormone de nature glycoprotéique, synthétisée principalement par les hépatocytes dans le foie chez le nouveau-né et par des fibroblastes interstitiels prétubulaires du cortex rénal chez l’adulte (Dame et al, 1998 ; Fisher et al, 2003). Elle fut découverte en 1905 par Paul Carnot, lors d’injection de sérums de lapins anémiques chez des lapins normaux. Ses résultats démontraient la production importante de globules rouges chez ces lapins injectés. Après plusieurs études, son rôle principal fut prouvé dans l’érythropoïèse et elle sera appelé «érythropoïétine» en 1948 (Jelkmann, 1986).
19 2.1 Caractérisation et structure
2.1.1 Érythropoïétine
C’est en 1950, lors de la purification de l’Epo que sa présence a été identifiée dans le sang. Cette étape longue et complexe a été difficile, puisque l’Epo possède une faible concentration (10 pg/ml) dans le sang en condition physiologique. Dans les années 1970, l’Epo a été isolée et purifiée à partir des urines de patients anémiques (Miyake et al. 1977). Cette étape va permettre sa caractérisation génétique et structurelle chez plusieurs espèces, telles que le rat, la souris, le chien, le chat, le singe ou encore l’humain (Wen et al. 1993). Par ailleurs, le gène codant pour l’Epo est localisé chez l’humain sur le chromosome 7q22 (Law et al. 1986), qui est hautement conservé entre les espèces. En effet, le gène de l’Epo humaine présente une importante homologie de séquence avec celui du singe (92%), de la souris (80%) ou encore le rat (80%) (Jelkmann 1992 ; Wen et al. 1993). Le gène de l’Epo code pour une protéine de 193 acides aminés parmi lesquels 27 de ces résidus sont impliqués dans l’adressage et sont clivés pour donner une protéine mature de 166 acides aminés (34 kDa) pliés en 4 alpha-hélices avec 2 ponts disulfures entre la cystéine 6 et 161, et 29 et 33 (Lai et al. 1986). Par ailleurs, l’Epo est une glycoprotéine qui appartient à la famille des cytokines de type I, et qui possède des similitudes structurelles (Alnaeeli et al, 2012), avec les interleukines (2, 3, 4 et 6) (D’Andrea et al, 1989), le facteur stimulant les colonies de granulocytes (G-CSF) (Sato et al, 1992), la thrombopoéïtine (Sato et al, 1992), la prolactine (Parry et al, 1988), l’oncostatin M (Bazan et al, 1990), le facteur neurotrophique ciliaire (Manavalan et al, 1992), le facteur inhibiteur leucocytaire (Manavalan et al, 1992) ou encore les hormones de croissances (Kaushansky et al, 1993). Elle possède également un poids moléculaire de 30 à 34 kDa, en raison d’une étape de glycosylation durant laquelle quatre chaines de carbohydrates sont ajoutées (Lai et al, 1986). Ces groupements, représentant 40 à 60% de son poids moléculaire, sont déterminants pour sa stabilité et sa demi-vie plasmatique (6 jours chez l’humain) (Lai et al. 1986). Elle est également constituée de 3 chaînes N-oligosaccharidiques liées aux résidus asparagine en position 24, 38 et 83, pouvant accueillir chacun 4 résidus sialiques et une chaîne O-oligosaccharidique liée à une sérine en position 126 (absent
20
chez le rongeur), qui n’est pas nécessaire à l’activité de l’Epo (Lai et al, 1986 ; Cf.
figure 8).
Figure 8: Représentation de la molécule d’Epo. L’Epo est constitué de 3 chaines N-oligosaccharidiques liées à des résidus d’asparagine (position 24, 38 et 128) et une chaine O-oligosaccharidique lié à une sérine (position 126). Lai et al, 1986.
2.1.2 Le récepteur de l’érythropoïétine
Le gène qui code le récepteur de l’Epo (EpoR), a été cloné en 1989 à partir de cellules érythrocytaires. Chez l'Homme, ce gène est localisé sur le chromosome 19p13.3-p13.2 (D’Andrea et al. 1989). Il code pour sa protéine, composée de 508 acides aminés avec un poids moléculaire de 66 kDa. Le récepteur de l’Epo appartient à la superfamille des récepteurs de cytokines de type I, avec une activité tyrosine-kinase (D’Andrea & Zon, 1990 ; Witthuhn et al, 1993) et se caractérise par la présence du motif Trp-Ser-X-Trp- Ser dans le domaine extracellulaire (Yoshimura & Arai 1996). L’EpoR est sous la forme monomérique inactive et s’active en s’organisant en dimères pouvant être constitués de sous-unités identiques (homo-oligomère) ou différentes (hétéro-oligomère). Par ailleurs, ces sous-unités hétérodimères sont composées de familles des récepteurs de cytokines qui peuvent partager une sous-unité commune spécifique à la sous-unité α (Youssoufian et al. 1990 ; Yoshimura & Arai, 1996) ou se dimériser avec
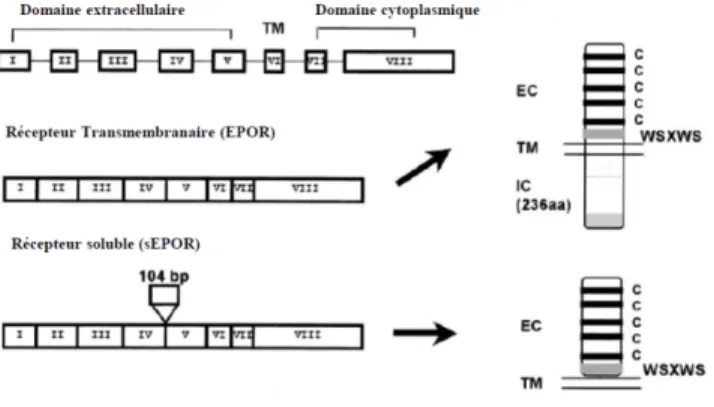
21 la sous-unité β dans les tissus non-hématopoïétiques. De plus, comme dans tous récepteurs de cytokines, il existe une forme transmembranaire et/ou soluble de récepteurs (Cf. figure 9).
Figure 9: Représentation des différentes formes du récepteur de l’Epo. EpoR transmembranaire et soluble avec ces domaines extracellulaires et cytoplasmiques. Moritz et al, 1997
2.1.2.1 Le récepteur transmembranaire
• Caractéristiques du récepteur transmembranaire
Le récepteur transmembranaire se compose de trois parties distinctes: un domaine extracellulaire, un domaine transmembranaire et un domaine cytoplasmique.
Le domaine extracellulaire va permettre la fixation du ligand et le domaine cytoplasmique se décompose en deux parties: une partie distale et une partie proximale. Sa partie distale est impliquée dans l’arrêt du signal de transduction et sa partie proximale permet la transduction du signal. De plus, sa partie distale ne possède pas de domaine catalytique intrinsèque et la région cytoplasmique est associée à une tyrosine kinase, JAK-2 (Janus kinase 2), qui est importante pour l’initiation à l’activation de la cascade intracellulaire après activation de l’EpoR (Witthuhn et al. 1993). Elle agit également comme chaperon en facilitant l’adressage et la mobilité d’EpoR vers la membrane plasmique (Constantinescu et al. 2001).
22
Le domaine extracellulaire de l’EpoR possède une courte hélice précédant 2 à 7 domaines, 5 résidus de cystéine et des motifs proximaux Trp-Ser-X-Trp-Ser aux membranes et caractéristiques des récepteurs de cytokines hématopoïétiques de classe I (Syed et al, 1998). Le domaine transmembranaire est encodé par l’exon 6 avec beaucoup de domaines cytoplasmiques encodés dans l’exon 8 (Youssoufian et al, 1993). JAK-2 est lié à l’EpoR aux régions BOX ½, ce qui lui permet de se déplacer d’un état inactif à l’état actif lors de son contact à l’Epo (Funakoshi-Tago et al, 2008). La liaison de l’Epo à son récepteur monomérique (EpoR) à la surface des premières cellules progénitrices érythroides entraîne sa dimérisation avec un monomère adjacent et cause un changement conformationnel dans le domaine cytoplasmique. Ce changement permet ensuite la transphosphorylation et l’activation de JAK-2 associée à chaque monomère de l’EpoR. Après activation des JAK-2, la phosphorylation des domaines tyrosines intra-cytoplasmiques de chaque monomère permet l’activation du récepteur (Remy et al. 1999). C’est alors que le récepteur de l’Epo déclenche plusieurs voies de signalisations intracellulaires, telles que STAT-5 (signal de transduction et activateur de transcription 5), MAPK/ERK (extracellular signal-regulated kinase), PI3Kinase/AKT (phosphatidylinositol-3) ou encore NF-kβ (Nuclear factor kβ) (Digicaylioglu & Lipton 2001 ; Rossert & Eckardt 2005). En effet, c’est l’extension de l’expression de l’EpoR à la surface des cellules qui détermine ses réponses à l’Epo, puisque ces voies peuvent avoir des effets directs ou indirects, et donc réguler l’expression de plusieurs gènes impliqués dans les phénomènes d’apoptose et de prolifération cellulaire (Kumral et al, 2011. Cf. figure 10).
23 Figure 10: Voies de signalation intracellulaire de l’Epo. L’Epo se lie aux dimères formés de 2 sous-unités du récepteur de l’Epo (EpoR) et stimule l'activité kinase de JAK-2, ce qui conduit à la phosphorylation de l’EpoR et de JAK-2. JAK-2 activé initie la transduction du signal à travers plusieurs molécules en aval tels que STAT-5, MAPK ERK, PI (3) K / AKT et IKB. NFKB dissocie IKB. NFKB et STAT5 entrent dans le noyau, se lient à l'ADN, et transcrivent les gènes neuroprotecteurs tels que BCL-XL et BCL2. Epo: érythropoïétine; EpoR: récepteur de l'érythropoïétine; JAK-2: Janus-tyrosine kinase-2; STAT-5: transducteur de signal et activateur de 5 transcription; NFKB: facteur nucléaire-KB; MAPK: mitogen-activated protein kinase; PI3-K: phosphatidylinositol-3-kinase; IAP: inhibiteur de la protéine apoptotique. Kumral et al, 2011.
2.1.2.2. Le récepteur soluble de l’Epo
Le récepteur soluble de l’Epo (sEpoR) est synthétisé par épissage alternatif à partir du gène codant pour l’EpoR. Ce type de récepteur ne possède que la partie extracellulaire commune à l’EpoR, et a un poids moléculaire d’environ 27-34 kDa. La fonction de sEpoR est encore mal connue aujourd’hui, bien que sa fonctionnalité et sa capacité à lier l’Epo aient été démontrées dans différentes études de la littérature (Baynes et al. 1993 ; Yet & Jones 1993). L’hypothèse principale serait qu'il joue un rôle dans la régulation des effets de l’Epo. Contrairement au récepteur transmembranaire, sEpoR n’entraine pas de cascade de signalisation intracellulaire, puisque sa forme tronquée et
24
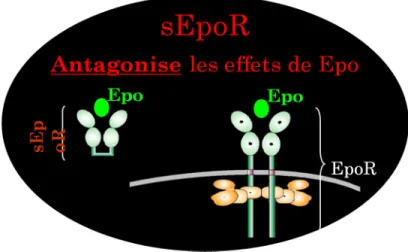
circulante (sEpoR) ne possède pas de parties transmembranaires même s’il possède une liaison avec l’Epo (Nagao et al, 1992). Ce récepteur est donc considéré comme étant un antagoniste endogène et un compétiteur naturel de l’Epo, l’empêchant de se lier au récepteur transmembranaire (Cf. figure 11).
Figure 11: Représentation du récepteur soluble de l’Epo (sEpoR) comparé au récepteur transmembranaire (EpoR). sEpoR agit comme antagoniste en compétition avec le récepteur transmembranaire pour la liaison de l’Epo. Soliz J@
2.2. Régulation de l’expression de l’érythropoïétine
L’hypoxie est un important facteur, qui régule la production de l’Epo. On trouve dans la région promotrice (3') du gène à l’Epo, un site de liaison pour le facteur induisant l’hypoxie (Hypoxia Indicible Factor - HIF). Ce site correspond à un "élément à la réponse hypoxique" (Hypoxic Response Element - HRE) (Semenza et al, 1991). Chez des souris la délétion de HIF-2α induit une anémie importante, montrant que HIF-2α est le principal régulateur de la production de l’Epo (Gruber et al, 2007). La régulation de la production de l’Epo par d’autres facteurs de transcription inclut la régulation négative par les facteurs de transcription GATA et l’activation par la GATA-4 dans le foie fœtal (Imagawa et al, 1997 ; Dame et al, 2004), mais aussi VEGF (facteur de croissance des cellules vasculaires endothéliales). Certaines hormones, comme l’oestradiol, sont également des régulateurs de l’expression du gène de l’Epo (Gasmann et al, 2009).
25 2.3. Rôle classique de l’érythropoïétine : Érythropoïèse
L’érythropoïèse est désignée comme étant l’ensemble des processus de la production d’érythrocytes (globules rouges) dans la moelle osseuse à partir de cellules souches hématopoïétiques totipotentes sous la dépendance de l’érythropoïétine. En conditions normales, chez l’humain l'érythropoïse dure environ 5 jours, mais lors de stimulation de l’Epo, elle ne dure pas plus que 2 jours. Ce système érythropoéitique est indispensable au niveau plasmatique et reste un processus hautement dynamique. En effet, les globules rouges ayant une vie limitée de 120 jours (demi-vie de 28 jours) doivent rester à un taux constant pour assurer un apport nécessaire d’O2 à l’organisme. Pour ce faire, les globules rouges restent à des taux bas (20 mUI/ml) continuellement pour assurer quotidiennement le renouvellement de 200 milliards de globules rouges et pour permettre le maintien des normes physiologiques (4 à 5 * 1012/l chez la femme et 5 à 6 * 1012/l chez l’homme) (Jelkmann et al, 2013).
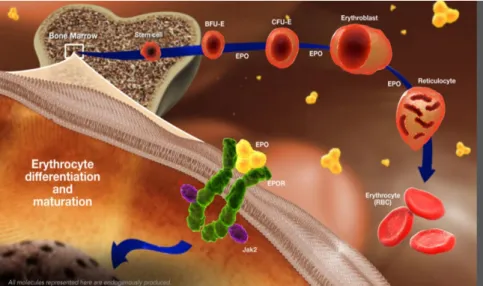
Figure 12: Les mécanismes d’action de l’Epo dans l’érythropoïèse. L’érythropoïèse débute par une cellule souche pluripotente de la moelle osseuse CFU-E (colonie forming unit, les plus matures) et BFU-E (burst forming unit erythroid, les plus immatures), et aboutit à des millions de souches matures dont les érythrocytes (avec la production de 250,000 hématies par seconde) (Wu et al, 1995). En effet, les BFU-E vont se différencier sous la dépendance d’interleukine 3 et du GM-CSF. Ces cellules donnent ensuite les CFU-E, qui vont se différencier sous l’influence de l’Epo et son effet anti-apoptotique. Cette régulation par l’Epo est essentielle, puisqu’elle augmente le nombre de divisions de l’hématocytoblaste et accélère le processus d’érythropoïèse (Anaeeli et al, 2011 ; Wu et al, 1995). Par la suite, la différenciation érythroide implique des précurseurs nucléés qui progressent et conduisent aux
26
réticulocytes, grâce à l’accumulation d’hémoglobine, à l’expansion d’érythroblaste limitée, la diminution continuelle de la taille cellulaire, la condensation nucléaire et l’énucléation finale. Pour finir, les réticulocytes sortent de la moelle osseuse et entrent dans la circulation sanguine où ils maturent et deviennent des érythrocytes Testa et al, 2004
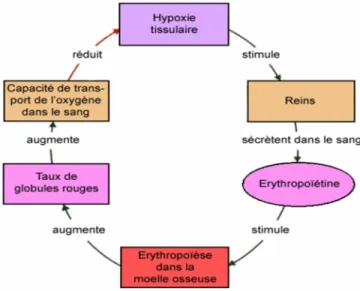
En cas d'hypoxie ou de diminution du nombre de globules rouges causée par une hémorragie, l’augmentation des besoins en oxygène entrainent une sécrétion importante d’érythropoïétine dans le sang, synthétisée par les reins. L’Erythropoïétine va alors stimuler la prolifération des cellules souches des hématies (à l’aide des CFU) au niveau de la moelle osseuse grâce à son effet anti-apoptotique, augmentant ainsi la production des globules rouges et donc l’augmentation de la capacité de transport de l’oxygène dans le sang, diminuant ainsi l’hypoxie tissulaire (Cf. figure 13).
Figure 13: Représentation du mode d’action de l’Epo. Lors d’hypoxie tissulaire, les reins sont stimulés et sécrètent dans le sang l’érythropoïétine. L’Epo stimule l’érythropoïèse dans la moelle osseuse, qui va augmenter le nombre de globule rouge sanguin et donc augmenter la quantité d’oxygène délivrée dans le sang. Ballot O@.
2.4. Rôle non hématopoïétique de l’érythropoïétine (non classique)
En 1993, Ryuzo Sasaki et ses collègues démontrent la présence de l’EpoR dans les cellules phéochromocytomes PC12 de rat, une lignée de cellules neuronales caractéristiques (Sasaki et al, 2001). Après quelques années, Sasaki et al, démontrent que l’Epo et son récepteur sont exprimés dans le cerveau de mammifère, incluant