I
Le diabète sucré est défini par un désordre métabolique d’étiologies diverses, caractérisé par la présence d’une hyperglycémie chronique accompagnée d'une perturbation des métabolismes glucidique, lipidique et protéique, résultant d’un défaut de sécrétion d’insuline, de son activité ou des deux associés [1].
L’explosion du nombre de personnes atteintes du diabète sucré dans le monde, «l’épidémie du diabète», amène aujourd’hui à considérer cette affection comme un problème majeur de santé public. En effet, 246 million de diabétiques sont touchés en 2007 .Ce chiffre atteindrait au moins le double en 2030 [2].
La mortalité liée à cette pathologie chronique s’élèverait à 80% au cours des huit prochaines années [2].Au Maroc, ils sont près de 3 millions de diabétiques à l’heure actuelle [3]
.
Le diabète de type 2 (DT2) représente l’essentiel (plus de 90% des cas). Près de 130 millions de nouveaux cas de ce type de diabète dans le monde sont attendus en 2050 [2].
Ces chiffres sont édifiants et tirent la sonnette d’alarme en vue de considérer cette pathologie comme une priorité sanitaire mondiale. Les conséquences néfastes sur la santé et l’économie ne sont plus à démontrer.
Des complications très invalidantes, touchant de nombreux organes : les yeux, les reins, les nerfs, les cœurs, les vaisseaux et apparaissant au longs cours attestent de la gravité de cette maladie chronique.
Leur prévention exige un maintien et un monitorage régulier de l’équilibre glycémique, objectif principal de la prise en charge du diabète sucré.
Le meilleur outil pour évaluer cet équilibre au long cours correspond à la mesure de l’HbA1c. Témoin de la régulation du métabolisme du glucose des 2 à
3 mois précédant le dosage, elle est reconnue comme le marqueur incontournable dans le suivi objectif du diabète sucré. Elle permet en effet d’adapter le traitement et d’apprécier le risque d’une survenue des complications.
Une corrélation entre l’équilibre glycémique objectivé par l’HbA1C et les
complications dégénératives du diabète sucré a été ainsi établie par des études épidémiologiques à grande échelle Diabetes Control and Complications Trial) (DCCT), l'United Kingdom prospective diabetes study(UKPDS). Cette relation met en exergue l’intérêt de ce test dans le suivi à long terme du patient diabétique. Elle a permis de fixer des valeurs thérapeutiques décisionnelles et de calculer le risque de survenue des complications en fonction de l’augmentation ou de la diminution des résultats de ce marqueur par rapport aux taux précédents.
La recrudescence foudroyante mondiale du diabète type 2 largement souligné par les études a également suscité notre intérêt et a motivé la réalisation de ce travail qui a porté sur une cohorte de 586 patients atteints de diabète sucré.
Notre objectif principal consiste à étudier l’apport de l’HbA1C dans
l’évaluation de l’équilibre glycémique et dans la prévention éventuelle des complications dégénératives chez les patients atteints de DT2 (n=487).
I
A. OBJECTIFS
Le présent travail se propose de:
o Décrire, chez une population de 586 patients atteints de diabète sucré, les caractéristiques démographiques, cliniques et biologiques,
o Etudier la corrélation entre le taux de l’HbA1C et d’autres
paramètres biochimiques, notamment la glycémie à jeun et post-prandiale,
o Analyser la relation entre le chiffre de ce même paramètre et les différentes complications, notamment la macroangiopathie, la rétinopathie, la néphropathie et la neuropathie chez les diabétiques de type 2.
B. MATERIELS
1- Type d’étude et patients inclus
Il s’agit d’une étude rétrospective, sur dossiers portant sur les cas de patients diabétiques colligés au service d’endocrinologie de l’HMIMV de Rabat durant 3 ans (de janvier 2004 à décembre 2006) dans le cadre du suivi de leur pathologie. Huit cent cinquante (n=850) patients ont été enregistrés, mais nous n’avons pu inclure dans le présent travail que 586 parmi eux (dont 487 cas de DT2) dont les dossiers médicaux étaient exploitables (données complètes de la
fiche d’exploitation, résultats de l’Hb A1C réalisés au laboratoire de biochimie de
l’HMIMV pour une interprétation homogène).
2- Recueil et nature des données relevées
Pour chacun des patients inclus, une fiche d’exploitation (cf, annexes) a été renseignée lors de l’analyse du dossier médical.
Dans cette fiche sont reportées les données démographiques et anthropométriques (nom, âge, sexe, poids, taille, IMC), les caractéristiques du diabète (type, circonstances et âge de découverte, ancienneté), les complications objectivées, les pathologies associées (HTA) de même que les résultats chiffrés des moyennes de certains paramètres biochimiques du bilan biologique.
Ont été inclus dans le présent travail, les patients diabétiques ayant été suivis pendant une durée de 3 ans.
C. METHODES
1. Répartition de la population étudiée
Dans le but d’obtenir un échantillon homogène du point de vue âge, durée de diabète et sexe, nous avons formé pour chaque sexe 4 tranches d’âge :
< 20 ans, 21 - 40 ans, 41 – 60 ans, > 60 ans,
et 3 tranches de durée de diabète : < 7ans,
7 -14 ans, > 14 ans.
2. Définitions, critères diagnostiques cliniques et biologiques
2.1. Diabète [4]
Le diabète est une affection métabolique caractérisée par la présence d'une hyperglycémie chronique résultant d'une déficience de sécrétion d'insuline, d'anomalies de l'action de l'insuline sur les tissus cibles, ou de l'association des deux.
Son diagnostic repose donc sur la mesure de la glycémie réalisée soit à jeun, soit deux heures après ingestion de 75 grammes de glucose (test d'hyperglycémie provoquée orale ou HGPO). Les critères diagnostiques du diabète revus par l'OMS en 1999 indiquent que le diagnostic peut être établi de trois façons différentes :
• présence de symptômes de diabète (polyurie, polydipsie, amaigrissement) et glycémie sur plasma veineux à un taux ≥ 2,00 g/l (11,1 mmol/l) ;
• une glycémie sur plasma veineux à jeun ≥ 1,26 g/l (7,0 mmol/l) ;
Le résultat de la glycémie doit être confirmé par une deuxième mesure montrant une nouvelle valeur anormale.
2.2. IMC
La surcharge pondérale et l’obésité sont estimées grâce au calcul de l’indice de masse corporelle (IMC) ou body mass index (BMI) des Anglo-saxons.
L’IMC est calculé à partir du rapport du poids en kg sur la taille en mètre au carré : IMC = poids (kg) / taille 2 (m)[5].
Selon la classification de l’OMS [6], les seuils d’IMC permettant de définir le surpoids et l’obésité sont reportés dans le tableau suivant (tableau I)
Tableau I. Seuils de l’IMC (kg/m2) selon la classification de l’OMS [6]
Maigreur IMC < 18,5
Poids normal 18,5 < IMC < 24,9
Surcharge pondérale 25 < IMC < 29,9
2.3. HTA
L’HTA a été définie par l’existence d’un traitement antihypertenseur en cours, ou en fonction des recommandations de l’OMS, lorsque le chiffre relevé était supérieur à 140 mmHg pour la pression artérielle systolique et/ou 90 mmHg pour la pression diastolique, chiffres confirmés par des mesures itératives (au minimum deux) [7].
2.4. Macro angiopathie diabétique [8,9]
La macro angiopathie regroupe les atteintes vasculaires des vaisseaux de moyen et gros calibre.
Les principales formes de macro angiopathie sont l’atteinte coronarienne, les accidents vasculaires cérébraux et l’artérite des membres inférieurs.
2.5. Microangiopathie diabétique
On distingue sous ce terme les complications spécifiques du diabète qui atteignent les petits vaisseaux, dont le diamètre est inférieur à 150µm [8]. Tous les capillaires de l’organisme vont subir cette complication, mais notre étude portera uniquement sur les territoires les plus concernés cliniquement (rein, rétine, système nerveux).
2.5. 1- Rétinopathie diabétique [10]
Elle se caractérise par des lésions micro angiopathiques au niveau de la rétine (micro anévrysmes, microhémorragies ou néovaisseaux pouvant entrainer
apparaissant généralement après 10ans d’évolution et sont extrêmement variables, pouvant être soit minimes ou sévères conduisant à la cécité.
2.5. 2- Néphropathie diabétique [10]
Définie par des lésions micro angiopathiques au niveau du rein, elle apparait souvent après 15ans d’évolution.
Comme pour la rétinopathie, les lésions sont variables, allant de la simple augmentation du débit de filtration glomérulaire, à l’insuffisance rénale terminale nécessitant la dialyse.
Entre ces deux stades, la néphropathie est définie par la l’apparition et l’aggravation progressive d’une micro albuminurie, puis d’une HTA et d’une insuffisance rénale.
Nous nous sommes basés, dans cette étude, sur les résultats du dosage de la micro albuminurie de 24h, sur l’évaluation de la fonction rénale et le calcul de la clairance de la créatinine selon la formule de Cockcroft et Gault.
2.5.3- Neuropathie diabétique [10]
La neuropathie diabétique est due aux conséquences directes ou indirectes de l’hyperglycémie, et à l’existence de phénomènes ischémiques liés à l’obstruction des microvaisseaux irrigant le système nerveux.
On distingue la neuropathie périphérique, de loin la plus fréquente, les atteintes centrales par atteinte des nerfs crâniens et la neuropathie végétative.
Cette dernière peut émailler l’évolution d’un diabète et toucher différents systèmes (cardiovasculaire, digestif, génito-urinaire,….).
2.6. Microalbuminurie et Clairance de la créatinine
2.6.1- Micro albuminurie [11]
La micro albuminurie pathologique se définit par la présence d'albumine dans les urines de 24 heures comprise entre 30 et 300 mg/24 h. Une valeur < 30 mg/24 h est considérée comme physiologique. Le caractère permanent est affirmé par la positivité de deux examens sur trois, pratiqués sur une période de 6 mois.
2.6..2- La clairance de la créatinine
La clairance rénale de la créatinine en ml/min représente le volume de plasma totalement épuré de la substance par les reins en 1 minute. En pratique, c’est la clairance de la créatinine qui est calculée [12].
On propose, en pratique courante, d’estimer la clairance de la créatinine (Clcr) à l’aide de la formule de Cockcroft et Gault [13] :
- Clcr = (140-âge) x poids (kg) x K] / 0,814 x Pcréat (μ mol/l),
(avec P créat = valeur de la créatinine plasmatique; K = 1 chez l’homme et 0,85 chez la femme ou 0,814 au dénominateur peut être remplacé par 7,2 lorsque la créatinine plasmatique est exprimée en mg/l), ou par la formule simplifiée :
Les valeurs de références sont de 120±20 ml/min (100-140 ml/min) chez l’homme, 110±20 ml/min (90-130 ml/min) chez la femme.
3. Données biochimiques
3.1. Nature des prélèvements requis
Les paramètres biochimiques étudiés ont été dosés sur des prélèvements de sang réalisés sur :
- un tube fluoré ou iodo-acétate (bouchon gris) pour la glycémie,
- un tube hépariné (bouchon vert) ou EDTA (bouchon violet) pour la détermination du taux de l’HbA1C
,
- un tube hépariné pour le reste des paramètres sanguins.
En ce qui concerne la microalbuminurie, elle a été déterminée à partir d’une miction ou sur un échantillon d’urine des 24H, lorsque la protéinurie était négative après avoir éliminé une infection urinaire par l’ECBU.
3.2. Méthodes de dosage
3.2.1. Détermination des paramètres biochimiques
Les noms des trousses des réactifs, les valeurs normales ainsi que les principes analytiques des différents paramètres biochimiques étudiés dans ce travail sont répertoriés dans le tableau II.
Tableau II : Principes analytiques et réactifs utilisés pour le dosage des
paramètres biochimiques sanguins et urinaire.
Paramètres Nom de la
trousse Principe analytique
Valeurs normales Fabriquant Glucose Cassette Glucose HK Méthode enzymatique à l’héxokinase 0,6-1,15 g/l Roche Diagnostics HbA1C Cassette HbA1C Immunodosage Turbidimétrique 2,59-4,91 % Roche Diagnostics CT Cassette CHOLL Méthode enzymatique colorimétrique 1,5-2 g/l Roche Diagnostics TG Cassette TRIGL Méthode enzymatique colorimétrique 0,6-1,5 g/l Roche Diagnostics Créatinine Jaffé Cassette CREAT Colorimétrie λ=512nm 7-13 mg/l Roche Diagnostics Urée Cassette UREE/BUN Méthode enzymatique cinétique 0,15-0,5 g/l Roche Diagnostics Micro- albuminurie Cassette ALB-T imunoturbidimétrie < 30 mg/24H Roche Diagnostics 3.2.2. Dosage de l’HbA1C Principe méthodologique
Le Cobas-Intégra® 400 de Roche (figure 1), est un automate multiparamétrique dont le panel d’analyse s’étend à la biochimie, à la pharmacologie, à la toxicologie de routine, ainsi qu’au dosage des protéines spécifiques. Il s’agit d’un système fermé à réactifs captifs, dont la cadence analytique est d’environ 400 tests/ heure, fonctionnant habituellement 24h/ 24h sans interruption.
Après hémolyse, l’Hb libérée subit une dégradation protéique par la pepsine pour permettre la réaction immunologique avec la partie N-terminale de la chaîne β.
Pour le dosage de l’Hb, les hèmes sont oxydés. L’Hb totale est déterminée dans l’hémolysat à l’aide d’une méthode colorimétrique n’utilisant pas le cyanure et fondée sur la formation d’un chromophore brun-vert dans une solution détergente alcaline. L’intensité de la couleur est proportionnelle à la concentration en Hb de l’échantillon et déterminée par la mesure de l’augmentation de l’absorbance à 552 nm. Le résultat du dosage est calculé à l’aide d’une constante déterminée à partir du calibrateur primaire chlorohémine.
Le dosage de l’HbA1C utilise des anticorps monoclonaux fixés à des particules de latex. Les anticorps se lient à la partie N-terminale de la chaîne β de l’HbA1C.
Les anticorps encore libres sont agglutinés à l’aide d’un polymère synthétique présentant plusieurs répliques de la partie N-terminale de la chaîne β de l’HbA1C. La variation de turbidité est inversement proportionnelle à la quantité de glycoprotéines liées et est mesurée par turbidimétrie à 552nm. La figure 2 résume de façon schématique ce principe.
Un polypeptide synthétique comprenant la partie N-terminale de l’HbA1C est utilisé pour la calibration.
Le résultat final est exprimé en pourcentage d’HbA1C et calculé à partir du rapport HbA1C/Hb et d’une équation de conversion pour établir la corrélation avec la méthode HPLC de référence : HbA1C (%) = (HbA1c/Hb) ×170,8 + 1,94.
Spécificités
Cette technique présente les spécificités suivantes :
- Un CV de 1,96% pour le niveau bas et de 2,21% pour le niveau haut en répétabilité, respectivement de 2,71 % et 2,63% en reproductibilité,
- Une linéarité satisfaisante jusqu’à 14,5% : y = 0,9941 X – 0,0384 et R2 = 0,9999,
- Des valeurs usuelles allant de 2,59 à 4,91%. Limites d’utilisation et d’interférence :
Les taux de l’HbA1C peuvent être pris en défaut chez des patients présentant
certains variants de l’hémoglobine. L’HbF glyquée ne contenant pas la chaîne ß glyquée caractéristique de l’HbA1C n’est pas détectée dans le test, par
conséquent, les échantillons présentant des quantités importantes d’HbF (> 10%) peuvent donner des taux d’HbA1C inférieurs aux résultats attendus .Les
échantillons contenant de l’HbS (anémie falciforme) et de l’HbC peuvent présenter des taux d’HbA1C supérieurs aux résultats attendus.
Définition des objectifs glycémiques
La stratégie thérapeutique a comme objectif d’atteindre puis de maintenir un bon contrôle glycémique, défini par la valeur de HbA1c, mesurée tous les 3 à
4 mois. Rappelons les critères recommandés du bon contrôle glycémique [14] objectif optimal : HbA1c ≤ 6,5 % ;
mauvais contrôle, impliquant, sauf chez le sujet âgé, une modification du traitement : HbA1c > 8 % sur2 contrôles successifs ;
contrôle « acceptable » justifiant sans l’imposer une modification du traitement après appréciation par le clinicien du rapport avantages/inconvénients du changement de traitement envisagé : HbA1c comprise entre 6,6 et 8 %.
Figure 1. L’analyseur Cobas-Intégra® de Roche (Laboratoire de biochimie H.M.I.M.V)
D. Analyse statistique
Les données ont été saisies et traitées par les logiciels Excel 2007 et
SPSS10.0 pour Windows. Les résultats ont été exprimés par la moyenne ± écart type pour les variables continues et par pourcentage (effectif) pour les variables discontinues.
Les résultats sont considérés statistiquement significatifs à partir d’une valeur de P≤ 0,05.
I
A. Répartition selon le type de diabète
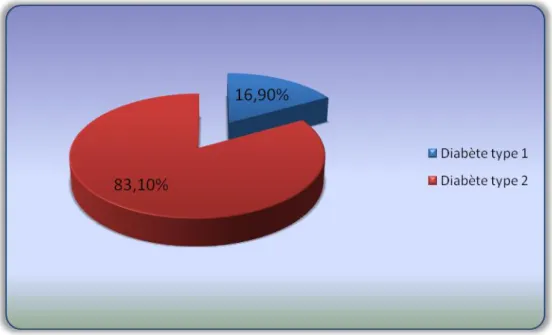
La population étudiée (n= 586) comprend : 99 cas de DT1, soit (16,9 %) et
487 patients atteints de DT 2 (83,1%), objet de notre étude.
La figure 3 illustre cette répartition et souligne la prédominance du DT2.
Figure 3 : Répartition de la population selon le type du diabète.
B. Caractéristiques démographiques, anthropométriques
biologiques et cliniques de la population étudiée
Les caractéristiques démographiques, anthropométriques et biologiques de notre population, ainsi que les différentes complications relevées et les pathologies associées sont représentées dans les tableaux III, IV et la figure 4.
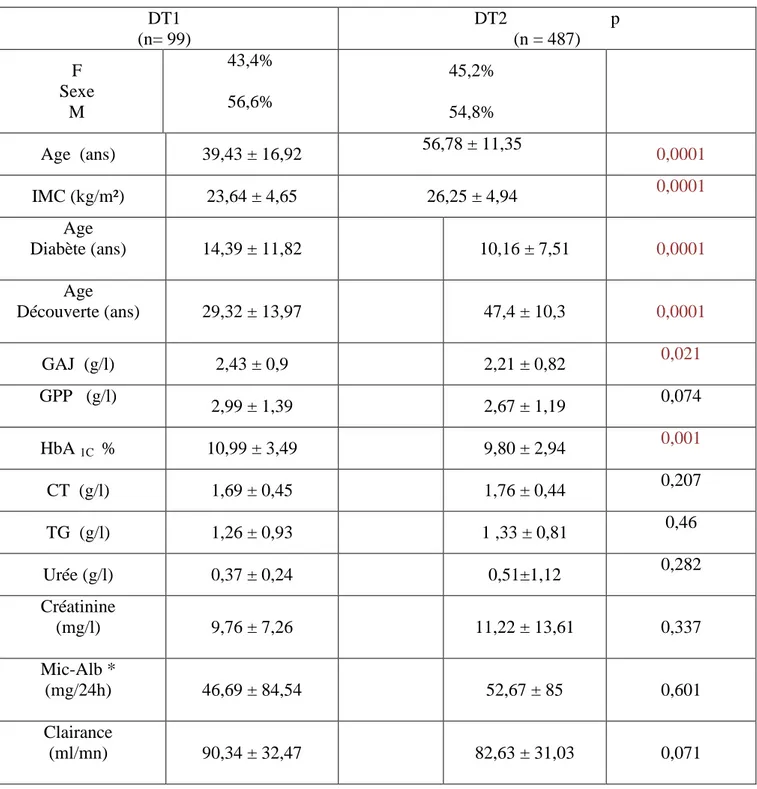
Tableau III : Données démographiques, anthropométriques et biologiques,
selon le type du diabète. DT1 (n= 99) DT2 p (n = 487) F Sexe M 43,4% 56,6% 45,2% 54,8% Age (ans) 39,43 ± 16,92 56,78 ± 11,35 0,0001 IMC (kg/m²) 23,64 ± 4,65 26,25 ± 4,94 0,0001 Age Diabète (ans) 14,39 ± 11,82 10,16 ± 7,51 0,0001 Age Découverte (ans) 29,32 ± 13,97 47,4 ± 10,3 0,0001 GAJ (g/l) 2,43 ± 0,9 2,21 ± 0,82 0,021 GPP (g/l) 2,99 ± 1,39 2,67 ± 1,19 0,074 HbA 1C % 10,99 ± 3,49 9,80 ± 2,94 0,001 CT (g/l) 1,69 ± 0,45 1,76 ± 0,44 0,207 TG (g/l) 1,26 ± 0,93 1 ,33 ± 0,81 0,46 Urée (g/l) 0,37 ± 0,24 0,51±1,12 0,282 Créatinine (mg/l) 9,76 ± 7,26 11,22 ± 13,61 0,337 Mic-Alb * (mg/24h) 46,69 ± 84,54 52,67 ± 85 0,601 Clairance (ml/mn) 90,34 ± 32,47 82,63 ± 31,03 0,071
Le sexe (variable qualitative) est exprimé en % alors que les variables quantitatives (âge, IMC, âge de découverte et âge du diabète, GAJ, GPP, HbA1C,
CT, TG, créatinine, urée, micro albuminurie, clairance) sont exprimées en moyenne ± écarts type.
Figure 4 : Boite à moustaches illustrant certaines données significativement
Tableau IV : Complications dégénératives relevées DT1 DT2 p n % n % Macroangiopathie 25 25.25 172 35,32 0,053 Rétinopathie 23 23,96 126 26,08 0,663 Neuropathie 32 32,32 195 40,04 0,151 Néphropathie 22 32,82 118 34,60 0,78
C. Spécificités du DT2 dans la population étudiée
1. Répartition selon les tranches d’âge
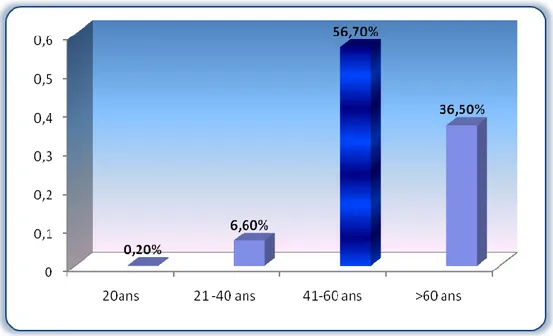
La figure 5 montre cette répartition du DT2 dans la population étudiée. Une prédominance significative de ce type de diabète, prés de 56.70% des cas (n=275), est objectivée dans la tranche d’âge comprise entre 41et 60 ans. Environ 36.50% des cas (n=177) sont âgés de plus de 60 ans. En revanche, les plus jeunes (moins de 40 ans) sont significativement les moins touchés (n=35, soit 7.2%). Il existe une différence très significative entre les différentes
Figure 5: Répartition de la population DT2 selon les tranches d’âge.
2. Répartition selon le sexe
Elle est illustrée par la figure 6 qui souligne la prédominance masculine
(54.80% d’hommes, soit n=267 contre 45.20 % de femmes, soit n=220), avec un
sexe ratio de 1.21 au profit des hommes.
3. Répartition selon l’IMC
Selon les résultats de l’IMC, on note que (figure 7):
- Prés de 45.40% (n= 218) des DT2 sont normaux, présentant un IMC compris entre18.5et 25 kg/m2,
- 31.90 % (n= 153) présentent un surpoids (IMC entre 25 et 29.9 kg/m2), - 20.20% (n= 97) sont obèses (IMC≥ 30 kg/m2
),
- Les maigres ne représentent, cependant que 2.50 %, soit un effectif de 12 patients (IMC <18.5 kg/m2).
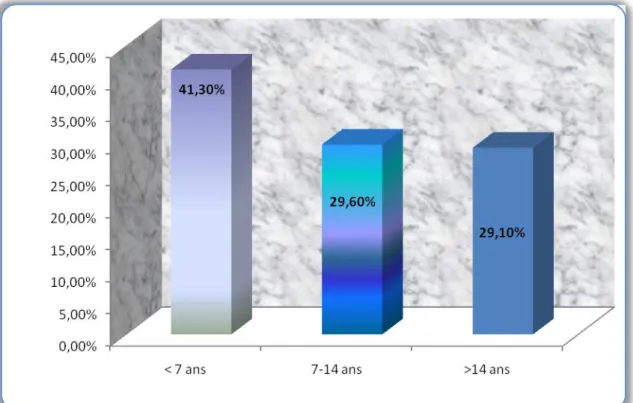
4. Répartition selon l’ancienneté du diabète
Représentée par la figure 8, elle montre la prépondérance du groupe dont l’âge du diabète est de moins de 7 ans (n= 202, 41.30%). Respectivement
29.60% (n=144) et 29.10% (n= 141) des cas ont été retrouvés dans les groupes
7-14 ans et > 14 ans.
Figure 8: Répartition des DT2 selon l’ancienneté du diabète.
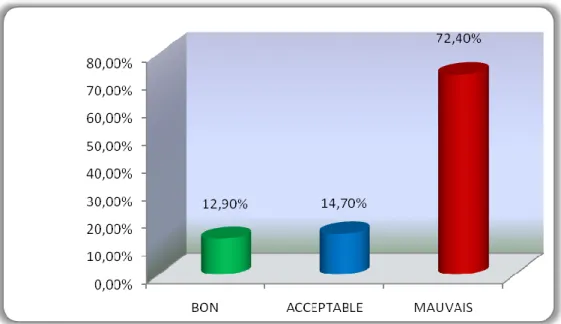
5. Répartition selon l’équilibre glycémique
Comme l’illustre bien la figure 9, le groupe présentant un mauvais équilibre glycémique (groupe 1) représente prés de 72.40%(n=330).
L’équilibre glycémique est jugé acceptable chez 14.70% des patients (n=67, ou groupe 2), et bon dans 12.90% des cas (n= 59, ou groupe 3).
Figure 9: Répartition des DT 2 selon l’équilibre glycémique
D. Analyse descriptive des complications du DT2
1. Microangiopathie
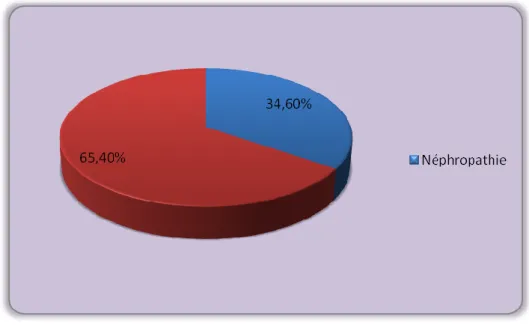
1.1. Néphropathie diabétique
La répartition de la néphropathie est représentée dans la figure 10. Les patients montrant cette complication comptent prés de 34.60% des cas (n=112).
Figure 10: Répartition de la néphropathie chez les DT2.
La répartition de la néphropathie en fonction du taux de l’HbA1C.
Soixante dix huit pourcent (n=88) des patients ayant une néphropathie sont mal équilibrés, alors que 13,40 % d’entre eux (n= 15) présentent un équilibre acceptable et seuls 8% (n=9) sont bien équilibrés (figure 11). La différence inter -groupes est significative (p<0.05).
Figure 11: Répartition de la néphropathie selon l’équilibre glycémique.
Répartition de la prévalence de la néphropathie dans chaque groupe (1, 2, 3) Comme l’illustre bien la figure 12, l’augmentation du taux de l’HbA1C
s’accompagne d’une augmentation de la prévalence de la néphropathie. En effet,
pour un taux de l’HbA1c < 6,5% (groupe 3), la néphropathie ne représente que
24,30%. Cette valeur passe à 34 ,10 % dans le groupe 2 (6,5% <HbA1c < 8%,
équilibre glycémique acceptable) et atteint 36,20% lorsque le taux d’HbA1c
Figure 12: Prévalence de la néphropathie dans chacun des groupes 1,2 et 3.
1.2. La rétinopathie diabétique
Répartition de la rétinopathie diabétique dans la population
La figure 13 montre la présence de rétinopathie chez 26,90% (n=122) de la population des DT2 étudiée.
Répartition de la rétinopathie selon l’équilibre glycémique
Comme l’illustre la figure 14, prés de 79,50 % des DT2 (n= 97) ayant une rétinopathie sont mal équilibrés, 14,80% (n=18) d’entre eux présentent un contrôle acceptable et seuls 5,70% (n=7) sont bien équilibrés. La différence inter -groupes est significative (p<0.05).
Figure 14 : Répartition de la rétinopathie diabétique selon l’équilibre
Glycémique
Répartition de la prévalence de la rétinopathie dans chaque groupe (1, 2, 3) On note une augmentation de la prévalence de la rétinopathie avec le taux de l’HbA1C (Figure 14). Ainsi, lorsque l’équilibre glycémique est bon (groupe
3), seuls 11% des cas présentent une rétinopathie, alors que des chiffres plus élevés, 27,3 % et 29,6% sont objectivés respectivement dans les groupes 2
Figure 15 : Prévalence de la rétinopathie diabétique dans chacun des groupes 1,2 et 3.
1.3. La neuropathie diabétique Répartition de la neuropathie diabétique
Environ 40,10 % des cas de la population DT2 (n=183) présente une neuropathie diabétique (figure 15).
Répartition Selon l’équilibre glycémique
Les patients atteints de neuropathie se répartissent de la manière suivante (figure 16):
82.0% parmi eux (n=150) présentent un mauvais équilibre glycémique,
prés de 10,90% (n=20) ont un équilibre acceptable, enfin, seuls 7.10% (n=13) sont bien équilibrés.
La différence entre les groupes est retrouvée nettement significative (p<0.001).
Répartition de la prévalence de la neuropathie dans les groupes (1, 2, 3)
On constate là aussi (Figure17) que l’augmentation du taux de l’HbA1C est
associée à une augmentation de la prévalence de la neuropathie, puisque celle-ci est notée dans 22, 29,9 et 45,5% des cas respectivement dans les groupes 3 (bon équilibre glycémique), 2 (équilibre glycémique acceptable) et 1 (mauvais équilibre glycémique).
Figure 18: Prévalence de la neuropathie dans chacun des groupes 1,2 et 3.
2. La macroangiopathie
Répartition de la macro angiopathie dans la population de DT2
La figure 18 montre que 35,1% des cas de la population DT2 étudiée présentent une macro angiopathie.
Figure 19: Répartition de la macro angiopathie dans le DT2
Répartition de la macro angiopathie selon l’équilibre glycémique Les 160 cas de macro angiopathie dans la population des DT2 se répartissaient de la manière suivante (figure 19):
122 cas (76,20%) sont mal équilibrés,
22 patients (13,8%) ont un équilibre acceptable, et seuls 16 d’entre eux(10%) sont bien équilibrés.
Figure 20 : Répartition de la macro angiopathie selon l’équilibre glycémique.
Répartition de la prévalence de la macro angiopathie selon les groupes (Figure 20)
Une augmentation de la prévalence de la macroangiopathie se retrouve associée à celle du taux de l’HbA1C : 27%1dans le groupe 3 (bon équilibre
glycémique), 32,8 % dans le groupe 2 (équilibre glycémique acceptable) et 37%
dans le groupe 1 (mauvais équilibre glycémique).
Figure 21: Prévalence de la macro angiopathie dans chacun des groupes 1,2 et 3
3. HTA
3.1. Répartition dans la population de DT2
Comme l’illustre la figure 21, une HTA est retrouvée dans 30,9% des cas de DT2.
3.2. Répartition selon l’équilibre glycémique (figure 22)
Près de 75,2% des patients hypertendus sont mal équilibrés, 14,2% d’entre eux présentent un équilibre acceptable et seuls 10,6% sont bien équilibrés.
La différence entre les groupes bon / mauvais, ou acceptable / mauvais est très significative (p<0.001).
Figure 23 : Répartition de l’HTA selon l’équilibre glycémique
Répartition de la prévalence de l’HTA dans chacun des groupes 1,2 et 3 (figure 23).
La prévalence de l’HTA suit un ordre croissant en allant du groupe 3 (25,4%) au groupe 1 (29,9%) en passant par le groupe 2 (32,1%).
Figure 24 : Prévalence de l’HTA dans chacun des groupes 1, 2, 3.
E. Corrélations
1. HbA
1C/ Paramètres biologiques et anthropométriques
Le résultat de cette corrélation est reporté dans le tableau V. Il existe une corrélation positive statistiquement significative entre les valeurs de l’Hb A1C et
les chiffres de la GAJ et de la GPP d’une part et l’IMC d’autre part.
Tableau V : Corrélation de l’Hb A1C avec les paramètres biologiques et
anthropométriques. HbA1C r P GAJ 0,373 0.0001 GPP 0,355 0.0001 Age 0,053 0,098
2. Corrélation HbA
1c/Complications dégénératives (Tableau
VI)
Le taux de l’Hb A1C se trouve corrélé de façon positive et statistiquement
significative avec la rétinopathie et la neuropathie.
Tableau VI : Corrélation de l’Hb A1C avec les complications dégénératives
Complication
p
HbA
1CMacro angiopathie
0,315Néphropathie
0,366Rétinopathie
0,019Neuropathie
0,0013. Corrélation : Ancienneté de DT2/Complications
Le tableau VII présente les résultats de cette corrélation. On note une corrélation statistiquement significative entre l’âge du diabète et les diverses complications dégénératives.
Tableau VII : Corrélation : Ancienneté du diabète/Complications dégénératives Complications dégénératives p
Ancienneté de DT2 Macroangiopathie 0,001 Néphropathie 0,0001 Rétinopathie 0,001 Neuropathie 0,026
E. Synthèse générale
Une synthèse des résultats de la prévalence des complications macro- et micro angiopathiques et de l’HTA dans la population de DT2 d’une part et selon l’équilibre glycémique d’autre part est présentée dans les figures 24 et 25.
Figure 25 : Répartition des complications dégénératives et de l’HTA dans
Figure 26 : Prévalence des complications dégénératives et de l’HTA dans
la population de DT2 selon l’équilibre glycémique
I
A. Diabète et hémoglobine glyquée A
1C(Hb A
1C)
1- Diabète : Généralités
Le diabète sucré est une affection mondialement répandue, de prévalence importante et en constante augmentation. Cette maladie chronique grave peut donner lieu à diverses complications, liées au mauvais contrôle glycémique, qui peuvent se manifester très tôt, sont débilitantes ou mettent en jeu le pronostic vital.
Il est ainsi devenu un problème de santé publique non seulement dans les pays industrialisés mais également au sein du tiers monde, où les patients diabétiques soufrent d’un mauvais pronostic et d’une espérance de vie brève. En conséquence, l’OMS a recommandé que des programmes nationaux contre le diabète soient initiés, avec l’objectif de retarder l’apparition des complications, et ainsi de réduire la mortalité et la morbidité [15].
1.1- Diagnostic
Le diagnostic de cette maladie repose sur la mise en évidence d'une hyperglycémie chronique. Les nouveaux critères diagnostiques définis selon l’OMS et l’ADA(American Diabetes Association)sont reportés dans le tableau III.
Le laboratoire joue un rôle important dans le dépistage, le diagnostic et le suivi de la maladie, de la simple détermination de la glycémie à la mise en évidence plus complexe de facteurs immunologiques de prédisposition.
Tableau VIII : Les Nouveaux critères de diagnostic du diabète sucré (ADA
1997/OMS 1999) [16]
Symptômes cliniques de diabète (polyurie, polydypsie, perte de poids inexpliquée) associés à : Glycémie ≥ 2 g/l à tout moment de la journée (sans considération de délai écoulé après le repas)
Ou
Glycémie à jeun ≥ 1.26 g/l soit 7.00 mmol/l
(jeûne : absence de prise alimentaire calorique depuis au moins 8 heures) Ou
Glycémie ≥ 2 g/l soit 11.1 mmol/l à la deuxième heure d’une HGPO
(dans les conditions définies par l’OMS : 75 g de glucose dissous dans 250 ml d’eau). Au cours d’une HGPO
Temps Valeurs Normales Impaired Fasting Glucose Intolérance au glucose
Diabète sucré unités
T0 < 1.10 (< 6.1) ≥1.10 < 1.26 (≥ 6.1 < 7) ≥ 1.26 (≥ 7) g/l mmol/l T+ 120 < 1.40 (< 7.8) ≥1.40 < 2.0 (≥ 7.8 < 11.1) ≥ 2.0 (≥ 11.1) g/l mmol/l
1.2. Classification et physiopathologie
[1, 17,18]Jusqu'en 1980-1985, l'OMS distinguait deux principaux types de diabète, le diabète insulinodépendant (DID) et le diabète non insulinodépendant (DNID) qui sont désormais abandonnés au profit d'une classification ne tenant plus compte du traitement mais de l'étiologie.
Selon la nouvelle terminologie,
le diabète de type 1 (DT1) est défini par la destruction des cellules ß des îlots de Langerhans d'origine auto-immune ou inconnue (diabètes idiopathiques).
Beaucoup plus rare, c’est une affection bruyante, reconnue sur des signes cliniques souvent intenses (polyurie, polydipsie, amaigrissement), et qui survient préférentiellement dans l’enfance, l’adolescence ou le jeune âge adulte.
L’existence d'une composante familiale est clairement établie. De nombreux gènes de prédisposition sont candidats, parmi lesquels le locus du complexe majeur d'histocompatibilité est de loin le plus incriminé. Ainsi, dans une fratrie d'un sujet diabétique, le risque de développer l'affection est de 1,8 % pour des HLA différents, de 5 % s'ils sont semi-identiques et de 16 % pour les HLA identiques. Les haplo types de prédisposition concernent des spécificités HLA de classe II : ces associations sont en effet beaucoup plus fortes que celles qui ont été initialement décrites avec les antigènes HLA de classe I : A1, B8, B18 et B15. A l'inverse des gènes de prédisposition, il a été montré que certains haplotypes confèrent une protection quasi absolue. Par ailleurs, des hypothèses avancent des facteurs infectieux (entérovirus), nutritionnels (protéines du lait de vache, carence en vitamine D), voire psychosociaux (âge maternel avancé, stress).
Le diabète de type 2 est défini par la présence d'une insulinorésistance et éventuellement d'une insulinopénie relative, associées de façon variable. C’est une maladie longtemps asymptomatique, qui survient typiquement après la cinquantaine, tout particulièrement chez des personnes en surpoids ou qui ont des antécédents familiaux de la même maladie.
entraîne une augmentation de la production de glucose et une diminution de son utilisation au niveau des tissus musculaires et adipeux.
Il s’agit d’une affection génétiquement transmise comme en témoigne la concordance quasi absolue de son apparition chez des jumeaux monozygotes. Le risque de devenir diabétique est de 30 % si un parent est atteint, et de 50 % si les deux parents le sont. La maladie est polygénique et nécessite des circonstances favorisantes. Celles pouvant être incriminées sont essentiellement représentées par la tendance à l’occidentalisation, à la sédentarité, les changements des habitudes alimentaires et le développement de l’obésité.
Par ailleurs, certaines populations présentent une susceptibilité plus importante que d'autres au diabète de type 2. Cette prédisposition, dont les bases génétiques sont encore inconnues, se révèle généralement lors du passage d'une alimentation traditionnelle à une alimentation riche en graisses et sucres rapides. Les Indiens Prima (Arizona, Etats-Unis) présentent la prévalence la plus élevée connue à ce jour : la moitié des adultes est diabétique. Les populations des iles du Pacifique Sud (Nauru, Fidji) sont aussi parmi les plus touchées par la maladie.
Par ailleurs, l’épidémiologie du « diabète », au moins en ce qui concerne la description de la maladie en population et les projections assez alarmantes sur son développement mondial pour un proche avenir, correspond en fait à « l’épidémiologie du DT2».
1.2- Complications
Outre les complications aigues, l’hyperglycémie chronique s’accompagne de complications chroniques qui constituent l’essentiel de la gravité du diabète. Elles sont de deux types, micro et macrovasculaires, elles représentent une source de handicaps pouvant altérer la qualité de vie et générer de lourdes dépenses de santé [19]. Nous les aborderons plus en détail lors de la discussion de nos résultats.
La connaissance de l’épidémiologie des complications du diabète est un élément important de la surveillance sanitaire des populations et doit aider à la mise en place de mesures de prévention au niveau individuel [20].
Le monitorage et la surveillance de l’équilibre glycémique est l’un des piliers de cette prévention. Le laboratoire, grâce au dosage de l’Hb A1C joue un rôle
indéniable dans ce contexte. Ceci nous amène tout naturellement à aborder une discussion autour de ce paramètre et marqueur biologique.
2- Hb A
1CL’HbA1c est reconnue depuis plusieurs années comme le paramètre le plus
objectif du contrôle glycémique dans la surveillance du diabète sucré. Elle s’est imposée comme le gold standard des examens biologiques, indispensable à une prise en charge optimale d’un patient diabétique. En effet, les résultats des grandes études prospectives (DCCT et UKPDS), ont établi de façon certaine une corrélation entre l’équilibre glycémique évalué par l’HbA et l’apparition
de complications dégénératives 21 . Cette relation met en exergue l’intérêt de ce test dans le suivi à long terme du patient diabétique.
Ce paramètre a permis de fixer des valeurs thérapeutiques décisionnelles et de calculer le risque de survenue des complications en fonction de l’augmentation ou la diminution des résultats par rapport au dosage précédant
22, 23
.
2.1- Signification
2.1.1- Hémoglobine[24,25]
L’hémoglobine est la protéine des globules rouges qui transporte l’oxygène vers les cellules, elle existe sous plusieurs formes :
- Les formes génétiquement déterminées : Hb A, A2 et F,
- Les formes résultant de modifications post traductionnelles telles que : Hb A1a, A1b, A1c.
L’Hb A2 de structure α2 δ2 est formée de deux chaînes polypeptidiques α
et δ.
L’Hb F de structure α2 γ2 est formée de deux chaînes polypeptidiques α et
γ. Elle prédomine pendant la vie fœtale et diminue pendant la première année de vie.
L’Hb A, possède la structure moléculaire α2 β2. Son analyse
chromatographique ou électrophorétique permet de mettre en évidence une hétérogénéité structurale. On distingue une forme majeure appelée HbA0 et
plusieurs formes mineures qui sont répertoriées sous le nom d’hémoglobine A1
ou hémoglobines rapides (elles migrent plus rapidement que l’HbA0 sous
l’influence d’un champ électrique). Ces dernières représentent 4 à 8 % de l’Hb totale et correspondent à des formes glyquées de l’hémoglobine. Toutes ces hémoglobines contiennent les mêmes chaînes polypeptidiques α et β et la structure α2 β2. Elles ne se différencient que par la fixation de molécules greffées
sur les chaînes polypeptidiques par la réaction de glycation. 2.1.2- Hb glyquée[1,23,24,25]
Les Hb glyquées correspondent à l’ensemble des molécules d’Hb modifiées par fixation non enzymatique d’oses sur les fonctions aminées libres de la globine.
Décrite par Maillard en 1912, la glycation des protéines, notamment de l’Hb correspond à la fixation non enzymatique d’oses simples sur des groupements aminés libres des protéines, et s’oppose à la glycosylation qui est un mécanisme enzymatique de la biosynthèse protéique [1].
Ce processus comporte plusieurs étapes. Dans un premier temps, la condensation d’une fonction aldéhyde ou d’un groupement cétonique d’un sucre avec un groupement aminé d’une protéine conduit à la formation d’une base de schiff (aldimine) labile. Cette réaction est rapide et réversible .
Dans un second temps, la base de schiff subit un réarrangement dit d’Amadori pour former une liaison cétoamine (ou fructosamine) stable (figure 3).
Figure 27. Les étapes de la glycation [24].
Du point de vue structurale, la fraction "Hb glyquée" regroupe un ensemble de composés différents par la nature de l’ose fixé (glucose, glucose-6-phosphate, fructose-1,6-biphosphate, galactose, mannose), et le site protéique de fixation par fonction α aminée libre de la valine N-terminale des chaînes β (60%) ou fonction ε aminée accessible des résidus lysiles.
Lorsque l’Hb est glyquée à l’extrémité N- terminale (valine) des chaînes β, ses propriétés physico-chimiques (pHi) sont suffisamment modifiées pour permettre une séparation par électrophorèse ou chromatographie, c’est l’HbA1.
L’hémoglobine peut également être glyquée sur d’autres sites, qui ne modifient alors pas son pHi.
Dans le globule rouge, on trouve donc l’hémoglobine glyquée sous différentes formes. On peut en séparer certaines par chromatographie d’échange ionique (figure 4). Ces formes ont une migration plus rapide par rapport à l’Hb non modifiée ou A0.
Figure 28. Les différentes fractions de l’hémoglobine obtenues par chromatographie d’échange cationique dans le sang d’un sujet adulte non
diabétique [22].
- L’hémoglobine A1 est formée de plusieurs fractions, qui, en fonction de leur
ordre d’élution en chromatographie d’échange cationique faible, ont été nommées HbA1a (comprenant elle même deux sous-fractions HbA1a1 et HbA1a2),
HbA1b, HbA1c.
- Les hémoglobines A1a1 et A1a2 résultent respectivement de la liaison de
fructose-1,6-diphosphate et de glucose-6-phosphate sur la valine N-terminale des chaînes β de l’hémoglobine. Ces deux formes représentent en moyenne environ 0,5 % de l’hémoglobine. Dans le cas de l’HbA1b (environ 0,8 % de
l’hémoglobine en moyenne), c’est le pyruvate qui est fixé à l’extrémité N-terminale des chaînes β de globine.
Le tableau IV résume les termes employés pour designer les différentes formes d’hémoglobines glyquées.
Lorsque d’autres hémoglobines sont présentes (HbS, HbC par exemple), elles subissent de la même façon le processus de glycation, et dans les globules rouges sont retrouvées des formes glyquées de ces variants (HbS1c ou C1c par
exemple), au même titre que les formes glyquées de l’HbA. Il faut en tenir compte pour l’interprétation des résultats, car la présence de ces hémoglobines anormales a un effet variable selon les techniques utilisées.
Tableau IX. Les différentes formes d’hémoglobine glyquée [24].
HbA Tétramère α2β2
HbA0
-Composant majeur de l HbA séparé par chromatographie d’échange ionique ou électrophorèse
-Comprend l’Hb glyquée sur des sites ne modifiant pas son pHi HbA1
-Hémoglobine(s)rapide(s) ou fast hémoglobins en chromatographie d’échange d’ions (ou électrophorèse) -Hb glyquées sur des sites modifiant le pHi
–HbA1a1+HbA1a2+HbA1b+HbA1c
HbA1c
-Hb glyquée formée par fixation de glucose sur l’extrémité N-terminale des chaînes β de l’Hb A
-Fonction cétoamine stable Hb pré-A1c
-Forme labile de l’HbA1C, caractérisée par une fonction
aldimine(base de schiff)
-Ne doit pas être évaluée en même temps que l’HbA1C
Hb glyquée
-Synonyme : glycohémoglobine
-Remplace le terme impropre « Hb glycosylée »
-Caractérisée par toute fixation non enzymatique de glucose (ou d’autres oses) sur l’Hb
-Fraction dosée par les méthodes de chromatographie d’affinité, souvent appelée « hémoglobine glyquée totale » ou HbG
2.1.3- Hb A1C
Selon le groupe de travail de l’IFCC, l’HbA1c est définie comme suit :
Hémoglobine A1 glyquée de manière irréversible sur une ou les deux extrémités
libres des valines N-terminale des chaînes β. Sa formation consiste en une fixation rapide, réversible de glucose sur la chaîne β par une liaison aldimine labile qui subit un réarrangement d’Amadori lent et irréversible pour donner une liaison stable cétonique [23, 26]. (Figure 5).
Figure 29. Formation de l’HBA1C [27]
L’importance de la glycation est dépendante de la concentration intra- érythrocytaire en glucose et de la durée de vie de l’hématie [26]
.
A cause du caractère lent et irréversible de cette dernière réaction, se déroulant sur la durée de vie de l’érythrocyte (120 jours), le % d’HbA1c reflète bien la concentration en glucose dans le sang pendant les deux mois précédant l’analyse.
2.2- Dosage
Apparu dans les années 1970, le dosage de l’Hb A1C s’est rapidement
imposé comme une analyse incontournable pour la surveillance des patients diabétiques [29].
La modification structurale acquise au cours du phénomène de glycation décrite plus haut, aboutit, comme cela a été précisé plus haut, à une modification de la charge électrique de l’HbA1c par rapport à l’HbA0. Elle permet ainsi de séparer
ces fractions par des techniques analytiques dont le principe est fondé sur la modification de cette propriété physico-chimique [26].
2.2.1. Phase pré analytique Prélèvement
Le dosage de l’HbA1c est réalisé sur un prélèvement de sang effectué par ponction veineuse au pli du coude sur héparine, fluorure, EDTA, ou ACD. Un prélèvement de sang capillaire est également possible [23,24].
Le sang total est conservé à + 4° C. La conservation de l’échantillon plus de 3 jours (EDTA), plus de 5 jours (ACD), pourrait conduire à l’apparition sur les pics des chromatogrammes d’épaulements provenant de la dégradation de l’hémoglobine [24]
.
Prétraitement et conservation
Le prétraitement de l'échantillon comprend la réalisation de l'hémolyse et l’élimination de la fraction labile de l’hémoglobine glyquée [24]
.
Les hémolysats peuvent être conservés à + 4° C pendant au maximum 7 jours, avec cependant possibilité de dégradation. Pour une conservation à long terme (plusieurs mois), une congélation des échantillons à – 24° C est requise. Des hémolysats préparés aussitôt après le prélèvement et conservés de cette façon peuvent valablement être utilisés pour contrôler la reproductibilité des techniques [23, 24].
2.2.2. Phase analytique
L’intérêt suscité par la détermination de l’HbA1c est à l’origine d’une multiplication des techniques de dosage adoptées. Les méthodes utilisées exploitent soit les caractéristiques physico-chimiques (chromatographie d'échange ionique, électrophorèse), soit immunologiques de la molécule.
Les techniques de chromatographie d'échange cationique faible sont les techniques « historiques » d'étude de l'HbAlc, ayant permis son isolement et sa
caractérisation. Elles sont basées sur la plus grande électronégativité des Hb glyquées sur I'extrémité N-terminale des chaînes β. Le terme générique chromatographie d'échange ionique recouvre des techniques très différentes allant des colonnes de chromatographie basse pression (CLBP) aux automates de chromatographie haute performance (CLHP) très résolutifs. Leurs propriétés analytiques varient et le pic « HbAlc» ne contient pas toujours les mêmes constituants [23].
Les techniques électrophorétiques, réalisées le plus souvent en gel d'agarose, mettent en jeu les mêmes propriétés de I'HbA1c. Comme les techniques chromatographiques, elles permettent la mise en évidence de la plupart des variants de l’Hb, mais ne permettent pas celle des Hb modifiées comme les Hb carbamylées [23].
Les anticorps utilisés dans les méthodes immunologiques reconnaissent le peptide N-terminal des chaînes β modifiées par la fixation de glucose. II s'agit d'un court peptide, de longueur variable selon les fabricants. Différents systèmes ont été proposés :
- Un dosage immunoturbidimétrique en phase homogène adapté sur divers analyseurs automatiques de biochimie clinique, effectué après hémolyse préalable manuelle d’une aliquote de sang. Le pourcentage d’HbA1c est calculé par rapport à l’Hb totale dosée en parallèle, à l’aide d’une gamme d’étalonnage titrée avec un système de CLHP,
- Un dosage d’immunoinhibition sur latex, effectué sur sang capillaire, requiert l’utilisation d’un analyseur spécialisé,
- Un dosage ELISA sur microplaques automatisé utilisant un anticorps monoclonal [24].
Récemment, il a été mis sur le marché un lecteur d’Hb glyquée, le moniteur A1c Now® (Bayer Diabetes Care), pour le dosage de l’HbA1c, à partir d’une goutte de sang capillaire en délocalisé. Ce système fait appel à des techniques d’immunodosage et d’analyse chimique pour mesurer l’HbA1c et l’Hb totale respectivement. Il offre une précision adéquate comparée aux techniques standardisées, il pourrait être plus bénéfique pour les patients qui ne peuvent obtenir des valeurs d’un laboratoire standardisé, en raison des contraintes financières ou de transport [28].
Le tableau V présente la plupart des réactifs disponibles pour le dosage de l’HbA1c en France, classés par méthode d'analyse, et leurs caractéristiques
Tableau X. Principaux réactifs disponibles pour le dosage de l’HBA1C en France [23].
Méthode Fabricant (gamme) Certification Mode de
calcul
Interférences décrites dans les notices
Chromatographie d’échange d’ions
NGSP HbA1C/ ensemble HbA CLHP Bio-Rad (Varian®,
D10®) Séparation/pas d’inter- férences avec HbA1C labile, HbF, variants
de l’Hb de charges différentes de l’HbA0 et de l’HbA1c (dont Hb
S,C,D,et E) . Tosoh Bioscience (G7) Menarini (HA) CLBP Bio-Rad (Diastal®) NGSP
Protocole d’hémolyse adapté pour éviter l’interférence de l’HbA1c
labile (co-migration), mauvaise séparation de l’HbF, séparation des Hb S et C.
Bayer Diagnostic
(glycomal®) Notice non communiquée par le fabricant Microcolone Bio-Rad
Electrophorèse Sebia Non précisée HbA1/Hb
totale Co-migration HbA1C et HbF Chromatographie
d’affinité Progen (Nycocard) Non précisée
Hb glyquées/ Hb non glyquées Calcul HbA1C
Pas de description des interférences
Méthode immunologique: inhibition d’agglutination ABX Pentra NGSP HbA1C/ Hb totale Augmentation de la valeur d’ HbA1C en présence d’Hb S et C.
Résultat d’ HbA1C< résultat attendu
en présence d’HbF > à10%. Pas d’interférence de HbA1C labile.
Roche Diagnostics
(Tina-Quant®, Intégra®) IFCC formule pour NGSP Beckman Coulter
(Synchron)
Pas d’effet de l’Hb glyquée labile, de l’HbF < à10%, des Hb S et C. Dade Behring
(dimension) NGSP
Reconnaissance par l’anticorps de nombreuses Hb anormales glyquées (S ,C ,E,G,H). Résultat inexact si taux élevé d’HbF. Bayer Diagnostic (DC
200) NGSP
Résultat d’HbA1C< résultat attendu
en présence d’Hb S ou C (diminution durée de vie des hématies) ou d’HbF > à10%.
Standardisation des méthodes de dosage (Tableau V) Plus de trente méthodes sont disponibles commercialement pour mesurer
l’Hb glyquée. Le manque de standardisation des méthodes utilisées pour mesurer l’hémoglobine glyquée a entraîné une très grande variabilité dans les résultats avec des valeurs allant de 4,0 % à 8,1 % pour le même échantillon de sang. Dans plusieurs pays, un processus de standardisation a été utilisé pour réduire la variabilité des résultats [30].
En France, les opérations de standardisation menées en particulier à l’instigation de la SFBC ont permis la sélection de techniques fiables et standardisées. Les sociétés scientifiques (SFBC, ALFEDIAM, SFE) et les organismes officiels (AFSSAPS, ANAES) retiennent comme critère incontournable l’utilisation de techniques standardisées dans les laboratoires de biologie.
Les seuils définis grâce aux études prospectives DCCT et UKPDS [12,13], l’ont été avec le seul système de standardisation NGSP de l’HbA1c utilisable sur la période de réalisation de ces travaux [23]. Le groupe NGSP utilise un système de référence en CLHP et des préparations d’Hb purifiées. Grâce à celui-ci, il a déjà certifié un grand nombre de méthodes. Il préconise des résultats chiffrés avec un intervalle de référence compris entre 4 et 6 % de l’Hb totale. Mais le pic chromatographique obtenu par la méthode de référence n’est en effet pas pur à 100 %. Cela a conduit le groupe IFCC à adopter un système de référence plus élaboré, utilisant une méthode de chromatographie CLHP en phase inverse, couplée à une détection par spectrométrie de masse ou par électrophorèse
globine obtenu par digestion enzymatique des préparations d’Hb purifiées. Mais l’inconvénient majeur de cette technique est de fournir des valeurs d’HbA1c de 1 à 2 % plus basses que celles de la standardisation NGSP.
Après plusieurs échanges au sein des laboratoires du groupe d'experts de l'IFCC et du NGSP, la relation entre les deux méthodes a été récemment décrite : NGSP = (0,915x IFCC) + 2,15. Une équation existe donc entre les deux types de standardisation et les membres des deux groupes ont mis en place une organisation permettant de surveiller l'absence de dérive ultérieure entre les résultats. De plus, des études de cohortes à grande échelle sont nécessaires pour fixer de nouveaux seuils décisionnels si la standardisation IFCC devient la nouvelle référence [23, 31, 32, 33].
Un groupe de travail, formé par I'EASD, l'ADA, l’IDF et des représentants du NGSPet de l'IFCC, a pris alors les décisions suivantes:
* pour éviter toute confusion au niveau des prescripteurs et des patients, les résultats doivent continuer à être rendus selon les normes NGSP/DCCT actuellement en vigueur,
* seules les valeurs usuelles et les seuils décisionnels NGSP/DCCT, avec lesquels les patients et les médecins sont actuellement familiarisés, doivent continuer à être utilisés,
* la standardisation IFCC définit dorénavant les matériaux et la méthode de référence avec laquelle les industriels du diagnostic in vitro devraient se standardiser.
Ce consensus permet d'éviter des confusions et ne remet pas en cause les recommandations de la HAS et de l'AFSSAPSf en matière de suivi et de traitement du patient diabétique [21].
Mais, comme nous l'avons vu, l'HbA1c reflète la concentration en glucose présente au cours d'une période d'environ 3 mois.
C'est pourquoi, il a été proposé, selon des recommandations toutes récentes, d'utiliser la concentration en HbA1c pour calculer une Concentration Moyenne
en Glucose (CMG) à l'aide de cette formule : CMG (mmol/l) = 1, 84 x IFCC HbA1c.
Elle a l'avantage de lier directement la mesure d'HbA1c à une concentration de glucose. Cela facilite l'interprétation du résultat par le patient et augmente la perception des petites variations.
Par ailleurs, devant la différence observée entre un résultat DCCT/NGSP et un résultat IFCC, il a été proposé d'exprimer les résultats IFCC dans une autre unité (mmol d’HbA1c / mol d’Hb) pour l’HbA1c. Cela a l'avantage de marquer clairement le type de standard utilisé, dès la lecture du résultat[34].
2.2.3. Phase post analytique, interprétation des résultats
La glycation de l’Hb étant à son terme quasiment irréversible, elle constitue une véritable mémoire des taux cumulés de glucose circulant. Liée à la durée de vie des globules rouges (120 jours), la quantité d’hémoglobine glyquée représente la valeur intégrée de la glycémie des 6 à 8 semaines précédentes et
Il existe, comme nous l’avons souligné plus haut, de nombreuses méthodes de dosage des hémoglobines glyquées auxquelles correspondent des valeurs de références et des causes d’erreur différentes. C’est pourquoi, il est hasardeux d’interpréter des résultats d’hémoglobine glyquée sans connaître exactement la méthode utilisée [24] .
Présentation des résultats [21]
Conformément aux recommandations de l’Afssaps, il est nécessaire pour le rendu des résultats du dosage de l’HbA1c :
D’utiliser des DMDIV standardisés (NGSP ou IFCC),
De maintenir le rendu des résultats du dosage de l'HbA1c dans le système de référence du NGSP/DCCTavec indication de la technique, du système de standardisation et des valeurs de référence adéquates.
Ceci afin de maintenir la cohérence avec les recommandations de la HAS en matière de suivi glycémique du patient diabétique et d'éviter toute confusion au niveau des prescripteurs et des patients.
Le compte rendu devra donc, spécifier la nature de la technique utilisée, la fraction d’hémoglobine glyquée effectivement dosée (HbA1c, HbA1, Hb glyquée totale), et l’intervalle des valeurs de référence. Les résultats sont exprimés en pourcentage de la fraction d’hémoglobine glyquée par rapport à la concentration de l’hémoglobine totale.
Valeurs usuelles
Les différentes valeurs usuelles, en fonction des techniques de mesures, parmi les plus utilisées, sont regroupées dans le tableau VI.
Tableau XI. Valeurs usuelles en fonction du type de technique [24]
Méthodes Forme d’hémoglobine
mesurée Valeurs normales
Electrophorèse HbA1 HbA1 HbA1c
6-9% 4-6%
Echange d’ions CLHP HbA1c 4,3-6,1%
Echange d’ions
(
microcolonne) HbA1c 4-6%Chromatographie
d’affinité (microcolonne) Hb glyquée totale 5, 3-7,5%
immunodosage HbA1c 4-6%
isofocalisation HbA1c 4-5%
Variations physiologiques
Les valeurs d’HbA1c sont indépendantes du régime alimentaire, de l’exercice physique et de l’état de jeûne. Il n’existe pas non plus de variations avec l’âge et le sexe [23].
Variations pathologiques, causes d’erreur - Raccourcissement de la durée de vie des globules rouges
La valeur sémiologique de l’HbA1c comme marqueur rétrospectif et cumulatif de l’équilibre glycémique au cours des 6 à 8 semaines précédant le
avec 97 à 99 % d’HbA. Si l’un de ces paramètres est modifié, l’interprétation du dosage de l’HbA1c devient délicate, voire impossible [23, 35].
La glycation de l’Hb se produit dés les stades érythropoïètiques, puis tout au long de la présence des globules rouges dans le courant circulatoire. Toute modification de la durée de vie des hématies entraîne donc une perturbation de cet équilibre, et la destruction prématurée des érythrocytes les plus âgées diminue les valeurs d’HbA1c. Les hémolyses, quelle que soit leur origine (auto-immune, mécanique, toxique, médicamenteuse), les hémorragies ou spoliation sanguine importante et les traitements stimulant l’érythropoïèse entraînent un rajeunissement globale de la population érythrocytaire en quelques jours et rendent ininterprétable les résultats d’HbA1c.
De la même façon, les antécédents transfusionnels récents altèrent les taux d’HbA1c. La même situation est rencontrée dans le cas de cirrhoses avancées qui provoquent l’augmentation de la séquestration splénique des globules rouges, ainsi qu’une hémolyse importante et d’hépatites virales traitées par Ribavirine® où les résultats d’HbA1c sont sous estimés du fait de l’anémie régénérative provoquée par le traitement [4, 19, 37].
Ces situations sont fréquentes en milieux hospitalier et leurs conséquences sur les dosages d’HbA1c sont souvent méconnues des cliniciens [23]
. - Présence d’une hémoglobinopathie
La présence d’un variant peut induire une erreur d’interprétation avec pour conséquence une décision thérapeutique inadéquate est donc des plus importantes [23]
L’hémoglobine fœtale peut être à l’origine de résultats erronés avec les techniques qui ne permettent pas de l’identifier ou de reconnaître spécifiquement la fraction l’HbA1c [24].
- Modifications post-traductionnelles de l'Hb L'Hb glyquée labile ou pré-Alc peut également interférer [25].
In vitro, I'incubation d'Hb normale avec de l'aspirine conduit a la formation d'Hb acétylée dont le point isoélectrique est proche de celui de I'HbAlc. L'Hb acétylée est séparée de I'HbAlc par les techniques modernes de chromatographie et n'interfère pas avec les techniques immunologiques. De plus, chez des patients consommant chroniquement jusqu'a 1 g d'aspirine par jour, I'Hb acétylée reste indétectable. L'interférence de I'Hb acétylée, quelle que soit la méthode de dosage, semble donc peu probable [23].
Au cours de l’éthylisme chronique, une acétylation de l’hémoglobine est également observée, avec les mêmes conséquences sur son comportement en électrophorèse et chromatographie d’échange cationique : des valeurs relativement élevées d’hémoglobine acétylée ont été trouvées chez des patients éthyliques (2 à 3 %), mais on ne possède pas vraiment de résultats d’études à grande échelle qui puissent affirmer le rôle réel de cette interférence dans les dosage de l’HbA1c [6].
- Hémoglobine carbamylée et insuffisance rénale
2.3.4.4. Autres interférences[24]. ➤ Lipémie
Lorsque la triglyceridémie est élevée, certaines techniques peuvent être affectées comme l’électrophorèse ou encore la chromatographie sur minicolonnes d échange ionique appliquée au cours de l’HbA1c dans son ensemble. Dans ces cas, les résultats peuvent être faussement élevés ou l’interprétation délicate (mauvaise séparation des bandes en électrophorèse). Un prétraitement de l’échantillon peut être nécessaire.
➤ Bilirubine : aucun effet n’est décrit. 2.3.5. Interprétation
Aujourd'hui, on admet généralement qu'un taux d'HbA1c de 4 à 6 % est normal et que le taux de 7 % représente le seuil à ne pas dépasser afin d'éviter les complications. Une récente campagne nationale d'information des patients diabétiques est de leur entourage, intitulée "sous le 7" promulgue d'ailleurs la valeur de 7 % comme objectif de valeur d'HbA1c à ne pas dépasser [21].
Un groupe européen pour le traitement du diabète de type I a défini une stratégie applicable à tous les laboratoires quelles que soient les techniques de dosage utilisées. Il recommande à chaque laboratoire de définir ses propres valeurs de référence à partir d’une population témoin non diabétique, de calculer une valeur moyenne et un écart-type pour évaluer la dispersion des valeurs. Le contrôle glycémique est jugé insuffisant chez les patients présentant des valeurs d’HbA1c supérieures à la moyenne observée + 5 écarts-type [24].