Ministère de l’Enseignement Supérieure et de la Recherche Scientifique
Université 08 Mai 45 Guelma
Faculté des Sciences de la Nature et de la Vie et Sciences de la Terre
et de l’Univers
Département de : Sciences de la Nature et de la Vie
Mémoire de Master
Domaine : Sciences de la Nature et de la Vie
Filière : Biologie
Spécialité : Biologie Moléculaire et Cellulaire
Option : Biologie Moléculaire des Procaryotes
Présenté par :
BOUNAIA Nor Elhouda
CHELBAB Amal
MAIZI Hamza
Devant le jury composé de :
Promoteur : M
meSIRIDI BRAIK. Asma (M.A.A. Univ de Guelma)
Président : M. DJEKOUNE. Mouhamed (M.C.B. Univ de Guelma)
Examinateur : M
elleHAMDI KAN. Malika
(M.A.A. Univ de Guelma)
Juin 2013
Le rôle protecteur des flavonoïdes dans
la préservation du cœur ischémique
Remerciements
Nous exprimons d’abord nos profonds remerciements à Dieu tout puissant, qui
nous a aidés à achever ce modeste travail.
Nous tenons d’abord à exprimer nos profonds remerciements à Mme SERIDI BRAIK ASMA, Maitre assistante à l’université de Guelma, notre encadreur, pour sa
rigueur scientifique et ses encouragements ainsi que pour la confiance qu’elle nous a constamment témoignée. Nous vous adressons nos profondes reconnaissances pour vos remarques et conseils en vue d’améliorer ce manuscrit.
Nous adressons nos remerciements à Mr Djekoune Mohamed, Maitre de
Conférences à l’université de Guelma, d’avoir présidé le jury et à Melle
Hamdikane Malika, Maitre Assistante à l’université de Guelma, d’avoir accepté d’évaluer ce
modeste travail et de nous avoir aidé avec ses conseils, ainsi que pour le temps qu’elle nous a consacrés dans notre étude.
Nous voudrions de tout cœur et vivement remercier tous ceux qui ont contribué de
loin ou de près, d'une façon ou d'une autre à notre formation et à la réalisation de ce travail.
Nos remercions les deux techniciennes de laboratoire de biochimie: RATIBA et
GHANIA pour leur disponibilité et surtout leur patience pendant la réalisation de ce travail.
Dédicace
Avec l
’
aide de dieu tout puissant, qui a tracé le
chemin de ma vie, j
’
ai pu réaliser ce travail que je
dédie à :
La lumière de mes yeux, l
’
ombre de mes pas et le
bonheur de ma vie ma mère Nacira qui ma
apporté son appui durant toutes mes années
d
’
étude, pour son sacrifice et soutien qui m
’
ont
donné confiance, courage et sécurité.
Mon cher père Nour Eddine qui ma appris le sens
de la persévérance tout au long de mes études, pour
son sacrifice, ses conseils et ses encouragements.
Ma très chère sœur Ibtisseme
Mon frère :Housseme Eddine
Toute la famille : Bounaia et djebbar
A mes amis
SOMMAIRE
Liste des abréviations
Liste des figures
Liste des tableaux
Introduction
Partie bibliographique
Chapitre I : préservation d’organe et stress oxydatif
I.1. Transplantation des organes (greffons)……….... 1
I. 2. Solution de préservation………... 1
I.2.1 Historique……….. 1
I. 2. 2. Rôle de la solution de préservation……… 2
I. 2. 3. Composition de la solution de préservation………... 2
A. Impermeants……….. 3
B. Colloïdes ou agents colloïdes……… 3
C. Antioxydants………. 3
D. Electrolytes………... 4
I. 3. L’ischémie – Reperfusion myocardique………... 5
I.3.1 Définition de l’ischémie myocardique………... 5
I.3.2 conséquence de l’ischémie……… 5
I.3.3 Définition de la reperfusion………... 7
I.3.4 conséquence de la reperfusion………... 7
II.2 Origine du stress oxydatif………... 9
II.3. Définition des RL………... 10
II.4. Nature et source des ERO……… 10
II.4.1 Composé oxygéné radical……… 10
II.4.2 Composés oxygénés non radicalaires………... 11
II.5 Les systèmes de défense antioxydants……….. 13
II.5.1 Le système antioxydant enzymatique……….. 13
II.5.2 Le système antioxydant non-enzymatique………... 14
A. Anti-oxydants hydrosolubles………. 14
B. Anti-oxydants liposolubles……… 16
II.6 Oxydation des molécules biologiques………... 16
II .6.1 Oxydation des protéines………... 16
Marqueurs biologiques……….………. 17
II .6.2 Oxydation de l’ADN………... 17
Marqueurs biologiques……..………. 17
II .6.3 Peroxydation lipidique………... 18
Marqueurs biologiques……….………. 18
II.7 Evaluation du stress oxydatif……… 19
II .8 Prévention du stress oxydatif………... 20
Chapitre II : les polyphénols I. Définition des polyphénols………... 21
II.1. Polyphénols monomériques………...……... 22
II.1.1. Les acides phénoliques……….…...……… 22
II.1.2 Les flavonoïdes………. 22
A. Les différentes classes des flavonoïdes……….. 23
II.2. Les polyphénols polymères………..……….. 26
II.2.1 Les Tanins……….………... 26
II.2.2. Les lignanes………... 27
II.2.3. Les stilbènes……….. 27
III. Propriétés des polyphénols……… 28
III.1 propriétés antioxydantes……….………... 28
A. Inhibition enzymatique………... 28
B. Chélation des ions métalliques……… 29
C. Piégeage des radicaux libres………... 29
III.2 propriétés anti- inflammatoires………...….. 30
III.3 propriétés antiallergiques………... 30
III.4 propriétés antivirales et antibiotiques………... 30
Action des polyphénols sur le système cardiovasculaire………...… 31
III.5. propriétés pro-oxydantes………... 31
Chapitre III : propolis Introduction……….. 32
I. Définition et étymologie………... 32
III. Propriétés physicochimiques de la propolis………... 33
IV. Composition de la propolis……… 34
IV.1 Composition de la propolis brute……….. 34
IV.2 Composition de la propolis purifiée………..……… 34
V. La récolte de la propolis………... 34
V.1 La récolte de la propolis par les abeilles………... 35
V.2 La récolte de la propolis par l’apiculteur……….... 35
VI. Utilisation de la propolis………... 35
VI.1. Utilisation de la propolis par les abeilles………... 35
VI.2. Utilisation de la propolis par l’homme………... 35
VII. Propriétés pharmacologiques de la propolis……….... 36
VII.1. Propriétés anti-infectieuse………... 36
A. Activité antibactérienne………. 36
B. Activité antifongique………. 37
C. Activité antiviral……… 37
VII.2. Propriétés anticancéreuses………... 37
VII.3. Propriétés anti-inflammatoires……… 37
VII.4. Propriétés digestives………... 37
VII.5 Propriétés anti-oxydante et anti-radicalaire………... 38
VII.6 Autres propriétés………... 38
Partie expérimentale
Produits spécifiques à l’étude……….. 39
Partie I : Mise en évidence et dosage des flavonoïdes de l’EEP……… 39
I.1. Extraction de la propolis……… 39
I.2. Mise en évidence des flavonoïdes par CCM………... 39
I.2.1 Principe……….. 39
I.2.2 Mode opératoire……… 40
I.3 Dosage des flavonoïdes………... 42
Partie II : Evaluation du statu oxydatif au niveau du tissu cardiaque……… 42
II.1. Animaux et conditions d’hébergement……… 42
II.2. Protocole expérimental……… 43
II.2.1 Sacrifice des animaux et prélèvement du cœur……… 43
II.2.2 Traitement du tissu cardiaque……….. 43
II.2.3 Préparation des homogénats du cœur……….. 44
II.2.4 Dosage tissulaire……….. 44
Mesure du taux du Malondialdéhyde cytosolique (MDA)………. 44
Mesure du glutathion cytosolique (GSH)………... 45
Partie III : Analyse statistique……… 46
Chapitre V : Résultats et discussion
Conclusion et perspective
Références bibliographiques
Résumé
Figure 01 : Représentatif des changements cellulaires liés à l’ischémie reperfusion...07
Figure 02 : Mécanismes de mort cellulaire apoptotique au cours de la reperfusion post- ischémique………...08
Figure 03 : Déséquilibre de la balance entre antioxydants et pro-oxydants………...09
Figure 04 : Origine des différents RL oxygénés et ERO implique en biologie………12
Figure 05 : Représentation simplifiée de la peroxydation lipidique……….…... 18
Figure 06 : Exemple de quelques acides hydroxybenzoïques…………..…………....22
Figure 07 : Structure chimique de l’acide hydroxycinnamique…………...……….... 22
Figure 08 : Structure du noyau flavone et le noyau flavane……….... 23
Figure 09 : Structure chimiques des chalcones et aurones………..……….23
Figure 10 : Structure chimiques des flavanones et flavanonols……….………...24
Figure 11 : Structure chimiques des flavones………...24
Figure 12 : Structure chimiques des Flavonols………...…...………...24
Figure 13 : Structure chimiques des Flavan-3-ols, flavan-3,4-diols………..…...25
Figure 14 : Structure chimiques des isoflavones………...………...25
Figure 15 : Structure chimiques des anthocyanes…………...………..……26
Figure 16 : Structure chimiques des tanins……….…...…………...…26
Figure 17 : Structure chimique des lignines………....….27
Figure 18 : Structure chimique des stilbènes………....27
Figure 19: Les flavonoïdes et leurs sites proposés pour la chélation des ions métallique………..28
Figure 22 : Aspect de la propolis………..…32
Figure 23 : Réaction du Chlorure d’Aluminium avec les flavonoïdes……….42
Figure 24 : Schéma de la réaction entre le TBA et le MDA……….45
Figure 25 : Schéma de réaction entre le DTND et le GSH………...………46
Figure 26 : Chromatogramme représentant le résultat de migration des flavonoïdes révélé par la solution d’AlCl3………...……….48
Figure 27 : Chromatogramme représentant le résultat de migration des flavonoïdes révélé par la lampe U. V………...…….49
Figure 28 : Courbe d’étalonnage de la quercétine par l’AlCl3………..…...50
Figure 29 : Variations des taux du MDA cytosolique au niveau des cœurs préservés………....51
Figure 30 : Variations des taux du glutathion réduit au niveau des cœurs préservés………52
Tableau 01 : La composition de différentes solutions de préservation…………..04 Tableau 02 : Relation entre la fluorescence et la structure des flavonoïdes……..40
Tableau 03 : Concentrations méthanoliques de quercétine de la courbe d’étalonnage………..42
Tableau 04 : Résultats (moyenne ± écartype) représentant la teneur de l’extrait éthanolique de la propolis en flavonoïdes……….51
Liste des abréviations
ADN Acide Désoxyribonucléique
AGPI acides gras polyinsaturés
AMPc Adénosine MonoPhosphate
ARN Acide Ribonucléique
AlCl3 Trichlorure d’aluminium
Ca2+ Ion Calcium
CAPE Ester phenyléthylique de l’acide caféique
CAT Catalases
CCM Chromatographie en couche mince
Cu Cuivre
ERO Espèces Réactives de l’Oxygénées
ERN Espèce réactives d’azote
EC Solution Euro-Collins
Fe2+ Fer libre à l’état ferreux
Fl Flavanoïdes GSH Glutathion GSH-PX Glutathion peroxydase GSH-R Glutathion réductase GSSG Glutathion oxydé H+ Ion Hydrogène
HIV Humane Immunodéficience Virus
H2O2 Peroxyde d’hydrogène
HO Le radical hydroxyle
HOCL Acides hypochloreux
HTK Solution de Bretschneider (ou Custodiol®)
IGL-1 Solution de l’Institut Gustave
LDL lipoprotéine à haute densité
MPO myéloperoxydase
MDA Malondialdéhyde
Mn Le manganèse
NADH nicotinamide adénine dinucléotide hydrogéné
NADPH nicotinamide adénine dinucléotide phosphate hydrogéné ONOO- le peroxynitrite
O2.- Le radical superoxyde
RO2H Hydroperoxydes
ROO Le radical peroxyle
RL Radicaux libres
SOD Superoxyde dismutase
(Se) sélénium
TBA l’acide thiobarbiturique
TBARS substances réagissant avec l’acide thiobarbiturique
UrH•- l’espèce radicalaire stable
Zn Le zinc
1 ∆ gO2 Oxygène singulet
4-HNE 4- hydroxynonenal
8-OHG 8-hydroxy-guanine
Revue
De nos jours, des milliers de personnes figurent dans des listes d’attente pour une greffe d’organe (cœur, fois, rein). Dans ce cas, le greffon doit être conservé dans une solution de préservation qui n’est certes pas l’élément fondamental d’une transplantation, qui repose essentiellement sur le geste chirurgical, mais elle favorise la meilleure reprise de fonction du greffon lors de sa transplantation.
En plus d’être un vecteur de froid, reconnu pour son effet cyto-protecteur, la solution de préservation, grâce à sa constitution (électrolytes, imperméants, colloïdes et antioxydants), contribue au maintien de la qualité et de l’intégrité du greffon (morphologie et biochimie).
Par ailleurs, depuis la phase de prélèvement du greffon du donneur jusqu’à la fin de l’implantation chez le receveur, l’organe sera le foyer d’une ischémie totale qui se définit comme une insuffisance d’apport sanguin tissulaire. Cette étape est à l’origine de nombreux effets délétères observés et étroitement liés au stress oxydatif au niveau cellulaire.
C’est à ce moment là que les antioxydants contenus dans la solution de préservation jouent un rôle crucial afin de protéger les cellules de l’effet délétère des radicaux libre oxydants lors de la phase d’ischémie et de réduire leur surproduction lors de la phase de reperfusion de l’organe transplanté.
Aujourd’hui, de nombreuses études sont établies afin d’améliorer les techniques de conservation ainsi que la composition des solutions de préservation en testant des molécules d’origine végétale telles que les polyphénols reconnus pour leurs propriétés anti-inflammatoire et antioxydantes.
Dans ce contexte, notre étude expérimentale a comme objectif d’améliorer la survie du greffon pendant la phase d’ischémie d’une préservation normo-thermique du cœur. Ce travail s’intéresse à l’étude de l’effet protecteur des flavonoïdes purs et contenus dans l’extrait éthanolique de la propolis, un produit de la ruche pourvu de forte propriété antioxydante, dans la préservation du cœur.
Mise en évidence des flavonoïdes dans l’extrait éthanolique de la propolis, Détermination de la teneur de cet extrait en flavonoïdes.
L’évaluation du statut oxydatif au niveau du tissu cardiaque Le manuscrit est structuré en deux parties.
La première est une synthèse bibliographique initiée par le chapitre de la préservation d’organe et du stress oxydatif, le deuxième chapitre décrit les différentes classes de polyphénols ainsi que leurs propriétés biologiques. Le troisième chapitre consiste en une description de la propolis dont l’extrait est utilisé dans notre étude.
Quand à la deuxième partie, elle est conçue en deux autres chapitres, le premier décrit les méthodes et matériels utilisés pour la réalisation de ce travail. Le deuxième rassemble tous les résultats de notre étude ainsi que leurs interprétations et leur discussion.
Chapitre I :
Préservation d’organe et
Stress oxydatif
1
I. Préservation d’organe
I.1. Transplantation des organes (greffons)
La transplantation d’organe offre l’occasion d’une deuxième vie à des milliers de personnes désespérées ayant perdu la fonction de leurs propres organes. La transplantation solide se résume à ces 4 phases :
- prélèvement du greffon (explantation) et éventuellement arrêt de l’organe, - stockage et transport à froid,
- implantation, - reperfusion.
Dès l’explantation, le greffon est privé de son environnement physiologique et devient alors très sensible. En normothermie (37°C), l’interruption de la vascularisation d’un organe entraîne la nécrose rapide des cellules qui le constituent. L’un des grands principes de la préservation est la réfrigération. En effet, la diminution de la température des tissus entraîne une diminution du métabolisme cellulaire, sans pour autant le stopper (Belzer F-O
et Southard J-H, 1988).
La solution de préservation d’organe intervient afin de protéger l’organe à greffer. L’hypothermie et les composants bien choisis de la solution luttent contre les effets délétères de la privation de sang et diffèrent la mort des cellules (Fornas D, 2001).
I.2. Solution de préservation I.2.1. Historique
Maintenir en vie le plus longtemps possible un organe hors du corps, pendant le temps qui sépare le prélèvement de l’implantation, implique la mise au point de méthodes de conservation.
F.O. Belzer s’intéresse tout d’abord à la préservation du rein et développe un appareil de perfusion artificielle d’organe. Les solutions réfrigérantes apparaissent par la suite. De plus l’intérêt de la transplantation s’étend aux autres organes abdominaux (foie, pancréas, intestin) et à la sphère thoracique (cœur, poumon) (Belzer F-O, Southard J-H, 1988).
Les premiers organes sont préservés dans du plasma supplémenté en diverses substances, à froid et oxygéné. Puis apparaissent de véritables solutions formulées pour la préservation statique d’organe. Elles constituent un vecteur pour le froid et apportent des
2
substances capables de lutter contre les mécanismes biologiques naturels de dégradation dans lesquels se trouve l’organe prélevé.
Les conditions nécessaires à la survie des cellules se précisent et le métabolisme spécifique de chaque organe est considéré.
I.2.2. Rôle de la solution de préservation
La solution contribue ainsi, grâce à ses propriétés, au maintien de la qualité et de l’intégrité du greffon (morphologie et biochimie). Surtout elle maintient sa viabilité ex
vivo :
• Lors de la phase de prélèvement, le greffon va être perfusé par la solution de préservation afin de le rincer et le débarrasser du sang du donneur (solution de rinçage). L’organe est refroidi suite à la perfusion hypothermique réalisée ex vivo ou in situ selon qu’il s’agit d’un prélèvement sur donneur vivant ou cadavérique. Le lavage sert également à équilibrer l’organe avec les composants de la solution.
• La période, depuis le début de l’explantation chez le donneur jusqu’à la fin de l’implantation chez le receveur, est critique : c’est la durée d’ischémie totale (voir section III). Cette étape est à l’origine des nombreux effets délétères observés. A ce moment là, la solution de préservation a un rôle réel de protection du greffon pendant le transport (solution de stockage). La qualité de la conservation à froid (~4°C) conditionnera la réussite de la reperfusion après l’implantation (Fornas D, 2001).
Le temps acceptable pour assurer la reprise de fonction ultérieure du greffon varie d’un organe à l’autre. Par exemple, il est d’environ 4-5 heures pour le cœur (Garlicki M et al,
1999 ; Mühlbacher F et al, 1999).
• La reperfusion, c’est-à-dire la revascularisation de l’organe est réalisée soit par un
mélange de sang du receveur et de cristalloïde (sels minéraux, glucose), soit par du sérum
physiologique, soit en partie par la solution de préservation. Elle permet d’éliminer les catabolites toxiques.
I.2.3. Composition de la solution de préservation A. Imperméants
ils sont soit des sucres (raffinose, sucrose, mannitol, glucose) qui limitent par la pression osmotique qu’ils exercent dans le compartiment vasculaire, la formation de l’œdème intracellulaire (leur efficacité étant proportionnelle à l’importance de leur
3
poids moléculaire); soit des anions tels que le citrate, le gluconate ou l’acide lactobionique qui présentent également un effet protecteur de membrane. Glucose, raffinose, lactobionate, mannitol (Fornas D, 2001 ; Emilie M, 2009).
B. Colloïdes ou agents colloïdes
les colloïdes tels que l’hydroxyéthyl starch (HES), le polyéthylène glycol (PEG), l’albumine, le dextran ne peuvent pas passer la membrane cellulaire et préviennent la constitution d’un œdème interstitiel par la pression oncotique qu’ils exercent au niveau de l’espace intra vasculaire. Leur utilisation semble particulièrement bénéfique pour des temps d’ischémie long (Emilie M, 2009).
C. Antioxydants
La source des RL est essentiellement intracellulaire. Cependant on constate la présence de radicaux dans le milieu extracellulaire, produits sur place (polynucléaires neutrophiles) ou provenant du milieu intracellulaire après diffusion (Myers C-L et al, 1986).
Le site d’action des antioxydants pourra donc être intra et/ou extracellulaire selon leur nature.
Les antioxydants peuvent s’attaquer aux précurseurs des RL, directement aux RL ou aux mécanismes de formation des RL. Ils sont représentés par :
c. 1. Les piégeurs enzymatiques : superoxyde dismutase, catalase, glutathion peroxydase, devraient exercer leur action dans le milieu intracellulaire. Cependant, un apport exogène sera efficace même si leur taille moléculaire est trop importante pour traverser la membrane. Ils s’attaqueront aux radicaux présents dans le milieu extracellulaire au niveau de l’endothélium (Fornas D, 2001).
c. 2. Les antioxydants de faible poids moléculaire : vitamine E, qui grâce à son caractère lipophile, intervient au niveau de la membrane et interrompt le processus de peroxydation. c. 3. Les antioxydants de faible poids moléculaire et porteurs d’un groupement thiol : glutathion forme réduite, N-acétylcystéine (précurseur du GSH), diéthyldithiocarbamate. Ils sont capables de capter un électron libre non apparié grâce au groupement thiol (Emilie
M, 2009).
c. 4. Les chélateurs de métal (fer) : déféroxamine, lactobionate. Le fer est couplé et ne participe plus à la formation de l’ion superoxyde.
4
c. 5. Les lazaroïdes : 21-aminosteroïds, qui luttent contre la lipoperoxydation.
c. 6. Les autres : allopurinol (inhibiteur compétitif de la xanthine-oxydase), oxypurinol (inhibiteur de la xanthine oxydase) mannitol (trappeur du radical hydroxyle, pouvoir osmolaire à considérer), histidine (trappeur de l’oxygène singulet), diméthylsulfoxide (trappeur du radical hydroxyle), précurseur de l’oxyde nitrique (piégeur de l’anion superoxyde).
D. Electrolytes
(KCl, NaCl) Il est admis que les solutions de conservation devraient être hyper potassiques comme le milieu intracellulaire, permettant de limiter l’entrée d’eau et de sodium dans la cellule (Fornas D, 2001).
Tableaux 01: la composition de différentes solutions de préservation. (René F, Benhabbouche S, 2011).
EC : Solution Euro-Collins, UW : Solution Université Wisconsin (ou Viaspan), HTK : Solution de Bretschneider (ou Custodiol), IGL-1 : Solution de l’Institut Gustave.
En plus de son rôle de vecteur de l’hypothermie, la solution de préservation doit, plus précisément prévenir ou limiter les effets suivants :
5
- le gonflement cellulaire et l’œdème, - l’accumulation intracellulaire de calcium, - la perte en substrat énergétique,
- l’acidose intracellulaire, - les lésions oxydatives, et
- l’inflammation tissulaire consécutive.
En comprenant mieux le mécanisme des lésions d’ischémie-reperfusion, ci-après détaillées, le principe de formulation d’une solution de préservation d’organe pour la conservation hypothermique statique, se clarifie.
I.3. L’ischémie – Reperfusion myocardique I.3.1. Définition de l’ischémie myocardique
L’ischémie peut se définir comme une insuffisance d’apport sanguin tissulaire, avec perte de trois fonctions importantes du flux sanguin: apport de nutriments, oxygénation et élimination des déchets (Fornas D, 2001).
En clinique, elle résulte, le plus souvent, de coronaropathies qui sont généralement de nature obstructive (thrombose, athérome...), mais aussi de spasmes artériels ou d’une réponse inadaptée à un besoin accru en oxygène (effort physique, par exemple).
Les conséquences de l'ischémie dépendent de sa durée, de sa localisation, du développement du réseau coronaire, mais surtout de sa sévérité (présence ou non d'un débit résiduel et valeur de ce débit).
I.3.2. Conséquences de l’ischémie
Le maintien de conditions d’ischémie sévère sur un tissu comme le myocarde dont le métabolisme requiert un apport important et permanent en substrats à catabolisme oxydatif aura des conséquences considérables sur les différentes fonctions cellulaires. De telles situations entraînent rapidement des altérations biochimiques, fonctionnelles et structurales Sans reperfusion, les lésions ischémiques vont en effet évoluer progressivement vers la mort cellulaire (Andry R, 2008).
6
A. Production d’ERO pendant l’ischémie
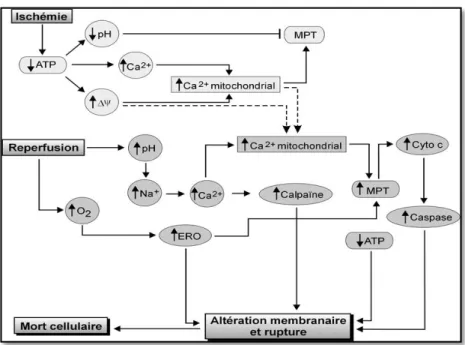
La mitochondrie est une source importante de production d’ERO. Pendant l’ischémie le fonctionnement mitochondrial est ralenti et l’activité des deux principaux sites de production d’ERO (complexes I et III) est affaiblie, ce qui laisse supposer que la production d’ERO diminue pendant l’ischémie (Figure 1).
B. Déséquilibre ionique, acidose et augmentation du calcium intracellulaire
Pendant l’ischémie, la production de l’ATP diminue. Par conséquent, la glycolyse anaérobique est activée. Le bilan de cette activation est le suivant :
Glucose 2 lactate + H⁺ + énergie
Le lactate produit dans la cellule est ensuite transféré dans le milieu extracellulaire. Les ions H⁺ produits dans cette réaction, et résultant de l’hydrolyse de l’ATP, sont responsables d’une baisse du pH intracellulaire, par conséquent, il se produit un phénomène d’« acidose », qui s’installe dans les 10 premières minutes de l’ischémie.
L’augmentation de la concentration des ions H⁺ induit une activation de la pompe Na⁺/H⁺ dans le sens d’expulsion de protons, ce qui a pour conséquence l’augmentation de la concentration intracellulaire des ions Na⁺. Pour compenser cette hausse en sodium, l’échange Na⁺/Ca²⁺ est activé dans le sens d’expulsion de Na⁺, ce qui est responsable d’une augmentation de la concentration calcique cytosolique et donc, de la hausse de la concentration du calcium intra-mitochondrial (Figure 1) (Baidi Z, 2006).
C. Gonflement cellulaire
Les troubles ioniques non compensés entraînent une perte de la polarité membranaire, un gonflement cellulaire par entrée d’eau et une désorganisation du cytosquelette. Des lésions cellulaires irréversibles, essentiellement par nécrose, peuvent alors apparaître (Figure 1) (Cour M et Argaud L, 2010).
D. Lésions irréversibles
Si la perfusion n’est pas rétablie dans les 30-45 minutes après le début de l’ischémie, l’accumulation des catabolites, ions calciques et radicaux libres provoquent un œdème cellulaire et la rupture de la membrane cytoplasmique des cardiomyocytes. Leur nécrose se caractérise alors par la disparition des noyaux et l’élimination du cytoplasme. La nécrose des cellules composant le tissu cardiaque se propage de l’endocarde vers l’épicarde et du
7
centre de la zone ischémie vers la périphérie (Fornas D, 2001). Les lésions touchent également les cellules nerveuses et les cellules vasculaires (Figure 1).
Figure 1 : Schéma représentatif des changements cellulaires liées à l’ischémie reperfusion. I.3.3. Définition de la reperfusion
Il est clairement établi que les cardiomyocytes ne peuvent survivre dans des conditions d’ischémie sévère prolongée. A l’heure actuelle, la reperfusion coronaire est reconnue comme étant la seule méthode permettant de réduire la taille de l’infarctus, la reperfusion précoce est possible grâce au développement de la thrombolyse et de l’angioplastie. Cette reperfusion permet la récupération du myocarde tant qu’il n’y a pas eu de lésions irréversibles (Grégory M, 2010).
I.3.4. Conséquences de la reperfusion
La reperfusion est une « épée à double tranchant » la restauration d’un flux sanguin provoque des lésions propres (Figure 1).
A. Production excessive de radicaux libres
La reperfusion réintroduit brutalement de l’oxygène en grande quantité dans les cellules qui en étaient privées. La chaîne respiratoire mitochondriale, fonctionnellement endommagée par l’ischémie, ne peut pas utiliser correctement cet excès d’oxygène et de substrats. Au lieu de synthétiser de l’ATP, la mitochondrie produit des espèces radicalaires de l’oxygène.
8
Par ailleurs, la réactivation des pompes ioniques corrige très rapidement l’acidose, mais au prix d’une surcharge sodique puis calcique potentiellement très délétère pour la cellule. En effet, l’excès de calcium provoque l’activation de nombreuses enzymes (protéases, lipases, NO synthases, déshydrogénases,...) qui conduisent directement ou indirectement à une production accrue de radicaux libres. De plus, l’hypoxanthine, produit de dégradation de l’ATP, induit également à la reperfusion, une surproduction de radicaux libres (Figure 1).
B. Peroxydation lipidique et inflammation
Cet excès de radicaux libres a des effets délétères pour le fonctionnement cellulaire. Il conduit en particulier, par peroxydation lipidique, à des lésions des membranes cellulaires (dont la membrane mitochondriale), mais aussi à une activation indirecte de l’inflammation en recrutant les leucocytes et en stimulant la production de cytokines. (Figure 1) (Cour M
et Argaud L, 2010). C. Apoptose
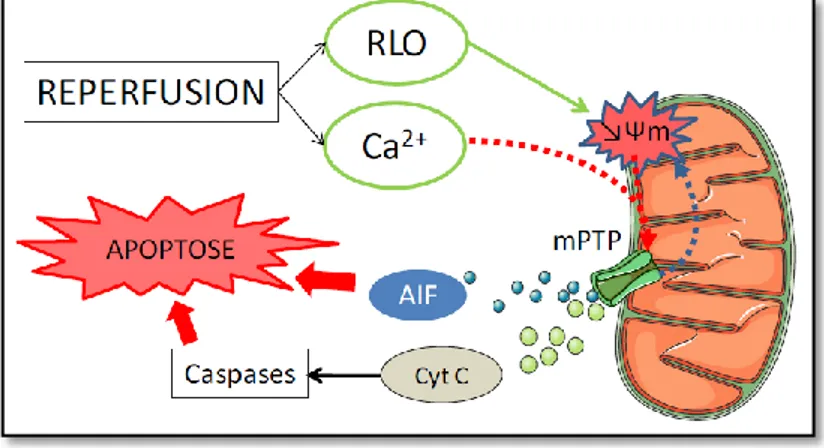
Le redémarrage de la machinerie intracellulaire contemporain de la reperfusion va conduire un certain nombre de cellules irrémédiablement lésées par l’ischémie vers la mort cellulaire par l’activation des voies de signalisation de l’apoptose (ou « mort cellulaire programmée ») qui est un phénomène actif et consommateur d’énergie (Figure 2)
(Grégory M, 2010; Cour M et Argaud L, 2010).
RLO : radicaux libres oxygénés ; mPTP : pore de transition de perméabilité mitochondriale ; AIF : Apoptosis Inducing Factor ; Cyt : cytochrome C.
Figure 2 : Mécanismes de mort cellulaire apoptotique au cours de la reperfusion
9
II. Stress oxydatif
II.1. Définition de stress oxydatif
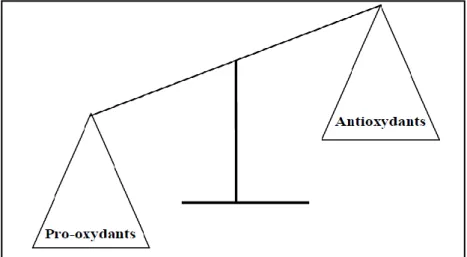
Le stress oxydatif correspond a une perturbation du statut oxydatif intracellulaire il se définit comme étant un déséquilibre de la balance oxydants/antioxydants en faveur des oxydants, avec comme conséquence l’apparition de dégâts souvent irréversible pour la cellule (Figure 03).
Il se développe lorsque les radicaux libres (molécules oxydantes) sont produits plus rapidement qu'ils ne peuvent être neutralisés par les systèmes de défense antioxydant
(Sabeur T, 2010).
Figure 03 : Déséquilibre de la balance entre anti-oxydants et pro-oxydants (Madièye G, 2007).
II.2. Origine du stress oxydatif
Dans notre organisme, le stress oxydatif peut provenir soit :
- D’une production endogène massive des R.L par activation de macrophage, des cellules endothéliales et de la mitochondrie, ou par une exposition a des générateurs environnementaux des R.L (soleil, radioactivité, tabagisme, pollution atmosphérique, consommation excessive d’alcool, etc.)
- D’une défaillance du système antioxydant provoquée, d’une part, par un affaiblissement des défenses enzymatique du a une carence en cofacteur oligoélément ou a une anomalie génétique ou acquise touchant leurs gènes correspondant. D’une autre part, cette déficience antioxydante peut aussi être causée par une carence en molécules non-enzymatiques antioxydantes apportées par la nutrition (Favier A, 2003).
10
II.3. Définition des R.L
Les radicaux libres sont des espèces chimiques (atomes ou molécules) qui possèdent un ou plusieurs électrons célibataires (électron non apparié) sur leur couche externe et capable d’existence indépendante. Ils peuvent être dérivés de l’oxygène (espèces réactives de l’oxygène ERO) ou de l’azote (espèce réactives d’azote ERN). La présence d’un électron célibataire confère aux radicaux libres une grande réactivité et ils peuvent être aussi bien des espèces oxydantes que réductrices. Cependant à cause de leur structure particulière, ils ont tendance à attirer les électrons d’autres atomes et molécules pour gagner leur stabilité
(Kabouche S, 2010).
Malgré, les effets délétères de ces radicaux libres, ils sont aussi indispensables à la vie. Ils remplissent en effet de très nombreuses fonctions utiles qui, à part la phagocytose, ont été découvertes récemment. Les radicaux libres participent au fonctionnement de certaines enzymes, à la transduction des signaux cellulaires la défense immunitaire contre les agents pathogènes, à la destruction par apoptose des cellules tumorales, à la différentiation cellulaires et à la régulation des gènes ( Araar I et al, 2007).
II.4. Nature et source des ERO
II.4.1 Composé oxygéné radicalaire A. L’anion superoxyde (O2•-)
L’anion superoxyde est une ERO primaire, formée par l'acquisition d’un électron par l’oxygène moléculaire. Radical ayant la réactivité la plus faible parmi les radicaux libres du stress oxydant. Il est cependant hautement réactif avec certains métaux de transition comme le cuivre, le fer et le manganèse.
Le radical superoxyde ne traverse pas rapidement la membrane plasmique et se dismute spontanément au pH physiologique en produisant du peroxyde d’hydrogène (Loïc L,
2011).
2 O2•-+ 2 H+ O2 + H2O2
Plusieurs sources de radical superoxyde peuvent être répertoriées in vivo. Il s’agit de réactions enzymatiques, de réactions d’auto-oxydation, de protéines héminiques, des mitochondries, du réticulum endoplasmique et du noyau de la cellule (Delattre et al,
11
B. Radical Hydroxyle (.OH)
Le radical hydroxyle peut être induit par la réduction de L’H2O2 selon la réaction
d’Haber-Weiss engendrant alors un ion OH inoffensif et un radical hydroxyle HO.
H2 O2 + O2 - HO + O2 + HO
Cette réaction est lente et probablement inopérante dans les tissus vivants. Mais en
revanche, en présence de métaux de transition (fer, cuivre), l’ H2O2 donne naissance in vivo
via la réaction de Fenton à un radical hydroxyle HO hautement réactif (Goldstein et al,
1994).
H2O2+Fe+2 OH-+OH + Fe+3
Le radical hydroxyle à une demi-vie extrêmement courte et une capacité à diffuser restreinte, il est capable de réagir très rapidement avec la plupart des molécules biologiques comme l’ADN, les protéines, les sucres et les lipides membranaire. Parmi les ERO le radical hydroxyle est de loin le plus réactif. (Kabouche S, 2010).
II.4.2 Composés oxygénés non radicalaires A. Peroxyde d’hydrogène (H2O2)
C’est un composé relativement peut réactif en l’absence de métaux de transition. Il peut
être produit selon deux grandes voies : l’action d’oxydases et la dismutation du radical O2.-
L’action des oxydases (acides aminés oxydases, glycolate oxydase, urate oxydase….) a lieu dans les organites cellulaires bien individualisés, les peroxysomes ; dans ces conditions, le peroxyde d’hydrogène ainsi produit reste localisé.
En revanche, la dismutation d’O2.- est très ubiquitaires, cette réaction est une réduction
du O2.- et est extrêmement lente et doit être catalysée (in vivo) par une enzyme, le
superoxyde dismutase (SOD), selon la réaction : (Delattre et al, 2003).
2 O2.-
SOD
H2O2 + O2
B. Acides hypochloreux (HOCl)
Comme le peroxyde d’hydrogène, l’acide hypochloreux ne rentre pas dans la définition stricte du radical. Cependant, au cours de l’inflammation, la métabolisation du peroxyde d’hydrogène en acide hypochloreux par l’enzyme myéloperoxydase (MPO) est élevée et l’acide hypochloreux est un agent chlorant et oxydant fort.
12
L’acide hypochloreux est considéré comme 100 à 1000 fois plus toxique que le radical superoxyde ou le peroxyde d’hydrogène et a des cibles bien marquées : inactivation enzymatique, oxydation des groupements thiols de la membrane plasmique, diminution des propriétés d’adhésion de certains composés de la matrice extracellulaire (Loïc L, 2011).
C. Oxygène singulet (1 ∆ gO2)
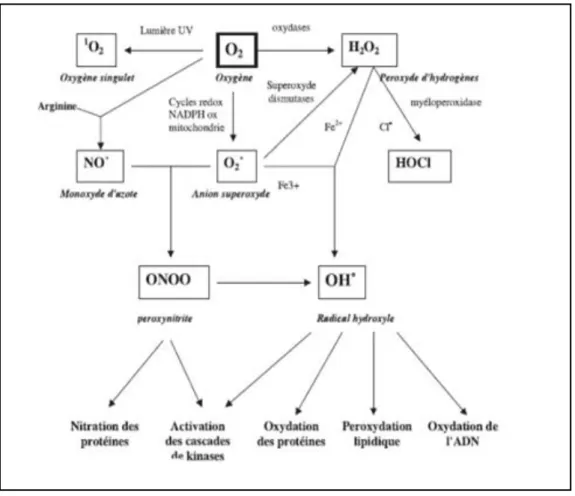
Forme excitée de l’oxygène moléculaire, est souvent assimilée à un radical libre en raison de sa forte réactivité (figure 04).
Figure 04 : Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène
implique en biologie (Favier A, 2003).
Le radical superoxyde O2•-, le peroxyde d’hydrogène H2O2 et le radical hydroxyle HO•
sont encore appelés espèce réactive de l’oxygène (ERO) car, ces espèces sont beaucoup plus réactives que l’oxygène qui leur a donné naissance. Toutefois, il existe d’autres ERO
tels que les radicaux peroxyles ROO hydroperoxydes RO2H ainsi que les radicaux alkoxyle
RO, et des espèces réactives d’azote (ERN) tels que le NO, produit par le NO synthétase,
qui est un vasodilatateur physiologique et le peroxynitrite ONOO- issu de la réaction entre
13
II.5. Les systèmes de défense antioxydants
La production excessive ou incontrôlée d’espèces oxydantes induit une perturbation du statut redox pouvant induire de sérieuses altérations des structures cellulaires. Il est donc absolument nécessaire que cette production d’EROs soit contrôlée. Pour cela, les cellules disposent de systèmes de défenses antioxydantes classées en antioxydants enzymatiques ou non-enzymatiques.
Les composés antioxydants sont définis comme « toutes substances qui, présentes à faible concentration par rapport à celle du substrat oxydable, retardent ou inhibent significativement l’oxydation de ce substrat » (Halliwell B, 1990).
Parmi ces composés, les systèmes de défense enzymatiques sont reconnus comme étant les plus performants (Loïc L, 2011).
II.5.1. Le système antioxydant enzymatique A. Superoxyde dismutases (SOD)
Cette enzyme assure l’élimination de l’anion superoxyde, première espèce toxique formée à partir de l’oxygène. Elle assure, ainsi, la première ligne de défense contre le stress oxydant.
Le mécanisme réactionnel est catalysé par un métal (Mn, Cu, Fe) situé au cœur de l’enzyme dont la nature distinguera les déférentes superoxyde-dismutases, (Mn-SOD, Cu-SOD, Fe-SOD) (Kebieche M, 2009).
B. Les catalases
Parmi les enzymes antioxydantes connues, la catalase est une des plus efficaces. Cette
oxydase convertit le H2O2 en eau et oxygène. Elle est présente particulièrement dans le foie
et les globules rouges. Cependant, du fait de sa localisation essentiellement au niveau des peroxysomes, elle est peu abondante dans le myocarde. Cette compartimentation réduit considérablement ses capacités d’élimination du peroxyde d’hydrogène du cytosol et des mitochondries cardiaques (Andry R, 2008).
C. Glutathion peroxydase (GSH-PX) et réductase (GSH-R)
La Glutathion peroxydase et réductase sont des sélénoenzymes présentent dans le sang,
les membranes et le cytosol. En présence de glutathion réduit (GSH), la réduit l’H2O2 en
14
2 H2O2 + 2 GSH
GPx (Se)
GSSG + 2H2O
ROOH + 2 GSH GPx (Se) ROH + H2O + GSSG
L’efficacité de la GPx est liée à un flux constant de GSH, et elle est couplée à
l’oxydation du glucose-6 phosphate en 6-phospho gluconate, source de NADPH2 qui est
utilisé comme cofacteur par la glutathion réductase (GRase) pour régénérer le GSH:
(Benaraba R, 2007).
GSSG + NADPH-H+ GRase 2GSH + NADP+
II.5.2. Le système antioxydant non-enzymatique
Ces systèmes comportent des composés synthétisés in vivo (la bilirubine, les hormones sexuelles (œstrogènes), la mélatonine, l’acide lipoïque, le coenzyme Q, l’acide urique, les mélanines,…) et des composés apportés par l’alimentation, comme la vitamine C, la vitamine E, les caroténoïdes ou les polyphénols.
Il est également possible de classer ces systèmes non enzymatiques selon qu’ils ont hydrosoluble, assurant une protection des milieux intra- et extracellulaires, ou liposolubles, agissant alors au niveau des membranes et des lipoprotéines circulant dans le sang
(Delattre et al, 2003).
A. Anti-oxydants hydrosolubles
l’Acide ascorbique
La vitamine C(ou acide ascorbique) n’est pas synthétisée par l’organisme. La vitamine C empêche l’oxydation des LDL produites par divers systèmes générateurs d’ERO (neutrophiles actives, cellules endothéliales activées, myeloperoxydase).Lors de son oxydation en acide dehydroascorbique, elle passe par une forme radicalaire intermédiaire (radical ascorbyl) qui joue un rôle essentiel dans la régénération de la vitamine E oxydée
(Anisio F, 2005).
Le glutathion réduit
Le glutathion ou L-γ-glutamyl-L-cystéinylglycine est un tripeptide dont les propriétés réductrices et nucléophiles jouent un rôle majeur dans la protection contre les altérations oxydantes des lipides, des protéines et des acides nucléiques. En situation de stress oxydatif, son rôle protecteur et détoxifiant résulte principalement de sa fonction de
15
cosubstrat des GPx et des GSH-S-transférases. Mais il fait aussi l’objet d’interactions synergiques avec d’autres composants du système de protection antioxydante tels que la vitamine C, la vitamine E et les superoxydes dismutases (Caroline J, 2003).
L’acide Urique
L’acide urique est produit par oxydation de l’hypoxanthine et de la xanthine par la xanthine oxydase et la xanthine déshydrogénase. Au pH physiologique, il est majoritairement présent sous la forme ionisée (urate) pouvant interagir avec les radicaux
hydroxyles et conduisant à la formation de l’espèce radicalaire UrH•
stable. Celle-ci est à son tour réduite par l’ascorbate régénérant l’urate. L’urate protège les protéines de la nitration en réagissant avec le peroxynitrite. Il peut également chélater les ions métalliques et donner des chélates peu réactifs sur le plan catalytique (Loïc L ,2011).
Les oligoéléments
Le cuivre (Cu), le zinc (Zn), le manganèse (Mn), le sélénium (Se) et le fer (Fe) sont des métaux essentiels dans la défense contre le stress oxydatif. Toutes les enzymes antioxydantes requièrent un cofacteur pour maintenir leur activité catalytique. Cependant, certains oligoéléments, notamment le fer, lorsqu'ils sont en excès dans l'organisme et sous leur forme réduite, peuvent avoir une action prooxydante (réaction de Fenton, d'Haber-Weiss) (Favier A, 2003).
Les polyphénols
Les polyphénols végétaux regroupent une grande variété de composés comprenant entre autres les flavonoïdes, les anthocyanes et les tanins. Ce sont des composés ubiquistes que l’on retrouve dans les plantes. Ils sont pourvus de propriétés antioxydantes. En effet, ils sont capables de piéger des radicaux libres, d’inhiber la peroxydation lipidique en réduisant les radicaux hydroxyles, superoxydes et peroxyles. Ils sont aussi capables de piéger les ions métalliques, car ils ont des propriétés chélatrices (Kabouche S, 2010).
B. Anti – oxydants liposolubles
La vitamine E
Est un antioxydant important qui protège les cellules contre les dommages associes aux radicaux libres et par conséquent, prolonge la vie cellulaire tout en ralentissant le processus de vieillissement et la diminution de l’athérosclérose. La vitamine E est rencontrée surtout
16
dans les huiles végétales, les noix et les germes de diverses graines (Mouhammedi Z,
2006).
β carotène
Le β Carotène est apporté par I’ alimentation .Il est doué de plusieurs capacités : précureur de la vitamine A, capte l’oxygène singulet sous faible pression d’oxygène et, avec les autres caroténoïdes, a le pouvoir de terminer les réactions en chaîne de lipoperoxydation. Il protège les structures cellulaires contre l’agression oxydante
(Kabouche, 2010).
L’ubiquinol 10
L’ubiquinol (forme réduite du coenzyme Q) contenu dans les LDL (low density lipoprotein) joue un rôle important dans leur résistance à l’oxydation. Cependant son rôle en tant qu’antioxydant peut être discuté dans la mesure où le coenzyme Q peut être à l’origine de la production d’anion superoxyde dans la chaîne respiratoire mitochondriale
(Loïc L, 2011).
II.6. Oxydation des molécules biologiques et ses marqueurs II.6.1. Oxydation des protéines
Les modifications oxydatives des protéines par les ERO provoquent l’introduction d’un groupement carbonyle dans la protéine. Ces réactions d’oxydation sont fréquemment
influencées par les cations métalliques comme le Fe++ ou le Cu++. Les réactions
d’oxydation de protéines peuvent être classées en deux catégories: d’une part, celles qui cassent les liaisons peptidiques et modifient la chaîne peptidique, et d’autre part, les modifications des peptides par addition de produits issus de la peroxydation lipidique comme le 4-HNE. De telles modifications conduisent généralement à une perte de fonction catalytique ou structurale des protéines affectées et deviennent généralement plus sensibles à l’action des protéases et sont donc éliminées. L’oxydation de la cystéine est réversible mais peut également perturber les fonctions biologiques du GSH ou de certaines protéines. Le rôle des protéines dans la cellule est tel que leur, dysfonctionnement peut bouleverser le fonctionnement cellulaire (enzymes, protéines structurales) (Kabouche S, 2010).
Marqueurs biologiques
L’oxydation des protéines et des chaines latérales de certains acides aminés peut donner naissance à des composés carbonylés ou dicarbonylés qui sont dosés par
17
spectrométrie. Cette méthode, essentiellement utilisée sur des prélèvements cellulaires et tissulaires, est applicable au plasma. Cependant, elle est délicate à mettre en œuvre et requiert des quantités importantes de protéines. Récemment, l’utilisation d’une méthode immunoenzymatique a permis d’augmenter la sensibilité (Sekli B-F, 2011).
II.6.2. Oxydation de l’ADN
Les ADN nucléaire et mitochondrial sont également des cibles des EROs. Les altérations de la molécule d’ADN peuvent conduire soit à l’arrêt de l’induction de la transcription ou de la transduction des voies de signalisation, soit à des erreurs de réplication, soit à une instabilité génomique et l’ensemble est associé au phénomène de carcinogenèse. Une des altérations fréquentes de l’ADN est l’oxydation de la guanine par le radical hydroxyle formant la 8-hydroxy-guanine (8-OHG).Les ERAs peuvent également induire des oxydations de l’ADN et le monoxyde d’azote ou le peroxynitrite peuvent oxyder la chromatine. De plus, le peroxynitrite peut induire la formation de 8- nitroguanine .Comme pour les autres composés, la majorité des altérations oxydatives de l’ADN sont induites par le radical hydroxyle. Lorsque le peroxyde d’hydrogène échappe aux enzymes de régulation, il gagne le noyau de la cellule et réagit avec les ions Fe2+ et Cu+ associés à la chromatine produisant ainsi in situ le radical hydroxyle qui attaque l’ADN proche (Loïc
L, 2011).
Marqueurs biologiques
Le plus largement utilisé est la détection de bases modifiées. Les quatre bases d’ADN peuvent être endommagées par l’attaque des radicaux libres mais la plus étudiée est la 8 hydroxy- 2’-désoxyguanosine (8-OHdG) qui est formée à partir de l’attaque des radicaux hydroxyles sur la désoxyguanosine. Un large panel de techniques est employé pour détecter et quantifier la 8-OHdG, dont l’HPLC qui est la plus fréquente. Les acides nucléiques oxydés peuvent être détectés dans l’ADN des cellules sanguines et aussi dans les urines. En effet, l’excrétion urinaire de 8-OHdG a été rapportée chez des personnes diabétiques (Favier A, 2003).
II.6.3. Peroxydation lipidique
Les acides gras polyinsaturés ainsi que les phospholipides membranaires sont les cibles privilégiées des attaques oxydatives. Les membranes sont plus particulièrement visées par le radical hydroxyle capable d'arracher un atome d'hydrogène sur les carbones situés entre deux doubles liaisons pour former un radical diène conjugué, oxydé en radical peroxyle.
18
Cette réaction de peroxydation lipidique forme une réaction en chaîne car le radical peroxyle formé se transforme en peroxyde au contact d'un autre acide gras qui forme un nouveau radical diène conjugué. Ce processus génère des hydroperoxydes qui peuvent continuer à s'oxyder et à se fragmenter en aldéhydes et en alcanes (éthane, éthylène, pentane). Le radical peroxyle peut, quant à lui, libérer différents aldéhydes toxiques dont le malondialdéhyde (MDA) ou l'hydroxynonénal (Figure 05).
Ainsi un unique évènement oxydatif peut altérer de nombreuses molécules lipidiques et induire une accumulation d'hydroperoxydes dans les membranes ce qui réduira leur fluidité ainsi que l’activité des protéines transmembranaires (Loïc L, 2011).
D. Marqueurs biologiques
Le malondialdéhyde (MDA) est un produit terminal de la peroxydation lipidique. La réactivité du MDA avec l’acide thiobarbiturique (TBA) reste un test classique de dépistage de la peroxydation lipidique encore très utilisé. Si cette méthode relativement simple présente une très bonne sensibilité, elle manque de spécificité en raison de la présence d’interférents. Très récemment, de nouveaux marqueurs stables et spécifiques de la peroxydation lipidique ont été proposés, les F2-isoprostanes, qui sont formés lors de l’attaque de l’acide arachidonique par les ERO. La détermination de ces produits dans le sang et les urines impose l’utilisation de techniques complexes, comme la chromatographie en phase gazeuse couplée à la spectrométrie de masse (Sekli B-F, 2011).
19
II.7. Evaluation du stress oxydatif
Le stress oxydatif est impliqué dans les processus de vieillissement et dans de nombreuses pathologies. Ainsi, de nombreuses techniques ont été développées pour l’évaluer. Le problème de disposer de marqueurs spécifiques, sensibles, fiables et d’exécution analytique aisée, ainsi que le manque de standardisation et d’optimisation des méthodes, compliquent l’interprétation des résultats. Dans ces conditions, il conviendra, pour identifier un stress oxydant, de choisir des marqueurs adaptés au phénomène à étudier et à sa localisation (marqueurs d’oxydation lipidique pour une agression extracellulaire, ou marqueur d’oxydation de l’ADN pour une irradiation attaquant le noyau cellulaire). De plus, une combinaison d’au moins deux marqueurs différents est souvent indiquée pour pallier l’absence d’un marqueur idéal.
Le stress oxydatif peut être évalué par trois grandes voies d’approches (Bonnefont R
et al, 2003 ; Favier A, 2003).
- la mesure de la production des ERO
- la mesure des capacités de défense (statut anti-oxydatif)
- la mesure des désordres biochimiques spécifiques créés par l’attaque des radicaux libres sur les principales cibles moléculaires (protéines, lipides et acides nucléiques) (Madièye
G, 2007).
II.8. Prévention du stress oxydatif
Afin de contrer les effets néfastes des ERO, notre organisme possède des molécules à activité antioxydante de nature enzymatique ou non enzymatique. Ces molécules interviennent sur trois lignes de défense : la prévention constitutive, la détoxification active suite à un stress oxydatif et la détoxification passive.
La prévention constitutive constitue la première ligne de défense et prévient la surproduction des ERO par inactivation de molécules endogènes telles que le fer bivalent et le cuivre monovalent. Elle est constituée d’enzymes et de protéines chélatantes : La ferroxydase, La transférrine, L’hémosidérine, L’albumine.
La détoxification active suite à un stress oxydatif constitue la deuxième ligne de défense au moyen principalement de trois enzymes ayant une activité complémentaire sur la cascade radicalaire au niveau du radical superoxyde et du peroxyde d’hydrogène, conduisant finalement à la formation d’eau et d’oxygène moléculaire. Les molécules
20
impliquées sont notamment les superoxydes dismutases (SOD), la catalase, et les glutathion peroxydase et réductase.
La détoxification passive ou dernière ligne de défense permet de réduire les ERO qui ont réussi à franchir les deux premières barrières. On y retrouve les molécules antioxydantes telles que le béta-carotène, l’acide L-ascorbique, l’alpha-tocophérol et les antioxydants d’origine exogène tels que les polyphénols. (Tabart J, 2011).
Dans le chapitre suivant, nous étalerons plus de détails concernant les propriétés antioxydantes des polyphénols.
Chapitre II :
Les polyphénols
21
Une des originalités majeures des végétaux réside dans leur capacité à produire des substances naturelles très diversifiées. En effet, à coté des métabolites primaires classiques (glucides, protides et lipides), les végétaux accumulent fréquemment des métabolites dits « secondaires » dont la fonction physiologique n’est pas toujours évidente mais qui représente une source importante de molécules utilisables par l’homme dans des domaines aussi différents que la pharmacologie ou l’agroalimentaire. Les métabolites secondaires appartiennent à des groupes chimiques très variés tels les alcaloïdes, les terpènes, les composés phénoliques, etc (Bellebcir L, 2008).
Tous les végétaux contiennent des composés phénoliques, qui sont en effet des éléments importants des qualités sensorielles (couleur, astringence…) et nutritionnelles des végétaux que consomme l’homme et leur intervention dans la santé est maintenant reconnue dans des domaines variés : lutte contre l’athérosclérose, action anticancérigène pour certains d’entre eux, action antioxydante permettant de lutter contre le vieillissement cellulaire
(Sarni M-P et Cheynier V, 2006). I. Définition des polyphénols
Les polyphénols sont des molécules synthétisées par les plantes en réponse à un stress de l’environnement. Ils forment une large famille de composés chimiques qui contient plus de 8000 molécules organiques différentes (Sagols et al, 2010).
L’expression de « composés phénoliques » est utilisée pour toutes substances chimiques possédant dans sa structure un noyau aromatique, portant un ou plusieurs groupements hydroxyles. Un nombre considérable de ces composés sont formés de deux noyaux benzéniques A et B reliés par un hétérocycle de type pyrane. Ces composés différent les uns des autres par la position des substitutions sur les noyaux A et B, par la nature de l’élément central et par la position, la nature et le nombre de molécules de sucre fixées ainsi que par la nature de la liaison hétérosidique (Nkhili Ez, 2009).
II. Les principales classes des composés phénoliques
Il existe deux grandes classes de polyphénols : les monomères, qui comprennent les acides phénoliques, les flavanoïdes, et les polymères, qui comprennent les oligomères, les tanins, les stilbènes, les lignanes (Sagols et al, 2010).
Ces composés phénoliques se différencient d’abord par la complexité du squelette de base (allant d’un simple C6 à des formes très polymérisées). Ensuite par le degré de modification de ce squelette (degré d’oxydation, d’hydroxylation et de méthylation, etc.).
22
Enfin par les liaisons possibles de ces molécules de base avec d’autres molécules (glucides, lipides, protéines, etc) (Bellebcire L, 2008).
II.1. polyphénols monomériques :
Les formes phénoliques les plus simples présentent des structures chimiques allant du simple phénol en C6 (non présent naturellement chez les végétaux) aux flavonoïdes en C15 et à des molécules proches. Sauf exception ; ces substances sont présentent sous forme soluble dans la vacuole (Machiex J-J et al, 2006).
II.1.1. Les acides phénoliques :
Ils sont composés d’un seul noyau phénolique et d’au moins une fonction carboxylique
(Frédéric M, 2011).Ils sont de deux types :
A. Acides hydroxybenzoïques :
Ils sont dérivés de l’acide benzoïque et ayant une formule de base de type C6 - C1. (Exemple : l’acide gallique, acide vanillique, acide syringique…) (Figure 06).
Figure 06: Exemple de quelques acides hydroxybenzoïques.
B. Acides hydroxycinnamiques :
Ils sont dérivés de l’acide cinnamique ayant la structure de base (C6 – C3). (Exemple : l’acide p-coumarique, l’acide caféique, l’acide férulique et son dérivé 5-hydroxyle et enfin
l’acide sinapique…) (Figure 07).
Figure 07: structure chimique de l’acide hydroxycinnamique (Bellebcire. L, 2008).
II.1.2. Les flavonoïdes :
Le nom flavonoïde est dérivé du mot « Flavus » en latin, qui signifie jaune. Les flavonoïdes sont des pigments hydrosolubles responsables de la couleur des végétaux. Il en
23
existe plus de 4000 variétés regroupées en 6 classes principales. Ils ont des propriétés antioxydantes supérieures à celles des vitamines.
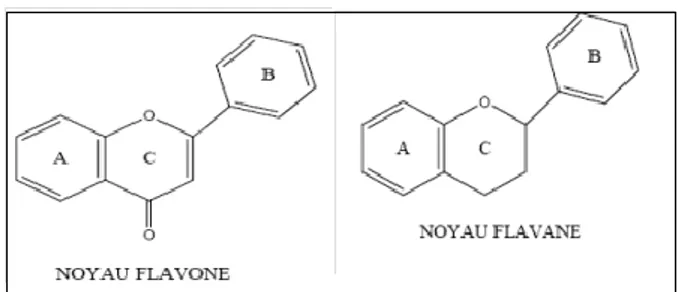
Les flavonoïdes sont des dérivés du noyau flavone ou 2-phenyl chromone (figure 08) portant des fonctions phénols libres, éthers ou glycosides. Le noyau flavone est lui même un dérivé du noyau flavane de base (figure 8) (Kebieche M, 2009).
Figure 08: Structure du noyau flavone et le noyau flavane.
Les flavonoïdes sont donc des polyphénols complexes dont la structure en C15 (C6-C3-C6) est constituée de deux noyaux aromatiques (noyaux A et B) et d’un hétérocycle oxygéné, cycle C (Milane H, 2004).
A. Les différentes classes des flavonoïdes :
les chalcones et aurones:
Les chalcones sont différents des autres types des flavonoïdes par l’ouverture du noyau pyranique central, elles sont donc constituées de deux unités aromatiques reliées par une
chaîne tricarbonée, cétonique, , -insaturée Le noyau B est fréquemment non substitué,
alors que les substitutions sur le cycle A sont identiques à celles des autres flavonoïdes (figure 09) (Nkhili Ez, 2009).
Figure 09: structure chimiques des chalcones et aurones (Francisco P-V et Juan D, 2010)
Les flavanones et flavanonols
Dérivent des précédentes par une cyclisation au centre du squelette, d’où un hétérocycle. Ils se caractérisent par l’absence de la double liaison entre C2 et C3 par la présence des centres d’asymétrie (figure 10) (Bellebcire L, 2008).
24
Les flavanonols (encore appelés dihydroflavonols) se distinguent des flavanones par l’hydroxylation de la position C-3 (figure 10) (Nkhili Ez, 2009).
Figure 10: structure chimiques des flavanones et flavanonols (Min H et al, 2010).
Les flavones
Dérivent des flavanones par une oxydation qui introduit une seconde double liaison dan l’hétérocycle. Dans plus de 90%, le cycle A est substitué par deux hydroxyles phénoliques en C5 et C7 (figure 11) (Bellebcire L, 2008).
Figure 11: structure chimiques des flavones (Alok K-V et Ram P, 2010).
Les flavonols
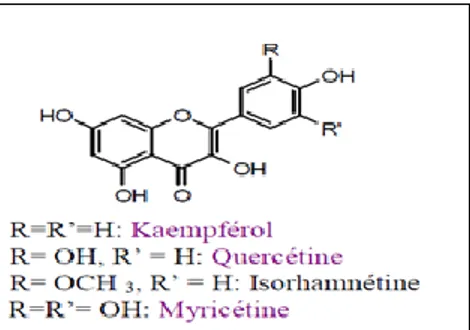
Se différencient des flavones par la présence d’un OH en C3 (Bellebcire L, 2008). Ces
composés constituent le groupe le plus hydroxylé de la famille des flavonoïdes. Ils peuvent exister soit sous forme d’aglycones, soit sous forme d’hétérosides. Les sucres les plus souvent impliqués sont des aldoses : D-glucose, D-galactose, L-rhammnose et L-arabinose (figure 12) (Nkhili Ez, 2009).
Figure 12: structure chimiques des Flavonols (Alan Crozier et al, 2009).
25
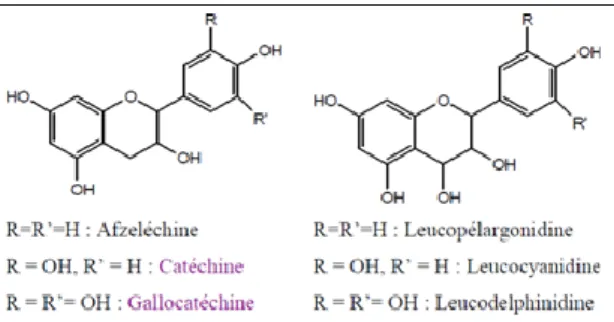
Flavan-3-ols, flavan-3,4-diols
À la différence des flavanones et des flavanonols, ces deux groupes de molécules sont toujours hydroxylés en position 3 et se caractérisent par l’absence du groupe carbonyle en C4. Les flavan-3-ols (appelés aussi les catéchines) possèdent deux atomes asymétriques en C2 et C3. Les flavan-3,4-diols se distinguent des catéchines par la présence du OH en position 4 (figure 13) (Nkhili Ez, 2009).
Figure 13: structure chimiques des Flavan-3-ols, flavan-3,4-diols (Alan C et al, 2009).
les isoflavones
Dérivent aussi des flavanones mais outre une oxydation centrale, il y a transposition du
cycle latéral du C2 au C4 de l’hétérocycle (figure 14) (Bellebcire L, 2008).
Figure 14: structure chimiques des isoflavones (Min H et al, 2010).
Les anthocyanes
Les anthocyanes sont des pigments rouges très répandus dans les fleurs et les fruits. Ils sont des dérivés du cation 2-phényl-1-benzopyrylium (flavylium) porteur de 3 cycles aromatiques conjugués d’où l’absorption de lumière visible (Nkhili Ez, 2009).
Chez les anthocyanes, en plus de la position 3 qui est toujours glycosylée, il y a préférentiellement la position 5 qui est glycosylée. La partie phénolique seule est désigné sous le nom d’anthocyanidine, alors que l’hétéroside (molécule phénolique associée à un sucre) est appelé anthocyanine (figure 15) (Bellebcir L, 2008).
26
Figure 15: structure chimiques des anthocyanes (Alok K-V et Ram P, 2010).
II.2. les polyphénols polymères « Les formes condensées »
Ces composés résultent généralement de la condensation de certaines des formes
simples précédemment évoquées. Dans tous les cas, les formes condensées sont particulièrement difficiles à étudier et, dans la plupart des cas, on est obligé de les dégrader, chimiquement ou enzymatiquement, avant de pouvoir les analyser. Selon la nature des constituants impliqués et selon le type de condensation, on obtient des composés plus ou moins complexes pouvant encore présenter une hydrosolubilité suffisante pour être présents dans la vacuole (tanins, certains produits de brunissement) ou au contraire acquérir un caractère lipophile marqué et s’accumuler alors dans les structures pariétales (lignines, acides phénoliques intégrés dans la cutine et la subérine…) (Macheix J-J et al,
2006).
II.2.1. Les Tanins
Ils représentent un groupe hétérogène assez difficile à définir de façon rigoureuse et concise car il n’y a pas de structure chimique de base (Nkhili Ez, 2009).
Il est classique de distinguer deux grands groupes de tanins, différents à la fois par leur réactivité chimique et par leur composition (Figure 16) (Bellebcire L, 2008).
Figure 16: Structure chimiques des tanins (Kanoun K, 2011).
A. Les tanins hydrolysables
Ce sont des esters de glucose et d’acide gallique. Ils sont d’abord caractérisés par le fait qu’ils peuvent être dégradés par l’hydrolyse chimique (enzymatique). Libérant ainsi une