MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET
DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE DE BOUIRA
FACULTE DES SCIENCES ET SCIENCES APPLIQUEES
DEPARTEMENT DE PHYSIQUE
MEMOIRE PREPARE POUR L’OTENTION DE DIPLÔME
DE MASTER EN PHYSIQUE
OPTION
Physique des Matériaux et Nanomatériaux
THEME
Simulation de la croissance de l’oxyde
thermique sur des substrats de silicium
Présentée par : Mell Betraoui Fatima
Soutenue le : 27/09/ 2014
Devant le jury :
D. Zirergui Djamel MAA Président D. Madi Djamel MCB Rapporteur D. Bennamara Salem MAB Examinateur
Je dédie ce travail
A la pensée de mes chers parents
A mes frères et mes sœurs
Remerciements
Avant tout développement de cette expérience professionnelle, il apparait opportun de commencer ce mémoire par des remerciements, à ceux qui m’ont appris au cours de ce travail, et même à ceux qui ont eu la gentillesse de faire de ce travail un moment très profitable.
Ainsi, je remercie mon encadreur Monsieur Madi Djamel, enseignant chercheur à la faculté des sciences et des sciences appliquées de l’université Mohand Akli Oulhadj de Bouira qui a mis à ma disposition tous les moyens nécessaires pour mener à bien mon travail. Aussi, j’exprime ma gratitude pour ses conseils et son suivi avec beaucoup d’objectivité et d’intention l’évolution de toutes les étapes de ce travail et ceci aussi bien de près que de loin.
J’exprime toute ma gratitude à Monsieur Zerirgui Djamel, enseignant chercheur à la faculté des sciences et des sciences appliquées de l’université Mohand Akli Oulhadj de Bouira, pour l’honneur qu’il m’a fait de présider le jury de mon mémoire.
Que Monsieur Benamara Salem, enseignant à la faculté des sciences et des sciences appliquées de l’université Mohand Akli Oulhadj de Bouira, trouve ici l’expression de ma profonde reconnaissance pour l’intérêt qu’il a manifesté à ce travail et d’avoir accepté de faire partie du jury de mon mémoire.
Je tiens à exprimer toute ma reconnaissance et ma gratitude à l’ensemble des enseignants à la faculté des sciences et des sciences appliquées de l’université Mohand Akli Oulhadj de Bouira qui n’ont jamais cessé de m’assister aussi bien durant ma formation en Licence ou en Master que dans les démarches administratives.
Mes remerciements les plus chaleureux sont adressés aux étudiants de Master que ce soit en Chimie ou en physique des matériaux et nanomatériaux.
Aussi, je tiens à témoigner ma profonde reconnaissance à ma chère famille, en particulier mon frère et ma belle-sœur, pour leurs aides et leurs soutiens ainsi que pour la grande confiance et la gentillesse qu’ils m’ont témoignée tout au long de ce travail.
Introduction générale . . . 1
Chapitre I : SILICIUM MONOCRISTALLIN ET POLYCRISTALLIN ELABORATIONS ET PROPRIETES . . . 3
I.1 Introduction . . . 4
I.2 Généralités sur le silicium . . . 4
I.3 Silicium monocristallin . . . 6
I.3.1 Elaboration du silicium monocristallin par procédé Czochralski . . . 6
I.3.2 Structure cristalline . . . 8
I.3.3 Défauts dans le silicium . . . 9
I.3.4 Propriétés électriques du silicium. . . 12
I.3.4.1 Structure de bande d’énergie du silicium. . . 12
I.3.4.2 Conductivité électrique . . . 14
I.3.4.3 Différents types de dopage . . . 15
a)- Le dopage de type n . . . 16
b)- Le dopage de type p . . . 17
I.3.4.4 Courant de conduction . . . 17
I.3.4.5 Courant de diffusion . . . 18
I.4 Silicium polycristallin . . . 19
I.4.1 Structure cristalline . . . 19
I.4.2 Défauts dans le silicium polycristallin . . . 20
a)- Les joins de grain . . . 20
b)- Les défauts intra granulaires . . . 20
I.4.3 Elaboration et Méthodes de dépôts . . . 22
I.4.3.1 Dépôt chimique en phase vapeur (CVD) . . . 22
I.4.3.2 La technique APCVD . . . 23
I.4.3.3 La technique LPCVD . . . 24
I.4.4 Structure de films du silicium polycristallin . . . 25
I.4.4.1 Effet de la température de dépôt . . . 25
a)- Effet sur la nature des couches déposées . . . 25
b)- Effet sur la texture des couches . . . 26
c)- Effet sur la taille des grains . . . 29
I.4.4.2 Effet des recuits thermiques . . . 29
I.4.4.3 Effet du dopage . . . 29
I.5 Conclusion . . . 31
Chapitre II : MODELES THEORIQUES ET ASPECTS EXPERIMENTALE D’OXYDATION THERMIQUE DU SILICIUM. . . 32
II.1 Introduction . . . 33
II.2 Oxydation thermique du silicium . . . 33
II.2.1 Processus chimique d’oxydation thermique du silicium. . . 33
II.3 Présentation des principaux modèles théoriques de modélisation . . . 34
II.3.1 Modèle de Deal et Grove . . . 34
II.3.2 Modèle de Naïto et al . . . . 41
II.3.2 Modèle de Han et Helms . . . . 43
II.3.2 Modèle de Reisman et al . . . 46
II.4 Modélisation Electrique Des Films De Polysilicium . . . 47
II.5 Aspect expérimental d’oxydation . . . 49
II.5.1 Aspects pratiques d’élaboration des échantillons . . . 49
II.5.2 Aspects pratiques de caractérisation. . . 51
a)- Profil de dopage . . . 51
b)- Aspect structural . . . 51
II.5.3 Aspects pratiques de mise en œuvre de l’oxydation thermique du silicium . . . 53
a)- Le matériel et ses caractéristiques . . . 53
b)- Effets des conditions expérimentales sur la croissance de l’oxyde . . . 54
b-1)- Utilisation des écrans . . . . 56
b-2)- Manœuvre d’entrée-sortie des dépôts dans le four . . . . 57
II.6 Conclusion . . . 58
Chapitre III. RESULTATS ET DISCUSSION. . . 59
III.1. Introduction . . . 60
III.2 Présentation du Logiciel Matlab utilisé dans la simulation . . . 60
III.3 Suivi de la croissance d’oxyde thermique du silicium monocristallin . . . 61
III.3.1 Interprétation des résultats. . . . . 67
III.4 Suivi de la croissance d’oxyde thermique du silicium polycristallin . . . . 68
III.4.1 Interprétation des résultats. . . 75
III.5 Conclusion . . . . . . . . . 76
Conclusion générale . . . 77
Introduction générale
Depuis plusieurs années, les traitements d’oxydation thermique du silicium font l’objet d’un intérêt sans cesse croissant dans les milieux industriels, car ils trouvent de plus en plus d’applications dans la technologie des circuits intégrés. Ils interviennent comme de couches passivantes à la surface du silicium, de masque d’implantation ou de diffusion de dopants, de couches sacrificielles permettant d’améliorer les performances et de grille dans la structure MOS.
Actuellement, une attention particulière est portée au silicium polycristallin fortement dopé in-situ, par suite sa facilité d’élaboration obtenue par LPCVD (Low Pressure Chemical Vapor Deposition) à des températures comprises généralement entre 520 et 605°C. Par ailleurs, cette technique permet d’obtenir une distribution homogène des dopants en ne nécessitant qu’une seule étape technologique et, de plus, elle se prête bien à la production en grande série, ce qui assure un faible coût de revient. L’étude de la thermo-oxydation de ce matériau est d’une grande importance car son introduction dans le processus d’élaboration des circuits intégrés a trouvé un large champ d’application dans l’industrie microélectronique. En particulier, l’oxyde formé sur des films fortement dopés in-situ au bore représente une bande d’isolation électrique excellente entre différentes couches de conduction ou entre différentes structures.
Notons que le but essentiel de notre travail est la simulation, aussi fidèle et précise, du processus de thermo-oxydation sous oxygène sec à pression atmosphérique, des films de silicium polycristallin fortement dopés in-situ au bore (B-LPCVD). Pour ce faire, une meilleure compréhension des cinétiques d’oxydation et des mécanismes qui les gouvernent dans le cas du silicium monocristallin est nécessaire. Il est donc primordial pour atteindre ce but de mettre en œuvre des études pratiques et théoriques en vue de rassembler le maximum d’information entourant le sujet. Ainsi, le présent mémoire est subdivisé en trois chapitres :
Le premier chapitre donne l’occasion à faire passer en revue les méthodes d’élaboration et les principales caractérisations, en particulier, celles liées aux structures des films de silicium monocristallin et polycristallin.
Le deuxième chapitre traite et analyse les diverses études théoriques de modélisation de l’oxydation thermique ainsi que les échantillons préparés pour subir des recuits thermiques sous oxygène sec avec leurs propriétés d’élaborations. Le four d’oxydation
est aussi dénoté avec les divers détails pour mieux cerner les difficultés liées à la procédure expérimentale.
Le troisième chapitre concerne la simulation par le modèle de Deal et Grove des données expérimentales relatives à l’oxydation thermique sèche des films minces de silicium monocristallin et ceux des films polycristallin fortement dopés in-situ au bore. Une étude détaillée sous l’influence de plusieurs paramètres est aussi envisagée.
___________________
Chapitre I
_________________
_______________________________
Silicium monocristallin et
polycristallin
I.1 Introduction
Dans une première partie de ce chapitre, nous allons rappeler les notions fondamentales liées au silicium monocristallin, décrire l’état cristallin de ce dernier et, en particulier, sa méthode d’élaboration par le procédé de Czochralski, qui se réalise en phase liquide à haute température. De plus, une vue générale sur ses propriétés cristallographiques et électriques est envisagée pour plus tard comprendre son comportement vis-à-vis des autres paramètres comme le dopage et la température.
Dans une deuxième partie de ce chapitre, nous intéressons au silicium polycristallin sous l’angle des propriétés structurales ainsi que les différentes méthodes de son élaboration. Dans ce dernier cas, on abordera la méthode de croissance par dépôt chimique en phase vapeur à basse pression (LPCVD) et les différents paramètres misent en jeu dans de tels processus. I.2 Généralités sur le Silicium
Le silicium est l’élément chimique le plus abondant dans la croute terrestre, après l’oxygène, puisqu’il représente 25,7% de la masse de la terre. Il fait partie de la famille des cristallogènes, son symbole est « Si » et son numéro atomique est « 14 ». Dans la nature, il n’existe pas à l’état pur mais sous forme de composés : soit sous forme de silice, qui est un dioxyde de silicium (SiO2) et que l’on trouve dans le sable, soit sous forme de silicates qui sont des sels dérivants de la silice et qui rentrent dans la composition d’une quantité importante de minéraux (97% de la croute terrestre). Citons entre autres, le quartz, le talc ou la topaze.
(a) (b)
Figure I.1 : Différents états du silicium : a) Poudre de silicium nano-poreux hydrogéné b) Silicium à l’état cristallin
De couleur marron foncé sous sa forme amorphe (figure I.1 a) et gris-noir sous sa forme cristallisée (figure I.1 b), le silicium est quasi insoluble dans l'eau. L’usage de l'acide fluorhydrique (HF) ou d’un mélange d’acide fluorhydrique et d’acide nitrique (HNO3) est nécessaire pour le nettoyage de la surface du silicium. Même si ses reflets métalliques bleutés et quelques-unes de ses caractéristiques semblent en faire un proche parent des métaux, il n'est pas aussi ductile que ces derniers et se rompt facilement sous les contraintes mécaniques. Le silicium existe naturellement sous trois formes d’isotopes : 28Si (92,18%), 29Si (4,71%) et 30
Si (3,12%). C’est en 1823 que le silicium fut séparé de ses composés par le chimiste suédois Jöns Jacob Berzelius (1779 - 1848). Quant au silicium à l’état cristallin, il a été obtenu pour la première fois en 1854 par le chimiste français Henry Sainte-Claire Deville (1818 - 1881).Son utilisation la plus ancienne est sous sa forme d'oxyde de silicium amorphe pour la fabrication du verre. Aussi, il a été utilisé avec l’aluminium pour former des alliages. Ce dernier est à son tour employé principalement dans l’automobile pour l’élaboration de pièces moulées telle que les « jantes en alliage » et dans l’aéronautique pour la conception des éléments de moteurs électriques. Près de 55% de la consommation mondiale du silicium été orientée vers l’utilisation industrielle des alliages Silicium-Aluminium. C’est avec l’arrivée de l’électronique qu’on lui a trouvé de nouveaux usages comme semi-conducteur. Les figures (I.2.a) et (I.2.b) représentent respectivement les structures bidimensionnelles de la silice amorphe et du silicium cristallin. Nous allons décrire ces formes cristallines dans les paragraphes suivants.
(a) (b)
Figure I.2 : Représentation bidimensionnelle de : a) la silice amorphe (SiO2), b) silicium cristallin
O
Le grand intérêt du silicium, provient de son oxyde (SiO2) qui est électriquement isolant et chimiquement stable même à haute température. De plus il permet de réaliser d’excellentes interfaces. Il est particulièrement adapté à la réalisation des composants micro-électroniques. Il peut être obtenu soit par des procédés de dépôts dans des fours à recuits thermique rapide ou par exposition d’une plaquette de silicium à un flux d’oxygène à des températures élevées.
I.3 Silicium monocristallin
Le silicium monocristallin est un matériau qui présente de bonnes propriétés électroniques grâce à sa grande pureté et à sa structure composée d’un seul grain. Il est élaboré à partir du procédé Czochralski. Ce dernier est réalisé à très haute température et en phase liquide. A la fin du procédé, le produit se présente sous forme de lingots de silicium pur monocristallin. Ces lingots sont ensuite découpés en plaquettes (wafers) de 300 μm d’épaisseur. Cette épaisseur est nécessaire pour assurer une stabilité mécanique [1].
I.3.1 Elaboration du silicium monocristallin par Procédé Czochralski :
Le procédé Czochralski est un procédé de croissance de cristaux monocristallins de grandes dimensions (plusieurs centimètres). Le schéma du procédé est représenté sur la figure I.3.
Figure I.3. Procédé Czochralski pour la croissance du silicium monocristallin
germe Lingot monocristallin Bain fondu inducteur générateur MF réfractaire creuset gaz protecteur
La méthode consiste en une solidification dirigée à partir d’un germe monocristallin de petite taille. On part du matériau fondu à une température juste au-dessus du point de fusion du silicium. Le germe est maintenu par une tige suspendue au-dessus du liquide et animée d’un mouvement de translation. Le germe est mis en contact avec le liquide et au fur et à mesure qu’on tire le germe vers le haut en le faisant tourner à vitesse très lente, le liquide se solidifie suivant une structure ayant la direction cristallographique similaire à celle du germe. L’opération de croissance du monocristal est réalisée sous atmosphère contrôlée (vide, argon, azote …). Ces monocristaux « géants » sont utilisés dans l’industrie électronique [2,3].
La figure I.4 présente deux cristaux obtenus par la méthode Czochralski : le premier a un diamètre de 150mm alors que le deuxième est de 200mm [4].
Figure I.4. Lingots de silicium monocristallin sous forme cylindrique obtenus par la méthode
de croissance Czochralski [4].
Une fois l’étape de croissance du silicium est terminée, on enlève les deux bouts du lingot. Le bout supérieur sert à constituer le germe monocristallin pour une croissance ultérieure. Le bout inférieur contient une concentration d’impureté plus importante que dans le volume du lingot et pour cela il est considéré comme un déchet. Le lingot sans les deux bouts est ensuite rectifié mécaniquement au bon diamètre pour donner un lingot parfaitement rond. L’orientation cristalline du lingot est déterminée par une technique d’analyse appelée diffraction des rayons X (DRX). La connaissance de cette orientation est nécessaire pour les étapes ultérieures de fabrication. Un monocristal se coupe ou se clive le long d’un de ses plans réticulaires que ce soit (100), (110) ou (111).
I.3.2 Structure cristalline :
La matière condensée peut prendre deux états solides différents, suivant les conditions dans lesquelles elle s'est formée : un état dit amorphe, dans lequel la disposition des atomes est aléatoire, ou un état cristallisé caractérisé par un arrangement périodique des atomes. Les solides amorphes sont généralement appelés des verres et considérés comme des liquides de haute viscosité. Les solides cristallisés peuvent former des monocristaux, si la périodicité est ininterrompue dans tout le volume, ou des poly-cristaux, s'il existe une périodicité locale et que le solide est composé d'un ensemble de grains cristallins à peu près de même taille. Dans la microphotographie de la figure I.5, prise par TEM (Transmission Electron Microscopy), une vue de coupe du réseau cristallin du silicium permet d'observer sa périodicité.
Figure I.5 : Microphotographie du réseau cristallin du silicium prise par TEM (D’après [5])
La figure ci-dessus montre un ensemble d’atome ordonné et d'électrons liés entre eux par des forces principalement coulombiennes. Ces forces sont plus ou moins importantes suivant l'électronégativité des éléments intervenant dans les liaisons, ce qui confère au solide des propriétés mécaniques et électriques plus au moins différentes. On distingue quatre familles de solides cristallins : les cristaux ioniques, les cristaux covalents les métaux et les cristaux moléculaires [5].
Le silicium monocristallin possède une structure cubique diamant où chaque atome est entouré de quatre plus proche voisins, ce qui permet de former des liaisons covalentes. Elle peut être décrite comme étant deux réseaux cubiques à faces centrées (CFC) déplacés l’un par rapport à l’autre le long de la diagonale principale. La position de l’origine du deuxième CFC par rapport à celle du premier CFC est de (1/4, 1/4, 1/4). On remarque sur la figure I.6, le mode de liaison tétraédrique (représenté en rouge) et quelques valeurs caractéristiques, à
savoir, le paramètre de maille a et la distance d entre deux proches voisins : et .
Figure I.6 : Le réseau du silicium monocristallin (d’après [5-7])
I.3.3 Défauts dans le silicium
Notons au préalable, que le silicium monocristallin idéal ne comporte aucune rupture du réseau cristallin. Les types de défauts possibles cités dans la littérature sont donnés dans le tableau I.1. Tout échantillon de silicium monocristallin contient au moins des défauts intrinsèques appelés aussi ponctuels comme les lacunes et les interstitiels, et des défauts extrinsèques issus de la présence des atomes étrangers désirables comme les dopants et indésirables comme les impuretés.
Type de défaut Exemples
Défauts intrinsèques Lacunes, interstitiels Défauts extrinsèques Dopants, impuretés
Tableau I.1 : Types de défauts cristallographiques dans le silicium monocristallin
La lacune dans le silicium constitue sans doute le défaut le plus simple et le plus connu grâce aux nombreux travaux cités dans la littérature [8, 9]. Pour former une lacune, quatre liaisons doivent être brisées avec les atomes voisins immédiats de l’atome déplacé. Ces liaisons pendantes peuvent former de nouvelles liaisons entre elles, entraînant des déplacements atomiques des proches voisins connus sous le nom de relaxation du défaut. Les liaisons nouvellement formées et les déplacements atomiques qui y sont associés dépendent
(0,0,0)
(1/4,1/4,1/4
) 2,35Å
de l’état de charge de la lacune, c’est-à-dire du nombre d’électrons participants aux liaisons. Dans le cas du silicium, une lacune possède cinq différents états de charge, présentant pour la plupart de fortes distorsions. Chaque fois qu’un électron est ajouté à la liaison, le défaut subit une relaxation afin de maintenir les électrons éloignés les uns des autres et ainsi minimiser leur répulsion électrostatique tout en optimisant leur interaction attractive avec les noyaux atomiques au voisinage de la lacune.
L’auto-interstitiel du silicium, appeler parfois par ”interstitiel” est le deuxième défaut ponctuel dans le silicium. Ces défauts sont particulièrement intéressant car ils sont à l’origine de la diffusion accélérée et transitoire dans le silicium [9]. Les auto-interstitiels peuvent alors se déplacer sur une longue distance même à basses températures avant de se recombiner avec une lacune. Les atomes des métaux de transition sont les impuretés les plus néfastes pour le silicium, en raison de leurs diffusivités et solubilités relativement élevées à hautes températures. Ils induisent des niveaux énergétiques dits profonds au milieu de l’espace de la bande interdite et modifie ainsi considérablement les propriétés électriques du silicium [10]. Les impuretés telles que Cr, Mg, Fe, Co, Ni et Cu sont bien connues en tant que diffuseurs rapides dans le silicium. Ceci dit, les fortes diffusivités de la plupart de ces impuretés rendent aussi plus facile les traitements destinés à les extraire du volume (effet Getter). Les impuretés connues pour se trouver en site substitutionnel (Au et Pt) peuvent quant à elles avoir des coefficients de diffusion relativement faibles. La solubilité et la diffusivité des métaux de transitions augmentent de manière générale avec leur numéro atomique.
L’impact des impuretés peut être réduit par des techniques appelées effets Getter. On entend par l’effet Getter un effet de purification du matériau par piégeage ou désactivation d’impuretés ou de défauts après un recuit thermique. On distingue en premier lieu entre deux types de Getter : un effet Getter interne, induit par des défauts initialement présents dans le volume et qui sont capables de capturer et de désactiver certaines impuretés. C’est le cas du phosphore [11] et de l’oxygène [12, 13]. Plus fréquemment utilisé est le Getter externe ou l’on applique volontairement un traitement pour piéger les impuretés métalliques. Les plus répondus parmi ces derniers on trouve le phosphore [14] et l’aluminium [15, 16], qui ont également l’avantage d’être des dopants. En effet, lors du processus de fabrication des cellules solaires, le but recherché par la diffusion du phosphore dans le silicium est non seulement la formation d’une région fortement dopée au phosphore appelée émetteur mais également l’extraction des impuretés par effet getter externe [17]. Un tel processus est illustré sur la figure I.7 qui montre trois étapes physiques induites lors d’un traitement thermique :
(1) dissolution de l’impureté pour la rendre mobile dans la région active de la cellule. (2) diffusion de l’impureté à travers le volume vers le centre Getter.
(3) capture et piégeage de l’impureté dans des emplacements appelés sites de Getter pour la rendre inactive.
Bien que la technique de Getter des impuretés induite par la diffusion du phosphore ait été mise en application avec succès dans l’industrie photovoltaïque, il a été également rapporté que l’efficacité de cette méthode est tout à fait faible dans les matériaux qui présentent des densités élevées de défauts [18,19]. De plus, les impuretés métalliques à diffusion rapide comme le Fe et le Cr sont facile à extraite du volume de silicium que celles à diffusio n lente comme le Ti et le Mo [20]. Les résultats expérimentaux rapportés dans la référence [18] suggèrent que certains défauts structuraux dans le silicium, décorés par des impuretés métalliques précipitées pendant la croissance du cristal, deviennent fortement stables et ne peuvent pas être extraites par des techniques conventionnelles de Getter.
Figure I.7 : Schéma du processus de l’effet Getter avec ces trois étapes (d’après [17]).
1) Extraction 2) diffusion 3) piégeage
Une autre alternative est mise en avant à travers le mécanisme de passivation des défauts dans le silicium par l’hydrogène ou simplement hydrogénation. La désactivation des impuretés et des dopants par l’hydrogène a été intensivement étudiée par beaucoup de chercheurs [21-23]. Par ailleurs, l’introduction de l’hydrogène dans le silicium et son
(1) impureté dissous
(2) diffusion (3) impureté capturée et piégée
interaction avec les défauts reste un sujet d’actualité où plusieurs équipes de recherche dans le monde ne cessent d’explorer.
I.3.4 Propriétés électriques du silicium
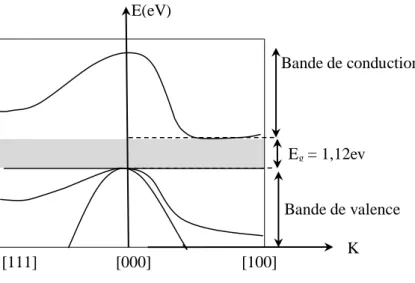
Dans un cristal idéal de silicium les atomes sont arrangés selon la structure diamant avec une distance interatomique . La liaison entre les atomes les plus proches est de caractère covalent [24]. A ce type de liaison correspondent des états électroniques couplés entre eux donnant lieu à des bandes d’énergies : deux permises et une interdite pour les électrons. La bande interdite, appelée Gap en anglais, sépare la bande permise de valence (BV) (pleine au zéro absolu) de la bande permise de conduction (BC) (vide au zéro absolu) d’une énergie égale à 1,12eV à la température ambiante. L’importance du gap est son aptitude à agir sur le transport des porteurs de charge entre les différentes bandes d’énergies et ainsi sur les propriétés électroniques du semi-conducteur.
I.3.4.1 Structure de bande d’énergie du silicium
Bien que les électrons d'un atome isolé aient des niveaux d'énergie permis bien définis, le comportement de ces électrons dans un réseau cristallin périodique est différent. Si la distance entre les atomes est suffisamment petite, comme dans le cas du réseau cristallin du silicium, la présence des atomes voisins génère une sorte d'interférence entre les niveaux permis de chaque atome. Cela entraîne une multitude quasi continue d'états autour de chaque niveau permis de l'atome individuel. Cet ensemble d'états, très proches entre eux, est plutôt considéré alors comme une bande d'énergie permise, avec une densité d'états associée.
Les niveaux d'énergie des électrons de valence et le niveau d'énergie d'ionisation génèrent ainsi deux bandes d’énergies permises particulièrement intéressantes, la bande de valence et la bande de conduction, séparées par une bande dépourvue de niveaux permis, nommée bande interdite (figure I.8). La particularité de ces bandes permises tient au fait que les électrons peuvent circuler librement dans toute la maille cristalline et ainsi générer des courants de conduction électrique.
Figure I.8 : Représentation de la structure de bande de silicium monocristallin
A des températures très basses, la bande de conduction se trouve vide d'électrons et la bande de valence est complètement occupée, car l'énergie thermique n'est pas suffisamment importante pour ioniser les atomes du réseau cristallin. Toutefois, l’agitation thermique fournit à certains électrons de valence une énergie nécessaire pour passer de la bande de valence dans la bande de conduction, devenant ainsi des porteurs de charge négative mobiles pouvant servir à la circulation d’un courant électrique dans le matériau.
Lorsqu'un électron passe dans la bande de conduction, il laisse dans le réseau cristallin un ion positif (atome ayant perdu un électron). Une particularité essentielle du silicium est que cet ion peut aisément rétablir son équilibre électronique en capturant un électron de valence d'un atome voisin, lequel peut à son tour rétablir son équilibre aux dépens d'un atome voisin. Le trou laissé par le passage d'un électron de la bande de valence à la bande de conduction correspond à une charge positive se déplaçant de proche en proche dans le réseau cristallin et participant ainsi à la conduction électrique au même titre que l'électron passé dans la bande de conduction. C'est pourquoi, lorsque l'agitation thermique fait passer un électron dans la bande de conduction, on dit qu'il y a création d'une paire électron- trou pour indiquer qu'il y a apparition de deux porteurs de charge mobiles de signes opposés. Par ailleurs, un électron passé dans la bande de conduction peut revenir dans la bande de valence en étant capturé par un ion positif; on dit que cet électron se recombine avec un trou du réseau cristallin. Par la suite, quand nous parlerons d'électrons, nous sous-entendrons qu'il s'agit d'électrons passés dans la bande de conduction.
La concentration des électrons libérés à la température est appelée la concentration intrinsèque ( ), est varie avec la température selon la relation suivante:
E(eV) [111] [000] [100] Eg = 1,12ev K Bande de conduction Bande de valence
( ) ⁄ ⁄ ( )
Où est une constante de l’ordre de ⁄ , et ⁄ est la constante de Boltzmann. A la température ambiante ( ), on trouve .
I.3.4.2 Conductivité électrique
Sous l’application d’un champ électrique ⃗⃗ , le courant électrique est assuré à la fois par les électrons et par les trous. A une température donnée, les deux types de porteurs sont animés d’une agitation thermique et subissent des collisions provoquées essentiellement par les vibrations thermiques du réseau cristallin. Ces deux mécanismes s’équilibrent, ce qui conduit à une situation où les porteurs de charges se déplacent avec des vitesses moyennes constantes pour les électrons et pour les trous. Pour des champs électriques modérés, typiquement inférieure à , les vitesses et sont proportionnelles à l’intensité du champ électrique ⃗⃗ :
(I.2)
(I.3)
Les coefficients et sont les mobilités respectivement des électrons et des trous. Elles diminuent si les collisions sont plus fréquentes. Pour le silicium à température ambiante, on trouve :
( )
La densité de courant électrique totale comporte une contribution de chacun des deux types de porteurs libres :
( ) Où :
( ) Où et représentent les concentrations des électrons et des trous.
La conductivité a donc pour expression :
( ) ( )
Dans le cas d’un semi-conducteur intrinsèque, l’expression précédente se réduit à :
( ) ( )
Ainsi, la résistivité est donnée par :
⁄ (μ μ ) ( )
La résistivité du silicium pur est au voisinage de . Cette valeur, à comparer à celle du cuivre ( ), reflète que le silicium intrinsèque n’a pas une grande utilité en électronique. Cependant, on peut modifier ses caractéristiques électriques en rajoutant des atomes étrangers appelés dopants.
I.3.4.3 Différents types de dopage
Une modification des populations des porteurs de charges dans le silicium entraîne forcément la diminution de sa résistivité électrique. Ceci est d’un intérêt fondamental pour la technologie des semi-conducteurs, car il est possible de couvrir pratiquement toute la gamme de résistivité s’étendant des isolants aux métaux en contrôlant la concentration en dopants. D’une manière générale, on distingue deux types de dopages : le dopage de type n et le dopage de type p.
a)- Le dopage de type n
On réalise un dopage de type n en injectant dans le cristal de silicium des atomes étrangers possédant cinq électrons de valence. Quatre électrons de valence de chaque atome étranger servent à établir des liaisons covalentes avec les atomes de silicium voisins ; le cinquième ne participe pas aux liaisons. L’énergie de liaison de cet électron avec l’atome étranger est faible à la température ambiante ; le cinquième électron est libéré de son atome parent. Il occupe alors un niveau de la bande de conduction. L’atome étranger est alors chargé positivement, c’est un ion positif, voir l’exemple de l’arsenic (As) à la figure I.9.
Un matériau de silicium type n est un semi-conducteur dont la concentration en électrons est largement supérieure à celle des trous. En général, on introduit du phosphore, de l’arsenic ou encore de l’antimoine. Dans le cas du silicium dopé avec de l’arsenic, on associe à ce dernier un niveau donneur Ed dans la bande interdite très proche de la bande de conduction. L’intérêt est que pour les températures supérieures à 25 C, les atomes de As sont ionisés, ce qui se traduit par le passage des électrons du niveau donneur à la bande de conduction. Cependant, des paires électron-trou venant des atomes de silicium peuvent être générées par l’agitation thermique pour contribuer à la conduction électrique. Dans ce cas, les électrons sont nommés les porteurs de charge majoritaires et les trous sont des minoritaires. Le dopage du silicium se traduit pratiquement par une forte diminution de sa résistivité. En effet, pour un dopage au phosphore de l’ordre de 1014
atomes/cm3, la résistivité du silicium monocristallin donne lieu à une valeur de 40 .cm.
Figure I.9: Représentation schématique de la substitution d’un atome d’arsenic dans
un cristal de silicium. Si Si Si Si Si As Si Si Si
b)- Le dopage de type p
Le second type de dopage conduit au contrôle de la population des trous et donne lieu au silicium de type p. Ce type de dopage s’obtient en injectant dans le cristal de silicium des atomes étrangers possédant trois électrons de valence. Considérons par exemple l’insertion d’un atome de bore (B) dans un cristal de silicium. L’atome de bore, se substituant à un atome de silicium, établit des liaisons covalentes avec ses quatre voisins. Le bore ne possédant que trois électrons de valence, une des liaisons n’est pas saturée ce qui conduit à un déficit d’électron. A la température ambiante, l’électron manquant est facilement cédé par une liaison voisine, ce qui crée un trou dans la bande de valence. L’atome du bore est à présent entouré d’un électron supplémentaire par rapport à sa configuration élémentaire : le bore est devenu un ion chargé négativement ( ), voir la figure I.10. On associe alors au bore un niveau accepteur Ea dans la bande interdite très proche de la bande de valence. Ce type de dopage entraîne une augmentation de la concentration des trous dans la bande de valence et en conséquence on parle de dopage par atomes accepteurs et d’un semi-conducteur de type p. Par ailleurs, on note qu’un atome dopant donné joue le rôle de donneur ou d’accepteur selon qu’il possède une valence supérieure ou inférieure à celle des atomes du cristal hôte. Le type de dopage obtenu est donc conditionné à la fois par les éléments introduits et par les éléments du cristal hôte.
I.3.4.4 Courant de conduction
La densité du courant de conduction ⃗⃗⃗ sous l’effet du champ électrique ⃗⃗ a pour expression :
Figure I.10: Représentation schématique de la substitution d’un atome de
bore dans un cristal de silicium.
Si Si Si Si Si B Si Si Si Vacance d’électron
⃗⃗⃗ ( ) ⃗⃗ ( )
Pour un semi-conducteur de type , , l’équation ( ) devient :
⃗⃗⃗ ⃗⃗ ⃗⃗ ( )
Dans le cas d’un semi-conducteur de type p :
⃗⃗⃗ ⃗⃗ ⃗⃗ ( )
I.3.4.5 Courant de diffusion
Supposons que la densité des porteurs libre se trouve localement modifiée par un moyen quelconque. Sous l’action du gradient de concentration qui en résulte, les porteurs de charge diffusent des régions à forte concentration vers les régions à plus faible concentration. Le courant de diffusion ⃗⃗⃗ est proportionnel au gradient de concentration et à la constante de diffusion . On écrit :
⃗⃗⃗ ( )⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗ ( )
⃗⃗⃗ ( )⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗ ( )
La relation d’Einstein relie entre les mobilités des porteurs et leurs constantes de diffusion par :
( )
Dans le cas général, le courant provient des deux mécanismes. Les effets du champ électrique et du gradient de concentration se superposent. On écrit alors :
⃗⃗⃗ ⃗⃗ ( )⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗⃗ ( )
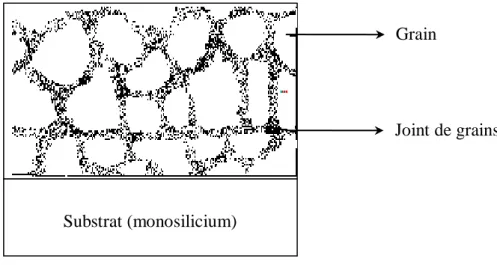
I.4 Silicium polycristallin
Le silicium polycristallin se présente comme un assemblage de petits cristaux ou grains d’orientations cristallographiques différentes, séparés les uns des autres par des zones fortement désordonnées appelées joints de grains (fig. I.11). La structure cristalline de ces grains est généralement assimilée à celle d’un monocristal de silicium, caractérisée par un arrangement périodique d’atomes exempt de défauts. Néanmoins, un grain peut présenter des sous joints dû à des réseaux de dislocations ou de macles engendrés lors de la croissance du matériau. D’autres parts, un très fort dopage des dépôts, dans le cas du bore, peut entraîner, au sein même du grain, l’apparition d’agrégats de nature amorphe [25].
Figure I.11 : Représentation schématique d’un film de silicium polycristallin.
I.4.1 Structure cristalline
La structure du silicium polycristallin, peut être colonnaire ou granulaire (voir la figure I.12) [26]. Le cristal de polysilicium se situe entre celle du silicium monocristallin et celle du silicium amorphe. Elle est constituée de grains dont la taille varie de quelques centaines de nanomètres à quelques millimètres suivant les conditions d’élaboration, séparés entre eux par des joints de grains.
Substrat (monosilicium)
Grain
(a) (b)
Figure I.12 : structure du silicium polycristallin : a) granulaire et b) colonnaire [26]
I.4.2 Défauts dans le silicium polycristallin
Dans la Silicium polycristallin on peut trouver en plus des lacunes et interstitiels d’autres défauts comme :
a)- Les joints de grains :
Les joints de grains délimitent des grains d’orientations différentes. Ils constituent des zones désordonnées, souvent assimilées à du silicium amorphe. Comme ce dernier, les joints de grains contiennent une forte densité de liaisons pendantes. Les joints de grains sont aussi le siège d’une ségrégation des éléments dopants qui deviennent inactifs. Cet effet est plus important si le rayon atomique du dopant est grand par rapport au rayon atomique du silicium ou lorsque la densité en éléments dopants augmente.
b)- Les défauts intra granulaires :
Parmi les défauts intra granulaires du silicium polycristallin, nous distinguons les dislocations les sous joints et les joints de macle.
– Les dislocations sont des défauts linéaires, créées à partir d’un glissement de certains plans atomiques par rapport à d’autres ou de la distorsion de deux régions adjacentes l’une par rapport à l’autre dans la structure cristalline. Elles sont engendrés par des chocs thermiques lors de l’élaboration du matériau ou encore à la présence d’impuretés. Ces défauts sont électriquement actifs, Une forte densité de dislocations entraine l’apparition de sous joints. – Les sous joints séparent à l’intérieur d’un cristal des zones d’orientation proche. En général, l’angle de désorientation est inférieur à 15 . Ces joints sont électriquement actifs à cause de la présence de dislocations.
– Les joints de macle correspondent à l’interface séparant une association de cristaux en croissance simultanée. Ils divisent donc un grain en plusieurs cristallites d’orientation
cristallographique proche. La désorientation entre deux grains formant la macle est de 60°.Ces joints de macle ne présentent pas de défauts intrinsèques tels que les dislocations. Par conséquent, ils ne sont pas ségrégatifs. La figure I.13 représente la densité des états dans la bande interdite du silicium polycristallin similaire à celle du silicium amorphe. Le désordre induit par les joints de grains et la distorsion des liaisons entre les atomes de silicium provoquent une distribution des états électroniques. Cela se traduit par l’apparition des états localisés dans la bande interdite au proche des bandes de conduction et de valence sous forme de queues de bandes. Les liaisons pendantes (liaisons non satisfaites) introduisent quant à elles deux états électroniques au milieu du gap.
Figure I.13 : Densité d’états en échelle logarithmique dans la bande interdite du silicium
polycristallin en présence de défauts (Ev : bande de valence, Ec: bande de conduction) [27].
Les grains peuvent être de différentes tailles. Leur qualité cristalline est fonction de la densité des défauts intra granulaires parmi lesquels les dislocations, les sous joints et les joints de macle. En présence de ces défauts, la structure de bande du silicium peut être modifiée. D’autre part, le silicium polycristallin a un niveau de pureté moins élevé par rapport au silicium monocristallin. La présence d’impuretés telles que l’oxygène, le carbone et les métaux de transition, pouvant être incorporées dans la couche lors de la fabrication du silicium polycristallin, limite la longueur de diffusion des porteurs minoritaires dans les applications telles que le photovoltaïque. D’autres impuretés peuvent être introduites intentionnellement dans le matériau par les procédés de dopage ou de passivation des défauts. Queues de bande Liaisons pendantes Énergie E Ec Ev D en si té d ’é ta ts N (E)
I.4.3 Elaboration et Méthodes de dépôts :
Le polysilicium peut être fabriqué par une large variété de techniques où les propriétés physiques et structurales diffèrent significativement [26]. Ces techniques se résument aux méthodes les plus courantes de dépôt. Elles sont en nombres de trois :
- pulvérisation
- évaporation sous vide
- dépôt chimique en phase vapeur (CVD)
Les principaux substrats utilisés sont le verre, le quartz, le silicium amorphe, le silicium monocristallin et le saphir. La nature de la couche déposée peut être monocristalline polycristalline ou amorphe et dépend partiellement de la nature du substrat utilisé qui est choisi suivant l’application envisagée [26].
Par ailleurs, les techniques de pulvérisation et de l’évaporation sous vide sont pratiquement abandonnées car elles nécessitent un matériel très coûteux et ne concernent qu’un seul substrat.
I.4.3.1 Dépôt chimique en phase vapeur (CVD) :
Dans l’industrie de la microélectronique, le dépôt chimique en phase vapeur est très utilisé pour réaliser des couches minces polycristallines par passage de gaz réactifs sur un substrat chauffé induisant une réaction thermique stimulée à la surface du substrat. Ce procédé utilise une chambre de réaction, généralement constituée d’un tube de quartz. Un bloc support chauffant fixe ou rotatif reçoit le substrat ; l’ensemble est complété par un système de tubes qui permettent d’amener les gaz dans la chambre. Nous verrons dans la suite que suivant la température de croissance, les réactions mises en jeu sont très différentes et qu’elles peuvent même conduire à des effets négatifs. Il faudra donc aussi contrôler les équilibres chimiques par injections des gaz de la décomposition de la source. Nous allons donner, ci-dessous, plus d’information sur ces différentes réactions.
Il existe différentes types de procédés suivant la source de silicium qui peut être du SiCl4, SiHCl3,SiH2Cl2 et du SiH4 [28].
1- à partir du tétrachlorosilane, SiCl4, la réaction est :
Elle s’effectue en général autour de 1250 C, ce qui entraîne une distribution importante des dopants.
2- à partir de trichlorosilane, SiHCl3, la réaction est :
( ) ( ) ⇔ ( ) ( )
Elle s’effectue en général autour de 1100 C , c’est la méthode industrielle la plus utilisée actuellement.
3- à partir de la pyrolyse du dichlorosilane, SiH2Cl2, la réaction est : ( ) ⇔ ( ) ( )
Cette réaction permet d’obtenir une bonne qualité du cristal avec une vitesse de dépôt élevée. L’ensemble des trois méthodes ci-dessus présente l’inconvénient de produire de l’acide chlorhydrique qui peut attaquer le silicium en cours de croissance.
4- à partir du silane, SiH4 :
→ ( ) ( )
Cette réaction s’effectue à 1000 C. La vitesse de dépôt est faible et le silane est un produit coûteux et dangereux.
Outre la CVD, il existe des techniques dérivées telle que : - LPCVD (Low Pressure Chemical Vapor Deposition).
- APCVD (Atmospheric Pressure Chemical Vapor Deposition). I.4.3.2 La technique APCVD :
La technique CVD à pression atmosphérique ou (APCVD) est actuellement presque abandonnée car elle nécessite un appareillage lourd et coûteux, présentant de faibles capacités de charges et ne permettant pas d’obtenir des dépôts uniformes [26]. D’où l’utilisation de la technique CVD à basse pression (LPCVD) qui en plus favorise la nucléation (formation de petits îlots à partir de l’arrivée d’atomes sur le substrat constituant le germe) [25].
I.4.3.3 La technique LPCVD :
Le dépôt chimique en phase vapeur sous faible pression (LPCVD) est actuellement le procédé standard d’obtention des couches du silicium polycristallin. Il permet une grande capacité de charge ; 200 rondelles peuvent être traitées à chaque opération de dépôt ainsi qu’une bonne reproductibilité des couches [26]. Le produit s’effectue à partir du silane (SiH4) ou du dichlorosilane (SiH2Cl2) au voisinage du substrat. La température utilisée est généralement d’environ 620 C sous une pression comprise entre 0,1Torr et 1Torr. La figure (I.12) représente un système LPCVD typique :
- Les rondelles sont placées verticalement dans un four à trois zones de chauffages.
- La réaction en surface contrôlant le dépôt et la température uniforme régnant dans le four commandent l’uniformité de l’épaisseur du dépôt [26].
- La vitesse de dépôt est de l’ordre de 100 /min [26].
Figure I.12 : Four de dépôt LPCVD [29].
Détecteur de pression Palier de charge et de décharge des films Trois zones de chauffage Pompe à vide
Introduction des gaz
Substrats Tube en quartz
Actuellement, on étudie le procédé (LPCVD) à très basses pressions qui permet de diminuer la température de cristallisation, le nombre de défauts, la rugosité de la surface et d’augmenter la taille des grains [26].
En outre, on peut obtenir un film de silicium polycristallin par deux techniques de dépôts par LPCVD :
As deposited : C’est un film de silicium polycristallin déposé directement sous forme polycristalline.
A-Si cristallisé : c’est un film de silicium polycristallin obtenu par cristallisation d’un film de silicium amorphe.
I.4.4 Structure des films du silicium polycristallin :
Deux méthodes sont utilisées pour étudier la structure des couches déposées sur des substrats différents :
- La diffraction des Rayons X qui permet de déterminer la nature des couches (cristallines ou amorphes) et de connaître la texture des couches polycristallines.
- La microscopie électronique à transmission qui apporte des informations sur la forme, la distribution et la taille des grains.
L’étude des couches déposées à des températures comprises entre 550 C et 700 C et à des pressions variant de 1mTorr à 1Torr, indique que leur structure aussi bien que leur orientation est essentiellement dû aux conditions de dépôt plutôt qu’à l’orientation du substrat [25]. La section des couches observée d’après [30] présente des grains en formes de colonnes. Certains grains s’étendent sur toute l’épaisseur de la couche (pour des épaisseurs atteignant 5000 Å). Leur taille moyenne est de quelques centaines d’angströms et est plus petite à l’interface substrat/polysilicium qu’à la surface supérieure de la couche. De plus, cette valeur moyenne mesurée à la surface de la couche augmente avec l’épaisseur [25,28].
I.4.4.1 Effet de la température de dépôt :
a)- Effet sur la nature de la couche déposée :
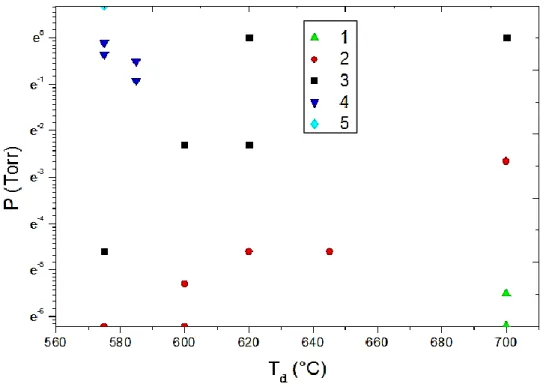
Les couches de silicium sont amorphes ou polycristallines selon la température et la pression régnant dans le four pendant le dépôt LPCVD. Comme le montre la figure (I.13) et les travaux déjà fait dans ce domaine [25,26], la température de transition entre ces deux états se situe vers 600°C.
- Pour des températures inférieures à 580°C les films de silicium déposés par LPCVD sont amorphes.
- Pour des températures comprises entre 580 et 600°C les films sont à dominantes amorphes.
Pour des températures comprises entre 600 et 620°C, on obtient des couches à dominantes polycristallines.
- Pour des températures supérieures ou égales à 620°C, les films sont polycristallins.
Figure I.13:Texture des couches en fonction de la température de dépôt et de la pression. 1. structure d’orientation aléatoire [25, 26]. 2. structure polycristalline d’orientation <100>. 3. structure polycristalline d’orientation <110>. 4. Structure polycristalline d’orientation <311>
5. structure amorphe.
b)- Effet sur la texture des couches :
La texture des couches dépend de la température de dépôt LPCVD (voir figure I.14) : - Vers 575°C, le silicium polycristallin déposé présente deux orientations préférentielles - <110> et <311> de ses grains dans la direction de croissance de la couche.
Figure I.14 : Effet de la température de dépôt sur la structure d’un film de silicium
polycristallin déposé par LPCVD, d’après [26].
(a)
(b)
Figure I.16 : Evolution de la texture en fonction de la température de recuit
(durée de recuit :60 min)[26]
a) Td=580°C épaisseur du film est 0,32 µm, Avant recuit la couche est amorphe.
c)- Effet sur la taille des grains :
La taille moyenne des grains d’un film de silicium polycristallin déposé par la technique LPCVD croit d’une manière approximativement linéaire avec la température de dépôt (voir figure I.15).
I.4.4.2 Effet des recuits thermiques :
La structure des films de polysilicium déposé par LPCVD est fortement influencée par les conditions de recuits. Le matériau amorphe peut se transformer en matériau polycristallin lors des recuits à plus de 900°C [31]. La texture de ces films cristallisés dépend de la température de recuit (figure I.16.a) : l’orientation <311> est prédominante mais l’intensité de l’orientation <111> augmente vers les hautes températures de recuits et celle de <311> diminue. Par contre la figure (I.16.b) montre que les recuits jusqu’à 1000 C affectent peu la texture pour les couches initialement polycristallines après dépôt et l’orientation <110> reste prédominante. Néanmoins, à 1100 C l’intensité de l’orientation <110> décroît d’une façon importante, par suite d’un arrangement de la structure dû à une décroissance significative de la taille des grains [32]. Par contre, la taille moyenne des grains (figure I.17) augmente avec la température de recuit. Cette augmentation d’après [25] est proportionnelle à la racine carrée de la durée de recuit, et elle est attribuée à la diffusion des atomes de silicium à travers les joints de grains [33].
I.4.4.3 Effet du dopage :
La taille des grains augmente en fonction de la concentration de dopant et de l’espèce dopante. Suivant ces deux facteurs, le coefficient de diffusion du silicium varie différemment, en relation avec la création des lacunes et la ségrégation du dopant. Mandurah [8] a observé que la taille moyenne des grains dans une couche de silicium polycristallin dopée Arsenic ou Bore, avec une concentration inférieure à 2.1019 atomes/cm3, est approximativement la même que celle des grains d’un film non dopé, recuit à la même température. Par contre pour des concentrations de dopants supérieures à 2.1019 atomes/cm3, la taille moyenne des grains augmente (voir figure I.18). Cependant la croissance des grains est plus faible pour les films dopés à l’Arsenic ; cela est dû probablement à la forte ségrégation de l’Arsenic aux joints de grains qui est plus importante que celle du phosphore. La taille moyenne des grains dans une couche dopée au bore augmente légèrement avec le dopage et reste inférieure à celle des grains d’une couche dopée à l’Arsenic ou au phosphore.
Figure I.17 : Taille moyenne des grains en fonction de la température de recuit pour
différentes concentrations [26] :
(1) Dopé phosphore à 3,8 1018 cm-3
(2) Dopé arsenic à 5,4 1019 cm-3.
(3) Dopé phosphore à 9 1020 cm-3
Figure I.18 : Taille moyenne des grains en fonction du dopant [34]: (1) Dopé Arsenic puis recuit à 1000°C.
(2) Dopé Arsenic puis recuit à 1100°C. (3) Dopé Phosphore puis recuit à 1100°C
I.5 Conclusion
Le présent chapitre est dédié en particulier à la structure monocristalline et polycristalline du silicium. En effet, nous avons rappelé quelques méthodes d’élaboration du silicium monocristallin, en particulier celle obtenue par le procédé Czochralski. L’objectif étant d’obtenir des plaquettes monocristalline de bonne qualité cristallographique. Nous avons également rappelé les propriétés structurales et électriques du silicium monocristallin où nous avons constaté que les défauts de type cristallographique et chimiques peuvent être éliminés par effet Getter ou encore passivés par l’introduction des atomes d’hydrogène. Plus tard, nous avons abordé le silicium polycristallin du point de vue élaboration et caractérisation. Nous avons pu identifier la texture, la structure des grains, la distribution et la taille des grains sous l’influence des différents paramètres expérimentaux.
___________________
Chapitre II
________________
_______________________________
Modèles théoriques
et aspect expérimental
de l’oxydation thermique sèche
du silicium
II.1 Introduction
L’intérêt sans cesse croissant, porté par la technologie planer au traitement d’oxydation thermique du silicium lors de la fabrication des composants électroniques, a poussé de nombreux scientifiques dans le monde à orienter leurs travaux vers ce créneau. Il s’agit, en effet, de comprendre le déroulement de ce processus et par la suite pouvoir le contrôler. Plusieurs modèles ont ainsi formulé, dont le plus célèbre est celui de Deal et Grove [35]. Ces derniers ont réussi à modéliser les mécanismes de l’oxydation et à avancer l’évolution de la couche d’oxyde thermique du silicium par une loi polynomiale. Mais, si ce modèle a donné des résultats assez satisfaisants pour l’oxydation humide et pour des oxydes épais sous oxygène sec, il demeure incapable de modéliser les oxydes minces . Ceci a donné naissance à d’autres tentatives de modélisation pour apporter une meilleure description du phénomène d’oxydation. En effet, on trouve dans la littérature plusieurs modèles, en particuliers, ceux de Naïto et al. [36], Han et Helms [37], et Reisman et al. [38]. Ces derniers restent des modèles dérivés de celui de Deal et Grove.
Dans ce deuxième chapitre, nous allons passer en revue les différents modèles mathématiques cités dans la littérature pour le suivi de l’oxydation thermique sèche du silicium monocristallin. De plus, nous présenterons les échantillons préparés pour subir des recuits thermiques sous oxygène sec avec leurs propriétés d’élaborations. Le four d’oxydation est aussi dénoté avec les divers détails pour mieux cerner les difficultés liées à la procédure expérimentale.
II.2 Oxydation thermique du silicium
II.2.1 Processus chimiques d’oxydation thermique du silicium
L’oxydation thermique du silicium peut se faire sous flux d’oxygène pur (oxydation sèche) ou d’oxygène chargé de vapeur d’eau (oxydation humide) à des températures généralement comprises entre 900°C et 1200°C.
Les réactions chimiques qui ont lieu dans les deux cas sont : Oxydation sèche (Dry oxidation) :
→
Oxydation humide (Wet oxidation):
→
L’oxydation sèche à haute température (> 1100°C) produit des oxydes fins présentant de bonnes propriétés électriques à l’interface SiO2/Si qui sont utilisés par exemple comme oxyde de grille de transistors MOSFET. Les oxydes humides épais présentent de faibles qualités électriques mais sont utilisés comme isolants (oxydes de champ) entre le substrat et les lignes de métallisation.
II.2.2 Cinétique simplifiée de la croissance de l’oxyde thermique
La cinétique de croissance de l’oxyde thermique dépend en effet de nombreux facteurs. Les facteurs prépondérants sont :
• le type d’oxydation (sec, humide) • la température
• la durée de l’oxydation
• l’orientation cristalline du substrat à oxyder D’autres facteurs interviennent comme :
• l’état cristallin ou polycristallin du substrat • la pression partielle de l’espèce oxydante • le dopage du substrat
• l’état de surface du substrat (procédure de nettoyage).
II.3 Présentation des principaux modèles théoriques de modélisation II.3.1 Modèle de Deal et Grove :
D’un point de vue historique, le modèle de Deal et Grove [35] est de la plus grande importance dans l’étude du phénomène d’oxydation du silicium monocristallin. Etabli en 1965, les deux auteurs étudient le processus d’oxydation en termes de phénomènes physico-chimiques. Leur modèle de base est représenté sur la figure (II.1).
Figure II.1: Modélisation selon Deal et Grove de l’oxydation du silicium
mettant en jeu une seule espèce oxydante.
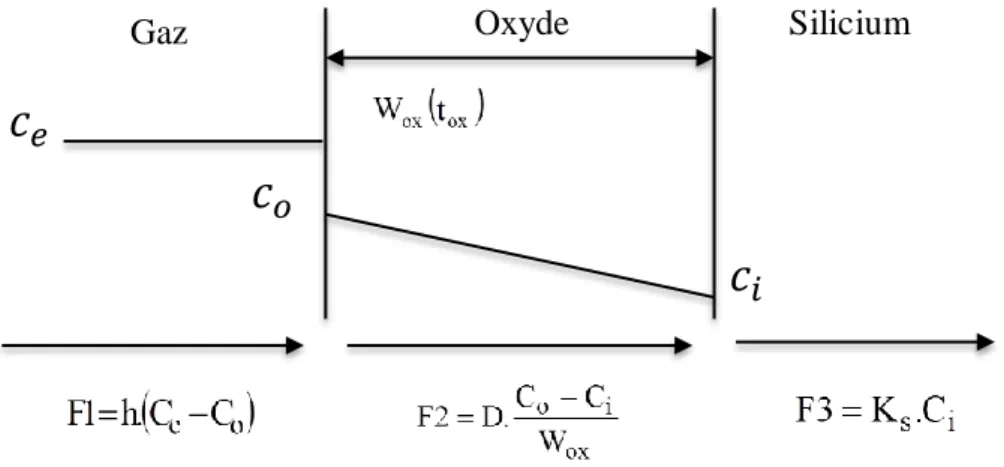
Il prend en compte une seule espèce oxydante du type moléculaire : O2ou H2O dans le cas d’une oxydation sèche ou humide, respectivement. Le mouvement des espèces oxydantes s’effectue du gaz vers la surface du silicium où elles rentrent en réaction avec les atomes de silicium. Ce comportement peut être décrit en trois différentes phases :
1- Transport des espèces oxydantes du volume du gaz vers l’interface gaz/oxyde où elles réagissent, ou bien absorbées (coefficient caractéristique ).
2- Les espèces oxydantes traversent l’oxyde par diffusion en direction de l’interface avec le silicium (coefficient caractéristique ).
3- Elles interagissent avec les atomes du silicium pour former une nouvelle couche d’oxyde (coefficient caractéristique ).
Le calcul est basé sur l’analyse des flux des espèces oxydantes dans les différentes zones indiquées sur la figure II.1. L’établissement du régime permanent impose l’égalité des trois flux. Ainsi, le taux de croissance de l’oxyde est décrit par l’équation différentielle suivante :
( II.1)
Où :𝑐
𝑖𝑐
𝑜𝑐
𝑒, est le coefficient de transport dans la phase gazeuse. , est le taux de réaction à l’interface .
, est le coefficient de diffusion de l’espèce oxydante à travers l’oxyde.
et sont les concentrations respectives de l’espèce oxydante aux interfaces et .
, la concentration d’équilibre de la molécule oxydante dans le gaz.
, la concentration d’équilibre de la molécule oxydante par unité de volume dans l’oxyde.
Le taux d’oxydation prend simplement la forme de l’expression suivante :
(II.2)
où A et B sont des constantes indépendantes de t et Wox, s’exprimant comme suit :
h 1 K 1 D . 2 A s (II.3) et N C . D . 2 B e (II.4) En supposant qu’au temps t0, l’épaisseur de l’oxyde est Wi , il vient après intégration :
( ) (II.5) d’où l’on tire :
2 A τ t B 4 A W 2 1 2 ox (II.6)Dans l’expression (II.6),
BAW W
τ i2 i définit un décalage dans le temps, et correspondant à une couche d’oxyde initialeWi.
- pour des temps relativement importants tτ et B . 4 A t 2 on aura : (II.7) Dans ce cas, l’oxydation évolue sous forme d’une loi parabolique et B est appelée constante de régime parabolique. Ce régime est applicable lorsque le phénomène d’oxydation est globalement limité par une faible diffusion de l’espèce oxydante dans la couche d’oxyde.
- pour des temps relativement courts
B . 4 A t 2 et tτ on a : ( ) (II.8) c’est une loi linéaire avec :
K h
. N C . h . K A B s e s (II.9) AB est appelé constante du régime linéaire. On le rencontre dans le cas où les coefficients de
transport et seraient faibles.
Les résultats de l’étude de Deal et Grove, résumée dans les tableaux ci-dessous montre que les coefficients A,Bet τ dépendent fortement de la température d’oxydation et du type d’espèce oxydante, sèche ou humide.
Température d’oxydation (°C) A (µm) B (µm 2 /h) ( ) ( ) 1200 0,05 0,72 14,40 0 1100 0,11 0,51 4,64 0 1000 0,226 0,287 1,27 0 920 0,5 0,203 0,406 0
Température d’oxydation (°C) A(µm) B(µm 2 /h) ( ) ( ) 1200 0,04 0,045 1,12 0,0019 1100 0,09 0,027 0,30 0,00693 1000 0,165 0,0117 0,071 0,029 920 0,235 0,0049 0,0208 0,098 800 0,370 0,001 0,0030 0,687 700 ……. …… 0,00026 7,81
Tableau II.2 : Les constantes d’oxydation pour une oxydation sèche du silicium [35].
La cinétique d’oxydation à l’interface tient compte du nombre d’atomes disponibles pour la réaction chimique. Lorsque les plans sont plus denses, la vitesse d’oxydation est légèrement supérieure comme la figure II.2 le montre. C’est le cas de l’oxydation d’un substrat orienté <111> comparé à celui de <100>.
Figure II.2: Effet de l'orientation cristalline sur la croissance d'oxyde d’après
Deal et Grove [35]. <111> Si <100> Si 900°C 100 10-1 10-2 E p ais se u r d ’oxy d e (m ic ron s) 10-1 100 101 Temps d’oxydation (h)
Les coefficients intervenants dans les tableaux (II.1) et (II.2) varient très fortement en fonction de la température. Comme dans le cas de la diffusion d’atomes dopants dans le cristal, la diffusion des éléments oxydants dans l’oxyde sera thermiquement activée suivant la loi d’Arrhenius.
Figure II.3 : Effet de la température sur le coefficient d'oxydation parabolique dans les cas
d'oxydation sèche, humide et vapeur. La variation suit la loi d'Arrhénius d'après Deal et Grove [35].
Etant donné que, B est proportionnelle au coefficient de diffusion,D, alors les énergies d’activation trouvées par les deux auteurs sont respectivement 0,70 et 1,24 eV pour l’oxydation humide et sèche, comme la figure II.3 le montre. La constante linéaire
A B
est donnée également par une loi du même type, avec une énergie d’activation de l’ordre de 2 eV.
Notons, de plus, que Deal et Grove ont montré que la constante parabolique B est proportionnelle à la pression partielle de l’espèce oxydante dans le gaz. Ce résultat a été prévu en se basant sur la loi d’Henry qui, à l’équilibre, prévoit que la concentration d’équilibre Ce est proportionnelle à la pression.
100 10-1 10-2 10-3 10-4 0,7 0,8 0,9 1,0 1,1 1,2 C on st an te p ar ab ol iq u e B ( µ m 2 /h ) 1000/T(K-1) Oxydation humide EA = 0,71 eV 640 mTorr H2O Oxydation Vapeur EA = 0,71 eV 760 mTorr H2O Oxydation sèche EA = 1,24 eV 640 mTorr O2
![Figure I.7 : Schéma du processus de l’effet Getter avec ces trois étapes (d’après [17])](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/16.892.104.786.348.883/figure-schéma-processus-l-effet-getter-étapes.webp)
![Figure I.13 : Densité d’états en échelle logarithmique dans la bande interdite du silicium polycristallin en présence de défauts (Ev : bande de valence, Ec: bande de conduction) [27]](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/26.892.257.629.419.747/densité-échelle-logarithmique-interdite-silicium-polycristallin-présence-conduction.webp)
![Figure I.14 : Effet de la température de dépôt sur la structure d’un film de silicium polycristallin déposé par LPCVD, d’après [26].](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/32.892.169.725.111.500/figure-effet-température-dépôt-structure-silicium-polycristallin-déposé.webp)
![Figure I.16 : Evolution de la texture en fonction de la température de recuit (durée de recuit :60 min)[26]](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/33.892.166.725.105.1007/figure-evolution-texture-fonction-température-recuit-durée-recuit.webp)
![Figure I.17 : Taille moyenne des grains en fonction de la température de recuit pour différentes concentrations [26] :](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/35.892.184.742.111.499/figure-taille-moyenne-grains-fonction-température-recuit-concentrations.webp)
![Tableau II.1 : Les constantes d’oxydation pour une oxydation humide du silicium [35].](https://thumb-eu.123doks.com/thumbv2/123doknet/13905290.448424/42.892.133.760.827.1034/tableau-ii-constantes-oxydation-oxydation-humide-silicium.webp)