UNIVERSITE MOHAMMED V - RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT-
ANNEE: 2017 THESE N°:114
LA THROMBASTHENIE DE GLANZMANN
THESE
Présentée et soutenue publiquement le :………..
PAR
Mr. Mounir AMEARAS
Né le 01 Janvier 1992 à Marrakech
Pour l'Obtention du Doctorat en pharmacie
MOTS CLES : Intégrine αIIbβ3 – Plaquette sanguine – Thrombasthénie de Glanzmann – ITGA2B ITGB3 – Facteur VII activé recombinant.
JURY
Mme. M. NAZIH PRESIDENTE Professeur d’Hématologie Biologique
Mr. A. MASRAR RAPPORTEUR
Professeur d’Hématologie Biologique Mr. A. DAMI
Professeur de Biochimie JUGES Mme. S. BENKIRANE
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie Professeur Jamal TAOUFIK
Secrétaire Général : Mr. Mohamed KARRA
1- ENSEIGNANTS-CHERCHEURS MEDECINS
ET
PHARMACIENS
PROFESSEURS : Décembre 1984
Médecine Interne – Clinique Royale Pr. MAAOUNI Abdelaziz
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pathologie Chirurgicale Pr. BENSAID Younes
Janvier, Février et Décembre 1987
Gastro-Entérologie Pr. CHAHED OUAZZANI Houria
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décem bre 1988
Chirurgie Pédiatrique Pr. BENHAMAMOUCH Mohamed Najib
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. CHAD Bouziane Pathologie Chirurgicale
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie Janvier et Novembre 1990
Pathologie Chirurgicale Pr. CHKOFF Rachid
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. MANSOURI Fatima Anatomie-Pathologique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Anatomie-Pathologique Pr. AL HAMANY Zaîtounia
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique
Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. TAOUFIK Jamal Chim ie thérapeutique V.D à la pharmacie+Dir du
Décembre 1992
CEDOC
Pr. AHALLAT Mohame d Chirurgie Générale V.D Aff. Acad. et Estud
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Radiothérapie Pr. BENJAAFAR Noureddine
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocr inologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. JELTHI Ahmed Anatomie Pathologique
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. JALIL Abdelouahed Chirurgie Générale
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Réanimation Médicale
Pr. ABOUQUAL Redouane
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur HMI Med V
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décem bre 1996
Radiologie
Pr. AMIL Touriya*
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novem bre 1997
Gynécologie-Obstétrique Pr. ALAMI Mohamed Hassan
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Gastro-Entérologie Pr. AFIFI RAJAA
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Janvier 2000
Pneumophtisiologie Pr. ABID Ahmed*
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie- Dir. Hop. Av. Marr.
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Inspecteur du SSM
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Neurologie Pr. AIDI Saadia
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hop. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Anesthésie-Réanimation Pr. BALKHI Hicham*
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hop.d’Enfants
Pr. GAZZAZ Miloudi* Neuro- Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décem bre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocr inologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stom atologie et Chirurgie Maxillo -faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005 Anesthésie Réanimation Pr. CHANI Mohamed Avril 2006 Rhumatologie Pr. ACHEMLAL Lahsen*
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Réanimation médicale Pr. ABIDI Khalid
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSM
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHARKAOUI Naoual* Pharmacie galénique
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologique
Pr. MRABET Mustapha*
Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décem bre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décem bre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Médecine interne Pr. ABOUZAHIR Ali*
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique
Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie Directeur Hôpita l My Ismail
Pr. LAMSAOURI Jamal* Chimie Thérapeutique
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. ZOUAIDIA Fouad Anatomie pathologique Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique
Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Infor m atique Pharm aceutique
0.
Anesthésie Réanimation Pr. BENSGHIR Mustapha*
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed
Ali Anesthésie Réanimation
Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. OUKABLI Mohamed* Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stom atologie et Chirurgie Maxillo -faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
MARS 2014 ACHIR ABDELLAH BENCHAKROUN MOHAMMED BOUCHIKH MOHAMMED EL KABBAJ DRISS EL MACHTANI IDRISSI SAMIRA HARDIZI HOUYAM HASSANI AMALE HERRAK LAILA
JANANE ABDELLA TIF JEAIDI ANASS
KOUACH JAOUAD LEMNOUER ABDELHAY MAKRAM SANAA OULAHYANE RACHID
RHISSASSI MOHAMED JMFAR SABRY MOHAMED
SEKKACH YOUSSEF TAZL MOUKBA. :LA.KLA.
*
Enseignants Militaires DECEMBRE 2014ABILKACEM RACHID' AIT BOUGHIMA FADILA BEKKALI HICHAM BENAZZOU SALMA BOUABDELLAH MOUNYA BOUCHRIK MOURAD DERRAJI SOUFIANE DOBLALI TAOUFIK
EL AYOUBI EL IDRISSI ALI
EL GHADBANE ABDEDAIM HATIM EL MARJANY MOHAMMED FE]JAL NAWFAL JAHIDI MOHAMED LAKHAL ZOUHAIR OUDGHIRI NEZHA Rami Mohamed SABIR MARIA
SBAI IDRISSI KARIM *Enseignants Militaires Chirurgie Thoracique Traumatologie- Orthopédie Chirurgie Thoracique Néphrologie Biochimie-Chimie Histologie- Embryologie-Cytogénétique Pédiatrie Pneumologie Urologie Hématologie Biologique Génécologie-Obstétrique Microbiologie Pharmacologie Chirurgie Pédiatrique CCV Cardiologie Médecine Interne Génécologie-Obstétrique Pédiatrie Médecine Légale Anesthésie-Réanimation Chirurgie Maxillo-Faciale Biochimie-Chimie Parasitologie Pharmacie Clinique Microbiologie Anatomie Anesthésie-Réanimation Radiothérapie
Chirurgie Réparatrice et Plastique O.R.L
Cardiologie
Anesthésie-Réanimation Chirurgie Pédiatrique Psychiatrie
AOUT 2015
Meziane meryem Dermatologie
Tahri latifa Rhumatologie
JANVIER 2016
BENKABBOU AMINE Chirurgie Générale
EL ASRI FOUAD Ophtalmologie
ERRAMI NOUREDDINE O.R.L
NITASSI SOPHIA O.R.L
2- ENSEIGNANTS – CHERCHEURS SCIENTIF IQUES
PROF ESSE UR S / PRs. HABILIT ES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. BOURJOUANE Mohamed Microbiologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique
Pr. EL GUESSABI Lahcen Pharmacognosie
Pr. ETTAIB Abdelkader Zootechnie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique
Pr. IBRAHIMI Azeddine Biologie moléculaire
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 14/12/2016 par le
DEDICACES
À MES TRÈS CHERS PARENTS
Aucune dédicace ne saurait exprimer mon respect, mon amour éternel et ma
considération pour les sacrifices que vous avez consenti pour mon instruction et
mon bien être.
Je vous remercie pour tout le soutien et l’amour que vous me portez depuis
mon enfance et j’espère que votre bénédiction m’accompagne toujours.
Que ce modeste travail soit l’exaucement de vos vœux tant formulés, le
fruit de vos innombrables sacrifices, bien que je ne vous en acquitterai jamais
assez.
Puisse Dieu, le Très Haut, vous accorder santé, bonheur et longue vie et
faire en sorte que jamais je ne vous déçoive.
À MA CH
ÈRE GRAND M
ÈRE
Aucune dédicace ne saurait exprimer tout ce que je ressens pour toi. Je te
remercie pour tout le soutien exemplaire et l'amour exceptionnel que tu me portes
depuis mon enfance et j'espère que ta bénédiction m'accompagnera toujours.
À LA MÈMOIRE DE MES GRAND-PÈRES
ET MA GRAND MERE
J’aurais tant aimé que vous soyez présents.
Que Dieu ait vos âmes dans sa sainte miséricorde.
À MON CHER FRÈRE
Pour toute l’ambiance dont tu m’as entouré, pour toute la spontanéité et
ton élan chaleureux, Je te dédie ce travail. Puisse Dieu le tout puissant exhausser
tous tes vœux.
À MA GRANDE FAMILLE
Merci pour vos encouragements. Je vous dédie ce modeste travail et je
prie Dieu qu’il vous garde.
À MES AMI(E)S DE TOUJOURS
En souvenir de notre sincère et profonde amitié et des moments agréables
que nous avons passés ensemble. Veuillez trouver dans ce travail l’expression de
mon respect le plus profond et mon affection la plus sincère.
UNE SPÉCIALE DÉDICACE A CETTE PERSONNE QUI
COMPTE ÉNORMÉMENT POUR MOI, ET POUR QUI JE PORTE
À TOUTES LES PERSONNES QUI ONT PARTICIPÉ A
L’ÉLABORATION DE CE TRAVAIL À TOUS CEUX QUE J’AI OMIS
DE CITER
À NOTRE MAITRE ET PRÉSIDENTE DE THÈSE
MADAME LE PROFESSEUR NAZIH MOUNA
PROFESSEUR AGRÉGÉ D’HÉMATOLOGIE
Pour le très grand honneur que vous nous faites en acceptant de juger et de
présider notre thèse.
Nous vous conservons toujours notre profonde reconnaissance en souvenir
de votre modestie de savoir.
Nous vous prions de trouver, ici, le témoignage de notre profond respect et
de notre haute estime
À NOTRE MAITRE ET RAPPORTEUR DE THÈSE
MONSIEUR AZLARAB MASRAR
PROFESSEUR D’HÉMATOLOGIE BIOLOGIQUE
Je vous remercie de la confiance que vous m’avez témoignée en me
confiant ce travail.
Ma reconnaissance n’a d’égale que mon admiration et mon respect pour
vos qualités scientifiques, intellectuelles et humaines.
Veuillez recevoir l’expression de mon profond respect et de ma très grande
considération.
À NOTRE MAITRE ET JUGE DE THÈSE
MONSIEUR LE PROFESSEUR DAMI ABDALLAH
PROFESSEUR AGRÉGÉ DE BIOCHIME
Je vous remercie de l’attention que vous portez à cette thèse, d’avoir accepté
sans me connaître de juger ce travail et de m’accorder de votre temps.
À NOTRE MAITRE ET JUGE DE THÈSE
MADAME LE PROFESSEUR BENKIRANE SOUAD
PROFESSEUR D’HÉMATOLOGIE
Nous sommes très heureux de l’honneur que vous nous faites en acceptant de
juger notre travail.
Votre présence est pour nous, l’occasion de vous exprimer notre admiration de
votre grande compétence professionnelle et de votre généreuse sympathie.
Veuillez trouver à travers ce modeste travail la manifestation de notre plus
haute estime, de nos sentiments les plus respectueux et de notre reconnaissance.
Merci.
Table des matières
INTRODUCTION ... 1
PARTIE I : ... PHYSIOPATHOLOGIE DE THROMBASTHENIE DE GLANZMANN ... 4
I. RAPPEL PLAQUETTES SANGUINES ET HÉMOSTASE PRIMAIRE ... 5 1. Plaquettes ... 5 1.1. Réponse plurifonctionnelle plaquettaire... 8 1.2. Les différents constituants de la plaquette et leurs principales fonctions ... 9 2. Hémostase primaire ... 9 2.1. Adhésion... 10 2.2. Activation ... 10 2.3. Agrégation ... 11 II. LA PHYSIOPATHOLOGIE... 12 1. Structure de l’intégrine αIIb-β3 :... 13 1.1. Domaine extracellulaire ... 14 1.1.1. Sous-unité αIIb... 14 1.1.2. Sous-unité β3 ... 18 1.2. Domaine transmembranaire ... 19 1.3. Domaine cytoplasmique ... 20 2. Fonction de l’intégrine ... 21 2.1. Inside-Out signaling ... 21 2.2. Outside-In signaling ... 23 III. SPECTRE MUTATIONNEL DES GENES ITGA2B / ITGB3 ET RELATION STRUCTURE-FONCTION DE LA PROTEINE αIIbβ3 ... 24
1. Structure, expression ... 24 2. Spectre mutationnel des gènes ITGA2B / ITGB3... 26 2.1. Particularités des mutations du site d’épissage ... 29 2.2. Mutation gitane ... 29
PARTIE II : ... THROMBASTHENIE DE GLANZMANN : DU DIAGNOSTIC AU TRAITEMENT.. 30
I. DIAGNOSTIC DE LA THROMBASTHENIE DE GLANZMANN ... 31 1. Aspects Cliniques ... 31 2. Aspects Biologiques ... 32 2.1. Etape pré-analytique :... 32 2.2. Tests réalisés : ... 32 a. La numération plaquettaire ... 32 b. Le temps de saignement ... 33 c. Le temps d’occlusion... 35 d. L’agrégation plaquettaire... 36 e. La cytométrie en flux... 42 f. Rétraction du caillot ... 44 2.3. Examens supplémentaires : ... 45
II. TRAITEMENT DE LA THROMBASTHENIE DE GLANZMANN ... 47 1. Gestion conservatrice des saignements mineurs ... 47 2. La transfusion plaquettaire ... 48 3. Le facteur VIIa recombinant ... 49 3.1. Facteur VII activé : structure, préparation ... 50 3.2. Mode d’action du Facteur VII activé recombinant : ... 51 3.3. Utilisation du Facteur VII activé recombinant dans la thrombasthenie de
Glanzmann ... 55 a. Enquête internationale sur rFVIIa et GT (1989-2004) ... 55 b. Registre de Thrombasthénie de Glanzmann (GTR) (2007-2011) : ... 56 c. RFVIIa: d'autres rapports de cas et séries de cas, et l'importance du traitement précoce ... 57 3.4. Surveillance du traitement :... 58 3.5. Effets indésirables du facteur VII activé recombinant ... 58
CONCLUSION ... 59
RESUME ... 60
Liste des figures
Figure 1 : Représentation schématique d‟une plaquette ... 5 Figure 2 : (A) Formation de proplaquettes par des mégacaryocytes murins en culture,
révélées par Immunofluorescence de la β-tubuline . (B) Image de microscopie électronique des plaquettes. ... 7
Figure 3 : Etapes de la réponse plaquettaire ... 8 Figure 4 : Représentation schématique de la structure de l‟intégrine αIIbβ3 ... 15 Figure 5 : Modélisation 3D du domaine β-propeller de la sous-unité αIIb ... 17 Figure 6 : Représentation 3D des sites de coordination des ions métalliques du domaine β-I
de la sous unité β3 ... 19
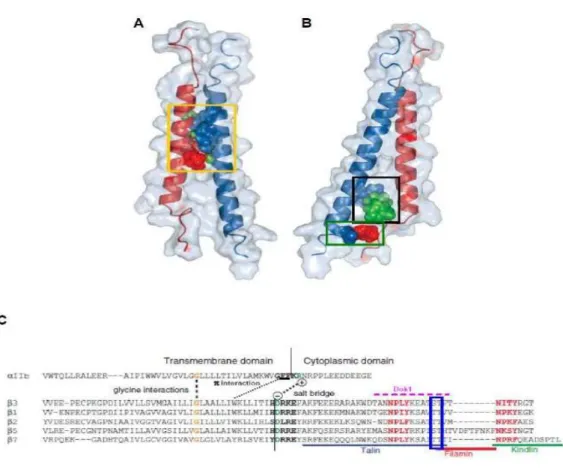
Figure 7 : (A,B) Représentation 3D des segments transmembranaires des sous-unités αIIb et
β3.(C) Représentation des différentes interactions des segments transmembranaires... 21
Figure 8 : La signalisation inside-out conduit à un changement conformationnel d‟αIIbβ3 qui
se traduit par une augmentation d‟affinité pour son ligand ... 22
Figure 9 : Outside-In signaling ... 23 Figure 10 : Représentation schématique du gène codant pour la sous-unité αIIb... 25 Figure 11: Représentation schématique du gène codant pour la sous-unité β3 (ITGB3) avec
les différentes anomalies génétiques pouvant mener à la TG chez l‟homme... 25
Figure 12 : Représentation des mutations répertoriées à ce jour au niveau des gènes ITGA2B
et ITGB3 (D‟après, Nurden AT, 2012)... 27
Figure 13 : Agrégation plaquettaire par inducteurs physiologiques chez un sujet atteint de
thrombasthénie de Glanzmann... 37
Figure 14 : Agrégation plaquettaire à la ristocétine chez un sujet atteint de thrombasthénie
de Glanzmann... 38
Figure 15: Agrégation plaquettaire par inducteurs physiologiques chez un sujet témoin non
atteint de thrombasthénie de Glanzmann... 39
Figure 17 : Principe du Mulitplate ... 42 Figure 18 : Représentation schématique des anomalies d'agrégation plaquettaire typiques
des principales thrombopathies ... 43
Figure 19 : Défaut d‟expression du complexe à la surface des plaquettes mesurée par
cryométrie en flux à l‟aide d‟anticorps monoclonaux reconnaissant différents épitopes. Á noter une expression normale de la sous-unité GPIb, qui n‟est pas affectée dans cette maladie
... 43 Figure 20 : Formation d‟un caillot et sa rétraction. ... 44 Figure 21 : Phase d‟initiation de la coagulation. ... 52 Figure 22 : Phase d‟amplification de la coagulation... 52 Figure 23 : Phase de propagation ... 53 Figure 24 : Mécanisme d‟action schématique du facteur VII activé recombinant au sein d‟une
Liste des tableaux
Tableau I : Les différents constituants de la plaquette et leurs principales fonctions ... 9 Tableau II : Alloantigènes plaquettaires présents sur les gènes Tableau IIIITGA2B et
ITGB3. ... 28
Tableau III : Diagnostic et classification de la thrombasthénie de Glanzmann. ... 46 Tableau IV : Registre de Thrombasthénie de Glanzmann: Traitement de (A) épisodes de
Liste des abréviations
ADNC : Acide désoxyribonucléique complémentaire. ADP : Adénosinediphosphate
Arg : Arginine
ARN : Acideribonucleique
ARNm : Acideribonucleique messager Asp : Acide Aspartique
AT : Antithrombine
ATP : Adénosine triphosphate Ca : Calcium
CPA : Concentré de plaquettes d'aphérèse CPS : Concentré de plaquttes standard DDAVP : Desmopressine
EDTA : Ethylène diamine tétraacétique FITC : Isothiocyanate de fluorescéine
FSAP : Plasminogen activator-activating protease FT : Facteur tissulaire
Facteur I : Fibrinogène Facteur II : Prothrombine Facteur V : Proaccélérine Facteur VII : Proconvertine
Facteur VIII : Facteur antihémophilique A Facteur IX : Facteur antihémophilique B Facteur X : Facteur Stuart
Facteur XI : Facteur rosenthal Facteur XII : Facteur hageman
Facteur XIII : Facteur stabilisant de la fibrine FVW : Facteur de Von Willebrand
GPIIb/IIIa : Glycoprotéine IIb/IIIa GPIb : Glycoprotéine Ib
Ig : Immunoglobuline KDa : Kilodalton
MEA : Multiple Electrode Aggregometry MIDAS : Metalion dependent adhesion PFA-100 : Temps d'occlusion plaquettaire PLS : Produits sanguins labiles
PRP : Plasma riche en plaquettes PSI : Plexin-Semaphorin-Intégrine rFVIIa : Facteur VII recombinant activé
RGDS : Arginine-Glycine-Acide aspartique-Serine SDS : Dodécylsulfate de sodium
TAFI : Thrombin activable fibrinolysis inhibitor TCA : Temps de céphaline activé
TG : Thrombasthénie de Glanzmann TQ : Temps de Quick
TS : Temps de saignement TxA2 : Thromboxane A2 VWF : Facteur Willebrand
1
2
Les pathologies plaquettaires d’origine génétique constituent un groupe hétérogène de maladies rares. Elles peuvent aussi bien être responsables d’anomalies de la production des plaquettes (thrombopénie) que de leurs fonctions (thrombopathie). Ces pathologies constituent un modèle pour la compréhension des mécanismes conduisant à l’activation et à la production de ces cellules. Les atteintes spécifiques de certaines protéines ont permis de mieux comprendre par exemple, comment elles étaient capables d’interagir avec le milieu extracellulaire ou bien comment elles étaient capables d’être produites correctement.
La pathologie plaquettaire constitutionnelle la plus fréquente et la mieux connue à ce jour reste la thrombasthénie de Glanzmann (TG).
Cette pathologie (TG) a été décrite pour la première fois en médecine humaine, en 1918 [1]. La thrombasthénie de Glanzmann est une dysfonction plaquettaire causée par une anomalie génétique qui peut toucher différents gènes. Ces gènes codent pour un groupe de protéines normalement reliées entre elles et présentes à la surface des plaquettes : il s’agit du complexe glycoprotéique IIb/IIIa (ou récepteur du fibrinogène). Lorsque ce récepteur est absent ou qu’il ne fonctionne pas correctement, les plaquettes ne collent pas (ne s’agrègent pas) les unes aux autres au siège de la lésion, ce qui entrave la coagulation du sang.
Il existe plusieurs types de TG [1] : les types I, II et les variants. Les types I et II présentent des anomalies quantitatives du récepteur αIIbβ3. Dans le type I, le déficit est majeur et le récepteur est absent ou n’est présent qu’à l’état de traces (<5 %) ; dans le type II, le taux résiduel est de l’ordre de 5 % à 20 %. Les formes variantes correspondent essentiellement à des anomalies qualitatives du récepteur, qui est présent à des taux proches de la normale. Dans tous les cas, l’anomalie fonctionnelle est la même et se traduit par l’incapacité des plaquettes à agréger entre elles [1].
Le tableau clinique de la TG chez l’homme est variable : certains patients présentent seulement quelques ecchymoses alors que d’autres ont des hémorragies fréquentes, sévères et parfois fatales. Les sites hémorragiques sont clairement définis et se situent surtout au niveau des muqueuses (purpura, épistaxis, gingivorragies, ménorragies). Les saignements gastro‐ intestinaux et les hématuries sont moins fréquents. Dans la plupart des cas, les saignements
3
débutent rapidement après la naissance, même si la TG est parfois diagnostiquée plus tardivement [2].
Le mode de transmission de la maladie de Glanzmann est autosomique récessif, ce qui signifie que les deux parents doivent être porteurs du gène défectueux même s’ils ne sont pas atteints de la maladie et le transmettre à leur enfant. Comme tous les troubles qui se transmettent de cette façon, il est plus répandu dans les régions du monde où le mariage entre proches parents est commun. La thrombasthénie de Glanzmann affecte autant les hommes que les femmes [3].
Le diagnostic présomptif repose sur la présence d’un tableau clinique compatible et des tests de laboratoire démontrant une absence d’agrégation plaquettaire en réponse aux stimuli physiologiques et associés à une numération et une morphologie plaquettaire normales. Le diagnostic final est établi lorsque le déficit de l’intégrine αIIb‐β3 est confirmé habituellement par cytométrie de flux.
Le traitement de la maladie repose essentiellement, en cas de syndrome hémorragique grave ou de chirurgie, sur les transfusions plaquettaires, mais ce traitement peut induire une immunisation anti-Gp IIb/IIIa et anti-HLA. Dans de telles conditions, l'utilisation du Facteur VII activé recombinant dont l'efficacité et la tolérance ont été démontrées dans le traitement des hémophilies représente une nouvelle alternative [4, 5].
L'objectif de notre travail est de comprendre le mécanisme et la physiopathologie de la thrombasthénie de Glanzmann, ainsi de souligner les différentes méthodes utilisées pour le diagnostic, et les attitudes thérapeutiques de cette pathologie.
4
PARTIE I :
5
I. RAPPEL PLAQUETTES SANGUINES ET HÉMOSTASE PRIMAIRE
1. Plaquettes
Les plaquettes sont les plus petits éléments figures du sang (2 à 3 µm). Ce sont des fragments cellulaires provenant des mégacaryocytes médullaires. Ces énormes cellules de taille moyenne de 30 µm proviennent des mêmes cellules totipotentes qui donnent naissance aux érythrocytes et aux leucocytes. Chaque mégacaryocyte produit environ 2000 plaquettes. Ce processus a lieu au niveau de la moelle osseuse. La durée de vie des plaquettes est de 8-10 jours chez l’humain et de 4 jours chez le rat. Dans le sang normal humain, le compte plaquettaire est compris entre 150 00 à 400 000/µl [6]. A l’état normal, les deux tiers de la masse plaquettaire circulent dans le sang et un tiers est séquestré dans la rate. Les plaquettes présentent à l'état de repos une forme discoïde avec un volume d’environ 6-8 µm3.
Les cellules plaquettaires, ou thrombocytes, présentent une structure très particulière en accord avec leurs fonctions primaires d’adhésion à l’endothélium et d’autoagrégation (Fig. 1):
Figure 1. Représentation schématique d’une plaquette. Ga : granules a ; Gd : granu les denses ; Ly : lysosomes ; sco : système canaliculaire ouvert ; mit : mitochondrie ; std : système tubulaire dense [6].
Membrane cytoplasmique riche en glycoprotéines fonctionnelles. Système membranaire complexe intra-cytoplasmique.
6 Système de granulations intra-cytoplasmiques.
La membrane plaquettaire est classiquement constituée, comme toute membrane cellulaire, d’une double couche lipidique au sein de laquelle viennent s’arrimer des glycoprotéines hydrophobes riches en acide sialique déterminant la charge négative. Les phospholipides constituent 80 % des lipides membranaires et sont polarisés au niveau du feuillet interne lorsque la plaquette est au repos. À l’état d’activation plaquettaire, les phospholipides sont exposés sur le versant externe de la membrane, au contact des composants plasmatiques, assurant ainsi leur fonction procoagulante. Les glycoprotéines ancrées dans la membrane jouent un rôle de récepteur dont la fonction est de transmettre un signal vers les structures cytoplasmiques, contractiles ou sécrétrices par exemple. Les glycoprotéines dont les fonctions sont les mieux connues sont le complexe GPIb/IX, récepteur de VWF impliqué dans l’adhésion plaquettaire à l’endothélium, et le complexe GPIIb/IIIa, récepteur du fibrinogène impliqué dans le processus d’agrégation plaquettaire.
Un système membranaire complexe intra-cytoplasmique caractérise la cellule plaquettaire et ses fonctions de sécrétion. Le système canaliculaire ouvert est un réseau membranaire constitué à partir d’invaginations de la membrane plasmique, dont le rôle est de permettre le déversement et le stockage des substances des granulations plaquettaires. Le système tubulaire dense n’est pas ouvert sur l’extérieur et consiste en un lieu de stockage du Ca++ utilisé par les structures contractiles.
Les microtubules et les microfibrilles représentent l’appareil contractile de la cellule plaquettaire; ils assurent le maintien de sa forme discoïde au repos et ses mouvements et changements de forme caractérisant son état d’activation, par le biais des deux principales protéines contractiles qui sont l’actine et la myosine.
Trois types de granules intra-cytoplasmiques sont individualisables, dont le rôle réside dans le stockage de nombreuses substances spécifiques à chacune d’entre elles. Les granules alpha sont les plus abondants et sont mis en évidence par leur teinte azurophile en coloration
7
par le May-GrünwaldGiemsa en microscopie optique. Ils contiennent des facteurs de la coagulation et des cytokines (PDGF, transforming growth factor [TGF], epidermal growth factor [EGF]...). Les granules denses sont les moins nombreux, de l’ordre de 5 à 10 par cellule ; individualisables en microscopie électronique, ils contiennent des substances proagrégantes et vasoactives (adénosine diphosphate [ADP], adénosine triphosphate [ATP], sérotonine, histamine, Ca++...). Les lysosomes, enfin, sont le lieu de stockage de diverses enzymes à activité antibactérienne ou protéolytique (phosphatase acide, protéase, collagénase...).
Figure 2 (A) Formation de proplaquettes par des mégacaryocytes murins en culture, révélées par Immunofluorescence de la β-tubuline [7]. (B) Image de microscopie électronique des plaquettes.
8
1.1. Réponse plurifonctionnelle plaquettaire
Après la blessure vasculaire, les plaquettes, véritables « SAMU » vasculaires, sont les premières à intervenir pour assurer le colmatage de la brèche. La mise en jeu des plaquettes est multifactorielle. Aboutissant au « clou plaquettaire », elle se déroule en plusieurs étapes intimement intriqués.
9
1.2. Les différents constituants de la plaquette et leurs principales fonctions
Tableau I Les différents constituants de la plaquette et leurs principales fonctions
2. Hémostase primaire
Le processus d'hémostase comprend l'ensemble des phénomènes qui vont permettre l'arrêt d'un saignement après la survenue d’une brèche vasculaire. C'est un phénomène localisé, auto-amplifié et autorégulé, déclenché par le contact du sang avec certains éléments du sous endothélium (essentiellement le facteur Willebrand (VWF), les microfibrilles de collagène, le facteur tissulaire...).
Il repose sur trois phases, en théorie successives, mais en réalité intriquées :
Structure Fonction Phospholipides membranaires Protéines membranaires GPIb-IX GPIIb-IIIa
Système canaliculaire ouvert Système tubulaire dense
Cytosquelette Microtubules Microfilaments (actine, myosine) Granules denses Mitochondries, glycogène
Organisation de la membrane, Source d’acide arachidonique
Récepteurs Adhésion Agrégation Sécrétion
Séquestration du calcium, synthèse du thromboxane A2 (TxA2) Morphologie
Contraction, rétraction du caillot
Sécrétion, changement de forme, rétraction
(ADP, ATP, sérotonine), agrégation secondaire Source énergétique
10
l'hémostase primaire, qui correspond à la formation du clou plaquettaire.
la coagulation, qui aboutit à la formation du caillot de fibrine.
la fibrinolyse qui permet la repermeabilisation du vaisseau après la formation du caillot de fibrine.
Les principaux acteurs de l'hémostase primaire sont : (i) les plaquettes, (ii) le facteur Willebrand (VWF), le fibrinogène, (iii) les phospholipides anioniques, (iv) le calcium, (v) l’endothélium et le sous-endothélium.
Lorsque survient une brèche vasculaire, une vasoconstriction réflexe se produit, qui va réduire les pertes sanguines en favorisant les interactions plaquettes-endothélium. Ensuite, intervient la formation du clou plaquettaire qui va se faire en trois étapes : l’adhésion, l’activation et l’agrégation plaquettaire.
2.1. Adhésion
Le VWF joue un rôle majeur dans l’interaction plaquettes-vaisseaux. C'est une glycoprotéine de haut poids moléculaire, présente sous forme de multimeres, synthétisée par les mégacaryocytes et les cellules endothéliales. Le VWF est stocké dans les corps de Weibel-Palade des cellules endothéliales, où il est secrété en permanence dans le plasma.
Sa concentration plasmatique peut physiologiquement augmenter dans certaines situations de stress (grossesse, inflammation,…). Lorsque survient une lésion de la paroi d'un vaisseau, les plaquettes vont venir adhérer au sous-endothélium :
soit par l’intermédiaire du récepteur plaquettaire α2β1 au collagène.
soit par l’intermédiaire du récepteur plaquettaire GPIb-IX-V au VWF.
2.2. Activation
L’activation des cellules plaquettaires est caractérisée par deux phénomènes principaux, leur changement de forme et leur activation métabolique. Il s’agit de processus actifs
11
nécessitant de l’énergie, sous forme d’ATP dérivant du métabolisme du glucose, et la disponibilité intra-cytoplasmique des ions calcium (Ca++) indispensables à l’activation du système contractile actine-myosine.
Discoïdes à l’état de repos, les plaquettes activées deviennent sphériques, émettent des pseudopodes et s’étalent sur la surface d’adhésion. Les granules intra-cytoplasmiques fusionnent avec le système canaliculaire ouvert et y libèrent leur contenu, qui se déverse ainsi dans le plasma environnant. Ce phénomène de sécrétion plaquettaire, libère de nombreuses substances proagrégantes (ADP, fibrinogène, sérotonine), pro-coagulantes (facteur V, VWF, fibrinogène) ou vasomotrices (sérotonine, NO, TXA2) contribuant à l’amplification du processus d’hémostase primaire et créant les conditions favorables à la coagulation plasmatique.
Par ailleurs, la plaquette activée génère de nombreuses substances pharmacologiquement actives à partir de ses phospholipides membranaires comme l’acide arachidonique. Celui-ci est métabolisé par la phospholipase A2 pour aboutir à la TXA2, puissant agent vasoconstricteur et proagrégant, et à d’autres prostaglandines modulant les activités plaquettaire et vasculaire.
Un autre phénomène essentiel se déroulant au cours de la phase d’activation plaquettaire est le phénomène de « flip-flop » membranaire, permettant aux structures internes de la membrane de se repositionner vers l’extérieur en contact avec le plasma. Cette modification permet aux phospholipides chargés négativement, et notamment la phosphatidylsérine, de s’extérioriser et de devenir disponibles pour la fixation des facteurs de la coagulation vitamine K-dépendants, amplifiant par-là considérablement les processus enzymatiques de la cascade de la coagulation.
2.3. Agrégation
L’ADP et les traces de thrombine initialement produites par les premières étapes de la coagulation sont les principaux agonistes de l’agrégation plaquettaire, qui est ensuite amplifiée par d’autres substances telles que la TXA2, l’adrénaline ou la sérotonine.
12
L’agrégation est permise par le fibrinogène qui crée de véritables ponts adhésifs interplaquettaires par le biais de sa fixation à son récepteur membranaire spécifique, la gpIIb/IIIa. Il s’agit d’un phénomène actif requérant ici aussi énergie et disponibilité de Ca++.
Si les phénomènes d’adhésion, d’activation et d’agrégation plaquettaire sont individualisables in vitro, ils se déroulent simultanément in vivo avec un phénomène de recrutement amplifiant la masse cellulaire active conduisant au clou plaquettaire hémostatique.
II. LA PHYSIOPATHOLOGIE
La TG est une maladie hémorragique affectant la lignée des mégacaryocytes et caractérisée par un défaut d’agrégation plaquettaire. La TG est caractérisée par l’absence ou la diminution marquée de l’intégrine αIIb-β3 [3]. Il est apparu que cette molécule joue un rôle central dans l’agrégation plaquettaire [8].
Il existe plusieurs types de TG : les types I, II et les variantes. Les types I et II présentent des anomalies quantitatives du récepteur αIIbβ3. Dans le type I, le déficit est majeur et le récepteur est absent ou n’est présent qu’à l’état de traces (<5 %) ; dans le type II, le taux résiduel est de l’ordre de 5 % à 20 %. Les formes variantes correspondent essentiellement à des anomalies qualitatives du récepteur, qui est présent à des taux proches de la normale. Dans tous les cas, l’anomalie fonctionnelle est la même et se traduit par l’incapacité des plaquettes à agréger entre elles [1].
L’agrégation plaquettaire est une réaction physiologique importante dans la physiologie de multiples pathologies et dans le maintien de l’hémostase. La phase d’adhésion est suivie par l’activation et le recrutement secondaire des plaquettes circulantes grâce à des mécanismes auto‐ et paracrines mettant en jeu la sécrétion d’agonistes (ADP, sérotonine), de protéines de liaison (thrombospondine, fibrinogène), de granules puis la synthèse et la
13
sécrétion de thromboxane A2. L’intégrine αIIb-β3 joue un rôle central dans l’agrégation plaquettaire. Le fibrinogène lie une intégrine αIIb-β3 d’une plaquette activée, et lie aussi une autre intégrine αIIb-β3 et forme entre ces deux plaquettes un pont de fibrinogène. Ce pont formé entre deux plaquettes par l’intermédiaire du fibrinogène et de l’intégrine αIIb-β3 constitue la dernière étape de l’agrégation plaquettaire. Les plaquettes recrutées vont former le thrombus plaquettaire [9, 10]
Le terme d’intégrine désigne la capacité d’un récepteur à interagir directement avec le cytosquelette de la cellule [11]. La glycoprotéine αIIb-β3 appartient à la famille des intégrines, qui sont des récepteurs de répartition ubiquitaire dans l’organisme. Les intégrines permettent l’adhésion cellule/cellule et cellule/matrice. Elles jouent un rôle important dans la migration, la prolifération, la différentiation et la survie cellulaire [12]. Elles sont également impliquées dans un certain nombre de pathologies telles que les néoplasies et la dissémination métastatique, la dysimmunité, l’ischémie-reperfusion, ou encore l’hémostase et la thrombose [13].
On compte environ 100 000 récepteurs αIIbβ3 présents à la surface des plaquettes, auxquels viennent s’ajouter, après activation plaquettaire, une quantité équivalente, contenue dans les membranes internes de la cellule [14]. Le récepteur αIIbβ3 est relié au cytosquelette, et principalement à l'actine. Lorsque les plaquettes s’activent, ce complexe est capable de se fixer au fibrinogène, mais aussi à d'autres protéines adhésives comme la fibronectine, la vitronectine, ou le facteur Willebrand. Ces quatre molécules ont une séquence peptidique commune (Arginine-Glycine-Acide aspartique-Serine = RGDS), par laquelle elles sont reconnues.
1. Structure de l’intégrine αIIb-β3 :
La synthèse des intégrines se fait dans les mégacaryocytes. La sous-unités αIIb est premièrement synthétisée en une simple protéine qui forme un complexe dimérique avec la sous-unités β3. L’assemblage des 2 molécules se fait dans le réticulum endoplasmique où
14
Ils vont subir une N-glycosylation en sus. Ce complexe est ensuite transporté dans l’appareil de Golgi pour l’assemblage final avec des oligosaccharides et pour le clivage de la simple chaine pro-αIIb en un αIIb mature constitué d’une chaine lourde et légère. Ensuite, le complexe est transporté de l’appareil de Golgi vers le système canaliculaire connecté à la surface et les granules alpha. L’assemblage des molécules d’ αIIb et β3 est un pré requis pour l’expression du récepteur αIIb et β3 à la surface des plaquettes [15].
Au début des années 1980, Jennings et Phillips ont purifié les glycoprotéines αIIb et β3 à partir des plaquettes [16], Cet hétéro-dimère est constitué de deux sous-unités : αIIb et β3, liées entre-elles de manière non-covalente. On y distingue un grand domaine extracellulaire, un domaine transmembranaire, et un court domaine intra-cytoplasmique, impliqué dans l’interaction avec les protéines du cytosquelette (Fig. 4) [17].
1.1. Domaine extracellulaire
Le domaine extracellulaire du complexe comprend la majorité des acides aminés de chaque sous-unité. Il est constitué de plusieurs sous-domaines comprenant deux « têtes » globulaires, impliquées dans la liaison du ligand et portées par deux longues « jambes ».
1.1.1. Sous-unité αIIb
La partie extra-cellulaire de la sous-unité αIIb se compose d’un domaine appelé « β-propeller », un domaine « thigh » et deux domaines « calf » [18, 19]. Le domaine β-β-propeller est constitué de différents feuillets β, organisés en pales d’hélice (au nombre de 7). Chaque pale d’hélice, ou « blade », est elle-même composée de quatre feuillets β anti-parallèles adoptant une topologie en W (Fig. 5) [19]. Deux anneaux concentriques de résidus, principalement aromatiques, tapissent le bord intérieur et supérieur de l'hélice, constituant un motif appelé « cage » qui accueille l’arginine 261 de la sous-unité β3 [20]. Les boucles reliant les différents feuillets β s'étendent au-dessus ou endessous du plan de l'hélice (Fig. 5). Les
15
boucles supérieures portent des motifs répétés « FG-GAP », communs à toutes les sous-unités α des intégrines et essentiels à la stabilisation de la structure de chaque « blade » (Fig. 5) [21].
Figure 4 Représentation schématique de la structure de l’intégrine αIIbβ3 [22]
Á l’opposé de ces motifs, quatre sites de liaison du Ca2+ sont retrouvés entre les « blades » 4 et 7 (Fig. 5 E,H) [18]. Les données des structures cristallines des intégrines αvβ3 et αIIbβ3 montrent que ces domaines décrivent des boucles de type β-hairpin, constituées par une boucle chargée avec une charnière de glycine, flanquée par des résidus hydrophobes. Ces sites de liaison du Ca2+ comprennent une séquence consensus de neuf résidus : D/E-D-Φ/N-X-D/N-G-Φ-X-D/E ("Φ", décrivant des résidus hydrophobes). L’ion Ca2+ présente des liaisons de coordination avec les atomes d'oxygène des chaînes latérales des résidus 1, 3, 5 et 9 et l'oxygène de la fonction carbonyle du résidu 7.
17
Figure 5 Modélisation 3D du domaine β-propeller de la sous-unité αIIb
Modélisation 3D du domaine propeller de la sous -unité αIIb, vue de face (région en contact avec le domaine β-I de la sous unité β3) (A) et de dos (B). Les feuillets β constituants les « blades » sont représentés en bleu avec, en bleu clair, les régions en contact de β3 et les régions opposées, en bleu foncé. Les motifs FG-GAP sont représentés en vert et les motifs de coordination du Ca2+ en marron, les sphères grises représentant les ions Ca2+. (D) Schéma de la structure d’un « blade » avec ses quatre feuillets β anti-parallèles et sa topologie en W. Les segments A, B et C, adjacents aux feuillets β1, 2 et 3, contiennent les acides aminés essentiels à la constitution des motifs ‘cage’ et FG-GAP. Le motif de liaison du calcium, retrouvé au niveau des blades 4 à 7, est également représenté. Il est présent au niveau des boucles reliant les feuillets β1-β2 et β3-β4. (C, E) Modélisation 3D des structures formant le domain e FG-GAP et le motif de liaison du Ca2+. Les chaînes latérales des acides aminés impliqués dans des liaisons hydrogènes (H) sont représentées en forme de ‘bâtonnet’ et les liaisons H sont formalisées par des lignes pointillées ; le Ca2+ étant représenté par une sphère grise. Les atomes d’oxygène des molécules d’eau, engagées dans les liaisons H, sont représentés par une petite sphère bleue ; Représentations 3D (F) et schématiques (G) des segments A, B et C portant les acides amin és des motifs ‘cage’ et FG-GAP. Les trois segments interagissent par l'intermédiaire d'un réseau de liaisons hydrogènes spécifiques qui sont identiques pour tous les « blades » du domaine β-propeller. Ces trois segments présentent en outre une structure secondaire conservée, où les segments A et B contiennent des β-turn de type II et I, impliquant des résidus Gly et Pro. Le réseau de liaisons hydrogènes, associé au motif de liaison du calcium, créent une structure extrêmement compact. (H) Représentation 3D du motif de liaison du calcium. Pour chaque « blade » ayant un motif de liaison du calcium (DxDxDG), les chaînes latérales des acides aminés de la boucle reliant les brins 1 e t 2, et les atomes de la chaîne latérale d’un acide aspartique ou d’une glycine, vont être impliqués dans la coordination de celui-ci. [21]
18 1.1.2. Sous-unité β3
Dans sa partie extra-cellulaire, la sous-unité β3 est composée des domaines β-I, PSI (pour plexin/semaphorin/intégrine), du domaine hybrid, et de quatre motifs répétés EGF (Fig. 4). Le domaine β-I comprend six feuillets β centraux, entourés de huit hélices α. Il contient un réseau linéaire de sites liant des ions métalliques : le site MIDAS (‘metal ion dependent adhesion site’) au centre, flanqué de deux autres sites, les sites SyMBS (Synergistic Metal ion-Binding Site) et ADMIDAS (adjacent to MIDAS) (Fig. 6).
Le domaine MIDAS contient un motif D-X-S-X-S, essentiel à la coordination de l'ion métallique et à la liaison du ligand. Il est formé des acides aminés suivants : D119,S121, S123, E220 et D251 (Fig. 6) [18]. Les différentes études de structure 3D réalisées ont montré que le groupe carboxyle du résidu aspartique de la séquence RGD du ligand est en coordination avec le Mg2+ du domaine MIDAS [22]. Dans la conformation de faible affinité de l’intégrine, le Ca2+ du site ADMIDAS interagit avec l'oxygène de la fonction carbonyle de la methionine 335, elle-même impliquée dans la liaison peptidique de la boucle β6-α7
(Fig. 6). Cette interaction empêche l’éloignement de l’hélice α7 et stabilise ainsi l'intégrine.
Le site SyMBS est lui aussi important, mais n’est pas absolument nécessaire à l'activation de l'intégrine. Il est considéré comme un site de régulation positive de la liaison du ligand. L’ion métallique du site SyMBS forme une interaction de type cation-π avec un résidu aromatique conservé de la boucle de détermination de spécificité (SDL) (Fig. 6). Cette interaction contribue d’une part, à stabiliser la coordination de l'ion métallique du site SyMBS et d’autre part, à assurer la bonne conformation de la boucle SDL [23].
Finalement, le ligand de l’intégrine αIIbβ3 se fixe au niveau d’un sillon formé par l’association des deux sous-unités, où il interagit avec le motif MIDAS de la sous-unité β3 et le domaine β-propeller de la sous-unité αIIb.

![Figure 1. Représentation schématique d’une plaquette. Ga : granules a ; Gd : granu les denses ; Ly : lysosomes ; sco : système canaliculaire ouvert ; mit : mitochondrie ; std : système tubulaire dense [6]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393394.701525/38.893.261.600.632.827/représentation-schématique-plaquette-granules-lysosomes-canaliculaire-mitochondrie-tubulaire.webp)
![Figure 2 (A) Formation de proplaquettes par des mégacaryocytes murins en culture, révélées par Immunofluorescence de la β-tubuline [7]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393394.701525/40.893.139.729.374.908/figure-formation-proplaquettes-mégacaryocytes-culture-révélées-immunofluorescence-tubuline.webp)


![Figure 4 Représentation schématique de la structure de l’intégrine αIIbβ3 [22]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393394.701525/48.893.290.606.227.667/figure-représentation-schématique-structure-l-intégrine-αiibβ.webp)


![Figure 8 : La signalisation inside-out conduit à un changement conformationnel d’αIIbβ3 qui se traduit par une augmentation d’affinité pour son ligand [39].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393394.701525/55.893.200.685.719.952/figure-signalisation-conduit-changement-conformationnel-αiibβ-augmentation-affinité.webp)