HAL Id: tel-01418981
https://tel.archives-ouvertes.fr/tel-01418981
Submitted on 18 Dec 2016HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
des implants polymère à libération contrôlée de
principes actifs
Mathilde Champeau
To cite this version:
Mathilde Champeau. Imprégnation par voie CO2 supercritique pour préparer des implants polymère à libération contrôlée de principes actifs. Polymères. Université de Bordeaux; Université de Liège, 2014. Français. �NNT : 2014BORD0205�. �tel-01418981�
THÈSE EN COTUTELLE PRÉSENTÉE POUR OBTENIR LE GRADE DE
DOCTEUR DE
L’UNIVERSITÉ DE BORDEAUX
ET
DE L’UNIVERSITÉ DE LIEGE
ÉCOLE DOCTORALE DE SCIENCES CHIMIQUES (Université de Bordeaux) ÉCOLE DOCTORALE DE CHIMIE (Université de Liège)
SPÉCIALITÉ POLYMERES
Par Mathilde CHAMPEAU
Supercritical Carbon Dioxide Assisted Impregnation to
Prepare Drug-eluting Polymer Implants
Sous la direction de Dr. Thierry TASSAING et Prof. Christine JÉRÔME Soutenue le 04 novembre 2014
Membres du jury :
M. HOWDLE, Steven Professeur, University of Nottingham, UK Rapporteur
M. BOURY, Frank Professeur, Université d’Angers, France Rapporteur
M. SERVANT, Laurent Professeur, Université de Bordeaux, France Examinateur
M. PIZARRO, Kevin Ingénieur R&D, Covidien, France Examinateur
M. THOMASSIN, Jean-Michel Chercheur associé, Université de Liège, Belgique Examinateur M. TASSAING, Thierry Directeur de recherche, CNRS, France Directeur de thèse Mme JÉRÔME, Christine Professeur, Université de Liège, Belgique Directrice de thèse
Que de gens à remercier après ces trois ans riches en expériences (à la paillasse et à côté) ! Cette thèse restera une aventure singulière et marquante. Trois ans un pied à Bordeaux et l’autre à Liège, faits de déplacements une valise à la main qui m’ont donné du fil à retordre. J’aurais pu perdre le fil avec cette vie de nomade mais heureusement, j’ai eu la chance de tisser des liens forts et de faire de nombreuses rencontres tout au long de cette aventure.
Je souhaite en premier lieu remercier chaleureusement mes quatre superviseurs pour tout ce qu’ils m’ont apporté et pour ce travail d’équipe qui s’est enrichi et imprégné du point de vue de chacun. Enfin, nous aurons réussi à démêler le vrai du faux sur l’imprégnation!
Tout d’abord, un grand merci à Dr. Thierry TASSAING pour m’avoir ouvert les portes du monde des spectroscopistes, pour m’avoir prouvé qu’il faut être bricoleur et ingénieux pour être novateur, et pour m’avoir rassurée en me confiant que rêver de pics certaines nuits est une caractéristique du métier ! Je tiens à remercier Dr. Jean-Michel THOMASSIN alias Mon Jean-Mi pour m’avoir appris la rigueur tout en douceur, pour m’avoir fait une petite place dans le bureau des blagues carambar et pour m’avoir poussée sans en avoir conscience à donner toujours plus pour ce projet. Merci à vous, Thierry et Jean-Michel pour vos encouragements précieux et bienveillants, pour votre disponibilité quotidienne, pour notre amitié qui s’est établie petit à petit, pour m’avoir accordée votre confiance, et pour m’avoir fait garder le rythme l’un en tapotant sur la table dans nos grands moments de réflexion face aux mystères des spectres IR et l’autre avec sa playlist « la pêche » lors de mes états supercritiques. Merci à Prof. Christine JEROME pour m’avoir accueillie au CERM et avoir dégagé du temps, régulièrement, dans un emploi du temps de ministre pour discuter des résultats et faire un brainstorming pour trouver LE titre adéquat pour nos publications. Alors que la parité en sciences n’est pas encore atteinte, j’ai trouvé mon exemple féminin d’excellence scientifique. Enfin, merci à Kevin Pizarro -qui a succédé à Dr. Benjamin Renault- pour avoir suivi ce travail de près et pour ta (votre) réelle implication via tes conseils que j’ai écoutés d’une oreille attentive. Travailler en vue d’une perspective industrielle concrète a été une réelle motivation pour moi !
Je remercie Prof. Steve HOWDLE et Prof. Frank BOURY de s’être intéréssés et d’avoir porté un regard extérieur sur ce travail de thèse, ainsi que Prof Laurent SERVANT pour avoir accepté de présider mon jury.
Du côté des spectroscopistes, je remercie Dr Gwenaëlle LE BOURDON, Dr Jean-Luc BRUNEEL, Frédéric ADAMIETZ pour m’avoir initié patiemment à l’IR, au Raman et au traitement d’image (haut en couleur !). Merci aussi à Annie CORREA DA COSTA pour son efficacité à gérer les retours de mission et à Stéphane RULLIER sans qui la fabrication de nos cellules hautes pressions et tout le travail qui en a découlé auraient été impossibles. Je remercie aussi Prof Laurent SERVANT car « la vie, c’est la violence et la brutalité » et pour être passé quotidiennement dans mon bureau pendant la période de rédaction afin de me coacher. Merci plus généralement à tous les membres de l’ISM pour m’avoir accueillie et conseillée.
Du côté des polyméristes, merci à vous tous de m’avoir acceptée dans votre clan, bien que petitE françaisE, ingénieure et n’ayant jamais réalisé une seule polymérisation de ma vie ! Un grand merci à Dr Bruno GRIGNARD pour tous tes coups de main (ou de clé) face aux réacteurs capricieux, pour tes conseils, tes encouragements et ta générosité. Merci
Merci aussi à Leyla BAHCIVAN pour avoir réalisé nombre de manipulations avec beaucoup d’application lors de ton travail de fin d’étude !
This thesis would not have been the same without being part of the IDS FunMat program. What an amazing adventure! Gathering people that come from everywhere, from different cultures with different languages for one common goal: science and research! I would like to thank a lot the people who created, organized and supported this project. Even if many difficulties were encountered, we learnt a lot, it gave us the opportunity to build a strong network and -above all- special international friendships were born! Thanks to all my IDS-friends for the precious time we had together, organizing diners, visiting, complaining to make you become a bit more French, sharing intense moments during the spring schools and celebrating our PhD! I wish you will have happy memories of France…and I hope sincerely to see you again…
Enfin, je tiens à remercier mes amis et collègues qui ont partagé mon quotidien. Tatiana, Elise, Flavie, Margot, Coralie, Stéphanie, Fatima, Thomas, Sergey, The Thuong, Antoine, Léonard, Yao…merci pour ces bons moments passés le midi à plaisanter ou à se dorer la pilule au bord du ‘lac’, à partager un petit café accompagné de chocolat ( !), pour les virées au ski des week-ends d’hivers ou à la plage pour les soirs d’été, pour les soirées coupe du monde-pizza dans la salle de réunion. Vive la spectro parce que c’est r_ _ _ _ o et restez moti’v! Merci, thank you, obrigada, gracias, grazie, teşekkür ederim, 谢谢, to all my friends and colleagues from the CERM ! Merci Phuong et Cédric pour cette première année où nous avons partagé notre bureau et notre passion pour le CO2 autour de confiseries et de
confidences ! Merci Sufien et Jean-Mi pour la deuxième et dernière année, ce fût un plaisir de parfaire ma culture footballistique en votre compagnie (ça me sera sûrement utile outre-Atlantique) et d’enrichir mon vocabulaire liégeois. Thanks to my girlzzzs for our friendship and for the nice moments we spent together, gossiping, savouring sushi (how many?), helping each other in this foreign country! Thanks also to Mirco l’italiano, Ji the ghost of the lab, Anthony and his horseshoe… Thanks to all of the CERM members for the volleyball trainings, the great time spent in congress in Washington, Roubaix, Ghent or in the middle of the Mediterranean sea, for the events organized in Liège, for the nice times in the lab…I wish the CERM will keep this amazing positive energy that make this lab unique!
Je remercie Flavie et Juliette pour m’avoir gentiment hébergée quelques nuits, vous m’avez rendu un confortable et grand service ! A special thanks to my dear friend Deniz for your warm welcoming during the last three months, it enabled us to share doubts and advices for thesis and our future…and a lot of fun!
Enfin, je souhaite remercier sincèrement mes parents, pour m’avoir soutenue et accompagnée durant ces années d’études puis de thèse, pour m’avoir aidée en gérant tous les aspects administratifs, pour votre soutien et pour l’intérêt que vous avez porté à mon travail bien que ce ne soit pas toujours facile à appréhender. Je vous en suis très reconnaissante ! Merci aussi à Léa, qui m’a régulièrement rendu service quand je faisais halte à Paris lors de mes déménagements et qui se creuse la tête pour m’aider à trouver l’Idée ! Obrigada para Flavio, ton soutien et tes encouragements m’ont été et me sont précieux. M’inspirer de ton expérience et de tes conseils m’aura aidée à aller de l’avant et à m’imprégner de ton positivisme brésilien !
1
Résumé:
Le procédé d’imprégnation par voie CO2 supercritique est une solution prometteuse pour
préparer des implants polymère à libération contrôlée de médicaments.
Ce travail a permis de comprendre l’influence des paramètres gouvernant ce procédé et de préciser dans quelle mesure ce procédé peut être utilisé pour préparer des implants polymères chargés en médicament. Pour ce faire, nous avons combiné les informations obtenues grâce aux techniques classiques de caractérisation de polymères et à un dispositif que nous avons développé basé sur la micro-spectroscopie FTIR haute pression in situ.
Dans cette étude, des fils de suture de PLLA, PP and PET ont été imprégné avec deux anti-inflammatoires (aspirine et kétoprofène).
Tout d’abord, l’évolution du comportement des systèmes binaires médicament/CO2 (solubilité
et spéciation) et polymère/CO2 (quantité de CO2 adsorbé, gonflement de la matrice, évolution
de la microstructure et des propriétés de tension du polymère) a été déterminé en fonction de la pression et de la température. Ensuite, le procédé d’imprégnation a été étudié. L’influence des conditions expérimentales sur le taux d’imprégnation a été déterminée et expliquée par la quantité de CO2 adsorbé, le gonflement de la matrice, la solubilité du médicament, l’évolution
de la microstructure du polymère et aussi l’affinité médicament/polymère. La matrice de PLLA a pu être plus largement imprégnée (jusqu’à 32%) que celles de PP et PET (5% max). Enfin, l’influence des conditions d’imprégnation et de dépressurisation sur le relargage a été démontrée sur le système PLLA/Kétoprofène, la durée de relargage variant de 3jours à 3mois.
Mots clés: CO
2 supercritique, imprégnation, implants en polymère, libération contrôlée demédicament, micro-spectroscopie FTIR haute pression, adsorption de CO2, gonflement, taux
d’imprégnation, suture, anti-inflammatoire
Title: Supercritical CO
2Assisted Impregnation to prepare Drug-eluting
Polymer Implants
Abstract:
The scCO2 impregnation process is a promising alternative to other manufacturing process to
prepare drug-eluting polymer implants.
This work enabled to rationalize the influence of the key parameters governing this process and to determine in which extent this process can be used to prepare drug-eluting implants. We have combined the information obtained with traditional polymer characterization techniques and a newly characterization set-up we have developed that is based on in situ FTIR micro-spectroscopy. We have worked on the impregnation of sutures made of PLLA, PP and PET with two anti-inflammatory drugs namely ketoprofen and aspirin.
Firstly, the thermodynamic behaviors of the systems drug/CO2 (solubility and speciation of
the drug) and polymer/CO2 (CO2 sorption, polymer swelling, evolution of the polymer
microstructure and of the tensile properties) were studied as a function of pressure and temperature. Then, the scCO2 impregnation process was investigated. The impact of the
operational conditions on the drug loading (contact time, pressure, temperature and depressurization conditions) was explored and accounted regarding to the CO2 sorption, the
2
explored. The tensile properties of the impregnated fibers were also evaluated. PLLA was more impregnated (up to 32%) than PP and PET (up to 5%) in the investigated conditions. Finally, we have shown that the drug release can be tuned from 3 days to 3 months by varying the impregnation and depressurization conditions on the system PLLA/Ketoprofen.
Keywords:
supercritical CO2, impregnation, drug-eluting polymer implants, in situ FTIRmicro-spectroscopy, CO2 sorption, polymer swelling, drug loading, suture, anti-inflammatory,
drug release
Unités de recherche
Institut des Sciences Moléculaires (ISM), UMR 5255 CNRS – Université de Bordeaux, 351 cours de la libération, 33405 TALENCE Cedex, France Center for Education and Research on Macromolecules (CERM), Sart-Tilman,
3 (ERASMUS MUNDUS Doctoral Program).
This thesis is the result of a collaboration between the Group of Molecular Spectroscopy (GSM) at the Institute of Molecular Sciences (ISM) at the University of Bordeaux (France) and the Center for Education and Research on Macromolecules (CERM) at the University of Liège (Belgium). It has been co-supervised by Dr. Thierry TASSAING (ISM), Prof. Christine JÉRÔME (CERM) and Dr. Jean-Michel THOMASSIN (CERM).
Covidien was also involved as the industrial partner and Dr. Kevin Pizarro has participated in the supervision of this work.
This work was founded by the “Conseil Régional Aquitaine”.
5
Résumé en français
Dans le domaine de l'administration de médicaments, la tendance actuelle est de délivrer le médicament directement où il doit agir et de contrôler la quantité de médicament relarguée dans le temps afin de résoudre les problèmes rencontrés avec les voies d'administration courantes. En effet, l’administration par voie orale souffre d’une faible biodisponibilité du principe actif et peut entraîner la détérioration de l’écosystème bactérien de l’intestin. Quant à la voie intraveineuse, le principe actif doit réussir à travers les barrières physiologiques. Dans les deux cas, la faible solubilité de nombreux principes actifs dans les fluides corporels limite leur efficacité. En outre, le médicament se retrouve distribué dans tout le corps et seule une petite quantité atteint le site ciblé et est réellement active. Le reste du médicament peut alors s'accumuler dans les tissus ou les organes non ciblés et peut entraîner des effets secondaires indésirables.
Par conséquent, différents systèmes de libération de médicaments à base de polymère ont été développés. Parmi les stratégies imaginées, l’une d’elle consiste à modifier des implants qui ont été développés à l'origine pour une fonction bien spécifique (par exemple mécanique (sutures, stents) ou optique (lentilles intraoculaires)) en implants à libération de médicaments. Ainsi, les implants ne remplissent pas seulement leur fonction d’origine mais libèrent aussi le médicament localement après implantation.
Les fils de suture chirurgicaux en polymère font partie des dispositifs médicaux les plus implantés. Ils sont aussi bien utilisés pour refermer des plaies ou pour immobiliser des prothèses. Afin de réduire la douleur due à la réponse inflammatoire après l’intervention chirurgicale, un médicament anti-inflammatoire peut être incorporé dans le fil de suture pour être ensuite relargué une fois le fil implanté.
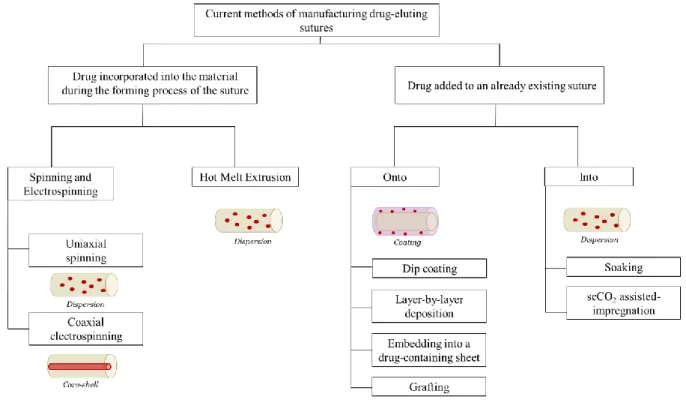
Plusieurs procédés de fabrication ont été développés pour créer des fils de sutures à libération de médicament. Le procédé d’électrospinning ou d’extrusion à l'état fondu permettent d'incorporer des médicaments dans la matrice polymère au cours de la fabrication du fil de suture. D'autres techniques permettent d’ajouter le médicament à un fil de suture déjà fabriqué, soit en créant un revêtement contenant le médicament autour du fil, en greffant sur la surface du fil des espèces qui peuvent interagir avec le médicament ou en plongeant le fil dans une solution de médicament. Pourtant, ces procédés nécessitent souvent de travailler à haute température, ce qui peut dégrader les médicaments thermosensibles ou d’utiliser des solvants organiques toxiques qui doivent ensuite être éliminés (ce qui est long et consomme de l’énergie) afin de respecter les normes établies par les agences de santé.
Dans ce contexte, l’imprégnation par voie CO2 supercritique apparaît comme une
alternative intéressante pour charger un principe actif dans un fil de suture déjà fabriqué. En effet, le CO2 dans des conditions supercritiques (c'est à dire au-dessus de 31 ° C et 73,8 bar)
peut être dissout dans de nombreux polymères. Le CO2 supercritique (scCO2) peut gonfler les
matrices polymères et temporairement augmenter leur volume libre. Le scCO2 peut aussi
solubiliser de nombreux principes actifs et ensuite les transporter au sein de la matrice polymère alors gonflée. La bonne diffusivité du scCO2 rend le processus d’imprégnation
facile et rapide.
Etant inerte, non-inflammable, bon marché, respectueux de l’environnement, facile à extraire des matrices polymères par dépressurisation, le scCO2 présente de nombreux
6
supercritiques du CO2 étant basses, ce procédé est compatible avec l’utilisation de principes
actifs thermosensibles. Enfin, les propriétés physiques du scCO2 (densité et diffusivité)
peuvent être ajustées en faisant varier la pression et la température. Il est donc possible de jouer sur les conditions opératoires pour modifier la solubilité du médicament dans le CO2, la
quantité de CO2 adsorbée dans le polymère, le gonflement du polymère et conséquemment la
quantité de médicament imprégné aussi appelé taux d’imprégnation.
L’objectif de ce projet a été d’étudier les paramètres clés régissant le processus d'imprégnation par voie CO2 supercritique et la possibilité d’appliquer ce procédé pour créer
des implants polymères à libération contrôlée de médicament. Pour ce faire, le Groupe de Spectroscopie Moléculaire (GSM) à l'Institut des Sciences Moléculaires (ISM) de l'Université de Bordeaux et le Centre d'Éducation et de Recherche sur les Macromolécules (CERM) de l'Université de Liège ont combiné leur expertise. Le Groupe de Spectroscopie Moléculaire est spécialisé dans le développement de montages spectroscopiques originaux permettant d’étudier des phénomènes complexes (tel qu’ici l’étude in situ des phénomènes impliqués dans l’imprégnation de matrices polymère ou la solubilité des médicaments dans le CO2). Le
CERM est spécialisé dans la modification de polymères et l’ingénierie des biomatériaux en polymère, les expériences d'imprégnation en réacteur batch et la caractérisation des matériaux imprégnés ont donc été réalisées dans ce laboratoire. Ainsi, cette collaboration scientifique a permis de combiner et de corréler les informations obtenues avec les mesures spectroscopiques in situ et avec les techniques classiques de caractérisation de polymères (SEM, DSC, test de traction, GPC ...) afin de déterminer les paramètres clés régissant le procédé d’imprégnation par voie CO2 supercritique et d’étudier les propriétés finales des fils
de sutures imprégnés.
Nous avons étudié l’imprégnation de trois fils de sutures monofilaments couramment implantés en poly-L-lactide (PLLA), le poly (éthylène téréphtalate) (PET) et polypropylène (PP) avec deux anti-inflammatoires non-stéroïdes solubles dans le scCO2 qui sont le
kétoprofène et l'aspirine (tous deux étant des acides carboxyliques). L'imprégnation d’un échantillon d’oxyde de polyéthylène PEO a également été effectuée pour compléter l'étude.
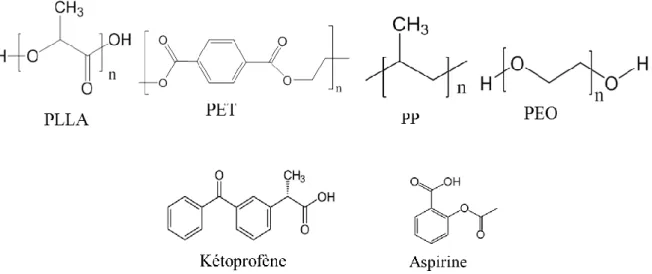
Figure a: Structure chimique des quatre matrices polymères et des deux médicaments
Ces quatre homopolymères sont tous semi-cristallins, mais possèdent des propriétés distinctes, telles que leurs températures de transition thermique (vitreuse Tg et de fusion Tm),
la présence ou non de groupes fonctionnels pouvant interagir avec le CO2 et/ou le médicament
imprégné, leur dégradabilité.... De plus, la comparaison du taux d’imprégnation des deux médicaments sélectionnés dans les quatre polymères permet de mettre en évidence l'influence
7 de la solubilité du médicament dans le scCO2 et de l’affinité polymère/médicament bien que
l’aspirine et le kétoprofène portent tous deux des groupements acides carboxyliques susceptibles d’interagir avec les polymères.
Figure b: Schéma du procédé d’imprégnation par voie scCO2.
Le procédé d'imprégnation par voie scCO2 comporte trois composantes: le polymère,
le médicament et le CO2 en tant que vecteur. Afin de comprendre le comportement
thermodynamique des systèmes ternaires {polymère + médicament + CO2}, nous les avons
tout d'abord décomposé systèmes binaires: {médicament + CO2} et {polymère + CO2}.
L’évolution des comportements des systèmes avec les conditions opératoires (pression et température) a été déterminée.
Tout d’abord, les systèmes {médicament+CO2} ont été étudiés (chapitre II). La
solubilité du kétoprofène et de l’aspirine dans le CO2 a été mesurée en fonction de la pression
et de la température. Les deux médicaments ont montré une solubilité similaire dans le CO2
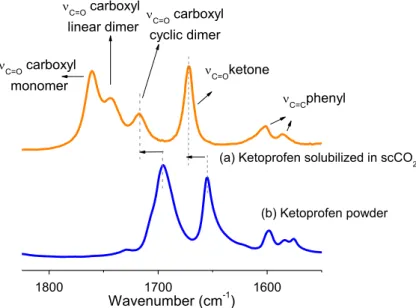
(entre 10-6 et 10-3 en fraction molaire) qui augmente avec la pression à température constante. Cette solubilité décroit avec la température en-deçà de la pression de crossover, puis augmente au-delà. Ces pressions de crossover ayant été évaluées à 150 et 170bar pour l’aspirine et le kétoprofène respectivement. Le modèle de Chrastil a été utilisé pour modéliser la solubilité des deux molécules. Enfin, la spéciation des médicaments sous forme d’espèce monomère, dimère linéaire ou dimère cyclique a été évaluée en observant la présence et l’évolution des bandes de vibration νC=O des groupements carboxyliques caractéristiques de
chaque espèce.
Ensuite, la quantité de CO2 adsorbée et le gonflement des quatre matrices polymère
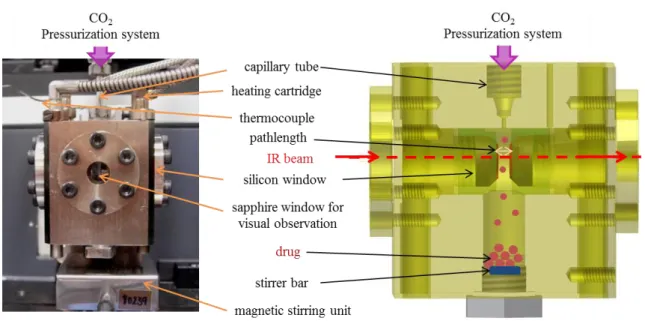
ont été mesurées in situ de 20 à 150bar à 40°C (chapitre III). Pour ce faire, un système a été développé couplant une cellule haute pression et un micro-spectromètre FTIR, permettant de mesurer ces deux paramètres in situ et simultanément dans des échantillons microscopiques (~ 5-500 μm d’épaisseur) comme présenté sur la figure e. En comparant les résultats obtenus et les propriétés physico-chimiques des quatre polymères, nous avons identifié que le polymère doit présenter deux critères principaux pour adsorber une large quantité de CO2 : il
doit pouvoir interagir avec le CO2 grâce à des interactions acide/base de Lewis et ses chaînes
doivent être suffisamment mobiles dans les régions amorphes. Le PLLA et le PEO remplissant ces deux critères, ils absorbent une grande quantité de CO2 soit 25 and 20 wt%
respectivement (figure c). Au contraire, seulement un critère est rempli par le PET (interactions acide/base de Lewis) et le PP (grande mobilité des chaînes car T>Tg), ce qui
explique leur faible adsorption de CO2. Par ailleurs, nous avons remarqué que le gonflement
8
chaînes à grande échelle. Il a été mesuré que la quantité de CO2 adsorbée augmente avec la
pression dans cette gamme de pression, une valeur plateau étant atteinte dans certains polymères aux plus hautes pressions.
Après avoir caractérisé les systèmes binaires {médicament+CO2} et {polymère+CO2},
l’étude de l’imprégnation des quatre polymères a été menée. L’impact des conditions opératoires sur le taux d’imprégnation (temps de contact, pression, température et conditions de dépressurisation) a été déterminé (chapitre IV).
0 20 40 60 80 100 120 140 160 0 5 10 15 20 25 %m as sC O2 (%) Pression (bar) PLLA PEO PET PP
Figure c: Pourcentage massique de CO2 adsorbé dans les échantillons de PEO, PLLA, PET et
PP en function de la pression de CO2 à 40°C.
La pression et la température permettent d’augmenter le taux d’imprégnation dans la gamme de pression 100-350bar et dans la gamme de température 40-130°C (figure d). Les conditions de dépressurisation (température et vitesse) impactent la quantité de médicament restant dans le polymère car le CO2 peut extraire le médicament imprégné dans certaines
conditions de dépressurisation.
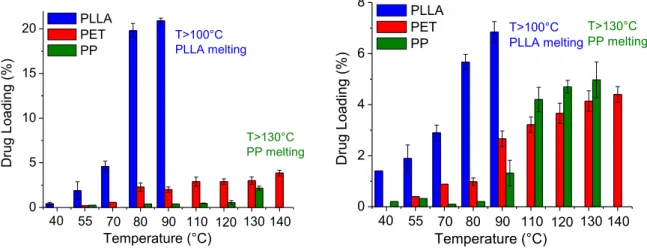
Figure d: Effet de la température sur le taux d’imprégnation du kétoprofène (à gauche) et de l’aspirine ( à droite) dans le PLLA, PET et PP à 300bar.
En comparant le comportement thermique de chaque matrice et l’affinité entre les polymères et les deux médicaments, nous avons conclu que l’imprégnation d’une matrice (i.e. le taux d’imprégnation) est favorisée par deux critères principaux : (i) une bonne mobilité des chaînes et (ii) une bonne affinité avec le médicament.
1 2 3 4 5 6 7 8 9 0 5 10 15 20 T>130°C PP melting 140 130 120 110 90 80 70 55 Drug Loadi ng (% ) Temperature (°C) PLLA PET PP 40 T>100°C PLLA melting 1 2 3 4 5 6 7 8 9 0 2 4 6 8 T>130°C PP melting 140 130 120 110 90 80 70 55 Drug Loadi ng (% ) Temperature (°C) PLLA PET PP 40 T>100°C PLLA melting
9 (i) Quand la mobilité des chaînes augmente, la quantité de CO2 adsorbé et dans
certains cas le gonflement du polymère augmentent, ce qui facilite la diffusion de la solution {CO2+médicament} dans la matrice. La mobilité des chaînes augmente au-dessus de la Tg et
encore plus quand la température approche la température effective de fusion Tm, ces deux
températures étant diminuées par la présence de CO2 et de médicament au sein de la matrice.
Au-dessus de la Tg, la mobilité des chaînes augmente dans les zones amorphes avec la
température alors qu’une fonte partielle des cristaux est observée proche de la Tm. Quand la
température approche la Tm, un phénomène de fonte/recristallisation partielle a été constaté,
ce qui est amplifié par la présence de médicament. Si une augmentation de la température proche de la Tm est bénéfique au taux d’imprégnation, la fonte des cristaux entraîne une
modification de la forme de l’échantillon, ce qui n’est pas souhaitable pour l’application visée.
Grâce au dispositif expérimental de micro-spectroscopie FTIR haute pression que nous avons développé, nous avons pu suivre simultanément la quantité de CO2 adsorbée, le
gonflement du polymère, la quantité de médicament imprégné mais aussi la spéciation du médicament dans un échantillon de PEO (voir figure e). Nous avons pu confirmer que le phénomène de fonte/recristallisation partielle des cristaux favorise l’imprégnation. Plus précisément, ceci entraîne une augmentation de la quantité de CO2 adsorbé et du gonflement
du polymère, qui facilite la diffusion de la solution {CO2+médicament} et donc
l’augmentation de la quantité de médicament imprégné. L’aspirine et le kétoprofène ayant un effet cryogénique sur le polymère, leur présence accentue la fonte des cristaux et ainsi de suite jusqu’à tant que l’équilibre thermodynamique soit atteint.
(ii) Une bonne affinité entre le polymère et le médicament doit exister pour obtenir de hauts taux d’imprégnation. En effet, de plus hauts taux d’imprégnation sont observés quand le médicament peut établir des liaisons hydrogène avec le polymère et quand les paramètres de solubilité des deux composés sont proches.
0 200 400 600 800 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Aspirine CO2 150 bar 100 bar C oncent rat ion (g/ cm 3 ) Temps (min) 50 bar Densité du PEO b)
Figure e:a) représentation schématique du dispositif expérimental couplant le microscope FTIR et la cellule haute pression; b) suivi de la concentration du polymère (lié au gonflement), du CO2 (lié à la
quantité de CO2 adsorbé) et du médicament (lié au taux d’imprégnation).
Comme l’échantillon de PLLA étudié rempli ces deux critères, de hauts taux d’imprégnation sont atteints (jusqu’à 32.5% avec le kétoprofène et 8.1% avec l’aspirine) quand la température d’imprégnation approche la température de fusion effective du PLLA (figure c). En revanche, le PET et le PP remplissent un seul des deux critères. Le PP ne peut pas interagir avec ces médicaments et la mobilité des chaînes du PET est restreinte dans les conditions étudiées.
10
Cette étude confirme que la solubilité d’un médicament dans le scCO2 ne permet pas
de prédire son imprégnation dans un polymère. Bien que l’aspirine et le kétoprofène ont des solubilités similaires, leur taux d’imprégnation dans une même matrice et dans les mêmes conditions opératoires varient largement.
Les cartographies Raman réalisées sur le diamètre des fils ont montré que l’imprégnation par voie scCO2 permet d’obtenir une dispersion homogène du principe actif
dans le fil, après seulement 1h d’imprégnation. De plus, les analyses DSC et spectroscopique ont prouvé que le médicament ne recristallise pas dans la matrice, même à des hauts taux d’imprégnation (20.9%).
Les propriétés mécaniques des fils sont impactées à la fois pas le traitement au CO2
mais aussi par la présence du médicament imprégné, résultant de l’évolution de la microstructure. Les propriétés en traction des fils imprégnés sont modifiées mais restent adéquates pour utiliser ces fils en tant que suture car leur domaine élastique n’est que peu impacté et la force à la rupture reste élevée.
Enfin, le comportement in vitro de certains fils imprégnés a été suivi au cours du temps (chapitre V). Les analyses ont montré que la dégradation du PLLA est catalysée par le kétoprofène imprégné, la vitesse d’absorption et la perte de la résistance en traction étant alors accéléré. Par conséquent, le PLLA imprégné est plus adapté pour suturer des tissus qui cicatrisent plus rapidement. Nous avons ensuite montré que des profils de relargage s’étalant de 3jours à 3mois peuvent être obtenus pour un même couple PLLA/kétoprofène en faisant varier les conditions d’imprégnation (T, P) et de dépressurisation (T, durée) comme montré sur la figure f. Tous les fils présentent une libération quasi-instantanée d’une partie du médicament, qui correspond au médicament précipité sur la surface du fil durant le procédé (qui représente 10 à 15% du taux d’imprégnation du kétoprofène dans le PLLA et jusqu’à 70% de l’aspirine dans le PP et PET). Puis le médicament est relargué plus ou moins rapidement, dépendamment du volume libre et du taux d’imprégnation du fil.
0 10 20 30 40 50 60 70 80 90 0 20 40 60 80 100 [-78°C; 5sec]; (21,3%) [80°C; 5sec]; (12,4%) [80°C; 5h]; (33%) % Ke toprofène relargué (% ) Temps (jours)
Figure f: Effet des conditions de dépressurisation [température; durée] sur le profil de relarguage du kétoprofène imprégné dans un fil de PLLA. Le taux d’imprégnation est donné entre parenthèse.
En revanche, nous avons constaté que les fils de PET et de PP ne sont pas capables de relarguer le médicament imprégné. Pour ce type de polymères, la possibilité de créer une couche de médicament sur la surface lors de l’étape de refroidissement/dépressurisation du réacteur permet d’obtenir un relargage de l’aspirine sur plusieurs dizaines de jours.
13
Table of contents
GENERAL INTRODUCTION ... 19
CHAPTER I - BACKGROUND AND LITERATURE REVIEW ... 25
1. Drug-eluting systems ... 28
1.1 Generalities... 28
1.2 Drug delivery systems ... 30
1.3 Drug-eluting implants ... 31
2. Drug-eluting sutures: production processes ... 33
2.1 API incorporated during the suture manufacturing ... 33
2.2 Post-addition of API to an already manufactured suture ... 35
2.2.a API added onto the suture ... 35
2.2.a.i Coating ... 35
2.2.a.ii Grafting on the suture surface ... 36
2.2.b API loaded into the suture ... 37
2.3 Conclusion ... 38
3. Supercritical carbon dioxide impregnation process ... 40
3.1 Supercritical carbon dioxide ... 40
3.1.a Generalities and phase diagram ... 40
3.1.b Properties of supercritical carbon dioxide ... 41
3.2 Supercritical carbon dioxide impregnation process ... 42
3.2.a Key parameters governing the scCO2 impregnation process ... 43
3.2.b Influence of the characteristics of the binary systems on the drug loading ... 49
3.2.b.i {API+CO2}: Solubility of the drug in CO2 ... 49
3.2.b.ii {Polymer+CO2}: CO2 sorption and polymer swelling... 49
3.2.b.iii {Polymer+API}: interactions ... 50
3.2.b.iv Cosolvent: impact on the previous systems ... 50
3.2.c Effect of experimental conditions on the drug loading ... 51
3.2.c.i Effect of temperature ... 51
3.2.c.ii Effect of pressure ... 52
3.2.c.iii Contact time and diffusive process ... 53
3.2.c.iv Depressurization rate ... 53
3.3 Application of the scCO2 impregnation process in the biomedical field... 53
3.3.a Drug-eluting implants ... 54
3.3.a.i Ophthalmic articles: lenses and subconjunctival implants ... 54
3.3.a.ii Tissue engineering: sutures and scaffolds ... 54
3.3.a.iii Other implants ... 55
3.3.b Oral drug delivery ... 56
3.4 Other fields of application of the scCO2 impregnation process ... 56
3.4.a Generalities... 56
3.4.b scCO2 dyeing of textiles ... 57
3.5 Processes ... 57
3.5.a Original process ... 57
14
3.6 Conclusion ... 59
References ... 60
CHAPTER II - {DRUG+CO2} SYSTEMS: SOLUBILITY AND SPECIATION OF KETOPROFEN AND ASPIRIN IN CO2 ... 71
1. Introduction ... 74
2. Experimental ... 75
2.1 Materials ... 75
2.2 Experimental infrared set-up ... 75
2.2.a Experimental set-up ... 75
2.2.b Experimental procedure ... 76
3. Infrared spectra and determination of the molar extinction coefficients ... 76
3.1 Infrared absorption spectra ... 76
3.1.a CO2 spectrum ... 76
3.1.a.i Vibration modes of CO2 ... 76
3.1.a.ii CO2 spectrum ... 77
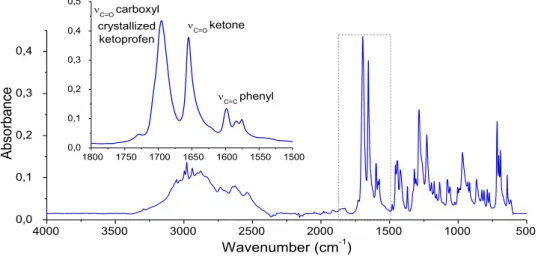
3.1.b Ketoprofen and aspirin spectra ... 78
3.1.b.i Ketoprofen spectra ... 78
3.1.b.ii Aspirin spectra ... 80
3.2 Determination of the molar extinction coefficients ... 81
3.2.a Ketoprofen ... 81
3.2.b Aspirin ... 82
4. Solubility of ketoprofen and aspirin in scCO2 ... 82
4.1 Data processing ... 82
4.2 Validation of the method by comparison with the literature data ... 84
4.2.a Ketoprofen ... 84
4.2.b Aspirin ... 84
4.3 Experimental solubility results ... 85
4.4 Semi-empirical correlation ... 86
5. Speciation of drug ... 89
5.1 Calculation of Cmonomer and Cdimer ... 89
5.2 Evolution of the dimerization constant K with pressure and temperature ... 91
6. Molecular structures after scCO2 treatment ... 92
6.1 Ketoprofen ... 92
6.2 Aspirin ... 92
7. Conclusion ... 94
References ... 95
CHAPTER III - {POLYMER+CO2} SYSTEMS: CO2 SORPTION AND SWELLING MEASUREMENTS BY IN SITU FTIR MICRO-SPECTROSCOPY ... 99
1. Introduction ... 102
15 2.1 Materials ... 102 2.2 Infrared micro-spectroscopy... 103 2.2.a Experimental set-up ... 103 2.2.b Experimental Procedure ... 105 3. Infrared spectra and data processing ... 105
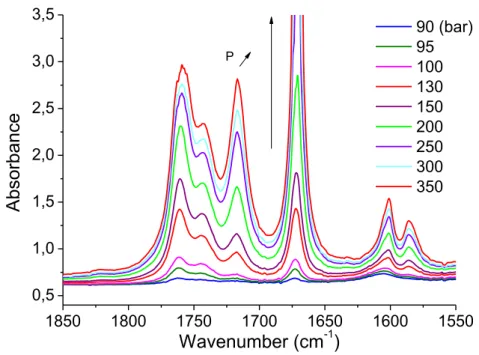
3.1 Infrared absorption spectra ... 105 3.1.a Choice of spectral bands of the polymer ... 106 3.1.b Choice of spectral bands of CO2 ... 107
3.2 Determination of polymer swelling and CO2 sorption: data processing ... 108
3.2.a Polymer swelling ... 108 3.2.b CO2 sorption ... 109
4. Results and discussion ... 109 4.1 Validation of the method with a reference system {PEO+CO2} ... 109
4.1.a Swelling ... 110 4.1.b CO2 sorption ... 110
4.2 Swelling and CO2 sorption into PLLA, PEO, PET and PP ... 111
4.2.a PLLA ... 113 4.2.b PEO ... 114 4.2.c PET ... 114 4.2.d PP ... 115 5. Conclusion ... 116 References ... 117
CHAPTER IV - INVESTIGATION OF THE SCCO2 ASSISTED IMPREGNATION
PROCESS ... 121 PART I - In situ investigation of scCO2 impregnation by high pressure FTIR
micro-spectroscopy ... 126
1. Introduction ... 126 2. Experimental details ... 127 2.1 Materials ... 127 2.2 Infrared micro-spectroscopy measurements ... 127 2.3 Thermal analysis ... 128 3. Infrared spectra ... 129
3.1 Infrared absorption spectra ... 129 3.2 Assignment of spectral bands of PEO and CO2 ... 129
3.3 Assignment of spectral band of the drugs ... 130 3.3.a Aspirin ... 130 3.3.b Ketoprofen ... 131 4. Determination of PEO swelling, CO2 sorption and drug loading: data processing .... 131
4.1 PEO swelling and CO2 sorption ... 131
4.2 Drug loading ... 131 5. Results and discussion ... 132
16
5.1 Thermodynamic behavior of the {PEO+CO2+Aspirin} system during the
impregnation process ... 132 5.2 Influence of pressure on the drug loading of aspirin into PEO ... 133 5.3 Influence of the loaded aspirin on the CO2 sorption and PEO swelling ... 134
5.4 Influence of the drug: comparison of aspirin and ketoprofen impregnation ... 137 6. Speciation of drug into PEO ... 139
6.1 Aspirin ... 139 6.2 Ketoprofen ... 140 7. Conclusion ... 141
PART II - ScCO2 assisted impregnation of polymeric sutures with drugs ... 143
1. Introduction ... 143 2. Materials and methods ... 144 2.1 Materials ... 144 2.2 Supercritical impregnation process ... 145 2.3 Characterization ... 145 2.3.a Drug Loading ... 145 2.3.b Fiber morphology imaging ... 146 2.3.c Thermal analysis ... 146 2.3.d Tensile test... 146 2.3.e API distribution by Raman imaging ... 146 3. Results and discussion ... 147
3.1 Drug impregnation vs. coating ... 147 3.1.a Coating ... 147 3.1.b Drug distribution along the cross-section of the fibers ... 150 3.2 Influence of impregnation operational parameters on the drug loading ... 151 3.2.a Contact time ... 151 3.2.b Pressure ... 152 3.2.c Temperature ... 153 4. Thermal and mechanical properties of impregnated fibers ... 155
4.1 PLLA ... 155 4.2 PET ... 161 4.3 PP ... 163 4.4 PP disks ... 166 4.5 Conclusion of the thermo-mechanical analyses ... 167 5. API/Polymer interactions ... 167
5.1 Speciation of API ... 167 5.2 Solubility parameter approach... 168 6. Influence of the depressurization conditions on the drug loading ... 169 7. Conclusion ... 171 References ... 172
17
CHAPTER V - IN VITRO BEHAVIOR: DEGRADATION AND DRUG RELEASE .. 175
1. Introduction ... 178 2. In vitro degradation of impregnated PLLA... 178 2.1 Materials and methods ... 179
2.1.a Degradation study ... 179 2.1.b Gel Permeation Chromatography ... 179 2.1.c Tensile properties ... 179 2.2 Results ... 179 2.2.a Evolution of the molecular weight ... 179 2.2.b Tensile properties ... 180 2.3 Conclusion ... 182 3. Drug Release ... 182
3.1 Materials and methods ... 183 3.1.a Supercritical impregnation process ... 183 3.1.b Drug Content ... 184 3.1.c In vitro drug release ... 184 3.1.d Dissolution of the coating: SEM ... 184 3.1.e Drug mapping: Raman imaging ... 185 3.2 Drug release profiles of ketoprofen from impregnated PLLA sutures ... 185 3.2.a Coating: burst release ... 185 3.2.b Free volume ... 188 3.2.c Drug release profiles ... 189
3.2.c.i Influence of the impregnation conditions on the drug release ... 189 3.2.c.ii Influence of depressurization conditions on the drug release profile ... 191
3.3 Drug release profiles of aspirin from impregnated PET and PP sutures ... 193 4. Conclusion ... 194 References ... 195
GENERAL CONCLUSION AND OUTLOOKS ... 197 APPENDICES ... 203 Appendices of Chapter III ... 206
Appendix III.A: Adjustments performed to optimize the infrared spectra ... 206 Appendix III.B: Evolution of the pathlength with pressure for PEO ... 207 Appendix III.C: Determination of the molar extinction coefficients of the characteristic peaks of CO2 ... 209
Appendices of Chapter IV ... 210
Appendix IV.A: Calculations of the molar extinction coefficient for the peaks at 3200cm-1 of aspirin and ketoprofen ... 210 Appendix IV.B: Characterization by ATR-FTIR analysis: API/Polymer interactions and drug speciation ... 212
18
Supplementary Appendix : In situ Raman micro-spectroscopy: CO2 sorption, polymer
swelling and drug loading measurements ... 216
1. Experimental details ... 217 1.1 Experimental set-up ... 217 1.2 Experimental Procedure ... 218 2. Raman spectra and data processing ... 218
2.1 Raman spectra ... 218 2.1.a Choice of spectral bands of CO2 ... 219
2.1.b Choice of spectral bands of the polymer ... 220 2.2 Determination of polymer swelling and CO2 sorption: data processing ... 220
2.2.a Polymer swelling ... 220 2.2.b CO2 sorption ... 221 3. Results ... 223 3.1 PLLA ... 223 3.2 PET ... 224 3.3 PP ... 225 4. Conclusion ... 226 References of Appendices ... 228
21 In drug delivery, the current trend is to deliver the drug at the target site and to control the amount of released drug over time in order to tackle the problems of common administration ways. Indeed, the oral administration way suffers from poor drug bioavailability and can deteriorate the gut bacterial ecosystem. The intravenous routes can be preferred but the crossing of physiological barriers is the main encountered problem. In both case, the low solubility of many Active Pharmaceutical Ingredients (APIs) in body fluids limits the efficiency. Moreover, the drug is distributed in all the body and only a few amount of the total quantity reaches the target site and is really active. The remaining amount can accumulate in untargeted tissues or organs and can thus cause side effects.
As a solution, various polymer based drug delivery systems have been developed. One strategy is to modify implants that have been originally developed for a specific function for instance mechanical (sutures, stents) or optical (intraocular lenses) into drug-eluting implants. Thus, the implants not only fulfill their former function but also locally release a drug after implantation.
Surgical polymeric suture is one of the most implanted medical devices due to its ability either to close a wound or to immobilize prosthesis. In order to reduce the pain due to the inflammatory response after surgery, an anti-inflammatory drug should be added to the suture.
Several production process strategies have been developed to create drug-eluting sutures. Electrospinning or hot melt extrusion allow incorporating drugs into the polymer matrix during the suture manufacturing. Other techniques enable to post-add the drug to an already manufactured suture by creating an erodible coating containing the drug, grafting species on the surface that can interact with the drug or soaking the suture into a drug solution. Yet, these processes often require either high temperature that can degrade thermosensitive drugs or the use of toxic organic solvents that must be removed (which is time and energy-consuming).
In this context, the supercritical carbon dioxide (scCO2) assisted impregnation process
appears as an interesting alternative to load a drug into a preformed polymeric suture. Indeed, if very few polymers are soluble in this medium, CO2 in supercritical conditions (i.e. above
31°C and 73.8 bar) can be dissolved in a variety of polymers. Supercritical CO2 swells them
and thus temporary increases their free volume. Since scCO2 can solubilize different drugs of
interest such as some anti-inflammatory drugs, it can carry them into the swollen polymer matrix. The high diffusivity of scCO2 makes such impregnation process easy and fast. Being
environment friendly, inert, non-flammable, inexpensive, easy to remove from the system by depressurization after treatment, scCO2 offers several additional advantages as compared to
conventional organic solvents. Moreover, since the supercritical state of CO2 can be reached
at reasonable temperature, this process remains compatible with thermosensitive APIs.
In order to investigate the key parameters governing the supercritical carbon dioxide impregnation process and the possibility to apply it to create drug-eluting polymeric implants, the Group of Molecular Spectroscopy (GSM) at the Institute of Molecular Sciences (ISM) at the University of Bordeaux, France and the Center of Education and Research on Macromolecules (CERM) at the University of Liège, Belgium have combined their expertise. The Group of Molecular Spectroscopy is specialized in developing tools based on spectroscopy to investigate complex phenomena such as in situ investigation in high-pressure media. The CERM is specialized in polymer processing and polymeric biomaterials
22
engineering so the impregnation experiments in batch reactors and the characterization of the impregnated materials were performed at CERM.
The goal of this collaborative project has been to combine and correlate the information obtained with in situ spectroscopic measurements and traditional polymer characterizations techniques (SEM, DSC, tensile test, GPC…) to determine the key parameters governing the supercritical CO2 assisted impregnation process and to study the
possibility to prepare drug-eluting sutures with this process.
In this work, we have explored the impregnation of three commonly implanted monofilament polymeric sutures made of poly-L-lactide (PLLA), poly(ethylene terephtalate) (PET) and polypropylene (PP) with two non-steroid anti-inflammatory drugs namely ketoprofen and aspirin. The impregnation of polyethylene oxide PEO was also performed to complete the study, even if it cannot be used as suture due to its poor mechanical properties.
These four homopolymers are all semi-crystalline but possess distinct properties such as the thermal transition temperatures (glassy and melting temperatures), the presence or not of functional group that can interact with CO2 and the impregnated drug, the degradability….
The comparison of the loading of the two selected drugs into the three polymers can highlight the influence of the drug and its solubility in scCO2 on this process.
The scCO2 impregnation process involves three components: the polymer, the drug
and CO2 as a carrier. In order to understand the thermodynamic behavior of the ternary
systems {polymer+drug+CO2} we have firstly decomposed it in two binary systems:
{drug+CO2} and {polymer+CO2}. Since the physical properties of scCO2 (density and
diffusivity) can be tuned by varying the pressure and the temperature, the influence of these operational conditions on the thermodynamic behavior of all the systems have been studied.
This manuscript is composed of five chapters.
The first chapter is dedicated to the background and the state of the art and is composed of two parts. The first one concerns the polymer-based drug delivery systems and more specifically the drug-eluting implants and the traditional processes to produce it. The scCO2 impregnation process is introduced as an alternative to these traditional processes. The
second part presents the properties of supercritical CO2 and reviews the state-of-the-art of the
scCO2 impregnation process. The influence of the properties of the {polymer+drug+scCO2}
systems and of the influence of the operating conditions is reviewed, as well as the various applications of this process in the biomedical field.
In the second chapter, the investigation of the {drug+CO2} systems is achieved
through the study of the solubility of ketoprofen and aspirin in scCO2 as a function of pressure
and temperature thanks to FTIR spectroscopy. The solubility is modeled and the molecular state of the two drugs is studied. The evolution of the speciation of both drugs in CO2 is also
evaluated.
In the third chapter, the CO2 sorption and the polymer swelling of the four polymers is
investigated as a function of the pressure at 40°C. These in-situ measurements are performed with an original experimental set-up that we have developed for this purpose, which is based on the coupling of a high-pressure cell and a FTIR micro-spectrometer. Comparing the relative behaviors and the characteristics of the four polymers, we identified the parameters that govern the CO2 sorption and the polymer swelling.
The fourth chapter is dedicated to the impregnation of the four polymers with the two selected drugs. In the first part, we followed simultaneously and in-situ the CO2 sorption, the
set-23 up. The impact of both drug on the CO2 sorption and the polymer swelling of the sample are
highlighted. In the second part, the influence of operating conditions on the impregnation of the three fibers is explored and explained with the CO2 sorption and the swelling of the
matrices as well as the change of the polymers microstructure. The tensile properties of the impregnated fibers are tested and the molecular state of the drugs in the matrixes is evaluated.
Finally, the in vitro behavior of PLLA impregnated with ketoprofen is explored. The influence of the impregnation and depressurization conditions on the drug release is investigated in the last chapter. The influence of the drug on the degradation of PLLA is also studied.
A general conclusion ends this work, guidelines for the applicability of the scCO2
assisted impregnation process to prepare drug-eluting implants from already manufactured polymer implants are proposed as well as outlooks of this study.
Chapter I
27
TABLE OF CONTENTS
1. Drug-eluting systems ... 28 1.1 Generalities ... 28 1.2 Drug delivery systems ... 30 1.3 Drug-eluting implants ... 31 2. Drug-eluting sutures: production processes ... 33 2.1 API incorporated during the suture manufacturing ... 33 2.2 Post-addition of API to an already manufactured suture... 35 2.2.a API added onto the suture ... 35
2.2.a.i Coating ...35 2.2.a.ii Grafting on the suture surface ...36
2.2.b API loaded into the suture ... 37 2.3 Conclusion ... 38 3. Supercritical carbon dioxide impregnation process ... 40 3.1 Supercritical carbon dioxide ... 40 3.1.a Generalities and phase diagram ... 40 3.1.b Properties of supercritical carbon dioxide ... 41 3.2 Supercritical carbon dioxide impregnation process ... 42 3.2.a Key parameters governing the scCO2 impregnation process ... 43
3.2.b Influence of the characteristics of the binary systems on the drug loading ... 49
3.2.b.i {API+CO2}: Solubility of the drug in CO2 ...49 3.2.b.ii {Polymer+CO2}: CO2 sorption and polymer swelling ...49 3.2.b.iii {Polymer+API}: interactions ...50 3.2.b.iv Cosolvent: impact on the previous systems ...50
3.2.c Effect of experimental conditions on the drug loading ... 51
3.2.c.i Effect of temperature...51 3.2.c.ii Effect of pressure ...52 3.2.c.iii Contact time and diffusive process ...53 3.2.c.iv Depressurization rate ...53
3.3 Application of the scCO2 impregnation process in the biomedical field ... 53
3.3.a Drug-eluting implants ... 54
3.3.a.i Ophthalmic articles: lenses and subconjunctival implants ...54 3.3.a.ii Tissue engineering: sutures and scaffolds ...54 3.3.a.iii Other implants ...55
3.3.b Oral drug delivery ... 56 3.4 Other fields of application of the scCO2 impregnation process ... 56
3.4.a Generalities ... 56 3.4.b scCO2 dyeing of textiles ... 57
3.5 Processes ... 57 3.5.a Original process... 57 3.5.b Variation of the scCO2 impregnation process ... 58
3.6 Conclusion ... 59 References ... 60
28
This chapter introduces the necessity of delivering the Active Pharmaceutical Ingredients (APIs) locally and of controlling their release to improve the pharmaceutical action. The four kinds of polymer-based controlled delivery systems are presented, and more particularly the drug-eluting implants. We describe some representative examples of developed drug-eluting implants and the benefits brought by the addition of APIs to the original raw implants.
Then, the processes generally used to produce drug-eluting implants are detailed, focusing specifically on the production processes of drug-eluting sutures. The pros and the cons of each process are listed.
The supercritical carbon dioxide (scCO2) impregnation process is proposed as an
interesting alternative to the traditional production processes that enables to overcome some of their recurrent drawbacks. The principles of the process are explained. The key parameters governing this process and the effect of the operational conditions are reviewed. Finally, the biomedical applications of the scCO2 impregnation are presented.
1. Drug-eluting systems
1.1 Generalities
Finding solutions to treat body’s disorders is the first goal of medicine and has become an exigency of the 21th century in advanced countries. It can be achieved by surgery or drug therapy and the major goal is to improve the patient’s quality of life and avoid pain.
Pharmaceutical treatments are based on drug action that interacts with cellular processes in either promoting or preventing cellular activities. Decreasing or blocking infections, inflammation, treating cancers, diabetes, cardiovascular diseases, brains diseases or delivering contraceptive agents are some area of major importance in drug therapy.
Oral drug treatment is the most common administration route to deliver a drug since it is easy to produce and cheap for the patient. However, oral delivery suffers from some drawbacks. The oral drug dosage passes through the liver and the gastrointestinal tract where a lot of Active Pharmaceutical Ingredients (APIs) are degraded before entering into the blood that could transport it to the target site. Moreover, the release of the drug into the gastrointestinal tract produces side effects such as the deterioration of the gut bacterial ecosystem, which entails transit disorders. The intravenous routes can be preferred but the crossing of physiological barriers is the main problem. In both case, the low solubility of many APIs in body fluids limits their efficiency.
Moreover, the drug is distributed in all the body and only a few amount of the total quantity reaches the target site and is really active. The remaining amount can fix and accumulate in tissues or organs which have a good affinity for the molecule. The accumulation of the drug can thus cause side effects.
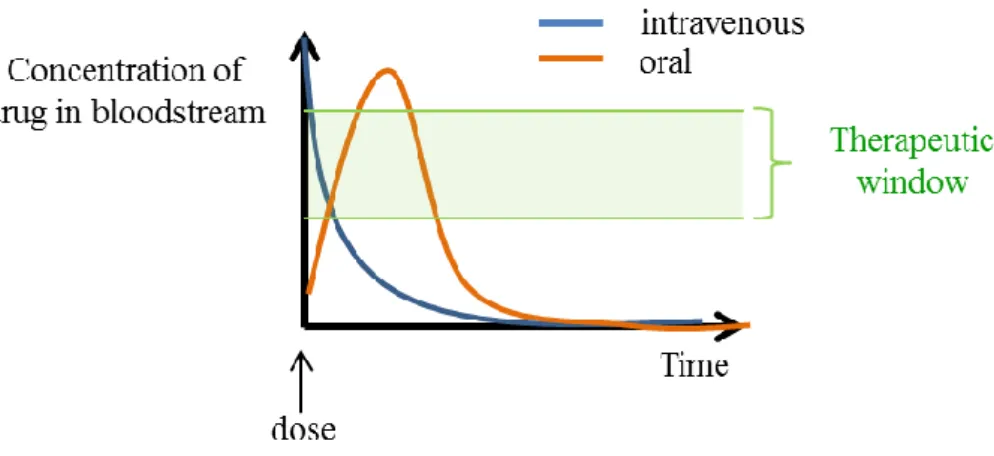
29 Figure I.1: Release profiles of oral drug delivery (─) and intravenous (─) compared to the therapeutic
window (─)
Figure I.1 shows the drug release profiles obtained by oral and intravenous delivery. The profiles are compared to the therapeutic window which is defined as the range of drug dosages that is efficient in treating the disorders while staying within the safety range. The period of dosage efficiency is narrow so it is necessary to increase the dosing frequency, which raises the probability of side effects and the discomfort for the patient.
Figure I.2: Comparison of release profiles of oral drug delivery (─) and a controlled drug delivery system (─)
In order to improve drug delivery, new controlled-release systems have been developed, with various objectives to be reached: to better control the amount of released drug over time, to protect the drug from degradation, to improve the capacity of drug to pass through the physiological barriers, to carry the drug to the targeted site of action thus avoiding the drug to spread all over the body and to improve the patient compliance by avoiding uncomfortable repeated administrations [1]. Figure I.2 shows the comparison of the release profiles of oral drug delivery and of a controlled drug delivery system. Various polymer-based controlled release delivery systems exist and have been listed elsewhere [2]. Among them, four kinds of systems can be highlighted: the carrier based delivery systems, the pumps, the reservoirs and the drug-eluting implants.
30
1.2 Drug delivery systems
The carrier based delivery systems include nanoparticles, nanocapsules, micelles, liposomes…[3, 4] In these systems, the drug is covered or trapped into a polymer. With this protection, it can stay longer in the systemic circulation compared to free drug. Moreover, the capsules are created to enable the drug to be delivered at the target site. For that purpose, various strategies have been created: the capsule can be pH sensitive or can trigger the drug release under other external stimuli. Another solution is to add targeting ligands to the polymer surface that can interact preferably with specific cells thus allowing the delivery of the drug into these cells after internalization.
The second category of polymer-based controlled release delivery systems is the pumps. Osmotic or pressure pumps are placed under the skin and work thanks to the osmotic force or mechanical pressurization respectively. For example, the osmotic pump has generally a cylinder-shape and contains two compartments separated by a piston, the first one being filled by an osmotic agent and the second one containing the drug (see figure I.3). Both extremities of the cylinder are drilled. By entering into the first compartment, the water pushes on the piston, which compresses the drug compartment entailing the drug release at the other side of the cylinder. In DurosTM osmotic pump, the drug can be released continuously over 3 to 12 months [5]. This kind of device is used to treat diseases of long duration such as diabetes type 2 or prostate cancer.
Figure I.3: Operating of an osmotic pump
In reservoirs systems – also called depots- the drug is incorporated into a polymeric matrix that forms an implant. The only function of the device is to contain the necessary amount of drug and to release it in a controlled way. In those devices, the drug is released by diffusion process and/or by polymer erosion and the profile is optimized by tuning the properties of the polymeric matrix (nature, adsorption rate, interaction with the drug, porosity…). One can distinguish two kinds of reservoirs systems:
The transdermal systems: they are applied on the skin (such as contraceptive or nicotine patches). The drug crosses the epithelial layers to enter into the blood stream.
The implantable systems: they can be either solid polymers or in liquid form that solidified when injected subcutaneously in the body. The solid implants are usually in rod-like shape or wafers and are implanted directly at the desired site of action. For example the commercialized OZURDEX device (see
31 figure I.4) is a thin rod made of PLGA inserted into the vitreous part of the eye and which delivers an anti-inflammatory drug (dexamethasone) to reduce the swelling of retinal veins responsible for macular edema [6]. Another example is the GLIADEL wafer which is placed at the surgery site after removal of a brain tumor and which delivers a chemotherapeutic agent which destroys the remaining cancer cells [7]. Such kind of implantable reservoirs is also advantageously used in contraceptive local delivery like the intravaginal rings that do not require any surgery [8]. These implants can contain a significant amount of drug as compared to the nanocarriers because of their larger size, so that it is possible to release the drug over a long period of time (several months, even years) by adjusting the chemical, physical properties and shape of the polymer. Finally, the local delivery of the drug decreases the undesired systemic effect.
The last category of polymer-based drug delivery systems implies implants which have been originally developed for a specific function, for instance mechanical (sutures, stents) or optical (intraocular lenses) that are valuably modified into drug-eluting implants. They thus not only fulfill their former function but also locally release a drug after implantation. Since the present project focuses on the development of such drug-eluting implants, they are more deeply discussed in the following.
Figure I.4: Examples of reservoir implants a) OZURDEX (reproduced from ref [9]); b) GLIADEL wafer (reproduced from ref [7]); c) NUVARING Intravaginal contraceptive ring
(reproduced from ref [8])
1.3 Drug-eluting implants
The treatment of some diseases sometimes requires the replacement by or the help of a synthetic medical device that is implanted in the body through a surgery. For example, the cataract that results from the opacification of the crystalline, the natural lens of the eyes, is cured by replacement of the opacified crystalline lens by a polymer artificial lens of adapted optical properties. After implantation of a device, the patient generally undergoes a pharmaceutical treatment. An interesting alternative to traditional API uptake can be to incorporate the drug to the implant, thus transforming it into a drug-delivery implant also called drug-eluting implant able to deliver the API in its vicinity. The final product is considered as a ‘combination product’ by FDA since it combines an implant and a drug both approved by FDA in the same device [10].
32
Numerous drug-eluting implants are currently in development. The main motivations are the reduction of postoperative discomfort and the prevention of bacterial infections by adding to the implant either an anti-inflammatory or an antimicrobial drug, respectively. Such devices include, cochlear implants [11], bone screws and prosthetic joints [12], intraocular lenses [13-15], sutures [16, 17] but the most significant example of such a kind of system is the drug-eluting stent.
Atherosclerosis is a pathology that causes heart attack and which is due to an increase in concentration of cholesterol into the arteries which can get obstructed. When the atherosclerosis become dangerous, a metallic stent can be implanted into the coronary artery, in order to mechanically open the artery and ensure the blood circulation to the heart. Unfortunately, the obstruction of the operated coronary artery reappears in 30 up to 50% of the patients that underwent a stent implantation after less than one year [18]. Thus, the stents have been improved by adding them inhibitor of cell proliferation agents thanks to a polymer-based drug coating onto the surface of the device. In that case, it has been shown that the reoccurrence of coronary obstruction fell to less than 5% [19]. Usually, the drug is contained into a polymer-based coating deposited on the surface of the stent, the polymer being absorbable or not. It is the case for Taxus® stent of Boston Scientific, Cypher® stent of Cordis, INFINNIUM®, Sahajanand Medical and EXCEL, JW Medical Systems [20].
Among the drug-eluting devices, we can also highlight the products developed by Ethicon: the MONOCRYL Plus, the PDS™ Plus and the Coated VICRYL™ Plus Antibacterial sutures which are three absorbable sutures made of a copolymer of glycolide and ε-caprolactone, poly(p-dioxanone) and poly(glycolic-co-lactic) acid respectively. All these sutures have antibacterial properties brought by triclosan. This broad spectrum antibacterial drug is embedded into a coating of PLGA surrounding the sutures. The problem to be tackle is the surgical site infection since the risk of bacteria adhesion and consequent biofilm formation on the surface of an implant is high (see figure I.5.a) and is responsible for nosocomial diseases, which are currently highly difficult to cure. As one can see on figure I.5.b, the drug-eluting suture enables to reduce the adhesion of bacteria on the surface. To the best of our knowledge, it is the only drug-eluting sutures on the market.
Figure I.5: a) Surface of raw suture colonized by bacteria b) Surface of the antibacterial-eluting suture MONOCRYL Plus. (Reproduced from ref [21])
These examples evidence that transforming an implant into a drug-eluting implant enables either to improve the efficiency of the implant (ex: drug-eluting stent) or to treat problems entailed by surgery and associated risks (ex: drug-eluting suture).