HAL Id: tel-01264533
https://tel.archives-ouvertes.fr/tel-01264533
Submitted on 29 Jan 2016
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
homéoprotéines
Thibault Lin
To cite this version:
Thibault Lin. Mécanismes du transfert intercellulaire des homéoprotéines. Biologie cellulaire.
Uni-versité Pierre et Marie Curie - Paris VI, 2015. Français. �NNT : 2015PA066346�. �tel-01264533�
Ecole doctorale Complexit´
e du Vivant
Centre Interdisciplinaire de Recherche en Biologie
k
M´
ecanismes du transfert intercellulaire
des hom´
eoprot´
eines.
Par Thibault Lin
Th`ese de doctorat de Biologie Cellulaire
Dirig´ee par Alain Joliot
Pr´esent´ee et soutenue publiquement le 24 septembre 2015
Devant un jury compos´e de :
P
rAlain Trembleau
Pr´esident
D
rEvelyne Bloch-Gallego Rapportrice
rEn premier lieu, je suis extrêmement reconnaissant envers le Professeur A. Trembleau de me faire l’honneur de présider ce jury de thèse.
Je tiens à remercier tout particulièrement les Docteurs E. Bloch-Gallego et B. Beaumelle d’avoir accepté d’être les rapporteurs de cette thèse ainsi que d’avoir consacré de leur temps à l’examen de mon travail.
Mes plus sincères remerciements sont également adressés au Docteur F. Bur-lina pour sa présence au sein de ce jury.
Bien entendu, je remercie infiniment A. Joliot sans qui rien de tout cela n’aurait été possible. Tout d’abord pour l’opportunité qu’il m’a offerte de pou-voir réaliser ces travaux de doctorat mais aussi pour son implication sans faille dans ceux-ci. Ensuite pour son enthousiasme et sa persévérance qui ont su mettre en déroute mon pessimisme naturel. Enfin pour ses grandes qualités scientifiques au premier rang desquelles son honnêteté intellectuelle fait pour moi figure d’exemple. Pour l’ensemble de ces raisons, ces cinq années passées sous sa direction resteront pour moi un excellent souvenir. Merci, tout simple-ment !
Tous ces moments passés au laboratoire n’auraient pas été les mêmes sans la rencontre de nombreuses personnes que je tenais à remercier :
Edmond pour ton aide, nos innombrables discussions scientifiques ou non, les litres de café ingurgités en ta compagnie, et surtout pour ta bonne humeur légendaire. Travailler quotidiennement à tes côtés a été un réel plaisir.
Valérie pour avoir supporté, non sans mal, ma compagnie parfois peu lo-quace ainsi que pour ton aide.
Julie et Lorenzo pour m’avoir guidé lors de mon arrivée dans le laboratoire et transmis leur savoir-faire.
L’intégralité des membres de notre équipe nouvellement formée : Sophie, Christine, Carole, Francesca, Marion ainsi que Michel. Merci pour vos conseils avisés, le regard nouveau que vous avez porté sur mes travaux, et ces réunions de labo que bon nombre nous envie.
Vincent pour avoir supporté mes bruyantes sessions de FACS et pour ta gentillesse.
Anabelle, Anne-Cécile, Clémence, Clémentine, Damien, François-Xavier, Ho-cine, Jessica, Karen et Raoul pour tous les bons moments passés en vos compa-gnies que ce soit autour de la machine à café ou sur les chaises usées du Zig-zag.
Ken, Navy, Olivia, Patricia et Rajiv.
Enfin, je tenais à remercier mes amis Dylan, Jimmy, Korentin, Lucas et Mi-chaël qui bien que faisant face la plupart du temps à des réponses laconiques de ma part, n’ont cessé de s’enquérir de l’état d’avancement de mes travaux tout au long de ces années de thèse.
Pour finir, je remercierai mes parents, mes sœurs, Christophe, Philippe et Valentin pour tout le reste (et ça en fait des choses !).
Table des figures
v
Liste des tableaux
vi
Liste des abréviations
x
I
Introduction
1
1 La théorie cellulaire, à la base de la biologie cellulaire moderne. 2 1.1 Genèse de la théorie cellulaire : De Hooke à Schwann et
Schlei-den. . . 2
1.2 Théorie cellulaire moderne : omnis cellula e cellula. . . 3
1.3 La cellule comme unité fondamentale du vivant. . . 4
2 De la cellule à l’organisme, morphogenèse et homéoprotéines. 5 2.1 Organismes pluricellulaires et morphogenèse. . . 5
2.2 Transformations homéotiques : observations et naissance du concept. 6 2.3 Du phénotype aux gènes, description des premiers gènes homéo-tiques. . . 6
2.4 L’homeobox, séquence commune aux gènes homéotiques. . . 7
2.5 Structure et fonction de l’homéodomaine : l’homéoprotéine comme facteur de transcription. . . 9
2.5.1 Structure protéique de l’homéodomaine. . . 9
2.5.2 Sites de liaisons à l’ADN. . . 9
2.5.3 Fonction physiologique. . . 10
3 Homéoprotéines, facteurs de transcription aux propriétés re-marquables. 11 3.1 Internalisation d’ANTENNAPEDIA, premier indice d’un trans-fert intercellulaire des homéoprotéines. . . 11
3.2 L’homéodomaine comme élément central de cette internalisation. 12 3.3 Sécrétion des homéoprotéines : le cas ENGRAILED-2. . . 13
3.3.1 Brefs rappels des fonctions d’ENGRAILED. . . 13
3.3.2 Mise en évidence et mécanismes connus de la sécrétion d’ENGRAILED-2. . . 14
4.1 La sécrétion à la base de la communication cellulaire. . . 18 4.1.1 La voie reticulum endoplasmique / appareil de Golgi /
vésicules de sécrétion : mode de sécrétion canonique. . . . 19 4.1.2 En opposition à la voie canonique, les modes de sécrétion
non-conventionnels. . . 23 4.1.3 Une classification arbitraire et non figée. . . 30 4.2 Après la sécrétion : différents mode d’intégration du signal transmis. 30 4.2.1 Les différentes voies endocytiques. . . 31 4.2.2 Détournement des voies endocytiques. . . 34 4.3 Implications physiologiques du transfert intercellulaire des
ho-méoprotéines. . . 37 4.3.1 Action paracrine de l’homéoprotéine OTX2. . . 37 4.3.2 Action paracrine de l’homéoprotéine ENGRAILED. . . . 38 4.3.3 Autres modèles d’action paracrine. . . 39 4.3.4 Action paracrine des homéoprotéines et pathologies. . . . 40
II
Matériels et méthodes
43
III
Résultats
49
5 Etude comparée de la sécrétion du FGF2 et d’EN-2. 51
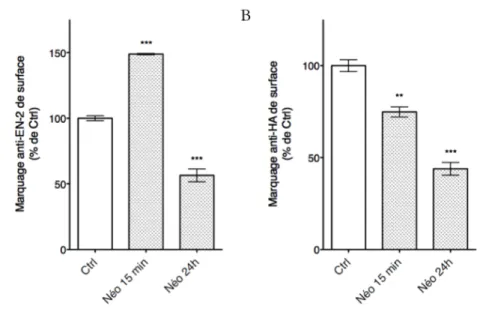
5.1 Propriétés communes. . . 51 5.2 Méthode de quantification de la sécrétion. . . 53 5.3 Altérations de la sécrétion après traitement à la néomycine. . . . 53
6 Les phosphoinositides. 58
6.1 Brefs rappels des fonctions et rôles connus des phosphoinositides. 58 6.2 Mise en évidence d’une interaction directe entre EN-2 et
phos-phoinositides. . . 60 6.2.1 Interaction avec des bicouches lipidiques artificielles. . . . 60 6.2.2 Interaction directe in vitro. . . 61 6.3 Localisation subcellulaire et phosphoinositides. . . 63 6.4 Rôle des PI(4,5)P2 dans la sécrétion d’EN-2 et du FGF2 :
ap-proche sub-cellulaire. . . 63 6.4.1 Présentation des outils utilisés. . . 66 6.4.2 Validation biologique des constructions mises au point. . . 66 6.4.3 Analyse de la sécrétion de EN-2 et du FGF2. . . 67 6.5 Rôle des PI(4,5)P2 dans l’internalisation d’EN-2. . . 70
6.5.1 Technique utilisée pour l’observation de l’internalisation. . 70 6.5.2 Un lien entre PI(4,5)P2 membranaires et internalisation
d’EN-2. . . 72
7 Les protéoglycanes. 76
7.1 Présentation des protéoglycanes. . . 76 7.2 Importance des protéoglycanes de surface dans l’internalisation
7.2.2 L’expression de syndecans favorise l’accumulation d’EN-2 à la surface des cellules. . . 77 7.3 Impact de l’expression de syndecans sur la sécrétion d’EN-2. . . . 79 8 Implication d’une nouvelle séquence dans le transfert
intercel-lulaire d’EN-2. 82
8.1 Un nouveau rôle pour l’hexapeptide ? . . . 82 8.2 Article no1 ; Contrôle de la segmentation du cerveau en
déve-loppement par le transfert paracrine d’Engrailed : une nouvelle fonction du domaine d’interaction avec Pbx. . . 85
IV
Discussion
87
9.1 Rôle des PI(4,5)P2dans le transfert intercellulaire de EN-2. . . . 88
9.2 Rôle des protéoglycanes dans le transfert intercellulaire de EN-2. 89 9.3 Interactions hydrophobes et électrostatiques, un équilibre subtil ? 89
Bibliographie
94
1 Le mutant bithorax . . . 8
2 Structure de l’homéodomaine . . . 8
3 Domaines conservés de la protéine ENGRAILED . . . 17
4 La voie de sécrétion classique. . . 20
5 Rôle des protéines SNAREs dans la fusion membranaire. . . 21
6 Les différentes protéines SNAREs impliquées dans les voies en-docytiques et de sécrétion chez les mammifères. . . 22
7 Les principales voies endocytiques. . . 34
8 Modèle de régulation par OTX2 de la plasticité du cortex visuel. 38 9 Marquage fluorescent de la protéine EN-2 purifiée. . . 47
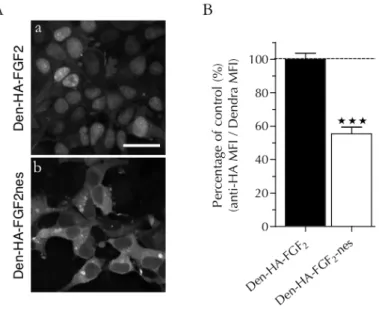
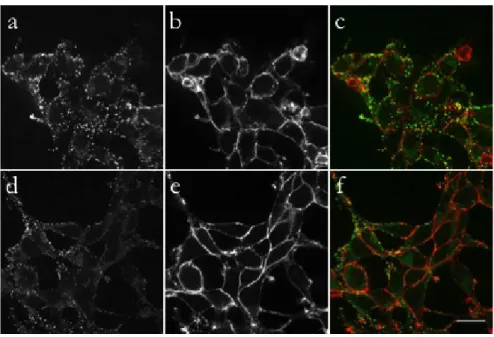
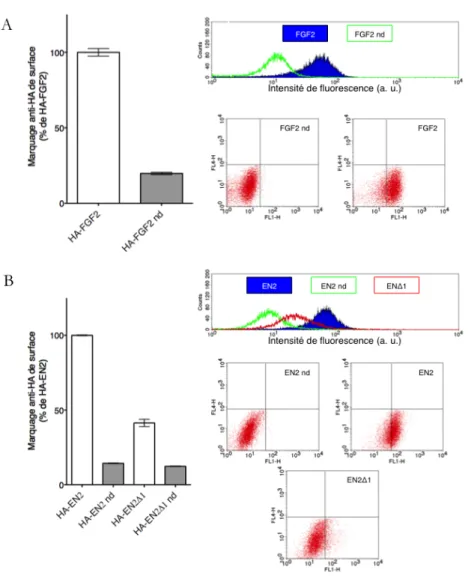
10 Effet de la relocalisation cytoplasmique du FGF2 sur sa sécrétion. 52 11 Visualisation d’EN-2 et du FGF2 à la surface des cellules. . . 54
12 Quantification de la sécrétion par cytométrie en flux. . . 55
13 Effet de la néomycine sur la sécrétion d’EN-2 et du FGF2. . . 57
14 Interaction directe entre EN-2 et le PI(4,5)P2 in vitro. . . 62
15 La relocalisation cytosolique de EN-2 entraîne une diminution de sa sécrétion. . . 64
16 Effet de la néomycine sur l’association de EN-2 avec les mem-branes cellulaires. . . 65
17 Localisations intracellulaires de domaines protéiques interagis-sant avec le PI(4,5)P2. . . 68
18 Localisation et activité enzymatique d’OCRL et nlsOCRL. . . 69
19 Influence de l’expression de OCRL et PHPLC sur la sécrétion de EN-2 et du FGF2. . . 71
20 Visualisation de l’internalisation d’EN-2. . . 73
21 La protéine EN-2 internalisée colocalise partiellement avec la Caveolin-1. . . 74
22 Influences de la néomycine et d’OCRL sur l’internalisation d’EN-2. 75 23 Les différentes classes de glycosaminoglycanes. . . 78
24 La présence de GAGs à la surface cellulaire est requise pour l’in-ternalisation de EN-2. . . 78
25 L’expression des SDC-1 et SDC-2 favorise l’accumulation de EN-2 extracellulaire à la surface des cellules. . . 80
27 Influence du pH sur la charge théorique globale de EN-2. . . 92 28 Le pH extracellulaire modifie l’internalisation de EN-2. . . 93
1 Les différentes grandes voies endocytiques. . . 35 2 Localisations et fonctions des phosphoinositides. . . 59 3 Interaction directe entre EN-2 et les phosphoinositides . . . 64
4E-BP1 eIF4E binding protein 1
Antp Gène Antennapedia
bpag-1 Gène de Bullous pemphigoid antigen 1
bx+ Gène bithorax
bxd+ Gène bithoraxoid
fgf8 Gène de fibroblast growth factor 8
ftz Gène fushi tarazu
iab-2+ Gène infra-abdominal-2
iab-3+ Gène infra-abdominal-3
iab-5+ Gène infra-abdominal-5 iab-8+ Gène infra-abdominal-8
map-1b Gène de Microtubule-associated protein 1B
Ubx+ Gène Ultrabithorax
ABC1 Transporteur ATP Binding Cassette 1
ADN Acide desoxyribonucléique
ANT-C Complexe polygénique Antennapedia
ANTP Protéine Antennapedia
ANTP-HD Homéodomaine d’Antennapedia
ANX2 Annexine 2
AP-2 Adaptator Protein 2
Ape1 Vacuolar aminopeptidase 1
APP Amyloid precursor protein
ARF1 ADP-ribosylation factor 1
ARN Acide ribonucléique
Atg8/9 Autophagy related protein 8/9
BFA Bréfeldine A
BX-C Complexe polygénique Bithorax
CCP Clathrin-Coated Pits
CDC42 Cell division control protein 42 homolog
CFTR cystic fibrosis transmembrane conductance regulator
CK2 Caséine kinase 2
CLIC Clathrin-independant carrier CNF1 Cytotoxic necrotizing facor 1 COPI / II Coat protein complex I / II
CTxB Sous-unité B de la toxine cholérique
CUPS Compartment for unconventional protein secretion Cx26 / 30 Connexine 26 / 30
DAT Sodium-dependent dopamine transporter DMEM Dulbecco’s Modified Eagle Medium
Dpp Decapentaplegic protein
EDC Endocytose dépendante de la clathrine EDTA Ethylène diamine tétra-acétique
EGF Epidermal growth factor
EGFR Epidermal growth factor receptor EGTA Ethylène glycol tétra-acétique
EH-1 Engrailed homology domain 1
eIF4E Eukaryotic translation initiation factor 4E EMX1/2 Empty spiracles-like protein 1/2
EN Protéine Engrailed
EN-1 Protéine Engrailed-1
EN-2 Protéine Engrailed-2
EndoH Endoglycosidase H
ESCRT Endosomal Sorting Complex Required for Transport EXD Homeobox protein extradenticle
FGF1 / 2 Fibroblast Growth Factor 1 / 2 FPLC Fast protein liquid chromatography
GRAF-1 GTPase regulator associated with focal adhesion kinase-1 GRASP Golgi reassembly stack protein
Grh1 GRASP65 homolog protein 1
GTP Guanosine triphosphate
HIV-1 Human Immunodeficiency Virus 1
HMGB1 High Mobility Group Box 1
HOM-C Complexe polygénique homéotique HSC70 Heat shock cognate 70 kDa protein 1 HSP70 70 kDa Heat shock protein
HSP90 Heat shock protein 90 HSPG Heparan-sulfate proteoglycan
IL-1β Interleukine 1β
kDa kiloDalton
KN-1 Protéine Knotted-1
MATα1/α2 Mating-type protein α1/α2
MIF Macrophage migration Inhibition Factor MMP-14 Matrix metalloproteinase-14
mTOR mammalian Target of rapamycin
MVB Multi-vesicular body
NKX3.1 Homeobox protein NK-3 homolog A
OPC Précurseur d’oligodendrocyte
OTX2 Orthodenticle homeobox 2
P2X7 P2X purinoceptor 7
p40Syn1 Fragment protéolytique de 40 kDa de la synaptogamine 1 PAGE Polyacrylamide gel electrophoresis
PAX6 Paired box protein 6
PBS Phosphate-buffered saline
PBX1 Pre-B-cell leukemia transcription factor 1 PDGFR Platelet-derived growth factor receptor
PE Exotoxine A de Pseudomonas
Pep12 Carboxypeptidase Y-deficient protein 12 PI(3)P Phosphatidylinositol 3-phosphate
PI(3,5)P2 Phosphatidylinositol-3,5-bisphosphate
PI(4)P Phosphatidylinositol 4-phosphate PI(4,5)P2 Phosphatidylinositol-4,5-bisphosphate
PI(5)P Phosphatidylinositol 5-phosphate
PINCH Particularly interesting new Cys-His protein 1 PMT Toxine de Pasteurella multodica
PNN Perineuronal net
PRD Protéine Paired
PTEN Phosphatase and tensin homolog
PV Parvalbumine
PVDF Poly(fluorure de vinylidène) RAB1a Ras-related protein Rab-1A RAB2 textitRas-related protein Rab-2 RAB8a Ras-related protein Rab-8A
RAC1 Ras-related C3 botulinum toxin substrate 1 RGC Neurone ganglionnaire de la rétine
RhoA Transforming protein RhoA
RISC RNA-Induced Silencing Complex
SDS Dodécysulfate de sodium
SK1 Sphingosine kinase 1
SNARE Soluble N-ethylmaleimide-sensitive-factor attachment protein re-ceptor
SRD Serin-rich domain
SRP Signal recognition particle STxB Sous-unité B de la Shiga toxine
SV40 Simian Virus 40
TBS Tris-buffered saline
TCTP Translationally-controlled tumor protein
TGN Trans-Golgi network
Tlg1 T-SNARE affecting a late Golgi compartment protein 1 tTG / TG2 tissueTransglutaminase / Transglutaminase 2
La théorie cellulaire, à la base
de la biologie cellulaire
moderne.
Un des enjeux majeurs de la biologie a été de comprendre ce qui différencie matière vivante et inerte. En ce sens, l’établissement de la théorie cellulaire a engendré un changement de conception du vivant, en mettant en avant une structuration microscopique propre au monde vivant. Les travaux entrepris au cours de cette thèse se centrant autour de l’étude du comportement de protéines à l’échelle cellulaire, il me semble important de rappeler brièvement comment a émergé la notion, qui nous est aujourd’hui familière, de cellule.
1.1
Genèse de la théorie cellulaire : De Hooke à
Schwann et Schleiden.
La naissance du concept de cellule est étroitement liée aux premières obser-vations de la structure de la matière vivante au niveau microscopique. Ainsi, la conception des premiers outils permettant de telles observations a constitué l’étape de départ à l’élaboration de la théorie cellulaire. On attribue à Antoni von Leeuwenhoek (1632-1723) la paternité des premiers microscopes mo-dernes, qu’il utilisera pour observer des particules microscopiques mouvantes1.
En 1676, dans une lettre adressée à la Royal Society [1], il détaille de nombreuses observations effectuées sur de l’eau de diverses origines (pluie, mer, neige. . .) dans laquelle il décrit la présence de très nombreux « animalcula » de tailles minuscules et de formes variables. Il est ainsi un des premiers à mettre en avant la structuration à l’échelle microscopique du vivant (et par la même occasion à offrir la première description de protozoaires). Bien qu’il soit également à l’ori-gine de la description des globules rouges du sang, il n’établira pas lui-même de principe de structuration global du vivant à l’échelle microscopique. La nais-sance d’un tel principe est plutôt à aller chercher du côté des travaux de Robert Hooke (1635-1702). Lui aussi précurseur dans le domaine de la microscopie, il
est le premier à introduire le terme de cellule2, en 1665 dans Micrographia, pour
décrire l’organisation en petites unités répétées d’une tranche liège. Bien qu’il n’utilise pas ce terme avec le sens qu’on lui donne aujourd’hui3, son utilisation
future provient directement de cet ouvrage. En 1831, Robert Brown observe et nomme pour la première fois le noyau cellulaire dans des cellules épidermiques d’orchidées. Il évoque « a single circular areola, generally somewhat more opake than the membrane of the cell [. . .] This areola, or nucleus of the cell as perhaps it might be termed, is not confined to the epidermis, being also found [. . .] in many cases in the parenchyma or internal cells of the tissue » [2]. En décrivant la présence d’une structure récurrente au sein des cellules d’une plante, il est un des premiers à apercevoir l’organisation d’un organisme en terme de consti-tuants cellulaires et plus seulement en termes d’organes et de tissus. Bien qu’il y ait débat sur la question4, on attribue généralement la formulation de la théo-rie cellulaire à Matthias Jakob Schleiden (1804-1881) et Theodor Schwann (1810-1882). En 1838, le premier propose que chaque élément constituant d’une plante est lui même composé de cellules ou de produits de celles-ci [4]. L’année suivante, Schwann propose à son tour que tous les tissus, quels qu’ils soient, sont composés de cellules, et que le développement de tout organisme passe né-cessairement par la formation de cellules [5]. Les bases de la théorie cellulaire sont ainsi clairement établies, à savoir que i) tous les organismes vivants sont constitués de cellules et que ii) la cellule est l’unité de structure et de fonction fondamentale du vivant. Restent cependant en suspend plusieurs interrogations comme celle de l’origine des cellules, ou bien encore de leur ultrastructure.
1.2
Théorie cellulaire moderne : omnis cellula e
cellula.
Schleiden propose une théorie selon laquelle les cellules se forment par un processus de cristallisation progressif autour d’un noyau dans la substance in-tracellulaire. C’est en s’opposant à cette hypothèse que Robert Remark (1815-1865), Rudolf Virchow (1821-1902) et Albert Kölliker (1817-1905) vont ajouter un nouveau principe fondamental à la théorie cellulaire, à savoir que toute cellule provient obligatoirement d’une cellule pré-existante, illustré par Virchow et la locution latine omnis cellula e cellula5. La cellule, qui est d’abord vue comme un « sac », délimité par une membrane, contenant une substance vis-queuse (le « protoplasme ») dans lequel flotte un noyau, va très vite être l’objet de nombreuses études visant à en comprendre la structure. Les progrès impor-tants en microscopie de la fin du XIXesiècle (objectifs à immersion et apparition
de nouvelles techniques de fixation / coloration) vont engendrer de nombreuses découvertes : l’observation de la chromatine lors de la division cellulaire (par Walther Flemming) en 1882, le reticulum endoplasmique (par Charles Gar-nier) en 1897, la mitochondrie (par Carl Benda) ou encore l’appareil de Golgi
2. Du latin Cella « petite pièce » et de son dérivé Cellulæ utilisé à l’époque pour décrire les alcôves des ruches.
3. Il décrit ces cellules comme des canaux permettant la circulation de liquides dans la plante.
4. Dès 1824, Henri Dutrochet affirme que « tout, en effet, dérive évidemment de la cellule dans le tissu organique des végétaux, et l’observation vient de nous prouver qu’il en est de même chez les animaux. » [3]
(par Camillo Golgi) en 1898. Flemming est également à l’origine de la descrip-tion de la mitose et de ses différentes phases, et note la séparadescrip-tion longitudinale de structures filamenteuses nucléaires (nommées « chromosomes » par Heinrich Wilhelm Waldeyer en 1888) qu’il suggère comme étant équitablement répar-ties entre les deux cellules filles [6]. Les neurones6, resteront longtemps à l’écart
de la théorie cellulaire, du fait de la difficulté à les observer. Ils seront longtemps considérés comme un immense réseau syncytial. L’accumulation d’observations de neurones individualisés (notamment par Santiago Ramòn y Cajal) permis l’émergence de la théorie du neurone, qui n’est autre que l’application de la théorie cellulaire aux neurones. Il faudra attendre l’observation de la synapse grâce à la microscopie électronique dans les années 1970 pour valider définitive-ment la théorie du neurone, et permettre ainsi l’avènedéfinitive-ment complet de la théorie cellulaire, formulée près de 150 ans plus tôt.
1.3
La cellule comme unité fondamentale du
vi-vant.
La conceptualisation de l’organisation du vivant découlant de la théorie cel-lulaire, et surtout dans le cas des organismes pluricellulaires, en une somme de briques élémentaires de même origine soulève ainsi de nombreuses interroga-tions, une des principales étant de savoir si et comment les organismes s’auto-structurent. L’organisme n’est donc plus seulement un assemblage de tissus et d’organes mais une communauté de clones cellulaires, puisque tous descendants de la même cellule œuf, qui se sont/ont été organisés et différenciés pour former un organisme fonctionnel. En outre, l’extrême reproductibilité de ce processus implique qu’il n’est pas la résultante du hasard mais de mécanismes robustes.
De la cellule à l’organisme,
morphogenèse et
homéoprotéines.
2.1
Organismes pluricellulaires et morphogenèse.
Déjà mise à mal par la théorie cellulaire, la théorie préformiste va connaître un coup d’arrêt avec les travaux de H. Driesch [7], en 1894, qui montrent que jusqu’au stade 8-cellules, chaque blastomère isolé de l’embryon d’oursin est ca-pable de donner un oursin complet. Chaque cellule contient donc toutes les infor-mations nécessaires à la formation d’un organisme complet (épigenèse). Cepen-dant Driesch estime qu’à l’heure où il avance ces idées, la connaissance que l’on a des lois physico-chimiques ne permet pas de comprendre l’auto-structuration du vivant. Une des premières tentatives visant à expliquer ces processus nous est fournie par A. Turing en 1952 [8]. Dans The chemical basis of Morphoge-nesis, il va poser un des problèmes centraux de la biologie de l’époque, le lien entre morphologie et information génétique. Turing part du principe que les gènes peuvent être vu comme des catalyseurs qui influencent l’anatomie d’un organisme en modulant la vitesse/rendement des réactions qu’ils catalysent. Il introduit ensuite la notion de morphogène comme : « chemical substances, cal-led morphogens, reacting together and diffusing through a tissue ». Il propose qu’initialement ces morphogènes soient uniformément distribués puis que via des interactions entre eux ils se répartissent en patrons organisés spatialement. Ensuite, ces morphogènes distribués de manière non-homogène dans le tissu vont activer des réactions chimiques (par l’intermédiaire de l’activation de gènes) qui donneront à ce tissu sa forme finale/attendue/développée. Tout en notant le côté novateur de ce modèle, C.H. Waddington émettra quelques réserves sur la théorie de Turing7, notamment que ce modèle ne permet pas d’expliquer
comment est régulée la taille finale des organismes ni comment apparaissent au sein de l’embryon un nombre fini d’organes et de tissus (sans états intermé-diaires). Peu à peu, ces mécanismes d’auto-structuration lors du développement ne vont plus être appréhendés d’un point de vu purement spatial (espace
sique) mais comme des relations entre des réseaux génétiques dans des états donnés. En 1969, L. Wolpert introduit le concept d’information positionnelle [9] et son célèbre « French Flag model » qui permet d’expliquer l’apparition de structures distinctes (comme les bandes bleues, blanches et rouges du drapeau français) au sein d’un espace donné, et ce peu importe la taille effective de cet espace physique. En 1972, A. Gierer et H. Meinhardt proposeront un modèle assez proche de celui de Turing mais tenant compte des aspects moléculaires et cellulaires à la base des phénomènes observés [10]. Cependant, ces modèles se heurtent à une limitation majeure, celle de ne pas connaître la nature molécu-laire de leurs acteurs. C’est grâce à l’observation d’anomalies développementales qu’une partie des gènes à la base de la morphogenèse vont pouvoir être identifiés.
2.2
Transformations homéotiques : observations
et naissance du concept.
William Bateson8décrit pour la première fois, en 1894, des cas d’animaux
dont une partie du corps a été remplacée par une autre (abeilles avec des pattes à la place des antennes, des écrevisses avec des oviductes supplémentaires, ou encore des cas de polydactylie, ou un nombre de côtes anormal chez l’Homme). Il nomme ce phénomène « homeosis » et caractérise ce genre de transforma-tion par l’adjectif « homéotique » [11]. En 1915, Calvin B. Bridges décrit le premier cas d’un mutant homéotique chez la drosophile (qui s’avérera être le modèle de choix pour la découverte des gènes homéotiques). Ce mutant, qu’il nomme bithorax (bx), présente un troisième segment thoracique converti en second segment thoracique, et donne donc une mouche dont les haltéres sont remplacées par une paire d’ailes. Bridges, qui « cartographie » la mutation bx, est le premier à établir un lien entre transformation homéotique et une mutation donnée [12]. Cependant, les mécanismes à l’œuvre derrière ces modifications du plan d’organisation restent non élucidés.
2.3
Du phénotype aux gènes, description des
pre-miers gènes homéotiques.
En 1971, J. H. Postlehwait et H. A. Schneiderman [13] décrivent la morphogenèse de l’antenne chez le mutant antennapedia de la drosophile, où les antennes sont remplacées par des pattes. Ils proposent que les transformations homéotiques proviennent d’un dérèglement de gènes de contrôle entrainant les cellules d’un programme développemental à un autre (ici de l’antenne vers la patte). C’est avec les travaux de E. B. Lewis, qu’il résume en 1978 [14], que le premier lien direct entre un complexe génique et le développement d’une partie d’un organisme est établi. Il montre que le complexe polygénique bithorax (BX-C), localisé sur le chromosome 3, est responsable de la segmentation thoracique et abdominale de l’embryon de drosophile, via la modulation de l’état de répres-sion des 8 gènes qui le compose (bx+, pbx+, Ubx+, bxd+, iab-2+, iab-3+, iab-5+,
8. A qui on doit également l’introduction publique, en 1905, du terme « génétique », du grec genn¯o, γεννώ (« donner naissance »), utilisé en tant que nom pour désigner l’étude de l’hérédité et de la variation inter-individu.
iab-8+). Enfin il suggère qu’il existe une colinéarité entre l’expression
antéro-postérieure et la situation proximo-distale de chaque gène au sein de BX-C. Un autre complexe de gènes homéotiques, le complexe Antennapedia (ANT-C), est décrit peu de temps après BX-C [15]. Des mutations au sein de ce complexe al-tèrent le développement de la partie antérieure (prothorax, proboscis, antennes, yeux) de l’embryon de drosophile. Dans les deux cas, il est proposé que c’est l’expression / répression combinatoire de l’ensembles des gènes de ces deux com-plexes qui permet aux différentes parties de l’embryon d’acquérir une identité positionnelle le long de l’axe antéro-postérieur de la larve. Du fait de la similarité d’organisation et de la relative proximité chromosomique de BX-C et ANT-C, les auteurs reprennent une hypothèse déjà formulée par E. B. Lewis, suggérant une origine évolutive commune à ces deux complexes avec l’existence d’un pro-bable complexe homéotique ancestral. La description chez le scarabée Tribolium castaneum d’un seul et unique complexe homéotique (HOM-C) regroupant les fonctions de ANT-C et BX-C [16] va confirmer cette idée. Par la suite, un tel complexe va être identifié dans la totalité des phyla bilatériens métazoaires. Chez les vertébrés, ce complexe HOM-C est retrouvé, à de rares exceptions près, en quatre exemplaires (désignés HOXA à HOXD) localisés sur des chromosomes différents. A eux quatre ils comportent 39 paralogues des gènes d’ANT-C et de BX-C. Néanmoins cette conservation de la structure des complexes multigé-niques homéotiques n’est, semble-t-il, qu’apparente, au vu des grandes disparités (tailles des régions intergéniques, orientations transcriptionnelles des membres du complexe, insertion ou non de gènes non-homéotiques, morcellement plus ou moins prononcé) existant dans l’organisation des complexes homéotiques dans les différentes lignées métazoaires [17]. Enfin, bien que l’identification des gènes homéotiques soient intimement liée à la découverte des ces complexes multigé-niques, il est fondamental de noter que bon nombre des gènes homéotiques se situent en dehors de ces complexes, au niveau de régions diverses et variées du génomes (voir pour exemple [18]).
2.4
L’homeobox, séquence commune aux gènes
ho-méotiques.
Le clonage des premiers gènes homéotiques [20, 21, 22, 23] représente une étape majeure dans la compréhension de leur structure et de leur fonctionne-ment. C’est en 1984 que les premiers travaux faisant état d’une séquence propre aux gènes homéotiques sont publiés. W. McGinnis et al. [24] sont les premiers à montrer une similarité de séquence entre différents gènes de BX-C et ANT-C en hybridant des sondes d’ADNc correspondant à diverses portions des gènes Antennapedia (Antp) et fushi tarazu (ftz) et de de l’ADN génomique. Ils dé-couvrent ainsi qu’il existe une forte homologie de séquence entre les régions 3’ de Antp et ftz, le « H repeat », et que ce H repeat se retrouve à d’autres endroits du génome de la drosophile, et notamment au niveau de BX-C, mais aussi de nouveaux loci présentant des caractéristiques compatibles avec une fonction ho-méotique (restriction spatiale stricte des transcrits au cours de l’embryogenèse, localisation cytogénétique au niveau de gènes homéotiques déjà décrits). Les auteurs en déduisent qu’il existe une séquence commune aux loci homéotiques, qu’ils nomment homeobox. Très vite, des loci contenant des homeobox sont
trou-Figure 1 – Le mutant bithorax de Drosophila melanogaster tel qu’illustré par C. B. Bridges en 1923 dans The third-chromosome group of mutant characters of Drosophila melanogaster [12].
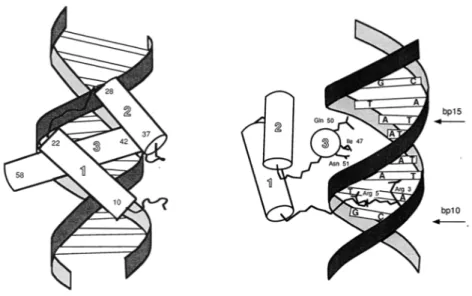
Figure 2 – Représentations schématiques de l’homéodomaine d’EN interagis-sant avec un duplex d’ADN. Tiré de [19].
vés chez le xénope [25], chez la souris [26, 27] ou chez l’Homme [28]. L’homeobox est donc une séquence conservée chez les métazoaires suggérant ainsi des mé-canismes communs lors du développement. Dès la découverte de l’homeobox, la communauté scientifique à chercher à connaitre la fonction de cette séquence. En alignant les produits protéiques potentiels des régions d’homologie entre les gènes Antp, Ubx et ftz M. P. Scott et al. [29] montre que la conservation de l’homeobox se retrouve potentiellement au niveau protéique, et qu’une homolo-gie de séquence existe même avec des facteurs de régulation de conjugaison MAT α1 et α2 de la levure [30]. De part la forte présence de résidus basiques au sein de la séquence de ce domaine protéique putatif, qui est nommé homéodomaine [31], l’hypothèse que ce soit un motif de liaison à l’ADN est très vite formulée.
2.5
Structure et fonction de l’homéodomaine :
l’homéoprotéine comme facteur de
transcrip-tion.
2.5.1
Structure protéique de l’homéodomaine.
Avant même de connaître la structure de l’homéodomaine, le rôle de régu-lateur transcriptionnel du produit des gènes homéotiques a été étudié. L’auto-amplification du gène ftz via fixation de son produit sur une de ses propres régions activatrices va être montrée [32], et ensuite des travaux effectués in vitro vont illustrer les rôles à la fois d’activateurs et de répresseurs de la transcrip-tion des produits de nombreux gènes homéotiques [33, 34, 35, 36, 37]. Ensuite, c’est la structure même de l’homéodomaine qui va être élucidée, d’abord seul dans le cas d’ANTENNAPEDIA (ANTP) [38], puis interagissant avec un duplex d’ADN dans le cas d’ENGRAILED (EN)[19]. Il s’agit d’un domaine protéique d’une soixantaine d’acides aminés organisés en trois hélices α. Le contact entre l’homéodomaine et ADN se fait via l’insertion de la troisième hélice α, ou hélice de reconnaissance, dans le grand sillon de l’ADN, et également via le domaine N-terminal qui va interagir avec le petit sillon de la double hélice d’ADN. De manière intéressante, l’homéodomaine isolé garde sa capacité à se lier à l’ADN [39]. Déjà évoquée [29], l’homologie de structure entre l’homéodomaine et des facteurs de conjugaison de la levure est confirmée expérimentalement [40]. Par la suite, une classification des protéines à homéodomaine, ou homéoprotéines, a été proposée sur la base de la présence de séquences conservées, autres que l’homéodomaine [41, 18].
2.5.2
Sites de liaisons à l’ADN.
Les séquences précises d’ADN reconnues par les homéoprotéines on ensuite été identifiées [42, 43, 44]. Il est ainsi apparu que ces sites de liaison étaient très proches, une séquence consensus contenant la « boîte » ATTA pouvant même être établie (citation). Ceci peut s’expliquer par la conservation très impor-tante des résidus de la troisième hélice α entre les différentes homéoprotéines [41, 18]. L’existence d’une telle séquence consensus pose cependant question quant à la spécificité de la liaison entre ADN et homéoprotéines, celles-ci ayant toutes la capacité, à peu de choses près, de se fixer sur les mêmes séquences
génomiques. Plusieurs éléments ont été apportés afin de tenter de comprendre d’où provenait la spécificité de fonction de chaque homéoprotéine. Un premier élément de réponse est la présence au sein de la troisième hélice de l’homéo-domaine d’un résidu qui lorsqu’il est muté modifie la spécificité de liaison de l’homéoprotéine PAIRED (PRD) vers les séquences reconnues habituellement par FUSHI TARAZU (FTZ) ou BICOÏD (BCD) [45], suggérant que les résidus non-conservés de l’hélice de reconnaissance puissent être à la base d’une certaine sélectivité. Un autre élément fondamental à prendre en compte est la capacité des homéoprotéines à se multimériser (homo-, hétéro-dimères, trimères). Cette multimérisation induit de nombreux changements dans les propriétés des ho-méoprotéines comme la modification de la spécificité de liaison à des séquences d’ADN, une interversion entre les fonctions activateur et répresseur au niveau d’un site donné, ou encore une modification de la localisation sub-cellulaire (voir [46] pour revue). Enfin, il est également proposé que la partie N-terminale de l’homéodomaine, également en contact avec l’ADN, puisse aussi être à l’origine d’une certaine sélectivité de fixation à des séquences données.
2.5.3
Fonction physiologique.
Au cours du développement embryonnaire, les différentes homéoprotéines sont exprimées selon des patrons d’expression très bien définis, que ce soit spa-tialement ou temporellement. L’expression combinatoire de ces protéines assure la mise en place du plan d’organisation de l’organisme, en conférant aux cellules une identité positionnelle précise. Etant donnée leur capacité à réguler la trans-cription, une association donnée d’homéoprotéines va ainsi entraîner la mise en place de l’expression d’un répertoire de gènes donnés qui, à terme, conduira à la différentiation de la cellule, et permettra la formation d’un tissu fonctionnel. Leur implication au niveau de la morphogenèse a lieu à différents niveaux. Ainsi l’expression régionalisée des membres des complexes ANT-C, BX-C ou HOXs va permettre la mise en place des axes antéro-postérieur et dorso-ventral de l’em-bryon. Les homéoprotéines ne sont pas seulement des protéines polarisantes lors du développement, mais elles sont également à la base de la formation de struc-tures morphologiques distinctes suivant leurs domaines d’expression en regard de ces mêmes axes. De par la grande diversité d’homéoprotéines recensées9, le nombre potentiellement très important de leurs gènes cibles10, ainsi que la ré-gulation complexe de leur activité de facteur de transcription (voir §3.3.1), il est difficile de dresser un état des lieux exhaustif de l’implication des homéopro-téines dans le développement. Cette complexité peut être illustrée dans le cas du développement de la rétine, où environ 25 homéoprotéines différentes sont requises pour la formation d’une rétine parfaitement fonctionnelle [48].
Historiquement, l’étude de la fonction des homéoprotéines a donc été centrée sur la compréhension de leur action en tant que facteurs de transcription nu-cléaires. L’observation plus précise du comportement de ces homéoprotéines à l’échelle cellulaire et non plus seulement à l’échelle de l’organisme, a cependant permis d’envisager un mode d’action nouveau pour celles-ci.
9. Selon la base de donnée UnitProtKB, rien que chez l’Homme, on dénombre près de 250 entrées vérifiées correspondant à des protéines contenant un homéodomaine.
Homéoprotéines, facteurs de
transcription aux propriétés
remarquables.
Dans un premier temps, les homéoprotéines sont donc décrites comme une famille de facteurs de transcription à l’action cellulaire-autonome. Leur action est donc vue comme restreinte à la cellule dans laquelle elles sont exprimées. Il est également admis que leur mode d’action ne passe que par la modulation de la transcription de gènes cibles. Des travaux menés par le groupe d’A. Prochiantz vont cependant mettre la lumière sur des propriétés cellulaires insoup¸onnées de ces homéoprotéines, ouvrant la voie à un possible rôle nouveau de cette famille protéique.
3.1
Internalisation d’ANTENNAPEDIA, premier
indice d’un transfert intercellulaire des
ho-méoprotéines.
Une première indication quant à un rôle dépassant le cadre du facteur de transcription pour les homéoprotéines va être apportée par A. Joliot et al. [49]. Le but de cette étude était de comprendre l’implication des homéogènes dans la morphogenèse cellulaire, et notamment dans le cas des neurones pour lesquels morphologie et fonction sont étroitement liés. Dans ce but, les auteurs ont tiré avantage de la capacité de l’homéodomaine isolé à conserver sa spécificité de liaison à l’ADN [39], pour s’en servir comme d’un inhibiteur compétitif11pour
la fixation sur les sites génomiques des protéines homéotiques endogènes aux neurones. Ainsi, l’introduction artificielle de l’homéodomaine purifié d’ANTP (ANTP-HD) dans des neurones embryonaires en culture entraîne une modifi-cation nette de leur morphologie. De manière beaucoup plus inattendue, cette étude montre également que lorsqu’il est ajouté dans le milieu de culture, ANTP-HD est capable de pénétrer à l’intérieur des neurones et de s’accumuler au sein
11. L’homéodomaine seul étant dépourvu des séquences trans-activatrices nécessaires à la régulation de la transcription.
du noyau. Dans ce second cas, une modification morphologique des neurones est aussi observée. Ces résultats impliquent donc : i) ANTP-HD est capable de pé-nétrer dans des neurones en franchissant des membranes biologiques intactes, ii) ANTP-HD conserve une activité biologique après son internalisation (qui passe effectivement par sa liaison à l’ADN [50]). Ces observations sont à la base d’un champs d’étude nouveau, l’observation des propriétés cellulaires des homéopro-téines, et notamment l’étude de leur éventuelle fonction non-cellulaire-autonome directe, comme nous allons le voir par la suite.
3.2
L’homéodomaine comme élément central de
cette internalisation.
L’internalisation de ANTP-HD a lieu à 37◦C comme à 4◦C, suggérant qu’elle se base au moins en partie sur des mécanismes énergie-indépendants (à l’inverse de l’endocytose classique qui nécessite une hydrolyse d’ATP). Après son inter-nalisation, ANTP-HD est retrouvé intact dans les cellules et n’est pas dirigé vers les compartiments de dégradation. Une région précise de l’homéodomaine, correspondant à la troisième hélice α, est nécessaire et suffisante pour son in-ternalisation [51]. Au sein de cette séquence de 16 acides aminés, un doublet d’acides aminés aromatiques WF a une importance primordiale car lorsque ces deux résidus sont délétés, l’internalisation de l’homéodomaine est drastiquement réduite [50]. La capture de cette troisième hélice α, nommée Penetratin, par les cellules ne dépend pas d’un récepteur chiral de surface. En effet, des peptides composés de D-énantiomères ou dont la séquence a été inversée sont eux aussi internalisés aussi efficacement que le peptide « sauvage » à 4◦C et 37◦C [52], et la Penetratin est capable de se transloquer au travers de vésicules lipidiques ar-tificielles dans certains modèles expérimentaux [53]. La structuration en hélice α de la Penetratin n’est pas un élément clé de ce processus, l’insertion de prolines en son sein n’empêchant pas son internalisation [52]. Sachant que la troisième hélice est la partie la plus conservée de l’homéodomaine parmi toutes les ho-méoprotéines, on peut s’attendre à ce que la capacité d’internalisation ne soit pas une capacité propre à ANTP mais commune à d’autres protéines de cette famille. Que ce soit dans le cas d’homéodomaines seuls ou de protéines entières, on retrouve effectivement cette propriété chez d’autres homéoprotéines comme HOX5A [54], ENGRAILED-2 (EN-2) [55], HOXC8, HOXB4, EMX1, EMX2, OTX2 ou PAX6 [56]. Comme c’est le cas pour la Penetratin, le tryptophane en position 48 de l’homéodomaine est également très important pour l’interna-lisation de l’homéodomaine seul [50] ou de l’homéoprotéine entière [55]. Ceci suggère donc que certains des mécanismes à la base de l’internalisation sont similaires entre Penetratin, homéodomaine et homéoprotéines entières. Sur la base de travaux biophysiques, il est proposé que la Penetratin puisse traverser les membranes biologiques via la formation de structures lipidiques intermé-diaires de type micelles inversées [57]. Plus récemment, un nouveau mécanisme impliquant une courbure de la membrane plasmique conduisant à des invagi-nations mimant un processus d’endocytose classique même en absence d’ATP a été proposé [58]. Persistent cependant de nombreuses zones d’ombre dans la compréhension de cette internalisation, et notamment en ce qui concerne les homéoprotéines entières.
La découverte de la capacité commune aux homéoprotéines d’être interna-lisées par des cellules vivantes a conduit à ne plus considérer cette famille pro-téique qu’uniquement comme une famille de facteurs de transcription au rôle cellulaire-autonome strict mais aussi comme des protéines à activité paracrine. Seul écueil à cette hypothèse, aucune homéoprotéine ne possède de peptide signal de sécrétion, le prérequis classique pour cette activité, la sécrétion de l’homéoprotéine devant alors être due à des mécanismes non décrits jusqu’alors.
3.3
Sécrétion des homéoprotéines : le cas
EN-GRAILED-2.
La capacité pour les homéoprotéines d’être transférées entre cellules va être démontrée par des travaux sur la protéine ENGRAILED (EN).
3.3.1
Brefs rappels des fonctions d’ENGRAILED.
Cette homéoprotéine, caractérisée chez la drosophile, joue de nombreux rôles durant le développement, en définissant par exemple les domaines postérieurs de chaque parasegment de l’embryon [59, 60], ou bien encore de l’aile [61]. Chez les vertébrés, on trouve deux gènes Engrailed, En1 et En2. Les protéines EN-1 et EN-2 correspondantes possèdent des patrons d’expression assez similaires, se distinguant surtout par leur expression temporelle, durant le développement embryonnaire. On les retrouve ainsi exprimées dans le neuroépithélium antérieur à partir du stade 1 (EN-1) ou au stade 4-5 somites (EN-2), puis au niveau de la région mésencéphale/métencéphale en formation. EN-1 est également retrouvé transitoirement dans de nombreux autres domaines de l’embryon tels que la peau, la partie ventrale des bourgeons des membres ou encore certains neurones de la moelle épinière [62, 63]. Collectivement, EN-1 et EN-2 régulent la formation de la frontière entre diencéphale et mésencéphale [64], ainsi que la mise en place de l’axe rostro-caudal du tectum visuel [65]. Enfin, ces deux protéines sont également exprimées au niveau des neurones dopaminergiques de la substance noire et de l’aire tegmentale ventrale. Leur expression n’est pas requise pour la différentiation des progéniteurs neuronaux en neurones dopaminergiques mais est essentielle pour la survie de ces derniers au cours du développement ainsi qu’à l’âge adulte [66].
D’un point de vue moléculaire EN a été initialement décrit comme un étant un répresseur transcriptionnel [67]. In vivo, l’activité de répresseur transcrip-tionnel actif d’EN est liée à la protéine GROUCHO ou ses orthologues chez les vertébrés, les protéines de la famille TLE (Transducin-like Enhancer of Split ). L’interaction entre EN et son co-répresseur GROUCHO/TLEs, via le domaine EH1 d’EN, est une étape importante dans l’établissement d’une répression trans-criptionnelle [68]. D’autres partenaires protéiques de EN, tels que les co-facteurs EXD/PBX, modulent son activité transcriptionnelle. L’interaction entre EN et PBX-1 ou son homologue chez la drosophile EXD, est en effet responsable d’un basculement du rôle de répresseur vers celui d’activateur de la transcription [69]. Ce changement dans l’activité d’EN peut s’expliquer par le fait que l’interac-tion avec EXD/PBX-1 entraîne une modifical’interac-tion des sites spécifiques d’ADN reconnus par EN [70, 71, 72, 73]. La formation d’hétérodimères entre EN et
EXD/PBX-1 repose sur la présence d’un domaine conservée au sein de la pro-téine EN, l’hexapeptide, qui se situe juste en amont de l’homéodomaine [74]. Bien que beaucoup de cibles génomiques potentielles d’EN aient été identifiées [47], l’activité transcriptionnelle effective d’EN au niveau de ces sites n’a pu être vérifiée que dans un nombre restreint de cas. On pourra ainsi citer les gènes de la β-tubuline 3 [75], du fgf8 [69], de map-1b [76], de bpag-1 [77] ou de polyhomeotic [78] dont l’expression dépend d’une régulation directe par EN. Dans les exemples précédents, EN a un rôle d’activateur dans les cas des gènes polyhomeotic, fgf8 et map-1b (ex vivo).
3.3.2
Mise en évidence et mécanismes connus de la
sécré-tion d’ENGRAILED-2.
L’observation d’une localisation non-nucléaire, et plus précisément l’associa-tion des protéines EN-1 et EN-2 avec des compartiments membranaires in vivo, dans des tissus nerveux embryonnaires de rat et ex vivo, dans des cellules COS-7 exprimant un EN-2 de poulet, a été le premier indice concernant une sécrétion de ces protéines [80]. Plus précisément, une partie du EN-2 endogène est associé à des vésicules de faible densité non-solubilisées par le TritonX-100, enrichies en glycosphingolipides et en cholestérol. Les protéines EN-2 et Caveolin-1 co-exprimées dans les cellules COS colocalisent dans des vésicules présentant les caractéristiques des cavéoles (absence de manteau de clathrine, taille réduite). Dans ce même article, les auteurs montrent également qu’une partie de la frac-tion de EN-2 associée à ce compartiment membranaire est protégée de l’acfrac-tion de la protéinase K, suggérant que la protéine a en partie accès au compar-timent luminal de ces vésicules. L’ensemble de ces résultats démontre qu’une partie de l’EN-2 intracellulaire a accès un compartiment subcellulaire vésicu-laire a priori compatible avec des mécanismes de sécrétion. La mise en évidence du transfert intercellulaire de EN-2, et donc implicitement de sa sécrétion, a été réalisée en utilisant un système de co-culture entre des cellules COS-7 ex-primant la protéine EN-2 et des neurones ne l’exex-primant pas. Après fixation et immunomarquage, la protéine est détectée à la fois dans les cellules COS-7 et les neurones, montrant qu’un transfert intercellulaire a bien eu lieu [55]. La délétion d’une séquence de 11 acides aminés situés au sein de l’homéodomaine, juste en amont du doublet WF évoqué plus tôt (voir §3.2), abolit la sécrétion de EN-2. La sensibilité à la protéinase K de la forme tronquée de EN-2 (appelée EN2Δ1) localisée dans le compartiment membranaire suggère que son défaut de sécrétion pourrait être lié à une localisation subcellulaire modifiée (pas d’accès au lumen de certaines vésicules par exemple). Il est intéressant de noter que la forme mutante de EN-2 dans laquelle le doublet WF est remplacé par un doublet SR (notée EN2SR) semble toujours sécrétée mais est internalisée beaucoup moins efficacement que la forme sauvage, montrant que sécrétion et internalisation né-cessitent des séquences différentes, toutefois localisées dans les deux cas au sein de l’homéodomaine. La forte déstabilisation de la structure de l’homéodomaine engendrée par la délétion Δ1 n’est pas la seule cause du défaut de sécrétion du mutant associé. La séquence Sec, qui correspond aux acides aminés délétés, est en effet capable de promouvoir la transcytose de la Penetratin au travers d’une monocouche cellulaire [81]. La sécrétion d’ENGRAILED est donc un processus actif.
dis-tinguer deux voies d’adressage distinctes, une menant au noyau et donc au rôle cellulaire-autonome, et une autre menant vers un compartiment de sécrétion et donc au rôle non-cellulaire-autonome. Dans les faits, la situation est différente car, bien qu’incompatibles de prime abord, localisation nucléaire et sécrétion d’ENGRAILED sont liées. En effet, in vitro, le mutant de sécrétion EN2Δ1 voit également son export nucléaire fortement réduit. L’identification d’une séquence d’export nucléaire de type « Leucin-rich » de 15 acides aminés chevauchant partiellement la séquence de sécrétion peut expliquer ces observations [82]. Une telle séquence d’export nucléaire est aussi retrouvée dans les homéoprotéines HOXC8 et HOXB4, renfor¸ant ainsi l’idée d’une conservation de ces mécanismes au sein de cette famille protéiques. Abordant la conservation des mécanismes du transfert intercellulaire entre métaphytes et métazoaires, M. Tassetto et al. [83] vont éclairer d’un jour nouveau la relation entre localisation nucléaire et sécrétion. L’homéoprotéine végétale KNOTTED-1(KN1) est capable de trans-fert intercellulaire in vivo chez les plantes, propriété abolie par la mutation de résidus basiques (M6) au sein de l’homéodomaine [84, 85]. Cette étude à montré que :
i) l’homéodomaine de KN1 est aussi transféré entre cellules animales, et donc qu’il existe une conservation forte des mécanismes du transfert in-tercellulaire au sein des organismes pluricellulaires.
ii) l’homéodomaine comportant la mutation M6 (KN1M6) est internalisé par des cellules animales en culture mais qu’il est incapable de transfert entre cellules dans un système de co-culture. Cette mutation qui empêche donc la sécrétion s’accompagne d’une redistribution de la protéine mutée du noyau vers le cytosol.
iii) l’ajout d’une séquence de localisation nucléaire ectopique à l’homéodo-maine muté restaure sa localisation nucléaire et sa capacité de transfert intercellulaire.
La localisation nucléaire semble donc être une étape préalable, nécessaire à la sécrétion ultérieure de la protéine.
Enfin, il est intéressant de noter que la sécrétion atypique des homéopro-téines est un processus sujet à une régulation. La phosphorylation d’une sé-quence riche en sérines (SRD) par la caséine kinase 2 (CK2) inhibe la sécrétion de EN-2 [86]. La séquence SRD se situant en dehors de l’homéodomaine, donc non conservée parmi les homéoprotéines, ce mécanisme de régulation est proba-blement propre à EN-2. On peut donc envisager la sécrétion des homéoprotéines comme reposant sur des mécanismes communs liés à des séquences contenues dans l’homéodomaine mais dont la régulation fine pourrait faire intervenir des partenaires/processus spécifiques à chaque protéine. Comme c’est le cas pour l’internalisation, plusieurs aspects de ce processus demeurent pour l’instant in-connus.
3.4
Une capacité de transfert intrinsèque aux
ho-méoprotéines.
Nous avons déjà vu précédemment qu’une partie des mécanismes de trans-fert avaient été illustrés en utilisant de nombreuses homéoprotéines différentes
(ANTP, EN-2, HOX5A, HOXC8, HOXB4, KN-1). Une autre série d’études12
a permis d’illustrer, in vivo, le transfert intercellulaire d’autres homéoprotéines telles que OTX2 [87, 88, 89], PAX6 [90, 91], VAX1[92] ou encore HOXD1 [93]. Bien que s’attardant plus sur les conséquences physiologiques de ce transfert plutôt que sur les mécanismes à l’œuvre derrière ce mode d’action paracrine, ces résultats renforcent l’hypothèse que le transfert intercellulaire est une pro-priété commune aux homéoprotéines. Il faut noter que les mécanismes de sécré-tion et/ou d’internalisasécré-tion alternatives, que l’on qualifiera désormais de non-conventionnelles, dépassent largement le seul cadre des homéoprotéines. Les tra-vaux qui seront présentés par la suite dans ce manuscrit, et qui visent justement à mieux comprendre ces mécanismes, se basent en partie sur d’autres cas de sé-crétions et d’internalisations non-conventionnelles qui vont être présentés dans le chapitre suivant.
Figure 3 – Organisation générale de la protéine ENGRAILED. Les domaines EHs (pour Engrailed Homology) correspondent à des domaines très conservés entre les différents homologues des protéines ENs. Adapté de [79].
Bases cellulaires du transfert
intercellulaire et conséquences
fonctionnelles.
4.1
La sécrétion à la base de la communication
cellulaire.
Comme évoqué précédemment (voir §1.3), tout organisme pluricellulaire peut être envisagé comme un regroupement de cellules, d’origine commune, ayant acquis au cours du développement des identités positionnelles et fonc-tionnelles diverses. Afin d’éviter un développement anarchique de cette « com-munauté », la communication entre chacun de ses éléments est une condition fondamentale. Cet échange d’informations entre cellules peut avoir lieu par des voies différentes :
i) La signalisation autocrine, dans laquelle, un messager chimique (métabo-lite, protéine . . .) produit par la cellule est libéré dans le milieu extracel-lulaire, puis va agir sur elle-même, par l’intermédiaire de récepteurs de surface par exemple.
ii) La signalisation paracrine, qui se distingue de la signalisation autocrine par le fait que le signal est transduit dans les cellules adjacentes (plus ou moins éloignées selon la capacité de diffusion du messager dans le milieu extracellulaire) et non plus seulement dans la cellule productrice. iii) La signalisation juxtacrine ou signalisation de contact, qui passe par
l’in-teraction entre des macromolécules, le plus souvent transmembranaires, présentées à la surface des cellules.
iv) La signalisation via des jonctions cellulaires communicantes comme les jonctions GAP ou les plasmodesmes chez les plantes. Dans ce cas, les cytoplasmes de deux cellules sont mis directement en contact via la for-mation d’un canal traversant leur membrane plasmique.
v) La signalisation synaptique qui est un cas particulier de signalisation pa-racrine spécifique aux neurones. La propagation d’un potentiel d’action jusqu’aux extrémités synaptiques du neurones va entraîner la libération
de neurotransmetteurs au niveau de la fente synaptique, neurotransmet-teurs qui en se fixant sur des récepneurotransmet-teurs situés à l’extrémité postsynap-tique d’une cellule adjacente vont entraîner la génération d’un potentiel électrique postsynaptique.
Exceptée la signalisation via les jonctions communicantes, toutes ces voies de communications cellulaires nécessitent la libération dans le milieu extracellulaire de composants intracellulaires, autrement dit, leur sécrétion.
4.1.1
La voie reticulum endoplasmique / appareil de Golgi
/ vésicules de sécrétion : mode de sécrétion
cano-nique.
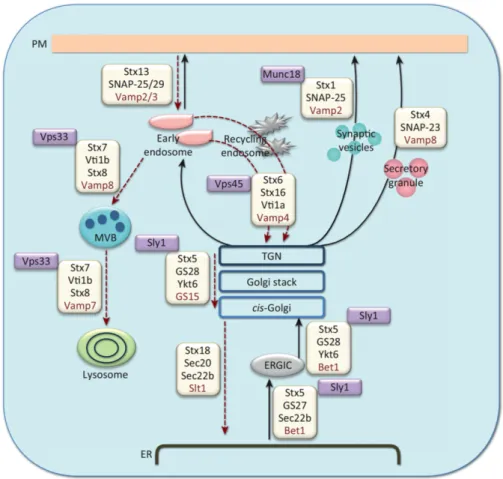
La grande majorité des protéines solubles destinées à la sécrétion suivent une voie commune dont les mécanismes sont quasi-invariants d’une protéine à une autre. L’adressage vers cette voie de sécrétion se fait de manière co-traductionnelle. La reconnaissance par le complexe protéique SRP (Signal Re-cognition Particle) d’un peptide signal situé en N-terminal de la protéine en cours de traduction entraîne l’association du complexe ribosome/chaîne poly-peptidique naissante/SRP avec la membrane du reticulum endoplasmique. En parallèle de sa traduction, la protéine est alors transférée vers le compartiment luminal du reticulum endoplasmique par l’intermédiaire d’un canal de translo-cation, le translocon (pour revue [94]). Le peptide signal de sécrétion est ensuite clivé, puis la protéine connaît une première étape de maturation (repliement, création de ponts disulfure, ajout du motif de base de la N-glycosylation) au contact d’enzymes et de protéines chaperonnes (pour revue [95]). La sortie du reticulum endoplasmique s’effectue par l’intermédiaire du bourgeonnement de vésicules, caractérisées par leurs protéines d’enveloppe, le complexe COPII. Ces vésicules COPII vont ensuite fusionner avec les saccules de l’appareil cis-golgien (pour revue [96]). Une fois au sein de l’appareil de Golgi, les protéines vont subir un second cycle de maturation (O-glycosylations par exemple), puis sont ensuite triées selon leur destination au niveau du réseau trans-golgien (TGN) (pour re-vue [97]). Des vésicules de sécrétion issues de l’appareil de Golgi sont orientées vers la membrane plasmique où la dernière étape du processus de sécrétion va avoir lieu, à savoir la formation d’un porosome issu d’une fusion partielle entre ces vésicules et la membrane, permettant la libération de leur contenu dans l’espace extracellulaire (pour revue [98]). Le bon déroulement de cette voie de sécrétion repose ainsi sur des échanges successifs de membranes (par des intermédiaires vésiculaires) entre compartiments donneurs et accepteurs. Ces événements de fusions dirigées entre organelles intracellulaires requièrent une famille de protéine centrale, les protéines SNAREs (Soluble N-ethylmaleimide-sensitive-factor Attachment protein REceptor ). Par des jeux d’interactions com-plémentaires entre SNAREs exprimées au niveau des compartiments donneurs (vSNAREs, pour vesicular SNARE) et accepteurs (tSNAREs, pour target -SNARE), ces protéines vont promouvoir une fusion contrôlée entre les compar-timents membranaires de la voie de sécrétion standard (pour revue [99]) (Figs. 5 et 6).
Figure 4 – Représentation schématique de la voie de sécrétion clas-sique. Tiré et adapté de [100]. TGN : Trans-Golgi Network ; RE : Reticulum
Figure 5 – Rôle des protéines SNAREs dans la fusion membranaire. Tiré et adapté de [99]. Trois protéines t-SNAREs (t) ancrées dans une membrane vont interagir avec une protéine v-SNARE (v), ancrée dans une autre membrane, pour former un complexe trans-SNARE ou « SNAREpin ». L’interaction entre ces deux types de SNAREs est initiée au niveau de leurs extrémités N-terminales et s’étend ensuite à leurs extrémités C-terminales. A la manière d’une fermeture à glissière, la propagation de cette interaction entraine la création d’une force rapprochant les deux membranes (A). Ceci va ensuite entraîner la fusion des deux membranes. Tous les membres des complexes SNAREs, qu’on désigne après fusion comme complexes cis-SNAREs, se retrouvent ainsi au sein de la même membrane, ce qui a pour conséquence d’annihiler toute force de tension générée par l’interaction entre t- et v-SNAREs (B).
Figure 6 – Les différentes protéines SNAREs impliquées dans les voies endocytiques et de sécrétion chez les mammifères. Tiré de [101]. En rouge sont indiquées les v-SNAREs potentielles. En violet sont indiquées les protéines accessoires impliquées dans l’assemblage des complexes de protéines SNAREs. TGN : Trans-Golgi Network ; ER : Reticulum endoplasmique ; PM : Membrane plasmique ; ERGIC : ER-Golgi Intermediate compartment ; MVB : Multivesicular body.
4.1.2
En opposition à la voie canonique, les modes de
sé-crétion non-conventionnels.
Au fil des ans, un nombre croissant de protéines sécrétées ne suivant pas la voie évoquée dans le paragraphe précédent a été répertorié. L’ensemble de ces événements, que l’on regroupe sous l’appellation vague de sécrétion non-conventionnelle, concerne des protéines diverses et variées aux propriétés bio-chimiques et fonctionnelles hétérogènes. Dans leur vaste majorité, ces sécré-tions non-conventionnelles ont comme point commun d’avoir comme substrat des protéines sans peptide signal de sécrétion, ainsi que d’avoir lieu de fa-çon post-traductionnelle (plus ou moins vrai pour golgi bypass). De manière systématique, ces sécrétions non-conventionnelles sont insensibles à la Bréfel-dine A (BFA), une substance pharmacologique qui bloque la sécrétion clas-sique, en annihilant le transport entre le réticulum endoplasmique et l’appareil de Golgi. Cependant leur regroupement sous le terme générique de sécrétion non-conventionnelle ne doit pas laisser penser que l’ensemble de ces processus obéit aux mêmes mécanismes cellulaires, chaque protéine utilisant un méca-nisme qui lui semble propre. Une classification des grands types de sécrétions non-conventionnelles a néanmoins été proposée [102], et c’est en se basant sur celle-ci et en l’adaptant que nous allons passer en revue différents exemples.
Détournement de la voie de sécrétion standard : le « Golgi bypass ». Le premier type de sécrétion non-conventionnelle regroupe essentiellement des protéines transmembranaires qui sont dirigées vers la membrane plasmique par des voies alternatives mais dérivant de la voie de sécrétion standard. Après synthèse, ces protéines sont retrouvées au niveau du reticulum endoplasmique à partir duquel elles vont être adressées à la membrane plasmique, sans passer par l’appareil de Golgi (« Golgi bypass »). Une des caractéristiques communes à ces protéines est leur sensibilité à l’endoglycosidase H (EndoH), qui est capable de cliver le motif de base riche en mannose de la N-glycosylation spécifique au reticulum endoplasmique car perdu par la suite au niveau de l’appareil de Golgi après maturation de la chaîne glycosylée. Les formes matures devenant résistantes à l’action de l’enzyme, la sensibilité à l’EndoH peut être considérée comme un marqueur potentiel d’un « Golgi bypass » [103]. Un des exemples les mieux documenté d’un tel processus concerne le canal ionique cystic fi-brosis transmembrane conductance regulator (CFTR), dont la forme mutante CFTRΔF508, incapable de quitter le reticulum endoplasmique, est impliquée dans près de 70% des cas de mucoviscidose. L’export de CFTR du reticulum endoplasmique se fait par l’intermédiaire des vésicules COPII, comme pour la sécrétion standard, mais la protéine n’est pas retrouvée au sein de l’appareil de Golgi. De plus sa sécrétion est insensible à l’expression de mutants domi-nants négatifs des protéines ARF1, RAB1a/RAB2 ou Syntaxin5 décrits comme bloquant les échanges entre le reticulum endoplasmique et l’appareil de Golgi. La fraction membranaire de CFTR présente cependant des glycosylations com-plexes caractéristiques de l’appareil de Golgi, et l’expression d’un mutant domi-nant négatif de la Syntaxin 13, qui régule les échanges vésiculaires au niveau du compartiment endosomal tardif et du réseau trans-golgien, abolit la sécrétion de CFTR [104]. CFTR serait donc transféré directement du reticulum endo-plasmique vers un compartiment mixte endosome tardif / réseau trans-golgien
(où auraient lieu les glycosylations) puis ensuite vers la membrane plasmique. L’accumulation de CFTR dans un compartiment intermédiaire péri-centrosomal [105] suggère l’existence d’une ou plusieurs étapes entre la sortie du reticulum endoplasmique et la présentation à la membrane de CFTR.
On peut également citer les exemples de la protéine-tyrosine phosphatase transmembranaire CD45 et des connexines 26 (Cx26) et 30 (Cx30). Ainsi, dans les lymphocytes T, une partie de la fraction membranaire de CD45 est sensible à l’action de EndoH. Cette même fraction est présentée beaucoup plus rapidement à la membrane après synthèse (∼ 5 minutes) que la fraction non-sensible à EndoH (∼ 15 minutes) dont le répertoire de glycosylations est différent [106]. L’adressage à la membrane de CD45 pourrait résulter en partie du processus conventionnel et en partie d’un Golgi bypass, les mécanismes précis de ce dernier n’étant pour l’heure pas connus. En ce qui concerne Cx26 et Cx30, là aussi les mécanismes précis de leur adressage à la membrane ne sont pas connus, mais ils semblent impliquer le cytosquelette d’actine, ainsi que les microtubules dans le cas de Cx26 [107, 108].
Un autre cas de Golgi bypass concerne la sous-unité αPS1 de l’intégrine PS1 de drosophile. Cette protéine adressée à la membrane selon la voie conven-tionnelle connaît une modification de son trafic intracellulaire au cours du dé-veloppement. Ainsi, au niveau de certaines cellules épithéliales de l’aile et des follicules ovariens, αPS1 adopte une voie alternative pour atteindre la membrane plasmique. Ce mode de sécrétion est insensible à une mutation de la dSyntaxin 5 et donc ne nécessite pas un transport reticulum endoplasmique / appareil de Golgi. La protéine dGRASP (pour Golgi ReAssembly Stack Protein, orthologue chez la drosophile des protéines GRASP55 et GRASP65 des vertébrés) et décrite pour son rôle dans le maintien de la structure de l’appareil de Golgi [109], est requise pour ce mode de sécrétion de αPS1, via la traduction locale de son ARN messager à proximité de la membrane plasmique [110]. L’apparition d’une ten-sion mécanique au sein de l’épithélium du follicule ovarien due à la maturation des ovocytes pourrait induire un remodelage de la membrane plasmique, via le recrutement, par les intégrines de RhoA, ainsi q’une hausse de la transcription du gène dgrasp suite à la relocalisation du régulateur transcriptionnel PINCH des points focaux d’adhésion vers le noyau. La sécrétion non-conventionnelle de la sous-unité αPS1 serait donc auto-induite par des intégrines déjà présentes à la membrane plasmique en réponse à un stress mécanique croissant, et donc de permettre le maintien de l’intégrité de l’épithelium du follicule ovarien [111]. Le mécanisme exact par lequel αPS1 quitte le reticulum endoplasmique pour at-teindre la membrane plasmique n’est pour l’heure pas identifié clairement. Bien que ce soit pour un rôle différent, dGRASP et ses différents orthologues sont impliqués dans un autre grand mode de sécrétion non-conventionnelle que nous allons aborder par la suite.
Sécrétion non-conventionnelle vésiculaire.
Un deuxième mécanisme majeur de sécrétion non-conventionnelle regroupe des protéines cytosoliques emprisonnées dans des structures vésiculaires en cours de formation, qui sont libérées elles-mêmes dans le milieu extérieur.
Les exosomes. Les exosomes sont le premier type identifié de structures vé-siculaires extracellulaires d’une taille comprise entre 50 et 100 nm de diamètre.
![Figure 4 – Représentation schématique de la voie de sécrétion clas- clas-sique. Tiré et adapté de [100]](https://thumb-eu.123doks.com/thumbv2/123doknet/14703985.565655/37.892.200.624.193.1020/figure-représentation-schématique-voie-sécrétion-sique-tiré-adapté.webp)
![Figure 7 – Les principales voies endocytiques. Tiré de [210].](https://thumb-eu.123doks.com/thumbv2/123doknet/14703985.565655/51.892.199.714.454.707/figure-principales-voies-endocytiques-tiré.webp)